自扶正系统、方法及相关组件
文献发布时间:2023-06-19 18:37:28
本申请是申请号为201880044130.1、发明名称为“自扶正系统、方法及相关组件”的中国专利申请的分案申请,该母案申请是2018年05月17日提交的PCT国际专利申请PCT/US2018/033210进入中国国家阶段的申请。
相关申请
本申请根据35 U.S.C.§119(e)要求以下的优先权:于2017年5月17日提交的标题为“SELF-RIGHTING ARTICLES”的美国临时申请序列号62/507,647,于2017年5月17日提交的标题为“SELF-ACTUATING ARTICLES”的美国临时申请序列号62/507,653,以及于2017年5月17日提交的标题为“COMPONENTS WITH HIGH API LOADING”的美国临时申请序列号62/507,665,其各自通过引用整体并入本文。
技术领域
本发明一般地涉及自扶正系统(self-righting system)和相关组件,例如自扶正制品(self-righting article)、自致动制品(self-actuating article)(包含例如自致动针和/或自致动活检凿(biopsy punch)),以及具有相对高的活性药物成分(activepharmaceutical ingredient,API)载量的组件。
背景技术
GI道为诊断和治疗患者提供了令人难以置信的机会。在过去的十年中,能够实现这一目标的智能剂量系统和制品的开发取得了显著增长。在最大化递送和与黏膜的相互作用中,最重大的挑战之一是确保制品和/或给药系统与GI黏膜之间并置。其先前的给药尝试包括引入黏膜黏附剂以及使双面系统的一个面纹理化。经口摄入的药物通常通过GI道组织壁扩散以进入血流。典型的摄入的丸剂或制品将其载物(cargo)随机释放到GI道中,并允许其通过对流和扩散移动至组织壁。然而,许多生物药物(例如胰岛素)不能通过GI道中的液体移动,因为它们即使被容纳在固体制剂中也会例如被酶降解。
另外,市场上的许多药用药物制剂需要通过注射来施用,包括许多疫苗、RNA和肽。传统上,注射涉及使用液体制剂通过空心针并通过静脉内或肌内进入体内。然而,这些液体制剂可引起活性药物成分(API)变得不稳定,并因此可需要冷藏和/或由于所需的稀释而使剂量的体积(bulk)显著增大。
因此,需要改善的系统、制品和方法。
发明内容
本发明一般地涉及自扶正制品,例如自扶正胶囊。
在一个方面,提供了自扶正制品。在一些实施方案中,所述自扶正制品包含第一部分,与第一部分相邻、具有与第一部分不同的平均密度的第二部分,以及空心部分,其中所述自扶正制品配置和布置成包封在000号胶囊或更小的胶囊中。
在一些实施方案中,尽管自扶正制品配置成000号胶囊或更小的胶囊中的潜在包封,但是自扶正制品不一定需要被包封在这样的胶囊中。在其中例如通过摄入自扶正制品而待施用自扶正制品的一些实施方案中,因此可在没有包封的情况下施用自扶正制品。
在一些实施方案中,自扶正制品包含第一部分,与第一部分相邻、具有与第一部分不同的平均密度的第二部分,以及与自扶正制品相关的组织接合组件(tissue-interfacing component),其中第一材料的平均密度与第二材料的平均密度的比例大于或等于2.5:1。在一些实施方案中,第二材料的平均密度与第一材料的平均密度的比例大于或等于2.5:1。
在一些实施方案中,自扶正制品配置成锚定在对象内部的位置处并且包含至少第一部分以及与自扶正制品相关联的至少一个锚定机构(anchoring mechanism),所述第一部分具有大于1g/cm
在一些实施方案中,自扶正制品配置成施用于对象内部的位置并且包含至少第一部分,所述第一部分具有大于1g/cm
在另一方面,提供了自致动制品。在一些实施方案中,该制品包含外壳,至少部分地包封在外壳内的弹簧,与弹簧相关联的支持材料(使得该支持材料在环境条件下将弹簧的至少一部分维持在至少5%压缩应变下),以及与弹簧相关联的组织接合组件。
在一些实施方案中,制品配置成锚定在对象内部的位置处并且包含外壳,用外壳至少部分地包封的弹簧(该弹簧通过支持材料维持在至少5%压缩应变下的至少部分压缩的状态),以及可操作地连接至弹簧的至少一个锚定机构。
在一些实施方案中,制品配置成向对象内部的位置处施用并且包含外壳,用外壳至少部分地包封的弹簧(该弹簧通过支持材料维持在至少5%压缩应变下的至少部分压缩的状态),至少两个组织接合组件,以及与所述至少两个组织接合组件电连通的电源,所述组织接合组件包含配置成接触组织的组织接触部分,每个组织接触部分包含配置成与组织电连通的导电部分和配置成不与组织电连通的绝缘体部分。
在另一方面,提供了组织接合组件。在一些实施方案中,该组件包含固体治疗剂和支持材料,其中作为组织接合组件之总重量的函数,固体治疗剂在组织接合组件中存在的量为大于或等于10wt%,其中固体治疗剂和支持材料基本上均匀地分布,并且其中组织接合组件配置成穿透组织。
在一些实施方案中,该组件具有尖端并且包含固体治疗剂和与该固体治疗剂相关联的支持材料,其中该固体治疗剂的至少一部分与组织接合组件的一个或更多个尖端相关联,并且其中作为组织接合组件之总重量的函数,固体治疗剂在组织接合组件中存在的量为大于或等于10wt%。
在另一方面,提供了方法。在一些实施方案中,该方法包括向对象施用包含外壳和自扶正制品的胶囊,该自扶正制品包含第一部分和第二部分,所述第二部分与第一部分相邻并具有与第一部分不同的平均密度。
在一些实施方案中,该方法包括向对象施用包含外壳和自扶正制品的胶囊,该自扶正制品包含:包含第一材料的第一部分,与第一部分相邻并且包含与第一材料不同的第二材料的第二部分,以及与活性药剂相关联的针,其中第一材料的平均密度与第二材料的平均密度的比例大于或等于2.5:1,使自扶正制品在对象内部的位置处取向成使得针刺穿对象内部的位置临近的组织,并将活性药剂的至少一部分释放到组织中。
在一些实施方案中,该方法包括向对象施用制品,所述制品包含外壳,用外壳至少部分地包封的弹簧,与弹簧相关联的支持材料(使得该支持材料在环境条件下将弹簧的至少一部分维持在至少5%压缩应变下),以及与弹簧相关联的组织接合组件。
在一些实施方案中,该方法包括向对象施用制品,所述制品包含外壳,用外壳至少部分地包封的弹簧,与弹簧相关联的支持材料(使得该支持材料在环境条件下将弹簧的至少一部分维持在至少5%压缩应变下),以及与弹簧相关联的组织接合组件;以及使所述支持材料的至少一部分降解,使得弹簧延伸和/或组织接合组件穿透位于对象内部的组织。
在一些实施方案中,该方法包括向对象施用制品,其中所述制品包含至少第一部分和至少一个锚定机构,所述第一部分具有大于1g/cm
在一些实施方案中,该方法包括向对象施用制品,该制品包含设置在制品内的至少一个组织接合组件,每个组织接合组件包含导电材料;从该制品释放至少一个接合组件;将所述至少一个接合组件插入到对象内部的位置处的组织中;跨过两个或更多个组织接合组件施加由与组织接合组件电连通的电源产生的电流,其中所述制品包含通过支持材料维持在至少5%压缩应变下的至少部分压缩的状态的弹簧,每个组织接合组件可操作地连接至所述弹簧。
在另一方面,提供了形成组织接合组件的方法。在一些实施方案中,该方法包括提供固体治疗剂和支持材料,以及将固体治疗剂与支持材料一起使用至少1MPa的压力压缩和/或加热以形成组织接合组件,其中所述组织接合组件配置成穿透组织。
当结合附图考虑时,本发明的其他优点和新特征将通过以下对本发明的多个非限制性实施方案的详细描述而变得明显。在本说明书和通过引用并入的文件包括冲突和/或不一致的公开内容的情况下,以本说明书为准。
附图说明
将参照附图通过实例的方式来描述本发明的一些非限制性实施方案,这些附图是示意性的并且不旨在按比例绘制。在附图中,所示出的每个相同或接近相同的组件通常由单一数字表示。为了清楚起见,并非每个组件在每幅图中都进行了标记,在举例说明不是使本领域普通技术人员理解本发明所必需的情况下,也没有示出本发明的各个实施方案的每个组件。在图中:
图1是根据一组实施方案的自扶正系统的示意图;
图2是根据一组实施方案的示例性自扶正系统的截面示意图;
图3是根据一组实施方案的自扶正系统的施用的示意图;
图4是根据一组实施方案的示例性自扶正制品的示意图;
图5是根据一组实施方案的示例性自扶正系统的截面示意图;
图6是根据一组实施方案的示例性自致动组件的截面示意图;
图7是根据一组实施方案的示例性自扶正形状图的图;
图8是根据一组实施方案在000号胶囊内的示例性自扶正制品的照片;
图9是根据一组实施方案通过计算机模型(预测的)进行的自扶正制品的扶正速度测试的图;
图10是根据一组实施方案通过高速摄影机分析(poly)进行的自扶正制品的扶正速度的图;
图11是根据一组实施方案通过高速摄影机分析(poly)进行的自扶正制品的扶正速度的图;
图12是根据一组实施方案的示例性自扶正制品的照片;
图13是根据一组实施方案与对照(垫圈(washer))相比在0度、45度和90度的方向下的示例性自扶正制品的一系列X射线图像;
图14是根据一组实施方案在猪的GI中的示例性自扶正制品系列的X射线照片;
图15是根据一组实施方案在猪的GI中的示例性自扶正制品的内镜检查术;
图16是根据一组实施方案的扶正制品的分数的图;
图17是根据一组实施方案的最大倾斜相对于形状的图;
图18是根据一组实施方案的最大倾斜测试装置的照片;
图19是根据一组实施方案的包含空气/水进出口的示例性自扶正制品的照片;并且
图20是根据一组实施方案的示例性自扶正制品的照片,该制品包含附接至磁性物体的磁性部分;
图21是根据一组实施方案的自致动制品的示意图;
图22是根据一组实施方案的示例性自致动制品的示意图,根据一组实施方案的在体内制品的照片和与未经压缩弹簧相比的制品的照片;
图23是根据一组实施方案的多种弹簧常数的力相对于位移的图;
图24是根据一组实施方案的糖溶解的直径相对于时间的图;
图25是根据一组实施方案的弹簧致动时间相对于直径的图;
图26是根据一组实施方案的与弹簧相关联的示例性组织接合组件(例如,活检凿)的照片和示意图;
图27是根据一组实施方案的从弹簧相关制品体外插入到组织中到达胃组织的肌肉层的针的组织学;
图28是根据一组实施方案的组织接合组件的示意图;
图29是根据一组实施方案的由80% BSA和20% PEG 200k w/w在100℃下暴露于3公吨压力下2分钟制成的平面针的照片;
图30是根据一组实施方案的由80%人胰岛素和20% PEG 200k w/w在100℃下暴露于3公吨压力下2分钟制成的平面针的照片;
图31是根据一组实施方案的平面针的照片,该平面针由80%人胰岛素和20% PEG200k w/w暴露于2公吨压力下制成,通过在麦芽糖中浸涂产生尖端;
图32是根据一组实施方案的具有相对高的API载量的组件的胰岛素释放相对于时间的图;
图33是根据一组实施方案的具有相对高的API载量的多个组件的负荷相对于延伸(横向负荷)的图;
图34是根据一组实施方案的具有相对高的API载量的多个组件的负荷相对于延伸(轴向负荷)的图;
图35是根据一组实施方案的与32号不锈钢针相比具有相对高载量的API载量的示例性组件的穿透力相对于插入深度的图;
图36是根据一组实施方案的具有相对高的API载量的组件(例如,基板(baseplate)上的针状突出物)的照片,该组件由83%人胰岛素、5%HPMC、2%硬脂酸镁和10%PEG 35k w/w在100℃下暴露于3公吨压力下2分钟制成;
图37是用于用非API基板制造具有相对高的API载量的组件(例如,针)的方法的示意图,根据一组实施方案,基板上的针状突出物由85%人胰岛素、5% HPMC和10% PEG 35kw/w在100℃下暴露于3公吨压力下2分钟制成;
图38是用于用非API基板和针基部制造具有相对高的API载量的组件(例如,针尖)的方法的示意图。根据一组实施方案,基板上的针状突出物由85%人胰岛素、5% HPMC和10% PEG 35k w/w在100℃下暴露于3公吨压力下2分钟制成;
图39是根据一组实施方案的具有相对高的API载量的组件(例如,微针)的轴向载荷的图;
图40A是根据一组实施方案的包含95wt%API的示例性组织接合组件的照片;
图40B至40C是图40A中的组织接合组件的压缩测试;
图40D是根据一组实施方案的组织接合组件的胰岛素回收百分比相对于温度的图;
图40E是根据一组实施方案的胰岛素二聚体形成百分比相对于温度的图;
图41是根据一组实施方案用于制造具有多个微针和相对高的API载量的组件的示例性方法的示意图;
图42A至42B是根据一组实施方案的负载有FITC-葡聚糖的示例性组件的共聚焦显微镜图像;
图43示出了根据一组实施方案,在向多个组织施用之后,包含多个微针和相对高的API载量的组织接合组件的溶解;
图44示出了根据一组实施方案,在向离体人颊组织施用之后,包含多个微针和相对高的API载量的组织接合组件的溶解;
图45是根据一组实施方案,在将包含多个微针和相对高的胰岛素载量的组织接合组件施加至猪的小肠之后,血液胰岛素浓度相对于时间的图;
图46是根据一组实施方案,在将包含多个微针和相对高的胰岛素载量的组织接合组件施加至猪的腭组织之后,血液胰岛素浓度相对于时间的图;
图47是根据一组实施方案,在将包含多个微针和相对高的人生长激素载量的组织接合组件施加至猪的唇之后,血液人生长激素浓度相对于时间的图;
图48是根据一组实施方案,在将包含多个微针和相对高的人生长激素载量的组织接合组件施加至猪的腭组织之后,血液人生长激素浓度相对于时间的图;
图49是根据一组实施方案,在将包含多个微针和相对高的人生长激素载量的组织接合组件施加至猪的唇之后,血液人生长激素浓度相对于时间的图;
图50是根据一组实施方案,在暴露于相对高的压力和相对高的温度之前和之后的阿达木单抗(adalimumab)活性的图;
图51是用于组织定位和弹出(ejecting)钩状微柱(hooked micropost)(即,钩)的自扶正系统的示意图。根据一组实施方案,在左侧示出了带钩的32号不锈钢针的一个实例;
图52是根据一组实施方案使用钩状微柱进入到猪胃组织中的穿透力的图;
图53是根据一组实施方案基于使用钩状微柱穿透猪胃组织的钩力(hookingforce)的图;
图54是钩状微柱的照片,该钩状微柱已自身附接至猪胃组织的肌纤维;
图55是根据一组实施方案基于使用钩状微柱穿透人胃组织的钩力的图;
图56是根据一组实施方案基于使用钩状微柱穿透猪小肠组织的钩力的图;
图57是根据一组实施方案基于使用钩状微柱穿透猪小肠组织的上拉高度(pullupheight)的图;
图58是根据一组实施方案的钩状微柱的照片,该钩状微柱已自身附接至猪小肠组织;
图59是水平组织保留测试模型的示意图。根据一组实施方案,探头(probe)向下按压在通过针锚定在组织上的装置上,并记录逐出(dislodge)该装置所需的力;
图60是根据一组实施方案逐出自扶正系统所需的力以及该力随着插入到猪胃组织中的针的数目线性增大的图;
图61是根据一组实施方案从猪胃组织逐出自扶正系统所需的力相对于针距(needle distance)的图;
图62是说明根据一组实施方案的体外实验设计的示意图,其中自取向装置在经历脉动流的同时锚定至猪胃组织;
图63是根据一组实施方案的图,该图显示了具有钩状微柱的三个装置在整整一周内保持其位置,与在两天内被逐出的比较系统相对;
图64是锚定力相对于体内和离体猪胃的图。根据一组实施方案,离体测量反映了使用来自不同胃的三个分开的组织样品进行的研究;
图65A是根据一组实施方案使用猪模型体内说明的图,当锚定的自取向装置遇到与胃组织平行的力时,其可保持其位置,同时旋转多至30度并经历0.5N至0.75N的力(峰和谷对应于动物的呼吸);
图65B是显示根据一组实施方案,附接至自扶正装置的辅助体(ancillary body)的数目与由胃酸施加在系统上的拖拽扭矩(drag torque)之间的关系的图;
图65C是根据一组实施方案将与自扶正装置碰撞的食物团的尺寸和施加在其上的扭矩进行比较的图;
图66是说明根据一组实施方案的聚对二甲苯(parylene)涂覆的电探头如何绕过黏液并通过组织传导电的示意图(例如,没有涂层的情况下,电将流过较低电阻的黏液而不刺激组织);
图67是说明根据一组实施方案的电刺激丸剂的示意图,该电刺激丸剂包含含有两个探头的自取向装置以及包封在绝缘壳(例如PDMS)中的电源和可编程微控制器;
图68是根据一组实施方案的图,其示出了当由两个氧化银电池(1.55V,6.8mm纽扣电池)供电时,电流不会随着组织刺激性电探头的半径增大而显著变化;
图69是根据一组实施方案的图,其示出了当由两个氧化银电池(1.55V,6.8mm纽扣电池)供电时,电流随着组织刺激性电探头之间距离的增大而减小;
图70A至70B是根据一组实施方案的图,其示出了由电压发生器提供动力的电探头通过组织提供了脉动刺激(pulsatile stimulation),如通过示波器(oscilloscope)所测量的(图70A),其可与在组织内测量的背景电压进行比较(图70B);
图71A至71D示出了用于经口胃递送的机械API定位和注射。(图71A)该示例性系统定位至胃衬壁(stomach lining)并利用独特的形状将其注射机构快速对准组织壁。一分钟之内,该装置启动并将药物有效负荷注入到黏膜和黏膜下层中。然后,负载药物的微柱缓慢溶解,并且其余装置从体内排出。(图71B)制造的示例性装置。(图71C)豹纹陆龟(Leopardtortoise,Stigmochelys pardalis)与用于在胃中自取向且稳定的经计算优化的形状之间的比较。经优化的形状具有更窄的构造以允许更快的取向时间,同时仍维持胃环境所期望的稳定性。(图71D)根据一组实施方案,示例性装置利用固定在焦糖化蔗糖中的压缩弹簧来提供用于微柱插入的力。
图72A至72E示出了示例性系统的体内优化和自取向。(图72A)以1000FPS的高速成像显示,由PCL与不锈钢的混合物制成的SOMA装置在64毫秒内自90°角自取向。(图72B)从给定的椭圆体(ellipsoid)、球体和示例性系统形状的初始角度的理论取向时间。全部由相同质量的PCL和不锈钢制成。(图72C)当归一化为其在水中的扶正时间时,从90°起始角起在不同流体中实验测量的受力形状(weighted shape)的相对扶正时间(n=6,误差条=SEM)。(图72D)当暴露于0.25rad/s的15°的摇摆运动时,实验确定的受力的3D形状的最大倾斜角(n=3,误差条=SEM)。(E)根据一组实施方案,由PCL和不锈钢制成的两个示例性系统在从5cm的高度掉落之后在体内在猪胃中取向,而由仅PCL制成的三个示例性装置无法适当地取向;
图73A至73I示出了示例性系统的微柱制造和插入力表征。(图73A)(i)微柱五部分不锈钢模具。(ii)将API混合物丝网印刷到尖端部分中。(iii)振动确保粉末填充腔。(iv)顶部装有可生物降解的聚合物。(v)将材料在550MPa下压缩。(图73B)胰岛素微柱。(图73C)MicroCT成像显示(i)将硫酸钡微柱递送到(ii)猪胃组织中的示例性系统。底部较大以确保成像期间的微柱稳定性。(图73D)使用以0.2mm/s推进的胰岛素微柱在猪胃中测量的体内插入力曲线(n=2个胃,n=8次插入,误差条=SEM)。(图73E)体内H&E染色的组织学是由Carr-Locke针插入到猪胃组织中获得的。在示例性系统中来自经由5N弹簧注射到原位猪中的胰岛素微柱的(图73F)H&E和胰岛素染色的组织学和(图73H)平滑肌染色的组织学。根据一组实施方案,用9N的弹簧插入到离体猪胃的钢微柱的(图73G)H&E染色的组织学和(图73I)平滑肌染色的组织学;
图74A至74D示出了示例性系统的体内API微柱递送和装置评价。通过示例性系统在手动皮下(S.C.)或胃内(I.G.)注射包含人胰岛素的微柱之后,在猪中记录了血浆(图74A和图74B)人胰岛素和(图74C和图74D)葡萄糖(B.G.)水平(n=5,误差条=SEM)。将这些猪与用示例性系统给药的猪进行比较,所述示例性系统设计成将微柱定位至组织壁但不注射(I.G.未注射)。对于每次注射试验,将280±15μg的人胰岛素浸入组织下方。人工放置的微柱除包含人胰岛素之外,还包含20% PEO 200k。与15分钟时间点相比,测量到B.G.降低,这是因为麻醉导致在那期间BG水平发生显著变化。在两种给药方法中均见到B.G.降低。根据一组实施方案,I.G.数据集仅包含成功禁食而没有残余食物或显著胃液的猪。
图75示出了示例性系统的不锈钢毒性检查。根据一组实施方案,与仅用1mL芥花油(canola oil)给药的大鼠相比,通过15G经口灌胃饲喂悬浮于1mL芥花油中的单剂量的2000mg/kg 316不锈钢颗粒的六只大鼠之一的消化道组织学显示没有异常;
图76示出了示例性系统的体内SOMA形状的X射线。向猪饲喂六个SOMA装置以及具有相同SOMA形状但密度均匀的一个对照装置。由于SOMA的金属底部为圆形,当完全取向时这些装置在X射线上显示为完整的圆,而在未取向时显示为亏缺的圆。对照装置还标记有薄金属垫圈。然后将猪轴向旋转多至180°,以及沿其他方向倾斜多至30°以模拟行走(ambulation)和广泛的运动应激。然后对猪进行X光检查。根据一组实施方案,该过程被重复10次,并且对于SOMA装置产生100%校正取向率,并且对于对照装置产生50%取向率。
图77示出了示例性系统的胃滞留(gastro-retentive)特性。显示六个SOMA装置在8天内通过了猪的GI道。SOMA装置在胃中度过1至7天。第1天的X射线显示一个SOMA装置通过食管被递送,并且五个soma装置在胃中。在第2天,所有SOMA装置都在胃中,并且它们一直在那停留至第7天。在第8天,显示有4个SOMA装置已移动到肠中。到第9天,X射线中不存在SOMA装置。这表明SOMA已从猪中传出。根据一组实施方案,在整个实验过程中,猪未显示出任何阻塞的迹象;
图78示出了示例性系统的压缩胰岛素的拉曼光谱分析。数个微柱是在不同压力下由压缩的胰岛素和PEO制成的。使用拉曼光谱分析这些API混合物以确定在暴露于高压期间是否发生任何蛋白质折叠变化。(A)人胰岛素和PEO 200k的标准品。黑色圆圈表示在胰岛素读数中存在而PEO读数中不存在的峰。在图(C至E)中分析了这些峰。(B)两个组件之间的差异允许成像软件使用内置的预处理和化学计量学而生成混合物的可视化。在该图片中,蓝色区域包含更多量的PEO。除五个带之外,胰岛素拉曼带与PEO带重叠:(C)酰胺I带出现在1660cm
图79示出了示例性系统的压缩胰岛素针压碎测试。由所述的胰岛素/PEO 200k混合物制造尺寸为3.3×0.55×0.55mm
图80示出了示例性系统的微柱溶解曲线。将包含按重量计80%人胰岛素和20%PEO 200k的微柱溶解在37℃下以50rpm在实验室摇床上振荡的包含2mL PBS的falcon管中。在开始的15分钟内每三分钟和15分钟之后的每5分钟采样200μL,并用新鲜PBS替换移除的液体。根据一组实施方案,在1小时内发生完全溶解。
图81示出了示例性系统的微柱API稳定性研究。根据一组实施方案,在16周的稳定性测试期间的(A)胰岛素纯度和(B)高分子量蛋白质(HMWP)浓度(n=3,误差条=SEM);
图82示出了示例性系统的针插入机构的示意图和照片。使用由线性滑行仪(linear glide)、步进电机(stepper motor)、0.5N或10N负荷传感器(load cell)和摄像机组成的以下装置获取需要视频的体内插入数据和离体插入数据。右下图示出了附接至该装置的10N负荷传感器。根据一组实施方案,所有装置都通过定制的LabView设置进行控制。
图83A至83E示出了示例性系统的蔗糖致动机构的表征。将在COMSOLMultiphysics中建模为蔗糖圆柱体的浓度梯度蔗糖溶解在无限的(A)以0.02m/s的速度流动的水体和(B)无对流的水体中。黑色圆圈指示糖圆柱体的收缩边界,并且浓度以mol/m
图84A至84D示出了示例性系统的可植入胰岛素微柱的零级动力学释放。(A)插入到皮下(S.C.)空间的微柱杆(shaft)递送胰岛素30小时(n=6,误差条=SEM)。(B)在最初的15小时中,见到BG持续下降。在第22小时饲喂猪,造成B.G.尖峰(spike)。这些植入物没有尖锐的尖端,而是直径为1.2mm高度为1mm的杆。(C)通过剖腹术和开胃手术(open stomachsurgery)插入到胃内(I.G.)空间的微柱杆在2小时的采样中递送胰岛素(n=5,误差条=SEM)。(D)根据一组实施方案,观察到剧烈的B.G.降低,这可以部分地是由于手术引起的。
图85A至85D示出了用于示例性系统的制造的微柱的酶活性测定。溶解用(A)80%溶菌酶和20% PEO 200k以及(B)40%葡萄糖-6-磷酸脱氢酶和60% PEO 200k产生的微柱尖端,并进行(C至D)酶活性测定以确保蛋白质在制造过程之后保持活性。对照表示未经压缩的粉末。比例尺为1mm。根据一组实施方案(误差条=SEM);
图86示出了示例性系统的涂覆有糖的弹簧制造工作流程。涂覆有糖的弹簧在短短的四步过程中制成。(I)将压缩弹簧放入硅酮模具中,并且(II)将在烤箱中加热至210℃15分钟的焦糖化蔗糖倒入到模具中。还使用了异麦芽酮糖醇(Isomalt)。定制的柱塞(plunger)将弹簧压缩到焦糖化蔗糖中,并将模具冷却数分钟。(III)然后移除柱塞,并且(IV)将蔗糖包封的弹簧从模具中拉出。根据一组实施方案,模具中孔的大小决定了糖包封的弹簧的宽度。
图87示出了示例性系统的胰岛素量化测定。ELISA和AlphaLisa实验利用均相珠测定,该测定采用针对人胰岛素的两种单克隆抗体。根据一组实施方案,该测定对人胰岛素比猪胰岛素更具有特异性;并且
图88示出了根据一组实施方案针对示例性系统的自取向形状优化的计算结果。
具体实施方式
概述
一般地提供了自扶正制品,例如用于向对象施用的自扶正胶囊。在一些实施方案中,自扶正制品可配置成使得制品可相对于表面(例如,对象的组织的表面)自身取向。本文中所述的自扶正制品可包含一个或更多个组织衔接表面,其配置成与表面(例如,对象的组织的表面)衔接(例如,与其接合、注入、锚定)。例如,可将自扶正制品放置在接近表面的任何方向上并且自扶正制品将自身(重新)取向成使得组织衔接表面与该表面接触(例如,直接接触)。在一些实施方案中,自扶正制品可具有特定的形状和/或密度(或质量)分布,其例如能够实现制品的自扶正行为。在一些这样的实施方案中,可将包含自扶正制品的胶囊施用于对象(例如,用于将自扶正制品递送至对象内部的位置例如胃肠道)。在一些实施方案中,自扶正可包含组织接合组件和/或药剂(例如,用于将活性药剂递送至对象内部的位置)。在一些情况下,在组织与制品的组织衔接表面接触之后,自扶正制品可配置成释放一个或更多个组织接合组件。在一些情况下,组织接合组件与自致动组件相关联。例如,自扶正制品可包含自致动组件,其配置成在暴露于流体之后从自扶正制品释放组织接合组件。在一些情况下,组织接合组件可包含药剂和/或与其相关联(例如,用于递送至对象内部的位置)。
本文中所述的自扶正制品可用作例如用于递送多种药剂的通用平台,所述药剂否则会由于在GI道中的降解而通常通过直接注射到组织中来递送。在一些情况下,自扶正制品可配置成在期望的位置和/或期望的时间和/或期望的持续时间内向对象递送药剂。在一些实施方案中,本文中所述的自扶正制品可用于递送传感器和/或进行活检,例如而不需要内镜检查。在某些实施方案中,本文中所述的自扶正制品可用于将一个或更多个制品锚定至例如GI道中的组织表面。在一些情况下,本文中所述的自扶正制品可用于直接向组织中提供电刺激。
有利地,在一些实施方案中,本文中所述的自扶正制品和/或自致动组件可用作用于递送多种药剂(例如,API)的通用平台,所述药剂由于在GI道中的降解而通常通过直接注射到组织中来递送。例如,自扶正制品可以能够沿指定方向(例如,允许负载的药物避免在扩散到血流中之前长时间通过GI道流体)将其自身定位至组织壁。在一些情况下,该制品可用作平台以允许目前被GI道中的酶降解的药物以更高的生物利用度被吸收。另外,该制品可使得机械和电气机构例如针柱塞、锚、传感器等直接在组织壁处和/或组织壁内致动。在某些实施方案中,以这种方式,该制品可用作将电子产品(electronics)或其他制品递送到GI道中的载剂。
在一些实施方案中,(例如,与自致动组件相关联的)组织接合组件可包含相对高负载的活性药物成分(例如,药物)。例如,在某些实施方案中,组织接合组件包含固体治疗剂(例如,固体API)和任选地支持材料(例如,黏合剂例如聚合物)使得相对于组织接合组件的总重量,固体治疗剂以相对高的量(例如,大于或等于80wt%)存在于该组件中。这样的组织接合组件可用于(例如,向对象)递送API剂。有利地,在一些实施方案中,与液体制剂相比,递送所需API剂量所需的体积减小允许在多个部位/组织(例如,舌、GI黏膜组织、皮肤)中创建用于多种药物的固体针递送系统,和/或降低和/或消除用于通过针中的小开口注射药物溶液的外力施加。在一些情况下,生理相关剂可存在于(例如,具有相对高的API载量的)单个组织接合组件中。
在一个示例性实施方案中,自扶正制品可包含组织接合组件和与该组织接合组件相关联的自致动组件(例如,包含弹簧和/或支持材料)。
如图1中所示,在一些实施方案中,系统100(例如,自扶正制品)包含组织衔接表面150。尽管本文中所述的一些实施方案是指单个组织接合表面,但是在一些实施方案中,可存在两个或更多个组织接合表面。在某些实施方案中,自扶正制品可设计和配置成使得组织衔接表面接触表面(例如,在对象内部的位置处的组织表面,例如对象的胃表面)。在一些实施方案中,系统100将自扶正(例如,将取向而无需或不使用施加至自扶正制品的外力)使得组织衔接表面150接触该表面。在某些实施方案中,自扶正制品配置成使得与组织衔接表面基本上垂直的轴优先平行于重力方向对准。如本文中更详细描述的,自扶正制品可配置成使得与组织衔接表面基本上垂直的轴在外部施加的扭矩下能够维持与垂直方向成20度或更小的取向。在一些实施方案中,自扶正制品配置成使得组织接合组件具有在自扶正时在垂直方向的15度内取向的最长纵轴。
不希望受到理论的束缚,由于在自扶正制品内的密度(和/或质量)的分布,自扶正制品可设计成自扶正。例如,在一些实施方案中,系统100(例如,自扶正制品)包含第一部分110和第二部分115,第一部分和第二部分具有不同的密度和/或不同的质量。在本文中对自扶正制品的不同密度/质量进行了更详细地描述。在某些实施方案中,自扶正制品可具有能够实现自扶正行为的特定形状。例如,如图1中所示,系统100包含如系统100的外表面170所指示的单静态形状(例如,单-单静态形状、冈布茨型形状(gomboc-type shape))。本文中使用的术语“单静态”被赋予其在本领域中的普通含义并且通常是指具有单一稳定静止位置(例如,平衡点)的三维形状。本文中使用的术语“单-单静态”被赋予其在本领域中的普通含义并且通常是指具有单一稳定静止位置和单一不稳定静止位置的三维形状。作为实例并且不希望受到理论的束缚,通常将质心从几何中心偏移的球形视为单-单静态形状。本文中使用的术语“冈布茨”被赋予其在本领域中的普通含义并且通常是指凸的三维形状,当放置在平整表面上时,其具有单一稳定平衡点(或取向)和单一不稳定平衡点(或取向)。例如,并且不希望受到理论的束缚,当将冈布茨型形状放置在除该形状的单一稳定取向之外的任何取向的表面上时,则该形状将倾向于重新取向为其单一稳定取向。以下对这样的形状进行更详细地描述。
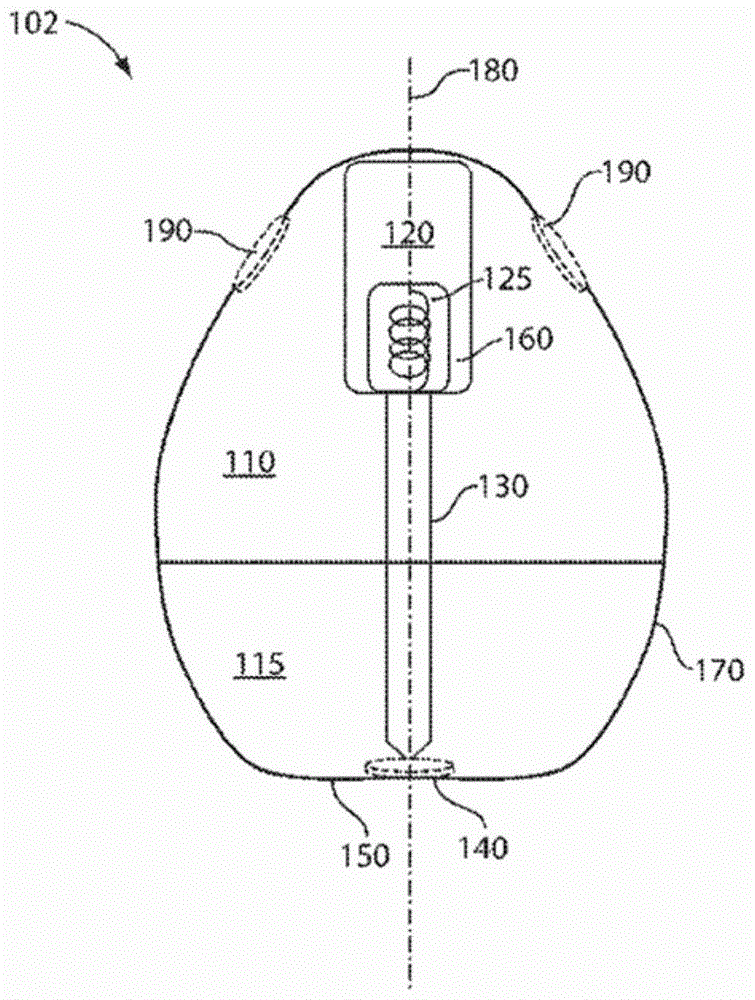
图2示出了示例性系统102的截面图。在一些实施方案中,系统102包含自致动组件120。自致动组件120可配置成例如在暴露于特定流体之后从系统102释放与自致动组件120相关联的组织接合组件130。例如,在一些情况下,自致动组件120包含弹簧125使得在致动自致动组件之后,弹簧125膨胀,将组织接合组件130通过孔140(与组织衔接表面150相关联)推出系统102。在一些情况下,弹簧125包含支持材料160,其使弹簧125维持在压缩下(例如,在至少5%压缩应变下)。在一些情况下,在支持材料160和/或弹簧125暴露于流体之后,弹簧可配置成释放弹簧的至少10%(例如,至少20%、至少30%、至少40%、至少50%、至少60%、至少70%、至少80%、至少90%,包括其中的任何百分比)的储存压缩能(例如,使得组织接合组件130被释放)。在一些实施方案中,弹簧与支持材料相关联(例如,至少部分地被支持材料包封,与支持材料直接接触)。
在某些实施方案中,组织接合组件130包含活性药剂。在一些实施方案中,活性药剂可以以相对高的量(例如,相对于组织接合组件的总重量,大于或等于10wt%、大于或等于80wt%、或者大于或等于90wt%API)存在于组织接合组件中。在一些情况下,可将本文中所述的自扶正制品施用于对象,例如使得药剂被递送至所述对象。例如,在一些情况下,可将制品施用于对象,并且在对象内部的位置处将药剂从制品释放。在本文中对制品的施用和药剂的释放进行更详细地描述。
在一些实施方案中,将该系统施用于对象(例如,经口)。在某些实施方案中,该系统可经口、经直肠、经阴道、经鼻或经尿道施用。在某些实施方案中,在到达对象内部的位置(例如,胃肠道)之后,支持材料的至少一部分降解使得弹簧延伸和/或组织接合组件与位于对象内部的组织接合(例如,接触、穿透)。在一些实施方案中,对象内部的位置是结肠、十二指肠、回肠、空肠、胃或食管。如上文和本文中所述,在一些实施方案中,活性药物成分可在穿透位于对象内部的组织期间和/或之后释放。
作为实例并且不希望受到这样的示例性实施方案组的限制,该系统可经口施用于对象,在一些情况下,其中该系统行进至对象的胃,沉入对象的胃的底部,并且系统自扶正使得系统的组织衔接表面接触胃组织(例如,系统由胃组织至少部分地支持)。例如,如图3中示意性地示出的,可将示例性系统100施用于对象(例如,经口)使得系统100进入对象的胃肠系统198。系统100可行进通过胃肠系统198直至到达对象的胃199(系统100a)。在一些实施方案中,系统100可沉至胃199的底部(系统100b)使得其接触胃199的表面。在某些实施方案中,系统100自扶正(系统100c)使得系统100的组织衔接表面150接触胃199的表面,并且系统100自致动使得组织接合组件130与对象内部的位置处的组织(例如,胃199的表面)接合。虽然图3示出了组织接合组件与胃199的表面的接合,但是基于本说明书的教导,本领域普通技术人员将理解的是,组织接合组件可接触在胃表面(或对象内部的其他位置)下方的一个或更多个层,包括例如黏膜层、黏膜下层、和/或肌组织层。
在一些情况下,如本文中所述,系统100的自扶正可由重力(例如,作用在系统100的质心上)驱动。在期望的时间段之后,在一些实施方案中,系统100解开(例如,组织接合组件130溶解和/或释放)并离开胃1999(系统100d)。以上描述并不意味着是限制性的,并且本领域普通技术人员将理解的是,也可以存在该系统与对象的胃肠系统之间的其他相互作用,如本文中所述。在一些实施方案中,系统100是单静态体(monostatic body),如以下更详细描述的。
以下描述提供了本文中所述系统的自扶正、自致动和相对高API负载的组件的多个实施方案。
自扶正
如上所述,在一些实施方案中,自扶正制品可包含具有不同平均密度的两个或更多个部分使得例如自扶正制品可使其自身基本上垂直于表面(例如,与重力基本上垂直的表面,组织的表面例如胃肠道的壁)取向。在一些情况下,自扶正制品可具有特定形状,例如,该形状使得能够实现制品的自扶正行为。在一些实施方案中,可将自扶正制品设置(例如包封)在胶囊中。在某些实施方案中,自扶正制品未在胶囊中提供。在一些实施方案中,可将包含自扶正制品的胶囊施用于对象(例如,用于将自扶正制品递送至对象内部的位置例如胃肠道)。在一些实施方案中,自扶正制品和/或胶囊可包含药剂(例如,用于将活性药剂递送至对象内部的位置)。
本文中所述的自扶正制品可例如用作用于递送多种药物成分的通用平台,所述药物成分否则会由于在GI道中的降解而通常通过直接注射到组织中来递送。在一些实施方案中,本文中所述的自扶正制品可用于递送传感器和/或进行活检,例如而不需要内镜检查。
有利地,自扶正制品可以能够沿指定方向(例如,允许负载的药物避免在扩散到血流中之前长时间通过GI道流体)将其自身定位至组织壁。如本文中所述,在一些情况下,该制品可用作平台以允许目前被GI道中的酶降解的药物以更高的生物利用度被吸收。另外,该制品可使得机械和电气机构例如针柱塞、锚、传感器等直接在组织壁处和/或组织壁内致动。在某些实施方案中,以这种方式,该制品可用作将电子产品或其他制品递送到GI道中的载剂。
在一些实施方案中,自扶正制品可具有特定的截面形状。在某些实施方案中,该形状可以是任何合适的截面形状,包括圆形、椭圆形、三角形、不规则形、梯形、正方形或矩形等。在某些实施方案中,自扶正制品可以是非球形的。在一些实施方案中,自扶正制品可以是单静态体和/或具有仅一个稳定点(例如,自扶正制品可在仅一个给定取向上稳定地维持特定取向)。在一个示例性实施方案中,该自扶正制品具有冈布茨形状和/或包含冈布茨形状的组件。具有冈布茨形状的自扶正制品可在从特定取向位移之后自扶正到该取向,而无需另外的力。在一些情况下,自扶正制品可在流体(例如,具有相对低黏度的液体,具有相对高黏度的液体)中自扶正。有利地,该形状是使得自扶正制品能够使自扶正制品可预测且快速地取向,同时描述了使由GI道内部的力引起的运动最小化。在一些情况下,自扶正制品的至少一个表面包含平整表面(flat surface)。例如,如图1和图2中所示,在一些实施方案中,组织衔接表面150可以是平整的。
再次参照图1,在一些实施方案中,自扶正制品包含第一部分110和与第一部分110相邻的第二部分115,第二部分115具有与第一部分不同的平均密度和/或与第一部分不同的质量。例如,在一些实施方案中,自扶正制品包含第一部分和与第一部分相邻的第二部分,第二部分具有与第一部分中的不同的平均密度。例如,第一部分可具有第一平均密度,并且第二部分可具有与第一平均密度不同的第二平均密度。在一些实施方案中,第一部分的平均密度与第二部分的平均密度的比例可大于1:1、大于等于2:1、大于等于2.5:1、大于等于3:1、大于等于3.5:1、大于等于4:1、大于或等于4.5:1、大于或等于5:1、大于等于5.5:1、大于等于5.5:1、大于等于6:1、大于或等于6.5:1、大于或等于7:1、大于等于8:1、大于或等于9:1、或者大于或等于10:1。在某些实施方案中,第一部分的平均密度与第二部分的平均密度的比例可小于或等于15:1、小于或等于10:1、小于或等于9:1、小于或等于8:1、小于或等于7:1、小于或等于6.5:1、小于或等于6:1、小于或等于5.5:1、小于或等于达到5:1、小于或等于4.5:1、小于或等于4:1、小于或等于3.5:1、小于或等于3:1、小于或等于2.5:1、小于或等于2:1、或者小于或等于1.5:1。可以是上述范围的组合(例如,大于或等于1:1且小于或等于15:1)。也可以是其他范围。不希望受到理论的束缚,具有二者具有不同平均密度的第一部分和第二部分的自扶正制品可能使得自扶正制品相对于表面(例如胃肠道的壁)基本上维持特定的取向。
在一些实施方案中,第二部分的平均密度与第一部分的平均密度的比例可大于1:1、大于等于2:1、大于等于2.5:1、大于等于3:1、大于等于3.5:1、大于等于4:1、大于或等于4.5:1、大于或等于5:1、大于等于5.5:1、大于等于5.5:1、大于等于6:1、大于或等于6.5:1、大于或等于7:1、大于等于8:1、大于或等于9:1、或者大于或等于10:1。在某些实施方案中,第二部分的平均密度与第一部分的平均密度的比例可小于或等于15:1、小于或等于10:1、小于或等于9:1、小于或等于8:1、小于或等于7:1、小于或等于6.5:1、小于或等于6:1、小于或等于5.5:1、小于或等于5:1、小于或等于4.5:1、小于或等于4:1、小于或等于3.5:1、小于或等于3:1、小于或等于2.5:1、小于或等于2:1、或者小于或等于1.5:1。可以是上述范围的组合(例如,大于或等于1:1且小于或等于15:1)。也可以是其他范围。
在某些实施方案中,自扶正制品包含第一部分和与第一部分相邻的第二部分,第二部分具有与第一部分不同的质量。例如,第一部分可具有第一质量,并且第二部分可具有与第一质量不同的第二质量。在一些实施方案中,第一部分的质量与第二部分的质量的比例可大于1:1、大于等于2:1、大于等于2.5:1、大于等于3:1、大于等于3.5:1、大于等于4:1、大于或等于4.5:1、大于或等于5:1、大于等于5.5:1、大于等于5.5:1、大于等于6:1、大于或等于6.5:1、大于或等于7:1、大于等于8:1、大于或等于9:1、或者大于或等于10:1。在某些实施方案中,第一部分的质量与第二部分的质量的比例可小于或等于15:1、小于或等于10:1、小于或等于9:1、小于或等于8:1、小于或等于7:1、小于或等于6.5:1、小于或等于6:1、小于或等于5.5:1、小于或等于5:1、小于或等于4.5:1、小于或等于4:1、小于或等于3.5:1、小于或等于3:1、小于或等于2.5:1、小于或等于2:1、或者小于或等于1.5:1。可以是上述范围的组合(例如,大于或等于1:1且小于或等于15:1)。也可以是其他范围。不希望受到理论的束缚,具有二者具有不同质量的第一部分和第二部分的自扶正制品可能使得自扶正制品相对于表面(例如胃肠道的壁)基本上维持特定的取向。
在一些实施方案中,第二部分的质量与第一部分的质量的比例可大于1:1、大于等于2:1、大于等于2.5:1、大于等于3:1、大于等于3.5:1、大于等于4:1、大于或等于4.5:1、大于或等于5:1、大于等于5.5:1、大于等于5.5:1、大于等于6:1、大于或等于6.5:1、大于或等于7:1、大于等于8:1、大于或等于9:1、或者大于或等于10:1。在某些实施方案中,第二部分的质量与第一部分的质量的比例可小于或等于15:1、小于或等于10:1、小于或等于9:1、小于或等于8:1、小于或等于7:1、小于或等于6.5:1、小于或等于6:1、小于或等于5.5:1、小于或等于5:1、小于或等于4.5:1、小于或等于4:1、小于或等于3.5:1、小于或等于3:1、小于或等于2.5:1、小于或等于2:1、或者小于或等于1.5:1。可以是上述范围的组合(例如,大于或等于1:1且小于或等于15:1)。也可以是其他范围。
如图4中所示,系统100可包含第一部分110和与第一部分110相邻的第二部分120。如本文中使用的,当一部分被称为与另一部分“相邻”时,它可与该部分直接相邻(例如,与其接触),或者也可存在一个或更多个居间组件(intervening component)(例如,液体、空心部分)。与另一部分“直接相邻”的部分意指不存在居间组件。
例如,再次参照图1,具有第一平均密度和/或质量的第一部分110可占据自扶正制品的第一体积,并且具有第二平均密度和/或质量的第二部分115可占据自扶正制品的剩余体积。在某些实施方案中,返回参照图4,第一部分110可占据自扶正制品的第一体积,第二部分115可占据自扶正制品的第二体积,并且第三部分130可以是空心的和/或可包含一个或更多个(另外的)组件。
在一些实施方案中,相对于自扶正制品的总体积,第一部分占据大于或等于1vol%、大于或等于5vol%、大于或等于10vol%、大于或等于20vol%、大于或等于25vol%、大于或等于30vol%、大于或等于40vol%、大于或等于45vol%、大于或等于50vol%、大于或等于55vol%、大于或等于60vol%、大于或等于65vol%、大于或等于70vol%、大于或等于75vol%、大于或等于80vol%、大于或等于90vol%、或者大于或等于95vol%。在某些实施方案中,相对于自扶正制品的总体积,第一部分占据小于或等于99vol%、小于或等于95vol%、小于或等于90vol%、小于或等于80vol%、小于或等于75vol%、小于或等于70vol%、小于或等于60vol%、小于或等于55vol%、小于或等于50vol%、小于或等于45vol%、小于或等于40vol%、小于或等于30vol%、小于或等于25vol%、小于或等于20vol%、小于或等于10vol%、或者小于或等于5vol%。也可以是上述范围的组合(例如,大于或等于1vol%且小于或等于99vol%,大于或等于40vol%且小于或等于60vol%0。也可以是其他范围。
在某些实施方案中,相对于自扶正制品的总体积,第二部分占据大于或等于1vol%、大于或等于5vol%、大于或等于10vol%、大于或等于20vol%、大于或等于25vol%、大于或等于30vol%、大于或等于40vol%、大于或等于45vol%、大于或等于50vol%、大于或等于55vol%、大于或等于60vol%、大于或等于65vol%、大于或等于70vol%、大于或等于75vol%、大于或等于80vol%、大于或等于90vol%、或者大于或等于95vol%。在一些实施方案中,相对于自扶正制品的总体积,第二部分占据小于或等于99vol%、小于或等于95vol%、小于或等于90vol%、小于或等于80vol%、小于或等于75vol%、小于或等于70vol%、小于或等于60vol%、小于或等于55vol%、小于或等于50vol%、小于或等于45vol%、小于或等于40vol%、小于或等于30vol%、小于或等于25vol%、小于或等于20vol%、小于或等于10vol%、或者小于或等于5vol%。也可以是上述范围的组合(例如,大于或等于1vol%且小于或等于99vol%,大于或等于40vol%且小于或等于60vol%0。也可以是其他范围。
在一些实施方案中,相对于自扶正制品的总体积,第三部分(例如,空心部分)占据大于或等于1vol%、大于或等于5vol%、大于或等于10vol%、大于或等于20vol%、大于或等于25vol%、大于或等于30vol%、大于或等于40vol%、大于或等于45vol%、大于或等于50vol%、大于或等于至55vol%、大于或等于60vol%、大于或等于65vol%、大于或等于70vol%、大于或等于75vol%、大于或等于80vol%、大于或等于90vol%、或者大于或等于95vol%。在某些实施方案中,相对于自扶正制品的总体积,第三部分占据小于或等于99vol%、小于或等于95vol%、小于或等于90vol%、小于或等于80vol%、小于或等于75vol%、小于或等于70vol%、小于或等于60vol%、小于或等于55vol%、小于或等于50vol%、小于或等于45vol%、小于或等于40vol%、小于或等于30vol%、小于或等于25vol%、小于或等于20vol%、小于或等于10vol%、或者小于或等于5vol%。也可以是上述范围的组合(例如,大于或等于1vol%且小于或等于99vol%,大于或等于40vol%且小于或等于60vol%0。也可以是其他范围。
在一些实施方案中,自扶正制品可包含由第一部分占据的第一体积与由第二部分占据的第二体积的任何合适的比例。在某些实施方案中,第一体积与第二体积的比例大于或等于1:100、大于或等于1:50、大于或等于1:25、大于或等于1:10、大于或等于1:8、大于或等于1:6、大于或等于1:4、大于或等于1:3、大于或等于1:2、大于或等于到1:1.5、大于或等于1:1.1、大于或等于1:1、大于或等于1.1:1、大于或等于1.5:1、大于或等于2:1、大于或等于3:1、大于或等于4:1、大于或等于6:1、大于或等于8:1、大于或等于10:1、大于或等于25:1、或者大于或等于50:1。在某些实施方案中,第一体积与第二体积的比例小于或等于100:1、小于或等于50:1、小于或等于25:1、小于或等于10:1、小于或等于8:1、小于或等于6:1、小于或等于4:1、小于或等于2:1、小于或等于1.5:1、小于或等于1.1:1、小于或等于1:1、小于或等于1:1.1、小于或等于1:1.5、小于或等于1:2、小于或等于1:4、小于或等于1:6、小于或等于1:8、小于或等于1:10、小于或等于1:25、或者小于或等于1:50。也可以是上述范围的组合(例如,大于或等于1:100且小于或等于100:1,大于或等于1:10且小于或等于10:1,大于或等于1:2且小于或等于2:1)。也可以是其他范围。也可以是其他体积比。不希望受到理论的束缚,在一些实施方案中,可选择由第一部分占据的第一体积与由第二部分占据的第二体积的比例,使得自扶正制品的质心具有一个局部最小值。
在一些实施方案中,自扶正制品配置成直接施用于对象(例如,不包封在胶囊中)。在某些实施方案中,自扶正制品配置和布置成包封在具有壳的胶囊中(例如,图4的外表面170包含壳)。在一些这样的实施方案中,现在参照图4,自扶正制品可包含第三部分130(例如,空心部分)。在某些实施方案中,组织接合组件和/或活性药物成分可设置在空心部分内。
在一些实施方案中,胶囊是000号胶囊或更小的胶囊(例如,胶囊具有如USP中所述的形状或大小,包括但不限于000号胶囊、00号胶囊、0号胶囊、1号胶囊、2号胶囊、3号胶囊、4号胶囊、或5号胶囊。)在某些实施方案中,胶囊至少部分地包封了自扶正制品的第一部分和第二部分。在一些实施方案中,可将多个装置放置在胶囊的内部。
在一些实施方案中,尽管自扶正制品可配置成潜在地包封在000号胶囊或更小的胶囊中,但是自扶正制品不一定需要包封在这样的胶囊中。在其中自扶正制品例如通过摄入该自扶正制品而待施用的一些实施方案中,因此该自扶正制品可在没有包封的情况下施用。
在某些实施方案中,自扶正制品可包含在自扶正制品的外表面的至少一部分上的涂层。在某些实施方案中,系统(例如,包含自扶正制品的系统)包含涂层(例如,设置在至少该系统表面上的膜)。在一些实施方案中,涂层可作为基于水性或有机溶剂的聚合物体系、脂肪和/或蜡施加。在某些实施方案中,涂层包含聚合物、增塑剂、着色剂、溶剂、脂肪和蜡中的一种或更多种。合适的脂肪和/或蜡的非限制性实例包括蜂蜡、巴西棕榈蜡、鲸蜡醇和鲸蜡硬脂醇。
用于涂层的合适聚合物的非限制性实例包括纤维素聚合物(例如,羟丙基甲基纤维素、羟丙基纤维素、羟乙基纤维素、邻苯二甲酸羟乙基纤维素、乙基纤维素、邻苯二甲酸乙酸纤维素、偏苯三酸乙酸纤维素)、乙烯基聚合物(例如,聚(乙烯基吡咯烷酮)、聚(乙烯醇))、聚(乙烯基吡咯烷酮)-聚(乙酸乙烯酯)共聚物、聚(乙烯醇)-聚(乙二醇)共聚物、聚(邻苯二甲酸乙酸乙烯酯)、二醇类(例如,聚(乙二醇))、丙烯酸类(例如,氨基烷基甲基丙烯酸酯共聚物)、其他碳水化合物(例如麦芽糖糊精、聚葡萄糖(polydextrose)),及其组合。
合适的着色剂的非限制性实例包括天然色素(例如核黄素、β-胡萝卜素、胭脂红色淀)、无机色素(例如二氧化钛、氧化铁)、水溶性染料(FD&C黄色5号、FD&C蓝色2号)、FD&C色淀(FD&C黄色5号色淀、FD&C蓝色2号色淀)、以及D&C色淀(D&C黄色10号色淀、D&C红色30号色淀)。
合适的增塑剂的非限制性实例包括多元醇(例如,丙二醇、甘油、聚乙二醇)、乙酸酯(例如,三醋精、柠檬酸三乙酯、乙酰基柠檬酸三乙酯)、邻苯二甲酸酯(例如,邻苯二甲酸二乙酯)、甘油酯(例如酰化甘油单酯)和油(例如,蓖麻油、矿物油)。
聚合物、增塑剂、着色剂、溶剂、脂肪和/或蜡可以以任何合适的量组合以形成涂层。涂层可以以任何合适的方法,包括例如浸涂和/或喷射雾化来施加。也可以是其他沉积涂层方法。
在一些实施方案中,组织接合组件与自扶正制品相关联。组织接合组件的非限制性实例包括针(例如,不锈钢针、包含API的针)、活检凿、微针(例如,包含API的微针)、弹头状物(projectile)等。
在某些实施方案中,组织接合组件包含喷射注射(jet injection)组件(例如,用于使用高速流将液体喷射注射到对象的组织中)。在一个示例性实施方案中,喷射注射组件包含含有聚合物部分的室。在某些实施方案中,聚合物部分可包含酸(例如,弱酸)和/或碱。在一些情况下,流体(例如,胃液)可进入室使得其与酸和/或碱反应形成气体。在一些情况下,室可包含涂层(例如,使得流体不与涂层溶解下的聚合物部分接触)。在另一个示例性实施方案中,喷射注射组件包含柱塞/活塞(piston)(例如,由与该柱塞/活塞相关联的弹簧致动),使得材料从系统中迅速排出。
在一些实施方案中,组织接合组件包含弹簧致动的组件。这样的组织接合组件在2017年5月17日提交的标题为“SELF-ACTUATING ARTICLES”的共同拥有的美国临时申请序列号62/507,653中进行了一般描述,其通过引用整体并入本文。例如,可将包含组织接合组件(例如,针)的自扶正制品施用于对象,使得自扶正制品在对象内部的位置处取向成使得组织接合组件刺穿对象内部的位置临近的组织。在一些这样的实施方案中,与自扶正制品相关联的活性药物成分可释放到组织中和或其附近。在一些实施方案中,组织接合组件可穿透组织。在一些实施方案中,以大于或等于1mN且小于或等于20,000mN(例如,大于或等于10mN且小于或等于20mN、大于或等于10mN且小于或等于100mN、大于或等于100mN且小于或等于20,000mN、大于或等于5,000mN且小于或等于20,000mN)的力穿透组织。
在某些实施方案中,组织接合组件可在自扶正制品内取向成使得在施用于对象之后,组织接合组件与对象内部的组织(例如GI黏膜组织)基本上正交(例如,在正交的15°以内)对准。在一些实施方案中,组织接合组件可设置在自扶正装置的空心部分内,使得组织接合组件沿空心部分的纵轴从自扶正装置释放。例如,再次参照图2,自扶正制品可具有在组织衔接表面150的正交的15度之内对准的最长纵轴180。在某些实施方案中,最长纵轴180与组织接合组件130的主轴平行。在一些实施方案中,组织接合组件130被释放(例如,在激活自致动组件120和/或弹簧125之后)使得弹簧125沿纵轴180膨胀和/或组织接合组件平行于纵轴180的方向行进。在一些这样的实施方案中,组织接合组件可在与纵轴180基本上平行的方向上离开孔140并进入对象的组织。然而,在另一些实施方案中,组织接合组件没有与对象内部的组织基本上正交对准。
在一些实施方案中,自扶正制品具有在自扶正之后在垂直的以下范围内取向的最长纵轴:小于或等于15度、小于或等于10度、小于或等于5度、小于或等于2度、或者小于或等于1度。在某些实施方案中,自扶正制品具有在以下范围内取向的最长纵轴:大于或等于0.1度、大于或等于1度、大于或等于2度、大于或等于5度、或者大于或等于10度。也可以是上述范围的组合(例如,大于或等于0.1度且小于或等于15度)。也可以是其他范围。
在某些实施方案中,组织接合组件具有在自扶正之后在垂直的以下范围内取向的最长纵轴:小于或等于15度、小于或等于10度、小于或等于5度、小于或等于2度、或者小于或等于1度。在一些实施方案中,组织接合组件具有在以下范围内取向的最长纵轴:大于或等于0.1度、大于或等于1度、大于或等于2度、大于或等于5度、或者大于或等于10度。也可以是上述范围的组合(例如,大于或等于0.1度且小于或等于15度)。也可以是其他范围。
在一些实施方案中,空心部分可以是圆柱形形状。也可以是其他形状。
在一个示例性实施方案中,组织接合组件包含多个微针。在另一个示例性实施方案中,组织接合组件包含单个针。在又一示例性实施方案中,组织接合组件包含活检组件(例如,活检钳口(biopsy jaw))。在一些情况下,组织接合组件可包含锚定机构(例如,钩、黏膜黏附剂)。以下对组织接合组件进行更详细地描述。
如上所述,在一些实施方案中,第一部分包含具有第一平均密度的第一材料。在一些实施方案中,可选择第一材料和/或第二材料以赋予第一部分和/或第二部分特定的质量和/或密度。
在一些实施方案中,第一部分的平均密度小于或等于2g/mL、小于或等于1.8g/mL、小于等于1.6g/mL、小于或等于1.4g/mL、小于或等于1.2g/mL、小于或等于1g/mL、小于或等于0.8g/mL、小于或等于0.6g/mL、小于或等于0.4g/mL、小于或等于0.2g/mL、小于或等于0.1g/mL、小于或等于0.05g/mL、或者小于或等于0.02g/mL。在某些实施方案中,第一部分的平均密度大于或等于0.01g/mL、大于或等于0.02g/mL、大于或等于0.05g/mL、大于或等于0.1g/mL、大于或等于0.2g/mL、大于或等于0.4g/mL、大于或等于0.6g/mL、大于或等于0.8g/mL、大于或等于1g/mL、大于或等于1.2g/mL、大于或等于1.4g/mL、大于或等于1.6g/mL、或者大于或等于1.8g/mL。也可以是上述范围的组合(例如,大于或等于0.01g/mL且小于或等于2g/mL,大于或等于0.6g/mL且小于或等于2g/mL)。也可以是其他范围。
在某些实施方案中,第二部分包含具有第二平均密度(例如,与第一平均密度不同)的第二材料。在一些实施方案中,第二部分(例如和/或第二材料)的平均密度小于或等于20g/mL、小于或等于18g/mL、小于或等于16g/mL、小于或等于14g/mL、小于或等于12g/mL、小于或等于10g/mL、小于或等于8g/mL、小于或等于6g/mL、小于或等于4g/mL、或者小于或等于3g/L。在某些实施方案中,第二部分的平均密度大于或等于2g/mL、大于或等于3g/mL、大于或等于4g/mL、大于或等于6g/mL、大于或等于8g/mL、大于等于10g/mL、大于等于12g/mL、大于或等于14g/mL、大于或等于16g/mL、或者大于或等于18g/mL。也可以是上述范围的组合(例如,大于或等于2g/mL且小于或等于20g/mL)。也可以是其他范围。在一些实施方案中,第二部分可具有在第一部分的情况下的一个或更多个上述范围中的平均密度(例如,大于或等于0.6g/mL且小于或等于2g/mL)并且与第一部分的平均密度不同。
可选择第一部分和第二部分以具有任何合适的质量。在一些实施方案中,第一部分的总质量(例如,包含第一部分内的所有组件)可以为大于或等于20mg、大于或等于50mg、大于或等于75mg、大于或等于100mg、大于或等于200mg、大于或等于300mg、大于或等于400mg、大于或等于500mg、大于或等于750mg、大于或等于1g、大于或等于1.5g、大于或等于2g、大于或等于3g、大于或等于4g、大于或等于5g、大于或等于7g、大于或等于10g、大于或等于15g,包括20mg至15g之间的任何质量。在某些实施方案中,第一部分的总质量可以为小于或等于15g、小于或等于10g、小于或等于7g、小于或等于5g、小于或等于4g、小于或等于3g、小于或等于2g、小于或等于1.5g、小于或等于1g、小于或等于750mg、小于或等于500mg、小于或等于400mg、小于或等于300mg、小于或等于200mg、小于或等于100mg、小于或等于75mg、小于或等于50mg、或者小于或等于20mg,包括15g至20mg之间的任何质量。也可以是上述范围的组合(例如,大于或等于50mg且小于或等于4g,大于或等于50mg且小于或等于15g)。在一些实施方案中,第一部分或第二部分的质量为大于等于20mg至小于或等于15g。在一些实施方案中,第一部分或第二部分的质量为大于等于20mg至小于或等于1g。在一些实施方案中,第一部分或第二部分的质量为大于等于300mg至小于或等于12g。在一些实施方案中,第一部分或第二部分的质量为大于等于100mg至小于或等于250mg。在一些实施方案中,第一部分或第二部分的质量为大于等于20mg至小于或等于15g。在一些实施方案中,第一部分或第二部分的质量为大于等于1.5至小于或等于6.5g。也可以是其他范围。
在某些实施方案中,第二部分的总质量(例如,包括第二部分内的所有组件)可以为大于或等于50mg、大于或等于75mg、大于或等于100mg、大于或等于200mg、大于或等于400mg、大于或等于500mg、大于或等于750mg、大于或等于1g、大于或等于1.5g、大于或等于至2g、大于或等于3g、大于或等于4g、大于或等于5g、大于或等于7g、或者大于或等于10g。在某些实施方案中,第二部分的总质量可以为小于或等于15g、小于或等于10g、小于或等于7g、小于或等于5g、小于或等于4g、小于或等于3g、小于或等于2g、小于或等于1.5g、小于或等于1g、小于或等于750mg、小于或等于500mg、小于或等于400mg、小于或等于200mg、小于或等于100mg、或者小于或等于75mg。也可以是上述范围的组合(例如,大于或等于50mg且小于或等于4g,大于或等于50mg且小于或等于15g)。也可以是其他范围。
在一些实施方案中,第一材料和/或第二材料选自聚合物、陶瓷、金属及其组合(例如,金属填充的聚合物)。在一些情况下,第一材料和/或第二材料可以是生物相容性的。在一些情况下,金属可选自不锈钢、铁-碳合金、菲尔德金属、钨、钼、金、锌、铁和钛。
在一些实施方案中,陶瓷可选自羟基磷灰石、氧化铝、氧化钙、磷酸三钙、硅酸盐、二氧化硅和氧化锆。
在某些实施方案中,聚合物可选自聚己内酯、聚乳酸、聚乙二醇、聚丙烯、聚乙烯、聚碳酸酯、聚苯乙烯和聚醚醚酮、以及聚乙烯醇。
在一个示例性实施方案中,第一材料包含金属,并且第二材料包含聚合物。
自扶正制品通常具有几何中心(例如,几何体积的中心)。在某些实施方案中,可选择第一部分和/或第二部分的密度、质量和/或体积使得自扶正制品表现出自扶正行为。例如,在一些实施方案中,自扶正制品的质心可从几何中心偏移,使得经由穿过几何中心的轴悬挂的质心从几何中心横向偏移的制品配置成在受到0.09*10^-4Nm或更小的外部施加的扭矩时维持与垂直方向成20度或更小的取向。
在一些实施方案中,自扶正制品在受到0.09*10^-4Nm或更小的外部施加的扭矩作用时维持与垂直方向成20°或更小的取向。在某些实施方案中,自扶正制品在受到0.09*10^-4Nm或更小的外部施加的扭矩作用时维持与垂直方向成15°或更小、12°或更小、10°或更小、8°或更小、6°或更小、4°或更小、或者2°或更小的取向。在一些实施方案中,自扶正制品在受到0.09*10^-4Nm或更小的外部施加的扭矩作用时维持与垂直方向成大于或等于1°、大于或等于2°、大于或等于4°、大于或等于6°、大于或等于8°、大于或等于10°、大于或等于12°、或者大于或等于15°的取向。也可以是上述范围的组合(例如20°或更小并且大于或等于1°)。也可以是其他范围。
在一些实施方案中,自扶正制品的特征可以为具有在特定流体中从90°起的特定自扶正时间。自扶正时间可通过以下来确定:将自扶正制品以90°放置在特定流体中,并允许自扶正制品返回至在不存在流体的情况下由该自扶正制品以其他方式维持的特定取向(例如,对应于制品的稳定平衡点(或取向)的取向)。
在某些实施方案中,流体是油。在一些这样的实施方案中,自扶正制品在油中从90°起的自扶正时间为小于或等于0.15秒、小于或等于0.1秒、小于或等于0.05秒、或者小于或等于0.02秒。在某些实施方案中,自扶正制品在油中从90°起的自扶正时间为大于或等于0.01秒、大于或等于0.02秒、大于或等于0.05秒、大于或等于0.1秒、或者大于或等于0.12秒。也可以是上述范围的组合(例如,小于或等于0.15秒且大于或等于0.01秒)。也可以是其他范围。在系统/制品被完全浸没的情况下确定其在油中的自扶正时间。
在一些实施方案中,流体是胃液。在一些这样的实施方案中,自扶正制品在胃液中从90°起的自扶正时间为小于或等于0.06秒、小于或等于0.05秒、小于或等于0.04秒、小于或等于0.03秒、或者小于或等于0.02秒。在某些实施方案中,自扶正制品在胃液中从90°起的自扶正时间为大于或等于0.005秒、大于或等于0.01秒、大于或等于0.02秒、大于或等于0.03秒、大于或等于0.04秒、或者大于或等于0.05秒。也可以是上述范围的组合(例如,小于或等于0.06秒且大于或等于0.005秒)。也可以是其他范围。在系统/制品被完全浸没的情况下确定其在胃液中的自扶正时间。
在某些实施方案中,流体是黏液。在一些这样的实施方案中,自扶正制品在黏液中从90°起的自扶正时间为小于或等于0.05秒、小于或等于0.04秒、小于或等于0.03秒、或者小于或等于到0.02秒。在某些实施方案中,自扶正制品在黏液中从90°起的自扶正时间为大于或等于0.005秒、大于或等于0.01秒、大于或等于0.02秒、大于或等于0.03秒、大于或等于0.04秒、或者大于或等于0.045秒。也可以是上述范围的组合(例如,小于或等于0.05秒且大于或等于0.005秒)。也可以是其他范围。在系统/制品被完全浸没的情况下确定其在黏液中的自扶正时间。
在一些实施方案中,流体是水。在一些这样的实施方案中,自扶正制品在水中从90°起的自扶正时间为小于或等于0.05秒、小于或等于0.04秒、小于或等于0.03秒、或者小于或等于到0.02秒。在某些实施方案中,自扶正制品在水中从90°起的自扶正时间为大于或等于0.005秒、大于或等于0.01秒、大于或等于0.02秒、大于或等于0.03秒、大于或等于0.04秒、或者大于或等于0.045秒。也可以是上述范围的组合(例如,小于或等于0.05秒且大于或等于0.005秒)。也可以是其他范围。在系统/制品被完全浸没的情况下确定其在水中的自扶正时间。
在一些实施方案中,自扶正制品包含一个或更多个进出口(例如,以允许空气和/或流体流过自扶正制品)。在一些实施方案中,自扶正制品包含与自扶正制品的至少一部分(例如,第一部分、第二部分)相关联的一个或更多个(例如,两个或更多个、三个或更多个、四个或更多个)进出口。在一些这样的实施方案中,进出口可允许流体(例如,胃液)进入自扶正制品的至少一部分使得例如自致动组件和/或弹簧暴露于流体(例如,使得自致动组件和/或弹簧致动)。例如,再次参照图2,系统102包含与自扶正制品的至少一部分(例如,第一部分110)相关联的进出口190。在一些情况下,进出口190可与自致动组件120、支持材料160和/或弹簧125流体连通。在一些实施方案中,虽然进出口在本文中被描述为与自扶正制品的第一部分相关联,但是基于本说明书的教导,本领域普通技术人员将理解的是,一个或更多个进出口可与自扶正制品的第二部分相关联。
在某些实施方案中,自扶正制品不包含进出口。
在一些实施方案中,自扶正制品可具有特别大的截面尺寸。在一些实施方案中,自扶正制品的最大截面尺寸为小于或等于2.0cm、小于或等于1.8cm、小于或等于1.6cm、小于或等于1.4cm、小于或等于1.2cm、小于或等于1.1cm、小于或等于1cm、小于等于0.8cm、小于或等于0.6cm、小于或等于0.4cm、或者小于或等于0.2cm,包括小于2.0cm的任何尺寸(例如0.1cm、0.3cm、0.5cm……1.7cm等)。在某些实施方案中,自扶正制品的最大截面尺寸为大于或等于0.1cm、大于或等于0.2cm、大于或等于0.4cm、大于或等于0.6cm、大于或等于0.8cm、大于或等于1cm、大于或等于1.2cm、大于或等于1.4cm、大于或等于1.6cm、大于或等于1.8cm,包括大于0.1cm且小于或等于2.0cm的任何尺寸(例如0.3cm、0.5cm……1.7cm、1.9cm等)。也可以是上述范围的组合(例如,小于或等于2cm且大于或等于0.1cm,小于或等于1.1cm且大于或等于0.1cm)。也可以是其他范围。
在一些实施方案中,可将自扶正制品(例如,经口)施用于对象。在一些这样的实施方案中,自扶正制品可包含一种或更多种活性药物成分。在某些实施方案中,活性药物成分在对象内部的位置处(例如,在G.I.道内)释放。
在某些实施方案中,一个或更多个传感器可与自扶正制品相关联。例如,在一些情况下,一个或更多个传感器可用于确定自扶正制品的位置(例如,对象内部的位置)和/或触发与该自扶正制品相关联的一个或更多个组织接合组件的致动。合适的传感器的非限制性实例包括pH、气体、光、GPS、蓝牙(Bluetooth)、取向、接近度、热、流体以及其他传感器。
在一些情况下,第一部分和/或第二部分中的一个或更多个可以是磁性的。
在一个示例性实施方案中,自扶正制品是可摄入的。根据某些实施方案,可摄入的自扶正制品包含具有平均密度的第一部分,具有与第一部分的平均密度不同的平均密度的第二部分,以及用于携带摄入该制品的对象的内部释放的药剂的有效负荷部分。在某些实施方案中,自扶正制品包含至少第一部分,所述第一部分具有大于1g/cm
在某些实施方案中,制品具有几何中心,并且质心从几何中心偏移,使得经由穿过几何中心的轴悬挂的质心从几何中心横向偏移的制品由于绕轴的重力而受到0.09*10^-4Nm或更小的外部施加的扭矩。根据一些实施方案,自扶正制品配置成包封在000号或更小的胶囊中。在另一些实施方案中,自扶正制品未被包封。在某些实施方案中,自扶正制品包含与自扶正制品相关联的组织接合组件。一些示例性实施方案涉及与自扶正制品的组织衔接表面基本上垂直的轴,所述轴配置成在受到0.09*10^-4Nm或更小的外部施加的扭矩作用时维持与垂直方向成20度或更小的取向。根据一些实施方案,自扶正制品具有最稳定、势能最低的物理配置,并且在水中自与最稳定配置在任何取向偏移90度起的自扶正时间为小于或等于0.05秒。根据某些实施方案,自扶正制品具有小于或等于1%(例如,小于或等于0.5%,小于或等于0.1%)的阻塞率。
某些示例性实施方案涉及将药剂递送至对象内部的位置的方法。根据一些实施方案,所述方法包括向对象施用包含外壳和自扶正制品的胶囊,以及使所述自扶正制品在对象内部的位置处取向成使得所述组织接合组件刺穿对象内部的位置临近的组织。
组织锚定
在一些实施方案中,制品(例如,自扶正制品)可配置成锚定至对象内部的位置(例如,对象内部的位置处的组织)。如上所述,在一些实施方案中,自扶正制品可包含一个或更多个组织接合组件,所述组织接合组件包含一个或更多个锚定机构(例如,钩、黏膜黏附剂)。以下对钩进行更详细地描述。以下对黏膜黏附剂进行更详细地描述。在一个示例性实施方案中,在一些情况下,自扶正制品可具有与制品的组织衔接表面垂直的纵轴和至少一个与自扶正制品相关联的锚定机构,所述纵轴配置成在受到0.09*10^-4Nm或更小的外部施加的扭矩作用时维持与垂直方向成20度或更小的取向。在另一个示例性实施方案中,制品可包含与支持材料相关联(例如,用其至少部分地包封)的弹簧(例如,使得弹簧通过支持材料维持在至少5%压缩应变下的至少部分压缩的状态)和至少一个可操作地连接至弹簧的锚定机构。以下对弹簧和支持材料进行更详细地描述。也可以是另一些实施方案,其包含与自扶正制品和/或自致动组件相关联的至少一个锚定机构。
在一些实施方案中,锚定机构包含钩(例如,钩状针(hooked needle))。例如,如图5中所示,系统104包含第一部分110和第二部分115。在某些实施方案中,组织衔接表面150与第二部分115相关联。在一些情况下,系统104可包含组织接合组件130,其包含锚定机构135。在一些实施方案中,锚定机构135可以是钩。在某些实施方案中,锚定机构135可在系统104内内部设置并且在期望组的条件下(例如,在对象内部的特定位置处)被释放(例如,经由孔140)。在某些实施方案中,图5中未示出,钩135可设置在系统104的外表面上。
现在参照图6,在某些实施方案中,系统106包含与自致动组件120(例如,包含弹簧125和/或支持材料160)相关联的锚定机构135。在某些实施方案中,在暴露于流体(例如,胃液)之后和/或在特定组的条件(例如,胃肠道的生理条件,例如在胃中)下,自致动组件致动将锚定机构插入到位于对象内部的组织中。
在一些实施方案中,锚定机构(和/或包含锚定机构的制品)配置成保持在对象内部的位置处。例如,在一些实施方案中,锚定机构与对象内部的位置处的表面(例如,组织的表面)衔接,使得其保持在该位置。
有利地,包含本文中所述的一种或更多种锚定机构的系统可插入到对象内部的位置处的组织的表面,并且可在相对高的施加力和/或相对高的取向变化下(例如,通过由胃肠道施加的压缩力和/或在胃肠道内的高流速下)维持与组织的接触。在一些实施方案中,本文中所述的系统基本上不阻塞胃肠道内(例如幽门中)的口(orifice),例如,限制流动并导致更长的接触时间。在某些实施方案中,胃肠道壁的天然补给可允许本文中所述系统的期望的脱附(detachment)和/或排出,而无需外科手术和/或内镜取回(endoscopicretrieval)。
例如,在一些实施方案中,锚定机构可插入到对象内部的位置处的组织的表面中并在以下的系统取向变化下维持与组织的接触(例如,系统保持锚定):大于或等于1度、大于或等于2度、大于或等于5度、大于或等于10度、大于或等于15度、大于或等于20度、大于或等于25度、大于或等于30度、大于或等于45度、大于或等于60度、大于或等于75度、或者大于或等于85度。在某些实施方案中,系统可在以下的系统取向变化下保持锚定:小于或等于90度、小于或等于85度、小于或等于75度、小于或等于60度、小于或等于45度、小于或等于30度、小于或等于25度、小于或等于20度、小于或等于15度、小于或等于10度、小于或等于5度、或者小于或等于2度。也可以是上述范围的组合(例如,大于或等于1度且小于或等于90度,大于或等于1度且小于或等于45度,大于或等于2度且小于或等于30度)。也可以是其他范围。
在某些实施方案中,系统(例如,包含锚定机构)配置成在每个锚定机构法向施加力的以下法向保持力(retention force)下保持在对象内部的位置处:大于或等于0.002N、大于或等于0.004N、大于或等于0.006N、大于或等于0.008N、大于或等于0.01N、大于或等于0.012N、大于或等于0.014N、大于或等于0.016N、大于或等于至0.018N、大于或等于0.02N、大于或等于0.025N、大于或等于0.03N、大于或等于0.04N、大于或等于0.05N、大于或等于0.1N、大于或等于0.15N、大于或等于0.2N、大于或等于0.25N、大于或等于0.3N、大于或等于0.35N、大于或等于0.4N、大于或等于0.5N、大于或等于0.6N、大于或等于0.7N、大于或等于0.8N、或者大于或等于0.9N。在一些实施方案中,系统的每个锚定机构法向施加力的法向保持力为小于或等于1N、小于或等于0.9N、小于或等于0.8N、小于或等于0.7N、小于或等于0.6N、小于或等于0.5N、小于或等于0.4N、小于或等于0.35N、小于或等于0.3N、小于或等于0.25N、小于或等于0.2N、小于或等于0.15N、小于或等于0.1N、小于或等于0.05N、小于或等于0.04N、小于或等于0.03N、小于或等于0.025N、小于或等于0.02N、小于或等于0.018N、小于或等于0.016N、小于或等于0.014N、小于或等于0.012N、小于或等于0.01N、小于或等于0.008N、小于或等于0.006N、或者小于或等于0.004N。也可以是上述范围的组合(例如,大于或等于0.002N且小于或等于1N,大于或等于0.02N且小于或等于0.08N,大于或等于0.1N且小于或等于1N)。也可以是其他范围。本文中所述的法向保持力可通过以下来确定:将系统的锚定机构插入到组织(例如,离体猪胃)的表面中至至少0.9mm的穿透深度并随后在与组织表面正交的方向上拉动系统直至将系统从组织中逐出。逐出系统之前的最大力是法向保持力。
在一些实施方案中,系统(例如,包含锚定机构)配置成在每个锚定机构法向施加力的以下正交保持力下保持在对象内部的位置处:大于或等于0.002N、大于或等于0.004N、大于或等于0.006N、大于或等于0.008N、大于或等于0.01N、大于或等于0.012N、大于或等于0.014N、大于或等于0.016N、大于或等于0.018N、大于或等于0.02N、大于或等于0.025N、大于或等于0.03N、大于或等于0.04N、大于或等于0.05N、大于或等于0.1N、大于或等于0.15N、大于或等于0.2N、大于或等于0.25N、大于或等于0.3N、大于或等于0.35N、大于或等于0.4N、大于或等于0.5N、大于或等于0.6N、大于或等于0.7N、大于或等于0.8N、或者大于或等于0.9N。在一些实施方案中,系统的每个锚定机构法向施加力的法向保持力为小于或等于1N、小于或等于0.9N、小于或等于0.8N、小于或等于0.7N、小于或等于0.6N、小于或等于0.5N、小于或等于0.4N、小于或等于0.35N、小于或等于0.3N、小于或等于0.25N、小于或等于0.2N、小于或等于0.15N、小于或等于0.1N、小于或等于0.05N、小于或等于0.04N、小于或等于0.03N、小于或等于0.025N、小于或等于0.02N、小于或等于0.018N、小于或等于0.016N、小于或等于0.014N、小于或等于0.012N、小于或等于0.01N、小于或等于0.008N、小于或等于0.006N、或者小于或等于0.004N。也可以是上述范围的组合(例如,大于或等于0.002N且小于或等于1N,大于或等于0.02N且小于或等于0.08N,大于或等于0.1N且小于或等于1N)。也可以是其他范围。本文中所述的正交保持力可通过以下来确定:将系统的锚定机构插入到组织(例如,离体猪胃)的表面中至至少0.9mm的穿透深度并随后在与组织表面平行的方向上向系统施加力(参见例如,图59)直至将系统从组织中逐出。逐出系统之前的最大力是正交保持力。
在一些实施方案中,系统配置成在小于或等于30度的取向变化和小于或等于1N的施加(例如,法向、正交)力下保持锚定至位于对象内部的组织的表面。
在一些实施方案中,系统包含两个或更多个锚定机构。在一些情况下,该系统可包含具有两个或更多个锚定机构的单个自扶正制品。在某些实施方案中,该系统包含两个或更多个自扶正制品,每个均包含一个或更多个锚定机构。在某些实施方案中,可通过增大与系统相关联的锚定机构的数量来增大移出锚定机构所需的力(例如,法向保持力、正交保持力)。不希望受到理论的束缚,锚定机构之间的间距可与系统的保持力(例如,法向保持力、正交保持力)有关。
在一些实施方案中,系统在锚定机构之间的平均间距可以为大于或等于0.1mm、大于或等于0.2mm、大于或等于0.3mm、大于或等于0.4mm、大于或等于0.5mm、大于或等于0.6mm、大于或等于0.7mm、大于或等于0.8mm、大于或等于0.9mm、大于或等于1mm、大于或等于1.2mm、大于或等于1.4mm、大于或等于1.5mm、大于或等于1.6mm、大于或等于1.8mm、或者大于或等于2mm。在某些实施方案中,系统在锚定机构之间的平均间距可以为小于或等于2.5mm、小于或等于2mm、小于或等于1.8mm、小于或等于1.6mm、小于或等于1.4mm、小于或等于1.2mm、小于或等于1mm、小于或等于0.9mm、小于或等于0.8mm、小于或等于0.7mm、小于或等于0.6mm、小于或等于0.5mm、小于或等于0.4mm、小于或等于0.3mm、或者小于或等于0.2mm。也可以是上述范围的组合(例如,大于或等于0.1mm且小于或等于2.5mm,大于或等于1mm且小于或等于1.5mm)。也可以是其他范围。
锚定机构可具有任何合适的尺寸和/或形状。例如,在一些实施方案中,包含锚定机构的组织接合组件的最大尺寸(例如,长度)可以为小于或等于1cm、小于或等于0.8cm、小于或等于0.6cm、小于或等于0.5cm、小于或等于0.4cm、小于或等于0.3cm、小于或等于0.25cm、小于或等于0.23cm、或者小于或等于0.2cm。在某些实施方案中,包含锚定机构的组织接合组件的最大尺寸(例如,长度)可以为大于或等于0.15cm、大于或等于0.2cm、大于或等于0.23cm、大于或等于0.25cm、大于或等于0.3cm、大于或等于0.4cm、大于或等于0.5cm、大于或等于0.6cm、或者大于或等于0.8cm。也可以是上述范围的组合(例如,大于或等于0.2cm且小于或等于1cm,大于或等于0.15cm且小于或等于1cm)。也可以是其他范围。
在一些实施方案中,锚定机构具有特定的锚定长度。作为实例,对于包含钩的锚定机构,锚定长度对应于钩的弯曲长度的最大截面尺寸(例如,钩的直径,不包含任何未弯曲部分)。在某些实施方案中,锚定长度大于或等于10微米、大于或等于20微米、大于或等于23微米、大于或等于25微米、大于或等于30微米、大于或等于34微米、大于或等于35微米、大于或等于40微米、大于或等于50微米、大于或等于60微米、大于或等于70微米、大于或等于至80微米、大于或等于90微米、大于或等于100微米、大于或等于120微米、大于或等于140微米、大于或等于160微米、大于或等于180微米、大于或等于200微米、或者大于或等于225微米。在某些实施方案中,锚定长度小于或等于250微米、小于或等于225微米、小于或等于200微米、小于或等于180微米、小于或等于160微米、小于或等于140微米、小于或等于120微米、小于或等于100微米、小于或等于90微米、小于或等于80微米、小于或等于70微米、小于或等于60微米、小于或等于50微米、小于或等于40微米、小于或等于30微米、或者小于或等于20微米。也可以是上述范围的组合(例如,大于或等于10微米并且小于或等于250微米)。也可以是其他范围。
在一些情况下,锚定机构可配置成具有最佳穿透深度(例如,锚定机构设置在位于对象内部的组织的表面下方的深度)。在一些实施方案中,锚定机构的穿透深度大于或等于0.5mm、大于或等于0.6mm、大于或等于0.7mm、大于或等于0.8mm、大于或等于0.9mm、大于或等于1mm、大于或等于1.2mm、大于或等于1.4mm、大于或等于1.5mm、大于或等于1.7mm、大于或等于1.9mm、大于或等于2mm、大于或等于2.2mm、大于或等于2.4mm、大于或等于2.5mm、大于或等于3mm、大于或等于3.5mm、大于或等于4mm、大于或等于4.5mm、或者大于或等于5mm。在某些实施方案中,锚定机构的穿透深度小于或等于6mm、小于或等于5mm、小于或等于4.5mm、小于或等于4mm、小于或等于3.5mm、小于或等于3mm、小于或等于2.5mm、小于或等于2.4mm、小于或等于2.2mm、小于或等于2mm、小于或等于1.9mm、小于或等于1.7mm、小于或等于1.5mm、小于或等于1.4mm、小于或等于1.2mm、小于或等于1mm、小于或等于0.9mm、小于或等于0.8mm、小于或等于0.7mm、或者小于或等于0.6mm。也可以是上述范围的组合(例如,大于或等于0.5mm且小于或等于6mm,大于或等于0.9mm且小于或等于2.5mm)。也可以是其他范围。不希望受到理论的束缚,组织的位移可大于或等于锚定机构的穿透深度。仅作为示例,并且在一个特定的实施方案组中,锚定机构可使组织移位多至14mm以实现例如多至4mm的穿透深度。
有利地,包含本文中所述的锚定机构的系统可在生理条件和流体流动(例如,暴露于以约0.1m/s流动的流体)下保持相对长的时间段。例如,在一些实施方案中,包含锚定机构的系统在位于对象内部的组织的表面处保持大于或等于1小时、大于或等于2小时、大于或等于4小时、大于或等于8小时、大于或等于12小时、大于或等于24小时、大于或等于2天、大于或等于3天、大于或等于5天、大于或等于7天、或者大于或等于10天。在某些实施方案中、系统保持小于或等于14天、小于或等于10天、小于或等于7天、小于或等于5天、小于或等于3天、小于或等于2天、小于或等于24小时、小于或等于12小时、小于或等于8小时、小于或等于4小时、或者小于或等于2小时。也可以是上述范围的组合(例如,大于或等于1小时且小于或等于14天)。也可以是其他范围。在一些情况下,锚定机构可配置成在生理条件和流体流动下保持相对非常长的时间段。例如,在某些实施方案中,锚定机构可在位于对象内部的组织的表面处保持大于或等于1个月、大于或等于2个月、大于或等于3个月、大于或等于6个月、或者大于或等于1年。在一些实施方案中,锚定机构可在位于对象内部的组织的表面处保持小于或等于2年、小于或等于1年、小于或等于6个月、小于或等于3个月、或者小于或等于2个月。也可以是上述范围的组合(例如,大于或等于1小时且小于或等于2年,大于或等于1个月且小于或等于2年)。也可以是其他范围。
本文中所述的锚定机构可包含任何合适的材料。在一些实施方案中,锚定机构材料是相对不可降解的。在某些实施方案中,锚定机构可配置成在一定时间段内降解。在一些实施方案中,锚定机构配置成在保持的情况下在一个或更多个上述时间范围内降解。例如,在一些实施方案中,锚定机构配置成在以下时间内降解(例如,使得系统不再保留在对象内部的位置处):大于或等于1小时、大于或等于2小时、大于或等于4小时、大于或等于8小时、大于或等于12小时、大于或等于24小时、大于或等于2天、大于或等于3天、大于或等于5天、大于或等于7天、或者大于或等于10天。在某些实施方案中,锚定机构配置成在以下时间内降解:小于或等于14天、小于或等于10天、小于或等于7天、小于或等于5天、小于或等于3天、小于或等于2天、小于或等于24小时、小于或等于12小时、小于或等于8小时、小于或等于4小时、或者小于或等于2小时。也可以是上述范围的组合(例如,大于或等于1小时且小于或等于14天)。也可以是其他范围。在一些情况下,锚定机构可配置成在以下时间内降解(例如,使得系统不再保留在对象内部的位置处):大于或等于1个月、大于或等于2个月、大于或等于3个月、大于或等于6个月、或者大于或等于1年。在一些实施方案中,锚定机构可在以下时间内降解:小于或等于2年、小于或等于1年、小于或等于6个月、小于或等于3个月、或者小于或等于2个月。也可以是上述范围的组合(例如,大于或等于1小时且小于或等于2年,大于或等于1个月且小于或等于2年)。也可以是其他范围。
在一些情况下,锚定机构可包含导电材料,如下所述。
电刺激
在一些实施方案中,本文中所述的系统、制品和方法可用于在对象内部的位置处提供电刺激。有利地,与包括例如内镜放置和/或电装置安装的传统方法相比,本文中所述的系统可经口(例如,在胶囊中)施用以向胃肠道提供暂时电刺激。在一些实施方案中,系统包含一个或更多个锚定机构,其中至少一个锚定机构包含导电部分(例如,用于与对象内部的位置处的组织电连通)。这样的系统可用于例如离子透入(iontophoresis)(例如,在施加局部电流期间将API引入到对象内部的组织中)。在其中本文中所述的系统配置成用于离子透入的某些实施方案中,该系统可包含第一组织接合组件(例如,包含在第一自扶正制品内),其包含导电尖端;以及第二组织接合组件(例如,包含在第二自扶正制品内),其配置成接触但不穿透组织(例如,钝圆柱体)。在一些实施方案中,一个或更多个电极可与第一和/或第二组织接合组件电连通。
在一些实施方案中,系统(例如,自扶正系统)包含两个或更多个组织接合组件。在某些实施方案中,每个组织接合组件包含配置成接触组织的组织接触部分。在一些情况下,组织接触部分可以是导电的。在某些实施方案中,组织接触部分可以是电绝缘的。
在一些实施方案中,组织接触部分包含第一导电部分和第二绝缘部分。在一些这样的实施方案中,导电部分可配置成与组织电连通,并且绝缘部分可配置成不与组织电连通。
不希望受到理论的束缚,在一些实施方案中,绝缘部分的长度可配置成防止与某些组织层电连通(例如,对于胃的肌肉刺激,长度可对应于外部肌肉层(例如,2至4mm),对于SI黏膜,长度可以为例如0.1至1mm。在一些情况下,绝缘部分可配置成使得组织的胃肠液和/或黏液涂层不接触导电部分(例如,不希望受到理论的束缚,胃肠液和黏液涂层通常是导电的,并因此在一些情况下可防止电刺激到达下面的组织)。
组织接触部分可包含导电部分与绝缘部分的任何合适比例。例如,在一些实施方案中,导电部分以组织接合组件的组织接触部分的总表面积的以下百分比的量存在于组织接触部分中:大于或等于0.1%、大于或等于0.5%、大于或等于1%、大于或等于2%、大于或等于5%、大于或等于10%、大于等于20%、大于等于30%、大于等于40%、大于等于50%、大于等于60%、大于或等于70%、大于或等于80%、或者大于或等于90%。在某些实施方案中,导电部分以组织接合组件的组织接触部分的总表面积的以下百分比的量存在于组织接触部分中:小于或等于100%、小于等于90%、小于或等于80%、小于或等于70%、小于或等于60%、小于或等于50%、小于或等于40%、小于或等于30%、小于或等于20%、小于或等于10%、小于或等于5%、小于或等于2%、小于或等于1%、或者小于或等于0.5%。也可以是上述范围的组合(例如,大于或等于0.1%且小于或等于100%,大于或等于10%且小于或等于100%,大于或等于30%且小于或等于90%)。也可以是其他范围。在一些实施方案中,组织接触部分的尖端是导电的,并且组织接触部分的其余部分是绝缘的。
在某些实施方案中,绝缘部分以组织接合组件的组织接触部分的总表面积的以下百分比的量存在于组织接触部分中:大于或等于10%、大于等于20%、大于等于30%、大于等于40%、大于等于50%、大于等于60%、大于或等于70%、大于或等于80%、或者大于或等于90%。在某些实施方案中,绝缘部分以组织接合组件的组织接触部分的总表面积的以下百分比的量存在于组织接触部分中:小于或等于100%、小于等于90%、小于或等于80%、小于或等于70%、小于或等于60%、小于或等于50%、小于或等于40%、小于或等于30%、或者小于或等于20%。也可以是上述范围的组合(例如,大于或等于10%小于或等于100%,大于或等于30%且小于或等于90%)。也可以是其他范围。
在一些实施方案中,系统包含如本文中所述的自扶正制品和至少一个组织接合组件,每个组织接合组件包含组织接触部分,该组织接触部分配置成接触与每个组织接合组件相关联的组织。在某些实施方案中,系统包含两个或更多个本文中所述的自扶正制品,每个自扶正制品包含至少一个组织接合组件,每个组织接合组件包含配置成接触组织的组织接触部分。例如,在一个示例性实施方案组中,可将单个自扶正制品施用于对象,该自扶正制品包含两个或更多个组织接合组件,其中电源可放置成与所述两个或更多个组织接合组件电连通,使得可将电流施加至与组织接合组件的组织接触部分直接接触的组织。在另一个示例性实施方案组中,可将两个(或更多个)自扶正制品施用于对象,每个自扶正制品包含至少一个组织接合组件,其中电源可放置成与自扶正制品电连通,使得可将电流施加至与来自每个自扶正制品的每个组织接合组件的组织接触部分直接接触的组织。也可以是其他组合。本领域普通技术人员将理解如何基于本说明书的教导来选择自扶正制品、组织接合组件与组织接触部分的组合。
如本文中所述,在一些实施方案中,可将包含自扶正制品和/或自致动制品的系统施用于对象,其中该系统包含设置在制品(例如,自撰写制品和/或自致动制品)内的至少一个组织接合组件。可施用该系统使得至少一个接合组件从制品释放和/或插入到对象内部的位置处的组织中。在某些实施方案中,可施加电流(例如,通过与组织接合组件知识性连通的电源产生的)使得电流流过两个或更多个组织接合组件。在一些这样的实施方案中,组织接合组件不与组织电连通。
导电部分可包含任何适当导电材料。合适的电子导电材料的非限制性实例包括导电聚合物、银、铜、金、不锈钢、铂、锌和钢。也可以是其他导电材料。
绝缘部分可包含任何适当电绝缘材料。合适的绝缘材料的非限制性实例包括聚合物,例如聚对二甲苯、聚己内酯和聚乙烯。也可以是其他绝缘材料。
在一些情况下,可将导电材料和/或绝缘材料作为涂层提供在组织接合组件上。在某些实施方案中,组织接触部分可包含块状材料(bulk material),该块状材料包含导电和/或绝缘材料。
在一些实施方案中,施加(例如,跨过组织接触部分,用于电刺激组织)的电流可大于或等于0.001毫安、大于或等于0.01毫安、大于或等于0.1毫安、大于或等于0.5毫安、大于或等于1毫安、大于或等于5毫安、大于或等于10毫安、大于或等于50毫安、大于或等于100毫安、或者大于或等于250毫安。在某些实施方案中,施加的电流可小于或等于500毫安、小于或等于250毫安、小于或等于100毫安、小于或等于50毫安、小于或等于10毫安、小于或等于5毫安、小于或等于1毫安、小于或等于0.5毫安、小于或等于0.1毫安、或者小于或等于0.01毫安。也可以是上述范围的组合(例如,大于或等于0.001毫安且小于或等于500毫安,大于或等于0.1毫安且小于或等于10毫安)。也可以是其他范围。电流可使用任何合适的方式包括例如外部电源(例如,电池)来施加。
在某些实施方案中,如上所述,系统配置成在大于或等于0.1N(例如,大于或等于0.6N)的力和/或者大于或等于30度的取向变化的情况下保持在对象内部的位置处。
自致动
一般地提供了自致动制品,其包含例如,自致动组织接合组件例如自致动针、自致动锚定机构和/或自致动活检凿。有利地,在一些实施方案中,本文中所述的自致动制品可用作用于递送多种药用药物的通用平台,所述药用药物由于在GI道中的降解而通常通过直接注射到组织中来递送。本文中所述的自致动制品还可用于将本文中所述的传感器、电刺激、锚定系统递送至组织,和/或进行活检,而无需内镜检查。在一些实施方案中,制品包含弹簧(例如,螺旋弹簧(coil spring)、波形弹簧、贝勒维尔垫圈(Belleville washer)、梁(beam)、膜、具有特定机械回复(mechanical recovery)特征的材料)。本领域普通技术人员将理解的是,术语弹簧不旨在限于螺旋弹簧,而是一般地涵盖任何可逆压缩材料和/或组件,在释放在所述材料/组件上施加的压缩力之后,所述材料/组件在环境条件下基本上恢复至所述材料/组件的未经压缩长度(例如,在压缩之前所述材料/组件的长度的40%之内、50%之内、60%之内、70%之内、80%之内、90%之内、95%之内或在中间的任何百分比)。
在某些实施方案中,术语自致动制品的弹簧可被提供为或进一步包含膨胀组件(expanding component)。本领域普通技术人员将理解的是,术语延伸组件(extendingcomponent)包含可逆和不可逆的压缩材料并且是在刺激和/或释放对膨胀组件的约束之后,膨胀组件在至少一个方向上(例如,沿其长度)延伸的组件。在一些实施方案中,膨胀组件包含用于膨胀气态容积膨胀组件的气态组合物(例如,小苏打与醋的混合物)。
在一些实施方案中,弹簧和/或膨胀组件可经由热膨胀、溶胀(例如,由于流体吸收)、气体驱动过程、气动过程、液压过程、电动机、磁性机构、扭转弹簧机构、化学气体发生器、和/或自催化反应。在一个示例性实施方案组中,当弹簧和/或膨胀组件暴露于流体(例如,胃肠液)之后,弹簧和/或膨胀组件可在至少一个方向上延伸。
在一些情况下,弹簧和/或膨胀组件可通过任何合适的激活机制来激活(例如,在至少一个方向上延伸,返回到组件的未经压缩长度)。合适的激活机制的非限制性实例包括释放压力差、电定时器、光传感器、颜色传感器、酶传感器、电容、磁、通过施加的应力(applied stress)激活(例如形状记忆材料)、外部激活(例如施加的磁场、施加的光、与胃肠液例如胃酸的反应)、及其组合。在一个示例性实施方案组中,弹簧和/或膨胀组件通过与胃肠液的相互作用(例如,反应)激活。
在一些情况下,激活机制将组织接合组件移位特定距离(例如,小于或等于10mm、小于或等于8mm、小于或等于6mm、小于或等于4mm、小于或等于2mm)和/或以特定力(例如,大于或等于0.1N、大于或等于0.3N、大于或等于0.5N、大于或等于1N、大于或等于1.5N)将组织接合组件移位。
如图21中所示,在一些实施方案中,制品100包含弹簧110和与弹簧110相关联(例如,与其可操作地连接)的支持材料120。在某些实施方案中,支持材料120在第一组条件下(例如,在环境条件(例如,室温、大气压力和相对湿度)下)将弹簧维持在压缩应变下。在一些实施方案中,在与第一组条件不同的第二组条件下,支持材料将弹簧至少部分地从压缩应变释放(例如,支持材料的至少一部分降解)。例如,在一些实施方案中,第二组条件包含生理条件(例如,在37℃或约37℃下,在生理流体例如胃液中)。
在一些情况下,弹簧110可与支持材料120相邻(例如,直接相邻)。如本文中使用的,当组件被称为与另一组件“相邻”时,它可与该组件直接相邻(例如,与其接触),或者也可存在一个或更多个居间组件。与另一组件“直接相邻”的组件意指不存在居间组件。在一些情况下,弹簧可至少部分地嵌入在支持材料内。在某些实施方案中,弹簧涂覆有支持材料。
在某些实施方案中,再次参照图21,制品100包含外壳170(例如,使得弹簧110至少部分地包封在外壳170内)。在一些情况下,支持材料可以是涂层。在一些实施方案中,支持材料是可生物降解的涂层。在某些实施方案中,涂层可具有任何合适的厚度。例如,涂层的厚度可以为大于或等于3mm、大于或等于4mm、或者大于或等于5mm。在某些实施方案中,涂层的厚度可以为小于或等于6mm、小于或等于5mm、或者小于或等于4mm。也可以是上述范围的组合(例如,大于或等于3mm且小于或等于6mm)。在某些实施方案中,可生物降解的涂层在生理条件下至少部分降解。在一些情况下,支持材料可以是脆性材料。合适的支持材料的非限制性实例包括糖和/或聚合物(例如,聚乙二醇、聚乙烯吡咯烷酮、聚乙烯醇)。
支持材料可具有任何合适的截面尺寸。在一些实施方案中,支持材料的平均截面尺寸为大于或等于0.1mm、大于或等于0.5mm、大于或等于1mm、大于或等于2mm、大于或等于3mm、大于或等于4mm、或者大于或等于5mm。在某些实施方案中,支持材料的平均截面尺寸为小于或等于10mm、小于或等于6mm、小于或等于5mm、小于或等于4mm、小于或等于3mm、小于或等于2mm、小于或等于1mm、或者小于或等于0.5mm。也可以是上述范围的组合(例如,大于或等于0.1mm且小于或等于10mm)。也可以是其他范围。
在一些实施方案中,支持材料、弹簧和/或膨胀组件包含一种或更多种材料,所述材料配置成溶解(例如,在酸性环境中、在pH中性环境、在水中、在碱性环境中)、在生理温度(例如,37℃)下熔化、刚度变化(例如,响应于温度变化、响应于流体吸收)、热膨胀、和/或形状变化(例如,响应于流体吸收、通过放气、通过泄漏)。
有利地,用于支持材料的配置和/或材料可允许调谐支持材料的溶解。在一些情况下,可调谐支持材料的溶解使得组织接合组件在期望的位置和/或期望的时间从制品释放。
支持材料可包含任何合适的材料。合适材料的非限制性实例包括糖及其衍生物(例如,糖醇(例如异麦芽酮糖醇)、糖混合物(例如太妃糖))、淀粉、碳酸钙、锌、氯化钠、和/或聚合物(例如,聚乙二醇、聚乙烯吡咯烷酮、聚乙烯醇、聚环氧乙烷、焦碳酸二乙酯、水凝胶)。也可以是其他材料。不希望受到理论的束缚,可将支持材料选择为相对脆性的(例如,使得弹簧在支持材料溶解之后被释放)。
在某些实施方案中,可将支持材料配置成具有提供期望的溶解曲线的特定结构。例如,在一些实施方案中,支持材料可配置成增强溶解曲线,具有受控的失效模式(例如,在相对可预测的位置处破裂成小块),和/或提供支持材料的结构完整性。
在一些实施方案中,支持材料具有期望的机械特性(例如,使得弹簧相对迅速地恢复其未经压缩长度的至少一部分)。例如,在某些实施方案中,支持材料的临界应力可以为大于或等于0.01N、大于或等于0.1N、大于或等于0.5N、大于或等于1N、大于或等于2N、大于或等于3N、大于或等于5N、大于或等于7N、大于或等于10N、大于或等于15N、大于或等于20N、大于或等于25N、大于或等于30N、大于或等于35N、大于或等于40N、大于或等于45N、大于或等于50N、或者大于或等于60N,包括在之间的任何临界应力值。在某些实施方案中,支持材料的临界应力可以为小于或等于70N、小于或等于60N、小于或等于50N、小于或等于45N、小于或等于40N、小于或等于35N、小于或等于30N、小于或等于25N、小于或等于20N、小于或等于15N、小于或等于10N、小于或等于7N、小于或等于5N、小于或等于3N、小于或等于2N、小于或等于1N、小于或等于0.5N、或者小于或等于0.1N,包括在之间的任何临界应力值。也可以是上述范围的组合(例如,大于或等于10N且小于或等于70N,大于或等于30N且小于或等于45N)。也可以是其他范围。临界应力通常是支持材料在破裂之前可承受的最大力(例如,由相邻弹簧施加的力),并且可通过计算临界应力来确定,其中:
其中σ
弹簧
在一些实施方案中,在第一组条件下,支持材料将弹簧的至少一部分维持在至少5%、至少10%、至少15%、至少20%、至少25%、至少30%、至少40%、至少50%、至少60%、至少70%、或至少80%的压缩应变下。在某些实施方案中,在第一组条件下,支持材料将弹簧的至少一部分维持在小于或等于90%、小于或等于80%、小于或等于70%、小于或等于60%、小于或等于50%、小于或等于40%、小于或等于30%、小于或等于25%、小于或等于20%、小于或等于15%、或者小于或等于10%的压缩应变下。
在某些实施方案中,在施加压缩应变之前和/或在不存在压缩应变的情况下(例如,通过支持材料),弹簧(例如,在少于10分钟、少于5分钟、少于1分钟、少于30秒、少于10秒、少于5秒、少于1秒、少于0.1秒、小于0.01秒内)恢复到的长度大于或等于10%、大于或等于20%、大于或等于30%、大于或等于40%、大于或等于50%、大于或等于60%、大于或等于70%、大于或等于80%、大于或等于85%、大于或等于90%、大于或等于95%、大于或等于98%、或者大于或等于99%的弹簧长度(例如,未经压缩的弹簧长度),包括10%和99%之间的任何百分比。在一些实施方案中,在施加压缩应变之前和/或在不存在压缩应变的情况下,弹簧恢复到的长度小于或等于100%、小于或等于99%、小于或等于98%、小于或等于95%、小于或等于90%、小于或等于85%、小于或等于80%、小于或等于75%、小于或等于70%、小于或等于60%、小于或等于50%、小于或等于40%、小于或等于30%、或者小于或等于20%的弹簧长度,包括20%和100%之间的任何百分比。有利地,如本文中所述的弹簧和支持材料的使用可实现例如释放与弹簧相关联(例如,与其可操作地连接)的组织接合组件(例如,针),使得组织接合组件接触和/或穿透临近制品的组织。在举例说明性实例中,在一些实施方案中,将与弹簧相关联的针施用于对象使得在支持材料降解之后,弹簧恢复并将针推入到临近制品的组织中以便针穿透组织(例如,GI道黏膜层)。在一些这样的实施方案中,可通过组织接合组件将活性药物成分递送到组织中。例如,在一些实施方案中,制品包含活性药物成分使得在对象内部的位置处释放弹簧之后,活性药物成分被释放(例如,释放到对象内部的位置临近的组织中)。在另一些实施方案中,在由支持材料释放弹簧之后,可进行活检(例如,通过组织接合组件例如活检装置)。再次参照图21,在一些实施方案中,制品100包含与弹簧110相关联的组织接合组件115。在本文中对组织接合组件(例如,针、钩、高API负载的组件)进行更详细地描述。
在某些实施方案中,组织接合组件包含针、针(例如,微针)的阵列或贴片、活检组件、钩、黏膜黏附贴片、或其组合。
在一些实施方案中,弹簧包含弹性材料。在某些实施方案中,弹簧包含选自镍钛诺(nitinol)、金属、聚合物、及其组合的材料。
在某些实施方案中,弹簧可具有特定的弹簧常数。例如,在一些实施方案中,弹簧的弹簧常数可以为大于或等于100N/m、大于或等于150N/m、大于或等于200N/m、大于或等于250N/m、大于或等于300N/m、大于或等于350N/m、大于或等于400N/m、大于或等于450N/m、大于或等于500N/m、大于或等于600N/m、大于或等于700N/m、大于或等于800N/m、大于或等于900N/m、大于或等于1000N/m、大于或等于1100N/m、大于或等于1200N/m、大于或等于1300N/m、或者大于或等于1400N/m、小于或等于1500N/m、小于或等于1800N/m、或者大于或等于2000N/m,并且包括在这些值之间的任何弹簧常数。在某些实施方案中,弹簧的弹簧常数可以为小于或等于2200N/m、小于或等于2000N/m、小于或等于1800N/m、小于或等于1500N/m、小于或等于1400N/m、小于或等于1300N/m、小于或等于1200N/m、小于或等于1100N/m、小于或等于1000N/m、小于或等于900N/m、小于或等于800N/m、小于或等于700N/m、小于或等于600N/m、小于或等于500N/m、小于或等于450N/m、小于或等于400N/m、小于或等于350N/m、小于或等于300N/m、小于或等于250N/m、小于或等于200N/m、或者小于或等于150N/m,包括在这些值之间的任何弹簧常数。也可以是上述范围的组合(例如,大于或等于100N/m且小于或等于500N/m,大于或等于100N/m且小于或等于1500N/m)。也可以是其他范围。
在一些实施方案中,与弹簧的未经压缩长度相比,弹簧沿弹簧的纵轴被压缩了(例如,通过支持材料)大于或等于1mm、大于或等于2mm、大于或等于3mm、大于或等于4mm、大于或等于5mm、大于或等于6mm、大于或等于7mm、大于或等于8mm、大于或等于9mm、大于或等于10mm、大于或等于12mm、或者大于或等于15mm。在某些实施方案中,与弹簧的未经压缩长度相比,弹簧被沿弹簧的纵轴压缩了小于或等于20mm、小于或等于15mm、小于或等于12mm、小于或等于10mm、小于或等于9mm、小于或等于8mm、小于或等于7mm、小于或等于6mm、小于或等于5mm、小于或等于4mm、小于或等于3mm、或者小于或等于2mm。也可以是上述范围的组合(例如,大于或等于1mm且小于或等于5mm,大于或等于5mm且小于或等于10mm)。也可以是其他范围。
在某些实施方案中,弹簧配置成释放弹簧的期望量的储存压缩能(例如,在支持材料暴露于流体例如胃肠液之后)。例如,弹簧和/或支持材料可暴露于流体,并且在支持材料的至少部分溶解之后,弹簧至少部分地释放储存压缩能,例如以使可操作地连接至弹簧的组织接合组件移位(例如,以将其释放到位于对象内部的组织中)。例如,在一些实施方案中,弹簧配置成释放弹簧的至少10%、至少20%、至少30%、至少40%、至少50%、至少60%、至少70%、或至少80%的储存压缩能,包括在这些值之间的任何百分比。在某些实施方案中,弹簧配置成释放弹簧的至少90%的储存压缩能、弹簧的至少92%的储存压缩能、弹簧的至少94%的储存压缩能、弹簧的至少96%的储存压缩能、弹簧的至少98%的储存压缩能、或弹簧的至少99%的储存压缩能(例如,在支持材料暴露于流体例如胃肠液之后),包括在这些值之间的任何百分比。在某些实施方案中,弹簧配置成释放弹簧的小于或等于100%的储存压缩能、弹簧的小于99%的储存压缩能、弹簧的小于98%的储存压缩能、弹簧的小于96%的储存压缩能、弹簧的小于94%的储存压缩能、弹簧的小于92%的储存压缩能、或弹簧的小于91%的储存压缩能。在一些实施方案中,弹簧配置成释放弹簧的小于或等于90%、小于或等于80%、小于或等于70%、小于或等于60%、小于或等于50%、小于或等于40%、小于或等于30%、或者小于或等于20%的储存压缩能(例如,在支持材料暴露于流体例如胃肠液之后),包括这些值之间的任何百分比。也可以是上述范围的组合(例如,弹簧的至少92%且小于98%的储存压缩能、弹簧的至少94%且小于96%的储存压缩能、弹簧的至少10%且小于或等于99%的储存压缩能)。也可以是其他范围。
在一些实施方案中,弹簧配置成在支持材料暴露于流体和/或支持材料机械失效(例如,破裂、断裂)的任何合适时间内释放弹簧的储存压缩能。例如,在一些实施方案中,弹簧配置成在支持材料机械失效的小于5毫秒、小于4毫秒、小于3毫秒、小于2毫秒、小于1毫秒、小于0.5毫秒、或小于0.2毫秒的时间内释放弹簧的储存压缩能(例如,至少10%的储存压缩能)。在某些实施方案中,弹簧配置成在支持材料机械失效的大于0.1毫秒、大于0.2毫秒、大于0.5毫秒、大于1毫秒、大于2毫秒、大于3毫秒、或大于4毫秒的时间内释放弹簧的储存压缩能。也可以是上述范围的组合(例如,小于5毫秒且大于1毫秒的时间内,小于2毫秒且大于0.1毫秒的时间内)。也可以是其他范围。
在某些实施方案中,弹簧配置成在支持材料暴露于流体的小于10分钟、小于9分钟、小于7分钟、小于5分钟、小于3分钟、或小于1分钟的时间内释放如本文中所述的弹簧的储存压缩能(例如,至少10%的储存压缩能),包括在这些值之间的任何时间。在一些实施方案中,弹簧配置成在大于30秒、大于1分钟、大于3分钟、大于5分钟、大于7分钟、或大于9分钟的时间内释放弹簧的储存压缩能,包括在这些值之间的任何时间。上述范围的组合(例如,小于10分钟且大于30秒的时间内,小于7分钟且大于5分钟的时间内)。也可以是其他范围。
也可以是上述范围的任何组合。例如,在某些实施方案中,弹簧配置成在支持材料暴露于流体的10分钟内释放至少10%(例如,至少90%)的弹簧的储存压缩能。在某些实施方案中,弹簧配置成在支持材料暴露于流体的30秒内释放弹簧的至少10%(例如,至少90%)的储存压缩能。在一些实施方案中,弹簧配置成在支持材料暴露于流体的10分钟内释放弹簧的小于或等于100%的储存压缩能。在某些实施方案中,弹簧配置成在支持材料暴露于流体的30秒内释放弹簧的小于或等于100%的储存压缩能。
在某些实施方案中,弹簧配置成在支持材料机械失效的5毫秒内释放弹簧的至少10%(例如,至少90%)的储存压缩能。在某些实施方案中,弹簧配置成在支持材料机械失效的0.1毫秒内释放弹簧的至少10%(例如,至少90%)的储存压缩能。在一些实施方案中,弹簧配置成在支持材料机械失效的5毫秒内释放弹簧的小于或等于100%的储存压缩能。在某些实施方案中,弹簧配置成在支持材料机械失效的0.1毫秒内释放弹簧的小于或等于100%的储存压缩能。
弹簧可具有任何合适的截面尺寸。在一些实施方案中,(未经压缩的)弹簧的最大截面尺寸大于或等于1mm、大于或等于2mm、大于或等于3mm、大于或等于4mm、或者大于或等于5mm。在某些实施方案中,(未经压缩的)弹簧的最大截面尺寸小于或等于10mm、小于或等于6mm、小于或等于5mm、小于或等于4mm、小于或等于3mm、或者小于或等于2mm。也可以是上述范围的组合(例如,大于或等于1mm且小于或等于10mm)。也可以是其他范围。
在一些实施方案中,将制品施用于对象(例如,经口)。在某些实施方案中,制品可经口、经直肠、经阴道、经鼻或经尿道施用。在某些实施方案中,在到达对象内部的位置(例如,胃肠道)之后,支持材料的至少一部分降解使得弹簧延伸和/或组织接合组件与位于对象内部的组织接合(例如,接触、穿透)。在一些实施方案中,对象内部的位置是结肠、十二指肠、回肠、空肠、胃或食管。在某些实施方案中,对象内部的位置在颊间隙(buccal space)中、在静脉系统(例如,动脉)中、在呼吸系统(例如,肺)中、在肾系统中、在泌尿系统中、或在胃肠系统中。如上文和本文中所述,在一些实施方案中,活性药物成分在穿透位于对象内部的组织期间和/或之后释放。
在一些实施方案中,组织接合组件包含针,并且以大于或等于1mN且小于或等于100mN(例如,大于或等于10mN且小于或等于20mN)的力穿透组织。在某些实施方案中,组织接合组件包含多个微针,并且以大于或等于100mN且小于或等于10N(例如,大于或等于1N且小于或等于2N,大于或等于100mN且小于或等于6N)的力穿透组织。
在一些情况下,并且如本文中所述,制品可取向为使得组织接合组件的纵轴与位于制品附近的组织正交(例如,在90°的小于或等于10%、小于或等于5%、或者小于或等于1%内)。在一些实施方案中,本文中所述的自致动制品(例如,包含组织接合组件)可与一个或更多个自扶正制品相关联。合适的自扶正制品的非限制性实例一般地描述于在2017年5月17日提交的标题为”SELF-RIGHTING ARTICLES”的共同拥有的美国临时申请序列号62/507,647中,其通过引用整体并入本文。
在一个示例性实施方案中,制品包含外壳、至少部分地包封在外壳内的弹簧、与弹簧相关联的支持材料(使得该支持材料在环境条件下将弹簧的至少一部分维持在至少5%压缩应变下)、以及可操作地连接至弹簧的组织接合组件。在某些实施方案中,制品包含组织接合组件和与组织接合组件相关联的弹簧,该弹簧通过支持材料维持在至少5%压缩应变下的至少部分压缩的状态。根据某些实施方案,弹簧配置成在支持材料机械失效的0.1毫秒内释放弹簧的至少10%(例如,至少90%)的储存压缩能。根据某些实施方案,制品压缩与组织接合组件相关联的药剂。在一些实施方案中,制品包含与组织接合组件相关联的自扶正制品。
高API
在一些实施方案中,如上文和本文中所述,系统包含组件(例如,组织接合组件),该组件包含固体治疗剂(例如,固体API)和第二材料(例如,用于固体API的支持材料例如黏合剂和/或聚合物)使得相对于组织接合组件的总重量,固体治疗剂以大于或等于10wt%的量存在于组件中。这样的组织接合组件可用于(例如,向对象)递送API剂。有利地,在一些实施方案中,与液体制剂相比,递送所需API剂量所需的体积减小允许在多个部位/组织(例如,舌、GI黏膜组织、皮肤)中创建用于多种药物的固体针递送系统,和/或降低和/或消除用于通过针中的小开口注射药物溶液的外力施加。在一些情况下,生理相关剂可存在于(例如,具有相对高的API载量的)单个组织接合组件中。
在某些实施方案中,API是基本上固体的(例如,粉末、压缩粉末、结晶固体、无定形固体),即固体治疗剂。在一些实施方案中,API可以为液体形式。在某些实施方案中,API可以是
在一些实施方案中,组织接合组件包含针、活检组件、弹头状物、多个微针、钩、黏膜黏附贴片、或其组合。在某些实施方案中,如本文中和上文所述,组织接合组件配置成穿透组织(例如,皮肤、舌、GI道组织例如GI道黏膜组织)。在一些实施方案中,以大于或等于1mN且小于或等于20N(例如,大于或等于10mN且小于或等于20mN,大于或等于1mN且小于或等于100mN,大于或等于20mN且小于或等于1N,大于或等于1N且小于或等于20N,大于或等于10N且小于或等于20N)的力穿透组织。
有利地,与传统的微针(例如,通常包含少于10wt%负载和/或需要大约数千至数万微针的多个微针来递送相似的剂量)相比,包含相对高的API载量(例如,相对于组件的总重量,大于或等于10wt%)包含针和/或多个微针的组织接合组件可显著降低针的数目/或递送特定API剂量所需的微针阵列的总尺寸)。
在一些实施方案中,组织接合组件具有特定的最大尺寸(例如,长度)。在某些实施方案中,组织接合组件的最大尺寸为大于或等于1mm、大于或等于2mm、大于或等于3mm、大于或等于5mm、大于或等于7mm、大于或等于10mm、大于或等于12mm、大于或等于15mm、大于或等于20mm、大于或等于25mm、大于或等于30mm、或者大于或等于50mm。在一些实施方案中,组织接合组件的最大尺寸为小于或等于100mm、小于或等于50mm、小于或等于30mm、小于或等于25mm、小于或等于20mm、小于或等于15mm、小于或等于12mm、小于或等于10mm、小于或等于7mm、小于或等于5mm、小于或等于3mm、或者小于或等于2mm。也可以是上述范围的组合。
在某些实施方案中,组织接合组件的平均截面尺寸(例如,直径)为大于或等于0.25mm、大于或等于0.5mm、大于或等于0.6mm、大于或等于0.7mm、大于或等于0.8mm、大于或等于0.9mm、大于或等于1mm、大于或等于1.1mm、大于或等于1.2mm、大于或等于1.3mm、大于或等于1.4mm、大于或等于1.5mm、大于或等于1.7mm、mm、大于或等于1.9mm、大于或等于2.5mm、大于或等于3.0mm、大于或等于4.0mm、或者大于或等于5.0mm。在一些实施方案中,组织接合组件的平均截面尺寸为小于或等于6.0mm、小于或等于5.0mm、小于或等于4.0mm、小于或等于3.0mm、小于或等于2.5mm、小于或等于1.9mm、小于或等于1.7mm、小于或等于1.5mm、小于或等于1.4mm、小于或等于1.3mm、小于或等于1.2mm、小于或等于1.1mm、小于或等于1mm、小于或等于0.9mm、小于或等于0.8mm、小于或等于0.7mm、或者小于或等于0.6、或者小于或等于0.5mm。也可以是上述范围的组合(例如,大于或等于0.5mm且小于或等于2.0mm)。也可以是其他范围。
在一些实施方案中,组织接合组件可包含多个微针。在一些这样的实施方案中,多个微针可具有特定的基部最大截面尺寸(例如,基部的直径)、特定的高度和/或特定的间距。
在一些实施方案中,多个微针的基部的平均直径为大于或等于100微米、大于或等于150微米、大于或等于200微米、大于或等于250微米、大于或等于300微米、大于或等于350微米、大于或等于400微米、或者大于或等于450微米。在某些实施方案中,多个微针的基部的平均直径为小于或等于500微米、小于或等于450微米、小于或等于400微米、小于或等于350微米、小于或等于300微米、小于或等于250微米、小于或等于200微米、或者小于或等于150微米。也可以是上述范围的组合(例如,大于或等于100微米且小于或等于500微米)。也可以是其他范围。
在某些实施方案中,多个微针的平均高度为大于或等于0.1mm、大于或等于0.2mm、大于或等于0.5mm、大于或等于0.7mm、大于或等于1mm、大于或等于1.2mm、大于或等于1.5mm、或者大于或等于2mm。在一些实施方案中,多个微针的平均高度为小于或等于2.5mm、小于或等于2mm、小于或等于1.5mm、小于或等于1.2mm、小于或等于1mm、小于或等于0.7mm、小于或等于0.5mm、或者小于或等于0.2mm。也可以是上述范围的组合(例如,大于或等于0.1mm且小于或等于2.5mm)。也可以是其他范围。
在一些情况下,多个微针的平均间距(例如,多个微针中相邻微针之间的间距)可以为大于或等于100微米、大于或等于200微米、大于或等于300微米、大于或等于400微米、大于或等于500微米、大于或等于600微米、大于或等于700微米、大于或等于800微米、大于或等于900微米、大于或等于1000微米、大于或等于1100微米、大于或等于1200微米、大于或等于1300微米、或者大于或等于1400微米。在某些实施方案中,多个微针的平均间距为小于或等于1500微米、小于或等于1400微米、小于或等于1300微米、小于或等于1200微米、小于或等于1100微米、小于或等于1000微米、小于或等于900微米、小于或等于800微米、小于或等于700微米、小于或等于600微米、小于或等于500微米、小于或等于400微米、小于或等于300微米、或者小于或等于200微米。也可以是上述范围的组合(例如,大于或等于100微米且小于或等于1500微米)。也可以是其他范围。
有利地,在一些实施方案中,组织接合组件(例如,针)相对较快地溶解,从而降低和/或消除了该组件在不期望位置二次穿透的风险。在一些实施方案中,组件的最大截面尺寸(例如,长度)设计成递送至其靶向的无论哪个器官,以防止疼痛和/或不期望的GI道穿孔。
在一些实施方案中,组织接合组件包含基部部分和尖端。例如,如图28中所示,组织接合组件100包含基部部分110和尖端115。在一些实施方案中,基部部分和/或尖端部包含黏膜黏附剂材料。合适的黏膜黏附剂材料的非限制性实例包括聚合物,例如聚(乙烯醇)、羟基化的甲基丙烯酸酯、以及聚(甲基丙烯酸)、聚丙烯酸酯(例如,聚丙烯酸、硫醇化的聚(丙烯酸)、
在一些实施方案中,基部部分和/或尖端包含固体治疗剂(例如,API)和第二材料(如果存在的话),使得相对于组织接合组件的总重量,固体治疗剂以大于或等于10wt%的量存在于组织接合组件中。在某些实施方案中,相对于组织接合组件的总重量,固体治疗剂以以下的量存在于组织接合组件中:大于或等于10wt%、大于或等于20wt%、大于或等于30wt%、大于或等于40wt%、大于或等于50wt%、大于或等于60wt%、大于或等于70wt%、大于或等于80wt%、大于或等于90wt%、大于或等于95wt%、大于或等于98wt%、或者大于或等于99.1wt%。在一些实施方案中,相对于组织接合组件的总重量,固体治疗剂以以下的量存在于组织接合组件中:小于或等于100wt%、小于或等于99wt%、小于或等于98wt%、小于或等于95wt%、小于或等于90wt%、小于或等于80wt%、小于或等于70wt%、小于或等于60wt%、小于或等于50wt%,小于或等于40wt%、小于或等于30wt%、或者小于或等于20wt%。也可以是上述范围的组合(例如,大于或等于10wt%且小于或等于100wt%,大于或等于80wt%且小于或等于100wt%)。也可以是其他范围。在一个示例性实施方案组中,相对于组织接合组件的总重量,固体治疗剂以大于或等于80wt%且小于或等于100wt%的量存在于组织接合组件中。
在某些实施方案中,相对于基部部分的总重量,固体治疗剂以以下的量存在于基部部分中:大于或等于0wt%、大于或等于5wt%、大于或等于10wt%、大于或等于20wt%、大于或等于30wt%、大于或等于40wt%、大于或等于50wt%、大于或等于60wt%、大于或等于70wt%、大于或等于80wt%、大于或等于90wt%、大于或等于95wt%、大于或等于98wt%、或者大于或等于99wt%。在一些实施方案中,相对于基部部分的总重量,固体治疗剂以以下的量存在于基部部分中:小于或等于100wt%、小于或等于99wt%、小于或等于98wt%、小于或等于95wt%、小于或等于90wt%、小于或等于80wt%、小于或等于70wt%、小于或等于60wt%、小于或等于50wt%、小于或等于40wt%、小于或等于30wt%、小于或等于20wt%、小于或等于10wt%、或者小于或等于5wt%。也可以是上述范围的组合(例如,大于或等于10wt%且小于或等于100wt%,大于或等于80wt%且小于或等于100wt%)。也可以是其他范围。在一个示例性实施方案中,基部部分基本上包含仅固体治疗剂。
在某些实施方案中,相对于尖端的总重量,固体治疗剂以以下的量存在于尖端中:大于或等于0wt%、大于或等于5wt%、大于或等于10wt%、大于或等于20wt%、大于或等于30wt%、大于或等于40wt%、大于或等于50wt%、大于或等于60wt%、大于或等于70wt%、大于或等于80wt%、大于或等于90wt%、大于或等于95wt%、大于或等于98wt%、或者大于或等于99wt%。在一些实施方案中,相对于尖端的总重量,固体治疗剂以以下的量存在于尖端中:小于或等于100wt%、小于或等于99wt%、小于或等于98wt%、小于或等于95wt%、小于或等于90wt%、小于或等于80wt%、小于或等于70wt%、小于或等于60wt%、小于或等于50wt%、小于或等于40wt%、小于或等于30wt%、小于或等于20wt%、小于或等于10wt%、或者小于或等于5wt%。也可以是上述范围的组合(例如,大于或等于10wt%且小于或等于100wt%,大于或等于80wt%且小于或等于100wt%)。也可以是其他范围。在一个示例性实施方案中,尖端基本上包含仅固体治疗剂。在另一个示例性实施方案中,尖端基本上不包含固体治疗剂。
在某些实施方案中,无论基部部分和/或尖端的构成如何,相对于组织接合组件的总重量,组织接合组件都包含大于或等于10wt%(例如,大于或等于80wt%)固体治疗剂。
在一些实施方案中,组织接合组件包含以下量的治疗剂(例如,固体治疗剂):大于或等于0.1mg、大于或等于0.5mg、大于或等于0.8mg、大于或等于1mg、大于或等于1.5mg、大于或等于2mg、大于或等于2.5mg、大于或等于3mg、大于或等于4mg、大于或等于5mg、大于或等于7mg、大于或等于9mg。在某些实施方案中,组织接合组件包含以下量的治疗剂:小于或等于10mg、小于或等于9mg、小于或等于7mg、小于或等于5mg、小于或等于4mg、小于或等于3mg、小于或等于2.5mg、小于或等于2mg、小于或等于1.5mg、小于或等于1mg、小于或等于0.8mg、小于或等于0.5mg、或者小于或等于0.2mg。也可以是上述范围的组合(例如,大于或等于0.1mg且小于或等于10mg)。也可以是其他范围。
在某些实施方案中,固体治疗剂(例如API)的至少一部分与组织接合组件的基部部分和/或一个或更多个尖端相关联。例如,在一些实施方案中,固体治疗剂和第二材料(如果存在的话)基本上均匀地分布在组织接合组件中(例如,在基部部分中和/或在尖端中)。在一些情况下,固体治疗剂可以是涂层(例如,设置在尖端的至少一部分上)使得相对于组织接合组件的总重量,组织接合组件包含大于或等于10wt%的固体治疗剂。
在一些实施方案中,组织接合组件可包含另外的涂层。在一些实施方案中,所述另外的涂层可包含配置成例如溶解时间相对于没有所述另外的涂层的组织接合组件的溶解减慢的材料。合适的另外的涂层材料的非限制性实例包括Zn、Al、Mg、聚合物(例如,肠溶聚合物、聚己内酯、聚对二甲苯、羟丙甲纤维素、聚乙二醇)、及其组合。也可以是其他另外的涂层材料。在一些实施方案中,另外的涂层可配置成使得固体治疗剂在特定的时间量内释放。例如,在一些实施方案中,另外的涂层配置成使得固体治疗剂在以下的时间内(例如,另外的涂层暴露于流体例如胃液之后)释放:小于或等于6个月、小于或等于3个月、小于或等于1个月、小于或等于2周、小于或等于1周、小于或等于4天、小于或等于2天、小于或等于1天、小于或等于12小时、小于或等于6小时、小于或等于3小时、小于或等于1小时、小于或等于30分钟、小于或等于15分钟、小于或等于10分钟、小于或等于5分钟、或者小于或等于2分钟。在某些实施方案中,另外的涂层配置成使得固体治疗剂在以下的时间内释放:大于或等于1分钟、大于或等于2分钟、大于或等于5分钟、大于或等于10分钟、大于或等于15分钟、大于或等于30分钟、大于或等于1小时、大于或等于3小时、大于或等于6小时、大于或等于12小时、大于或等于1天、大于或等于2天、大于或等于4天、大于或等于1周、大于或等于2周、大于或等于1个月、或者大于或等于3个月。也可以是上述范围的组合(例如,大于或等于1分钟且小于或等于1天,大于或等于1天且小于或等于2周,大于或等于1周且小于或等于6个月)。也可以是其他范围。
在某些实施方案中,组织接合组件包含多个微针,其包含固体治疗剂和第二材料(如果存在的话)。
在一些实施方案中,固体治疗剂的至少一部分存在于尖端的至少一个表面上。在某些实施方案中,第二材料的至少一部分存在于尖端的至少一个表面上。
本文中所述的组织接合组件可使用任何合适的方法形成。在一些实施方案中,组织接合组件通过以下形成:提供固体治疗剂和第二材料(如果存在的话),以及将固体治疗剂和第二材料一起离心和/或使用至少1MPa的压力一起压缩来形成组织接合组件。在一些实施方案中,将第二材料(如果存在的话)和固体治疗剂加热以形成组织接合组件。
在一些实施方案中,组织接合组件使用以下的压力形成:至少1MPa的压力、至少2MPa的压力、至少3MPa的压力、至少5MPa的压力、至少7MPa的压力、至少10MPa的压力、至少12MPa的压力、至少15MPa的压力、至少20MPa的压力、至少25MPa的压力、至少30MPa的压力、至少40MPa的压力、至少50MPa的压力、至少75MPa的压力、至少150MPa的压力、至少300MPa的压力、至少600MPa的压力、至少900MPa的压力、至少1GPa的压力、或至少1.2GPa的压力。在一些实施方案中,组织接合组件使用以下的压力形成:小于或等于1.4GPa的压力、小于或等于1.2GPa的压力、小于或等于1GPa的压力、小于或等于900MPa的压力、小于或等于600MPa的压力、小于或等于300MPa的压力、小于或等于150MPa的压力、小于或等于100MPa的压力、小于或等于75MPa的压力、小于或等于50MPa的压力、小于或等于40MPa的压力、小于或等于30MPa的压力、小于或等于25MPa的压力、小于或等于20MPa的压力、小于或等于15MPa的压力、小于或等于12MPa的压力、小于或等于10MPa的压力、小于或等于7MPa的压力、小于或等于5MPa的压力、小于或等于3MPa的压力、或者小于或等于2MPa的压力。也可以是上述范围的组合(例如,至少1MPa的压力且小于或等于100MPa的压力,至少20MPa的压力且小于或等于100MPa的压力,至少100MPa且小于或等于1.4GPa的压力)。也可以是其他范围。
在某些实施方案中,组织接合组件可在特定温度下形成。例如,在一些实施方案中,组织接合组件在以下的温度下形成:大于或等于50℃、大于或等于60℃、大于或等于70℃、大于或等于80℃、大于或等于90℃、大于或等于100℃、或者大于或等于120℃。在一些实施方案中,组织接合组件在以下的温度下形成:小于或等于150℃、小于或等于130℃、小于或等于120℃、小于或等于110℃、小于或等于100℃、小于或等于90℃、小于或等于80℃、小于或等于70℃、或者小于或等于60℃。也可以是上述范围的组合(例如,大于或等于50℃且小于或等于130℃)。也可以是其他温度和范围。
有利地,组织接合组件可具有期望的机械特性(例如,杨氏弹性模量(Young’selastic modulus)),例如使得组织接合组件可适当地刺穿胃肠道的组织。在一些实施方案中,组织接合组件的杨氏弹性模量为大于或等于100MPa(例如,大于或等于125MPa、大于或等于150MPa、大于或等于175MPa、大于或等于200MPa、大于或等于250MPa、大于或等于300Mpa、或者大于或等于350MPa)。在某些实施方案中,组织接合组件的杨氏弹性模量为小于或等于400MPa、小于或等于350MPa、小于或等于300MPa、小于或等于250MPa、小于或等于200MPa、小于或等于175MPa、小于或等于150Mpa、或者小于或等于125MPa。也可以是上述范围的组合(例如,大于或等于100MPa且小于或等于250MPa,大于或等于100MPa且小于或等于400MPa)。也可以是其他范围。
在一些情况下,组织接合组件可配置成以特定的力穿透特定的深度进入人胃肠道黏膜组织。例如,组织接合组件可配置成以小于或等于20N(例如,小于或等于小于或等于10N、小于或等于5N、小于或等于1N、小于或等于500mN、小于或等于100mN、小于或等于50mN、小于或等于20mN、小于或等于15mN、小于或等于10mN、小于或等于5mN)的力穿透大于或等于1mm(例如,大于或等于2mm、大于或等于3mm、或者大于或等于4mm)。
在一些实施方案中,第二材料包含可聚合单体和/或聚合物。在某些实施方案中,第二材料是可生物降解的。用于第二材料的合适材料的非限制性实例包括聚乙二醇、聚乙烯吡咯烷酮、聚乳酸、多糖类(例如,麦芽糖、乳糖、淀粉、纤维素)、阿拉伯胶、甲基纤维素、明胶、西黄蓍胶(tragacanth)、黏土、HPMC、硬脂酸、硬脂酸钠、硬脂酸镁、滑石、聚乙二醇、矿物油、防腐剂(例如,苯酚、对羟基苯甲酸酯、西曲溴铵)、抗氧化剂(例如,没食子酸、生育酚)、其衍生物、及其组合。
在一些实施方案中,组织接合组件包含具有大于或等于50MPa(例如,大于或等于60MPa、大于或等于70MPa、或者大于或等于80MPa)的屈服强度的涂层。
在一些实施方案中,涂层可由薄膜金属、陶瓷或类金刚石涂层(Diamond LikeCoating,DLC)构成。在一些实施方案中,组织接合组件不包含涂层。
在一些实施方案中,涂层可由可腐蚀材料(例如铁、锌、铝或合金)构成使得当涂层开始与生理环境接触时,其将崩解并呈现出治疗剂。在某些实施方案中,涂层可包含聚合物例如聚对二甲苯,如本文中所述。
在一些情况下,组织接合组件可配置成每平方厘米的对象组织递送特定量的活性药剂。例如,在一些实施方案中,组织接合组件配置成每平方厘米的对象组织(其在组织接合组件的穿透位置附近)递送以下量的药剂:大于或等于0.01μg、大于或等于0.05μg、大于或等于0.1μg、大于或等于0.2μg、大于或等于0.5μg、大于或等于0.7μg、大于或等于1μg、大于或等于2μg、大于或等于5μg、或者大于或等于10μg。在某些实施方案中,组织接合组件配置成每平方厘米的组织递送以下量的药剂:小于或等于20μg、小于或等于5μg、小于或等于2μg、小于或等于1μg、小于或等于0.7μg、小于或等于0.5μg、小于或等于0.2μg、小于或等于0.1μg、或者小于或等于0.05μg。也可以是上述范围的组合(例如,大于或等于1μg且小于或等于20μg)。在一些实施方案中,组织接合组件配置成在任何合适的时间段内(例如,在大于或等于0.1秒的时间内、在大于或等于0.5秒的时间内、在大于或等于1秒的时间内、在大于或等于5秒的时间内、在大于或等于30秒的时间内、大于或等于1分钟、大于或等于5分钟、10分钟、大于或等于30分钟、大于或等于1小时、大于或等于4小时、大于或等于24小时、大于或等于48小时、大于或等于72小时、大于或等于96小时、大于或等于120小时、大于或等于144小时、大于或等于168小时)每平方厘米的对象组织递送大于或等于1μg的药剂。
在某些实施方案中,组织接合组件包含黏合剂(例如,在一些情况下,第二材料是黏合剂)。合适的黏合剂的非限制性实例包括糖例如山梨糖醇和蔗糖、明胶、聚合物(例如聚乙烯醇(PVA)、聚乙二醇(PEG)、聚己内酯(PCL)和聚乙烯吡咯烷酮(PVP),以及包含乙醇的聚合物)、或另一些第3类有机溶剂(例如,乙酸、庚烷、丙酮、甲酸、乙酸异丁酯等)。
在一个示例性实施方案中,相对于总制品重量,制品包含大于或等于80wt%的固体活性药剂。在某些实施方案中,制品包含大于或等于1mg的活性药剂。根据一些实施方案,所述药剂选自噬菌体、DNA、mRNA、胰岛素、人生长激素、单克隆抗体、阿达木单抗、肾上腺素和昂丹司琼。在某些示例性实施方案中,将活性药剂浇铸到模具中以形成制品。在一些实施方案中,将模具离心。根据某些实施方案,制品还包含黏合剂。在某些实施方案中,黏合剂包含糖(例如山梨糖醇或蔗糖)、明胶、聚合物(例如PVA、PEG、PCL、PVA或PVP)、和/或乙醇。根据某些实施方案,制品具有大于或等于100MPa的杨氏弹性模量。在一些实施方案中,制品配置成以小于或等于20mN的力穿透到人胃肠黏膜组织中至少1mm。根据某些实施方案,制品配置成每平方厘米的对象组织递送至少1mg的药剂,和/或制品每平方厘米包含大于或等于1mg的活性药剂。
某些示例性实施方案涉及形成制品的方法,其中所述方法包括将包含相对于组合物的总重量的大于80wt%固体药剂的组合物引入到模具中,向组合物施加大于或等于1MPa的压力,以及将组合物加热至至少70℃的温度持续至少1分钟。本文中使用的术语“活性药物成分”(也称为“药物”或“治疗剂”)是指施用于对象以治疗疾病、障碍或其他临床上公认的病症,或者用于预防目的,并且对待治疗和/或预防疾病、障碍或病症的对象的身体具有临床上显著的作用的药剂。
药剂
根据一些实施方案,本文中描述的组合物和方法与一种或更多种治疗剂、诊断剂和/或增强剂(例如药物、营养物、微生物、体内传感器和示踪剂)相容。在一些实施方案中,所述活性物质是治疗剂、营养剂、预防剂或诊断剂。尽管说明书的大部分描述了治疗剂的使用,但是也可以使用本文中列出的其他药剂。
药剂可包括但不限于当施用于对象(例如,人或非人动物)时通过局部和/或全身作用而诱导期望的药理学效应、免疫原性效应和/或生理学效应的任何合成或天然存在的生物活性化合物或物质组合物。例如,在某些实施方案的情况下可用或潜在可用的是传统上认为为是药物、疫苗和生物药物的化合物或化学物质。某些这样的药剂可包括用于治疗领域、诊断领域和/或增强领域的分子(例如蛋白质、肽、激素、核酸、基因构建体等),所述治疗领域、诊断领域和/或增强领域包括但不限于疾病或病害的医学或兽医学治疗、预防、诊断和/或缓解(例如,HMG co-A还原酶抑制剂(他汀类)如瑞舒伐他汀;非甾体抗炎药如美洛昔康;选择性5-羟色胺再摄取抑制剂如艾司西酞普兰;血液稀释剂如氯吡格雷;类固醇如泼尼松;抗精神病剂如阿立哌唑和利培酮;镇痛剂如丁丙诺啡;拮抗剂如纳洛酮、孟鲁司特和美金刚;强心苷类如地高辛;α-阻断剂如坦索罗辛;胆固醇吸收抑制剂如依折麦布(ezetimibe);代谢物如秋水仙碱;抗组胺剂如氯雷他定和西替利嗪;阿片样物质如洛派丁胺;质子泵抑制剂如奥美拉唑;抗(逆)病毒剂如恩替卡韦、度鲁特韦、利匹韦林(rilpivirine)和卡博特韦(cabotegravir);抗生素如多西环素、环丙沙星和阿奇霉素;抗疟剂;以及synthroid/左甲状腺素);物质滥用治疗(例如,美沙酮和伐尼克兰(varenicline));计划生育(例如,激素避孕);表现增强(例如,兴奋药如咖啡因);以及营养和补充剂(例如,蛋白质、叶酸、钙、碘、铁、锌、硫胺、烟酸、维生素C、维生素D以及其他维生素或矿物质补充剂)。
在某些实施方案中,活性物质是一种或更多种特定的治疗剂。本文中使用的术语“治疗剂”或者还称为“药物”是指施用于对象以治疗疾病、障碍或其他临床上确认的病症或者用于预防目的并且对对象的身体具有临床上显著的作用以治疗和/或预防疾病、障碍或病症的物质。已知治疗剂的实例的列表可见于例如美国药典(United StatesPharmacopeia,USP);Goodman和Gilman的The Pharmacological Basis of Therapeutics,第10版,McGraw Hill,2001;Katzung,B.(ed.)Basic and Clinical Pharmacology,McGraw-Hill/Appleton&Lange;第8版(2000年9月21日);Physician’s Desk Reference(Thomson Publishing)和/或The Merck Manual of Diagnosis and Therapy,第17版(1999)或在其之后出版的第18版(2006),Mark H.Beers和Robert Berkow(eds.),MerckPublishing Group中,或者在动物的情况下,可见于The Merck Veterinary Manual,第9版,Kahn,C.A.(ed.),Merck Publishing Group,2005;以及“Approved Drug Productswith Therapeutic Equivalence and Evaluations,"由美国食品药物管理局(UnitedStates Food and Drug Administration,F.D.A.)出版(“橙皮书(Orange Book)”)。批准用于人使用的药物的实例由FDA列于21C.F.R.§§330.5,331至361和440至460之下,其通过引用并入本文;用于兽医使用的药物由FDA列于21C.F.R.§§500至589之下,其通过引用并入本文。在某些实施方案中,治疗剂是小分子。治疗剂的示例性种类包括但不限于:镇痛剂、抗镇痛剂、抗炎药、解热剂、抗抑郁剂、抗癫痫剂、抗精神病剂、神经保护剂、抗增殖剂(例如抗癌剂)、抗组胺剂、抗偏头痛药、激素、前列腺素、抗微生物剂(包括抗生素、抗真菌剂、抗病毒剂、抗寄生虫剂)、抗毒蕈碱剂、抗焦虑剂、抑菌剂、免疫抑制剂、镇静剂、催眠剂、抗精神病剂、支气管扩张剂、抗哮喘药、心血管药、麻醉剂、抗凝剂、酶的抑制剂、甾体剂、甾体或非甾体抗炎剂、皮质类固醇、多巴胺能剂(dopaminergic)、电解质、胃肠药物、肌肉松弛剂、营养剂、维生素、拟副交感神经剂、兴奋药、减食欲剂和抗发作性睡病剂(anti-narcoleptic)。还可向药物递送装置中引入营养品(nutraceutical)。这些可以是维生素;补充剂(例如钙或生物素),或者天然成分(例如植物提取物或植物激素)。
在一些实施方案中,治疗剂是一种或更多种抗疟药。示例性的抗疟药包括奎宁、本芴醇、氯喹、阿莫地喹、乙胺嘧啶、氯胍、氯丙胍-氨苯砜、磺胺类(例如磺胺多辛和磺胺甲氧哒嗪)、甲氟喹、阿托伐醌、伯氨喹、卤泛群、多西环素、林可霉素、青蒿素及青蒿素衍生物。在一些实施方案中,所述抗疟药是青蒿素或其衍生物。示例性的青蒿素衍生物包括蒿甲醚、二氢青蒿素、蒿乙醚和青蒿琥酯。在某些实施方案中,所述青蒿素衍生物是青蒿琥酯。
在另一个实施方案中,治疗剂是免疫抑制剂。示例性的免疫抑制剂包括糖皮质激素、细胞抑制剂(例如,烷化剂、抗代谢物和细胞毒性抗体)、抗体(例如,针对T细胞受体或Il-2受体的那些)、作用于免疫亲和蛋白的药物(例如,环孢菌素、他克莫司和西罗莫司)、以及其他药物(例如,干扰素类、阿片样物质、TNF结合蛋白、霉酚酸酯/盐(mycophenolate)、以及其他小分子(例如,芬戈莫德))。
在某些实施方案中,治疗剂是激素或其衍生物。激素的非限制性实例包括胰岛素、生长激素(例如,人生长激素)、加压素、褪黑素、甲状腺素、促甲状腺素释放激素、糖蛋白激素(例如,黄体生成素(luteinzing hormone)、促卵泡激素、促甲状腺激素)、类二十烷酸(eicosanoid)、雌激素、孕激素、睾酮、雌二醇、皮质醇、肾上腺素、以及其他类固醇。
在一些实施方案中,治疗剂是具有以下分子量的小分子药物:小于约2500道尔顿、小于约2000道尔顿、小于约1500道尔顿、小于约1000道尔顿、小于约750道尔顿、小于约500道尔顿、少于约400道尔顿。在一些情况下,治疗剂是具有以下分子量的小分子药物:200道尔顿至400道尔顿、400道尔顿至1000道尔顿、或500道尔顿至2500道尔顿。
在一些实施方案中,治疗剂选自活性药剂,例如胰岛素、核酸、肽、噬菌体、DNA、mRNA、人生长激素、单克隆抗体、阿达木单抗、肾上腺素、GLP-1受体激动剂、索马鲁肽(semaglutide)、利拉鲁肽、度拉鲁肽(dulaglitide)、艾塞那肽、VIII因子、小分子药物、progrstin、疫苗、亚单位疫苗、重组疫苗、多糖疫苗、以及结合疫苗(conjugate vaccines)、类毒素疫苗、流感疫苗、带状疱疹疫苗、prevnar肺炎疫苗、mmr疫苗、破伤风疫苗、肝炎疫苗、HIV疫苗Ad4-env分支C(HIV vaccine Ad4-env Clade C)、HIV疫苗Ad4-mGag、dna疫苗、rna疫苗、依那西普、英夫利昔单抗、非格司亭(filgastrim)、乙酸格拉替雷(glatirameracetate)、利妥昔单抗、贝伐单抗、包封在纳米颗粒中的任何分子、肾上腺素、溶菌酶、葡萄糖-6-磷酸脱氢酶、其他酶、塞妥珠单抗(certolizumab pegol)、优特克单抗(ustekinumab)、依奇珠单抗(ixekizumab)、戈利木单抗(golimumab)、布罗达单抗(brodalumab)、古塞库单抗(gusellu,ab)、苏金单抗(secikinumab)、奥马珠单抗(omalizumab)、tnf-α抑制剂、白介素抑制剂、维多珠单抗(vedolizumab)、奥曲肽、特立帕肽(teriperatide)、crispr cas9、甘精胰岛素(insulin glargine)、地特胰岛素(insulindetemir)、赖脯胰岛素(insulin lispro)、门冬胰岛素(insulin aspart)、人胰岛素、反义寡核苷酸、以及昂丹司琼。
在一个示例性实施方案中,治疗剂是胰岛素。
在一些实施方案中,本文中所述的组织接合组件包含两种或更多种类型的治疗剂。
在某些实施方案中,治疗剂以一定浓度存在于组织接合组件中使得从组织接合组件释放之后,该治疗剂引起治疗响应。
在一些情况下,治疗剂可以以低于通常与活性治疗剂缔合的最小浓度的浓度(例如,以微剂量浓度)存在。例如,在一些实施方案中,组织接合组件包含相对低剂量(例如,不希望受到理论的束缚,低剂量的治疗剂(例如,类固醇)可介导对象内部位置处的对象的异物反应(例如,响应于组织接合组件的接触))的第一治疗剂(例如,类固醇)。在一些实施方案中,治疗剂的浓度为小于或等于100μg和/或30nMol的微剂量。然而,在另一些实施方案中,治疗剂不是以微剂量提供,而是以以上列出的一种或更多种量存在。
在一些实施方案中,组织接合组件包含自致动组件。这样的自致动组织接合组件在2017年5月17日提交的标题为”SELF-ACTUATING ARTICLES”的共同拥有的美国临时申请序列号62/507,653中进行了一般描述,其通过引用整体并入本文。
在一些实施方案中,将组织接合组件施用于对象(例如,经口)。在某些实施方案中,制品可经口、经直肠、经阴道、经鼻或经尿道施用。在某些实施方案中,组织接合组件(例如,和/或其中包含的API)通过使对象的皮肤与该组件接触来施用。在一个示例性实施方案中,组织接合组件(例如,和/或其中包含的API)通过使对象的颊组织(buccal tissue)(例如,唇、腭区域、颊、舌下、舌)与该组件接触来施用。在又一个示例性实施方案中,组织接合组件经口施用,并且在到达对象内部的位置(例如,GI道(例如结肠、十二指肠、回肠、空肠、胃)、颊间隙、食管等)之后,组织接合组件在对象内部的位置处与对象的组织接合(例如,接触)并至少部分地穿透组织。在某些实施方案中,组织接合组件的至少一部分穿透对象的组织,并且至少一部分支持材料和/或活性药剂溶解到对象的组织中。
有利地,与传统方法相比,将具有相对高的API载量的组织接合组件的施用于GI道可允许更有效的API递送。例如,不希望受到理论的束缚,与其他方法相比,已显示通过注射将药物递送至GI道具有更高的生物利用度。
在一些实施方案中,系统包含自扶正制品(例如,配置成以特定取向定位于对象内部的位置)、自致动组件(例如,配置成在特定组的条件下激活,例如在暴露于流体胃肠液之后)、与自致动组件相关联的组织接合组件,以及与组织接合组件相关联的API。在某些实施方案中,系统包含自扶正制品、自致动组件,以及与自致动组件相关联的组织接合组件。在一些实施方案中,系统包含自致动组件和与自致动组件相关联的组织接合组件。在某些实施方案中,系统包含自扶正制品和与自扶正制品相关联的API。在一些实施方案中,系统包含组织接合组件和与组织接合组件相关联的API。在一些实施方案中,系统包含自致动组件、与自致动组件相关联的组织接合组件,以及与组织接合组件相关联的API。自扶正制品、自致动组件、组织接合组件和API以及相关配置在上文和本文中进行了描述。
“对象”是指任何动物,例如哺乳动物(例如,人)。对象的非限制性实例包括人、非人灵长类、牛、马、猪、绵羊、山羊、狗、猫、或啮齿动物(例如小鼠、大鼠、仓鼠)、鸟、鱼、或豚鼠。通常来说,本发明针对用于人。在一些实施方案中,例如在施用自扶正制品之后,对象可表现出健康益处。
本文中使用的“流体”被赋予其普通含义,即,液体或气体。流体无法维持确定的形状,并且会在可观察的时间框架内流动以填充其所放入的容器。因此,流体可具有允许流动的任何合适的黏度。如果存在两种或更多种流体,则本领域普通技术人员可在基本上任何流体(液体、气体等)中独立地选择每种流体。
实施例
以下实施例旨在举例说明本文中所述的某些实施方案,包括本发明的某些方面,但不示例本发明的全部范围。
实施例1-自扶正制品
提供了由特定的形状和/或密度分布组成(任选地,具有包封在标准“000”、“00”号胶囊或者可能更小或更大的胶囊中的容量)的自扶正制品。例如,密度和/或形状的分布可使得:
1.该设计具有仅一个稳定点和一个不稳定点以便其总是自扶正至单一配置和取向;
2.制品的设计具有从每个可能取向到其稳定配置的相对短的扶正时间;
3.该设计使GI道中的力(例如,流体流动和肌肉收缩)带来的失稳定作用最小化;和/或
4.该设计允许通过制品上特定位置中产生的空心缝将多种形状和重量的制品加载到系统中。
在一些情况下,制品形状源自于在笛卡儿平面(Cartesian plane))的两个右象限内绘制并绕y轴旋转的平滑曲线。该形状具有数个明显的特征。它具有与y轴垂直的移到高曲率拐角的平坦底部,并随后随着曲线的继续缓慢降低其曲率。曲线的平坦底部截面可有助于满足制品的第三规范。因为底部是平坦的并且被陡峭的拐角包围,所以需要更大的力才能将制品推到其侧面上。这类似于椭圆体在推动时会摆动但立方体则不会摆动的方式。
可使用以下方程以满足第一和第二规范的方式优化曲线的其余部分。制品的扶正时间根据以下角运动方程(angular kinematic equation)计算:Δθ=ωt+1/2αt
在一些情况下,制品可由两种不同的材料制成:一种具有高密度,并且另一种具有低密度。限定密度的比例以使得形状的质心位于坐标系的原点。平面的下半部分由高密度材料组成,而平面的上部由低密度材料组成。为了使材料密度能够由目前可用的材料实现,可对原始形状做出实例中说明的某些孔和修改。这些孔和修改也用于将制品容纳在系统内,然后在确定其他材料的密度时将其考虑在内。
一旦已设计了3D形状,就可使用以上方程从给定取向测试扶正时间。制品的重量和体积决定了决定扭矩的作用力,并由材料的密度以及生成的曲线确定。用于确定扭矩的距离和角测量值仅由生成的曲线确定。用角坐标集在径向坐标中通过一组点绘制平滑曲线来生成曲线。然后,代码将改变点的距离坐标直到达到最小的扶正时间集。
实施例2
通过旋转由绕y轴限定的平滑曲线而生成的固体形状(实例:图7)。该形状由具有正y值的所有区域中的生物相容性聚合物(实例:PCL、PLA、PEG)和具有负y值的所有区域中的生物相容性陶瓷(实例:羟基磷灰石)或金属(实例:不锈钢、菲尔德金属)制成。两种材料的密度的比例应为6:1至16:1。制品可按比例缩放至任意长度,但是图7中的点描述了可装配在胶囊(图8)例如000号胶囊内的物体。
该形状已针对具有相同体积和类似尺寸的椭圆体和球体对其扶正能力进行了测试。将制品在数种不同的液体(包括水、油和胃液)中以及在不同的表面(包括塑料和猪胃组织)上在高速摄影机下以1000FPS进行了测试。结果(图9至12)表明,该制品总体上具有较快的扶正时间,以及在接近稳定取向的角度处具有更快的扶正时间。由于制品最有可能开始接近其稳定取向,因此这使该制品比其他形状更好。
还通过放置在倾斜混合器上测试了制品保持扶正的能力。将混合器设置为以50rpm在每个方向上倾斜15度。制品从未离开其稳定取向,而球体从其最佳取向倾斜了18度,并且椭圆体从其最佳取向倾斜了31度(图13至16)。
还使用塑料管作为人工食管,将该制品体外放置到悬吊的全猪胃中,并与由仅PCL制成的球体相比,比较将其以正确取向着陆了多少次。在装满水的、装满油的、或空的胃的情况下进行每个制品的60个试验中,发现具有如图7中的形状的制品每次都以正确取向着陆,而球体只有25%的次数以正确取向着陆。
另外,在体内进行了类似的实验。通过胃管向镇静的猪饲喂6个自扶正制品和6个非自扶正但形状相同的制品。然后将猪大力摇动以模拟行走。摇动猪之后,将它们置于X射线下,并计数保持正确取向的制品的数目。通过在它们内部放置一块金属来标识这些制品(图14)。自扶正制品的下半部分已有半个金属球,其自扶正时在X射线下显示为一个完整的圆形,并且在未自扶正时显示为亏月。将圆形垫圈放置在对照制品中,并且当自扶正时显示为完整的圆形,或者未扶正时显示为翘曲的卵状。65/66自扶正试验显示出摇动后的正确取向,而只有7/31的对照制品显示出正确取向。
实施例3
具有与实施例2中描述的形状类似的形状,但是在制品中内置有孔、进出口和狭缝的物体。这样的孔和狭缝可用于允许流体进入系统或可用于在系统内储存制品(图19)。这些狭缝也可用于将制品挖空以将密度比保持在可使用可用材料实现的合理值上。例如,通过挖空制品的顶部截面,可使用更高密度的材料填充其余的顶部区域;允许使用更高密度的材料,因为对制品的唯一限制是外形和质心。在制作孔时,制品应尽量保持轴对称,或尽可能接近轴对称。
这些孔和狭缝的这样的实例包括但不限于以下:
1.圆柱体,其半径小于以y轴为中心的制品的半径。
2.以y轴为中心的圆锥截面,其允许半径随系统半径的变化而变化。
3.从系统顶部或底部以给定宽度进行垂直直线切削。
4.维持系统的整体完整性的任何其他种类的切削。
实施例4
具有与实施例2和3中描述的形状类似的形状,但是在系统中内置有药物递送制品的物体。该制品可以是负载药物的实心或空心针。其可以是连接至储存器(reservoir)的空心针,或者其可以是负载有或涂覆有药物的一系列针。也可以是其他药物递送制品例如贴片。
在针的实例中,可将针容纳在系统内部或安置在系统外部。当安置在系统外部时,它们可通过黏合剂连接或嵌入在制品的模具内。当容纳在系统内部时,可将其容纳在制品中挖空的孔内。
针穿刺可由制品的重力被动地致动。在该实施中,制品的重量可将针推入到组织中。
实施例5
具有与实施例2至4中描述的形状类似的形状、但是在系统中内置有电子产品片的物体。
通过向与锚组合的制品添加电子产品(electronics)片,该制品可用作电子产品的胃滞留机构(gastro retentive mechanism)。由于制品的方向性,传感器可能可进入组织壁或GI道内部。例如,附接至制品底部的pH传感器根据其在系统上的放置将能够读取胃壁区域或胃内部区域的pH。
实施例6
具有与实施例2至4中描述的形状类似的形状但具有将其他制品远程附接至系统的能力的物体(图20)。
通过向系统的壁添加吸引力和/或黏附力,患者可以能够吞咽填充有新制品或药物的其他胶囊并使它们在系统处聚集在一起。这样的力可由磁体、黏合剂、真空、或任何数目的其他机构产生。
例如,磁体可附接至系统的壁以及电子传感器的壁。患者可首先吞咽自扶正系统,并将其如实施例4中所述锚定至组织壁。然后,患者可服用容纳有电子传感器的单独胶囊。从放置的磁体在两个制品之间产生的磁力将允许两个系统附接。由于自扶正系统锚定至组织壁,因此电子传感器也将能够保持在胃中,即使它不具有任何胃滞留特性。该系统可使任何种类的制品都变为胃滞留。
实施例7–自致动制品
该装置可被主动地致动。这可能包括机构例如形状记忆镍钛诺、膨胀弹性体或压缩弹簧。压缩弹簧可固定在固体可生物降解和生物相容性的聚合物或糖(实例:蔗糖、麦芽糖)中,这种机制已被证明在体内起作用(图22)。然后可将这些机构容纳在制品的挖空截面内或制品外部。将装置锚定至系统制品的方式不限于磁体、系结(tying knot)和施加黏合剂。
进一步探究弹簧实例,可期望针进入到GI道的黏膜下层以便递送药物,例如,针应穿透到组织中至少1mm。如果针穿透组织超过5mm,则患者将有穿孔风险。因此,弹簧可能压缩在1至5mm之间。同样,虽然穿透GI组织所需的力的量通常低,大约为1至10mN,但可能需要花费大约100mN的力才能进入到黏膜层与黏膜下层之间的胃的肌肉层中。在一些情况下,弹簧在压缩时会包含足够的力,其将以100mN的力加上3x至10x的安全系数推动组织。这意味着在一些情况下,弹簧可具有约100至250N/m的弹簧常数(图23)。
另外,压缩弹簧可被包入可保持这样的力的材料中。该材料也可以是脆性的,使得例如弹簧突然从该材料中脱离出来。脆性物质(例如(结晶的)糖)一旦受到给定的应力,将通常会迅速且完全地破裂。焦糖化蔗糖通常在0.1MPa的应力下破裂。如果压缩弹簧在蔗糖涂层上施加1N的力,则蔗糖涂层的直径可能为至少3.56mm以容纳弹簧。添加至涂层的任何更多焦糖化蔗糖可用作装置的计时机构(例如,不希望受到理论的束缚-涂层的厚度可能至少与降解涂层所需的时间成比例)。
使用运行具有界面平衡的扩散传质问题的建模软件,确定一旦将涂覆有蔗糖的弹簧(通过用4至6mm的蔗糖涂覆弹簧)溶解在水中,则可使致动延迟1至4分钟。通过实验证实了这一点(图24至25)。已证明至少20秒的延迟足以使得致动在胃中而不是在嘴或食管中发生。
为了确保液体到达蔗糖以启动此溶解过程,可在装置的顶部和底部添加进出口以允许流体流动。这些进出口允许例如使困在内部的空气逸出的方式。它们也可以是吸湿的以允许水容易地通过。
在一些情况下,锚定装置将允许系统通过物理或化学方式将自身附接至GI道的组织壁。这样的装置可包含带刺的或带钩的针、黏膜黏附贴片、捕获与闭合机构(图26)、真空抽吸、或任何数目的其他机构。锚定装置可位于装置的底部以确保其面向组织壁。
如果锚定装置使用钩(例如,钩状针),则其可能会到达黏膜层与黏膜下层之间的组织的肌肉层。图27示出了由穿透到目的肌肉层的装置穿透的胃组织块的组织学载片。这种穿透是通过使用如上所述的涂覆有糖的弹簧产生的,该弹簧被压缩6mm并且具有210N/m的弹簧常数。
实施例8–高API负载
形成了包含高浓度API(例如,固体治疗剂)和黏合剂(例如,支持材料)的固体溶解针(例如,组织接合组件)。该API可由从小分子到肽药物再到疫苗的任何东西组成。针的制造使用以下中的一者或两者来产生:热和压力。压力可通过压丸机(pill press)、液压机、离心、或任何其他方式施加以提供大量的力。所施加的力在100cm
描述了可溶的组织接合组件,其包含黏合剂和以两位数百分比负载的固体API。该组织接合组件(例如,针)可被施加至皮肤、GI道、或身体的任何其他区域。在一些情况下,针使用粉末状形式的API。这些针通过向粉末状混合物施加压力和/或添加热而产生,这是与拉式或溶剂浇铸的传统溶解针不同的方法,但是也可使用这样的方法。可将这样的针添加至致动器以便给予足够的力以进入身体。
GI道为这样的针制剂提供了令人难以置信的机会。由于GI道某些区域的壁通常厚且具有巨大的表面积,因此与微针相比,这些针可加长和扩大以容纳甚至更大量的药物。例如,使用按重量计80%胰岛素载量的制剂允许以直径小于600μm、长度为3.3mm的针递送一毫克的API。这样的针可递送至胃而没有穿孔的风险。此外,少于一百个长度为a mm且基部直径为450μm的锥形针可将相同剂量的API递送至稍薄的小肠而没有穿孔的风险。
实施例9
使用平面内模具创建具有投影二维设计的针。针的直径可长至2mm或更大,但较大的针会阻碍穿透。针的长度也可长至厘米。其可以是钝的或有尖端角。可使用具有小焦点直径的激光器产生平面内模具,并且尖端半径仅受该测量的限制。较大分子量的蛋白质或不太可能聚集的蛋白质(例如BSA)可使用更大量的黏合剂。然而,也可产生使用100%胰岛素的尖端半径为40微米的针。在一些情况下,使用的黏合剂量可有助于控制所给API的剂量以及针的完整性。当将20至30w/w百分比的黏合剂添加至混合物时,没有观察到黏合问题。对于胰岛素和BSA二者,在80%API/20% PEG 200k制剂中具有以下尺寸(510um×510um×3.3mm)的针(图29至30)。
针也可用两部分制成,一部分包含API并且另一部分不包含API。这允许在仅尖端包含药物的情况下创建针。先前文献已表明,当针穿透时,它们在穿透的组织中产生坑(crater),从而阻碍针完全进入。在尖端负载药物有助于确保递送全部API剂量。可通过在针模上方创建一个分区并在一侧负载仅黏合剂而在另一侧负载API+黏合剂来创建这种类型的针。由于这两种制剂都包含相同的黏合剂,因此在压力或热下,两侧将融合以产生一个针(图31)。
高负载的胰岛素针显示出在20分钟内在37℃下在PBS中迅速溶解(图32)。三个针的溶解曲线还显示了每个针中药物负载的均匀性。另外,已使用Instron机器进行压碎测试来对这些针的强度进行测试。针表现出类似于延性材料的曲线。这容易理解,因为很大比例的针由PEG制成(图33至34)。最后,在人胃中测试了这些针的穿透力。发现,针以18mN的力完全穿透(图35)。
实施例10
平面外模具可创建具有三维形状的针。通过首先使用3D打印机制造实心阳模来创建该模具。这样的打印机可产生约1微米的尖端半径。然后,使用蒸发器用薄的10um铬层和另外的200um铜层涂覆该阳模以产生具有小晶粒尺寸的金属外壳,以保持可见于印刷原型中的尖端锐度。接下来,为了产生阴模,将数毫米的镍电镀到铜层的顶部。然后将所得的镍模具与阳模分离、进行平面化和平滑处理以至使力均匀分布。
通过在以下一种方法中将粉末压缩到模具中来创建针:
1.将粉末填充在模具的顶部上并压缩以产生完全由一种制剂制成的针和基底(图36)。
2.将粉末填充在模具的顶部上并压缩以产生完全由一种制剂制成的针和基底。然后分离基板,将针留在模具内。然后使用不含API的制剂压制模具。移除整个压制的装置,留下连接至不具有API的基板的具有API制剂的针(图37)。
3.API制剂松散地装在模具的孔中。然后将不含API的制剂放置在API制剂的顶部。立即按压整个装置,将API制剂留在针尖端中,并且将不具有API的制剂留在针基部和基板中(图38)。
这些针具有强的完整性,如通过在Instron机器上进行的轴向载荷测试所示。方法3的针开始具有小于10um的尖端半径,且在顶部的0.06N的力之后,尖端具有34um的尖端半径(图39)。
实施例11
该实施例示出了包含95wt%胰岛素(例如,API)和5wt%羟丙基甲基纤维素(HPMC)(例如,黏合剂材料)的组织接合组件的形成。如本文中所述,使用>1MPa的压力将胰岛素和HPMC压在一起。该组件的照片示于图40A中。显示,该组件在破裂之前承受>62.7N的力(图40B至图40C)。
还形成了包含100wt%胰岛素的组织接合组件。
使用胰岛素作为用PCL挤出的API产生另一种组织接合组件。量化回收的胰岛素百分比,并示于图40D中。还测试了胰岛素二聚体的形成,表明胰岛素对高至120℃至150℃的温度稳定(图40E)。
实施例12
以下实施例示出了包含具有高API载量的多个微针的组织接合组件的形成。
简单地说,如图41中所示,将API浇铸在模具中,压入到微针腔中。然后将模具离心以迫使API进入到微针腔的尖端中。在一些情况下,向模具中添加黏合剂。再次将模具离心以迫使黏合剂进入到微针腔中。将微针干燥1至3天。将微针从模具中移出并准备使用。在一些情况下,微针包含至少1mg的API。
为了可视化API在微针中的分布,在上述方法中使用分子量为3至5kDa(例如,类似于胰岛素的分子量)和分子量为20至22kDa(例如,类似于一些人生长激素的分子量)的FITC-葡聚糖代替API,并随后使用共聚焦显微镜成像。图42A至42B示出了FITC-葡聚糖在微针中的分布。在一些情况下,FITC-葡聚糖最明显地集中在微针的上三分之一至上三分之二(例如,在尖端)。
如上所述,还用胰岛素作为API制备了微针。在将微针贴片施加至猪的颊间隙之前对其进行成像。在体内在猪(麻醉下)中,将微针贴片插入到颊间隙的不同区域(舌、舌下、颊、唇和腭)中持续不同的时间5、15和30秒。测试了作为对照的微针贴片(在图43中标记为对照(30秒),并将它们仅放置在组织表面的顶部上(例如,使得任何潜在的降解将与放置的表面的湿气而不是组织内部发生的降解相关)。在施加之后再次对所有微针贴片进行成像。
图43示出了在30秒中,微针在猪中的舌、舌下、颊、唇和腭组织上的溶解。实验表明,在一些情况下,微针可在少于30秒,并且在一些情况下,少于15秒或少于5秒的时间内溶解API并将其递送至组织。
如实施例5中所述,再次用胰岛素作为API制备微针。这里,将微针贴片插入离体人组织(例如,人颊)中持续不同的时间5、15和30秒。图44示出了微针随时间的溶解。
实施例13
以下实施例示出了在对象内部的位置处负载有API的微针的体内溶解。
如实施例12中所述,用胰岛素作为API制备微针。在猪体内(麻醉下),将微针贴片插入到颊间隙的不同区域(舌、舌下、颊、唇和腭)和小肠(small intestine,SI)中。在设定的时间(0、2.5、5、7.5、10、15、20、25、30、35、40、45、50、55、60、70、80、90、100、110、120、135、150、165、180、210和240分钟)从量化胰岛素浓度的部位采集血液样品。图45至46示出了在将多种API载量(1.4mg、1.6mg、2.01mg、2.42mg和3.56mg)的微针施加至小肠(图45)和腭组织(图46)之后血液胰岛素浓度的图。
如实施例12中所述,还用人生长激素(hGH)作为API制备微针。在猪体内(麻醉下),将微针贴片插入到颊间隙的不同区域(舌、舌下、颊、唇和腭)和小肠(SI)中。在设定的时间(0、2.5、5、7.5、10、15、20、25、30、35、40、45、50、55、60、70、80、90、100、110、120、135、150、165、180、210和240分钟)从量化hGH浓度的部位采集血液样品。图47至48示出了在将多种API载量(1.75mg、2.35mg、2.13mg)的微针施加至唇(图47)和腭(图48)之后血液hGH浓度的图。
还使用山梨糖醇(例如,糖)作为黏合剂,用hGH制备微针。图49示出了在体内将微针施加至猪的唇之后血液hGH浓度的图。
实施例14
以下实施例示出了包含高单克隆抗体载量的组织接合组件的形成。
将一剂阿达木单抗冷冻干燥并使其经受相对高的压力(高至3mT)和/或相对高的热(高至70℃)。PEG 200K用作黏合剂。进行ELISA测定以确认抗体活性。图50示出了在暴露于高压和高热之后冻干的阿达木单抗的活性的图。
预示的一些示例性实施方案
1.具有包封容量的制品,其具有将自身迅速朝向GI道组织壁的能力。
a.其中所述制品的形状可通过图7中绕y轴旋转的曲线来描述。
b.其中所述制品由可生物降解和生物相容性的聚合物(实例:PCL)或金属(实例:不锈钢)、或其组合制成。
c.其中所述制品有由图7中的x轴界定的2个不同的截面,所述2个不同的截面由具有不同密度的材料制成,密度比为6至16:1。
2.根据实施方案1所述的制品,其中所述制品可以以保持具有孔或进出口(例如,圆柱体、圆锥截面、矩形截面、或其他几何形状)的自扶正能力的方式被挖空。
3.根据实施方案1所述的制品,其中所述制品可容纳由针(空心或实心)或贴片和致动机构制成的药物递送系统。
a.其中致动机构可以是形状记忆镍钛诺。
b.其中致动机构可以是压缩弹簧。
c.其中致动机构可以是重力。
d.其中致动机构可以是膨胀材料。
e.其中针可连接至药物储存器。
f.其中针可由药物制剂制成。
g.其中针可容纳药物制剂。
4.根据实施方案3b所述的制品,其中所述弹簧具有100至250N/m的弹簧常数,被压缩1至5mm,并且涂覆有3.6至6mm的焦糖化蔗糖。
5.根据实施方案1所述的制品,其中所述制品可连接至锚定系统以维持胃滞留。
a.其中锚定机构是钩状针。
b.其中锚定机构是空头陷阱(bear trap)机构。
c.其中锚定机构是黏膜黏附贴片。
d.其中锚定机构是真空吸引。
6.根据实施方案1所述的制品,其中所述制品可通过磁体、化学黏合剂、真空力、或另一种吸引力附接至其他摄入的胶囊。
7.根据实施方案1所述的制品,其中所述制品可连接至电子系统,例如传感器。
a.其中电子系统容纳在制品内
b.其中电子系统被装入另一胶囊中并随后附接至自扶正系统。
8.具有致动机构的装置。
a.其中致动机构可以是形状记忆镍钛诺。
b.其中致动机构可以是压缩弹簧。
c.其中致动机构可以是重力。
d.其中致动机构可以是膨胀材料。
e.其中针可附接至药物储存器。
f.其中针可由药物制剂制成。
g.其中针可容纳药物制剂。
9.根据实施方案8b所述的装置,其中所述弹簧具有100至250N/m的弹簧常数,被压缩1至5mm,并且涂覆有3.6至6mm的焦糖化蔗糖。
10.根据实施方案8所述的装置,其中所述装置可连接至锚定系统以维持胃滞留。
a.其中锚定机构是钩状针。
b.其中锚定机构是空头陷阱机构。
c.其中锚定机构是黏膜黏附贴片。
d.其中锚定机构是真空吸引。
11.粉末状API与黏合剂的经压制和/或经加热制剂,其API载量>10%w/w,其被模制成可穿透的物体。
a.作为微针的穿透物体,其高度为0.3至1.5mm并且基部直径为200um至700um。
b.成形为传统的针的穿透物体,其直径长至1.5mm并且长度长至10cm。
c.形状像弹头状物的穿透物体,其在任何方向上的直径长至2mm。
12.穿透形状,其中API与黏合剂被集中在物体的顶部部分中,并且物体的底部部分为仅黏合剂。
13.由压制用粉末(pressing powder)制成的穿透形状,其具有穿透通过GI组织的结构完整性。
14.由压制用粉末制成的穿透形状,其具有穿透通过皮肤的结构完整性。
15.穿透形状,其中尖端由另一种脆性材料(例如糖)制成。
16.穿透形状,其中通过切削和铣削(milling)现有形状的尖端来创建尖端。
17.通过将API和黏合剂压入到平面内模具中创建的穿透形状。
18.通过将API和黏合剂压入到平面外模具中创建的穿透形状。
19.通过将API和黏合剂压入压丸机内部创建的穿透形状。
20.粉末状API与黏合剂的经压制和/或经加热制剂,其中黏合剂是分子量为5千至1百万的PEG。
21.粉末状API与黏合剂的经压制和/或经加热制剂,其中API是胰岛素或另一种肽。
22.粉末状API与黏合剂的经压制和/或经加热制剂,其中API是核酸。
23.粉末状API、黏合剂与抗黏剂的经压制和/或经加热制剂,其中抗黏剂选自蜡、油和硬脂酸酯,例如硬脂酸镁、硬脂富马酸钠等。
实施例15–锚定机构
以下实施例示出了与本文中所述系统相关联的锚定机构的形成和使用。
本公开内容的该附录讨论了可使用钩状针将装置锚定到GI道的组织壁上的方式。可通过负载的弹簧机构将针从自取向装置推入到GI道中(图51)。存在放置针的最佳途径以使得该装置可以以更大的强度保持在胃中,所述途径包括:穿透深度(图52)和钩尺寸(图53)。例如,32号针需要使组织移位至少1.9mm,以便实际上穿透胃衬壁。这意味着在一些情况下,该装置将针排出此距离以产生钩住作用。如果该装置将针排出的甚至更远,则其将继续进一步穿透组织并维持其对组织的钩持。钩尺寸是指在针的最尖端处的弯曲长度。通常将针削尖到一个细点时,将针有目的地弯曲此点以在末端形成钩。随着该钩变得更大,针的穿透力增大。30um的钩显示出使穿透力与钩入的组织的量平衡的长度。如图54中见到的)。钩抓在胃组织上并为装置提供垂直的保持力。该保持力特别有助于该装置抵抗由于蠕动运动(peristaltic movement)引起的排出。同样使用30um钩状针在人胃上进行了相同的实验,并且显示该装置可钩在组织上(图55)。与猪胃相比,人胃需要稍微更大的插入深度。还显示在猪小肠中也发生钩住(图56至58)。
尽管针尖端上的钩提供了将装置锚定至组织并提供垂直保持力的方法,但胃中的主要力垂直于胃衬壁起作用并来自流体流动。为了对此进行测试,将该系统插入到组织块中,并用探头以恒定力向下按压以确定该装置的水平保持力(图59)。通过将更多的针插入到组织中,相对水平的保持力随着每个另外的针线性增大(图60)。随着针彼此进一步分开,它们还提供了更大的保持力(图61)。针锚定装置具有承受来自流体流动以及探头的力的能力。图62至63示出了模拟胃中流体流动的体外设置。将装置附接至与地面垂直悬挂的组织块上并暴露于0.1m/s的脉动流一周。每个装置只有一个针将其锚定至组织。用直针的装置保持在组织上一天,而用钩状针的装置保持在组织上整整一周。同样在活猪模型中也进行了水平组织测试(图64、图65A)。在两只不同动物中进行的这些实验证明,该装置在体内和离体具有等量的力。平均起来,装置具有0.6至0.8N的保持力并且可在其从组织中逐出之前旋转30度。
由于GI道在其组织的顶部包含厚的高导电性黏液层,因此针杆涂覆有5um的聚对二甲苯层以进行绝缘。仅针的基部和尖端是导电的,从而允许电流流过组织而不是黏液(图66)。整个系统由电源、具有针形探头的自致动装置、以及调节提供刺激的脉冲的微控制器组成(图67)。电力组件必须绝缘以防止短路。所有这些组件都可容易地安装到000号胶囊内部。图68和图69示出了用固定电源改变探头尺寸以及改变探头距离的效果。探头之间的距离极大地影响整个电路的电阻,并因此当电压固定时改变通过系统的电流量。改变探头尺寸出人意料地不会对电流产生很大影响,并且这很可能是由于电路中的主要因素是组织而不是探头这一事实。图70A示出了由植入到组织壁中的最终装置产生的电路的电压测量。与由电路产生的功率相比,图70B中所示的背景噪声是可忽略的。使用微控制器,将电脉冲编程到电路中。该电路是通过使用涂有聚对二甲苯(paralyene)的针,并将其附接至连接至恒压源的自致动系统,并将这些探头插入到组织壁中而创建的。虽然自扶正/自致动系统包含金属底部,但该底部涂覆有聚对二甲苯以使其绝缘。这些图表明,该装置确实可将编程的电流递送到GI道的组织壁中。
钩状针具有一些可能的安全问题。首先,它们必须不使组织穿孔。胃组织约5mm厚,并且小肠约1至1.5mm厚。这些组织二者均是有延展性的,并且在它们被穿孔之前,针可将它们移位的距离大于其深度。对于小肠,针可在来自3个不同猪的组织的样品量(总计n=15)中将组织移位5.9mm±1.1mm。记录的最低值为4.5mm。对于胃来说,很难将组织移位整个厘米,但是如果缓慢进行的话,那么其仍不会将组织穿孔。为了安全起见,理想的是使针保持组织的厚度,尤其是当针快速地穿透时。
针也可以不可降解或降解非常缓慢以便提供胃内滞留的能力。这提供了将针长时间留在组织中的可能性。然而,GI道中的组织更新非常快速,因此会及时迫使针离开组织。只要针仍然附接至装置,也可使用检索方案来检索它们。例如,可通过内镜检查将装置移除,或者可使用宿主/客体相互作用将其附接至另一吞咽装置,例如黏性水凝胶。
最后,如果针与装置分离或者当装置与组织脱附时,则装置必须安全穿过GI道。在文献中已注意到,长度小于1cm的一维物体尖锐物体不会造成穿孔的危险。通常来说,如果针的长度小于1cm,则穿孔的风险很小。然而,在一些情况下,安全性和穿孔的理想长度可取决于组织的类型、对象的类型(例如,动物、人)、以及组织的位置,并且在一些情况下,可以大于1cm。
预示的实例
1.使用钩锁定(latch)在GI道的组织壁上的装置
2.所使用的钩为10至250um长,最佳为约30um
3.钩穿透到组织中1至3mm
4.钩间隔至少1.5mm
5.钩不可降解
6.包含钩的针的长度小于1cm
7.每个装置可使用多于1个钩。
8.钩提供垂直保持力
9.插入的物体提供水平保持力
10.金属针可用于电刺激
11.电路可由具有2个针形探头的1个装置或各自具有一个针形探头的两个装置制成。
12.整个装置设置可安装在000号胶囊内并被摄入。
13.由于胃衬壁脱落(slough off),该装置的保留是暂时的。
在人以及数种动物如猪中,胃位于食管的末端,食管是与口连接的长的纤维肌管,食物在此进入GI道。胃是人体食物消化的主要场所,是提供1至4小时的高驻留时间的重要空间。为了消化食物,胃包含创造低pH环境的胃酸以及将其分解为氨基酸的许多酶,例如胃蛋白酶。通过肌肉运动,胃在其内容物上施加约0.2N的平移力,这有助于溶液运动。一旦食物已充分降解,其就通过幽门括约肌进入到十二指肠中以到达小肠。为了保护自己免受恶劣内环境的影响,胃的内表面具有40至450μm厚的黏液涂层。黏膜下方是黏膜肌层,其是由平滑肌纤维构成的薄层。黏膜肌层将黏膜与黏膜下层分开,黏膜下层覆盖了用于收缩的胃的主要肌纤维。
为了使针穿透胃衬壁,设计了系统以确保其放置。根据冈布茨的理论,先前已设计了自扶正的状使得该装置可用面朝下的针使自己在胃酸中倒置。该装置本身由两个不同部分组成,较重的底部部分由不锈钢制成,而顶部部分由聚己内酯(PCL)制成。附接至涂覆有糖的压缩弹簧的针位于装置的中央。一旦糖溶解,弹簧就充当自动喷射器,其将针从装置内部弹出使得其可将自身插入到肌肉衬壁中,如图51中所示。为了增大针的保持能力,使用Instron机器弯曲针的尖端,在针上施加1N的力,如图51中所示。创建了位于针的末端的这个钩以帮助针锁定在窦附近的远端胃中的肌纤维上,如图54中所示。
为了确定将针从胃衬壁逐出所必需的最大力,使用猪组织创建离体模型,因为猪的胃肠道已显示是其人对应物的良好模型。为了证实这一点,进行了初步的离体实验。为此,从约克夏猪(Yorkshire pig)的胃中解剖出10cm×10cm的组织切片。然后将猪组织固定在两个丙烯酸板之间,其中在板下胃的内表面朝上,所述板在其中央包含约3cm直径的孔。然后将这些板放置在由运动臂构成的Instron机器上,该运动臂包含精确到0.1mN的力传感器。在这个Instron臂上,将黏附在螺钉上的不锈钢钩状针固定在适当位置。为了确定穿透组织所需的力,将Instron臂以0.1mm/秒的恒定速率降低直至达到5mm的深度,同时该装置记录了达到该层所需施加的钩力。然后使用来自人尸体胃的组织重复该实验。如图52和图55中所示,与猪试验相比,人胃表现出非常相似的特性并产生了几乎等同的结果。
由于猪组织被证明是其人对应物的强有力模型,因此进行了类似的实验来确定理想的穿透深度以使保持力最大化。为了确定理想的穿透深度以使保持力最大化,将Instron臂以0.1mm/秒的恒定速率降低直至达到穿透到组织中1mm、3mm或5mm。在该实验中,Instron记录了为了达到该穿透层所需施加的钩力,如图56中所示。
为了验证这些测量值以及确定哪个组织层使钩力最大化,在使用之前将针用外科染料染色。一旦实验完成,就将组织固定至石蜡。通过每10微米进行一次平行的侧向切割来切开组织发现针穿刺部位。一旦确定其位置,就在倒置显微镜下分析该部位以确定穿透深度。这些组织学发现还证实,针已锁定在胃衬壁中的黏膜下的黏膜肌层中的肌纤维上。
最后,为了确定逐出锚定在胃衬壁中的针所需的力,进行了类似的实验。将黏附至螺钉的不锈钢钩状针附接至Instron的移动臂。然后将该臂以0.1mm/秒的恒定速度降低直至针穿透2.5mm进入到固定的新鲜猪组织中。一旦达到该距离,就以0.1mm/秒的恒定速率抬起臂直至针从组织上脱附。通过该实验,Instron记录了穿透深度和从组织中移出针所施加的力。重复该实验数次,发现穿透组织和逐出针所需的平均力分别为平均3.86mN和10mN。
由于逐出在胃衬壁中锚定的针所需的力确定,以及确认了猪组织表现出与人胃类似的特性,因此创建了计算模型来确定具有钩状针的自扶正装置保持其在人胃中的位置的能力。此外,该模型确定了可设计用于多种应用的具有可变数目的辅助体的自扶正装置是否能够进行胃滞留。
根据文献,发现胃中的特征流体流动为2至3mm/秒,而其雷诺数(Reynoldsnumber)已确定为大约0.1至30。该雷诺数表示胃内的流动是层流并由黏滞力支配。斯托克斯定律(Stokes’law)是针对黏性流体中的小球形物体建模的纳维-斯托克斯方程(Navier-Stokes equation)的推导,于是其可用于确定施加在装置上的拖拽力(drag force)。方程1中示出了此表达式,其中F是拖拽力,r是装置的半径,v是液体的速度,并且μ是液体的动态黏度。
F=6π*r*v*μ 方程1
为了使用该方程,必须找到胃酸的动态黏度。根据文献,基于胃消化物的流变性质,胃酸的动态黏度可有极大的变化。如果摄入10%的葡萄糖溶液粉,则可将胃内容物建模为黏度为10
使用附接至4mm针的自扶正装置的半径,方程1中所示的斯托克斯方程可用于确定施加在装置上的拖拽力。如使用方程2所示,此拖拽力确定为2.26*10
F=6π*0.004m*0.003m/s*0.001Pa.s=2.26*10
如先前所示,由于此力显著低于通过使用Instron的离体实验所确定的逐出装置必需的力,因此其允许使用外科手术不可吸收缝合线将单独的辅助体附接至自扶正装置的能力,所述缝合线可用于应在第4章中讨论的一系列应用。利用方程1计算这些装置上的拖拽力,所述装置可能具有4.5mm的最大半径以充裕地适合于00号胶囊,可发现每个装置的拖拽力为2.54*10
在确定将针从胃衬壁逐出所需的条件时,考虑扭矩也很重要。利用见于自扶正装置和辅助体的力,可使用方程3计算扭矩,其中τ是扭矩,r是矩臂,并且F是力。
τ=rxF 方程3
使用此方程,其中矩臂是从组织到装置底部的针长度(1.25mm),然后可创建图。如图65B中所示,创建了图用于将附接至自扶正装置的辅助体的数目与由拖拽力施加的扭矩进行比较(红色虚线表示在逐出针之前可在系统上施加的最大扭矩。该值由在Instron上进行的离体实验中将针逐出所需的力确定,同时使用将从组织到装置底部的针长度1.25mm作为矩臂)。然而,如该图中所示,即使具有9个辅助体的装置也只能承受比将其逐出所需的扭矩小数个数量级的扭矩。
从图65B,可确定的是,拖拽力拖拽扭矩仍然比将装置从胃衬壁逐出所需的扭矩小数个数量级。然而,如前所述,由于动态黏度不考虑食物作用,因此必须创建第二模型。在咀嚼过程中,食物被磨碎成小球形食物团块(bolus),其随后沿食管下行至胃。一旦这些团块到达胃,它们就与胃酸混合以形成食糜。使用筛分和激光衍射测量,研究已表明,在不同个体中,这些经咀嚼颗粒的大小根据所摄入食物的质地而变化。例如,生蔬菜产生的团块平均大于2mm,而多于一半的坚果颗粒直径小于1mm
由于食物团块大小的这种大变化,因此创建了模型来确定它们是否能够在与自扶正装置的撞击上施加足够大的扭矩以将其逐出。应该注意的是,该模拟是在假定没有辅助体附接至装置的情况下创建的,然而,除其自身拖拽力外,针还必须克服来自食物团块的扭矩。为此,假定食物密度为1000
由于穿透深度和逐出力的初步测量结果确定,除使用计算模拟验证该装置可抵抗胃中存在的力之外,还设计了实验来测试其保持能力。本章将讨论体外以及体内试验,这些试验是充分模拟胃状况以确定该装置是否可抵抗逐出所必需的。
为了测试微柱尽管受到来自胃流的拖拽力的作用但仍能保持其在胃衬壁中的位置的能力,设计了体外实验。为此,将聚乙烯(Tygon)PVC管连接在一起以创建附接至水泵的闭合回路。从约克夏猪的胃解剖10cm×10cm的组织切片,并将其固定至与地面垂直的管内部。然后将具有钩状针的3个自扶正装置放置在该组织的顶部。另外,还将具有不带钩的针的3个自扶正装置、不具有针的3个自扶正装置、以及与自扶正装置相同尺寸的3个球形物体放置在组织上作为对照。然后将水引入系统,并打开泵以0.1m/s泵送流体。图57示出了如何进行该实验。
将系统运行一周以确定与钩状针的对应物相比钩状针承受流体流动的能力。如图58中所示,当所有对照在第2天之前被逐出时,具有钩状针的自扶正装置能够在整周内保持其位置,以验证计算模拟的结果。
由于来自合成胃实验的阳性结果证实了计算模拟的预测,因此针对猪模型设计了多日体内试验。使用外套管(overtube),将具有钩状针的4个自扶正装置以直线放置在胃的右侧。将具有常规针的另外4个自扶正装置以类似的布置放置在胃的左侧,以便可将它们区分开。在第2天和第3天时,使用内镜监测是否有任何自扶正装置移动。然而,在进行实验时,所有装置,无论是带钩的还是不带钩的都无法在胃中保持其位置。
对于装置为何在猪胃中被逐出有数种可能的解释。为了确定该装置是否不如预测的计算模型那样具有弹性,必须在体外进行进一步的实验以表征其保持能力。这些实验中的数个方案将在第4章中进行描述。然而,逐出也可能是由于人胃和猪模型之间的差异,例如运动性。与在胃中消化食物1至4小时的人不同,猪可能需要花费超过6个小时的时间才能将餐食传递到小肠中
通过在Instron机器上进行的离体实验,确定了穿透胃衬壁所需的力、确保最大保持力所必需的深度、以及移除钩状针所需的力。创建了两个计算模型,以利用该数据来验证具有钩状针的自扶正装置即使受到胃状况及相关影响也能够保持其位置。为了模拟拖拽力,进行了体外实验以确保自扶正装置在暴露于流体流动时不会被逐出。有了这项实验的积极结果,使用猪模型进行体内试验,然而,经过多天的研究,没有一个钩状针设法保持其位置。
胃衬壁中微柱的长期保留可能会产生许多应用。如前所述,它将允许传统上必须每天施用的药物(例如,胰岛素)的延长递送。这也将为由于胃环境中的酶促降解而在传统上必须注射的生物药物的经口递送提供一种可行的方法。
这样的微柱可充当传统上无法在GI道中维持高停留时间的其他装置在胃中的锚。这些装置可使用不可吸收缝合线附接至自扶正装置,并作为辅助体坐在胃中。一种潜在的应用可能是用于医疗监测的蓝牙低功耗。这项技术创造了不断发展的领域,其有望帮助医生和健康工作者在家监测其患者的病情。因此,可装入到00号胶囊中的小蓝牙监测器可与长期的针保持装置组合以监测胃中的不同特性,例如pH或温度变化。最后,已显示胃电刺激有望处理数种临床问题,例如胃轻瘫和肥胖。如果附接至自扶正装置的辅助体是创建的多针系统中的电池,则可与胃衬壁一起产生可有助于这种刺激的电路。
图51:用于组织定位和弹出钩状微柱的自扶正系统的示意图。左侧示出了带钩的32号不锈钢针的一个实例
图52:使用钩状微柱穿透猪胃组织显示,对于23mm钩和30mm钩二者,1.9mm的深度需要最大的穿透力
图53:使用钩状微柱穿透猪胃组织显示,当钩30mm长时,使用1.9mm和2.4mm钩使逐出自扶正系统所需的力最大化
图54:已自身附接至猪胃组织的肌纤维上的钩状微柱
图55:使用钩状微柱穿透人胃组织显示,当穿透深度为5mm时,使从身体和窦(antrum)组织逐出自扶正系系统所需的力最大化
图56:使用钩状微柱穿透猪小肠组织显示,在穿透1.5mm之后逐出自扶正系统所需的力达到稳定
图57:使用钩状微柱穿透猪小肠组织显示,在穿透1.5mm之后组织可提升的高度达到稳定
图58:已自身附接至猪小肠组织的钩状微柱
图59:水平组织保留测试模型。探头向下按压在通过针锚定在组织上的装置上,并记录逐出该装置所需的力。
图60:显示出,逐出自扶正系统所需的力随插入到猪胃组织中的针的数目线性增大
图61:显示出,当其三个针间隔较远时,从猪胃组织逐出自扶正系统所需的力在统计学上显著增大
图62至63:A)说明体外实验设计的图,其中自取向装置在经历脉动流的同时锚定在猪胃组织上(图62)。该图显示了具有钩状微柱的三个装置在整整一周内保持其位置,与在两天内被逐出的其他系统相对(图63)。
图64:该图说明了自取向装置对体内和离体猪胃的锚定力没有统计学显著性差异。离体测量反映了使用来自不同胃的三个分开的组织样品进行的研究。
图65A:使用猪模型说明体内的图,当锚定的自取向装置遇到与胃组织平行的力时,其可保持其位置,同时旋转多至30度并经历0.5N至0.75N的力。峰和谷是动物呼吸的结果。
图66:说明聚对二甲苯涂覆的电探头如何绕过黏液并通过组织传导电的示意图。没有涂层的情况下,电将流过较低电阻的黏液而不刺激组织。
图67:说明电刺激丸剂的图,该电刺激丸剂包含含有两个探头的自取向装置以及包封在绝缘壳(例如PDMS)中的电源和可编程微控制器。该系统使用绝缘线连接在适当的电路中。该电路通过组织完成。整个系统可包装在000号胶囊中。
图68:该图示出了当由两个氧化银电池(1.55V,6.8mm纽扣电池)供电时,电流不会随着组织刺激性电探头的半径增大而显著变化。
图69:该图示出了当由两个氧化银电池(1.55V,6.8mm纽扣电池)供电时,电流随着组织刺激性电探头之间距离的增大而减小。
图70A和70B:由电压发生器提供动力的电探头通过组织提供了脉动刺激,如通过示波器所测量的(图70)。其可与在组织内测量的背景电压进行比较(图70B)。
实施例16–示例性系统(SOMA)
以下实施例示出了本文中所述的示例性自扶正系统的制造和设计。
示例性系统(SOMA)的自取向能力有助于确保将装置正确放置以将微柱插入到组织壁中,并且在一些实施方案中,其通过以足以仅到达黏膜下层的力递送微柱来解决与插入相关的安全性和效力问题。胃的天然生物学在插入事件过程中提供了广泛的安全范围(safety margin);表明,在一些情况下,微柱将使用多于4牛顿的另外的力来穿透通过下一组织层,外层肌。SOMA由在大鼠和猪二者中都经过生物相容性测试的材料制成,并且其小形状因子(form factor)通常防止下GI道阻塞。SOMA的体积比经FDA批准的每日给药的OROS系统
设计了优化为迅速自取向的单-单静态体,其具有在达到稳定点时抵抗外力(例如,流体流动、蠕动运动、运动)的能力(图71A至71D)。例如,被称为头胸甲(carapace)的龟甲(tortoise shell)的上部具有高的曲率以帮助自取向,而被称为胸板(plastron)的下部具有较低的曲率以提高稳定性。龟的软组织占据了壳的下部区域,使质心朝着胸板移动并进一步稳定了优选取向。由于自取向装置与其体积中心相比通常依赖于低的质心,因此使用聚己内酯(PCL)和316L不锈钢的组合以产生密度梯度。类似的密致材料例如聚丙烯和菲尔德金属功能在体外原型加工过程中可互换使用。由于不锈钢通常不用于经口装置,因此在急性和亚慢性研究二者中都对其在大鼠中的经口毒性进行了评价。观察到没有炎症或毒性迹象(图75),这与对GI空间中对不锈钢的其他研究,包括在牙套(dental brace)上的研究一致。
利用MATLAB的fmincon函数,设计了由极坐标(r,θ)中的平面曲线C描绘的轴对称形状,该形状使物体从36个不同角度朝向GI道组织壁所需的平均时间最小化,同时使得使装置从其优选取向倾斜所需的扭矩最大化。使用牛顿角运动方程(Newtonian angularkinematic equation)计算理论取向时间,如下所述。作为形状的初始猜测,采用了龟甲的几何模型,该模型将双曲线表示头胸甲与低曲率弧表示胸板组合。模仿龟的质量分布,装置的上部在模型中被挖空并用于容纳致动机构和API微柱。另外,装置被缩放成具有相对较小的体积。
将制造版本的优化形状与高致密球体和椭圆体进行了比较。在体外用高速摄影进行自取向和失稳定化测试以验证计算机建模(图72A)。最佳形状在所有可能取向中的69%中取向最快,并且取向平均起来比其他形状更快(图72B)。在理想的环境中,该装置可在少于100毫秒的时间内从所有起始角度中的85%以上达到其优选取向。当放置在可见于GI道中的液体(例如油、胃液、黏液和水)中时,与椭圆体相比,优化的装置由于黏性作用而显示出更小的减速(deceleration)(图72C)。与其他形状相比,该装置在取向至其优选状态之后还显示出强大的回弹,因为当暴露于在以50rpm的倾斜摇床上与+/-15度的偏移混合时,其倾斜了不超过一度(图72D)。
确定最终形状之后,对于自取向和黏膜接合的持久性,在猪胃的离体实验装置中进行了300次测试,以及在禁食动物中在体内进行了60次测试。通过动物模型的180度旋转和30度倾斜进行了体内模拟的步行和广泛的运动压力测试。为了测量适当的装置取向,在腹部搅动之后对猪进行内镜检查(图72E),并对猪进行X射线拍摄(图76)。在每次试验中,优化的装置均以100%取向,而相同形状的对照装置在时间内做出仅PCL以50%取向。当立即向猪给药6个SOMA原型时,发现没有GI阻塞或其他不良临床效应的证据(图77)。通过使用具有在体内快速且一致的自取向能力的装置,通常在组织方向上发生药物递送致动事件。
在创建了定位系统之后,制造了装配式(fabricated)压缩的API微柱。与液体或溶剂浇铸制剂相比,压缩固体制剂每单位体积递送多至100倍的更多的API。通过在550MPa的压力下压缩80%人胰岛素与20%200k分子量聚环氧乙烷(PEO)的混合物,将0.5mg胰岛素负载到量出高度为1.7mm并且直径为1.2mm的尖锐锥形结构中。并将其附接至由可降解的生物相容性聚合物(例如,PEO和羟丙基甲基纤维素)制成的杆(shaft)(图73A至73B)。
机械和化学表征研究确保了微柱的稳定性。压缩微柱的拉曼光谱揭示了在高压暴露之后在整个微柱尖端均一的API分布并验证了API的蛋白质结构(图78,表1)。压缩测试测得的杨氏模量为730+/-30MPa,类似于PEO的杨氏模量,并且极限强度为20.0+/-0.7MPa,确保在存在外力的情况下微柱的完整性(图79)。体外溶解曲线表明在60分钟内完全溶解(图80)。在40℃下进行的稳定性研究表明,固态胰岛素和PEO微柱在干燥的环境中持续16周保持稳定,维持大于80%纯度和小于5%高分子量蛋白质(high molecular weight protein,HMWP)形成(图81)。这与液体制剂的稳定性为4周形成对比。使用相同的压缩概念,微柱由100%胰岛素制成,由于缺乏黏合剂,尖端和杆二者均完全由胰岛素构成。SOMA中利用了100%胰岛素微柱以提高插入有效负荷。
表1
评估了在体内胰岛素微柱在猪胃组织中的插入概况。使用定制的可控台(controllable stage)以0.2mm/s的速率将尖端插入(图82),并且通常使用约1N的力以使组织移位超过7mm(图73D)。使用该测量值作为边界条件,以能够将负载药物的微柱插入到胃组织中而不会引起穿孔的力将延时致动机构实施到SOMA中。将弹簧用作动力源,是因为例如其空间需求小并且其能够几乎瞬间沿一个轴释放能量。SOMA负载有不锈钢弹簧,其在完全压缩时提供1.7至5N的力(k=0.1至0.5N/mm)。弹簧将微柱加速1mm,并随后将其插入到组织中5mm。致动之后,它们保留在装置内部。将来自SOMA插入事件的组织学结果与来自用染色的Carr-Locke针手动插入的体内猪胃的组织学结果直接进行比较(图73E)。微计算机断层扫描(computed tomography,CT)成像确定,弹簧可将负载硫酸钡的微柱从SOMA推进到离体猪组织中多至2mm(图73C)。来自原位实验的组织学表明,胰岛素微柱在用5N弹簧从SOMA弹出后插入到猪胃组织的黏膜下层中(图73F和73H),达到与Carr-Locke针相同的深度。为了确保插入力的安全边缘,使用9N钢弹簧(k=1.13N/mm)将不锈钢微柱弹出到离体猪组织中。即使具有另外的力和动量,不锈钢微柱也不使组织穿孔(图73G和图73I)。
为了为致动事件在胃而不是在嘴或食管中发生安排时间,将结晶糖和类糖材料(例如,蔗糖和异麦芽酮糖醇)确定为可用的弹簧包封材料。物质的脆性性质使得例如在涂层的直径溶解至临界尺寸之后的1毫秒时间内弹簧完全释放。通过COMSOL中的模拟和体外实验,证明了调整和释放弹簧的能力在4分钟的时间跨度内,标准偏差为11.4s(图83A至83E)。整个弹簧致动系统可容易地装入到SOMA的空心部分中,同时位于弹簧上方的孔允许胃肠液渗透并到达包封材料。
向猪施用胰岛素负载的微柱,并在2小时的过程内测量血糖和胰岛素水平。经由SOMA胃内递送并且经由手动注射皮下递送,插入到组织中的微柱以接近零级的动力学速率释放(图74A至74D)(n=5)。还进行了剖腹术和开胃手术以手动地胃内放置微柱,并且该递送方法产生了与SOMA相当的药代动力学吸收(图84A至84D)。在整个采样期间,猪血浆中的人胰岛素水平保持在10至70pM的范围内。如通过重量测量和组织学估计的,由PEO 200k和人胰岛素制成的手动插入的微柱以及由100%人胰岛素产生的SOMA递送的微柱浸没在组织下方的280±20μg API。所有微柱插入的方法均产生血糖降低作用,并且与皮下给药的微柱相比,胃内插入的微柱提供更明显的下降。将该数据与利用了SOMA的研究进行比较,所述SOMA设计成将微柱定位至胃壁而不将其插入到组织中(n=5)。接受非插入SOMA的猪未见到胰岛素吸收或血糖降低作用。所插入微柱的接近零级动力学释放速率表示了将它们用作可植入药物储存器的可能性,并且这些制剂在更长的时间内释放API的能力保持不变(图84A至84D)。当插入1mg或更大的API时,微柱在至少30小时过程中继续在皮下空间释放API(n=6)。这通常可使得能够降低给药频率。
微柱
SOMA通常提供经口递送API(例如,胰岛素)的方式,并且还显示了与其他API一起使用的潜力。由于一些微柱制造方法使用高量的压力,因此递送的分子应在这样的应力下保持活性。对用溶菌酶和葡萄糖6-磷酸脱氢酶制造的微柱的活性测定表明,多种API在制造过程之后维持其活性(图85A至85D)。另外,可递送剂量受进入到胃黏膜中的微柱的体积限制。虽然提高穿透深度和微柱的宽度将分别允许剂量容量的一级和二级提高,但这可能会损害胃黏膜屏障并提高穿孔的风险。SOMA代表了潜在递送广泛的生物药物的平台,所述生物药物包括但不限于:基于其他蛋白质和核酸的生物药物。用这种新技术实现的药物递送效力表明,该方法可取代传统的皮下注射胰岛素,并证明进一步评价其他生物大分子是合理的。
材料和方法
Dulbecco的磷酸缓冲盐水(PBS)购自Gibco by Life Technologies(Woburn,USA)。人胰岛素获自Novo Nordisk(Maalov,Denmark)。200,000分子量PEO、45,000分子量聚己内酯(PCL)和蔗糖购自Sigma Aldrich(Saint Louis,USA)。301钢弹簧由MadsensFjedrefabrik(Brondby,Denmark)定制制造。这三个定制制造的弹簧具有表2中所示的规格。1.7N弹簧购自Lee Spring Company(Brooklyn,USA)并且序列号为CI008B05S316。异麦芽酮糖醇购自CK Products(Fort Wayne,USA)。
表2
装置制造:
在Solidworks(Dassault Systemes,Velizy-Villacoublay,France)中设计了作为两部分的阴模(negative mold),并将其在Form 2 3D打印机(Formlabs,Somerville,USA)上打印用于椭圆体、球体和SOMA顶部部分。每个装置设计成具有0.77g的重量,其中88%的重量由不锈钢构成并且所得重量由PCL构成。将PCL顶部部分以熔融状态浇铸到阴模中以形成装置的顶部(top section),并使用铣床由316L不锈钢制成底部部分。
然后使用熔化的PCL将弹簧固定至装置的顶部,并使用PCL再次将负载药物的微柱附接至弹簧。最后,使用PCL将装置附接在一起。
在制造不锈钢部件之前,用购自Alfa Aesar(Haverville,USA)的菲尔德金属制成原型模型。这种金属合金的低熔点使得其易于装置制造,并且其7.88g/cm
糖弹簧包封:
在具有三个不同直径(4mm、5mm和6mm)的孔由SYLGARD 184弹性体套件(DowChemical,Midland,USA)制成的模具(图86)中,将蔗糖加热至210℃持续15分钟。将弹簧放入装有熔化的蔗糖的模具内,并在烤箱中对其进行焦糖化持续另外5分钟。从烤箱移出模具,并使用定制的柱塞将弹簧压缩到蔗糖中,并将蔗糖弹簧冷却,然后从模具中移出。用相同的方法制造异麦芽酮糖醇弹簧,但是材料没有焦糖化。
胰岛素微柱制造
如本文中所述和图73A所描绘的制造胰岛素微柱。
在多种流体中的自取向实验
为了计算装置的扶正速度,使用Vision Research Phantom v7.1单色高速摄像机(Vision Research,Homewood,USA)以1000fps进行记录。将由PCL和菲尔德金属以及PCL和316L不锈钢制成的SOMA从90°角释放,同时浸入在以下流体之一中的2×5×10cm
切离的猪胃中的自取向实验
用于离体评价的猪组织获自Blood Farm Slaughterhouse(West Groton,USA)。对猪实施安乐死,并取得新鲜组织并储存在冰上。在安乐死的6小时内对组织进行测试。为了确定装置在胃中的取向效率,将完整的约克夏猪胃定位成悬挂状态使得食管括约肌和幽门括约肌升高到胃体上方。然后将长为12.7cm并且直径为1.9cm的聚乙烯管插入到胃的食管括约肌中并抵靠其夹紧,以模拟食管。然后,将胃用水装满,并使装置通过管落下并进入到胃中。通过在胃的最上面的截面(小弯(lesser curvature))上切开的窗口,评估装置以确定装置的期望侧面是否与组织壁接触。该实验是用由仅PCL制成的SOMA形状,以及由菲尔德金属和PCL、以及316L不锈钢和PCL制成的SOMA形状进行的。另外,还测试了椭圆体和球体装置。
对外部运动的抗性的测试
通过将装置浸没在500mL锥形瓶(Erlenmeyer flask)内的水中并在以50rpm使用15°倾斜的倾斜摇床上时对它们进行记录,在体外测试对外部运动的抗性。使用Image J在逐帧的基础上评估连续镜头(Footage),并通过确定在一个倾斜周期内装置的轴向平面与摇床平面之间的最大角度来计算倾斜角。
体内模拟步行测试
所有动物实验均经MIT动物护理委员会(Committee on Animal Care at MIT)批准并据此进行。雌性约克夏猪获自塔夫茨大学(Tufts University)(Medford,USA)进行体内实验。使用外套管向猪饲喂两种装置。一种装置是SOMA,而另一种装置具有与SOMA相同的形状但完全由PCL制成,包含用于X射线可视化目的的钢垫圈。将猪近尾部地和侧面地移动,并从左侧侧面向右侧侧面滚动两次。接下来,将猪放回桌子上并滚动180度。最后,拍摄X射线以使装置的取向可视化。将这些X射线与将装置以已知角度放置的体外X射线进行比较。由于猪的胃包含不同的曲率,因此如果装置位于X射线垂直平面的30度以内,则认为该装置是经取向的(图76)。
体内针穿透力测试
构建专门的台以测试在体内力插入曲线(图82)。该装置由线性组成,该线性以0.2mm/s的受控速度朝组织块向下移动。测力计和摄影机放置在移动台上。当针穿透组织时,力和影片测量以及视频传送都在LabVIEW中记录下来。如“In vivo Insulin DeliveryEvaluation”方法部分中所述使约克夏猪镇静。进行剖腹术操作以接近胃表面黏膜。使胃组织反射以显示出至少7.5x 7.5cm
胰岛素微柱体外溶解
将三个50ml的Falcon管用2mL PBS填充,并在37±0.1℃下孵育。在测试开始时,每个Falcon管中都浸没了一个胰岛素微柱尖端。将包含管的架子放置在设定为37±0.1℃和50rpm的Innova 44Shaker系列培养箱(New Brunswick Scientific,Edison,USA)中。
每三分钟对管进行取样一次直至经过15分钟为止,并随后每5分钟取样一次直至经过60分钟为止。在这些次中的每一次,都从培养箱中移出试管架并将200μL溶液吸移到HPLC小瓶中。然后,在37±0.1℃下将200μL的PBS吸回到管中。将试管架重新插入到培养箱中。还从在37±0.1℃下孵育的纯PBS小瓶中收集空白参考样品。
使用从以下论文中检索到的方法,对运行时间进行了修改,在HPLC机器(Agilent,Santa Clara,USA)中对HPLC小瓶进行测试以确定在给定时间溶解的胰岛素的量。简单地说,使用7.8×300mm
胰岛素稳定性测试
将胰岛素微柱尖端放置在干的丸剂容器内,并留在设定为40℃和75%相对湿度的气候受控室内。将相同批次的微柱尖端放置在5℃和15%相对湿度的气候受控室内。另外,将以4mg/mL的浓度溶解在PBS中的纯胰岛素的液体制剂也放置在两个气候室内。将样品放置0、2、4和16周。一旦移出,除高分子量蛋白质(HMWP)分析、活性测试和拉曼光谱分析之外,还对微柱进行了溶解测试。在标题为“拉曼光谱”的稍后章节中对拉曼分析进行了描述,同时使用“体外溶解”章节中所述的HPLC方法进行HMWP分析,并且使用受体结合测定进行活性测试。简单说来,对来自微柱的人胰岛素进行了闪烁迫近测定(scintillation proximityassay,SPA),并通过来自微柱的人胰岛素与SPA中[125I]TyrA14标记的胰岛素的竞争对结合受体亲和力进行验证。使用四参数逻辑模型分析亲和力,并将结果与未经处理的人胰岛素进行比较。
拉曼光谱
使用DXRxi EM-CCD拉曼成像显微镜(ThermoFisher Scientific,Waltham,USA)对胰岛素和PEO压缩混合物进行成像。将样品暴露于780nm波长的激光,功率为24mW并且频率为200Hz。激光束通过20x NA0.40物镜聚焦,并通过该物镜收集散射。在进入配置有400线/mm光栅的光谱仪之前,通过边缘滤器阻挡瑞利散射和反斯托克斯散射(Rayleigh andanti-Stokes scattering)。以每个尺寸5μm的扫描步长扫描200×200μm
酶活性测定
如上所述制造了微柱尖端,但是不是使用胰岛素作为有效成分,而是使用了来自鸡蛋的溶菌酶(Sigma Aldrich)并将在大肠杆菌(E.coli)(G6PD)中表达的葡萄糖-6-磷酸脱氢酶作为API(Sigma Aldrich)。为了在G6PD上进行活性测定,使用了活性测定试剂盒(Sigma Aldrich),该试剂盒测量氧化的葡萄糖-6-磷酸的量。使用40% G6PD和60% PEO200k制造了3个微柱尖端,并将它们全部溶解在一起进行测定,并随后与未压缩到微柱尖端中的G6PD进行比较。对溶解的溶液进行重复测定。
为了测量溶菌酶的活性,使用由Sigma Aldrich提供的测定,该测定测量了裂解的溶壁微球菌(Micrococcus lysodeikticus)细胞的量。简单地说,将50mM磷酸钾缓冲液中的200单位/mL溶菌酶溶液添加至相同缓冲液中的0.015%[w/v]溶壁微球菌细胞悬液。在5分钟中在A
体内胰岛素递送评估
为了评估胰岛素微柱制剂,通过三种分开的方法将API制剂施用于大动物模型(雌性约克夏猪,35kg至65kg):通过SOMA装置的胃内注射(I.G.);手动I.G.;以及皮下注射(S.C.)。选择猪模型是由于GI道与人的解剖学相似性以及其在GI道、装置评价中的广泛使用。实验期间未观察到不良作用。为了递送SOMA装置,在操作之前将猪置于流质饮食24小时并将猪禁食过夜。用肌内注射特拉唑尔(Telazol)(替来他明(tiletamine)/唑拉西泮(zolazepam))(5mg/kg)、赛拉嗪(xylazine)(2mg/kg)和阿托品(0.05mg/kg)使猪镇静,并且如果需要的话通过面罩补充异氟烷(氧气中的1%至3%)。在胃内镜的引导下放置口胃管或外套管,并将其保留在食管中以使装置的通过变得容易。将SOMA装置通过外套管并放置到胃中。尽管猪被禁食,但在SOMA递送过程中,一些猪在其胃中仍然有食物。从样品中将从这样的SOMA装置收集的血液样品丢弃,所述SOMA装置在致动之后落在食物上或未注入其药物有效负荷。在指定的时间点通过中央静脉线获得血液样品,所述时间点包括但不限于前两个小时的每10分钟、2至4小时的每30分钟、以及6、12和24小时时。使用LifeScan Inc.(Milpitas,USA)的OneTouch Ultra血糖监测仪立即测试血液样品的葡萄糖水平。将另外的血液收集到乙二胺四乙酸K3管(Sarstedt,Numbrecht,Germany)中,并以2000相对离心力(Relative Centrifugal Force)离心15分钟。将收集的血浆在干冰上运输用于分析。简单地说,同质珠测定使用针对人胰岛素的两种单克隆抗体,产生接受体珠、胰岛素和供体珠分层。这生成了与胰岛素浓度成比例的信号。该测试对人胰岛素具有特异性,并且不检测其他内源性胰岛素(图87)。
通过使用18G针在猪皮肤上产生3mm深的导向孔(guide hole)并将微柱放置在导向孔中皮下递送胰岛素微柱。通过剖腹术操作过程中的胃内注射递送微柱,在所述操作中使用3cm切口进入胃黏膜,并将微柱手动插入到胃表面上皮中。血液样品和镇静以与上述相同的方式进行。
使用来自原位实验的组织学结果估计通过SOMA装置插入到组织中的胰岛素的量(图73F)。由于SOMA微柱杆和尖端由100%人胰岛素制成,因此并非所有API都被视为有效负荷。评估微柱插入深度,并将其用于计算浸没在组织中的微柱的体积。然后,将这个体积乘以微柱的密度以估算所递送的API的量。通过由80%人胰岛素和20% PEO 200k制成的人工放置的微柱递送的人胰岛素量假定为并入的API的100%,因为整个微柱均已插入到组织中。
体内保留和安全性评价
使用外套管将六个SOMA放置在猪的胃中,所述SOMA具有永久固定的32G不锈钢针从装置底部向外突出3mm。当这些装置仍处于胃内部时,模拟该装置在体内时可能经历的平移猪运动(以模仿“模拟行走测试”方法章节中所述的外力)。然后进行内镜检查以检查由针引起的任何出血。随后进行每日射线照片(radiograph)以确定装置的驻留时间。拍摄X射线直至所有装置通过。另外,在保持装置期间,对动物进行临床评价以评价其正常饲喂和粪便模式。
大鼠毒性试验
急性毒性研究:对三只大鼠(Charles River Labs,Sprague Dawley体重为400至450g)一次给以2000mg/kg的直径测量为100至300μm的不锈钢颗粒(McMaster CarrElmhurst,USA)(在1mL大豆油(Crisco Orrville,USA)中)。将这些大鼠与仅给以1mL大豆油的对照组的三只大鼠进行比较。14天之后,通过过量吸入二氧化碳对两组进行安乐死并进行尸体剖检,并将心脏、肺、胃、小肠、结肠、肝、肾、脾、胰和膀胱的样品在福尔马林中固定,使用H&E染色并由病理学家进行分析以确定是否发现任何异常。
亚慢性研究:对六只大鼠(Charles River Labs,Sprague Dawley体重330至450克)经由经口管饲给以80mg/kg的直径测量为100至300μm的不锈钢颗粒(在1mL大豆油中),每周五天,持续四周。将这些大鼠与以相同的频率和持续时间仅给以1mL大豆油的对照组的六只大鼠进行比较。在第1、15和26天采集全血样品,并对其痕量的铬和镍进行测试。还在第15天采集尿液样品以测试痕量的铬和镍。在第8天使用Faxitron Multifocus(Faxitron,Tucson,USA)拍摄GI道的射线照片以确认不锈钢的通过。在研究结束时,在第26天时,通过过量吸入二氧化碳对所有12只大鼠进行安乐死并进行尸体剖检。将心脏、肺、胃、小肠、结肠、肝、肾、脾、胰和膀胱的样品在福尔马林中固定,使用H&E染色并由病理学家进行分析以确定是否发现任何异常。
计算优化:
通过在第I和IV象限中的180度平面上进行二维曲线优化并使曲线绕Y轴旋转,可创建优化的形状。图88示出了该章节中描述的优化的曲线以及载体和方法。优化函数改变了沿在极坐标下绘制的曲线以相等角度间隔开的25个不同点的半径。当重新转换为笛卡尔坐标时,将旋转曲线内部和X-Z平面以下的空间设定为包含高密度材料(7.7g/cm
优化本身利用了牛顿运动方程来找到给定形状的自取向时间,t:
α=τ/I 方程(2)
ω=ω
I=∫r
τ=d*F*sin(θ) 方程(5)
其中角加速度α和角速度ω根据装置的转动惯量I和扭矩τ确定。重力F在模型中充当外力并用于计算施加至杠杆臂d的模拟扭矩,该扭矩定义为装置的质心和与组织壁的接触点之间的距离。
由方程2定义的装置在给定方向上的角加速度决定了取向速度,并随扭矩和转动惯量而变化。通过将3D空间分解成50×50×50阵列的大小相等的块,为每个块分配密度,并执行方程4中所述的求和而计算转动惯量和装置的总重量。
计算装置上的扭矩,需要根据方程5确定力和距离矢量的方向和大小二者。力矢量是物体上的重力,其从质心开始并指向与接触面垂直的方向。距离矢量计算为质心与装置在接触面上的枢轴点之间的距离。确定枢轴点时,将装置的大弯(greater curvature)考虑在内,因为具有凹曲率的区域不接触表面。
蔗糖包封溶解模型
使用格里菲斯准则(Griffith’s criterion)计算蔗糖包封将传播裂纹的半径:
将COMSOL Multiphysics(Stockholm,Sweden)用于数学建模蔗糖圆柱体在静止的水和以0.02m/s(与人胃的相似)流动的水中的溶解。菲克定律(Fick’s law)用于估计在蔗糖与水之间的收缩边界处扩散过程的速率。将5.2*10^
为了计算蔗糖在水中的传质系数,将蔗糖在具有6mm直径的孔的PDMS模具中在215℃下焦糖化15分钟,以形成圆柱体。在室温下将焦糖化蔗糖圆柱体放置在500mL烧杯的水中,并每分钟测量蔗糖的直径。对溶解速率进行建模,并将线性拟合的斜率确定为传质系数。
为了测试蔗糖涂层在弹簧上的溶解度,在室温下将蔗糖包封的弹簧放置在500mL烧杯的水中,并记录4mm、5mm和6mm直径的蔗糖弹簧的弹簧致动时机,各自进行三次试验。
实施例17-涂层
该实施例示出了多种涂层在本文中所描述的系统上的使用。
使用Instron以0.1mm/s压缩多种涂层(PDMS浸渍涂层、PDMS膜涂层、PCL浸渍涂层和PCL 3x浸渍涂层)。结果总结于表3中。
表3
示例性实施方案
1.可摄入的自扶正制品,其包含:
具有平均密度的第一部分;
具有与所述第一部分的平均密度不同的平均密度的第二部分;以及
有效负荷部分,所述有效负荷部分用于携带用于在摄入所述制品的对象内部释放的试剂,
其中所述自扶正制品配置成被包封在胶囊中。
2.可摄入的自扶正制品,其包含有效负荷部分,所述有效负荷部分用于携带用于在摄入所述制品的对象内部释放的试剂,其中所述制品具有几何中心和从所述几何中心偏移的质心,使得经由穿过几何中心的轴悬挂的质心从几何中心横向偏移的制品由于绕所述轴的重力而受到0.09*10^-4Nm或更小的外部施加的扭矩,
其中所述自扶正制品配置成包封在胶囊中。
3.自扶正制品,其包含:
具有平均密度的第一部分;
具有与所述第一部分的平均密度不同的平均密度的第二部分;以及
与所述自扶正制品相关联的组织接合组件,
其中所述第一部分的平均密度与所述第二部分的平均密度的比例大于或等于2.5:1。
4.如任一前述实施方案所述的自扶正制品,其中所述自扶正制品为冈布茨形状。
5.如任一前述实施方案所述的自扶正制品,其中在受到0.09*10^-4Nm或更小的外部施加的扭矩作用时,所述自扶正制品维持与垂直方向成20度或更小的取向。
6.如任一前述实施方案所述的自扶正制品,其中所述第一部分具有小于或等于2g/mL且大于或等于0.6g/mL的平均密度。
7.如任一前述实施方案所述的自扶正制品,其中所述第二部分具有小于20g/mL且大于或等于3g/mL的平均密度。
8.如任一前述实施方案所述的自扶正制品,其中所述第一部分包含第一材料,并且所述第二部分包含第二材料。
9.如任一前述实施方案所述的自扶正制品,其中所述第一材料和/或第二材料选自聚合物、陶瓷和金属。
10.如任一前述实施方案所述的自扶正制品,其中所述第一材料和/或第二材料是生物相容性的。
11.如任一前述实施方案所述的自扶正制品,其中所述第一材料和/或所述第二材料是可生物降解的。
12.如任一前述实施方案所述的自扶正制品,其中所述第一材料是金属、陶瓷、或其组合。
13.如任一前述实施方案所述的自扶正制品,其中所述金属选自不锈钢、铁-碳合金、菲尔德金属、钨、钼、金、锌、铁和钛。
14.如任一前述实施方案所述的自扶正制品,其中所述陶瓷选自羟基磷灰石、氧化铝、氧化钙、以及磷酸三钙、氧化锆、硅酸盐、二氧化硅。
15.如任一前述实施方案所述的自扶正制品,其中所述第二材料是聚合物。
16.如任一前述实施方案所述的自扶正制品,其中所述聚合物选自聚己内酯、聚乳酸、聚乙二醇、聚丙烯、聚乙烯、聚碳酸酯、聚苯乙烯和聚醚醚酮、以及聚乙烯醇。
17.如任一前述实施方案所述的自扶正制品,其中所述第一材料与所述第二材料不同。
18.如任一前述实施方案所述的自扶正制品,其中活性药物成分设置在空心部分中。
19.如任一前述实施方案所述的自扶正制品,其中所述自扶正制品在油中自90度起的自扶正时间为小于或等于0.15秒,在胃液中自90度起的自扶正时间为小于或等于0.06秒,在黏液中自90度起的自扶正时间为小于或等于0.05秒。
20.如任一前述实施方案所述的自扶正制品,其中所述自扶正制品在水中自90度起的自扶正时间为小于或等于0.05秒。
21.如任一前述实施方案所述的自扶正制品,其中所述自扶正制品包含一个或更多个进出口。
22.如任一前述实施方案所述的自扶正制品,其中所述自扶正制品具有小于或等于1.1cm的最大截面尺寸。
23.胶囊,其包含外壳和如任一前述实施方案所述的自扶正制品。
24.如实施方案23所述的胶囊,其包含弹簧致动的组件。
25.使胶囊在对象中取向的方法,其包括:
向对象施用包含外壳和自扶正制品的胶囊,所述自扶正制品包含:
具有平均密度的第一部分;
具有与所述第一部分的平均密度不同的平均密度的第二部分;以及
与所述自扶正制品相关联的组织接合组件。
26.如实施方案25所述的方法,其中所述自扶正制品包含活性药剂。
27.如实施方案26所述的方法,其中所述活性药剂的至少一部分被释放至所述对象内部的位置。
28.如实施方案25所述的方法,其包括向所述对象施用传感器使得所述传感器与所述自扶正制品相关联。
29.向对象内部的位置递送药剂的方法,其包括:
向对象施用包含外壳和自扶正制品的胶囊,所述自扶正制品包含:
包含第一材料的第一部分,所述第一材料具有第一平均密度;
包含第二材料的第二部分,所述第二材料具有与所述第一平均密度不同的第二平均密度;以及
设置在所述自扶正制品内并与活性药剂相关联的组织接合组件,
其中所述第一材料的平均密度与所述第二材料的平均密度的比例大于或等于2.5:1,
其中所述自扶正制品在对象内部的位置处取向成使得所述组织接合组件刺穿对象内部的位置临近的组织,并且
其中所述活性药剂的至少一部分被释放到组织中。
30.自扶正制品,其包含:
第一材料和与所述第一材料不同的第二材料;以及
与所述自扶正制品相关联的活性药剂,
其中与所述自扶正制品的组织衔接表面基本上垂直的轴配置成在受到0.09*10^-4Nm或更小的外部施加的扭矩作用时维持与垂直方向成20度或更小的取向,并且
其中所述第一材料的平均密度与所述第二材料的平均密度的比例大于或等于2.5:1。
31.自扶正制品,其包含:
至少第一部分,所述第一部分具有大于1g/cm
其中所述自扶正制品具有小于或等于1.1cm的最大截面尺寸,并且
其中与所述自扶正制品的组织衔接表面垂直的轴配置成在受到0.09*10^-4Nm或更小的外部施加的扭矩作用时维持与垂直方向成20度或更小的取向。
32.自扶正制品,其包含:
包含第一材料的第一部分,所述第一材料具有第一平均密度;
包含第二材料的第二部分,所述第二材料具有与所述第一平均密度不同的第二平均密度;并且
其中所述自扶正制品具有最稳定、势能最低的物理配置,并且在水中自与最稳定配置在任何取向偏移90度起的自扶正时间为小于或等于0.05秒,并且
其中所述第一材料的平均密度与所述第二材料的平均密度的比例大于或等于2.5:1。
33.自扶正制品,其包含:
至少第一部分,所述第一部分具有大于1g/cm
其中所述自扶正制品具有小于或等于1.1cm的最大截面尺寸,并且
其中所述自扶正制品在水中自90度起的自扶正时间为小于或等于0.05秒。
34.自扶正制品,其包含:
至少第一部分,所述第一部分的平均密度大于1g/cm
其中所述自扶正制品在水中自90度起的自扶正时间为小于或等于0.05秒,
其中与所述自扶正制品的组织衔接表面垂直的纵轴配置成在受到0.09*10^-4Nm或更小的外部施加的扭矩作用时维持与垂直方向成20度或更小的取向,和/或
其中所述自扶正制品具有小于或等于1%的阻塞率。
34.制品,其包含:
外壳;
至少部分地包封在外壳内的弹簧;
支持材料,其与所述弹簧相关联以使得所述支持材料在环境条件下将所述弹簧的至少一部分维持在至少5%压缩应变下;以及
可操作地连接至所述弹簧的组织接合组件。
35.如任一前述实施方案所述的制品,其中所述支持材料在生理条件下至少部分地释放所述弹簧。
36.如任一前述实施方案所述的制品,其中所述组织接合组件包含针、活检组件、钩、黏膜黏附贴片、或其组合。
37.如任一前述实施方案所述的制品,其中所述制品包含活性药剂。
38.如任一前述实施方案所述的制品,其中所述制品配置成使得在所述支持材料至少部分降解之后所述活性药剂的至少一部分从所述制品释放。
39.如任一前述实施方案所述的制品,其中所述支持材料配置成将所述弹簧维持在压缩下,从而使得在所述支持材料至少部分降解之后,所述弹簧解压缩。
40.如任一前述实施方案所述的制品,其中所述支持材料包含脆性材料。
41.如实施方案40所述的制品,其中所述脆性材料包含糖和/或聚合物。
42.如任一前述实施方案所述的制品,其中所述支持材料是厚度大于或等于3mm且小于或等于6mm的涂层。
43.如任一前述实施方案所述的制品,其中所述弹簧包含选自镍钛诺、金属和聚合物的材料。
44.如任一前述实施方案所述的制品,其中所述弹簧具有大于或等于100N/m且小于或等于20000N/m的弹簧常数。
45.如任一前述实施方案所述的制品,其中所述弹簧从所述弹簧的未经压缩长度被压缩大于或等于1mm且小于或等于5mm。
46.如任一前述实施方案所述的制品,其中所述外壳是胶囊。
47.如任一前述实施方案所述的制品,其中所述制品与自扶正系统相关联。
48.如任一前述实施方案所述的制品,其中所述弹簧具有大于或等于1mm且小于或等于10mm的平均截面尺寸。
49.包括以下的方法:
向对象施用制品,所述制品包含:
外壳;
用所述外壳至少部分地包封的弹簧;
支持材料,其与所述弹簧相关联以使得所述支持材料在环境条件下将弹簧的至少一部分维持在至少10%压缩应变下;以及
与弹簧相关联的组织接合组件。
50.用于刺穿位于对象内部的组织的方法,其包括:
向对象施用制品,所述制品包含:
外壳;
被所述外壳至少部分地包封的弹簧;
支持材料,其与所述弹簧相关联以使得支持材料在环境条件下将所述弹簧的至少一部分维持在至少10%压缩应变下;以及
与所述弹簧相关联的组织接合组件;其中所述支持材料的至少一部分被降解以使得所述弹簧延伸和/或组织接合组件穿透位于对象内部的组织。
51.如实施方案50所述的方法,其中活性药剂在位于对象内部的组织的穿透期间和/或之后释放。
52.如实施方案51所述的方法,其中所述自扶正制品取向成使得所述组织接合组件的纵轴与位于所述自扶正制品附近的组织正交。
53.制品,其包含:
组织接合组件和与所述组织接合组件相关联的弹簧,所述弹簧通过支持材料维持在至少5%压缩应变下的至少部分压缩的状态,
其中所述弹簧配置成在将所述支持材料暴露于流体的10分钟内释放弹簧的至少10%的储存压缩能。
54.如实施方案53所述的制品,其包含与所述组织接合组件相关联的药剂。
55.如实施方案53或54所述的制品,其包含与所述组织接合组件相关联的自扶正制品。
56.组织接合组件,其包含:
固体治疗剂和支持材料,
其中作为所述组织接合组件之总重量的函数,所述固体治疗剂在所述组织接合组件中存在的量为大于或等于10wt%,
其中所述固体治疗剂和支持材料基本上均匀地分布,并且
其中所述组织接合组件配置成穿透组织。
57.如实施方案56所述的组织接合组件,其包含多个微针,所述微针包含所述固体治疗剂和所述支持材料。
58.如实施方案56所述的组织接合组件,其包含与所述组织接合组件相关联的支持材料。
59.组织接合组件,其具有尖端并且包含:
固体治疗剂和与所述固体治疗剂相关联的支持材料,
其中所述固体治疗剂的至少一部分与所述组织接合组件的一个或更多个尖端相关联,并且
其中作为组织接合组件之总重量的函数,所述固体治疗剂在所述组织接合组件中存在的量为大于或等于10wt%。
60.如实施方案59所述的组织接合组件,其包含多个微针,所述微针包含所述固体治疗剂和所述支持材料。
61.如实施方案59或60所述的组织接合组件,其中所述固体治疗剂的至少一部分存在于所述尖端的至少一个表面上。
62.如实施方案59至61中任一项所述的组织接合组件,其中所述尖端的至少一部分包含所述固体治疗剂。
63.如实施方案62所述的组织接合组件,其中相对于所述尖端的总重量,所述尖端包含大于或等于70wt%的固体治疗剂。
64.如实施方案59或60所述的组织接合组件,其中所述支持材料的至少一部分存在于所述尖端的至少一个表面上。
65.形成组织接合组件的方法,其包括:
提供固体治疗剂和支持材料;以及
将固体治疗剂与支持材料一起使用至少1MPa的压力压缩和/或加热以形成组织接合组件,
其中所述组织接合组件配置成穿透组织。
66.如实施方案65所述的方法,其中压缩包括对所述固体治疗剂和所述支持材料进行离心。
67.如实施方案65所述的方法,其中压缩包括使用至少20MPa的压力。
68.如任一前述实施方案所述的组织接合组件或方法,其中所述支持材料是可生物降解的。
69.如任一前述实施方案所述的组织接合组件或方法,其中所述支持材料包含聚合物。
70.如实施方案69所述的组织接合组件或方法,其中所述聚合物选自聚乙二醇和HPMC。
71.如任一前述实施方案所述的组织接合组件或方法,其中所述固体治疗剂选自活性药物药物成分、胰岛素、核酸、肽和抗体。
72.如任一前述实施方案所述的组织接合组件或方法,其中所述组织接合组件包含涂层。
73.如任一前述实施方案所述的组织接合组件或方法,其中所述涂层具有大于或等于50MPa的屈服强度。
74.制品,其包含:
相对于总制品重量,大于或等于80wt%的固体活性药剂,
其中所述制品具有大于或等于100MPa的杨氏弹性模量,并且
其中所述制品配置成以小于或等于20mN的力穿透到人胃肠道黏膜组织中至少1mm。
75.形成制品的方法,其包括:
将包含相对于组合物的总重量的大于或等于80wt%固体活性药剂的组合物引入到模具中;
向所述组合物施加大于或等于1MPa的压力;以及
将组合物加热至至少70℃的温度持续至少1分钟,
其中所述制品配置成以小于或等于20mN的力穿透到人胃肠道黏膜组织中至少1mm。
76.制品,其包含:
相对于总制品重量,大于或等于80wt%的固体活性药剂,
其中所述制品配置成每平方厘米的对象组织递送至少1mg的活性药剂,和/或其中所述制品每平方厘米包含大于或等于1mg的活性药剂。
77.如任一前述实施方案所述的制品或方法,其中将所述活性药剂浇铸到模具中以形成所述制品。
78.如任一前述实施方案所述的制品或方法,其中将所述模具离心。
79.如任一前述实施方案所述的制品或方法,其还包含黏合剂。
80.如实施方案79中所述的制品或方法,其中所述黏合剂包含糖(例如山梨糖醇或蔗糖)、明胶、聚合物(例如PVA、PEG、PCL、PVA或PVP)、和/或乙醇。
81.如任一前述实施方案所述的制品或方法,其中所述制品包含大于或等于1mg的活性药剂。
82.如任一前述实施方案所述的制品或方法,其中所述活性药剂选自噬菌体、DNA、胰岛素、人生长激素、单克隆抗体、阿达木单抗、肾上腺素和昂丹司琼。
83.自扶正制品,其配置成锚定在对象内部的位置处,所述自扶正制品包含:
至少第一部分,所述第一部分具有大于1g/cm
与所述自扶正制品相关联的至少一个锚定机构。
84.制品,其配置成锚定在对象内部的位置处,所述制品包含:
外壳;
被外壳至少部分地包封的弹簧,所述弹簧通过支持材料维持在至少5%压缩应变下的至少部分压缩的状态,
可操作地连接至所述弹簧的至少一个锚定机构。
85.用于将制品锚定至对象内部的位置的方法,其包括:
向对象施用所述制品,其中所述制品包含至少第一部分和至少一个锚定机构,所述第一部分具有大于1g/cm
86.如任一前述实施方案所述的方法或制品,其中每个锚定机构包含钩。
87.如任一前述实施方案所述的制品或方法,其中每个锚定机构是钩状针。
88.如任一前述实施方案所述的制品或方法,其中每个锚定机构配置成以大于或等于1mm且小于或等于3mm的深度穿透所述对象内部的位置处的组织。
89.如任一前述实施方案所述的制品或方法,其中所述钩包含在生理条件下不可降解的材料。
90.如任一前述实施方案所述的制品或方法,其中所述锚定机构的长度为大于或等于10微米且小于或等于250微米。
91.如任一前述实施方案所述的制品或方法,其中每个锚定机构具有大于或等于0.002N且小于或等于1N的钩力。
92.如任一前述实施方案所述的制品或方法,其中所述制品配置成在大于或等于0.6N的横向施加力下保持在所述位置处。
93.如任一前述实施方案所述的制品或方法,其中所述制品配置成在大于或等于30度的取向变化之后保持在所述位置处。
94.如任一前述实施方案所述的制品或方法,其中所述制品包含间隔至少1mm的两个或更多个锚定机构。
95.自扶正制品,其配置成施用于对象内部的位置,其包含:
至少第一部分,所述第一部分具有大于1g/cm
至少两个组织接合组件,所述组织接合组件包含配置成接触组织的组织接触部分,每个组织接触部分包含配置成与组织电连通的导电部分和配置成不与组织电连通的绝缘体部分;以及
与所述至少两个组织接合组件电连通的电源。
96.制品,其配置成施用于对象内部的位置,所述制品包含:
外壳;
被外壳至少部分地包封的弹簧,所述弹簧通过支持材料维持在至少5%压缩应变下的至少部分压缩的状态,
至少两个组织接合组件,所述组织接合组件包含配置成接触组织的组织接触部分,每个组织接触部分包含配置成与组织电连通的导电部分和配置成不与组织电连通的绝缘体部分;以及
与所述至少两个组织接合组件电连通的电源。
97.用于向对象内部的位置提供电刺激的方法,其包括:
向对象施用制品,所述制品包含设置在所述制品内的至少一个组织接合组件,每个组织接合组件包含导电材料;
从所述制品释放所述至少一个接合组件;
将所述至少一个接合组件插入到对象内部的位置处的组织中;
跨过两个或更多个组织接合组件施加由与组织接合组件电连通的电源产生的电流,
其中所述制品包含通过支持材料维持在至少5%压缩应变下的至少部分压缩状态的弹簧,每个组织接合组件可操作地连接至所述弹簧。
98.如实施方案97所述的方法,其包括向对象施用两个或更多个制品并且跨过两个制品施加电流。
99.如任一前述实施方案所述的制品或方法,其中所述制品配置成在大于或等于0.6N的力和/或大于或等于30度的取向变化下保持在对象内部的位置处。
100.自扶正制品,其包含:
组织接合组件和与所述组织接合组件相关联的弹簧,所述弹簧通过支持材料维持在至少5%压缩应变下,
其中所述自扶正制品具有小于或等于1.1cm的最大截面尺寸,并且
其中与所述自扶正制品的组织衔接表面基本上垂直的轴配置成在受到0.09*10^-4Nm或更小的外部施加的扭矩作用时维持与垂直方向成20度或更小的取向,和/或
其中所述自扶正制品在水中自90度起的自扶正时间为小于或等于0.05秒。
101.如实施方案100所述的自扶正制品,其中所述弹簧配置成在将所述支持材料暴露于流体的10分钟内释放所述弹簧的至少10%的储存压缩能。
102.如实施方案100或101所述的自扶正制品,其中所述自扶正制品在水中自90度起的自扶正时间为小于或等于0.05秒。
103.用于向对象递送药剂的制品,其包含:
组织接合组件;以及
弹簧,所述弹簧与所述组织接合组件相关联并通过支持材料维持在至少5%压缩应变下,
其中所述组织接合组件以相对于总的组织接合组件重量的大于或等于110wt%的量包含固体药剂。
104.如实施方案103所述的制品,其中所述弹簧配置成在将所述支持材料暴露于流体的10分钟内释放所述弹簧的至少90%的储存压缩能。
105.如实施方案103或104所述的制品,其中所述组织接合组件是针。
106.如实施方案103至105中任一实施方案所述的制品,其中所述组织接合组件具有大于或等于100MPa的杨氏弹性模量。
107.用于向对象递送药剂的制品,其包含:
组织接合组件;以及
与所述组织接合组件相关联的弹簧,
其中所述针以相对于总的针重量的大于或等于80wt%的量包含固体药剂,并且
其中所述弹簧配置成在将支持材料暴露于流体的10分钟内释放所述弹簧的至少10%的储存压缩能。
108.如实施方案107所述的制品,其中所述弹簧通过支持材料维持在至少5%压缩应变下。
109.自扶正制品,其包含与所述自扶正制品相关联的一个或更多个组织接合组件,
其中所述自扶正制品在水中自90度起的自扶正时间为小于或等于0.05秒,并且
其中所述自扶正制品配置成使得至少一个组织接合组件具有在自扶正时在垂直方向的15度内取向的最长纵轴。
110.自扶正制品,其包含与所述自扶正制品相关联的组织接合组件,
其中所述组织接合组件以相对于总的组织接合组件重量的大于或等于10wt%的量包含固体药剂,并且
其中与所述自扶正制品的组织衔接表面基本上垂直的轴配置成在受到0.09*10^-4Nm或更小的外部施加的扭矩作用时维持与垂直方向成20度或更小的取向。
111.向对象递送药剂的方法,其包括:
向对象施用包含与所述药剂相关联的组织接合组件的制品;以及
在对象内部的位置处从所述制品释放所述药剂的至少一部分。
其中在到达对象内部的位置处之后,所述制品:
具有所述制品的纵轴,其配置成相对于垂直方向取向成约90度;和/或
具有纵轴,其在受到0.09*10^-4Nm或更小的外部施加的扭矩作用时维持与垂直方向成20度或更小的取向;和/或
可以以一定量的力穿透黏膜组织;和/或
具有在水中自90度起小于或等于0.05秒的自扶正时间;和/或
具有大于1g/cm
以相对于总的组织接合组件重量的大于或等于10wt%的量包含固体药剂;和/或
包含配置成用于瞬时释放的弹簧。
112.从对象收集样品的方法,其包括:
向所述对象施用包含弹簧、支持材料和活检机构的制品;以及
通过活检机构在对象内部的位置处收集样品,
其中在到达对象内部的位置之后,与所述自扶正制品的组织衔接表面基本上垂直的轴配置成在受到0.09*10^-4Nm或更小的外部施加的扭矩作用时维持与垂直方向成20度或更小的取向,并且所述弹簧配置成在支持材料机械失效的0.1毫秒内释放所述弹簧的至少10%的储存压缩能。
113.如实施方案112所述的方法,其包括将所述组织接合组件暴露于对象的流体以使得组织接合组件的至少一部分致动。
114.自扶正制品,其包含
自致动组件,所述自致动组件包含弹簧和支持材料,所述支持材料适于将所述弹簧维持在至少部分压缩状态并且构造成在暴露于生物流体时至少部分降解;以及
与活性药剂相关联的组织接合组件;
其中所述自扶正制品由于所述自扶正制品的质心和所述自扶正制品的形状而配置为单静态体。
115.如实施方案114所述的自扶正制品,其中当所述自扶正制品由对象的组织至少部分地支持时,所述自扶正制品在允许所述组织接合组件将活性药剂的至少一部分释放到组织中的方向上取向。
116.自扶正制品,其包含:
具有质量的第一部分;
具有与所述第一部分的质量不同的质量的第二部分;
自致动组件;
组织接合组件,所述组织接合组件与活性药剂相关联并且可操作地连接至自致动组件;以及
组织衔接表面,所述组织衔接表面配置成接触对象内部的组织的表面;
其中所述自扶正制品由于所述自扶正制品的质心和所述自扶正制品的形状而配置为单静态体;
其中当所述自扶正制品由对象的组织至少部分地支持时,所述自扶正制品在允许所述组织接合组件将所述活性药剂的至少一部分释放到组织中的方向上取向。
117.如实施方案116所述的自扶正制品,其中所述第一部分包含第一材料并且所述第二部分包含第二材料,其中所述第一材料与所述第二材料相同。
118.如实施方案116所述的自扶正制品,其中所述第一部分包含第一材料并且所述第二部分包含第二材料,其中所述第一材料与所述第二材料不同。
119.自扶正制品,其包含:
第一部分,所述第一部分包含第一材料并且具有质量;
第二部分,所述第二部分包含第二材料并且具有与所述第一部分的质量不同的质量;
自致动组件;
组织接合组件,所述组织接合组件与活性药剂相关联并且可操作地连接至所述自致动组件;以及
组织衔接表面,所述组织衔接表面配置成接触位于对象内部的组织的表面;
其中所述自扶正制品具有大于1g/cm
其中所述自扶正制品由于所述自扶正制品的质心和所述自扶正制品的形状而配置为单静态体;并且
其中当所述自扶正制品由对象的组织至少部分地支持时,所述自扶正制品在允许所述组织接合组件将所述活性药剂的至少一部分释放到组织中的方向上取向。
120.如实施方案116至119中任一项所述的自扶正制品,其中所述第一材料和/或第二材料选自聚合物、陶瓷、金属、金属合金、及其组合。
121.如实施方案120所述的自扶正制品,其中所述金属选自不锈钢、铁-碳合金、菲尔德金属、钨、钼、金、锌、铁和钛。
122.如实施方案120所述的自扶正制品,其中所述陶瓷选自羟基磷灰石、氧化铝、氧化钙、磷酸三钙、氧化锆、硅酸盐和二氧化硅。
123.如实施方案120所述的自扶正制品,其中所述聚合物选自聚己内酯、聚乳酸、聚乙二醇、聚丙烯、聚乙烯、聚碳酸酯、聚苯乙烯和聚醚醚酮、以及聚乙烯醇。
124.如实施方案117至123中任一项所述的自扶正制品,其中所述第一材料是金属并且所述第二材料是聚合物。
125.如实施方案117至123中任一项所述的自扶正制品,其中所述第一材料是聚合物并且所述第二材料是金属。
126.如实施方案117至125中任一项所述的自扶正制品,其中所述自致动组件包含弹簧和适于将所述弹簧维持在至少部分压缩状态的支持材料,其中所述支持材料配置成在生物流体中至少部分降解。
127.如实施方案126中所述的自扶正制品,其中所述弹簧具有100N/m至1500N/m的弹簧常数。
128.如实施方案115至127中任一项所述的自扶正制品,其中所述组织接合组件包含所述活性药剂。
129.如实施方案128所述的自扶正制品,其中所述活性药剂以所述组织接合组件的总重量的大于或等于80wt%的量存在于组织相互作用组件中。
130.如实施方案128所述的自扶正制品,其中100wt%的所述组织相互作用组件是所述活性药剂。
131.如实施方案115至130中任一项所述的自扶正制品,其中所述自扶正制品包含一个或更多个进出口,所述进出口配置成使得所述自致动组件与外部环境流体连通。
132.如实施方案115至131中任一项所述的自扶正制品,其中所述生物流体是胃液。
133.如实施方案115至132中任一项所述的自扶正制品,其中所述自扶正制品的形状为冈布茨形状。
虽然本文中已经描述和举例说明了本发明的数个实施方案,但是本领域普通技术人员将容易地想到用于执行本文中描述的功能和/或获得本文中描述的结果和/或一项或更多项优势的多种其他方式和/或结构,并且这样的变化和/或改变各自均被认为在本发明的范围之内。更一般地,本领域技术人员将容易认识到,本文中描述的所有参数、尺寸、材料和配置意在是示例性的,并且实际参数、尺寸、材料和/或配置将取决于特定的应用或本发明的教导所用于的应用。本领域技术人员将认识到或者能够仅使用常规实验确定本文中描述的本发明的具体实施方案的许多等同方案。因此,应当理解,前述实施方案仅以示例的方式给出,并且在所附权利要求书及其等效文件的范围内,本发明可以以不同于具体描述和要求保护的方式实施。本发明涉及本文中描述的每个单独特征、系统、制品、材料、药盒和/或方法。另外,如果这些特征、系统、制品、材料、药盒和/或方法不相互矛盾,则两个或更多个此类特征、系统、制品、材料、药盒和/或方法的任意组合包含在本发明的范围。
除非明确指出相反,否则本说明书和权利要求书中使用的没有数量词修饰的名词应理解为指“至少一个/种”。
本说明书和权利要求书中使用的短语“和/或”应理解为意指这样结合起来的要素中的“任一个或二者”,即在一些情况下联合性地存在而在一些情况下分离性地存在的要素。除非明确指出相反,否则存在除了由“和/或”子句具体标识的要素之外还任选地存在其他要素,无论与具体标识的那些要素相关或无关。因此,作为一个非限制性实例,当结合例如“包含/包含”的开放式用词使用时提及“A和/或B”在一个实施方案中可指A而没有B(任选地包含除B之外的要素);在另一个实施方案中指B而没有A(任选地包含除A之外的要素);在另一个实施方案中可指A和B二者(任选地包含其他要素)等。
本说明书和本权利要求书中使用的“或/或者”应该理解为具有与如上定义的“和/或”相同的含义。例如,当在列表中分列项目时,“或/或者”或“和/或”应该解释为包含性的,即,包含大量要素或要素列表中的至少一个,而且包含多于一个,并且任选地包含另外的未列出项目。只有明确表示相反含义的术语,如“仅仅之一”或“正好之一”或当在权利要求书中使用“由...组成”时将指包含大量要素或要素列表中的正好一个要素。一般来说,本文中使用的术语“或/或者”当在前面有排他性术语时,应当解释为指示排他性替换(即“一个/种或另一个/种但不是两个/种”),例如“任一个”、“之一”、“仅一个”或”恰好一个”。当在权利要求书中使用时,“基本上由……组成”应具有其在专利法领域中使用的普通含义。
在提及一个或更多个要素的列表时,本说明书和权利要求书中使用的短语“至少一个/种”应理解为意指选自所述要素列表中的任意一个或更多个要素的至少一个要素,但不一定包含所述要素列表内明确列举的每个要素中的至少一个,也不排除所述要素列表中要素的任意组合。该定义还允许除在短语“至少一个/种”所指的要素列表内具体确定的要素之外,还可任选地存在其他要素,而无论与具体确定的那些要素相关或不相关。因此,作为一个非限制性实例,“A和B中的至少一个”(或等同地,“A或B中的至少一个”,或等同地,“A和/或B中的至少一个”)在一个实施方案中可指至少一个A,任选地包含多于一个A,而没有B(并且任选地包含除B之外的要素);在另一个实施方案中,可指至少一个B,任选地包含多于一个B,而没有A(并且任选地包含除A之外的要素);在另一个实施方案中,可指至少一个A,任选地包含多于一个A,以及至少一个B,任选地包含多于一个B(并且任选地包含其他要素);等。
在权利要求书及上文说明书中,例如“包含”、“包括”、“载有”、“具有”、“含有”、“涉及”、“保持”等所有连接词应理解为开放式的,即指包含但不局限于。如美国专利局专利审查程序手册第2111.03节(United States Patent Office Mannual of Patent ExaminingProcedures,Section 2111.03)中所述,只有过渡性短语“由……组成”和“基本上由……组成”应是封闭式的或半封闭式的连接词。
除非另外限定或指出,否则本文中涉及以下所使用的任何术语均应理解为不要求绝对符合此类术语的数学定义:例如一个或更多个制品、结构、力、场、流、方向/轨迹和/或其子组件和/或其任意组合和/或上文未列出的可通过此类术语表征的任何其他有形或无形元件或者其之间的形状、取向、排列和/或几何关系,而应理解为指示在如此表征的主题可能的程度上符合此类术语的数学定义,如与这样的主题最密切相关领域技术人员将理解的。与形状、取向和/或几何关系相关联的这些术语的实例包括但不限于描述以下的术语:形状-例如,圆形、正方形、冈布茨、环形的/环形、矩形的/矩形、三角形的/三角形、圆柱形的/圆柱形、椭圆的/椭圆、(n)多边形的/(n)多边形等;角定向-例如垂直、正交、平行、垂直、水平、共线等;轮廓和/或轨迹-例如,平面/平面的、共面的、半球形的、半-半球形的、线/线性、双曲线的、抛物线的、扁平、弯曲的、直线的、弧形的、正弦的、切线/切线的等;方向-如北、南、东、西等;表面和/或散体材料特性(bulk material property)和/或空间/时间分辨率,和/或分布-例如,光滑、反射、透明、清晰、不透明、刚性、不可穿透、均匀、惰性、不可润湿、不溶、稳定、不变、恒定、同质等;以及相关领域技术人员显而易见的许多其他内容。作为一个实例,在本文中描述为“正方形”的制造制品不要求这样的制品具有完全平面或线性的并且以精确的90度的角度相交的面或边(实际上,这样的制品可仅作为数学抽象存在),相反,这样的制品的形状应被解释在所记载的制造技术通常可实现或已实现的程度上为近似于数学上定义的“正方形”,如本领域技术人员所理解的或如具体描述的。作为另一个实例,在本文中描述为“对准”的两个或更多个所制造制品不要求这样的制品具有完全对准的面或边(实际上,这样的制品只可仅作为数学抽象存在),相反,这样的制品的设置应被解释为在所记载的制造技术通常可实现或已实现的程度上为近似于数学上定义的“对准”,如本领域技术人员所理解的或如具体描述的。
本发明还涉及以下各项实施方案(它们对应于原申请的权利要求书):
1.自扶正制品,其包含:
组织接合组件和与所述组织接合组件相关联的弹簧,所述弹簧通过支持材料维持在至少5%压缩应变下,
其中所述自扶正制品具有小于或等于2cm的最大截面尺寸,并且
其中与所述自扶正制品的组织衔接表面基本上垂直的轴配置成在受到0.09*10^-4Nm或更小的外部施加的扭矩作用时维持与垂直方向成20度或更小的取向。
2.自扶正制品,其包含:
组织接合组件和与所述组织接合组件相关联的弹簧,所述弹簧通过支持材料维持在至少5%压缩应变下,
其中所述自扶正制品具有小于或等于2cm的最大截面尺寸,并且
其中所述自扶正制品在水中自90度起的自扶正时间为小于或等于0.05秒。
3.如实施方案1或2所述的自扶正制品,其中所述弹簧配置成在将所述支持材料暴露于流体的10分钟内释放所述弹簧的至少10%的储存压缩能。
4.如任一前述实施方案所述的自扶正制品,其中所述自扶正制品在水中自90度起的自扶正时间为小于或等于0.05秒。
5.用于向对象递送药剂的制品,其包含:
组织接合组件;以及
弹簧,所述弹簧与所述组织接合组件相关联并通过支持材料维持在至少5%压缩应变下,
其中所述组织接合组件以相对于总的组织接合组件重量的大于或等于110wt%的量包含固体药剂。
6.如实施方案5所述的制品,其中所述弹簧配置成在将所述支持材料暴露于流体的10分钟内释放所述弹簧的至少90%的储存压缩能。
7.如实施方案5或6所述的制品,其中所述组织接合组件是针。
8.如任一前述实施方案所述的制品,其中所述组织接合组件具有大于或等于100MPa的杨氏弹性模量。
9.用于向对象递送药剂的制品,其包含:
组织接合组件;以及
与所述组织接合组件相关联的弹簧,
其中所述针以相对于总的针重量的大于或等于80wt%的量包含固体药剂,并且
其中所述弹簧配置成在将所述支持材料暴露于流体的10分钟内释放所述弹簧的至少10%的储存压缩能。
10.如实施方案9所述的制品,其中所述弹簧通过支持材料维持在至少5%压缩应变下。
11.自扶正制品,其包含与所述自扶正制品相关联的一个或更多个组织接合组件,
其中所述自扶正制品在水中自90度起的自扶正时间为小于或等于0.05秒,并且
其中所述自扶正制品配置成使得至少一个组织接合组件具有在自扶正时在垂直方向的15度内取向的最长纵轴。
12.自扶正制品,其包含与所述自扶正制品相关联的组织接合组件,
其中所述组织接合组件以相对于总的组织接合组件重量的大于或等于10wt%的量包含固体药剂,并且
其中与所述自扶正制品的组织衔接表面基本上垂直的轴配置成在受到0.09*10^-4Nm或更小的外部施加的扭矩作用时维持与垂直方向成20度或更小的取向。
13.向对象递送药剂的方法,其包括:
向所述对象施用包含与所述药剂相关联的组织接合组件的制品;以及
在所述对象内部的位置处从所述制品释放所述药剂的至少一部分。
其中在到达所述对象内部的位置处之后,所述制品:
具有所述制品的纵轴,所述纵轴配置成相对于垂直方向取向成约90度;和/或
具有纵轴,其在受到0.09*10^-4Nm或更小的外部施加的扭矩作用时维持与垂直方向成20度或更小的取向;和/或
可以以大于或等于1mN且小于或等于20,000mN的力穿透黏膜组织;和/或
具有在水中自90度起小于或等于0.05秒的自扶正时间;和/或
以相对于总的组织接合组件重量的大于或等于10wt%的量包含固体药剂;和/或
包含配置成用于瞬时释放的弹簧。
14.如实施方案13所述的方法,其中所述制品具有大于1g/cm
