骨膜蛋白的应用、产品及产品制备方法
文献发布时间:2023-06-19 18:46:07
技术领域
本发明涉及生物医学基础研究领域,特别是涉及一种骨膜蛋白的应用、产品及产品制备方法。
背景技术
牙周病以进行性牙槽骨破坏和牙周组织丧失为特征,是全球成年人牙齿缺失的主要原因。牙周炎是一种常见的传染性口腔疾病,牙周炎会引起牙周组织缺损,对牙周组织缺损进行修复是当前口腔医学面临的一大挑战。
目前,植骨术、引导性组织/骨组织再生术(GTR/GBR)、局部使用生长因子等技术已在临床中用于牙周缺损的治疗并取得一定疗效,但上述方法仍存在一些不足,包括:易形成长结合上皮、再生牙骨质的能力较差、GTR的适应证较窄及膜降解时易塌陷等。
因此,目前亟需一种新的牙周组织再生策略。
发明内容
为解决上述背景技术中存在的问题,本发明提供了一种骨膜蛋白的应用、产品及产品制备方法。
第一方面,本发明提供了一种骨膜蛋白在制备促牙周再生制剂中的应用,所述促牙周再生制剂用于植入牙周缺损部位,所述骨膜蛋白用于在炎症环境下进行免疫调节,促进牙周组织再生。
可选地,所述骨膜蛋白用于促进巨噬细胞由M1向M2型转化。
可选地,所述骨膜蛋白用于与巨噬细胞表面受体intergrinαM结合、激活下游信号通路p-Erk/Erk从而使巨噬细胞向M2型极化。
可选地,所述骨膜蛋白还用于构建牙囊干细胞的细胞外基质。
可选地,所述促牙周再生制剂还包括:体外扩增牙囊干细胞。
第二方面,本发明提供了一种骨膜蛋白分子制剂,所述骨膜蛋白分子制剂的组成成分包括:骨膜蛋白、载体试剂,所述骨膜蛋白的浓度为100ng/ml。
可选地,所述载体试剂为重组胶原凝胶。
可选地,所述骨膜蛋白分子制剂还包括:牙囊干细胞,所述骨膜蛋白分子制剂用于植入牙周缺损部位,所述骨膜蛋白用于在炎症环境下进行免疫调节,促进牙囊干细胞的增殖和成骨分化能力,促进牙周组织再生。
第三方面,本发明提供了一种骨膜蛋白分子制剂的制备方法,所述方法包括:
制备胶原蛋白溶液;
将骨膜蛋白与所述胶原蛋白溶液混合,得到混合溶液;
静置所述混合溶液,得到骨膜蛋白分子制剂。
与现有技术相比,本发明包括以下优点:
本发明实施例中提供的促牙周再生制剂主要包括:骨膜蛋白和胶原凝胶,制备简单,无需复杂的设备和流程。本发明实施例所使用的骨膜蛋白分子制剂植入SD大鼠上颌第一磨牙近中牙周缺损后,取得了优秀的促牙周组织再生效果。HE及MASSON染色结果显示骨膜蛋白胶原凝胶组的骨充盈程度,牙槽骨高度都明显优于单纯的胶原凝胶组以及未处理组。骨膜蛋白胶原凝胶组再生的牙周膜纤维的排列也更为有序。Micro-CT的结果也显示骨膜蛋白胶原凝胶组的骨再生优于其他两组。由此,本发明实施例提供的牙周再生制剂植入牙周缺损部位,可以在炎症环境下进行免疫调节,促进牙周组织再生。
附图说明
图1是本发明实施例提供的骨膜蛋白分子制剂制备方法的流程图;
图2是本发明实施例提供的实施例2中的组织学染色结果;
图3是本发明实施例提供的实施例2中的各组上颌第一磨牙缺损区的micro-CT图像;
图4是本发明实施例提供的实施例2中4周时缺损区骨再生的定量显微CT评估结果图像;
图5是本发明实施例提供的实施例3中DFSCs移植后的DFSCs存活率结果图;
图6是本发明实施例提供的实施例3中植入DFSC膜片后缺损区的牙周再生情况结果分析图;
图7是本发明实施例提供的实施例3中植入DFSC膜片后缺损区免疫微环境的情况分析结果图;
图8是本发明实施例提供的实施例3中缺损区域骨膜蛋白的表达情况分析结果图;
图9示出了骨膜蛋白促进巨噬细胞浸润的Transwell结果分析图;
图10示出了骨膜蛋白促进巨噬细胞重编程为M2型的信号通路分析结果图。
具体实施方式
提供下述实施例是为了更好地进一步理解本发明,并不局限于所述最佳实施方式,不对本发明的内容和保护范围构成限制,任何人在本发明的启示下或是将本发明与其他现有技术的特征进行组合而得出的任何与本发明相同或相近似的产品,均落在本发明的保护范围之内。
实施例中未注明具体实验步骤或条件者,按照本领域内的文献所描述的常规实验步骤的操作或条件即可进行。所用试剂以及其他仪器未注明生产厂商者,均为可以通过市场购买获得的常规试剂产品。
相关研究表明,牙囊干细胞(DFSCs)具有促进牙周组织再生的潜力,然而其机制尚未明确,相关研究还表明,骨膜蛋白(Periostin)可以促进干细胞的分化,表明它具有免疫调节能力。但是,骨膜蛋白是否在DFSC促进牙周组织再生的过程中发挥作用尚不清楚。
本发明实施例对DFSC在炎症微环境中促进牙周再生的机制、以及骨膜蛋白在这一过程中的作用和机制,进行了探索,确定了骨膜蛋白在促牙周组织再生药物的潜在可能性。
本发明实施例中探索发现:DFSC可以通过炎症微环境中的免疫调节促进牙周再生,其作用由骨膜蛋白及其下游pErk/Erk信号通路介导的巨噬细胞M2型极化产生。进而本发明提出以下发明构思:将骨膜蛋白用于制备促牙周再生制剂,促进牙周组织再生。
基于该发明构思,第一方面,本发明实施例提供了一种骨膜蛋白在制备促牙周再生制剂中的应用,所述促牙周再生制剂用于植入牙周缺损部位,所述骨膜蛋白用于在炎症环境下进行免疫调节,促进牙周组织再生。
具体的,所述骨膜蛋白用于促进巨噬细胞由M1向M2型转化。
本发明实施例中探索发现,牙囊干细胞具备募集巨噬细胞并促进巨噬细胞由M1向M2型转化的能力,从而牙囊干细胞可以在炎症环境下改变局部免疫微环境,募集巨噬细胞并促进其向M2型极化来促进牙周组织再生。
本发明实施例中,使用两种细胞(敲低骨膜蛋白的牙囊干细胞和正常牙囊干细胞)的条件培养基比较两者募集巨噬细胞的能力,发现敲低骨膜蛋白的组募集的巨噬细胞数是相对更少的。然后,本发明实施例中,使用P.g-LPS将巨噬细胞诱导为M1型巨噬细胞,向其中加入两种细胞的条件培养基,从mRNA/蛋白以及细胞水平比较两者调节巨噬细胞由M1型向M2型转化的能力。结果发现,敲低骨膜蛋白减弱DFSCs促进巨噬细胞由M1向M2型转化的能力。
由此,本发明实施例认为:骨膜蛋白可以增强牙囊干细胞募集巨噬细胞的能力,以及增强牙囊干细胞促进巨噬细胞由M1向M2型转化的能力,进而达到促进牙周组织再生的效果。
具体的,所述骨膜蛋白用于与巨噬细胞表面受体intergrinαM结合、激活下游信号通路p-Erk/Erk从而使巨噬细胞向M2型极化。
本发明实施例中,在体系中加入骨膜蛋白的特异性受体intergrinαM的拮抗剂,结果发现,抑制了骨膜蛋白与其下游受体结合后,erk信号通路的激活,CD163的表达均被抑制,也就是说,骨膜蛋白对巨噬细胞表型的调节可能主要是通过与巨噬细胞表面受体intergrinαM结合后激活下游信号通路p-Erk/Erk产生的。
具体的,所述骨膜蛋白还用于构建牙囊干细胞的细胞外基质。
本发明实施例中,进一步探索发现,DFSCs可在炎症微环境中促进牙周再生。主要是通过旁分泌作用改变局部免疫微环境。而骨膜蛋白可以构建牙囊干细胞的细胞外基质,因此,骨膜蛋白还可以通过构建牙囊干细胞的细胞外基质的方式促进牙周组织再生。
由此,本发明实施例提出:将骨膜蛋白作为分子制剂的主要成分,用于促进牙周再生。
本发明实施例也通过动物模型证明了骨膜蛋白分子制剂可以在体内取得了优秀的促牙周组织再生效果,具体包括:骨膜蛋白胶原凝胶组的骨充盈程度,牙槽骨高度都明显优于单纯的胶原凝胶组以及未处理组。骨膜蛋白胶原凝胶组再生的牙周膜纤维的排列也更为有序。Micro-CT的结果也显示骨膜蛋白胶原凝胶组的骨再生优于其他两组。由此证明,本发明实施例提供的牙周再生制剂植入牙周缺损部位,可以在炎症环境下进行免疫调节,促进牙周组织再生。
具体的,所述促牙周再生制剂还包括:体外扩增牙囊干细胞。
本发明实施例中,为了进一步促进牙周组织再生修复,还可以在促牙周再生制剂中添加体外扩增牙囊干细胞,从而骨膜蛋白可以在炎症环境下进行免疫调节,促进牙囊干细胞的增殖和成骨分化能力,以促进牙周组织再生。
本发明实施例中,体外扩增牙囊干细胞的获取方法可以参考相关技术中任意成熟的细胞扩增方法。
第二方面,本发明实施例提供了一种骨膜蛋白分子制剂,所述骨膜蛋白分子制剂的组成成分包括:骨膜蛋白、载体试剂,所述骨膜蛋白的浓度为100ng/ml。
具体的,所述载体试剂为重组胶原凝胶。
具体的,所述骨膜蛋白分子制剂还包括:体外扩增牙囊干细胞,所述骨膜蛋白分子制剂用于植入牙周缺损部位,所述骨膜蛋白用于在炎症环境下进行免疫调节,促进牙囊干细胞的增殖和成骨分化能力,促进牙周组织再生。
本发明实施例中,将骨膜蛋白和重组胶原凝胶可以制备得到骨膜蛋白凝胶,便于临床应用。在具体应用时,可以将骨膜蛋白凝胶填充到牙周缺损部位。
第三方面,本发明实施例提供了一种骨膜蛋白分子制剂的制备方法,如图1所示,其示出了本发明实施例提供的骨膜蛋白分子制剂的制备方法的流程图,具体的,所述方法包括以下步骤:
S101:制备胶原蛋白溶液。
具体的,本发明实施例中,可以按照相关技术中任意成熟可行的方法和原材料制备得到胶原蛋白凝胶,所述胶原蛋白凝胶可以保持骨膜蛋白的活性。
S102:将骨膜蛋白与所述胶原蛋白溶液混合,得到混合溶液。
S103:静置所述混合溶液,得到骨膜蛋白分子制剂。
为使本领域技术人员更好地理解本发明,以下通过具体的实施例来说明本发明提供的骨膜蛋白的应用、产品及产品制备方法。
实施例1:骨膜蛋白分子制剂的制备
根据说明书(Nitta Gelatin,Japan)制备重构的胶原蛋白溶液。然后加入适量的rh骨膜蛋白,混合至终浓度为100ng/ml。将溶液在37℃下放置30分钟以变成凝胶。将上述凝胶植入大鼠上颌第一磨牙缺损处。
说明书:(冰上操作)将试剂盒中的ABC组分按8:1:1混合(先混合AB,再添加C)得到骨膜蛋白凝胶,然后将r骨膜蛋白按100ng/ml加入上述重组胶原溶液中。将此混合溶液在37℃下放置30分钟以变成凝胶。(A:Cellmatrix I-A,B:10X conc.Sterile culture mediumwithoutNaHCO3,C:Sterile reconstitution buffer)。
实施例2:Collagen-matrix搭载的rh骨膜蛋白促进牙周组织再生
1)动物模型的构建:
本发明实施例中,动物获自达硕实验动物有限公司(中国成都)。获取8周龄雄性SD大鼠(200-250g)随机分为三组。将所有大鼠安置在特定的无病原体环境中。
通过腹膜内注射用戊巴比妥(1mg/kg)麻醉大鼠,并用丁丙诺啡(0.05mg/kg)将疼痛降至最低。用5.0棉线结扎左上颌第一磨牙并接种P.g.(33577,2*10
然后,在第一磨牙的近中根面产生尺寸为2*2*1.5mm(W*L*D)的牙周缺损。然后用盐水冲洗缺损并用无菌棉球干燥,除未处理组(control;n=3)外,其余两组植入胶原凝胶(collagen;n=3)或载有rh骨膜蛋白的胶原凝胶(col-骨膜蛋白;n=3)。最后,间断缝合关闭创口。术后3天每天一次皮下注射抗生素(Eufloxacin;0.1ml/100g)和镇痛剂(Camprofen;0.1ml/100g)。在第28天,处死动物用于后续分析。
2)微型计算机断层扫描评估:
通过SkyScan 1176desktop X-ray micro-CT system(Skyscan,Belgium)以18-μm的分辨率扫描收获和固定的上颌骨。根据缺陷的大小和位置,为3维(3-D)测量和随后的分析定义了大约0.125mm3的感兴趣区域(ROI)。测量骨体积占总体积的百分比(BV/TV,%)、小梁分离(Tb.Sp,mm)、小梁厚度(Tb.Th,mm)和小梁数(Tb.N,1/mm)通过CTAn软件(Burkermicro-CT,Kontich,Belgium)分析。
3)组织学、免疫组织化学和免疫荧光分析
将所有骨标本均经过脱钙、脱水和包埋。获得连续切片(5μm),然后根据制造商推荐的方案用苏木精和伊红(HE)、Masson三色(MT)染色。所有样品在倒置显微镜(Olympus,Japan)或共聚焦激光扫描显微镜(Olympus,Japan)下成像,并使用Image J软件进行半定量分析。每个测定一式三份进行。
4)结果:
图2示出了本发明实施例中植入后4周各组的组织学染色结果。其中,黑色虚线表示新形成的牙槽骨的边缘。a:牙槽骨;c:牙骨质;p:牙周膜。4周组织学染色结果显示,3组均可观察到新的牙槽骨再生,但骨膜蛋白+胶原组的骨充盈明显优于其他两组,且牙槽骨更致密,牙周膜排列有序,牙龈附着位置也更高。
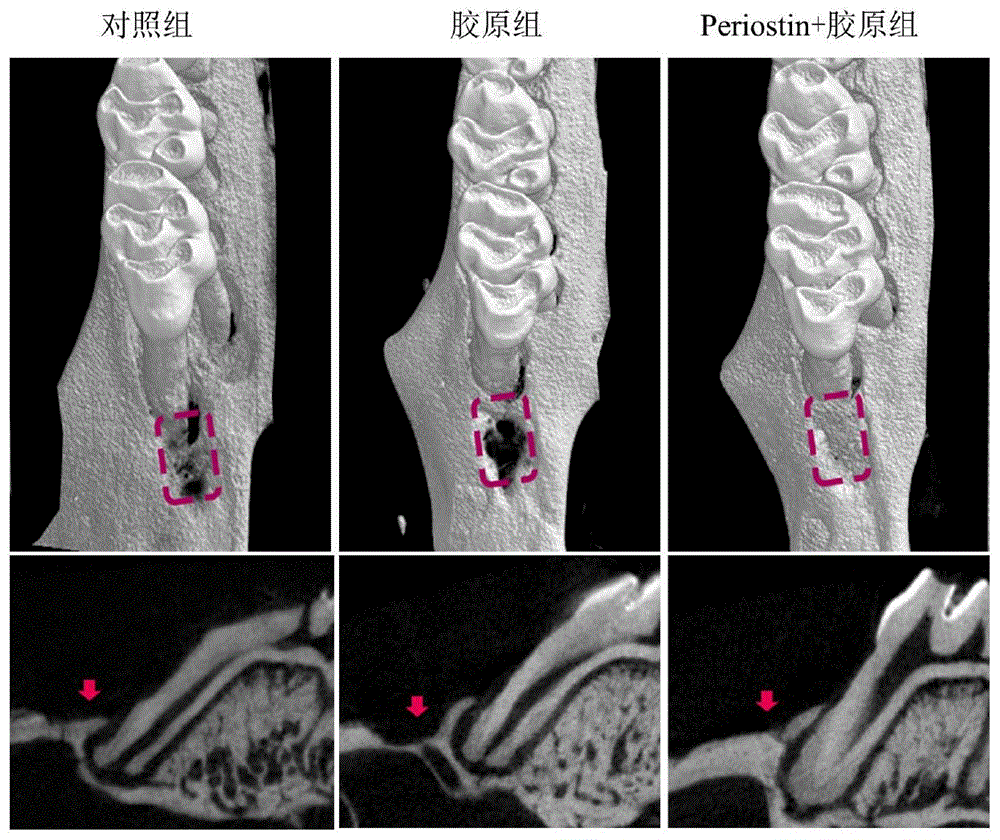
图3示出了本发明实施例中,各组上颌第一磨牙缺损区的micro-CT图像。上排显示3D图像,矩形区域表示缺陷区域;下一行是矢状图,红色箭头指向缺陷区域。可以看到,骨膜蛋白+胶原组缺损区可见明显骨组织再生,而对照组和胶原组的缺损仍然明显,仅见少量牙槽骨。
图4示出了本发明实施例中,4周时缺损区骨再生的定量显微CT评估结果,其中,BV/TV表示:骨体积分数,Tb.Sp表示:骨小梁分离度,Tb.Th表示:骨小梁厚度,Tb.N表示:骨小梁数。Micro-CT分析显示,col-骨膜蛋白组的BV/TV和Tb.Th显着高于胶原蛋白组和对照组(如图7中B部分和C部分所示)。三组在其他指标上无统计学差异。
4周组织学染色结果显示,3组均可观察到新的牙槽骨,但col-骨膜蛋白组的骨填充明显优于其他两组,且牙槽骨更致密,接近于健康组(如图7中A部分所示)。这些结果证明了骨膜蛋白在促进牙周组织再生方面的作用。
实施例3:DFSC片在炎症微环境中促进牙周组织再生的治疗作用
本发明实施例中,采用经典的丝线结扎+涂菌法在SD大鼠上颌第一磨牙建立实验性牙周炎模型。一周后,制造牙周骨内缺损并移植提前转染了GFP慢病毒DFSCs(sh-ncDFSCs)以追踪其命运。图5示出了DFSCs移植后的DFSCs存活率结果图。其中,A部分为动物模型建立及效果分析示意图。B部分为移植后3、7、14和28天缺损区DFSCs存活情况的代表性图像,其中,红色虚线表示牙根的轮廓,白色虚线框表示缺损区域,紫色虚线表示牙槽骨,黄色箭头表示DFSCs。r表示:根;d表示:缺陷面积;na表示:新形成的牙槽骨。*p<0.05;**p<0.01;***p<0.001。误差线是平均值±SD。使用独立的非配对student t检验分析数据。
由图5可见,植入后3天,在缺损区域可以观察到大量的绿色荧光。在第7天,大约40%的GFP+移植细胞仍位于缺损区域,而在第2周和第4周时,它们大大减少到不到5%(如图5中B部分和C部分所示)。此外,GFP+DFSCs不与骨细胞、牙周膜细胞和成牙骨质细胞共定位,而是始终位于再生牙周组织周围(如图5中B部分所示)。这一结果表明DFSCs植入后随时间延长,逐渐减少,并且可能并未进行转分化。
图6示出了植入DFSC膜片后缺损区的牙周再生情况结果分析图。其中,图6中A部分和B部分分别示出了在移植DFSCs后2周(A)和4周(B)通过HE和MASSON染色对缺损区进行组织学分析结果,其中显示的是代表性图像,中间排代表第一排黑框所示的放大视图,黑色箭头表示新形成的牙槽骨,而R表示根面,黑色虚线表示新形成的牙槽骨的边缘,a表示:牙槽骨;c表示:牙骨质;p表示:牙周韧带,s表示:DFSCs。图6中C部分示出了不同组缺陷区域的代表性显微CT图像,其中,上排显示3D图像,矩形区域表示缺陷区域;下排是矢状视图,红色箭头指向缺陷区域。图6中D部分示出了4周时缺损区域骨再生的定量显微CT评估,其中,测量指标为BV/TV(%)、Tb.Sp(mm)、Tb.Th(mm)和Tb.N(1/mm)。*p<0.05;**p<0.01;***p<0.001。误差线是平均值±SD。使用独立的非配对student t检验分析数据。
由图6可见,在2周时,对照组和sh-ncDFSCs组都观察到新形成的骨组织,但后者在牙槽骨高度和牙龈丰满度方面明显优于对照组(如图6中A部分所示)。sh-ncDFSCs组牙周膜排列整齐,对照组排列紊乱。4周时,sh-ncDFSCs组新形成的牙槽骨丰满致密,与健康组接近(如图6中B部分所示)。对照组的骨充盈明显低于sh-ncDFSCs组,根面仅可见一层薄薄的牙槽骨,缺损区软组织松散塌陷。此外,对照组牙龈软组织塌陷比sh-ncDFSCs组更明显。对牙槽骨的micro-CT评估显示,与对照组相比,sh-ncDFSCs组的BV/TV和Tb.Th百分比显着更高如图6中C部分和D部分所示)。此外,sh-ncDFSCs组与健康组之间无统计学差异。这些结果表明,尽管植入后的存活率较低,但DFSCs在炎症性牙周缺损大鼠模型中促进了牙周组织的再生。
图7示出了植入DFSC膜片后缺损区免疫微环境的情况分析结果图。其中,A部分示出了在移植后3天,对从对照组和sh-ncDFSCs组获得的样本中的缺损区域进行HE染色的结果,健康组显示相同区域,右图为左图中的黑框表示的放大视图。B部分示出了手术后第14天针对CD68、CD163和NOS2的免疫组化染色结果,其中,蓝色虚线表示牙槽骨的轮廓,a表示:牙槽骨;p表示:牙周韧带。C部分示出了手术后第14天对缺损区CD68+细胞数、CD163+细胞数和NOS2+细胞数进行定量分析。*p<0.05;**p<0.01;***p<0.001。误差线是平均值±SD。使用独立的非配对student t检验分析数据。
由图7可知,HE染色的结果显示,3天时,对照组出现典型的急性炎症反应,组织充血水肿,缺损区伴有大量炎性细胞。sh-ncDFSCs组也可见组织水肿,但炎症细胞浸润明显减少(如图7中A部分所示)。IHC的结果显示sh-ncDFSCs组浸润的巨噬细胞明显比对照组更多(如图7中B部分和C部分所示)。此外,sh-ncDFSCs组中的CD163+的M2巨噬细胞数比对照组更多(如图7中B部分和C部分所示),而对照组显示出更高数量的NOS2+巨噬细胞(M1巨噬细胞)(如图7中B部分和C部分所示)。这些结果表明在炎症微环境中DFSCs移植到牙周缺损处,可能通过改变局部免疫微环境,募集巨噬细胞,增加M2巨噬细胞的数量,从而促进牙周组织的再生。
图8示出了缺损区域骨膜蛋白的表达情况分析结果。其中,A部分示出了在第3天和第7天时,在缺损区域对骨膜蛋白进行免疫荧光染色的代表性图像。B部分示出了第3天和第7天时,各组骨膜蛋白的总荧光强度定量分析结果。*p<0.05;**p<0.01;***p<0.001。误差线是平均值±SD。使用独立的非配对student t检验分析数据。
本发明实施例中,为了研究骨膜蛋白是否参与DFSCs调节免疫和促进牙周再生的过程,检测了在早期修复阶段骨膜蛋白的表达水平。免疫荧光的结果显示,第7天时对照组骨膜蛋白的表达高于第3天。在sh-nc组中,无论在第3天还是第7天,骨膜蛋白均呈现高水平表达,且表达高于对照组(如图8中A部分所示)。这些结果表明,DFSCs植入后良好的再生效果可能与骨膜蛋白的高表达有关。
由此,本发明实施例提出,牙囊干细胞分泌的骨膜蛋白可以促进牙周再生,基于此,本发明实施例提出,将骨膜蛋白作为主要成分和载体试剂制成骨膜蛋白分子制剂,用于促进牙周再生。
实施例4:炎症微环境中骨膜蛋白通过intergrimαM/p-Erk/Erk/CD163信号通路促进巨噬细胞重编程
1、人急性白血病单核细胞系细胞(Human acute leukaemia monocyticcellline,THP-1)培养:
本发明实施例中,THP-1细胞购自美国典型培养物保藏中心(American TypeCulture Collection,ATCC)。将细胞接种在6孔板(2×10
2、Transwell试验
将巨噬细胞以1×10
3、定量逆转录聚合酶链反应(qRT-PCR)
根据制造商的方案(天漠生物科技,中国北京)使用TRIzol试剂分离总RNA。使用iScript cDNA合成试剂盒(Vazyme,南京,中国)将RNA(1μg)转化为cDNA。使用GAPDH表达作为内部对照,通过2
4、流式细胞术
THP-1衍生的巨噬细胞中intergrimαM、CD163和NOS2的表达通过BD Accuri C6(Becton Dickinson,美国)测定荧光并使用FlowJo V10软件进行分析。根据制造商的说明,收集贴壁细胞并在4℃下用抗体染色30分钟。
5、蛋白质印迹分析
细胞在RIPA缓冲液(KeyGEN Biotech,中国南京)中用1mM蛋白酶抑制剂苯甲磺酰氟裂解30分钟,然后提取蛋白质。测试蛋白的相对强度。
6、结果:
图9示出了骨膜蛋白促进巨噬细胞浸润的Transwell结果分析图。其中,部分示出了Transwell测定的代表性图像;B部分示出了和细胞数量定量分析结果;图9显示了骨膜蛋白对巨噬细胞迁移的影响。可见,骨膜蛋白组募集的巨噬细胞数目明显多于对照组。
图10示出了骨膜蛋白促进巨噬细胞重编程为M2型的信号通路分析结果图,其中,A部分示出了骨膜素处理Pg-LPS刺激后的巨噬细胞中促炎标志物的qRT-PCR结果,纵坐标表示mRNA相对表达量;B部分示出了骨膜蛋白处理Pg-LPS刺激后的巨噬细胞中CD163和ERK信号通路的蛋白质印迹分析结果,其中,添加DMSO、10μg/ml U0126(LP-U1)或20μg/ml U0126(LP-U2)以检测ERK信号通路在骨膜素促进CD163表达中的作用;C部分示出了骨膜蛋白和(或)Erk信号通路抑制剂处理Pg-LPS刺激后的巨噬细胞中CD163和p-Erk/Erk的蛋白相对表达量分析结果;D部分示出了使用intergrimαM中和抗体(ITGAM)处理骨膜素刺激后的巨噬细胞中CD163和ERK磷酸化的蛋白质印迹分析结果;E部分示出了使用intergrimαM中和抗体(ITGAM)处理骨膜素刺激后的巨噬细胞中CD163和p-Erk/Erk的蛋白相对表达量分析结果。
可知,RhPeriostin抑制M1巨噬细胞中NOS2、IL-1β、IL-6和IL-12mRNA的表达(如图10中B部分所示)。在蛋白质水平,rhPeriostin促进了CD163蛋白的表达(如图10中C部分所示)。前期研究表明Periostin对巨噬细胞的作用可能与Erk信号通路有关。因此,蛋白质印迹分析检测到Erk信号通路的激活,rhPeriostin的加入可以激活p-Erk/Erk信号通路(如图10中C部分所示)。体系中加入ERK信号通路抑制剂(U0126),rhPeriostin促进巨噬细胞CD163表达的作用随后被显着抑制(如图10中C部分所示),表明rhPeriostin对巨噬细胞CD163表达的促进作用部分是通过其下游p-Erk/Erk信号通路的激活。在体系中加入intergrimαM的中和抗体,蛋白质印迹分析显示p-Erk/Erk信号通路受到抑制,CD163的表达随之降低(如图10中E部分所示)。这些结果表明rhPeriostin可以促进炎症微环境中CD163的表达,这一作用主要是通过与巨噬细胞表面受体整合素αM结合并激活下游p-Erk/Erk信号通路产生的。
对于方法实施例,为了简单描述,故将其都表述为一系列的动作组合,但是本领域技术人员应该知悉,本发明并不受所描述的动作顺序的限制,因为依据本发明,某些步骤可以采用其他顺序或者同时进行。其次,本领域技术人员也应该知悉,说明书中所描述的实施例均属于优选实施例,所涉及的动作和部件并不一定是本发明所必须的。
以上对本发明所提供的一种骨膜蛋白的应用、产品及产品制备方法进行了详细介绍,本文中应用了具体个例对本发明的原理及实施方式进行了阐述,以上实施例的说明只是用于帮助理解本发明的方法及其核心思想;同时,对于本领域的一般技术人员,依据本发明的思想,在具体实施方式及应用范围上均会有改变之处,综上所述,本说明书内容不应理解为对本发明的限制。
