一种丝素蛋白改性材料及其制备方法和应用
文献发布时间:2023-06-19 19:27:02
技术领域
本申请属于生物功能材料技术领域,具体涉及一种丝素蛋白改性材料及其制备方法和应用。
背景技术
丝素蛋白作为纯天然多功能环境友好型生物材料,因其优良的生物可降解性、生物相容性和易加工性备受关注,丝素蛋白作为原料在各个领域得到了广泛的研究,特别是在生物支架领域,丝素蛋白具备了支架要求的所有特征,其中包括生物相容性、导骨性、支持细胞活动、无毒性、允许细胞在其上粘附增值、促进血管化的特性。
可丝素蛋白本身的模量与机械性能并不能兼顾刚度与柔韧度,中国发明专利CN111228215A公开了一种自组装可成像聚乙二醇-丝素蛋白水凝胶,利用聚乙二醇优异的生物相容性和药物缓释型制备出了生物相容性极好的丝素蛋白水凝胶,但是其机械性能并未得到有效改善。为了提高丝素蛋白的机械强度,中国发明专利CN102174203B公开了一种聚乳酸-聚乙二醇-聚乳酸共聚物加入丝素蛋白溶液静置、形成为水凝胶的策略。分别调节共聚物浓度和聚乙二醇链段比例可以控制水凝胶的力学性能。但是生物相容性问题还没得到改进,且其改善力学性能的原理仅为可逆的物理交联过程,决定了其水凝胶机械性能提升不大。中国发明专利CN110420354B公开了一种增强型丝素蛋白人工颚骨载体支架,通过分子量6000~12000的聚乙二醇(PEG)与丝素蛋白溶解液的混合交联,得到了低免疫排斥、定向成骨诱导分化能力的支架,虽其力学性能得到了提高,但仍属于可逆的物理交联,提升的机械性能并不大。
发明内容
本申请的目的在于克服现有技术的不足,提供一种丝素蛋白改性材料及其制备方法和应用,以解决现有技术中的丝素蛋白基生物材料的刚度和柔韧度不能兼顾以及机械性能不能得到有效提升的技术问题。
为了实现上述申请目的,第一方面,本申请提供了一种丝素蛋白改性材料的制备方法,包括以下步骤:
获取包括至少两个第一端基活性基团的柔性高分子物质;
获取能与丝素蛋白发生β-折叠的肽嵌段,所述肽嵌段的单端带有第二活性基团;
使所述柔性高分子物质和所述肽嵌段发生键合反应,所述第一端基活性基团和所述第二活性基团间形成共价键,反应后得到所述丝素蛋白改性材料。
进一步地,所述共价键包括酯键、酰胺键、脲键、酸酐、取代三氮唑中的至少一种。
进一步地,所述第一端基活性基团各自相同或不同地取自羧基、羟基、氨基、炔基、巯基、硫醇、醇胺、叠氮、卤代烃中的任意一种。
进一步地,所述肽嵌段的肽序列包括GSGAGA、GSGA、GAGA、GGAG、AAGA中的至少一种。
进一步地,所述柔性高分子物质的柔性链段包括聚乙二醇、聚丙二醇、聚乙烯醇、聚乙醇酸、聚己内酯、聚乳酸、聚羟基乙酸、聚乳酸-羟基乙酸共聚物、脂肪族芳香族无规共聚酯、聚己内酯-聚乙二醇-聚己内酯、聚己内酯三醇、三羟基聚氧化丙烯醚、四臂-聚乙二醇、八臂-聚乙二醇、树状聚乙二醇、聚醚多元醇、聚己内酯多元醇中的至少一种。
进一步地,所述柔性链段的分子量为400~20000道尔顿。
进一步地,所述键合反应中,所述柔性高分子物质与所述肽嵌段的摩尔比为1:n~2n,其中n为所述第一端基活性基团的数量。
第二方面,本申请还提供了一种丝素蛋白改性材料,所述丝素蛋白改性材料采用上述任意一项所述的制备方法得到。
第三方面,本申请还提供了一种丝素蛋白改性材料在丝素蛋白改性上的应用,应用过程包括使丝素蛋白改性材料和丝素蛋白接触,诱导并共同构成β-折叠结构。
进一步地,所述丝素蛋白改性材料的添加量小于所述丝素蛋白的质量;和/或,
所述β-折叠反应的溶剂包括水、二甲基亚砜、氮,氮-二甲基甲酰胺、氮,氮-二甲基乙酰胺、乙腈、甲酸、乙酸、盐酸胍、尿素中的至少一种。
与现有技术相比,本申请具有以下的技术效果:
本申请制备出的丝素蛋白改性材料与丝素蛋白间发生的相互作用为特异性的氢键协同作用,形成β-折叠结构,具有更强的结合键能,协同丝素蛋白改性材料刚柔相济的化学结构,以超分子作用交联丝素蛋白,对丝素蛋白机械性能的提升更大;本申请制备出的丝素蛋白改性材料可调节改性丝素蛋白的断裂强度、断裂拉伸率和模量,随着丝素蛋白改性材料的加入总质量和种类的变化,丝素蛋白的机械性能有显著变化;本申请制备的丝素蛋白改性材料能与丝素蛋白共同构成β-折叠结构,充分发挥柔性高分子物质对外力产生滑移的特性,从而提高丝素蛋白的机械性能,以达到同时兼顾强度性能和拉伸性能(柔韧性能)的效果。
本申请制备丝素蛋白改性材料所使用的原料皆为生物材料或高生物相容性材料,具有低毒、可生物降解、无免疫原性等特点,具备广阔的市场应用前景。
附图说明
为了更清楚地说明本申请实施例中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本申请的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动性的前提下,还可以根据这些附图获得其他的附图。
图1为本申请实施例提供的丝素蛋白改性材料的分子结构示意图;
图2为本申请实施例提供的一种丝素蛋白改性材料的合成路线示意图;
图3为本申请实施例1提供的一种丝素蛋白改性材料的核磁共振氢谱(
图4为本申请实施例1提供的纯丝素蛋白(a)和改性丝素蛋白(b)的傅里叶变换红外光谱(FT-IR)图;
图5为本申请实施例1提供的纯丝素蛋白(a)、实施例1提供的改性丝素蛋白(b)、实施例2提供的改性丝素蛋白(c)、对比例1提供的改性丝素蛋白(d)和对比例2提供的改性丝素蛋白(e)的扫描电子显微镜(SEM)图;
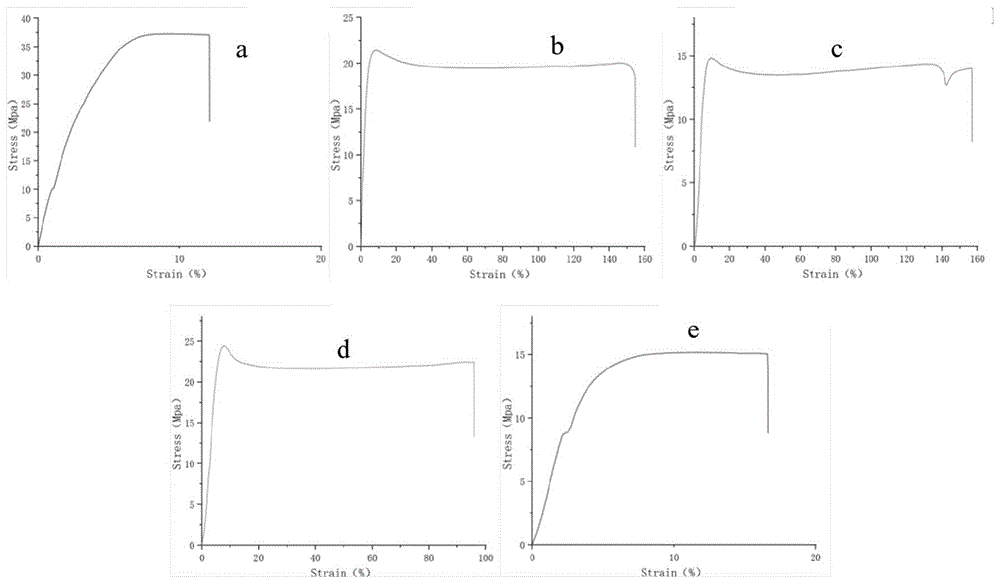
图6为本申请实施例1提供的纯丝素蛋白(a)、实施例1提供的改性丝素蛋白(b)、实施例2提供的改性丝素蛋白(c)、对比例1提供的改性丝素蛋白(d)和对比例2提供的改性丝素蛋白(e)的断裂强度/断裂伸长率示意图。
具体实施方式
为了使本申请要解决的技术问题、技术方案及有益效果更加清楚明白,以下结合实施例,对本申请进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本申请,并不用于限定本申请。
本申请中,术语“和/或”,描述关联对象的关联关系,表示可以存在三种关系,例如,A和/或B,可以表示:单独存在A,同时存在A和B,单独存在B的情况。其中A,B可以是单数或者复数。字符“/”一般表示前后关联对象是一种“或”的关系。
本申请中,“至少一个”是指一个或者多个,“多个”是指两个或两个以上。“以下至少一项(个)”或其类似表达,是指的这些项中的任意组合,包括单项(个)或复数项(个)的任意组合。例如,“a,b,或c中的至少一项(个)”,或,“a,b,和c中的至少一项(个)”,均可以表示:a,b,c,a-b(即a和b),a-c,b-c,或a-b-c,其中a,b,c分别可以是单个,也可以是多个。
应理解,在本申请的各种实施例中,上述各过程的序号的大小并不意味着执行顺序的先后,部分或全部步骤可以并行执行或先后执行,各过程的执行顺序应以其功能和内在逻辑确定,而不应对本申请实施例的实施过程构成任何限定。
在本申请实施例中使用的术语是仅仅出于描述特定实施例的目的,而非旨在限制本申请。在本申请实施例和所附权利要求书中所使用的单数形式的“一种”、“所述”和“该”也旨在包括多数形式,除非上下文清楚地表示其他含义。
本申请实施例说明书中所提到的相关成分的重量不仅仅可以指代各组分的具体含量,也可以表示各组分间重量的比例关系,因此,只要是按照本申请实施例说明书相关组分的含量按比例放大或缩小均在本申请实施例说明书公开的范围之内。具体地,本申请实施例说明书中所述的质量可以是μg、mg、g、kg等化工领域公知的质量单位。
术语“第一”、“第二”仅用于描述目的,用来将目的如物质彼此区分开,而不能理解为指示或暗示相对重要性或者隐含指明所指示的技术特征的数量。例如,在不脱离本申请实施例范围的情况下,第一XX也可以被称为第二XX,类似地,第二XX也可以被称为第一XX。由此,限定有“第一”、“第二”的特征可以明示或者隐含地包括一个或者更多个该特征。
第一方面,本申请实施例提供了一种丝素蛋白改性材料的制备方法,包括以下步骤:
(1)获取包括至少两个第一端基活性基团的柔性高分子物质;
(2)获取能与丝素蛋白发生β-折叠的肽嵌段,肽嵌段的单端带有第二活性基团;
(3)使柔性高分子物质和肽嵌段发生键合反应,第一端基活性基团和第二活性基团间形成共价键,反应后得到丝素蛋白改性材料。
上述步骤(1)中,本申请实施例的柔性高分子物质由位于结构中间部分的柔性链段和连接在柔性链段端基上的第一端基活性基团构成,柔性高分子物质可以为带有两个第一端基活性基团的流星锤状分子,柔性链段包括但不限于聚乙二醇、聚丙二醇、聚乙烯醇、聚乙醇酸、聚己内酯、聚乳酸、聚羟基乙酸、聚乳酸-羟基乙酸共聚物、脂肪族芳香族无规共聚酯、聚己内酯-聚乙二醇-聚己内酯等;柔性高分子物质也可以为带有三个第一端基活性基团的三叉星状分子,柔性链段包括但不限于聚己内酯三醇、三羟基聚氧化丙烯醚等;柔性高分子物质也可以为带有四个第一端基活性基团的四叉树状分子,柔性链段包括但不限于四臂-聚乙二醇等;柔性高分子物质还可以为带有多个第一端基活性基团的树状分子,柔性链段包括但不限于八臂-聚乙二醇、树状聚乙二醇、聚醚多元醇、聚己内酯多元醇或其他能提供柔性链段、端基拥有多个第一端基活性基团的物质。
本申请实施例的柔性链段可以选择低毒、易降解、高度亲水、良好生物相容性、良好的血液相容性、无免疫原性特性、刚柔并济的链段。
本申请实施例的柔性高分子物质所带的第一端基活性基团各自可以取相同、也可以取不同的基团,第一端基活性基团可以取自羧基、羟基、氨基、炔基、巯基、硫醇、醇胺、叠氮、卤代烃中的任意一种。第一端基活性基团易于与蛋白质等物质键合,以免降低丝素蛋白的生物兼容性。第一端基活性基团与蛋白质反应后,仍能保留柔性高分子物质优异的中间柔性长链结构,为丝素蛋白增加机械强度。
本申请实施例的柔性高分子物质的柔性链段的分子量为400~20000道尔顿,因为过低或过高的分子量会导致对外力的滑移效果变差,甚至出现相分离的现象,破坏丝素蛋白本身的结构,最终导致丝素蛋白机械性能的大幅度损失。
本申请实施例的柔性高分子物质可以由不含第一端基活性基团的、有柔性链段的高分子物质和带有第一端基活性基团的物质间发生端基基团活化反应获得。
上述步骤(2)中,本申请实施例的肽嵌段的单端带有第二活性基团,即本申请实施例的肽嵌段的一端是封端的,另一端修饰或者保留可以和柔性高分子物质的第一端基活性基团发生反应的第二活性基团,第二活性基团可以取自羧基、羟基、氨基、炔基、巯基、硫醇、醇胺、叠氮、卤代烃中的任意一种。
形成β-折叠结构要求侧链基团越小越好,丝素蛋白结晶区大多是由甘氨酸和丙氨酸间隔组成,其中每两次间隔就穿插一个丝氨酸,所以在结晶区的组成中大多仅有一个氢原子或甲基。Gly-Ser-Gly-Ala-Gly-Ala(GSGAGA)作为丝素蛋白中形成silkⅡ中β-折叠的主要重复单元,在丝素蛋白的组成中扮演着提供机械强度的重要的角色。丝素蛋白有着特殊的半结晶结构,其中β-折叠可视为由微小的结晶分散于无定型的基体中,其结晶区的β-折叠构型直接影响了丝素蛋白的机械强度性能,除此之外,包括但不限于GSGA、GAGA、GGAG、AAGA等类似或是其各自独立单元的重复结构也能达到预料效果。因此,本申请实施例所选取的肽嵌段的肽序列包括但不限于GSGAGA、GSGA、GAGA、GGAG、AAGA中的至少一种,可以是含有GSGAGA、GSGA、GAGA、GGAG、AAGA重复单元的肽序列,这些肽序列均能与丝素蛋白发生β-折叠。其中,肽序列中的G代表GLY,即甘氨酸;S代表SER,即丝氨酸;A代表ALA,即丙氨酸。
上述步骤(3)中,键合反应中,柔性高分子物质与肽嵌段的摩尔比为1:n~2n,其中n为第一端基活性基团的数量,这样可以保证每一个柔性高分子物质的第一端基活性基团都与肽嵌段上的第二活性基团发生键合反应。通过键合反应,第一端基活性基团和第二活性基团间形成共价键,共价键包括但不限于酯键、酰胺键、脲键、酸酐、取代三氮唑中的至少一种。
第二方面,本申请实施例还提供了一种丝素蛋白改性材料,该丝素蛋白改性材料采用上述所述的制备方法得到。
丝素蛋白改性材料的分子结构示意图如图1所示。从图1中看到,选取不同结构的中间柔性链段,可以衍生出多种不同结合形式的高分子柔性物质,以达到增强丝素蛋白机械性能的目的。
图2示出了一种丝素蛋白改性材料的合成路线示意图。根据所需的丝素蛋白改性材料的分子构象,可自由选择合成的柔性高分子物质的构象,柔性高分子物质的构象包括但不限于流星锤状、三叉星状、四叉树状和树状分子,如图1所示。还可以自由选择形成β-折叠的肽嵌段,如GSGAGA、GSGA、GAGA、GGAG、AAGA等或是上述的重复序列,在SilkⅡ反平行β-折叠结构中提供机械强度。根据不同的活性基团,如羧基、羟基、氨基、炔基、巯基、硫醇、醇胺、叠氮、卤代烃等与柔性高分子链段上的其他活性基团反应构成如酯键、酰胺键、脲键、酸酐、取代三氮唑等的化学接连结构。随着诱导的发生,诱导丝素蛋白改性材料的肽链段和丝素蛋白共同构成β-折叠结构,并利用丝素蛋白改性材料的刚柔相济的分子结构,以超分子作用交联丝素蛋白从而实现提高丝素蛋白机械性能的目的。
本申请实施例制备出的丝素蛋白改性材料与丝素蛋白间发生的相互作用为利用氢键和疏水相互作用协同共同构成β-折叠结构,丝素蛋白改性材料的肽链段与丝素蛋白间具有强的结合键能,并利用丝素蛋白改性材料的刚柔相济的分子结构,以超分子作用交联丝素蛋白,对丝素蛋白机械性能的提升更大;本申请实施例制备出的丝素蛋白改性材料可调节改性丝素蛋白的断裂强度、断裂拉伸率和模量,随着丝素蛋白改性材料的加入总质量和种类的变化,丝素蛋白的机械性能有显著变化;本申请实施例制备的丝素蛋白改性材料能与丝素蛋白发生β-折叠,充分发挥柔性高分子物质对外力产生滑移的特性,从而提高丝素蛋白的机械性能,以达到同时兼顾强度性能和拉伸性能(柔韧性能)的效果。
第三方面,本申请实施例还提供了一种丝素蛋白改性材料在丝素蛋白改性上的应用,应用过程包括使上述制备的丝素蛋白改性材料和丝素蛋白接触,并诱导共同构成β-折叠结构,通过β-折叠结构将丝素蛋白超分子交联。
通过将丝素蛋白改性材料和丝素蛋白按比例混合,可以得到改性的具有β-折叠结构的、兼顾柔韧性和刚性的丝素蛋白生物材料。
改性混合过程中,丝素蛋白改性材料的添加量小于丝素蛋白的质量,占丝素蛋白改性材料和丝素蛋白总质量的1~50%。丝素蛋白、丝素蛋白改性材料与溶剂的比例可以根据实际要求变化,最终添加量可根据所需改性丝素蛋白的总质量、丝素蛋白改性材料的种类和溶剂的体积等做适量调整。丝素蛋白改性材料的添加种类可根据最终设计需求进行优化,可以不同种类、不同比例混合,如流星锤状聚乙二醇混合三叉星状聚己内酯三醇、流星锤状聚己内酯混合四叉树状四臂-聚乙二醇、树状-聚乙二醇等。
改性混合过程中,β-折叠反应的溶剂包括但不限于水、二甲基亚砜、氮,氮-二甲基甲酰胺、氮,氮-二甲基乙酰胺、乙腈、甲酸、乙酸、盐酸胍、尿素中的至少一种。
本申请实施例的丝素蛋白改性材料能与丝素蛋白构成β-折叠结构,充分发挥丝素蛋白改性材料中柔性高分子链段对外力产生滑移的特性,从而提高丝素蛋白的机械性能,以达到同时兼顾强度性能和拉伸性能的效果。
本申请实施例通过使用柔性高分子物质,利用柔性高分子物质的中间柔性链段对外力的滑移作用,柔性链段端基连接可与丝素蛋白形成β-折叠的肽链,从而形成流星锤状、三叉星状、四叉树状、树状等特殊结构的分子。丝素蛋白改性材料可诱导与丝素蛋白自组装,解决了丝素蛋白材料作为生物填充材料时韧性和刚性不能兼得,并且其他韧性增强材料引入会降低生物相容性和生物可降解性的问题,扩宽了其应用。本申请实施例的丝素蛋白改性材料有着低毒、可降解性、生物相容性、无免疫原性等特点,有应用于医疗和生物功能材料方面的潜力。
以下通过多个具体实施例来举例说明本申请实施例的一种丝素蛋白改性材料及其制备方法和应用。
实施例1
本申请实施例1提供一种丝素蛋白改性材料及其制备方法和应用,包括以下步骤:
(1)将5g蚕茧切成小块,入2000mL浓度为0.2%的碳酸钠水溶液中,在100℃下煮30分钟以除去丝胶,去离子水清洗后拉松,在通风橱干燥一夜,得到脱胶后的家蚕丝素蛋白,将脱胶后的丝素蛋白4g溶解于16mL的9.3M溴化锂水溶液中,搅拌直至丝素蛋白完全溶解,得到的丝素蛋白溶解液倒入透析袋中,在2000mL去离子水中搅拌透析48小时,其中透析袋半透膜的截留分子量为100kDa。将所得纯化家蚕丝素蛋白溶解液用液氮冷冻后冷冻干燥48小时,得到具有α-螺旋结构的丝素蛋白。将得到的干燥丝素蛋白按照1g:19mL比例溶解于甲酸中备用。
(2)聚乙二醇(PEG)与丁二酸酐反应制备柔性高分子物质:称取聚乙二醇PEG(分子量为2000)4g、丁二酸酐2g、4-二甲氨基吡啶(DMAP)0.153g、二环己基碳二亚胺(DCC)2.06g,加入20mL四氢呋喃(THF)中,加入8.32mL三乙胺(TEA)作为缚酸剂,在75℃的油浴锅中反应回流5小时,得到产物后旋蒸除去四氢呋喃(THF),加入二氯甲烷(CH
(3)丝素蛋白结晶区肽GSGAGA封端制备肽嵌段:取Gly-Ser-Gly-Ala-Gly-Ala(GSGAGA)0.209g、苯胺0.455mL、4-二甲氨基吡啶(DMAP)0.0066g、环己基碳二亚胺(DCC)0.206g,加入12mL氮,氮-二甲基甲酰胺(DMF)中,在50℃油浴锅中反应回流5小时,减压蒸馏后,得到产物加入去离子水、过滤后真空冷冻干燥48小时得到氮-一氨基-肽苯酚酯。
(4)制备丝素蛋白改性材料:取步骤(2)得到的羧酸-聚乙二醇-羧酸2.1g、步骤(3)得到的氮-一氨基-肽苯酚酯0.2505g、4-二甲氨基吡啶(DMAP)0.0066g、环己基碳二亚胺(DCC)0.206g,加入12mL氮,氮-二甲基甲酰胺(DMF)中,在50℃油浴锅中反应回流5小时,减压蒸馏后,得到产物加入去离子水、过滤后真空冷冻干燥48小时得到肽嵌段-聚乙二醇-肽嵌段。
(5)混合改性:称取步骤(4)得到的肽嵌段-聚乙二醇-肽嵌段1g溶解于19mL甲酸中,与步骤(1)得到的丝素蛋白甲酸溶液按照质量比例3:7混合均匀后,放入通风橱使甲酸挥发过夜,最终得到肽嵌段-聚乙二醇-肽嵌段:丝素蛋白3:7比例的高机械强度改性丝素蛋白。
实施例2
其与实施例1不同之处在于,步骤(5)的混合改性过程中,称取步骤(4)得到的肽嵌段-聚乙二醇-肽嵌段1g溶解于19mL甲酸中,与步骤(1)得到的丝素蛋白甲酸溶液按照质量比例4:6混合均匀后,放入通风橱使甲酸挥发过夜,最终得到肽嵌段-聚乙二醇-肽嵌段:丝素蛋白4:6比例的高机械强度改性丝素蛋白。
实施例3
本申请实施例3提供一种丝素蛋白改性材料及其制备方法和应用,包括以下步骤:
(1)将5g蚕茧切成小块,入2000mL浓度为0.2%的碳酸钠水溶液中,在100℃下煮30分钟以除去丝胶,去离子水清洗后拉松,在通风橱干燥一夜,得到脱胶后的家蚕丝素蛋白,将脱胶后的丝素蛋白4g溶解于16mL的9.3M溴化锂水溶液中,搅拌直至丝素蛋白完全溶解,得到的丝素蛋白溶解液倒入透析袋中,在2000mL去离子水中搅拌透析48小时,其中透析袋半透膜的截留分子量为50kDa。将所得纯化家蚕丝素蛋白溶解液用液氮冷冻后冷冻干燥48小时,得到具有α-螺旋结构的丝素蛋白。将得到的干燥丝素蛋白按照1g:5mL比例溶解于水中备用。
(2)叠氮-GGAG-GGAG-GGAG-羧基封端制备肽嵌段:取叠氮-GGAG-GGAG-GGAG-羧基0.418g、乙胺0.91mL、1-乙基-(3-二甲基氨基丙基)碳酰二亚胺(EDC)0.0777g、1-羟基苯并三唑(HOBT)0.0676g,加入15mL氮,氮-二甲基甲酰胺(DMF)中,在50℃油浴锅中反应回流5小时,减压蒸馏后,得到产物加入去离子水、过滤后真空冷冻干燥48小时得到氮-一氨基-叠氮肽苯酚酯。
(3)制备丝素蛋白改性材料:取炔基-聚己内酯三醇-炔基4.2g、步骤(2)得到的氮-一氨基-叠氮肽苯酚酯1.542g在氮气氛围下,氯化亚铜0.00495g的催化下,60℃加热反应18个小时成环得到肽嵌段-聚己内酯三醇-肽嵌段,炔基-聚己内酯三醇-炔基的分子结构如下所示:
(4)混合改性:称取步骤(3)得到的肽嵌段-聚己内酯三醇-肽嵌段1g溶解于5mL甲酸中,与步骤(1)得到的丝素蛋白水溶液按照质量比例1:9混合均匀后,超声震荡诱导中诱导其β-折叠,最终得到肽嵌段-聚己内酯三醇-肽嵌段:丝素蛋白1:9比例的高机械强度改性丝素蛋白。
实施例4
本申请实施例4提供一种丝素蛋白改性材料及其制备方法和应用,包括以下步骤:
(1)将5g蚕茧切成小块,入2000mL浓度为0.2%的碳酸钠水溶液中,在100℃下煮30分钟以除去丝胶,去离子水清理后拉松,在通风橱干燥一夜,得到脱胶后的家蚕丝素蛋白,将脱胶后的丝素蛋白4g溶解于16mL的9.3M溴化锂水溶液中,搅拌直至丝素蛋白完全溶解,得到的丝素蛋白溶解液倒入透析袋中,在2000mL去离子水中搅拌透析48小时,其中透析袋半透膜的截留分子量为10kDa。将所得纯化家蚕丝素蛋白溶解液用液氮冷冻后冷冻干燥48小时,得到具有α-螺旋结构的丝素蛋白。将得到的干燥丝素蛋白按照1g:99mL比例溶解于二甲基亚砜(DMSO)中备用;
(2)制备丝素蛋白改性材料:取羟基-四臂-聚乙二醇-羟基10.5g、取羧基-GAGA-氨基树脂0.2505g、1-乙基-(3-二甲基氨基丙基)碳酰二亚胺(EDC)0.0777g、4-二甲氨基吡啶(DMAP)0.0066g,加入12mL氮,氮-二甲基甲酰胺(DMF)中,在70℃油浴锅中反应回流5小时,减压蒸馏后,得到产物加入去离子水、过滤后真空冷冻干燥72小时得到肽嵌段-四臂-聚乙二醇-肽嵌段,羟基-四臂-聚乙二醇-羟基的分子结构如下所示:
(3)混合改性:称取步骤(2)得到的肽嵌段-四臂-聚乙二醇-肽嵌段1g溶解于99mL二甲基亚砜(DMSO)中,与步骤(1)得到的丝素蛋白二甲基亚砜溶液按照质量比例5:5混合均匀后,放入甲醇溶液中浸泡2h处理,诱导其自组装β-折叠,最终得到肽嵌段-四臂-聚乙二醇-肽嵌段:丝素蛋白5:5比例的高机械强度改性丝素蛋白。
实施例5
本申请实施例5提供一种丝素蛋白改性材料及其制备方法和应用,包括以下步骤:
(1)将5g蚕茧切成小块,入2000mL浓度为0.2%的碳酸钠水溶液中,在100℃下煮30分钟以除去丝胶,去离子水清理后拉松,在通风橱干燥一夜,得到脱胶后的家蚕丝素蛋白,将脱胶后的丝素蛋白4g溶解于16mL的9.3M溴化锂水溶液中,搅拌直至丝素蛋白完全溶解,得到的丝素蛋白溶解液倒入透析袋中,在2000mL去离子水中搅拌透析48小时,其中透析袋半透膜的截留分子量为10kDa。将所得纯化家蚕丝素蛋白溶解液用液氮冷冻后冷冻干燥48小时,得到具有α-螺旋结构的丝素蛋白。将得到的干燥丝素蛋白按照1g:4mL比例溶解于水中备用。
(2)AAGA-AAGA封端制备肽嵌段:取AAGA-AAGA 0.412g、乙酸0.91mL、1-羟基苯并三唑(HOBT)0.1352g、碳酰二亚胺(EDC)0.1445g,加入12mL氮,氮-二甲基甲酰胺(DMF)中,在50℃油浴锅中反应回流5小时,减压蒸馏后,得到产物加入去离子水、过滤后真空冷冻干燥72小时得到封端的肽嵌段。
(3)制备丝素蛋白改性材料:取氨基-树枝状-聚乳酸聚乙二醇-氨基4.2g、步骤(2)得到的封端的肽嵌段0.2505g、1-羟基苯并三唑(HOBT)0.0676g、碳酰二亚胺(EDC)0.0777g,加入12mL氮,氮-二甲基甲酰胺(DMF)中,在50℃油浴锅中反应回流5小时,减压蒸馏后,得到产物加入去离子水、过滤后真空冷冻干燥72小时得到肽嵌段-树枝状-聚乳酸聚乙二醇-肽嵌段,氨基-树枝状-聚乳酸聚乙二醇-氨基的分子结构如下所示:
(4)混合改性:称取步骤(3)得到的肽嵌段-树枝状-聚乳酸聚乙二醇-肽嵌段1g溶解于4mL水中,与步骤(1)得到的丝素蛋白水溶液按照质量比例4:6混合均匀后,使用40%浓度乙醇浸泡6h,最终得到肽嵌段-树枝状-聚乳酸聚乙二醇-肽嵌段:丝素蛋白4:6比例的高机械强度改性丝素蛋白。
对比例1
其与实施例1相比,区别在于:省去步骤(2)-(4),步骤(5)的混合改性仅使用聚乙二醇PEG(分子量为2000)作为丝素蛋白的改性材料,其他工艺条件相同。
对比例2
其与实施例2相比,区别在于:省去步骤(2)-(4),步骤(5)的混合改性仅使用聚乙二醇PEG(分子量为2000)作为丝素蛋白的改性材料,其他工艺条件相同。
本申请实施例1制备的丝素蛋白改性材料的核磁共振氢谱(
本申请实施例1制备的高机械强度改性丝素蛋白和纯丝素蛋白的傅里叶变换红外光谱(FT-IR)图如图4所示,图4中,在1733cm
纯丝素蛋白、本申请实施例1制备的高机械强度改性丝素蛋白、本申请实施例2制备的高机械强度改性丝素蛋白、本申请对比例1制备的聚乙二醇改性丝素蛋白、本申请对比例2制备的聚乙二醇改性丝素蛋白的扫描电子显微镜(SEM)图如图5所示。其中,图(a)所示:纯丝素蛋白表面分散着丝素蛋白微粒,是因为纯丝素蛋白中的β-折叠结晶区域含量并未达到临界值,所以产生了局部的自组装不均匀现象;图(b)、(c)所示:随着肽嵌段-聚乙二醇-肽嵌段含量的增大,丝素蛋白中发生β-折叠的结晶区域含量也同时增加,在不破坏丝素蛋白原本的结构基础上,减少了局部自组装不均匀的现象,丝素蛋白表面变得更加光滑,同时也证明了肽嵌段-聚乙二醇-肽嵌段与α-螺旋结构的丝素蛋白溶解液混合后发生了自组装行为,随着甲酸挥发一起转变为了β-折叠构象,最终嵌至丝素蛋白结晶区上;图(d)所示,聚乙二醇(PEG)的加入并未增加丝素蛋白β-折叠结晶区域的含量,所以与原丝素蛋白相比并未产生太大变化;图(e)所示,随着聚乙二醇(PEG)比例超过临界值,破坏了丝素蛋白原本的结构,对丝素蛋白的机械性能造成了较大损失。
纯丝素蛋白、本申请实施例1制备的高机械强度改性丝素蛋白、本申请实施例2制备的高机械强度改性丝素蛋白、本申请对比例1制备的聚乙二醇改性丝素蛋白、本申请对比例2制备的聚乙二醇改性丝素蛋白的断裂强度/断裂伸长率示意图如图6所示,测试数据如下表1所示。可以看出,原始丝素蛋白(a)的断裂强度是最高的,但是断裂伸长率是最低的,显示出极大的脆性,而添加了聚乙二醇(d、e)后,聚乙二醇因其拥有良好的相容性,以无规则线团的形式随机分散在丝素蛋白的非结晶区内,在外力作用下更易发生力的滑移现象,导致材料断裂强度降低而拉伸性能提高。单纯的聚乙二醇和丝素蛋白混合交联只依靠物理的氢键作用,而肽嵌段-聚乙二醇-肽嵌段(b、c)加入后,由于其特有的易于转变为β-折叠构象结构,与α-螺旋的丝素蛋白溶液一起转变为了β-折叠构象,平衡了聚乙二醇的柔性结构和丝素蛋白结晶区β-折叠的强力结构,根据添加比例的不同,更大程度地增强了丝素蛋白的机械性能。
表1不同实施例丝素蛋白的断裂强度、断裂伸长率与模量
由上表1数据可知,添加聚乙二醇平衡了丝素蛋白的断裂强度和断裂伸长率,对于纯丝素蛋白原样而言,在聚乙二醇(PEG)与丝素蛋白3:7比例下,断裂伸长率提升到了8.017倍;而在肽嵌段-聚乙二醇-肽嵌段与丝素蛋白3:7比例下,断裂伸长率提升到了12.701倍;与对照样相比,模量仅为前者的56%,说明柔性更好。在肽嵌段-聚乙二醇-肽嵌段与丝素蛋白4:6比例下,断裂伸长率更是高达13.123倍,这是因为添加的肽嵌段-聚乙二醇-肽嵌段与原始丝素蛋白段形成了β-折叠为其提供了强度,并且与化学接连的聚乙二醇形成新的外力缓冲区,使外力更容易发生滑移,为材料提供了更为强大的柔性,拓宽了其在医疗和生物材料领域的应用。
以上实施例仅表达了本申请的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对本申请专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本申请构思的前提下,还可以做出若干变形和改进,这些都属于本申请的保护范围。因此,本申请专利的保护范围应以所附权利要求为准。
