一种依巴斯汀口服溶液的有关物质分析方法
文献发布时间:2023-06-19 19:28:50
技术领域
本发明为药物分析领域,具体涉及一种依巴斯汀口服溶液的有关物质分析方法。
背景技术
依巴斯汀(Ebastine),化学名称为:1-[4-(1,1-二甲基乙基)苯基]-4-[4-(二苯基甲氧基)-1-哌啶基]-1-丁酮,是一组胺H1受体阻断剂,被广泛用于治疗荨麻疹,过敏性鼻炎,湿疹等治疗。
依巴斯汀口服溶液参比制剂为西班牙艾美罗医用药物工业有限公司生产,其处方内含有乳酸、甘油、山梨醇、羟苯甲酯钠、羟苯丙酯钠、三氯蔗糖等。依巴斯汀口服溶液中除依巴斯汀以外,还含有多种强紫外吸收的辅料,且在稳定性过程中,会产生不同于依巴斯汀原料药的特定杂质。
国家药品标准方法,采用甲醇-醋酸铵缓冲液(pH3.9)为流动相,检测波长为254nm,但该波长下个别杂质无吸收,且杂质无法达到有效分离,不能准确检测杂质;
中国专利CN102095808所描述的方法采用三乙胺的磷酸盐缓冲溶液(pH6.5~10.8)为流动相,存在峰型钝且拖尾、杂质无法有效分离、优选的250nm波长下杂质不能完全被检测。
中国专利CN104101663B公开了一种依巴斯汀原料药中有关物质的检测方法,其无法将杂质和辅料分开。
现有方法无法解决依巴斯汀、各杂质及辅料峰的分离问题,因此需开发依巴斯汀口服溶液的有关物质的分析方法。
发明内容
针对现有技术的不足,本发明提供一种依巴斯汀口服溶液的有关物质分析方法。
本发明的技术方案如下:一种依巴斯汀口服溶液的有关物质分析方法,所述方法是高效液相色谱法,采用以十八烷基硅烷键合硅胶为填料的色谱柱,以磷酸盐缓冲液为流动相A,乙腈为流动相B,其中流动相A的配置方法为:取十二水合磷酸氢二钠3.58g~7.16g,用磷酸调节pH值至3.0~5.0,加辛烷磺酸钠1.44g~2.88g溶解加水溶解并稀释至1000ml。
在一些实施方案中,所述分析方法按下表进行线性梯度洗脱:
/>
且在洗脱过程中,流动相A比例与流动相B比例总和为100%;其中流动相A比例是指流动相A体积占洗脱液总体积的百分比,流动相B比例是指流动相B占洗脱液总体积的百分比。
在一些实施方案中,所述流动相的流速为0.9ml~1.1ml/min;优选地,所述洗脱液的流速为1.0ml/min。
在一些实施方案中,所述分析方法在高效液相色谱仪上进行,采用紫外检测器,且其检测波长为200nm~250nm;优选为210nm。
在一些实施方案中,所述色谱柱的柱温为30~40℃;优选为35℃。
另一方面,本发明提供了一种依巴斯汀口服溶液的有关物质分析方法,其特征在于:
所述分析方法是在高效液相色谱仪上进行的;其采用十八烷基硅烷键合硅胶作为固定相的色谱柱;
所述分析方法采用紫外检测器,检测波长是210nm;
所述分析方法柱温为30~40℃;进样体积10μl;
所述分析方法以流动相A和流动相B作为洗脱液,其中流动相A为磷酸盐缓冲液,流动相B是乙腈,所述流动相A的配置方法为:取十二水合磷酸氢二钠3.58g~7.16g,用磷酸调节pH值至3.0~5.0,加辛烷磺酸钠1.44g~2.88g溶解加水溶解并稀释至1000ml;
所述分析方法按下表进行线性梯度洗脱:
且在洗脱过程中,流动相A比例与流动相B比例总和为100%;其中流动相A比例是指流动相A体积占洗脱液总体积的百分比,流动相B比例是指流动相B占洗脱液总体积的百分比;
洗脱液流速为1.0ml/min。
在一些特定的实施方案中,本发明提供了一种依巴斯汀口服溶液的有关物质分析方法,包括以下步骤:
系统适用性溶液:取依巴斯汀、杂质A、杂质C及杂质D对照品适量,加乙腈-水(50:50)溶解并稀释制成的系统适用性溶液。
供试品溶液的配制:取供试品适量,加乙腈-水(50:50)溶解并稀释制成供试品溶液。
对照溶液的配制:精密量取供试品溶液适量,用乙腈-水(50:50)定量稀释制成对照溶液。
用十八烷基硅烷键合硅胶为填充剂;以磷酸盐缓冲液(取十二水合磷酸氢二钠3.58g~7.16g,用磷酸调节pH值至3.0~5.0,加辛烷磺酸钠1.44g~2.88g溶解加水溶解并稀释至1000ml)为流动相A,以乙腈为流动相B,按下表进行线性梯度洗脱;流速为每分钟0.9ml~1.1ml;检测波长为210nm;柱温为30~40℃,进样体积为10μl。
测定;精密量取系统适用性溶液、供试品溶液和对照溶液各10μl,分别注入液相色谱仪,记录色谱图。
本发明中,适量是指在根据实验目的,各化合物的量均在其高效液相色谱仪的检测限或定量限范围内。
本发明的有益效果:在供试品溶液中,将强紫外吸收的辅料与杂质峰有效分离,并使辅料峰均出峰在相对保留时间0.15之前,不干扰任何杂质的测定,能够准确有效的检测依巴斯汀口服液的有关物质。流动相中,水相中加入适量的辛烷磺酸钠,有效的改善峰形,及延长杂质峰出峰时间,从而提高杂质峰与杂质峰之间、杂质峰与依巴斯汀峰之间的分离度,方法专属性良好,且该检测方法简便﹑快速﹑灵敏度高﹑重复性好以及准确度好,可以快速准确地进行供试品中各工艺杂质、降解杂质含量的定性及定量分析,保证本品质量的可控性。
附图说明
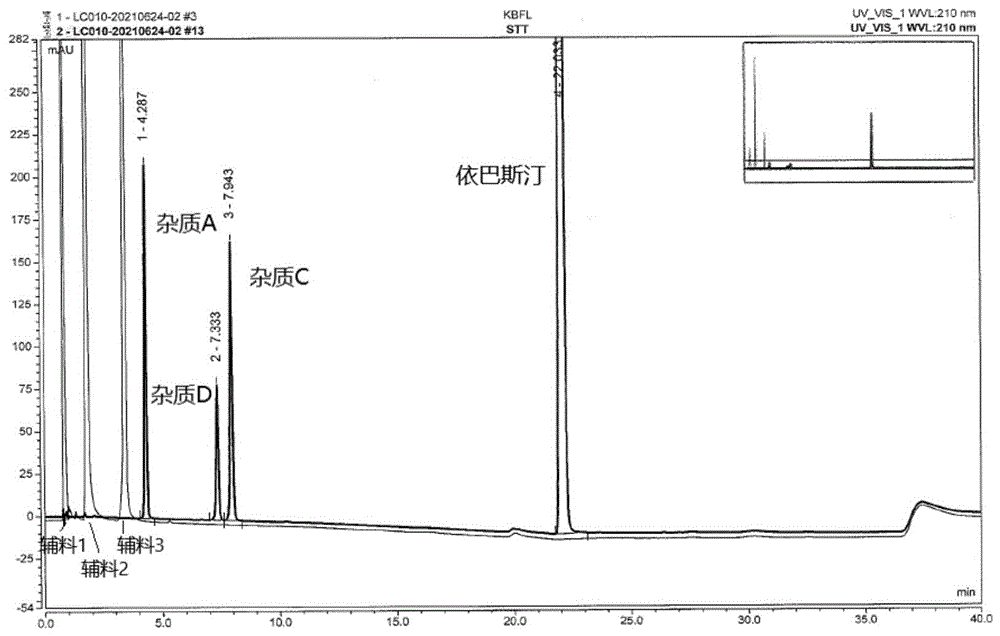
图1为系统适用性溶液图谱
图2为供试品溶液图谱
图3为对照溶液图谱
图4为空白辅料1、2、3,杂质A、C、D和依巴斯汀的混合液的图谱
图5为欧洲药典中依巴斯汀原料药检测混合杂质色谱图与依巴斯汀口服溶液供试品溶液谱图的叠加对比
图6为日本药典中依巴斯汀原料药检测混合杂质色谱图及依巴斯汀口服溶液空白辅料图谱叠加对比
图7为CN104101663B检测混合杂质溶液及依巴斯汀口服溶液供试品溶液图谱叠加对比
具体实施方式
下面的实施例可以使本专业的本领域技术人员更全面地理解本发明,但并不因此将本发明限制在所述的实施例范围之中。
杂质A为合成依巴斯汀原料药过程中的起始物料,同时也是降解杂质,对照品来源于Sinco,含量97.18%,杂质结构式如下:
杂质C(中国药典杂质I)为合成依巴斯汀原料药过程中的反应副产物,同时也是降解杂质,对照品来源为Sinco,含量95.83%,杂质结构式如下:
杂质D(中国药典杂质II)为合成依巴斯汀原料药过程中的中间体,同时也是降解杂质,对照品来源为Sinco,含量96.07%,杂质结构式如下:
实施例1样品检测
系统适用性溶液:取依巴斯汀对照品、杂质A、杂质C及杂质D适量,加乙腈-水(50:50,V/V)溶解并稀释制成每1ml约含依巴斯汀0.5mg、杂质A1μg、杂质C1μg、杂质D1μg的混合溶液。系统适用性溶液色谱图中,理论塔板数按依巴斯汀峰计算不低于5000,杂质D峰与杂质C峰之间的分离度均应符合要求。
供试品溶液:精密量取本品5ml,置10ml量瓶中,用乙腈-水(50:50)稀释至刻度,摇匀。
对照溶液:精密量取供试品溶液1ml,,置200ml量瓶中,用乙腈-水(50:50)稀释至刻度,摇匀。
色谱条件:用十八烷基硅烷键合硅胶为填充剂;以磷酸盐缓冲液(取十二水合磷酸氢二钠3.58g~7.16g,用磷酸调节pH值至3.0~5.0,加辛烷磺酸钠1.44g~2.88g溶解加水溶解并稀释至1000ml)为流动相A,以乙腈为流动相B,按下表进行线性梯度洗脱;流速为每分钟0.9ml~1.1ml;检测波长为210nm;柱温为30~40℃,进样体积为10μl。
测定;精密量取系统适用性溶液、供试品溶液和对照溶液各10μl,分别注入液相色谱仪,记录色谱图。
对比例1:欧洲药典中依巴斯汀原料药检测方法
图5为欧洲药典中依巴斯汀原料药检测混合杂质色谱图及依巴斯汀口服溶液供试品溶液谱图的叠加对比,由图中可以看出,依巴斯汀口服溶液的3个强紫外吸收辅料峰对其杂质测定的影响较大,其中辅料2与杂质1峰几乎完全重合,辅料3与杂质2峰无法完全分离。
对比例2:日本药典中依巴斯汀原料药检测方法
图6为日本药典中依巴斯汀原料药检测混合杂质色谱图及依巴斯汀口服溶液空白辅料图谱叠加对比,由图中可以看出,依巴斯汀口服溶液的3个强紫外吸收辅料峰对其杂质测定的影响较大,其中辅料1与杂质1峰几乎完全重合,辅料3与杂质2峰几乎完全重合。
对比例3:CN104101663B检测方法
图7为CN104101663B检测混合杂质溶液及依巴斯汀口服溶液供试品溶液图谱叠加对比,由图中可以看出,依巴斯汀口服溶液的3个强紫外吸收辅料峰对其杂质测定的影响较大,其中辅料2与杂质1峰几乎完全重合。
