马铃薯高温响应基因及其应用
文献发布时间:2023-06-19 19:28:50
技术领域
本发明属于种质资源培育和分子生物学领域,具体涉及马铃薯高温响应基因及其应用。
背景技术
植物的生长发育容易受到外界环境的胁迫,比如生物胁迫以及极端温度、干旱、重金属等引起的非生物胁迫。在众多的不利因素中,高温胁迫是对植物生长繁殖影响最严重且最不易控制的因素之一。全球气候变化加剧高温的危害,从而造成植物作物产量和品质的下降,威胁到全世界的粮食安全。高温胁迫会影响植物体内一系列生理生化反应的正常进行,植物也会产生诸多响应热害的防御机制,能够在一定的高温范围内得以生存。通常将短时间内环境温度提高10-15℃的现象称为高温胁迫(heat stress)或者热激(heatshock)。高温胁迫的效果又因胁迫强度、持续时间以及温度升高速率不同存在一定差异。白天与夜晚的时间长度以及温度差也会影响高温胁迫的效果。耐热性(heat tolerance)通常定义为植物在高温条件下生长并产生有经济效益的产量的能力。
磷脂酰乙醇胺结合蛋白(phosphatidylethanolamine-binding protein,PEBP)基因家族成员参与植株分生组织的活性保持与功能转变。拟南芥有6个PEBP基因,分别为FT、TFL1、TSF(TWIN SISTER OF FT)、BFT(BROTHER OF FT AND TFL1)、ATC(ARABIDOPSISTHALIANACENTRORADIALIS)和MFT(MOTHER OF FT)。FT蛋白是一种参与顶端分生组织由营养生长向生殖生长转变的开花促进物,而TFL1蛋白则是一种开花抑制物。磷脂酰乙醇胺结合蛋白是植物的一种环境信号传播载体。长日照条件诱导拟南芥叶片CONSTANS(CO)基因的表达,CO蛋白则结合到FT基因的启动子区域并促进其表达,接下来FT蛋白通过韧皮部运输到茎顶端分生组织,并与FD(bZIP transcription factor)、14-3-3蛋白相互作用以形成成花复合体,进而激活下游基因SOC1和AP1的表达,调节植物顶端分生组织由生殖生长向繁殖生长的转变。在多年生木本模式植物杨树(Populus)中的研究表明,长日照条件促进叶片中的FT2的表达并运输到茎顶端分生组织,然后结合LAP1蛋白并激活下游基因表达;但是长日照向短日照的转变会降低叶片FT2的表达,进而造成顶芽的季节性的生长中止。TFL-like基因与FT-like基因往往互相拮抗以调节植株的生长。长日照促进杨树叶片中FT1/2的表达,而短日照会在抑制FT1/2表达的同时促进TFL1在顶芽中表达,光周期通过调节FT1/2与TFL1表达水平的此消彼长进而调节茎顶端分生组织(SAM)的活性。TFL1蛋白可以通过14-3-3与FD蛋白结合,而ChIP-seq的实验结果表明,在拟南芥中鉴定到971个TFL-FD富集位点,其中71.8%的位点位于启动子区域。这些位点包含开花时间调节基因CONSTANS(CO)和GIGANTEA(GI)以及分生组织身份调节基因FRUITFULL(FUL)、LEAFY(LFY)、APETALA1(AP1)和LATEMERISTEM IDENTITY 1(LMI1)等。此外,TFL-FD还会影响独脚金内酯(strigolactone)、细胞分裂素(cytokinin)、生长素(auxin)、油菜素类固醇(brassinosteroid)、茉莉酸(jasmonicacid)和脱落酸(abscisic acid)等植物激素代谢途径。
现有技术存在的问题:1.现有技术未见系统的筛选耐高温马铃薯的方法。2.现有技术未见马铃薯耐高温转录组鉴定耐高温基因。3现有技术未见马铃薯耐高温PEBP基因。
发明内容
本发明要解决的关键技术问题在于提供马铃薯高温响应基因德尔筛选及其应用。为解决上述技术问题,本发明采用如下技术方案:
1.一种耐高温马铃薯评价指标的筛选方法,包括:(1)试验材料选择,(2)高温胁迫处理与性状测定,(3)划分马铃薯品种的熟性等级,(4)数据处理和分析方法确定,(5)叶片SPAD值与品种熟性的关联分析,(6)株高与品种熟性的关联分析,(7)单株块茎数及单株最大块茎鲜重与品种熟性的关联分析,(8)品种熟性的各性状间相关性分析。
2.一种耐高温马铃薯品种筛选方法,包括:(1)试验材料选择,(2)高温胁迫处理与测定马铃薯SPAD、株高和块茎鲜重性状,(3)划分马铃薯品种的熟性等级。
3.响应高温马铃薯PEBP基因筛选方法,包括:(1)材料选择;(2)高温胁迫处理;(3)马铃薯PEBP基因家族成员鉴定;(4)RNA提取、cDNA合成与实时定量PCR;(5)StPEBPs在高温胁迫转录组中的表达模式分析。
4.马铃薯响应高温PEBP基因,所述PEBP基因CDS序列如序列表SEQ ID NO.1、SEQID NO.2和SEQ ID NO.3所示。
5.PEBP基因在提高马铃薯耐高温中的应用,所述PEBP基因CDS序列如序列表SEQID NO.1、SEQ IDNO.2和SEQ ID NO.3所示。
有益效果:本申请提供了筛选耐高温马铃薯的方法,通过筛选评价马铃薯耐高温的生理指标,最终确定SPAD、株高和块茎鲜重作为马铃薯耐高温的评价指标,可用于马铃薯耐高温品种的筛选。本申请还提供了3个马铃薯耐高温PEBP基因。
附图说明
图1为不同熟性组SPAD值
其中,CK为常温,HS为高温胁迫;Early、Mid和Late分别为早熟组、中熟组和晚熟组品种;每个部分标有相同字母的SPAD值之间没有显著性差异(双因素方差分析,Duncan,P<0.05)。
图2为不同熟性组收获时株高
其中,K为常温,HS为高温胁迫;Early、Mid和Late分别为早熟组、中熟组和晚熟组品种;Plant height为马铃薯植株在收获时的株高;在每个部分中的具有相同字母的两组数值之间没有显著性差异(双因素方差分析,Duncan,P<0.05)。
图3为不同熟性组单株块茎数量和单株最大块茎鲜重
其中,CK为常温,HS为高温胁迫;Early、Mid和Late分别为早熟组、中熟组和晚熟组品种;Tuber number为单株块茎数,Tuber weight为单株最大块茎鲜重。在每个部分中的具有相同字母的两组数值之间没有显著性差异(双因素方差分析,Duncan,P<0.05)。
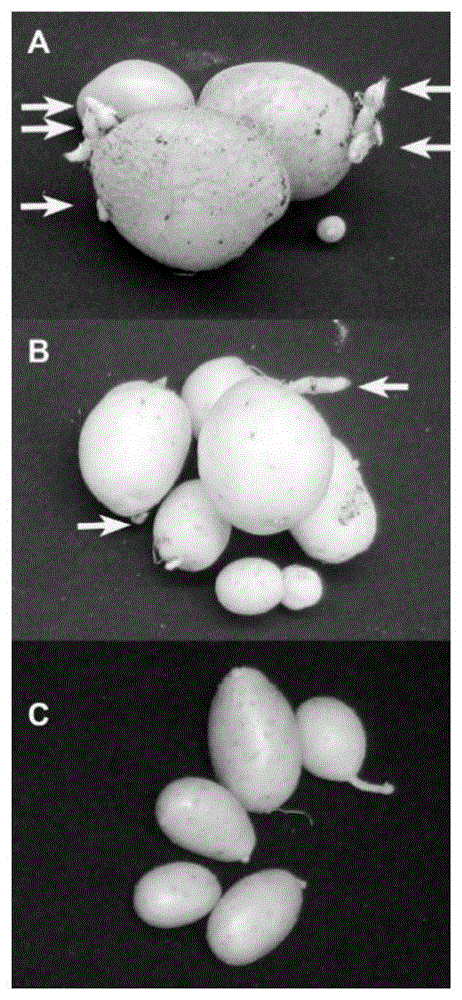
图4为高温胁迫植株收获时的块茎
注:A为“Eramosa”,B为“Nipigon”,C为“Innovator”,箭头所示为芽。
图5为储存63d的发芽块茎数
注:A为常温块茎,B为高温胁迫块茎。
图6为StPEBPs在高温胁迫叶片的基因表达水平
注:Normalized gene expression是三个生物学重复的ΔCt标准化值的平均值。*为P<0.05,**为P<0.01。
图7为StPEBPs在高温胁迫根系的基因表达水平
注:Normalized gene expression是三个生物学重复的ΔCt标准化值的平均值。*为P<0.05,**为P<0.01。
图8为响应高温的3个PEBP基因。
具体实施方法
本发明专利下述实施例中使用方法和装置,如无特殊说明,均为常规方法和装置;所用器材、试剂均为试剂公司购买的常规器材和试剂。为使本发明专利的目的、技术方案和优点更加清楚,下面结合具体实施例对本发明专利的具体实施方式进行详细说明。这些优选实施方式的示例在具体实施例中进行了例示。在此,还需要说明的是,为了避免因不必要的细节而模糊了本发明专利的技术方案,在实施例中仅仅示出了与根据本发明专利的方案密切相关的技术方案和/或处理步骤,而省略了关系不大的其他细节。
实施例1
本实施例提供耐高温马铃薯品种筛选方法,具体包括:
1.试验材料选择
本试验所用50个马铃薯品种(表1)的无菌苗由加拿大新布伦瑞克植物繁育中心提供。试验所用温室位于加拿大农业部弗雷德里克顿研究与发展中心。
2.高温胁迫处理与性状测定
试管苗在生长室内培养30d,然后将幼苗移栽到含有1/2霍格兰培养液的容器内进行为期12d的温室环境驯化,温室的温度为白天(22±1)℃,夜间(18±1)℃,每日光照14h。经过驯化的幼苗移栽到含有固体基质的花盆中,花盆高度18cm,内径15cm,基质由泥炭土、土壤、珍珠岩、蛭石(比例2:1:1:1)构成。温室栽培20d后,对高温胁迫组(Heat stress,HS)植株施加高温,环境温度为白天(35±1)℃/夜间(28±1)℃,每日光照14h,胁迫持续至收获(从移栽入花盆到收获的生长时间为102d);在此期间,常温组(CK)温室的温度保持白天(22±1)/夜间(18±1)℃;常温组与高温胁迫组的光照条件一致。本发明包含50个马铃薯品种,每个品种16株,本试验中共800个植株。
SPAD-502测量仪获得的叶片SPAD值(Soil Plant Analysis Development)与叶片的叶绿素含量高度相关。因此在高温胁迫的7d(SPAD7D)、16d(SPAD16D)和32d(SPAD32D)测量所有植株的叶片SPAD值以检测叶绿素含量。检测目标为植株的第4片完全展开叶片,若第4片叶过小则检测第5片叶。每片叶子经过3次测量取平均值作为最终测量结果。在收获时测量每个植株从土壤表面到顶芽的距离作为株高。收获时测定每个块茎的重量,并统计每个植株的鲜重超过1.5g的块茎数量作为单株块茎数,统计每个植株所产块茎中最大块茎的鲜重作为单株最大块茎鲜重,通过统计块茎数和块茎鲜重来分析高温胁迫对马铃薯产量的影响。
3.划分马铃薯品种的熟性等级
本发明中所用47个品种的熟性数据来自《Potato Varieties in Canada》,另外三个品种“Alturas”、“Cherry Red”和“Innovator”的熟性数据来自加拿大食品检验局(Canadian Food Inspection Agency,http://www.inspection.gc.ca/)。上述信息源将马铃薯的熟性划分为极早熟(very early)、早熟(early)、中早熟(medium early)、早中熟(early mid-season)、中熟(mid-season)、中晚熟(medium late)、晚熟(late)和极晚熟(very late)共8个等级。本发明对8个熟性等级进行编号,极早熟(very early)为8级,极晚熟(very late)为1级,然后基于以上信息将50个品种划分为早熟组(Early,5-8级)、中熟组(Mid,4级)和晚熟组(Late,1-3级),三个组分别有13、20和17个品种(表1)。
表1本发明所用马铃薯品种的熟性
注:1为最晚熟(very late),8为最早熟(very early);Early、Mid和Late分别为早熟组(5-8级)、中熟组(4级)和晚熟组(1-3级)。
4.数据处理和分析方法确定
使用SAS软件对相对叶绿素含量、株高、块茎数量和块茎鲜重进行方差分析(ANOVA),基于皮尔逊相关系数(Pearson correlation coefficient)进行多性状相关性分析。
5.叶片SPAD值与品种熟性的关联分析
测量不同熟性的马铃薯品种在高温胁迫7d、16d和32d的叶片SPAD值,利用SAS软件进行双因素方差分析(Duncan)。结果表明,常温(CK)条件下,早熟组与中熟组品种的叶片SPAD值随生长时间增加而显著降低(7d vs 32d),晚熟组品种的SPAD值未发生显著性变化。高温胁迫(HS)条件下,早熟组、中熟组和晚熟组品种的SPAD值随生长时间延长而显著上升。高温植株SPAD与常温植株SPAD的比值(SPAD HS/CK)也随栽培时间延长而显著增大,其中早熟组的增长幅度最明显(图1)。
6.株高与品种熟性的关联分析
测量50个马铃薯品种在收获时的株高,并分析不同熟性品种在高温与常温下的株高差异(表2)。结果表明,早熟组、中熟组和晚熟组的常温条件株高存在显著差异,早熟组的株高数值最小,而晚熟组的株高数值最大。高温胁迫条件下,3个熟性组的株高数值并没有显著差异。高温胁迫植株与常温植株的株高比值(Plant height HS/CK ratio)也存在显著差异,早熟组最大,而晚熟组最小(图2)。
表2 50个马铃薯品种株高
/>
注:PH为株高,CK为常温,HS为高温胁迫;*为P<0.05,**为P<0.01。
7.单株块茎数及单株最大块茎鲜重与品种熟性的关联分析
在高温胁迫下,50个马铃薯品种的单株块茎数(鲜重超过1g)平均值从5.66个/株显著地降低到1.7个/株(P<0.01)。在常温条件下,早熟组、中熟组和晚熟组品种的单株块茎数差异不显著,但在高温胁迫下早熟组的单株块茎数显著高于晚熟组(P<0.05);早熟组、中熟组和晚熟组的高温胁迫条件与常温条件单株块茎数比值(TN HS/CK ratio)分别为0.5、0.3和0.2,但差异不显著。在常温条件下马铃薯品种“AC Ptarmigan”的单株块茎数最多(11.20个/株),而“Eramosa”的数量最少(2.50个/株)。在高温胁迫条件下,品种“Chieftain”的单株块茎数的值最大(6.75),而“AC Chaleur”(7级)、“Butte”(1级)和“White Rose”(4级)无块茎。“Eramosa”(1.40个/株)具有最大的TN HS/CK ratio,而“ACChaleur”、“Butte”和“White Rose”的数值最低(0.00)(表3,图3A-C)。
如图4,图5和表4所示,收获时统计每个植株的最大块茎鲜重。结果表明,在常温条件下早熟组的单株最大块茎鲜重显著低于晚熟组,但在高温胁迫下早熟组的单株最大块茎鲜重显著高于晚熟组(P<0.05)。从比值(Tuber weight HS/CK ratio)来看,早熟组(0.13)显著高于中熟组(0.07)和晚熟组(0.05)(图3D-F)。
表3 50个马铃薯品种单株块茎数
/>
注:CK为常温组,HS为高温胁迫组,TN为单株块茎数。
表4 50个品种的单株最大块茎鲜重
/>
注:CK为常温,HS为高温胁迫,LTW为单株最大块茎鲜重;*为P<0.05,**为P<0.01。
8.品种熟性的各性状间相关性分析
利用SAS软件对相对叶绿素含量值、株高、单株块茎数量和单株最大块茎鲜重进行多重相关性分析(表5)。结果表明,熟性与常温/胁迫植株的7d和16d SPAD值(SPAD7DCK、SPAD7DHS、SPAD16DCK和SPAD16DHS)无显著相关性,与32d的高温胁迫植株SPAD值(SPPAD32HS)无相关性,但与SPAD32DCK显著负相关。熟性与SPADHS/CK的正相关性随胁迫时间延长而增强,在7d时两者不相关,而在16d(R=0.46,P<0.01)和32d(R=0.65,P<0.01)呈显著正相关。这表明早熟组在常温与高温胁迫环境中的叶绿素含量差异最大。
在常温条件下,收获时的株高与熟性之间存在显著的负相关,表明早熟类型在常温下往往植株较矮,而晚熟品种的植株较高。在高温条件下,熟性与株高无显著相关性。株高的HS/CK比值与熟性显著正相关(R=0.58,P<0.01),表明早熟品种在常温与高温条件下的株高差异最大。
从单株块茎数量上分析,熟性与常温条件下的块茎数量无显著相关性,而在高温胁迫下熟性与块茎数存在显著正相关关系(R=0.36,P<0.05)。此外,熟性与单株块茎数量的HS/CK比值存在显著正相关关系(R=0.34,P<0.05)。表明熟性越早的品种在高温条件下拥有越多的单株块茎数,而且常温与高温条件下的块茎数量差异越显著。
从单株最大块茎鲜重方面分析,熟性与常温条件下的块茎鲜重存在显著负相关关系,在高温胁迫条件下熟性与块茎鲜重显著正相关。此外,熟性与块茎鲜重的HS/CK比值也呈现显著正相关关系。这表明在常温条件下早熟品种的鲜重较小,而晚熟品种的鲜重较大;而在高温条件下则相反,早熟品种的鲜重较大,而晚熟品种的鲜重较小。成熟越早的品种在常温与高温下的块茎鲜重差异越大。
表5相对叶绿素含量、株高、单株块茎数和单株最大块茎鲜重与熟性相关性
注:CK为常温,HS为高温胁迫;Tuber number为单株块茎数,Tuber weight为单株最大块茎鲜重,Plant height为收获时株高。*为P<0.05,**为P<0.01(多重相关分析)。
9.结论
9.1熟性对常温下马铃薯SPAD、株高和块茎鲜重的影响
将50个品种按照熟性划分为3组,早熟组的叶绿素含量(SPAD)在常温条件下随栽培天数增加而降低,晚熟品种的SPAD值并未出现显著性降低。并且早熟品种在常温条件下收获时的株高显著低于晚熟品种。早熟品种的植株较小,其在光合成能力与叶绿素含量方面略低于晚熟品种。
在常温条件下,与晚熟品种相比,早熟品种的单株最大块茎鲜重更小,这表现在熟性与常温块茎鲜重的显著负相关(R=-0.30,P<0.05)。该负相关可能源自晚熟品种相较于早熟品种有更多的时间用于块茎膨大,而且晚熟品种能在更长的时间段内保持较高的叶绿素含量,进而可以产生更多的光合产物。本发明中所用的50个马铃薯品种均已适应加拿大当地的长日照条件。块茎大小是衡量马铃薯品种的重要性状,需要进一步研究熟性与块茎鲜重在常温下的显著负相关关系是否受熟性相关基因的影响。
9.2熟性对高温下马铃薯SPAD、株高和块茎鲜重的影响
已有研究报道高温条件下马铃薯叶片的叶绿素含量。在本发明中结合熟性进一步分析高温对叶绿素含量的影响。不同于早熟品种在常温条件下表现出的叶绿素含量下降,其在高温条件下的叶绿素含量较稳定。这表明早熟品种在高温条件下的生长周期延长。已知高温胁迫会引起多种热激转录因子与热激蛋白的表达,这些转录因子有可以激活更多基因的表达。研究热激转录因子与热激蛋白如何调节叶绿素的合成与代谢对农业生产很有意义。本发明中发现早熟马铃薯品种在高温胁迫下的叶绿素含量显著上升。
9.3熟性与耐热性
本发明中,测量50个品种的植株在高温下的性状,结果表明高温胁迫使早熟品种的活力保持在较高的水平。早熟品种在常温下的植株较矮,而高温胁迫下的植株高度与晚熟品种并无显著性差异。早熟品种的相对叶绿素含量(SPAD值)和株高的HS/CK比值均高于晚熟品种的相应比值。熟性相同的品种对高温胁迫的反应也不一定相同。结合本发明与此前报道的结果进行分析,熟性对马铃薯耐热性的影响并非简单的使植株避开高温胁迫,且某些与熟性相关基因可能参与构成马铃薯的耐热性。熟性有关基因不仅可以诱导块茎形成,还参与高温胁迫下的叶绿素合成和植株生长。在本发明的高温胁迫条件下,植株的基因表达和代谢方面均发生显著变化,进而影响植物的生长发育,比如将同化产物运输的目标由块茎改为地上部。
实施例2
本实施例提供高温响应马铃薯PEBP基因及其应用,具体包括:
1.材料选择
本发明所用材料为马铃薯品种“Atlantic”。
2.高温胁迫处理
首先将“Atlantic”的试管苗转接到含有固体MS培养基(3%质量分数蔗糖)的广口瓶(6cm×15cm)中,温度为22℃,每日光照16h,光照强度10000Lux。培养30d后将无菌苗移入含有霍格兰培养液的水培箱,进行为期7d的驯化。在驯化过程中,用透明水杯罩住幼苗以避免萎蔫。每个水培箱装有8L霍格兰培养液,每箱有12个马铃薯植株,每3d更换培养液。水培45d(包含驯化时间)后,开始对水培苗进行高温胁迫。高温胁迫组的温度为白天35℃/夜间28℃,常温组温度为白天23℃/夜间20℃。在高温胁迫的第3d更换水培液。分别在高温胁迫的0d、1d、4d和7d进行取样。1d、4d和7d的取样包括常温组与高温胁迫植株。取样的组织包括叶片与根系,所有样品均包含3个生物学重复,即来自3个不同的马铃薯植株。叶片为从上往下数第5-7片完全展开的叶片,根系为占根系总长度1/2的新生部分。取下组织后,立刻用锡箔纸包裹并投入液氮中冷冻10min,放入-80℃冰箱中保存。
3.马铃薯PEBP基因家族成员鉴定
用隐马尔可夫模型(Hidden Markov Models,HMM)方法,在马铃薯中搜索StPEBP家族成员。目标蛋白结构域为PBP结构域,Pfam编号为PF01161,用马铃薯蛋白质序列文件为DM_1-3_516_R44_potato.v6.1.hc_gene_models.pep(http://solanaceae.plantbiology.msu.edu/)。利用HMMSEARCH从马铃薯蛋白序列文件中搜索潜在的家族成员。将潜在成员的蛋白质序列提交至SMART(http://smart.embl.de/)、NCBI CDD(https://www.ncbi.nlm.nih.gov/cdd/)以搜索PBP结构域,含有PBP结构域的家族成员用于进一步分析。DM v3.4版本的注释信息使用时间较久,许多此前的研究和公布的数据库都是基于该版本。在PGSC_DM_v3.4_pep.fasta(该文件中的蛋白序列以DMT编号命名)注释文件中运用上述方法进行PEBP家族成员鉴定。将在DMv6.1注释数据中筛选得到的15个家族成员的蛋白质序列提交到Expasy网站(https://www.expasy.org/)计算Isoelectric point(等电点)与Molecular weight(分子量)。利用UniProt网站(https://www.uniprot.org/)和STRING网站(https://string-db.org/)对本发明鉴定的15个StPEBP的蛋白质序列进行功能注释,使用KOBAS网站(http://kobas.cbi.pku.edu.cn/kobas3)进行GO注释和KEGG注释。
4.RNA提取、cDNA合成与实时定量PCR
用TransZol Up试剂(全式金)提取高温胁迫叶片与根系的总RNA,储存于-80℃冰箱中备用。cDNA的合成用TransScript One-Step gDNARemoval and cDNA SynthesisSuperMix试剂盒(全式金)。在超净台中,向200μL无菌无酶PCR管中分别加入1μg TotalRNA、1μL Oligo(dT)18Primer和2μL RNase-free H2O,于65℃孵育5min,然后冰浴2min。冰浴后加入10μL 2◇TS Reaction Mix、1μL TransScript RT/RI Enzyme Mix和1μL gDNARemover,加RNase-free H2O将总反应体系补足到20μL。将上述混合液放入PCR仪进行cDNA合成,程序为:42℃孵育15min,85℃加热5s。合成的cDNA置于-20℃冰箱中备用。
表6实时荧光定量PCR使用的引物
注:UBI-F和UBI-R为内参基因(基因ID:PGSC0003DMG400005199,转录本ID:PGSC0003DMT400013321)引物。
利用NCBI的Primer-BLAST与qPrimerDB网站(https://biodb.swu.edu.cn)设计实时荧光定量PCR(qRT-PCR)引物,以UBI基因为内参基因,引物由上海生工生物工程股份有限公司合成(表6)。分别计算三个生物学重复中StPEBP家族成员与内参基因的ΔCt,对其进行标准化(2-ΔCt◇100000),然后以三个生物学重复的平均值代表该基因的最终表达量。对常温与高温条件下的PEBP基因表达量进行t-测验。
5.StPEBPs在高温胁迫转录组中的表达模式分析
以本发明从DM v6.1中鉴定的15个PEBP基因与10个来自DM v3.4的PEBP基因构建系统进化树,根据文献中的转录组数据分析StPEBPs在高温胁迫植株各组织中的表达模式。
6.结果与分析
6.1马铃薯PEBP基因家族成员鉴定
利用隐马尔科夫模型(Hidden Markov Models)在马铃薯基因组DM v6.1中鉴定到15个StPEBP蛋白,利用Expasy网站计算PEBP蛋白的等电点与分子量,用UniProt和STRING注释PEBP蛋白(表7)。通过序列比对StPEBP1、StPEBP2、StPEBP3、StPEBP5被注释到CEN1,StPEBP11匹配到SP9D。StPEBP4、StPEBP7、StPEBP8和StPEBP9的注释结果为Floweringlocus T Protein。StPEBP14和StPEBP15被注释被Flowering locus T。StPEBP6被注释为MFT。StPEBP12和StPEBP13被鉴定为Phosphatidylethanolamine binding protein。本发明鉴定的15个StPEBP家族成员均注释为PEBP蛋白。在DM v3.4注释文件中鉴定到10个PEBPs。
在KEGG注释结果中,StPEBP4、StPEBP7、StPEBP8、StPEBP9、StPEBP14和StPEBP15影响植物的昼夜节律(Circadian rhythm-plant)。而GO注释显示StPEBP3和StPEBP5具有调节植株开花的功能(flower development和vegetative to reproductive phasetransition of meristem),StPEBP6与ABA响应和种子萌发有关(response to abscisicacid和positive regulation of seed germination),而StPEBP11涉及到“细胞核(nucleus)”、“细胞质(cytoplasm)”、“花发育的负调控(negative regulation of flowerdevelopment)”和“分生组织由营养生长向生殖生长的转变(vegetative to reproductivephase transition of meristem)”。
表7StPEBP基因功能注释
注:以Sotub开头ID是由Abelenda等研究中鉴定的PEBP基因;文献报道使用ID为来自DM v3.4与Abelenda等;百分数为同一行基因序列的一致性(NCBI-Blastn);Function为Uniprot和STRING对PEBP蛋白的功能注释结果。
6.2StPEBPs在高温胁迫叶片中的表达模式
Tang等的研究发现,持续3d的高温胁迫(白天35℃/夜间28℃)会引起马铃薯品种“Russet Burbank”叶片中分别与StPEBP5、StPEBP9、StPEBP14和StPEBP15同源关系较近的StCEN1(T37143,log2FC=-5.1,edger P=8.00E-04)、Flowering locus T protein(T60057,-10.8,5.30E-08)和两个Flowering locus T(T41725,-4.4,5.30E-05;T41726,-4.2,0.00014)的表达水平显著下调(表8)。在Hastilestari等研究中,分别对马铃薯品种“Agria”的地下、地上和整个植株施加高温胁迫,并利用转录组技术揭示对植株的不同组织施加的高温胁迫对叶片中的基因表达模式的影响。结果表明,只对植株的地下部进行高温胁迫(高温胁迫组,地下部分29℃,地上部分白天22℃/夜间20℃;常温组,白天22℃/夜间20℃)未能引起叶片中PEBPs表达量的显著变化;而对植株地上部(地上27-29℃,地下22℃)和整个植株(27-29℃)施加的高温胁迫都可以引起分别与StPEBP5和StPEBP9同源关系较近的StCEN1(T37143,log2FC=-3.6,P<0.001;log2FC=-5.4,P<0.001)和Flowering locus Tprotein基因(T60057,log2FC=-2.5,P<0.001;log2FC=-2.2,P<0.001)的表达水平显著下调。
综上所述,高温胁迫会诱导与StPEBP5、StPEBP9、StPEBP14和StPEBP15同源关系较近的多个PEBP基因在叶片中的表达量下降。在常温下,植株的成熟叶片中,StPEBP14和StPEBP15的表达量随培养时间的增加而显著上调;每个基因在4d和7d的表达量均无显著差异,但都显著高于其在0d的表达水平。在0d时,StPEBP15的表达量就显著高于其它StPEBP基因,且其余StPEBP基因间无显著差异。在7d时,StPEBP15的表达水平也显著高于其它基因。StPEBP11在所有常温叶片(包含0d)中都表达水平过低(Ct>35)而无法检测到,其余PEBP基因的表达水平均未随时间延长而发生显著性变化(图6)。
在高温胁迫植株的成熟叶片中,StPEBP15呈现出表达水平先降后升的趋势。尽管StPEBP15在1d CK、4d CK和7d CK叶片的表达量显著高于其余基因的同期表达水平,但都显著低于StPEBP15的0d叶片中的表达量(图6)。结果表明,受高温胁迫影响,成熟叶片的StPEBP14和StPEBP15的表达量均显著下降。
6.3StPEBPs在高温胁迫根系中的表达模式
在本发明的常温水培植株的根系中,StPEBP5的4d CK表达量达到常温根系中StPEBPs表达量的最大值。StPEBP5、StPEBP8、StPEBP10、StPEBP11和StPEBP14在4d的表达量都显著高于其在0d的水平。StPEBP3、StPEBP4、StPEBP12和StPEBP15的表达量均未发生显著性变化(图7)。
在高温胁迫根系中,StPEBP10的表达量随胁迫时间延长而上升,其在7d HS根系中的表达量显著高于在0d、1d HS和4d HS根系的表达量。其它基因的表达量未随胁迫时间延长而发生显著性变化,且都显著低于StPEBP10的7d表达水平(图7)。结果表明,根系中StPEBP10的表达量受高温胁迫诱导而显著升高,且显著高于其它StPEBP基因的表达水平,而StPEBP5、StPEBP8、StPEBP10、StPEBP11和StPEBP14的表达受高温胁迫抑制。
6.4StPEBPs在高温胁迫块茎中的表达模式
与常温条件形成的块茎相比,高温胁迫下形成块茎中的StPEBP9(T60057,StSP6A)表达量较低(log2FC=-1.5,P=0.52),但是StPEBP3(T30575,StCEN1)的表达量较高(log2FC=2.3,P=0.44)。Hancock等研究表明,块茎中StPEBP9即StSP6A(T60057)的表达量受高温胁迫而下降,且在每日的16h达到最低值(log2FC=-2.6,原文未标注P值)。
表8StPEBPs在马铃薯高温胁迫转录组的表达模式
注:RB为马铃薯品种“Russet Burbank”高温胁迫3d后的表达量;Agria为马铃薯品种“Agria”的叶片在高温胁迫下的基因表达模式;Desiree是马铃薯品种“Desiree”从0点开始,每4h检测叶片的基因表达量,下午4点(16h)时T60057表达量达到最低值,该研究未标注P值;RB2为马铃薯品种“Russet Burbank”热激发芽转录组数据(未发表)。#表示该基因无显著性差异表达。
7结论
Abelenda等称在马铃薯中发现15个StPEBP,这些基因分布于7条染色体,包括1、2、3、5、6、9和11号染色体。本发明在DM v6.1版本的马铃薯基因组注释信息中鉴定到的15个StPEBP基因,分布于1、3、5、6、9和11号染色体。鉴定结果的不一致源自不同版本马铃薯基因组注释信息间的差异,这一差异有可能是由所采用的测序技术造成的。Abelenda等的研究基于2011年公开的基因组注释信息,该注释信息由RNA-seq的短读长(short-read)数据拼接而成;而2020年发表的长读长参考基因组数据(long-read reference genome)(DMv6.1)]对马铃薯基因组的注释更加完整全面。且Abelenda等并未研究PEBP基因在高温胁迫植株各部位中的表达模式。因此,本发明通过在DM v6.1注释信息中鉴定StPEBP基因并进行高温下的表达模式分析。
拟南芥的6个PEBP均含有1、2、3、4和5号基序。超过50%的马铃薯与番茄PEBP蛋白也具有相同的基序,而另外6个PEBP蛋白拥有但不仅限于这5个基序。从功能上看,促进开花的AtFT、SlSP3D和与SlSP3D同源的StPEBP4也都具有1-5号基序。这表明1-5号基序是PEBP蛋白最常见的保守序列,也是PEBP蛋白发挥其生物学功能特别是调控开花的结构基础。
StSP6A(StPEBP9)是诱导块茎形成的重要基因。StPEBP9有1-5号基序,而番茄SP6A只有1、3、4和5号基序,这表明2号基序可能在StSP6A诱导结薯过程中发挥关键作用。7号基序仅存在于注释为CEN1的StPEBP1、StPEBP2和StPEBP3和番茄CEN1(Solyc01g009580和Solyc01g009560),这说明7号基序可能参与构成CEN1蛋白的核心功能组件。
在常温条件下,StPEBP5、StPEBP8、StPEBP10、StPEBP11和StPEBP14是根系表达量较高的PEBP家族成员,而在成熟叶片中表达量最高的PEBP基因为StPEBP14和StPEBP15。在块茎形成前,StPEBP5、StPEBP8、StPEBP10和StPEBP11主要在根系中表达,StPEBP15主要在叶片表达,而StPEBP14在根系和叶片都有较高的表达量。据报道部分PEBP蛋白质可以通过韧皮部运输到顶端分生组织或者匍匐茎末端。这表明在根系或叶片中产生的PEBP基因编码产物也可能会对其它组织的生长发育产生影响。
马铃薯品种“Russet Burbank”叶片中的StPEBP5(T37143)、StPEBP9(T60057)、StPEBP14(T41725)和StPEBP15(T41726)的表达水平受高温胁迫而下降;而在Hastilestari等的研究中仅StPEBP5(T37143)和StPEBP9(T60057)的表达受高温胁迫抑制。在本发明中,受高温胁迫影响,成熟叶片中的StPEBP14和StPEBP15呈现出表达水平先下降再升高的趋势。StPEBP5(T47143)即StCEN1具有抑制块茎形成的功能。StPEBP5(T47143)的表达量下降表明该基因在抑制块茎形成的同时可能具有其它功能,且该功能受到高温胁迫的抑制。本发明中StPEBP9(T60057)的表达一直受到抑制,故其表达量未随高温胁迫的开始而发生显著性变化。值得注意的是StPEBP14(T41725)和StPEBP15(T41726)具有抑制结薯的作用,但这两个基因在本发明的表达量显著下调,这值得进一步研究。
StPEBP5、8、10、11和14在常温根系中的表达量显著上升,并在4d后开始下降。高温胁迫条件下,StPEBP5、8、11和14在根系中的表达水平未随时间延长而发生显著性变化,但StPEBP10的表达水平显著升高,并在7d达到最大值(图7)。高温胁迫引起马铃薯植株的一系列形态学变化,其中就包括根系的生长受抑制;而TFL1通常被认为是生长点活性的抑制物,因此,StPEBP10在高温胁迫下的表达水平上升可能是高温抑制根系生长的原因之一。
参考文献:
Campbell M,Suttle J,Douches D S,et al.Treatment of potato tubers withthe synthetic cytokinin
1-(α-ethylbenzyl)-3-nitroguanidine results in rapid termination ofendodormancy and induction of transcriptsassociated with cell proliferationand growth[J].Functional&Integrative Genomics,2014,14(4):789-799.Li L-Q,ZouX,Deng M-S,et al.Comparative morphology,transcription,and proteomics studyrevealing the keymolecular mechanism of camphor on the potato tuber sproutingeffect[J].International Journal of MolecularSciences,2017,18(11):2280.
/>
/>
