鲍曼不动杆菌核心寡糖-蛋白偶联物及其制备方法与应用
文献发布时间:2023-06-19 19:28:50
本申请要求2022年1月14日提交的中国发明专利申请【CN202210040080.8】、名称为“一种鲍曼不动杆菌ATCC 17904血清型脂多糖内核心寡糖片段及其合成方法”的优先权,并以引用方式全文并入。
技术领域
本发明属于化学领域,具体涉及一种鲍曼不动杆菌核心寡糖-蛋白偶联物及其制备方法与应用。
背景技术
鲍曼不动杆菌(Acinetobacter baumannii)又称鲍氏不动杆菌,属于革兰氏阴性菌,是一种严格需氧、非乳糖发酵的条件致病菌,不具有鞭毛,移动性不高,但生命力极强。鲍曼不动杆菌广泛分布于医院环境中,特别是在重症监护病房(ICU)、急诊科和呼吸内科病房中,可导致人的急性肺炎、脑膜炎、败血症,以及人体血液和软组织严重感染,感染后患者的死亡率可达7.8%-23%,未经治疗的鲍曼不动杆菌感染的患者死亡率甚至可达到50%以上。鲍曼不动杆菌具有快速获得和传播耐药性的能力,因此造成的感染性疾病已成为全球范围内最难治疗和最难控制的院内获得性感染疾病。2017年,鲍曼不动杆菌被世界卫生组织(WHO)列为最迫切需要开发新型药物或疫苗的一类细菌。因此,亟需开发能够用于治疗或预防鲍曼不动杆菌的新型药物或疫苗。
发明内容
有鉴于此,本发明的目的在于提供一种鲍曼不动杆菌核心寡糖-蛋白偶联物及其制备方法与应用,具体技术方案如下。
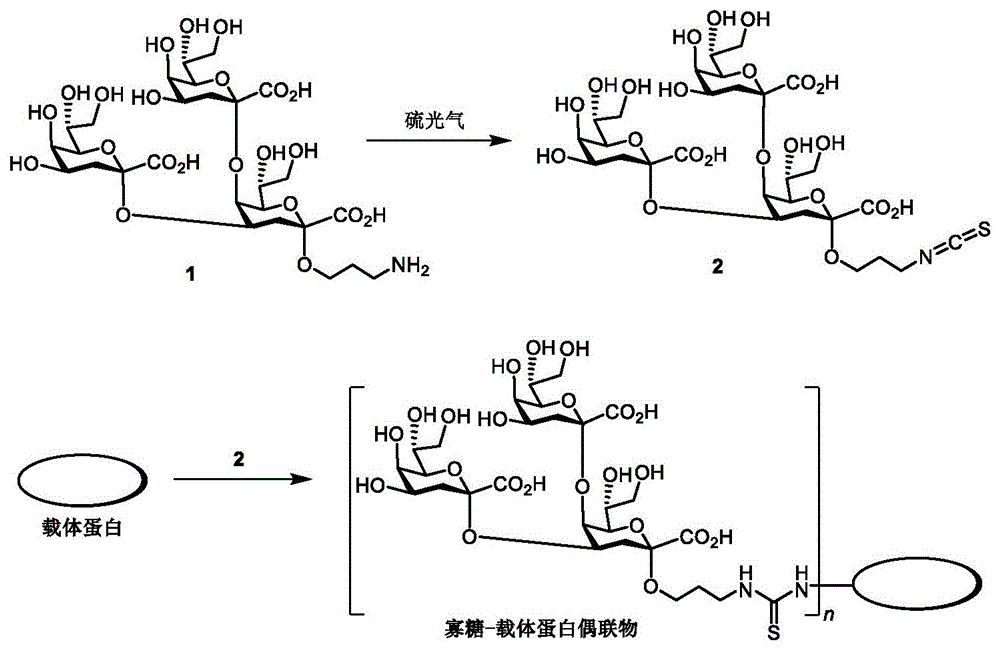
一种鲍曼不动杆菌核心寡糖-蛋白偶联物,所述鲍曼不动杆菌核心寡糖-蛋白偶联物的核心寡糖为α-Kdo-(2→4)-[α-Kdo-(2→5)]-α-Kdo分支三糖(以下简称寡糖1),所述蛋白包括破伤风类毒素、白喉类毒素、白喉毒素的无毒变异体(CRM197)、流感嗜血杆菌D蛋白、B群脑膜炎球菌外膜蛋白复合体或Qβ噬菌体蛋白颗粒等。所述蛋白均为能够增强或辅助增强免疫应答的载体蛋白,且具有能与核心寡糖中间产物结合在一起的氨基酸结构。
进一步,所述α-Kdo-(2→4)-[α-Kdo-(2→5)]-α-Kdo分支三糖先与硫光气反应得到中间产物半抗原(以下简称半抗原2),所述半抗原具有硫氰酸酯结构,所述硫氰酸酯结构随后与蛋白的氨基发生缩合反应生成硫脲,从而将所述核心寡糖与所述蛋白偶联在一起。
上述鲍曼不动杆菌核心寡糖-蛋白偶联物的制备方法,包括如下步骤:
1)α-Kdo-(2→4)-[α-Kdo-(2→5)]-α-Kdo分支三糖作为起始物料溶解于碳酸氢钠水溶液中,室温下加入混有硫光气的氯仿溶液并于室温下搅拌过夜得到反应混合物,用水稀释所述反应混合物后用纯氯仿溶液提取,提取后得到水层和氯仿层,取水层(氯仿层去掉)除去多余硫光气后收集并冻干,制得中间产物半抗原的粗提物;
2)将步骤1)制得的所述半抗原的粗提物与载体蛋白按照质量比2:1进行混合,在碱性磷酸缓冲液中反应过夜制得所述核心寡糖-蛋白偶联物;所述载体蛋白包括破伤风类毒素、白喉类毒素、白喉毒素的无毒变异体、流感嗜血杆菌D蛋白、B群脑膜炎球菌外膜蛋白复合体或Qβ噬菌体蛋白颗粒。
上述鲍曼不动杆菌核心寡糖-蛋白偶联物在制备预防或治疗由鲍曼不动杆菌引起的感染性疾病的疫苗中的应用。
进一步,所述感染性疾病包括皮肤或伤口感染、尿路感染、机械通气相关性肺炎、败血症、脑膜炎和心内膜炎中的一种或几种。
进一步,所述疫苗可选地还可以包括α-Kdo-(2→4)-[α-Kdo-(2→5)]-α-Kdo分支三糖。
进一步,所述疫苗可选地还可以与佐剂联用。优选的佐剂类型包括氢氧化铝、皂苷或CpG寡脱氧核苷酸等,但不局限于此。
进一步,所述疫苗诱导的抗体可以直接结合鲍曼不动杆菌全菌抗原,用于抑制或杀死细菌。
进一步,所述疫苗的免疫程序为:在第0天初次接种后,分别于第14天和第28天进行加强免疫接种。
进一步,所述疫苗的接种方式包括皮下注射和/或肌肉注射。
有益技术效果
本发明利用自合成的鲍曼不动杆菌核心寡糖α-Kdo-(2→4)-[α-Kdo-(2→5)]-α-Kdo分支三糖作为起始物料(寡糖1),合成了一种寡糖1-载体蛋白偶联物,并利用所述寡糖1-载体蛋白偶联物进行了免疫实验,结果证明:
1)寡糖1与寡糖1-CRM
2)脾细胞增殖结果显示寡糖1和寡糖1-CRM
3)寡糖1与寡糖1-CRM
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作一简单地介绍。显而易见地,下面描述中的附图是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动性的前提下,还可以根据这些附图获得其它的附图。
图1为本发明的核心寡糖和载体蛋白偶联过程示意图;
图2为SDS-PAGE鉴定寡糖1与CRM
图3为免疫后不同时间点的小鼠血清中总IgG抗体浓度图;
图4为间接ELISA测免疫后不同时间点的小鼠血清中特异性IgG抗体滴度图;
图5为CCK-8法分析小鼠脾细胞体外增殖实验;
图6为鲍曼不动杆菌全菌抗原ELISA测定不同稀释倍数血清抗体结合实验图;
图7为合成α-Kdo-(2→4)-[α-Kdo-(2→5)]-α-Kdo分支三糖的起始物料反应路径图;
图8为合成α-Kdo-(2→4)-[α-Kdo-(2→5)]-α-Kdo分支三糖的中间产物反应路径图;
图9为合成α-Kdo-(2→4)-[α-Kdo-(2→5)]-α-Kdo分支三糖路径图。
具体实施方式
为使本发明实施例的目的、技术方案和优点更加清楚,下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述。显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
需要说明的是,在本文中,术语“包括”、“包含”或者其任何其他变体意在涵盖非排他性的包含,从而使得包括一系列要素的过程、方法、物品或者装置不仅包括那些要素,而且还包括没有明确列出的其他要素,或者是还包括为这种过程、方法、物品或者装置所固有的要素。在没有更多限制的情况下,由语句“包括一个……”限定的要素,并不排除在包括该要素的过程、方法、物品或者装置中还存在另外的相同要素。
如在本说明书中使用的,术语“大约”,典型地表示为所述值的+/-5%,更典型的是所述值的+/-4%,更典型的是所述值的+/-3%,更典型的是所述值的+/-2%,甚至更典型的是所述值的+/-1%,甚至更典型的是所述值的+/-0.5%。
在本说明书中,某些实施方式可能以一种处于某个范围的格式公开。应该理解,这种“处于某个范围”的描述仅仅是为了方便和简洁,且不应该被解释为对所公开范围的僵化限制。因此,范围的描述应该被认为是已经具体地公开了所有可能的子范围以及在此范围内的独立数字值。例如,范围
本发明中所述的α-Kdo-(2→4)-[α-Kdo-(2→5)]-α-Kdo分支三糖(寡糖1)的化学式如下所示:
本发明中所述的中间产物半抗原(半抗原2)的化学式如下所示:
实施例1
半抗原2的合成
将寡糖1(5mg)溶于碳酸氢钠水溶液(1mL)中,室温下加入硫光气(6.68μL,87.2μmol)的氯仿(1.5mL)溶液,加完后在室温下搅拌反应过夜。用水(10mL)稀释反应混合物,用纯氯仿溶液(4mL×3)提取,提取后去掉氯仿层取水层,除去多余的硫光气。收集水层,冻干,得粗产物,直接用于下一步的蛋白偶联。
偶联疫苗的制备
将半抗原2(1.0mg)与0.5mg的CRM
其中,寡糖1-BSA偶联物作为后续检测时包被所用的抗原。
实施例2
小鼠免疫
选用6-8周龄的雄性BALB/c小鼠,将小鼠分为3组,每组8-10只小鼠,Group A:PBS,Group B:寡糖1,Group C:寡糖1-CRM
血清采集
在初次免疫后的第0天、7天、14天、21天、28天、35天通过小鼠眼眶静脉采取血液0.4ml。全血先在室温静置4h,10,000r/min离心15min后吸取上层血清,获得血清约0.2ml,血清冻存于-70℃用于后续抗体滴度测定。
脾淋巴细胞的提取
脾淋巴细胞提取的整个过程都在无菌超净台环境条件下进行,且在冰上进行以保持细胞活力,具体步骤如下:
1)断颈处死经过完整三次免疫后第35天的小鼠,于75%的乙醇中浸泡5min进行消毒。
2)在超净台中,加入1mL RPMI-1640培养基浸润细胞筛,在玻璃培养皿中倒入适量的无菌PBS。消毒后的小鼠背部朝下、用针头固定在泡沫板上,剪开腹腔后取出小鼠脾脏(位于腹腔右上部位),放于10cm玻璃培养皿中用PBS进行清洗。
3)将清洗后的脾脏放于细胞筛上,用研磨棒轻轻研磨至脾脏完全其分散为单个脾细胞后,用15mL的RPMI-1640培养基将细胞筛和研磨棒上残留的脾细胞冲洗至底部的离心管。
4)将制备的脾淋巴细胞悬液在4℃、1000g条件下离心5min,舍弃上清,收集脾细胞沉淀。
5)向脾细胞沉淀加入红细胞裂解液,并轻吸吹重悬细胞沉淀,避免产生气泡。充分重悬后置于室温,计时4min。
6)裂解结束后,迅速加入10mL RPMI-1640培养基以终止裂解,混匀后1000g离心5min。
7)丢弃细胞上清,收集细胞沉淀并加入1mL RPMI-1640培养基重悬,挑出残留的脾淋巴细胞组织块,加入9mL加入RPMI-1640培养基,按前面的同样条件离心,收集脾细胞沉淀。
8)向细胞沉淀中加入1mL完全RPMI-1640(含10% FBS和1%双抗)培养基重悬细胞沉淀,分散均匀后即制得单个淋巴细胞悬液,用于脾淋巴细胞增殖实验。
实施例3
间接ELISA测定小鼠血清特异性IgG抗体滴度
1)包被:寡糖1-BSA偶联物(10μg/ml,100μL/well)在4℃包被过夜(12-16小时),并用封口膜封板,防止挥发(包被缓冲液为:50mmol/L碳酸氢盐缓冲液,pH 9.6),小心放入湿盒。
2)洗板:弃去板中原有的包被液体,用PBST洗液洗涤3次,拍干。
3)封闭:用200μL的脱脂牛奶封闭液在37℃孵育2h;酶标板拍干后应即刻使用,避免完全干燥。
4)洗板:弃去封闭液,用PBST洗液洗涤3次,拍干。
5)一抗结合:拍干后,先加入稀释液,50μL/well,被检血清的稀释在酶标板内进行,将酶标板横向使用,向第1列中加入稀释的50μL待检血清,将1列用排枪混匀后取50μL加入第2列,混匀,再取50μL加入第3列混匀,如此倍比稀释至第10列混匀后弃掉50μL液体,然后37℃孵育2h。
6)洗板:弃去样品液,用PBST洗液洗涤5次,拍干。
7)二抗:加入100μL,氧化物酶(HRP)偶联IgG羊抗鼠二抗(1:10000稀释倍,最后一遍洗板时再配酶标抗体),室温孵育2h。
8)洗板:弃去板内溶液,用PBST洗板7次、拍干。
9)显色:在避光条件下加入100μL TMB显色液,室温孵育30min(注意避光操作)。
10)终止:用50μL 2mol/L H2SO4终止反应。
11)读板:读取450nm的吸光度值以评价抗体活性。终止反应30min以内读取450nm处的吸光度,并设立620nm波长作为本底吸收扣除。
12)抗体滴度的计算:注意PBS对照孔血清应不溶血,通常设定阴性孔平均值的2倍作为临界值,大于该临界值的孔判断为阳性,阳性孔的最高稀释倍数即为该血清样品的抗体滴度。
实验结果:
抗体滴度是评价体液免疫的重要指标,通过间接ELISA测定免疫小鼠血清的抗体滴度,结果如图4所示。小鼠免疫后,血清抗体滴度在整体上呈现出增加的趋势。但初次免疫后14天内,小鼠体内抗体滴度水平都较低。在初免后的第28天,实验组显著高于PBS组,表明各组抗原在小鼠体内都引起了有效的体液免疫反应。经完整三次免疫后,小鼠在第35天体内的抗体滴度显著性升高。相比于PBS,未偶联蛋白的寡糖1也能够诱导小鼠产生特异性抗体。但寡糖1与CRM
小鼠血清总IgG抗体浓度测定
小鼠血清总IgG抗体浓度测定方法按照小鼠血液总IgG抗体试剂盒手册方法测定。经PBS组、寡糖1组以及寡糖1-CRM
实验结果:
总IgG抗体浓度是评价疫苗引起免疫应答能力的重要指标,通过商品化试剂盒测定免疫小鼠血清的总IgG抗体浓度,结果如图3所示。小鼠免疫后,血清总IgG抗体浓度在整体上呈现出持续增加的趋势。相比于PBS组,实验室小鼠血清总IgG抗体浓度均显著升高。寡糖1-CRM
实施例4
脾细胞增殖实验
本实验中采用CCK-8法检测脾淋巴细胞在体外抗原刺激物作用下增殖能力,具体操作如下:使用台盼蓝计数法淋巴细胞悬液的细胞浓度,并用RPMI-1640完全培养基将细胞浓度调整为5×l0
实验结果:
首先,通过CCK-8法测量小鼠脾细胞总体的增殖情况,如图5所示,在体外经寡糖1、寡糖1-CRM
实施例5
小鼠血清抗体结合鲍曼菌实验
鲍曼不动杆菌(华西检验科提供)经LB培养基+1%琼脂糖固体培养基上培养后,挑取菌落,重悬于LB培养基中,调节菌体浓度至1×10
实验结果:
PBS组、寡糖1组、寡糖1-CRM
本发明实验结论:
1)寡糖1与寡糖1-CRM
2)脾细胞增殖结果显示寡糖1和寡糖1-CRM
3)寡糖1与寡糖1-CRM
实施例6
α-Kdo-(2→4)-[α-Kdo-(2→5)]-α-Kdo分支三糖(本实施例中的化合物15)的合成示例
化合物S-1在TBAF的作用下脱除TBS保护基,随后在甲醇钠的作用下将C5位苯甲酰基脱除,以两步85%的产率得到化合物S-2。化合物S-2在C-4OH选择性上烯丙基,以87%的产率得到受体2。
其中,S-1和S-2化学式如下:
供体1与C5-OH受体2在TBPA的催化作用下进行糖苷化反应,以80%的产率得到2,5-连接的Kdo二糖化合物3。一方面,二糖化合物3在Et
其中,供体1、受体2、化合物3、受体5化学式分别如下所示:
4-OH二糖受体5与供体12进行糖苷化反应,以70%的产率得到Kdo支链三糖13。Kdo支链三糖13脱除8’-O-TBS和5’,7’-O-DTBS保护基,得到化合物14(产率87%)。化合物14通过在酸性条件下脱除异亚丙基,通过皂化反应脱除全部的酯基保护基,以及通过催化氢化还原脱除苄基保护基的同时将叠氮基转化为氨基,以三步总产率为58%的产率得到目标支链三糖15。
其中,供体12、化合物14的化学式如下所示:
/>
上面结合附图对本发明的实施例进行了描述,但是本发明并不局限于上述的具体实施方式,上述的具体实施方式仅仅是示意性的,而不是限制性的,本领域的普通技术人员在本发明的启示下,在不脱离本发明宗旨和权利要求所保护的范围情况下,还可做出很多形式,这些均属于本发明的保护之内。
