一种多羰基咔唑衍生物及其制备方法
文献发布时间:2023-06-19 19:30:30
技术领域
本发明属于有机合成技术领域,公开了一种多羰基咔唑衍生物及其制备方法。
背景技术
咔唑及其衍生物是一类重要的含氮杂环化合物,在化学和生物学中都发挥着重要作用。许多含有咔唑基序的分子具有相当大的药理活性,例如抗病毒、抗疟疾、抗雌激素和抗肿瘤特性(Chem.Lett.,2000,10,1021)。此外,咔唑因其结构刚性和广泛的π共轭而广泛用于各种有机光电材料和发色团(Tetrahedron Lett.,2016,57,243)。因此,咔唑衍生物的合成一直受到化学工作者广泛关注。
目前,文献中已有多种合成策略应用于咔唑衍生物的制备。早期的方法包括Graebe-Ullmann反应、Borsche-Drechsel环化和Fischer-Borsche咔唑合成等反应。这类方法反应条件苛刻且反应步骤长。近些年,贵金属和过渡金属催化剂被应用于咔唑及其衍生物的合成,丰富了咔唑的合成手段。一类方法是由联苯衍生物构建氮杂环。然而,这类方法需要预官能化且产物结构受限。另一类方法是由吲哚衍生物出发通过环合反应构建咔唑环。这是一类能够快速、有效地得到结构多样的咔唑衍生物的途径之一。其中,吲哚环化反应构建咔唑可以采取以下几种策略:[2+2'+2']环化反应(Org.Chem.2009,74,7481)、[2+2'+2"]环化反应(Org.Lett.2016,18,5384)和[4+2]环加成反应(Adv.Synth.Catal.2014,557)。这类方法无需官能化,原子经济性好且产物结构多样。然而,一锅反应合成多羰基咔唑衍生物的制备方法鲜有报道。
发明内容
针对现有技术存在的问题,本发明提供一种多羰基咔唑衍生物及其制备方法。用简单的吲哚衍生物与易制备、结构多样的β-氯代酮衍生物和γ-氯代酮衍生物经Domino吲哚烯基化-Diels-Alder环加成-脱氢芳构化-C-H氧化反应合成一系列多羰基咔唑衍生物1。与已报道的咔唑衍生物合成方法相比较,本发明原料易得、操作简便、适用范围广。
为了实现上述目的,本发明的技术方案如下:
一种多羰基咔唑衍生物,所述多羰基咔唑衍生物1的结构式如下:
其中,R
一种多羰基咔唑衍生物的制备方法,合成路线如下述反应式(1)所示:
所述的制备方法以简单且结构多样的吲哚衍生物2,易制备、结构多样的β-氯代酮衍生物3和γ-氯代酮衍生物4为原料,钯盐为催化剂,加入反应溶剂中,并加入氧化剂和添加剂,在碱性条件下加热进行吲哚衍生物2与β-氯代酮类衍生物3和γ-氯代酮类衍生物4的Domino吲哚烯基化-Diels-Alder环加成-脱氢芳构化-C-H氧化反应(反应式1),其中反应温度为30-150℃,反应时间为1-30小时,反应结束后按常规分离纯化方法进行产物分离和表征,合成得到多羰基咔唑衍生物1。所述吲哚衍生物2与催化剂的摩尔比为1:0.05-1:0.15,吲哚衍生物2与氧化剂摩尔比为1:1-1:8,吲哚衍生物2与添加剂摩尔比为1:1-1:8,吲哚衍生物2与碱摩尔比为1:1-1:8,吲哚衍生物2、β-氯代酮衍生物3、γ-氯代酮衍生物4三者的摩尔比为1:1:1-1:1:6。
所述的吲哚衍生物2的结构式为
所述的β-氯代酮类衍生物3的结构式为
所述的γ-氯代酮类衍生物4的结构式为
进一步的,所述的催化剂为醋酸钯、氯化钯、四三苯基膦钯或二苯基膦二氯化钯。优选为醋酸钯,其催化剂效果最好,所述的吲哚衍生物2与醋酸钯的最优摩尔比为1:0.05-1:0.1。
进一步的,所述的氧化剂为醋酸铜、水合醋酸铜、水合氯化铜、三氟甲磺酸铜、氯化亚铜。其中,以水合醋酸铜为氧化剂效果最好,吲哚衍生物2与水合醋酸铜的最优摩尔比为1:2-1:5。
进一步的,所述的添加剂为2,2,6,6-四甲基哌啶氮氧化物TEMPO。其中,吲哚衍生物2与2,2,6,6-四甲基哌啶氮氧化物的最优摩尔比为1:2-1:5。
进一步的,所述的碱为醋酸锂、醋酸钠、醋酸铯、碳酸钠或磷酸钾,其中以醋酸钠为碱效果最好,吲哚衍生物2与醋酸钠的最优摩尔比为1:4-1:5。
进一步的,所述的反应溶剂为乙醇、四氢呋喃、甲苯、氯苯、乙腈和N,N-二甲基甲酰胺中的一种或两种以上。其中,反应在N,N-二甲基甲酰胺和甲苯的混合溶剂中进行效果最好,两者最优体积比为1:2-1:5。
进一步的,所述的吲哚衍生物2与β-氯代酮衍生物3和γ-氯代酮衍生物4的摩尔比优选为1:1:3-1:1:4时反应效果最好。
进一步的,所述的反应温度优选为70-130℃,反应时间为12-24小时。
本发明的反应机理为:首先吲哚衍生物2与β-氯代酮衍生物3脱氯化氢生成的烯基酮反应生成烯基吲哚中间体,然后中间体与γ-氯代酮衍生物4通过DA反应/脱氢芳构化/碳-氢氧化最终合成咔唑衍生物1。
本发明提供一种原料易得、反应条件温和、适应性广、能简单方便的合成多羰基咔唑衍生物的方法。与现有技术相比,具有以下有益效果:
1)反应原料吲哚衍生物2、β-氯代酮类衍生物3和γ-氯代酮类衍生物4具有结构多样性,可以用来合成不同类型和结构的多羰基咔唑衍生物1。
2)反应原料2、3和4便宜易得,部分原料商业可得,其他原料可通过简单方式制备。
3)多羰基咔唑衍生物1合成反应条件温和、步骤简单、产物收率高且适用范围广。
总之,本发明利用吲哚衍生物2、β-氯代酮类衍生物3和γ-氯代酮类衍生物4类型和结构的多样性来高效合成不同类型和结构的多羰基咔唑衍生物1,原料便宜易得,操作简便,目标产物收率高。
附图说明
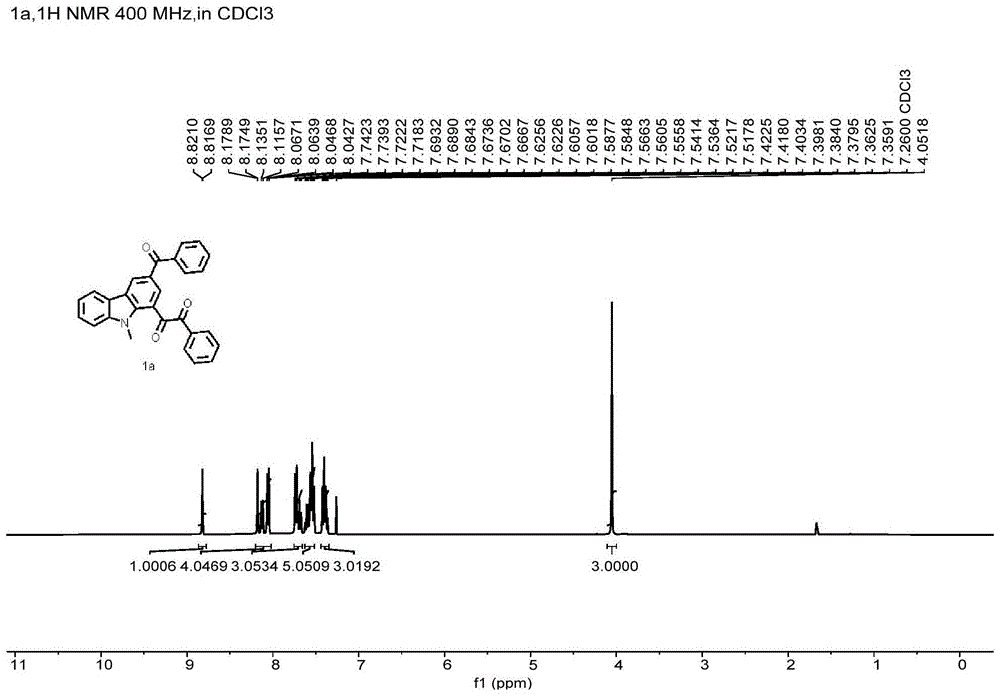
图1为1a核磁H谱。
图2为1a核磁C谱。
图3为1b核磁H谱。
图4为1b核磁C谱。
图5为1d核磁H谱。
图6为1d核磁C谱。
图7为1f核磁H谱。
图8为1f核磁C谱。
具体实施方式
以下结合具体实施例对本发明作进一步说明。
本发明以简单的吲哚衍生物2为原料与β-氯代酮类衍生物3和γ-氯代酮类衍生物4在碱性条件下加热进行Domino吲哚烯基化-Diels-Alder环加成-脱氢芳构化-C-H氧化反应,合成多羰基咔唑衍生物1。通过下述实施例有助于进一步理解本发明,但本发明的内容并不仅限于此。
实施例1
在35ml耐压瓶中,空气下依次加入醋酸钯Pd(OAc)
实施例2
反应步骤与操作同实施例1,与实施例1不同之处在于,催化剂为氯化钯PdCl
实施例3
反应步骤与操作同实施例1,与实施例1不同之处在于,催化剂为四三苯基膦钯Pd[P(C
实施例4
反应步骤与操作同实施例1,与实施例1不同之处在于,氧化剂为氯化亚铜CuCl且吲哚衍生物2a与氯化亚铜CuCl的摩尔比为1:1。停止反应,经后处理得到目标产物1a(32mg,收率38%)。
实施例5
反应步骤与操作同实施例1,与实施例1不同之处在于,氧化剂为三氟甲磺酸铜Cu(OTf)
实施例6
反应步骤与操作同实施例1,与实施例1不同之处在于,吲哚衍生物2与添加剂2,2,6,6-四甲基哌啶氮氧化物TEMPO摩尔比是1:1。停止反应,经后处理得到目标产物1a(41mg,收率50%)。
实施例7
反应步骤与操作同实施例1,与实施例1不同之处在于,吲哚衍生物2与添加剂2,2,6,6-四甲基哌啶氮氧化物TEMPO摩尔比是1:8。停止反应,经后处理得到目标产物1a(55mg,收率66%)。
实施例8
反应步骤与操作同实施例1,与实施例1不同之处在于,碱为碳酸钠Na
实施例9
反应步骤与操作同实施例1,与实施例1不同之处在于,碱为磷酸钾K
实施例10
反应步骤与操作同实施例1,与实施例1不同之处在于,反应溶剂为N,N-二甲基甲酰胺和四氢呋喃的混合溶剂,比例为1:5。停止反应,经后处理得到目标产物1a(25mg,收率30%)。
实施例11
反应步骤与操作同实施例1,与实施例1不同之处在于,反应溶剂为N,N-二甲基甲酰胺和甲苯的混合溶剂,比例为1:2。停止反应,经后处理得到目标产物1a(63mg,收率75%)。说明以N,N-二甲基甲酰胺和甲苯的混合溶剂作为反应溶剂有助于反应的进行。
实施例12
反应步骤与操作同实施例1,与实施例1不同之处在于,反应溶剂为N,N-二甲基甲酰胺。停止反应,经后处理得到目标产物1a(23mg,收率28%)。
实施例13
反应步骤与操作同实施例1,与实施例1不同之处在于,反应温度为30℃,反应时间为1h。停止反应,经后处理得到目标产物1a(23mg,收率28%)。
实施例14
反应步骤与操作同实施例1,与实施例1不同之处在于,反应温度为90℃,反应时间为15h。停止反应,经后处理得到目标产物1a(25mg,收率30%)。
实施例15
反应步骤与操作同实施例1,与实施例1不同之处在于,反应温度为150℃,反应时间为30h。停止反应,经后处理得到目标产物1a(54mg,收率65%)。
实施例16
反应步骤与操作同实施例1,与实施例1不同之处在于,反应体系中加入的吲哚衍生物2b(31mg,0.2mmol),氯苯丁酮4a(36.5mg,0.2mmol)且2b,3a和4a的摩尔比为1:1:1。停止反应,经后处理得到橙黄色固体1b(18mg,20%)。目标产物通过核磁共振谱和高分辨质谱测定得到确认。
实施例17
反应步骤与操作同实施例1,与实施例1不同之处在于,反应体系中加入的吲哚衍生物2c(32mg,0.2mmol),氯苯丁酮4a(219mg,1.2mmol)且2c,3a和4a的摩尔比为1:1:6。停止反应,经后处理得到淡黄色固体1c(45mg,50%)。目标产物通过核磁共振谱和高分辨质谱测定得到确认。
实施例18
反应步骤与操作同实施例1,与实施例1不同之处在于,反应体系中加入的β-氯代酮衍生物3b(40mg,0.2mmol)。停止反应,经后处理得到淡黄色固体1d(45mg,50%)。目标产物通过核磁共振谱和高分辨质谱测定得到确认。
实施例19
反应步骤与操作同实施例1,与实施例1不同之处在于,反应体系中加入的β-氯代酮衍生物3c(36mg,0.2mmol)。停止反应,经后处理得到淡黄色固体1e(39mg,45%)。目标产物通过核磁共振谱和高分辨质谱测定得到确认。
实施例20
反应步骤与操作同实施例1,与实施例1不同之处在于,反应体系中加入的γ-氯代酮衍生物4b(120mg,0.6mmol)。停止反应,经后处理得到淡黄色固体1f(18mg,21%)。目标产物通过核磁共振谱和高分辨质谱测定得到确认。
实施例21
反应步骤与操作同实施例1,与实施例1不同之处在于,反应体系中加入的γ-氯代酮衍生物4c(129mg,0.6mmol)。停止反应,经后处理得到淡黄色固体1g(47mg,53%)。目标产物通过核磁共振谱和高分辨质谱测定得到确认。
典型化合物表征数据
咔唑衍生物(1a),淡黄色固体。
咔唑衍生物(1b),橙黄色固体。
咔唑衍生物(1d),淡黄色固体。
咔唑衍生物(1f),淡黄色固体。
以上所述实施例仅表达本发明的实施方式,但并不能因此而理解为对本发明专利的范围的限制,应当指出,对于本领域的技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些均属于本发明的保护范围。
- 一种制备聚咔唑衍生物纳米纤维的方法
- 一种四苯乙烯-二苯甲酮-咔唑衍生物、晶体及其制备方法与应用
- 一种咔唑衍生物及其制备方法和用途
- 咔唑酰胺类衍生物或其盐及其制备方法和用途
- 一种N-(6-羟基己基)咔唑衍生物及N-(6-羟基己基)咔唑及其衍生物的合成方法
- 一种羰基修饰咔唑衍生物室温磷光材料的制备方法和应用
