一种具有抗炎活性的多肽类化合物及其制备方法与应用
文献发布时间:2023-06-19 19:30:30
技术领域
本发明属于医药技术领域,具体地说,涉及一种具有抗炎活性的多肽类化合物及其制备方法与应用。
背景技术
骨性关节炎(osteoarthritis,OA)是一种高发病率和高致残率的退行性关节疾病,给患者、家庭和社会均造成了沉重的负担。据文献报道,目前全球OA患者已超过5亿,约占成年人人口的15%。伴随着人口老龄化进程的加剧,OA患病率呈逐渐上升趋势。目前,早期OA治疗药物首选非甾体类抗炎药物(NSAIDs)局部外用,而中重度OA患者以口服NASIDs和选择性环氧合酶抑制剂控制症状为主,主要侧重短期获益,长期用药可导致心血管毒性,胃肠道出血,肝肾损害等不良反应。针对现有治疗药物的局限性,开发靶向OA病理机制的安全有效药物改善关节微环境至关重要。
关节软骨细胞的凋亡和先天炎症通路的激活在OA的发生发展中发挥着关键作用。STING作为关节软骨细胞中炎症诱导衰老损伤的关键受体,可识别细胞质的环状二核苷酸,招募TBK1激酶及IRF3转录因子,使IRF3磷酸化和二聚体形成,诱导一型干扰素和炎症因子的表达,驱动炎症反应。而STING缺失或突变可延缓自发性骨关节炎中的炎症反应和软骨降解,并减轻成年小鼠DMM模型骨关节的损伤,表明STING可能是治疗OA的新靶点。理想的药物递送系统可提高药物的作用效果并降低给药剂量和毒副作用,多肽类药物因适应性广,安全性高且疗效显著,目前已广泛应用于哮喘、过敏、疼痛等疾病的治疗。基于靶向STING的多肽药物替代传统抗炎药物治疗关节炎具有巨大潜力,且目前尚未见报道。
发明内容
本发明的第一个目的是提供一种具有抗炎活性的多肽类化合物。
本发明的第二个目的是提供一种所述具有抗炎活性的多肽类化合物的制备方法。
本发明的第三个目的是提供一种所述具有抗炎活性的多肽类化合物在制备治疗膝或骨关节炎的药物中的应用。
为了实现上述目的,本发明采用的技术方案如下:
本发明的第一方面提供了一种具有抗炎活性的多肽类化合物或其药用盐,该多肽是从Sting的二元复合物晶体结构二者之间相互作用的关键残基序列中筛选鉴定获得,结构选自以下结构的一种:
LA
X
NFNVAHGLAWSYYI
式(I)中,X
X
片段中成对的(2R)-2-氨基-2-甲基-6-庚烯酸可通过或不通过烯烃复分解反应进行环合;
式(II)中,X
式(III)中,X
式(I)、式(II)或式(III)多肽的N末端的氨基和C末端的羧基以及氨基酸侧链基团可以不进行修饰,也可以在基本不影响本发明多肽活性的前提下进行修饰,如形成“药学上可接受的酯”,N末端氨基基团的修饰包括但不限于脱-氨基、N-低级烷基、N-二低级烷基和N-酰基修饰,C末端羧基基团的修饰包括但不限于酰胺、低级烷基酰胺、二烷基酰胺和低级烷基酯修饰,本发明多肽N末端的氨基进行乙酰化修饰,即是-Ac,C末端的羧基进行酰胺化修饰,即是-NH
优选的,所述具有抗炎活性的多肽类化合物的氨基酸序列选自以下氨基酸序列的一种:
SEQ ID NO.1所示的氨基酸序列;
SEQ ID NO.2所示的氨基酸序列;
SEQ ID NO.3所示的氨基酸序列;
SEQ ID NO.4所示的氨基酸序列;
SEQ ID NO.5所示的氨基酸序列;
SEQ ID NO.6所示的氨基酸序列;
SEQ ID NO.7所示的氨基酸序列;
SEQ ID NO.8所示的氨基酸序列;
SEQ ID NO.9所示的氨基酸序列;
SEQ ID NO.10所示的氨基酸序列;
SEQ ID NO.11所示的氨基酸序列。
本发明的第二方面提供了一种所述具有抗炎活性的多肽类化合物的制备方法,包括以下步骤:
第一步,树脂的溶胀:将Fmoc-Rinkamid-MBHAResin(取代度=0.44mmol/g)置于多肽反应管中,经DCM溶胀,抽滤去除DCM;
第二步,Fmoc保护的脱除:向第一步的反应管中加入20%的哌啶/DMF溶液振摇,抽滤去除溶液,使用DCM冲洗树脂;
第三步,氨基酸的连接:将Fmoc-Leu-OH、Fmoc-Arg(Pbf)-OH、Fmoc-Asn(Trt)-OH、Fmoc-Gln(Trt)-OH或Fmoc-Gly-OH和HCTU中加入DMF溶解,再加入DIPEA振摇后将其倒入第二步的多肽反应管中,常温振摇,反应结束后,抽滤去除溶液,使用DCM和DMF冲洗树脂;
重复第二步和第三步的步骤依次连接Fmoc-Arg(Pbf)-OH、Fmoc-Leu-OH、Fmoc-Tyr(tBu)-OH、Fmoc-Gly-OH、Fmoc-Ile-OH、Fmoc-Tyr(tBu)-OH、Fmoc-Tyr(tBu)-OH、Fmoc-Ser(tBu)-OH、Fmoc-Trp(Boc)-OH、Fmoc-Ala-OH、Fmoc-Leu-OH,直至所有氨基酸连接完毕;
或,重复第二步和第三步的步骤依次连接Fmoc-Arg(Pbf)-OH、Fmoc-Leu-OH、Fmoc-Tyr(tBu)-OH、Fmoc-Gly-OH、Fmoc-S
或,重复第二步和第三步的步骤依次连接Fmoc-Leu-OH、Fmoc-Leu-OH、Fmoc-Asn(Trt)-OH、Fmoc-Asn(Trt)-OH、Fmoc-Tyr(tBu)-OH、Fmoc-His(Trt)-OH、Fmoc-Gln(Trt)-OH、Fmoc-Arg(Pbf)-OH、Fmoc-Tyr(tBu)-OH、Fmoc-Thr(tBu)-OH、Fmoc-Arg(Pbf)-OH、Fmoc-Ile-OH、Fmoc-Arg(Pbf)-OH、Fmoc-Ala-OH、Fmoc-Gln(Trt)-OH、Fmoc-Leu-OH、Fmoc-Glu(tBu)-OH、Fmoc-Pro-OH、Fmoc-Leu-OH、Fmoc-Ile-OH、Fmoc-Leu-OH、Fmoc-Arg(Pbf)-OH、Fmoc-Leu-OH、Fmoc-Tyr(tBu)-OH,直至所有氨基酸连接完毕;
或,重复第二步和第三步的步骤依次连接Fmoc-Leu-OH、Fmoc-Leu-OH、Fmoc-Asn(Trt)-OH、Fmoc-Asn(Trt)-OH、Fmoc-Tyr(tBu)-OH、Fmoc-His(Trt)-OH、Fmoc-Gln(Trt)-OH、Fmoc-Arg(Pbf)-OH、Fmoc-Tyr(tBu)-OH、Fmoc-Thr(tBu)-OH、Fmoc-Arg(Pbf)-OH、Fmoc-Ile-OH、Fmoc-Arg(Pbf)-OH、Fmoc-Ala-OH、Fmoc-Gln(Trt)-OH、Fmoc-Leu-OH、Fmoc-Glu(tBu)-OH、Fmoc-Pro-OH、Fmoc-Leu-OH、Fmoc-Ile-OH、Fmoc-Leu-OH、Fmoc-Arg(Pbf)-OH、Fmoc-Leu-OH、Fmoc-Tyr(tBu)-OH、Fmoc-Gly-OH、Fmoc-Ile-OH,直至所有氨基酸连接完毕;
或,重复第二步和第三步的步骤依次连接Fmoc-Ile-OH、Fmoc-Tyr(tBu)-OH、Fmoc-Tyr(tBu)-OH、Fmoc-Ser(tBu)-OH、Fmoc-Trp(Boc)-OH、Fmoc-Ala-OH、Fmoc-Leu-OH、Fmoc-Gly-OH、Fmoc-Ala-OH、Fmoc-Val-OH、Fmoc-Asn(Trt)-OH、Fmoc-Phe-OH、Fmoc-Asn(Trt)-OH,直至所有氨基酸连接完毕;
或,重复第二步和第三步的步骤依次连接Fmoc-Ile-OH、Fmoc-Leu-OH、Fmoc-Arg(Pbf)-OH、Fmoc-Leu-OH、Fmoc-Tyr(tBu)-OH、Fmoc-Gly-OH、Fmoc-Ile-OH、Fmoc-Tyr(tBu)-OH、Fmoc-Tyr(tBu)-OH、Fmoc-Ser(tBu)-OH、Fmoc-Tyr(tBu)-OH、Fmoc-Ala-OH、Fmoc-Leu-OH、Fmoc-Gly-OH、Fmoc-His(Trt)-OH、Fmoc-Ala-OH、Fmoc-Val-OH、Fmoc-Asn(Trt)-OH、Fmoc-Phe-OH、Fmoc-Asn(Trt)-OH,直至所有氨基酸连接完毕;
或,重复第二步和第三步的步骤依次连接Fmoc-Leu-OH、Fmoc-Glu(tBu)-OH、Fmoc-Pro-OH、Fmoc-Leu-OH、Fmoc-Ile-OH、Fmoc-Leu-OH、Fmoc-Arg(Pbf)-OH、Fmoc-Leu-OH、Fmoc-Tyr(tBu)-OH、Fmoc-Gly-OH、Fmoc-Ile-OH、Fmoc-Tyr(tBu)-OH、Fmoc-Tyr(tBu)-OH、Fmoc-Ser(tBu)-OH、Fmoc-Trp(Boc)-OH、Fmoc-Ala-OH、Fmoc-Leu-OH、Fmoc-Gly-OH、Fmoc-His(Trt)-OH、Fmoc-Ala-OH、Fmoc-Val-OH、Fmoc-Asn(Trt)-OH、Fmoc-Phe-OH、Fmoc-Asn(Trt)-OH,直至所有氨基酸连接完毕;
或,重复第二步和第三步的步骤依次连接Fmoc-Tyr(tBu)-OH、Fmoc-Thr(tBu)-OH、Fmoc-Arg(Pbf)-OH、Fmoc-Ile-OH、Fmoc-Arg(Pbf)-OH、Fmoc-Ala-OH、Fmoc-Gln(Trt)-OH、Fmoc-Leu-OH、Fmoc-Glu(tBu)-OH、Fmoc-Pro-OH、Fmoc-Leu-OH、Fmoc-Ile-OH、Fmoc-Leu-OH、Fmoc-Arg(Pbf)-OH、Fmoc-Leu-OH、Fmoc-Tyr(tBu)-OH、Fmoc-Gly-OH、Fmoc-Ile-OH、Fmoc-Tyr(tBu)-OH、Fmoc-Tyr(tBu)-OH、Fmoc-Ser(tBu)-OH、Fmoc-Trp(Boc)-OH、Fmoc-Ala-OH、Fmoc-Leu-OH、Fmoc-Gly-OH、Fmoc-His(Trt)-OH、Fmoc-Ala-OH、Fmoc-Val-OH、Fmoc-Asn(Trt)-OH、Fmoc-Phe-OH、Fmoc-Asn(Trt)-OH,直至所有氨基酸连接完毕;
或,重复第二步和第三步的步骤依次连接Fmoc-Asn(Trt)-OH、Fmoc-Asn(Trt)-OH、Fmoc-Tyr(tBu)-OH、Fmoc-His(Trt)-OH、Fmoc-Gln(Trt)-OH、Fmoc-Asn(Trt)-OH、Fmoc-Tyr(tBu)-OH、Fmoc-Thr(tBu)-OH、Fmoc-Arg(Pbf)-OH、Fmoc-Ile-OH、Fmoc-Arg(Pbf)-OH、Fmoc-Ala-OH、Fmoc-Gln(Trt)-OH、Fmoc-Leu-OH、Fmoc-Glu(tBu)-OH、Fmoc-Pro-OH、Fmoc-Leu-OH、Fmoc-Ile-OH、Fmoc-Leu-OH、Fmoc-Arg(Pbf)-OH、Fmoc-Leu-OH、Fmoc-Tyr(tBu)-OH、Fmoc-Gly-OH、Fmoc-Ile-OH、Fmoc-Tyr(tBu)-OH、Fmoc-Tyr(tBu)-OH、Fmoc-Ser(tBu)-OH、Fmoc-Trp(Boc)-OH、Fmoc-Ala-OH、Fmoc-Leu-OH、Fmoc-Gly-OH、Fmoc-His(Trt)-OH、Fmoc-Ala-OH、Fmoc-Val-OH、Fmoc-Asn(Trt)-OH、Fmoc-Phe-OH、Fmoc-Asn(Trt)-OH,直至所有氨基酸连接完毕;
或,重复第二步和第三步的步骤依次连接Fmoc-Leu-OH、Fmoc-Asn(Trt)-OH、Fmoc-Asn(Trt)-OH、Fmoc-Tyr(tBu)-OH、Fmoc-His(Trt)-OH、Fmoc-Gln(Trt)-OH、Fmoc-Asn(Trt)-OH、Fmoc-Tyr(tBu)-OH、Fmoc-Thr(tBu)-OH、Fmoc-Arg(Pbf)-OH、Fmoc-Ile-OH、Fmoc-Arg(Pbf)-OH、Fmoc-Ala-OH、Fmoc-Gln(Trt)-OH、Fmoc-Leu-OH、Fmoc-Glu(tBu)-OH、Fmoc-Pro-OH、Fmoc-Leu-OH、Fmoc-Ile-OH、Fmoc-Leu-OH、Fmoc-Arg(Pbf)-OH、Fmoc-Leu-OH、Fmoc-Tyr(tBu)-OH、Fmoc-Gly-OH、Fmoc-Ile-OH、Fmoc-Tyr(tBu)-OH、Fmoc-Tyr(tBu)-OH、Fmoc-Ser(tBu)-OH、Fmoc-Trp(Boc)-OH、Fmoc-Ala-OH、Fmoc-Leu-OH、Fmoc-Gly-OH、Fmoc-His(Trt)-OH、Fmoc-Ala-OH、Fmoc-Val-OH、Fmoc-Asn(Trt)-OH、Fmoc-Phe-OH、Fmoc-Asn(Trt)-OH,直至所有氨基酸连接完毕;
或,重复第二步和第三步的步骤依次连接Fmoc-Leu-OH、Fmoc-Leu-OH、Fmoc-Asn(Trt)-OH、Fmoc-Asn(Trt)-OH、Fmoc-Tyr(tBu)-OH、Fmoc-His(Trt)-OH、Fmoc-Gln(Trt)-OH、Fmoc-Asn(Trt)-OH、Fmoc-Tyr(tBu)-OH、Fmoc-Thr(tBu)-OH、Fmoc-Arg(Pbf)-OH、Fmoc-Ile-OH、Fmoc-Arg(Pbf)-OH、Fmoc-Ala-OH、Fmoc-Gln(Trt)-OH、Fmoc-Leu-OH、Fmoc-Glu(tBu)-OH、Fmoc-Pro-OH、Fmoc-Leu-OH、Fmoc-Ile-OH、Fmoc-Leu-OH、Fmoc-Arg(Pbf)-OH、Fmoc-Leu-OH、Fmoc-Tyr(tBu)-OH、Fmoc-Gly-OH、Fmoc-Ile-OH、Fmoc-Tyr(tBu)-OH、Fmoc-Tyr(tBu)-OH、Fmoc-Ser(tBu)-OH、Fmoc-Trp(Boc)-OH、Fmoc-Ala-OH、Fmoc-Leu-OH、Fmoc-Gly-OH、Fmoc-His(Trt)-OH、Fmoc-Ala-OH、Fmoc-Val-OH、Fmoc-Asn(Trt)-OH、Fmoc-Phe-OH、Fmoc-Asn(Trt)-OH,直至所有氨基酸连接完毕;
第四步,N-末端乙酰化:向上述第三步的多肽反应管中加入体积比为1:1的吡啶和醋酸酐常温振摇,反应结束后抽滤去除溶液,使用DCM和DMF冲洗树脂;
第五步,多肽的树脂解离和侧链保护脱除:向上述第四步的多肽反应管中加入切割试剂,切割试剂为:TFA/TIPs/水=95:2.5:2.5,常温振摇,反应结束后收集滤液,向滤液中加入冰乙醚沉淀粗肽,过滤获得粗肽;
第六步,粗肽的纯化:将第五步获得的粗肽溶于体积比为1:1的乙腈和水混合溶液中,采用反相HPLC纯化,冷冻干燥,得到具有抗炎活性的多肽类化合物。
所述第六步的反相HPLC纯化条件:色谱柱:Shim-packPREP-ODS15UM20X250MM(日本岛津);A泵:含有千分之一的三氟乙酸的乙腈;B泵:含有千分之一的三氟乙酸的水;冲洗梯度:20分钟内由90%B泵到0%B泵;检测器:双波长214nm和254nm。
所述具有抗炎活性的多肽类化合物的制备方法还包括:
或,第四步后包括侧链烯烃复分解反应:向上述第四步的多肽反应管中加入第一代Grubbs催化剂的1,2-二氯乙烷溶液,常温振摇过夜。反应结束后,抽滤去除溶液,使用DCM和DMF冲洗树脂;继续进行第五步反应。
本发明的第三个方面提供了一种所述具有抗炎活性的多肽类化合物或其药用盐在制备治疗膝或骨关节炎的药物中的应用。
本发明通过内侧半月板切除诱导小鼠OA模型,治疗后第6周和第12周,采用Micro-CT扫描小鼠胫骨内侧平台三维图像和冠状面图像,并根据HE和番红固绿染色评估小鼠膝关节炎的OARSI评分,IHC检测发现靶向所合成的多肽SIP-2可降低软骨组织中MMP13和COL2A1阳性细胞的表达,发现本发明多肽可有效地减轻小鼠OA模型的关节软骨破坏,促进软骨基质合成,且抑制骨赘形成。
所述药用盐指一些小分子酸性或碱性化合物与多肽形成的盐,一般能够增加多肽的溶解性,所形成的盐基本上不改变多肽的活性。例如,通常能与本发明多肽形成盐的酸有盐酸、磷酸、硫酸、乙酸、琥珀酸、马来酸和柠檬酸等;能与本发明多肽形成盐的碱有碱金属或碱土金属的氢氧化物、铵和碳酸盐等。
本发明具有抗炎活性的多肽类化合物的抗炎作用可以通过常规的实验方法来验证,如细胞学实验等,在本发明的具体实施方式中,优选通过细胞学实验如荧光定量PCR,通过该试验,发现本发明具有抗炎活性的多肽类化合物都具有体外抗炎作用。
本发明还提供了一种药物组合物,以所述具有抗炎活性的多肽类化合物作为活性药物组分,可以用于抗炎治疗。
所述药物组合物可以含有一种或多种药学上可接受的稀释剂、赋形剂或载体,优选该组合物为单位剂量形式,如片剂、膜剂、丸剂、胶囊(包括持续释放或延迟释放形式)、粉剂、颗粒剂、糖浆剂或乳液剂、消毒的注射用溶液、悬浮液或冻干粉末针剂、气雾剂或液体喷剂、滴剂自动注射装置或栓剂。
所述药物组合物中的活性药物组分可以与一种无毒的药物学可接受的惰性载体组合在一起,如乙醇、甘油、水或其组合,本发明具有抗炎活性的多肽类化合物优选使用消毒的注射用水溶液。
本发明的药物组合物可通过所属领域技术人员所熟知的给药方式来进行给药,例如口服、直肠、舌下、肺部、透皮、离子透入、阴道及鼻内给药。本发明的药物组合物优选胃肠道外给药,如皮下、肌内或静脉内注射。
由于采用上述技术方案,本发明具有以下优点和有益效果:
本发明提供的多肽类化合物,可以靶向STING从而产生抗炎效果,用于治疗膝骨关节炎。
本发明通过第二信使2’,3’-cGAMP刺激小鼠RAW264.7细胞,构建STING免疫信号通路激活模型,RT-qPCR分析结果显示SIP-2以剂量依赖性方式降低了cGAMP诱导的Ifnβ基因表达;通过westernblot进一步研究发现SIP-2通过STING-TBK1-IRF3信号轴有效降低了STING相关的先天免疫信号通路的激活。类似的,在小鼠原代软骨细胞中,进行了进一步的验证,结果显示SIP-2可能降低关节软骨中STING的表达,延缓关节软骨退变;在小鼠DMM模型中,通过OARSI评分系统对软骨退变、软骨下骨改变及骨赘形成进行定量评分,结合第6周与第12周的IHC分析结果表明,SIP-2可明显减缓OA中小鼠膝关节退变进程。
附图说明
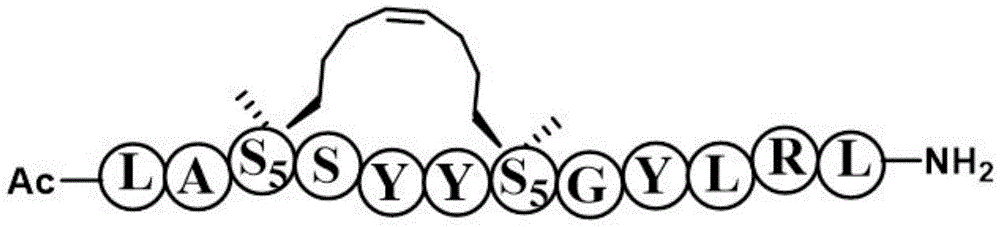
图1为多肽类化合物SIP-2结构式的示意图。
图2为本发明的多肽类化合物SIP-1的活性初筛及验证数据示意图。
图3为本发明的多肽类化合物SIP-2的活性初筛及验证数据示意图。
图4为本发明的多肽类化合物SIP-3的活性初筛及验证数据示意图。
图5为本发明的多肽类化合物SIP-4的活性初筛及验证数据示意图。
图6为本发明的多肽类化合物SIP-5的活性初筛及验证数据示意图。
图7为本发明的多肽类化合物SIP-6的活性初筛及验证数据示意图。
图8为本发明的多肽类化合物SIP-7的活性初筛及验证数据示意图。
图9为本发明的多肽类化合物SIP-8的活性初筛及验证数据示意图。
图10为本发明的多肽类化合物SIP-9的活性初筛及验证数据示意图。
图11为本发明的多肽类化合物SIP-10的活性初筛及验证数据示意图。
图12为本发明的多肽类化合物SIP-11的活性初筛及验证数据示意图。
图13为SIP-2在不同浓度下对软骨24h的细胞毒性示意图。
图14为SIP-2在不同浓度下对软骨48h的细胞毒性示意图。
图15为SIP-2在不同浓度下对软骨炎性损伤模型24h的保护作用示意图。
图16为SIP-2在不同浓度下对软骨炎性损伤模型48h的保护作用示意图。
图17为SIP-2对软骨细胞炎性因子Ifnb基因释放调控的数据示意图。
图18为SIP-2对软骨细胞炎性因子Tnf基因释放调控的数据示意图。
图19为SIP-2对软骨细胞炎性因子Il6基因释放调控的数据示意图。
图20为SIP-2治疗小鼠关节炎损伤的给药方案示意图。
图21为SIP-2对DMM模型小鼠关节处软骨硬化的影响示意图。
图22为SIP-2对DMM模型小鼠关节处软骨面积量化示意图。
图23为SIP-2对DMM模型小鼠关节处软骨厚度量化示意图。
图24为SIP-2对DMM模型膝关节处骨赘生成的影响中下肢膝关节CT扫描示意图。
图25为SIP-2对DMM模型膝关节处骨赘生成中骨赘分级评分示意图。
图26为SIP-2对DMM模型膝关节处骨赘生成中骨赘等级量化示意图。
图27为SIP-2对DMM模型膝关节处骨赘生成中骨体积量化示意图。
图28为SIP-2对DMM模型软骨组织HE病理和SO染色评价中番红固绿染色示意图。
图29为SIP-2对DMM模型软骨组织HE病理和SO染色评价中关节面积量化示意图。
图30为SIP-2对DMM模型软骨组织HE病理和SO染色评价中关节损伤量化示意图。
具体实施方式
为了更清楚地说明本发明,下面结合优选实施例对本发明做进一步的说明。本领域技术人员应当理解,下面所具体描述的内容是说明性的而非限制性的,不应以此限制本发明的保护范围。
本发明所使用的多肽及氨基酸和化学基团的表示方法均为本领域公认的表示方法,其中氨基酸的缩写可参照表1中的定义。特殊氨基酸结构可参照表2中的定义,在本发明中,若不特别指出,氨基酸一般指L-型的氨基酸。
表1氨基酸缩写表
表2特殊氨基酸缩写表
本发明合成的化合物的名称、结构式和质谱数据如表3所示:
表3优选多肽类活性分子的名称、结构式和质谱数据
实施例1
直链多肽类抗炎活性化合物的制备方法,固相合成SIP-1具体步骤如下:
第一步,树脂的溶胀
称取Fmoc-Rinkamid-MBHAResin(上海吉尔生化)1g(取代度=0.44mmol/g)置于多肽反应管(自制)中,经10mlDCM溶胀20min,抽滤去除DCM。
第二步,Fmoc保护的脱除
向第一步的反应管中加入6ml20%的哌啶/DMF溶液,振摇10分钟,抽滤去除溶液,使用20mlDCM冲洗树脂。
第三步,氨基酸的连接
将Fmoc-Leu-OH(466mg,1.32mmol)和HCTU(545mg,1.32mmol)置于10ml离心管中,加入6mlDMF溶解,再加入DIPEA(170mg,1.32mmol),振摇5min后将其倒入第二步的多肽反应管中,常温振摇40min。反应结束后,抽滤去除溶液,使用20mlDCM和20mlDMF冲洗树脂。
重复第二步Fmoc保护基的脱除和第三步氨基酸的连接步骤,先加入6ml20%的哌啶/DMF溶液,振摇10分钟,抽滤去除溶液,使用20mlDCM冲洗树脂,接着将Fmoc-Arg(Pbf)-OH(855mg,1.32mmol)和HCTU(545mg,1.32mmol)置于10ml离心管中,加入6mlDMF溶解,再加入DIPEA(170mg,1.32mmol),振摇5min后将其倒入第二步的多肽反应管中,常温振摇40min。反应结束后,抽滤去除溶液,使用20mlDCM和20ml DMF冲洗树脂。依次连接Fmoc-Leu-OH(466mg,1.32mmol)、Fmoc-Tyr(tBu)-OH(605mg,1.32mmol)、Fmoc-Gly-OH(392mg,1.32mmol)、Fmoc-Ile-OH(466mg,1.32mmol)、Fmoc-Tyr(tBu)-OH(605mg,1.32mmol)、Fmoc-Tyr(tBu)-OH(605mg,1.32mmol)、Fmoc-Ser(tBu)-OH(505mg,1.32mmol)、Fmoc-Trp(Boc)-OH(694mg,1.32mmol)、Fmoc-Ala-OH(410mg,1.32mmol)、Fmoc-Leu-OH(466mg,1.32mmol),直至所有氨基酸连接完毕。
第四步,N-末端乙酰化
向上述第三步的多肽反应管中加入5ml吡啶和5ml醋酸酐,常温振摇30min。反应结束后,抽滤去除溶液,使用20mlDCM和20mlDMF冲洗树脂。
第五步,多肽的树脂解离和侧链保护脱除
向上述第四步的多肽反应管中加入10ml切割试剂(TFA/TIPs/水=95:2.5:2.5,体积比),常温振摇2小时。反应结束后,收集滤液。向滤液中加入100ml冰乙醚沉淀粗肽,过滤获得粗肽。
第六步,粗肽的纯化
将第五步获得的0.31g粗肽溶于10毫升乙腈和水混合溶液(1:1,体积比)中,采用反相HPLC纯化。色谱柱:Shim-packPREP-ODS15UM20X250MM(日本岛津);A泵:含有千分之一的三氟乙酸的乙腈;B泵:含有千分之一的三氟乙酸的水;冲洗梯度:20分钟内由90%B泵到0%B泵;检测器:双波长(214nm和254nm)。纯化完毕后,收集到的液体采用冷冻干燥机(美国Labconco)冻干至粉末状,得到0.24g纯度≥97.2%的SIP-1白色冻干粉末。
第七步,多肽的鉴定
纯品多肽采用高分辨质谱(WatersXevoG2-XSQTOF,美国沃特世公司)对分子量进行鉴定。HRMSm/z[M+H]
SIP-1的结构式:LAWSYYIGYLRL。
实施例2
固相合成SIP-2,多肽类化合物SIP-2的制备方法包括以下步骤:
第一步,树脂的溶胀
称取Fmoc-Rinkamid-MBHAResin(上海吉尔生化)1g(取代度=0.44mmol/g)置于多肽反应管(自制)中,经10mlDCM溶胀20min,抽滤去除DCM。
第二步,Fmoc保护的脱除
向第一步的反应管中加入6ml20%的哌啶/DMF溶液,振摇10分钟,抽滤去除溶液,使用20mlDCM冲洗树脂。
第三步,氨基酸的连接
将Fmoc-Leu-OH(466mg,1.32mmol)和HCTU(545mg,1.32mmol)置于10ml离心管中,加入6mlDMF溶解,再加入DIPEA(170mg,1.32mmol),振摇5min后将其倒入第二步的多肽反应管中,常温振摇40min。反应结束后,抽滤去除溶液,使用20mlDCM和20mlDMF冲洗树脂。
重复第二步和第三步的步骤依次连接Fmoc-Arg(Pbf)-OH(855mg,1.32mmol)、Fmoc-Leu-OH(466mg,1.32mmol)、Fmoc-Tyr(tBu)-OH(605mg,1.32mmol)、Fmoc-Gly-OH(392mg,1.32mmol)、Fmoc-S
第四步,N-末端乙酰化
向上述第三步的多肽反应管中加入5ml吡啶和5ml醋酸酐,常温振摇30min。反应结束后,抽滤去除溶液,使用20mlDCM和20mlDMF冲洗树脂。
第五步,侧链烯烃复分解反应
向上述第四步的多肽反应管中加入第一代Grubbs催化剂(120mg,0.15mmol)的1,2-二氯乙烷溶液8mL,常温振摇过夜。反应结束后,抽滤去除溶液,使用20mlDCM和20mlDMF冲洗树脂。
第六步,多肽的树脂解离和侧链保护脱除
向上述第五步的多肽反应管中加入10ml切割试剂(TFA/TIPs/水=95:2.5:2.5,体积比),常温振摇2小时。反应结束后,收集滤液。向滤液中加入100ml冰乙醚沉淀粗肽,过滤获得粗肽。
第七步,粗肽的纯化
将第五步获得的0.46g粗肽溶于10毫升乙腈和水混合溶液(1:1,体积比)中,采用反相HPLC纯化。色谱柱:Shim-packPREP-ODS15UM20X250MM(日本岛津);A泵:含有千分之一的三氟乙酸的乙腈;B泵:含有千分之一的三氟乙酸的水;冲洗梯度:20分钟内由90%B泵到0%B泵;检测器:双波长(214nm和254nm)。纯化完毕后,收集到的液体采用冷冻干燥机(美国Labconco)冻干至粉末状,得到0.22g纯度≥97.2%的SIP-2白色冻干粉末。
第八步,多肽的鉴定
纯品多肽采用高分辨质谱(WatersXevoG2-XSQTOF,美国沃特世公司)对分子量进行鉴定。HRMSm/z:[M+H]
如图1所示,图1为多肽类化合物SIP-2结构式的示意图。SIP-2的结构式:
实施例3
多肽类化合物SIP-3的制备方法包括以下步骤:
第一步,树脂的溶胀
称取Fmoc-Rinkamid-MBHAResin(上海吉尔生化)1g(取代度=0.44mmol/g)置于多肽反应管(自制)中,经10mlDCM溶胀20min,抽滤去除DCM。
第二步,Fmoc保护的脱除
向第一步的反应管中加入6ml20%的哌啶/DMF溶液,振摇10分钟,抽滤去除溶液,使用20mlDCM冲洗树脂。
第三步,氨基酸的连接
将Fmoc-Arg(Pbf)-OH(855mg,1.32mmol)和HCTU(545mg,1.32mmol)置于10ml离心管中,加入6mlDMF溶解,再加入DIPEA(170mg,1.32mmol),振摇5min后将其倒入第二步的多肽反应管中,常温振摇40min。反应结束后,抽滤去除溶液,使用20ml DCM和20mlDMF冲洗树脂。
重复第二步和第三步的步骤依次连接Fmoc-Leu-OH(466mg,1.32mmol)、Fmoc-Leu-OH(466mg,1.32mmol)、Fmoc-Asn(Trt)-OH(466mg,1.32mmol)、Fmoc-Asn(Trt)-OH(786mg,1.32mmol)、Fmoc-Tyr(tBu)-OH(605mg,1.32mmol)、Fmoc-His(Trt)-OH(818mg,1.32mmol)、Fmoc-Gln(Trt)-OH(805mg,1.32mmol)、Fmoc-Arg(Pbf)-OH(855mg,1.32mmol)、Fmoc-Tyr(tBu)-OH(605mg,1.32mmol)、Fmoc-Thr(tBu)-OH(525mg,1.32mmol)、Fmoc-Arg(Pbf)-OH(855mg,1.32mmol)、Fmoc-Ile-OH(466mg,1.32mmol)、Fmoc-Arg(Pbf)-OH(855mg,1.32mmol)、Fmoc-Ala-OH(410mg,1.32mmol)、Fmoc-Gln(Trt)-OH(805mg,1.32mmol)、Fmoc-Leu-OH(466mg,1.32mmol)、Fmoc-Glu(tBu)-OH(563mg,1.32mmol)、Fmoc-Pro-OH(445mg,1.32mmol)、Fmoc-Leu-OH(466mg,1.32mmol)、Fmoc-Ile-OH(466mg,1.32mmol)、Fmoc-Leu-OH(466mg,1.32mmol)、Fmoc-Arg(Pbf)-OH(855mg,1.32mmol)、Fmoc-Leu-OH(466mg,1.32mmol)、Fmoc-Tyr(tBu)-OH(605mg,1.32mmol),直至所有氨基酸连接完毕。
第四步,N-末端乙酰化
向上述第三步的多肽反应管中加入5ml吡啶和5ml醋酸酐,常温振摇30min。反应结束后,抽滤去除溶液,使用20mlDCM和20mlDMF冲洗树脂。
第五步,多肽的树脂解离和侧链保护脱除
向上述第四步的多肽反应管中加入10ml切割试剂(TFA/TIPs/水=95:2.5:2.5,体积比),常温振摇2小时。反应结束后,收集滤液。向滤液中加入100ml冰乙醚沉淀粗肽,过滤获得粗肽。
第六步,粗肽的纯化
将第五步获得的0.38g粗肽溶于10毫升乙腈和水混合溶液(1:1,体积比)中,采用反相HPLC纯化。色谱柱:Shim-packPREP-ODS15UM20X250MM(日本岛津);A泵:含有千分之一的三氟乙酸的乙腈;B泵:含有千分之一的三氟乙酸的水;冲洗梯度:20分钟内由90%B泵到0%B泵;检测器:双波长(214nm和254nm)。纯化完毕后,收集到的液体采用冷冻干燥机(美国Labconco)冻干至粉末状。得到0.24g纯度≥97.2%的SIP-3白色冻干粉末。
第七步,多肽的鉴定
纯品多肽采用高分辨质谱(WatersXevoG2-XSQTOF,美国沃特世公司)对分子量进行鉴定。HRMSm/z:[M+2H]
SIP-3的结构式:YLRLILPELQARIRTYNQHYNNLLR。
实施例4
多肽类化合物SIP-4的制备方法包括以下步骤:
第一步,树脂的溶胀
称取Fmoc-Rinkamid-MBHAResin(上海吉尔生化)1g(取代度=0.44mmol/g)置于多肽反应管(自制)中,经10mlDCM溶胀20min,抽滤去除DCM。
第二步,Fmoc保护的脱除
向第一步的反应管中加入6ml20%的哌啶/DMF溶液,振摇10分钟,抽滤去除溶液,使用20mlDCM冲洗树脂。
第三步,氨基酸的连接
将Fmoc-Arg(Pbf)-OH(855mg,1.32mmol)和HCTU(545mg,1.32mmol)置于10ml离心管中,加入6mlDMF溶解,再加入DIPEA(170mg,1.32mmol),振摇5min后将其倒入第二步的多肽反应管中,常温振摇40min。反应结束后,抽滤去除溶液,使用20ml DCM和20mlDMF冲洗树脂。
重复第二步和第三步的步骤依次连接Fmoc-Leu-OH(466mg,1.32mmol)、Fmoc-Leu-OH(466mg,1.32mmol)、Fmoc-Asn(Trt)-OH(596mg,1.32mmol)、Fmoc-Asn(Trt)-OH(596mg,1.32mmol)、Fmoc-Tyr(tBu)-OH(605mg,1.32mmol)、Fmoc-His(Trt)-OH(818mg,1.32mmol)、Fmoc-Gln(Trt)-OH(805mg,1.32mmol)、Fmoc-Arg(Pbf)-OH(855mg,1.32mmol)、Fmoc-Tyr(tBu)-OH(605mg,1.32mmol)、Fmoc-Thr(tBu)-OH(525mg,1.32mmol)、Fmoc-Arg(Pbf)-OH(855mg,1.32mmol)、Fmoc-Ile-OH(466mg,1.32mmol)、Fmoc-Arg(Pbf)-OH(855mg,1.32mmol)、Fmoc-Ala-OH(410mg,1.32mmol)、Fmoc-Gln(Trt)-OH(805mg,1.32mmol)、Fmoc-Leu-OH(466mg,1.32mmol)、Fmoc-Glu(tBu)-OH(563mg,1.32mmol)、Fmoc-Pro-OH(445mg,1.32mmol)、Fmoc-Leu-OH(466mg,1.32mmol)、Fmoc-Ile-OH(466mg,1.32mmol)、Fmoc-Leu-OH(466mg,1.32mmol)、Fmoc-Arg(Pbf)-OH(855mg,1.32mmol)、Fmoc-Leu-OH(466mg,1.32mmol)、Fmoc-Tyr(tBu)-OH(605mg,1.32mmol)、Fmoc-Gly-OH(392mg,1.32mmol)、Fmoc-Ile-OH(466mg,1.32mmol),直至所有氨基酸连接完毕。
第四步,N-末端乙酰化
向上述第三步的多肽反应管中加入5ml吡啶和5ml醋酸酐,常温振摇30min。反应结束后,抽滤去除溶液,使用20mlDCM和20mlDMF冲洗树脂。
第五步,多肽的树脂解离和侧链保护脱除
向上述第四步的多肽反应管中加入10ml切割试剂(TFA/TIPs/水=95:2.5:2.5,体积比),常温振摇2小时。反应结束后,收集滤液。向滤液中加入100ml冰乙醚沉淀粗肽,过滤获得粗肽。
第六步,粗肽的纯化
将第五步获得的0.68g粗肽溶于10毫升乙腈和水混合溶液(1:1,体积比)中,采用反相HPLC纯化。色谱柱:Shim-packPREP-ODS15UM20X250MM(日本岛津);A泵:含有千分之一的三氟乙酸的乙腈;B泵:含有千分之一的三氟乙酸的水;冲洗梯度:20分钟内由90%B泵到0%B泵;检测器:双波长(214nm和254nm)。纯化完毕后,收集到的液体采用冷冻干燥机(美国Labconco)冻干至粉末状。得到0.36g纯度≥97.2%的SIP-4白色冻干粉末。
第七步,多肽的鉴定
纯品多肽采用高分辨质谱(WatersXevoG2-XSQTOF,美国沃特世公司)对分子量进行鉴定。HRMSm/z:[M+H]
SIP-4的结构式:IGYLRLILPELQARIRTYNQHYNNLLR。
实施例5
多肽类化合物SIP-5的制备方法包括以下步骤:
第一步,树脂的溶胀
称取Fmoc-Rinkamid-MBHAResin(上海吉尔生化)1g(取代度=0.44mmol/g)置于多肽反应管(自制)中,经10mlDCM溶胀20min,抽滤去除DCM。
第二步,Fmoc保护的脱除
向第一步的反应管中加入6ml20%的哌啶/DMF溶液,振摇10分钟,抽滤去除溶液,使用20mlDCM冲洗树脂。
第三步,氨基酸的连接
将Fmoc-Gly-OH(392mg,1.32mmol)和HCTU(545mg,1.32mmol)置于10ml离心管中,加入6mlDMF溶解,再加入DIPEA(170mg,1.32mmol),振摇5min后将其倒入第二步的多肽反应管中,常温振摇40min。反应结束后,抽滤去除溶液,使用20mlDCM和20mlDMF冲洗树脂。
重复第二步和第三步的步骤依次连接Fmoc-Ile-OH(466mg,1.32mmol)、Fmoc-Tyr(tBu)-OH(605mg,1.32mmol)、Fmoc-Tyr(tBu)-OH(605mg,1.32mmol)、Fmoc-Ser(tBu)-OH(505mg,1.32mmol)、Fmoc-Trp(Boc)-OH(694mg,1.32mmol)、Fmoc-Ala-OH(410mg,1.32mmol)、Fmoc-Leu-OH(466mg,1.32mmol)、Fmoc-Gly-OH(392mg,1.32mmol)、Fmoc-Ala-OH(410mg,1.32mmol)、Fmoc-Val-OH(447mg,1.32mmol)、Fmoc-Asn(Trt)-OH(466mg,1.32mmol)、Fmoc-Phe-OH(387mg,1.32mmol)、Fmoc-Asn(Trt)-OH(466mg,1.32mmol),直至所有氨基酸连接完毕。
第四步,N-末端乙酰化
向上述第三步的多肽反应管中加入5ml吡啶和5ml醋酸酐,常温振摇30min。反应结束后,抽滤去除溶液,使用20mlDCM和20mlDMF冲洗树脂。
第五步,多肽的树脂解离和侧链保护脱除
向上述第四步的多肽反应管中加入10ml切割试剂(TFA/TIPs/水=95:2.5:2.5,体积比),常温振摇2小时。反应结束后,收集滤液。向滤液中加入100ml冰乙醚沉淀粗肽,过滤获得粗肽。
第六步,粗肽的纯化
将第五步获得的0.53g粗肽溶于10毫升乙腈和水混合溶液(1:1,体积比)中,采用反相HPLC纯化。色谱柱:Shim-packPREP-ODS15UM20X250MM(日本岛津);A泵:含有千分之一的三氟乙酸的乙腈;B泵:含有千分之一的三氟乙酸的水;冲洗梯度:20分钟内由90%B泵到0%B泵;检测器:双波长(214nm和254nm)。纯化完毕后,收集到的液体采用冷冻干燥机(美国Labconco)冻干至粉末状。得到0.31g纯度≥97.2%的SIP-5白色冻干粉末。
第七步,多肽的鉴定
纯品多肽采用高分辨质谱(WatersXevoG2-XSQTOF,美国沃特世公司)对分子量进行鉴定。HRMSm/z:[M+H]
SIP-5的结构式:NFNVAHGLAWSYYIG。
实施例6
多肽类化合物SIP-6的制备方法包括以下步骤:
第一步,树脂的溶胀
称取Fmoc-Rinkamid-MBHAResin(上海吉尔生化)1g(取代度=0.44mmol/g)置于多肽反应管(自制)中,经10mlDCM溶胀20min,抽滤去除DCM。
第二步,Fmoc保护的脱除
向第一步的反应管中加入6ml20%的哌啶/DMF溶液,振摇10分钟,抽滤去除溶液,使用20mlDCM冲洗树脂。
第三步,氨基酸的连接
将Fmoc-Leu-OH(466mg,1.32mmol)和HCTU(545mg,1.32mmol)置于10ml离心管中,加入6mlDMF溶解,再加入DIPEA(170mg,1.32mmol),振摇5min后将其倒入第二步的多肽反应管中,常温振摇40min。反应结束后,抽滤去除溶液,使用20mlDCM和20mlDMF冲洗树脂。
重复第二步和第三步的步骤依次连接Fmoc-Ile-OH(466mg,1.32mmol)、Fmoc-Leu-OH(466mg,1.32mmol)、Fmoc-Arg(Pbf)-OH(855mg,1.32mmol)、Fmoc-Leu-OH(466mg,1.32mmol)、Fmoc-Tyr(tBu)-OH(605mg,1.32mmol)、Fmoc-Gly-OH(392mg,1.32mmol)、Fmoc-Ile-OH(466mg,1.32mmol)、Fmoc-Tyr(tBu)-OH(605mg,1.32mmol)、Fmoc-Tyr(tBu)-OH(605mg,1.32mmol)、Fmoc-Ser(tBu)-OH(505mg,1.32mmol)、Fmoc-Tyr(tBu)-OH(694mg,1.32mmol)、Fmoc-Ala-OH(410mg,1.32mmol)、Fmoc-Leu-OH(466mg,1.32mmol)、Fmoc-Gly-OH(392mg,1.32mmol)、Fmoc-His(Trt)-OH(818mg,1.32mmol)、Fmoc-Ala-OH(410mg,1.32mmol)、Fmoc-Val-OH(447mg,1.32mmol)、Fmoc-Asn(Trt)-OH(786mg,1.32mmol)、Fmoc-Phe-OH(387mg,1.32mmol)、Fmoc-Asn(Trt)-OH(786mg,1.32mmol),直至所有氨基酸连接完毕。
第四步,N-末端乙酰化
向上述第三步的多肽反应管中加入5ml吡啶和5ml醋酸酐,常温振摇30min。反应结束后,抽滤去除溶液,使用20mlDCM和20mlDMF冲洗树脂。
第五步,多肽的树脂解离和侧链保护脱除
向上述第四步的多肽反应管中加入10ml切割试剂(TFA/TIPs/水=95:2.5:2.5,体积比),常温振摇2小时。反应结束后,收集滤液。向滤液中加入100ml冰乙醚沉淀粗肽,过滤获得粗肽。
第六步,粗肽的纯化
将第五步获得的0.76g粗肽溶于10毫升乙腈和水混合溶液(1:1,体积比)中,采用反相HPLC纯化。色谱柱:Shim-packPREP-ODS15UM20X250MM(日本岛津);A泵:含有千分之一的三氟乙酸的乙腈;B泵:含有千分之一的三氟乙酸的水;冲洗梯度:20分钟内由90%B泵到0%B泵;检测器:双波长(214nm和254nm)。纯化完毕后,收集到的液体采用冷冻干燥机(美国Labconco)冻干至粉末状。得到0.47g纯度≥97.2%的SIP-6白色冻干粉末。
第七步,多肽的鉴定
纯品多肽采用高分辨质谱(WatersXevoG2-XSQTOF,美国沃特世公司)对分子量进行鉴定。HRMSm/z:[M+2H]
SIP-6的结构式:NFNVAHGLAWSYYIGYLRLIL。
实施例7
多肽类化合物SIP-7的制备方法包括以下步骤:
第一步,树脂的溶胀
称取Fmoc-Rinkamid-MBHAResin(上海吉尔生化)1g(取代度=0.44mmol/g)置于多肽反应管(自制)中,经10mlDCM溶胀20min,抽滤去除DCM。
第二步,Fmoc保护的脱除
向第一步的反应管中加入6ml20%的哌啶/DMF溶液,振摇10分钟,抽滤去除溶液,使用20mlDCM冲洗树脂。
第三步,氨基酸的连接
将Fmoc-Gln(Trt)-OH(805mg,1.32mmol)和HCTU(545mg,1.32mmol)置于10ml离心管中,加入6mlDMF溶解,再加入DIPEA(170mg,1.32mmol),振摇5min后将其倒入第二步的多肽反应管中,常温振摇40min。反应结束后,抽滤去除溶液,使用20ml DCM和20mlDMF冲洗树脂。
重复第二步和第三步的步骤依次连接Fmoc-Leu-OH(466mg,1.32mmol)、Fmoc-Glu(tBu)-OH(563mg,1.32mmol)、Fmoc-Pro-OH(445mg,1.32mmol)、Fmoc-Leu-OH(466mg,1.32mmol)、Fmoc-Ile-OH(466mg,1.32mmol)、Fmoc-Leu-OH(466mg,1.32mmol)、Fmoc-Arg(Pbf)-OH(855mg,1.32mmol)、Fmoc-Leu-OH(466mg,1.32mmol)、Fmoc-Tyr(tBu)-OH(605mg,1.32mmol)、Fmoc-Gly-OH(392mg,1.32mmol)、Fmoc-Ile-OH(466mg,1.32mmol)、Fmoc-Tyr(tBu)-OH(605mg,1.32mmol)、Fmoc-Tyr(tBu)-OH(605mg,1.32mmol)、Fmoc-Ser(tBu)-OH(505mg,1.32mmol)、Fmoc-Trp(Boc)-OH(694mg,1.32mmol)、Fmoc-Ala-OH(410mg,1.32mmol)、Fmoc-Leu-OH(466mg,1.32mmol)、Fmoc-Gly-OH(392mg,1.32mmol)、Fmoc-His(Trt)-OH(818mg,1.32mmol)、Fmoc-Ala-OH(410mg,1.32mmol)、Fmoc-Val-OH(447mg,1.32mmol)、Fmoc-Asn(Trt)-OH(786mg,1.32mmol)、Fmoc-Phe-OH(387mg,1.32mmol)、Fmoc-Asn(Trt)-OH(786mg,1.32mmol),直至所有氨基酸连接完毕。
第四步,N-末端乙酰化
向上述第三步的多肽反应管中加入5ml吡啶和5ml醋酸酐,常温振摇30min。反应结束后,抽滤去除溶液,使用20mlDCM和20mlDMF冲洗树脂。
第五步,多肽的树脂解离和侧链保护脱除
向上述第四步的多肽反应管中加入10ml切割试剂(TFA/TIPs/水=95:2.5:2.5,体积比),常温振摇2小时。反应结束后,收集滤液。向滤液中加入100ml冰乙醚沉淀粗肽,过滤获得粗肽。
第六步,粗肽的纯化
将第五步获得的0.66g粗肽溶于10毫升乙腈和水混合溶液(1:1,体积比)中,采用反相HPLC纯化。色谱柱:Shim-packPREP-ODS15UM20X250MM(日本岛津);A泵:含有千分之一的三氟乙酸的乙腈;B泵:含有千分之一的三氟乙酸的水;冲洗梯度:20分钟内由90%B泵到0%B泵;检测器:双波长(214nm和254nm)。纯化完毕后,收集到的液体采用冷冻干燥机(美国Labconco)冻干至粉末状。得到0.42g纯度≥97.2%的SIP-7白色冻干粉末。
第七步,多肽的鉴定
纯品多肽采用高分辨质谱(WatersXevoG2-XSQTOF,美国沃特世公司)对分子量进行鉴定。HRMSm/z:[M+2H]
实施例8
多肽类化合物SIP-8的制备方法包括以下步骤:
第一步,树脂的溶胀
称取Fmoc-Rinkamid-MBHAResin(上海吉尔生化)1g(取代度=0.44mmol/g)置于多肽反应管(自制)中,经10mlDCM溶胀20min,抽滤去除DCM。
第二步,Fmoc保护的脱除
向第一步的反应管中加入6ml20%的哌啶/DMF溶液,振摇10分钟,抽滤去除溶液,使用20mlDCM冲洗树脂。
第三步,氨基酸的连接
将Fmoc-Asn(Trt)-OH(800mg,1.32mmol)和HCTU(545mg,1.32mmol)置于10ml离心管中,加入6mlDMF溶解,再加入DIPEA(170mg,1.32mmol),振摇5min后将其倒入第二步的多肽反应管中,常温振摇40min。反应结束后,抽滤去除溶液,使用20ml DCM和20mlDMF冲洗树脂。
重复第二步和第三步的步骤依次连接Fmoc-Tyr(tBu)-OH(605mg,1.32mmol)、Fmoc-Thr(tBu)-OH(525mg,1.32mmol)、Fmoc-Arg(Pbf)-OH(855mg,1.32mmol)、Fmoc-Ile-OH(466mg,1.32mmol)、Fmoc-Arg(Pbf)-OH(855mg,1.32mmol)、Fmoc-Ala-OH(410mg,1.32mmol)、Fmoc-Gln(Trt)-OH(805mg,1.32mmol)、Fmoc-Leu-OH(466mg,1.32mmol)、Fmoc-Glu(tBu)-OH(563mg,1.32mmol)、Fmoc-Pro-OH(445mg,1.32mmol)、Fmoc-Leu-OH(466mg,1.32mmol)、Fmoc-Ile-OH(466mg,1.32mmol)、Fmoc-Leu-OH(466mg,1.32mmol)、Fmoc-Arg(Pbf)-OH(855mg,1.32mmol)、Fmoc-Leu-OH(466mg,1.32mmol)、Fmoc-Tyr(tBu)-OH(605mg,1.32mmol)、Fmoc-Gly-OH(392mg,1.32mmol)、Fmoc-Ile-OH(466mg,1.32mmol)、Fmoc-Tyr(tBu)-OH(605mg,1.32mmol)、Fmoc-Tyr(tBu)-OH(605mg,1.32mmol)、Fmoc-Ser(tBu)-OH(505mg,1.32mmol)、Fmoc-Trp(Boc)-OH(694mg,1.32mmol)、Fmoc-Ala-OH(410mg,1.32mmol)、Fmoc-Leu-OH(466mg,1.32mmol)、Fmoc-Gly-OH(392mg,1.32mmol)、Fmoc-His(Trt)-OH(818mg,1.32mmol)、Fmoc-Ala-OH(410mg,1.32mmol)、Fmoc-Val-OH(447mg,1.32mmol)、Fmoc-Asn(Trt)-OH(786mg,1.32mmol)、Fmoc-Phe-OH(387mg,1.32mmol)、Fmoc-Asn(Trt)-OH(786mg,1.32mmol),直至所有氨基酸连接完毕。
第四步,N-末端乙酰化
向上述第三步的多肽反应管中加入5ml吡啶和5ml醋酸酐,常温振摇30min。反应结束后,抽滤去除溶液,使用20mlDCM和20mlDMF冲洗树脂。
第五步,多肽的树脂解离和侧链保护脱除
向上述第四步的多肽反应管中加入10ml切割试剂(TFA/TIPs/水=95:2.5:2.5,体积比),常温振摇2小时。反应结束后,收集滤液。向滤液中加入100ml冰乙醚沉淀粗肽,过滤获得粗肽。
第六步,粗肽的纯化
将第五步获得的0.81g粗肽溶于10毫升乙腈和水混合溶液(1:1,体积比)中,采用反相HPLC纯化。色谱柱:Shim-packPREP-ODS15UM20X250MM(日本岛津);A泵:含有千分之一的三氟乙酸的乙腈;B泵:含有千分之一的三氟乙酸的水;冲洗梯度:20分钟内由90%B泵到0%B泵;检测器:双波长(214nm和254nm)。纯化完毕后,收集到的液体采用冷冻干燥机(美国Labconco)冻干至粉末状。得到0.66g纯度≥97.2%的SIP-8白色冻干粉末。
第七步,多肽的鉴定
纯品多肽采用高分辨质谱(WatersXevoG2-XSQTOF,美国沃特世公司)对分子量进行鉴定。HRMSm/z:[M+2H]
实施例9
多肽类化合物SIP-9的制备方法包括以下步骤:
第一步,树脂的溶胀
称取Fmoc-Rinkamid-MBHAResin(上海吉尔生化)1g(取代度=0.44mmol/g)置于多肽反应管(自制)中,经10mlDCM溶胀20min,抽滤去除DCM。
第二步,Fmoc保护的脱除
向第一步的反应管中加入6ml20%的哌啶/DMF溶液,振摇10分钟,抽滤去除溶液,使用20mlDCM冲洗树脂。
第三步,氨基酸的连接
将Fmoc-Leu-OH(466mg,1.32mmol)和HCTU(545mg,1.32mmol)置于10ml离心管中,加入6mlDMF溶解,再加入DIPEA(170mg,1.32mmol),振摇5min后将其倒入第二步的多肽反应管中,常温振摇40min。反应结束后,抽滤去除溶液,使用20mlDCM和20mlDMF冲洗树脂。
重复第二步和第三步的步骤依次连接Fmoc-Asn(Trt)-OH(786mg,1.32mmol)、Fmoc-Asn(Trt)-OH(786mg,1.32mmol)、Fmoc-Tyr(tBu)-OH(605mg,1.32mmol)、Fmoc-His(Trt)-OH(818mg,1.32mmol)、Fmoc-Gln(Trt)-OH(805mg,1.32mmol)、Fmoc-Asn(Trt)-OH(786mg,1.32mmol)、Fmoc-Tyr(tBu)-OH(605mg,1.32mmol)、Fmoc-Thr(tBu)-OH(525mg,1.32mmol)、Fmoc-Arg(Pbf)-OH(855mg,1.32mmol)、Fmoc-Ile-OH(466mg,1.32mmol)、Fmoc-Arg(Pbf)-OH(855mg,1.32mmol)、Fmoc-Ala-OH(410mg,1.32mmol)、Fmoc-Gln(Trt)-OH(805mg,1.32mmol)、Fmoc-Leu-OH(466mg,1.32mmol)、Fmoc-Glu(tBu)-OH(563mg,1.32mmol)、Fmoc-Pro-OH(445mg,1.32mmol)、Fmoc-Leu-OH(466mg,1.32mmol)、Fmoc-Ile-OH(466mg,1.32mmol)、Fmoc-Leu-OH(466mg,1.32mmol)、Fmoc-Arg(Pbf)-OH(855mg,1.32mmol)、Fmoc-Leu-OH(466mg,1.32mmol)、Fmoc-Tyr(tBu)-OH(605mg,1.32mmol)、Fmoc-Gly-OH(392mg,1.32mmol)、Fmoc-Ile-OH(466mg,1.32mmol)、Fmoc-Tyr(tBu)-OH(605mg,1.32mmol)、Fmoc-Tyr(tBu)-OH(605mg,1.32mmol)、Fmoc-Ser(tBu)-OH(505mg,1.32mmol)、Fmoc-Trp(Boc)-OH(694mg,1.32mmol)、Fmoc-Ala-OH(410mg,1.32mmol)、Fmoc-Leu-OH(466mg,1.32mmol)、Fmoc-Gly-OH(392mg,1.32mmol)、Fmoc-His(Trt)-OH(818mg,1.32mmol)、Fmoc-Ala-OH(410mg,1.32mmol)、Fmoc-Val-OH(447mg,1.32mmol)、Fmoc-Asn(Trt)-OH(786mg,1.32mmol)、Fmoc-Phe-OH(387mg,1.32mmol)、Fmoc-Asn(Trt)-OH(786mg,1.32mmol),直至所有氨基酸连接完毕。
第四步,N-末端乙酰化
向上述第三步的多肽反应管中加入5ml吡啶和5ml醋酸酐,常温振摇30min。反应结束后,抽滤去除溶液,使用20mlDCM和20mlDMF冲洗树脂。
第五步,多肽的树脂解离和侧链保护脱除
向上述第四步的多肽反应管中加入10ml切割试剂(TFA/TIPs/水=95:2.5:2.5,体积比),常温振摇2小时。反应结束后,收集滤液。向滤液中加入100ml冰乙醚沉淀粗肽,过滤获得粗肽。
第六步,粗肽的纯化
将第五步获得的0.86g粗肽溶于10毫升乙腈和水混合溶液(1:1,体积比)中,采用反相HPLC纯化。色谱柱:Shim-packPREP-ODS15UM20X250MM(日本岛津);A泵:含有千分之一的三氟乙酸的乙腈;B泵:含有千分之一的三氟乙酸的水;冲洗梯度:20分钟内由90%B泵到0%B泵;检测器:双波长(214nm和254nm)。纯化完毕后,收集到的液体采用冷冻干燥机(美国Labconco)冻干至粉末状。得到0.65g纯度≥97.2%的SIP-9白色冻干粉末。
第七步,多肽的鉴定
纯品多肽采用高分辨质谱(WatersXevoG2-XSQTOF,美国沃特世公司)对分子量进行鉴定。HRMSm/z:[M+3H]
实施例10
多肽类化合物SIP-10的制备方法包括以下步骤:
第一步,树脂的溶胀
称取Fmoc-Rinkamid-MBHAResin(上海吉尔生化)1g(取代度=0.44mmol/g)置于多肽反应管(自制)中,经10mlDCM溶胀20min,抽滤去除DCM。
第二步,Fmoc保护的脱除
向第一步的反应管中加入6ml20%的哌啶/DMF溶液,振摇10分钟,抽滤去除溶液,使用20mlDCM冲洗树脂。
第三步,氨基酸的连接
将Fmoc-Leu-OH(466mg,1.32mmol)和HCTU(545mg,1.32mmol)置于10ml离心管中,加入6mlDMF溶解,再加入DIPEA(170mg,1.32mmol),振摇5min后将其倒入第二步的多肽反应管中,常温振摇40min。反应结束后,抽滤去除溶液,使用20mlDCM和20mlDMF冲洗树脂。
重复第二步和第三步的步骤依次连接Fmoc-Leu-OH(466mg,1.32mmol)、Fmoc-Asn(Trt)-OH(786mg,1.32mmol)、Fmoc-Asn(Trt)-OH(786mg,1.32mmol)、Fmoc-Tyr(tBu)-OH(605mg,1.32mmol)、Fmoc-His(Trt)-OH(818mg,1.32mmol)、Fmoc-Gln(Trt)-OH(805mg,1.32mmol)、Fmoc-Asn(Trt)-OH(786mg,1.32mmol)、Fmoc-Tyr(tBu)-OH(605mg,1.32mmol)、Fmoc-Thr(tBu)-OH(525mg,1.32mmol)、Fmoc-Arg(Pbf)-OH(855mg,1.32mmol)、Fmoc-Ile-OH(466mg,1.32mmol)、Fmoc-Arg(Pbf)-OH(855mg,1.32mmol)、Fmoc-Ala-OH(410mg,1.32mmol)、Fmoc-Gln(Trt)-OH(805mg,1.32mmol)、Fmoc-Leu-OH(466mg,1.32mmol)、Fmoc-Glu(tBu)-OH(563mg,1.32mmol)、Fmoc-Pro-OH(445mg,1.32mmol)、Fmoc-Leu-OH(466mg,1.32mmol)、Fmoc-Ile-OH(466mg,1.32mmol)、Fmoc-Leu-OH(466mg,1.32mmol)、Fmoc-Arg(Pbf)-OH(855mg,1.32mmol)、Fmoc-Leu-OH(466mg,1.32mmol)、Fmoc-Tyr(tBu)-OH(605mg,1.32mmol)、Fmoc-Gly-OH(392mg,1.32mmol)、Fmoc-Ile-OH(466mg,1.32mmol)、Fmoc-Tyr(tBu)-OH(605mg,1.32mmol)、Fmoc-Tyr(tBu)-OH(605mg,1.32mmol)、Fmoc-Ser(tBu)-OH(505mg,1.32mmol)、Fmoc-Trp(Boc)-OH(694mg,1.32mmol)、Fmoc-Ala-OH(410mg,1.32mmol)、Fmoc-Leu-OH(466mg,1.32mmol)、Fmoc-Gly-OH(392mg,1.32mmol)、Fmoc-His(Trt)-OH(818mg,1.32mmol)、Fmoc-Ala-OH(410mg,1.32mmol)、Fmoc-Val-OH(447mg,1.32mmol)、Fmoc-Asn(Trt)-OH(786mg,1.32mmol)、Fmoc-Phe-OH(387mg,1.32mmol)、Fmoc-Asn(Trt)-OH(786mg,1.32mmol),直至所有氨基酸连接完毕。
第四步,N-末端乙酰化
向上述第三步的多肽反应管中加入5ml吡啶和5ml醋酸酐,常温振摇30min。反应结束后,抽滤去除溶液,使用20mlDCM和20mlDMF冲洗树脂。
第五步,多肽的树脂解离和侧链保护脱除
向上述第四步的多肽反应管中加入10ml切割试剂(TFA/TIPs/水=95:2.5:2.5,体积比),常温振摇2小时。反应结束后,收集滤液。向滤液中加入100ml冰乙醚沉淀粗肽,过滤获得粗肽。
第六步,粗肽的纯化
将第五步获得的0.78g粗肽溶于10毫升乙腈和水混合溶液(1:1,体积比)中,采用反相HPLC纯化。色谱柱:Shim-packPREP-ODS15UM20X250MM(日本岛津);A泵:含有千分之一的三氟乙酸的乙腈;B泵:含有千分之一的三氟乙酸的水;冲洗梯度:20分钟内由90%B泵到0%B泵;检测器:双波长(214nm和254nm)。纯化完毕后,收集到的液体采用冷冻干燥机(美国Labconco)冻干至粉末状。得到0.55g纯度≥97.2%的SIP-10白色冻干粉末。
第七步,多肽的鉴定
纯品多肽采用高分辨质谱(WatersXevoG2-XSQTOF,美国沃特世公司)对分子量进行鉴定。HRMSm/z:[M+3H]
实施例11
多肽类化合物SIP-11的制备方法包括以下步骤:
第一步,树脂的溶胀
称取Fmoc-Rinkamid-MBHAResin(上海吉尔生化)1g(取代度=0.44mmol/g)置于多肽反应管(自制)中,经10mlDCM溶胀20min,抽滤去除DCM。
第二步,Fmoc保护的脱除
向第一步的反应管中加入6ml20%的哌啶/DMF溶液,振摇10分钟,抽滤去除溶液,使用20mlDCM冲洗树脂。
第三步,氨基酸的连接
将Fmoc-Arg(Pbf)-OH(855mg,1.32mmol)和HCTU(545mg,1.32mmol)置于10ml离心管中,加入6mlDMF溶解,再加入DIPEA(170mg,1.32mmol),振摇5min后将其倒入第二步的多肽反应管中,常温振摇40min。反应结束后,抽滤去除溶液,使用20ml DCM和20mlDMF冲洗树脂。
重复第二步和第三步的步骤依次连接Fmoc-Leu-OH(466mg,1.32mmol)、Fmoc-Leu-OH(466mg,1.32mmol)、Fmoc-Asn(Trt)-OH(786mg,1.32mmol)、Fmoc-Asn(Trt)-OH(786mg,1.32mmol)、Fmoc-Tyr(tBu)-OH(605mg,1.32mmol)、Fmoc-His(Trt)-OH(818mg,1.32mmol)、Fmoc-Gln(Trt)-OH(805mg,1.32mmol)、Fmoc-Asn(Trt)-OH(786mg,1.32mmol)、Fmoc-Tyr(tBu)-OH(605mg,1.32mmol)、Fmoc-Thr(tBu)-OH(525mg,1.32mmol)、Fmoc-Arg(Pbf)-OH(855mg,1.32mmol)、Fmoc-Ile-OH(466mg,1.32mmol)、Fmoc-Arg(Pbf)-OH(855mg,1.32mmol)、Fmoc-Ala-OH(410mg,1.32mmol)、Fmoc-Gln(Trt)-OH(805mg,1.32mmol)、Fmoc-Leu-OH(466mg,1.32mmol)、Fmoc-Glu(tBu)-OH(563mg,1.32mmol)、Fmoc-Pro-OH(445mg,1.32mmol)、Fmoc-Leu-OH(466mg,1.32mmol)、Fmoc-Ile-OH(466mg,1.32mmol)、Fmoc-Leu-OH(466mg,1.32mmol)、Fmoc-Arg(Pbf)-OH(855mg,1.32mmol)、Fmoc-Leu-OH(466mg,1.32mmol)、Fmoc-Tyr(tBu)-OH(605mg,1.32mmol)、Fmoc-Gly-OH(392mg,1.32mmol)、Fmoc-Ile-OH(466mg,1.32mmol)、Fmoc-Tyr(tBu)-OH(605mg,1.32mmol)、Fmoc-Tyr(tBu)-OH(605mg,1.32mmol)、Fmoc-Ser(tBu)-OH(505mg,1.32mmol)、Fmoc-Trp(Boc)-OH(694mg,1.32mmol)、Fmoc-Ala-OH(410mg,1.32mmol)、Fmoc-Leu-OH(466mg,1.32mmol)、Fmoc-Gly-OH(392mg,1.32mmol)、Fmoc-His(Trt)-OH(818mg,1.32mmol)、Fmoc-Ala-OH(410mg,1.32mmol)、Fmoc-Val-OH(447mg,1.32mmol)、Fmoc-Asn(Trt)-OH(786mg,1.32mmol)、Fmoc-Phe-OH(387mg,1.32mmol)、Fmoc-Asn(Trt)-OH(786mg,1.32mmol),直至所有氨基酸连接完毕。
第四步,N-末端乙酰化
向上述第三步的多肽反应管中加入5ml吡啶和5ml醋酸酐,常温振摇30min。反应结束后,抽滤去除溶液,使用20mlDCM和20mlDMF冲洗树脂。
第五步,多肽的树脂解离和侧链保护脱除
向上述第四步的多肽反应管中加入10ml切割试剂(TFA/TIPs/水=95:2.5:2.5,体积比),常温振摇2小时。反应结束后,收集滤液。向滤液中加入100ml冰乙醚沉淀粗肽,过滤获得粗肽。
第六步,粗肽的纯化
将第五步获得的0.80g粗肽溶于10毫升乙腈和水混合溶液(1:1,体积比)中,采用反相HPLC纯化。色谱柱:Shim-packPREP-ODS15UM20X250MM(日本岛津);A泵:含有千分之一的三氟乙酸的乙腈;B泵:含有千分之一的三氟乙酸的水;冲洗梯度:20分钟内由90%B泵到0%B泵;检测器:双波长(214nm和254nm)。纯化完毕后,收集到的液体采用冷冻干燥机(美国Labconco)冻干至粉末状。得到0.66g纯度≥97.2%的SIP-11白色冻干粉末。
第七步,多肽的鉴定
纯品多肽采用高分辨质谱(WatersXevoG2-XSQTOF,美国沃特世公司)对分子量进行鉴定。HRMSm/z:[M+3H]
SIP-11的结构式:NFNVAHGLAWSYYIGYLRLILPELQARIRTYNQHYNNLLR。
实施例12
实时定量PCR技术检测SIP-1~SIP11对IFN-β的抑制活性,具体步骤如下:
使用RAW264.7(小鼠单核巨噬细胞白血病细胞),待细胞长至80~90%融合度,去除上清,PBS洗两遍,使用含0.25%EDTA的胰蛋白酶消化细胞,待细胞脱壁,加入等量完全培养基终止,转移至15mL离心管收集细胞,弃去上清,加入1~2mL培养基重悬细胞,细胞计数,并按照8000个/孔的密度接种于48孔板中。初筛时候,分别使用含有相同浓度(10μM)多肽的新鲜培养基培养6小时,而后使用2’3’-cGAMP(5μg/mL)刺激细胞4h,使用TRIzol试剂盒提取RNA,定量后反转录成cDNA,使用实时定量PCR技术在mRNA水平上检测IfnbmRNA的变化。优选化合物药效验证时,使用含有不同浓度的药物(0、1、2.5、5、7.5、10、20、40、80μM)的新鲜培养基培养6h,而后使用2’3’-cGAMP(5μg/mL)刺激细胞4h,提取RNA,使用荧光定量PCR技术检测IfnbmRNA的表达量,并通过GraphpadPrism9.0软件拟合出IC
实验结果:如图2~12所示,图2为本发明的多肽类化合物SIP-1的活性初筛及验证数据示意图。图3为本发明的多肽类化合物SIP-2的活性初筛及验证数据示意图。图4为本发明的多肽类化合物SIP-3的活性初筛及验证数据示意图。图5为本发明的多肽类化合物SIP-4的活性初筛及验证数据示意图。图6为本发明的多肽类化合物SIP-5的活性初筛及验证数据示意图。图7为本发明的多肽类化合物SIP-6的活性初筛及验证数据示意图。图8为本发明的多肽类化合物SIP-7的活性初筛及验证数据示意图。图9为本发明的多肽类化合物SIP-8的活性初筛及验证数据示意图。图10为本发明的多肽类化合物SIP-9的活性初筛及验证数据示意图。图11为本发明的多肽类化合物SIP-10的活性初筛及验证数据示意图。图12为本发明的多肽类化合物SIP-11的活性初筛及验证数据示意图。各多肽化合物抑制IfnbmRNAIC
实施例13
CCK-8法测定SIP-2对软骨细胞毒性研究,具体步骤如下:
提取原代软骨细胞,待细胞至80~90%融合度时传代,先去除培养基,PBS洗两遍,使用含0.25%EDTA的胰蛋白酶消化细胞,待细胞脱壁,加入等量完全培养基终止反应,转移至15ml离心管中收集细胞,弃去上清,加入1~2ml培养基制得细胞悬液,细胞计数,并将获得的软骨细胞按照每孔5000个的密度接种于96孔板,贴壁过夜后,使用含不同浓度药物(6.25、12.5、25、50、100、200μM)的完全培养基分别培养24h和48h,加入CCK-8工作液,在37℃培养箱中避光孵育1~1.5h,使用酶标仪测定450nm处OD值。
实验结果:结果如图13和图14所示,图13为SIP-2在不同浓度下对软骨24h的细胞毒性示意图。图14为SIP-2在不同浓度下对软骨48h的细胞毒性示意图。图中表明SIP-2工作浓度在50μM以下对于原代软骨细胞具有良好的安全性。
实施例14
CCK-8法测定SIP-2对软骨细胞炎性损伤模型的保护作用研究,具体步骤如下:
将软骨细胞接种于96孔板中,每孔密度为5000个/孔;培养24小时后,使用IL-1β(10ng/ml)诱导炎性损伤模型,同时与不同浓度药物(10、50μM)共同培养24h和48h,加入CCK-8工作液,在37℃培养箱中避光孵育1~1.5h,使用酶标仪测定450nm处OD值。
结果如图15和16所示,图15为SIP-2在不同浓度下对软骨炎性损伤模型24h的保护作用示意图。图16为SIP-2在不同浓度下对软骨炎性损伤模型48h的保护作用示意图。图中说明,与IL-1β诱导损伤模型相比,SIP-2药物治疗组细胞活力显著升高,表明SIP-2可以有效改善软骨炎性损伤。
实施例15
实时定量PCR技术检测SIP-2对软骨细胞Ifnβ、Tnf和Il6mRNA变化的研究,具体步骤如下:
将软骨细胞接种于48孔板中,每孔密度为8000个/孔,在孵育箱中培养过夜后,加入不同浓度SIP-2(10、50μM)预处理细胞6h,使用IL-1β(10ng/ml)诱导炎性损伤模型,提取RNA,通过荧光定量PCR技术检测Ifnb、Tnf和Il6基因的变化。
实验结果:结果如图17~19所示,图17为SIP-2对软骨细胞炎性因子Ifnb基因释放调控的数据示意图。图18为SIP-2对软骨细胞炎性因子Tnf基因释放调控的数据示意图。图19为SIP-2对软骨细胞炎性因子Il6基因释放调控的数据示意图。图中说明,使用IL-1β刺激后Ifnb、Tnf和Il6三种因子显著升高,而SIP-2处理组明显降低了上述炎性细胞因子转录水平,且具有较好的量效关系,SIP-2可以改善IL-1β(10ng/ml)诱导炎性损伤模型。
实施例16
SIP-2对小鼠内侧半月板失稳术诱导的关节炎模型的治疗作用研究,具体步骤如下:
受试动物:C57BL/6小鼠,共36只,8-9周,雄性,购自常州凯文斯公司。
实验药物:模型组(Model,n=12)、低浓度(Lowdosage,1mg/kg,n=12)、高浓度(High dosage,10mg/kg,n=12)。
内侧半月板失稳术(DMM)诱导的关节炎模型构建方法如下:使用异氟烷对小鼠进行麻醉,将小鼠仰卧固定在手术操作台上,对左膝关节常规备皮、消毒,用灭菌的手术器械经髌骨内侧依次切开皮肤、皮下组织、轻轻拨开髌韧带,暴露膝关节。切断前内侧半月板韧带和内侧副韧带,游离内侧半月板,造成左膝关节不稳定,缝合切口并用碘伏消毒。
实验小鼠分3组:模型组(Model,n=12)、低浓度(Lowdosage,1mg/kg,n=12)、高浓度(Highdosage,10mg/kg,n=12),给药方案如图20(图20为SIP-2治疗小鼠关节炎损伤的给药方案示意图。)所示,在DMM术后尾静脉给药,每3天一次,治疗6周和12周分别收集关节组织进行组织形态学评价。
实验结果:与DMM模型组相比,SIP-2治疗组(10mg/kg)膝关节间隙变宽,硬化软骨的厚度显著下降,如图21~23所示,图21为SIP-2对DMM模型小鼠关节处软骨硬化的影响示意图。图22为SIP-2对DMM模型小鼠关节处软骨面积量化示意图。图23为SIP-2对DMM模型小鼠关节处软骨厚度量化示意图。图中说明,SIP-2有效改善了DMM模型小鼠关节的软骨硬化进程;三维成像观察SIP-2对关节处骨赘的影响,发现SIP-2治疗显著降低了DMM术后骨赘的面积和体积。
如图24~27所示,图24为SIP-2对DMM模型膝关节处骨赘生成的影响中下肢膝关节CT扫描示意图。图25为SIP-2对DMM模型膝关节处骨赘生成中骨赘分级评分示意图。图26为SIP-2对DMM模型膝关节处骨赘生成中骨赘等级量化示意图。图27为SIP-2对DMM模型膝关节处骨赘生成中骨体积量化示意图。图中说明,SIP-2有效改善了DMM模型小鼠关节骨赘形成;软骨组织形态学观察软骨形态变化,HE染色显示SIP-2治疗与模型组相比软骨表面平滑恢复、肥大软骨细胞减少、潮线下移、股骨远端软骨病变和缺失减少,软骨组织完整,OARSI评分显著增加。
如图28~30所示,图28为SIP-2对DMM模型软骨组织HE病理和SO染色评价中番红固绿染色示意图。图29为SIP-2对DMM模型软骨组织HE病理和SO染色评价中关节面积量化示意图。图30为SIP-2对DMM模型软骨组织HE病理和SO染色评价中关节损伤量化示意图。图中说明,SIP-2高浓度治疗组可有效保护膝关节处软骨的正常形态和组织结构。
以上所述仅是本发明的较佳实施例而已,并非对本发明作任何形式上的限制,虽然本发明已以较佳实施例揭露如上,然而并非用以限定本发明,任何熟悉本专利的技术人员在不脱离本发明技术方案范围内,当可利用上述提示的技术内容作出些许更动或修饰为等同变化的等效实施例,但凡是未脱离本发明技术方案的内容,依据本发明的技术实质对以上实施例所作的任何简单修改、等同变化与修饰,均仍属于本发明方案的范围内。
