一种用于鉴别湖北麦冬的试剂盒和方法
文献发布时间:2023-06-19 19:30:30
技术领域
本发明属于分子生物学领域,具体涉及一种用于鉴别湖北麦冬的试剂盒和方法。
背景技术
麦冬根据产地不同分为浙麦冬和川麦冬,前者主产于浙江的慈溪、余姚、萧山等地,后者主产于四川的绵阳地区;湖北麦冬属于山麦冬中的其中一个品种,主产于湖北。麦冬作为常用大宗药材,在市场上流通量较大,近年来随着浙麦冬栽培面积的减少,川麦冬和湖北麦冬已成为市场上麦冬类药材流通的主要品种。由于川麦冬和湖北麦冬的外观相似度较高,因此以湖北麦冬替代或掺杂麦冬的现象屡见不鲜。
许敏等,麦冬总皂苷含量测定方法的研究[J],临床医药实践,2010,19(5B)中用紫外-可见吸收分光光度法测定麦冬中总皂苷的含量,该方法专属性不强,虽然湖北麦冬价格远低于麦冬,但其皂苷的含量明显高于麦冬,总皂苷的含量方法不能有效地评价麦冬药材及其饮片的质量优劣,这也给如何科学有效鉴别湖北麦冬混用麦冬提出了新的挑战。目前,对包括湖北麦冬在内的山麦冬的分子鉴别研究多为DNA条形码比对分析和系统发育树的亲缘关系研究,未达到准确、易客观判定的鉴别方法要求。
专利CN104073553A公开了一种湖北麦冬的特异性引物,建立了湖北麦冬的普通PCR鉴别方法,并对湖北麦冬及其混伪品进行鉴别,由于该方法中未设计内参照反应,在不能有效地保证样品DNA提取成功的情况下,造成鉴别结果可能会出现假阴性的问题。当湖北麦冬样品基因组DNA未提取成功时,PCR反应自然不会出现DNA条带,此时该方法的鉴别结果为阴性,即样品不是湖北麦冬,造成鉴别结果的假阴性。
发明内容
本发明的目的在于提供一种用于鉴别湖北麦冬的引物对,它是SEQ ID NO.1、SEQID NO.2所示的引物对。
本发明还提供了SEQ ID NO.1、SEQ ID NO.2所示的引物对在制备鉴别湖北麦冬的试剂中的用途。
进一步地,所述试剂是PCR-RFLP检测试验用试剂。
本发明还提供了一种用于鉴别湖北麦冬的试剂盒,它是PCR-RFLP检测试验用试剂,包括SEQ ID NO.1、SEQ ID NO.2所示的引物对。
进一步地,它还包括Taq DNA聚合酶、Mg
更进一步地,它还包括特异性内切酶。
更进一步地,所述特异性内切酶为Nae I限制性内切酶。
本发明还提供了一种前述试剂盒在用于鉴别湖北麦冬中的用途。
本发明最后提供了一种鉴别湖北麦冬的方法,它包括如下步骤:
(1)提取样本DNA:取待检样品,提取其中的DNA;
(2)基因扩增:用权利要求5~7任意一项所述的试剂盒对待检样本中的DNA进行扩增,并对扩增产物酶切;
(3)结果检测:检测步骤2)所得扩增产物以及酶切产物的片段大小。
进一步地,所述待检样品为麦冬或湖北麦冬;所述检测的扩增产物在300-400bp之间有1条DNA条带,且酶切产物在100bp-300b之间有2条DNA条带片段,待检样品为湖北麦冬。
本发明通过对湖北麦冬和麦冬的ITS序列进行比对分析,在ITS 2序列发现了湖北麦冬特有的限制性内切酶位点Nae I,通过在酶切位点上、下游序列合适位置设计湖北麦冬与麦冬的鉴别引物,并进行聚合酶链式反应-限制性片段长度多态性(PCR-RFLP)方法考察和验证。结果表明鉴别引物对湖北麦冬和麦冬均能扩增出377bp的单一条带,经Nae I酶切后,湖北麦冬被切为231bp和146bp两条条带,麦冬仍为377bp的单一条带,以此实现湖北麦冬的分子鉴别,结果准确,有广泛的应用前景。
显然,根据本发明的上述内容,按照本领域的普通技术知识和惯用手段,在不脱离本发明上述基本技术思想前提下,还可以做出其它多种形式的修改、替换或变更。
以下通过实施例形式的具体实施方式,对本发明的上述内容再作进一步的详细说明。但不应将此理解为本发明上述主题的范围仅限于以下的实例。凡基于本发明上述内容所实现的技术均属于本发明的范围。
附图说明
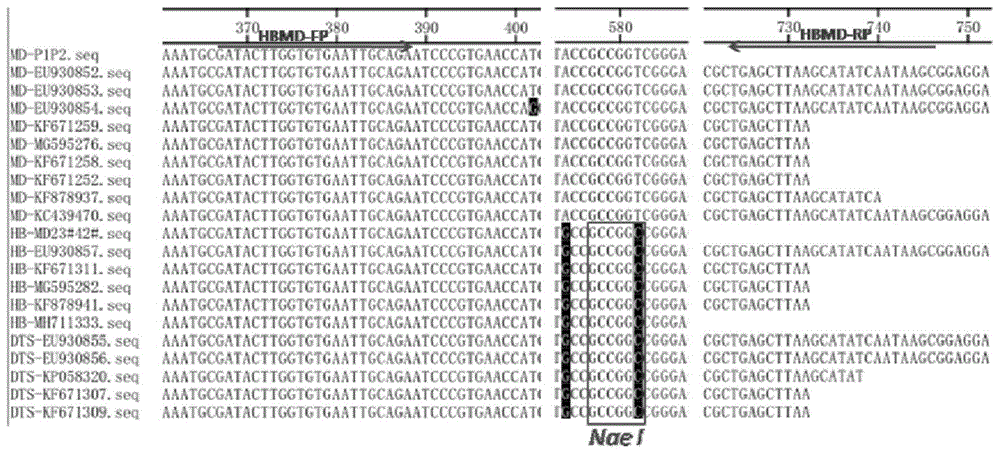
图1.山麦冬、麦冬ITS序列比对及酶切位点(MD:麦冬;HB:湖北麦冬;黑色区域表示序列不一致碱基;红色箭头表示引物设计位点)
图2湖北麦冬ITS 2区HBMD-FP/RP扩增序列(绿色碱基:HBMD-FP/RP引物序列;红色碱基:Nae I酶切位点)
图3山麦冬、麦冬ITS 2区NaeI酶切位点示意图
图4不同退火温度的PCR反应结果(1,3,5,7,9泳道:湖北麦冬;2,4,6,8,10泳道:麦冬;M:DNA分子量标记;B:空白对照)
图5不同循环数和PCR仪的PCR反应结果(1,3泳道:AB Verriti;2,4泳道:Bio-RadC1000;M:DNA分子量标记;B:空白对照)
图6湖北麦冬不同时间点的酶切效果(1,5泳道:15min;2,6泳道:30min;3,7泳道:60min;4,8泳道:90min;M:DNA分子量标记;B:空白对照)
图7不同批次样品的PCR-RFLP结果①(1-12泳道:湖北麦冬1-12#;13-24泳道:川麦冬1-12#)
图8不同批次样品的PCR-RFLP结果②(1-23泳道:川麦冬13-35#;24泳道:湖北麦冬1#)
图9不同批次样品的PCR-RFLP结果③(1-12泳道:浙麦冬1-12#;B:空白对照)
具体实施方式
实施例1本发明用于鉴别湖北麦冬的试剂盒和检测方法
一、本发明试剂盒成分
包含SEQ ID NO.1、SEQ ID NO.2所示的引物对;如表1所示:
表1本发明引物
注:F为5’端引物,R为3’端引物。
经过筛选,只有采用本发明引物才能有效扩增,采用别的引物无法有效扩增。
二、采用本发明试剂盒鉴别湖北麦冬
1、DNA提取
取湖北麦冬样品,用75%乙醇擦拭去除表面杂物,晾干后,切成约1mm薄片。称取20mg,至2mL离心管中,用植物基因组DNA提取试剂盒进行DNA提取,最终制成50μL洗脱液,作为模板DNA溶液,置4℃冰箱中保存备用。
2、PCR-RFLP反应
以湖北麦冬基因组DNA为模板,在PCR反应缓冲液(2×)(缓冲液中包含Taq DNA聚合酶、Mg
PCR反应体系:在200μL离心管中进行,反应总体积为25μL,反应体系包括PCR反应缓冲液(2×)12.5μL,上、下游引物(10μmol/L)各0.5μL,DNA模板1μL,灭菌的去离子水(ddH
取PCR反应液,置200μL离心管中,进行酶切反应,反应总体积为25μL,包含10×酶切缓冲液2.5μL,PCR反应液10μL,Nae I限制性内切酶(10U/μL)0.5μL,灭菌的去离子水(ddH2O)13μL,酶切反应在37℃水浴反应1小时。另取灭菌的去离子水,同法上述PCR-RFLP反应操作,作为空白对照。
3、电泳检测
分别取PCR反应液5μL和酶切反应液8μL,使用胶浓度为1.5%的琼脂糖凝胶进行电泳,电压约5V/cm,时间30-40分钟;电泳结束后,取凝胶片在凝胶成像仪或紫外透射仪上检视。
4、质量控制
样品的PCR反应产物在300-400bp之间应有1条DNA条带,空白对照无DNA条带。否则,实验视为无效。
5、判定原则
在100bp-300bp的范围内,湖北麦冬应有2条DNA条带,空白对照无条带。
以下通过试验例具体说明本发明的有益效果:
试验例1湖北麦冬鉴别研究
1.样品收集及基原确定
1.1样品信息
共收集样品59批。其中麦冬样品47批,包含川麦冬35批,浙麦冬12批;湖北麦冬样品12批(表1)。主要通过两种方式收集样品:1)委托本地药检机构或药企从产地收集,2)通过产地药检机构委托产地药企收集。
1.2样品基原的确定
对收集的47批麦冬和12批湖北麦冬进行外观性状鉴定和ITS测序比对,确定了样品的基原(表1),为下面的研究工作奠定了样品基础。
1.2.1外观性状鉴别
本研究所收集的麦冬、湖北麦冬样品均由成都市药品检验研究院鉴定;浙麦冬由浙江省食品药品检验研究院鉴定;
1.2.2样品ITS测序比对
对收集的样品进行ITS通用引物扩增并测序,对测序结果进行整理和拼接后,在GenBank中进行BLAST,结果显示所有川麦冬和浙麦冬的ITS序列比对结果为麦冬(Ophiopogonjaponicus),序列匹配一致性在97%以上,而湖北麦冬的ITS序列比对结果显示为湖北麦冬(Liriope spicata)。
表1.样品信息表
2.相关ITS序列检索
从GenBank数据库中检索麦冬、湖北麦冬的ITS序列,并结合已有的文献资料,整理了ITS序列中存在不同SNP位点的相关序列(表2),用于序列比对和鉴别引物位点的设计。
3.仪器与试剂
普通PCR仪(Verriti,ABI公司),普通PCR仪(C1000,Bio-Rad公司),电泳仪(PowerPac Basic,Bio-Rad公司),凝胶成像系统(Gel Doc XR
新型植物基因组DNA提取试剂盒(DP320,天根生化科技(北京)有限公司),2×TransTaq HiFi PCR SuperMix(P20412,北京全式金生物技术有限公司),NaeI限制性内切酶(R0190A,NEB公司),核酸染料(Gelview,北京百泰克生物技术有限公司),其它试剂均为国产分析纯,水为灭菌的去离子水(ddH
4.湖北麦冬PCR-RFLP方法的建立
4.1麦冬类ITS序列比对及酶切位点确定
将收集的47批麦冬和12批湖北麦分别进行ITS通用引物测序(测序用引物:上游ITS-P1:5'-GGAAGTAAAAGTCGTAACAAGG-3',下游ITS-P2:5'-TCCTCCGCTTATTGATATGC-3')。并进行序列拼接,然后与表2中的下载序列用MegAlign软件进行比对。发现在ITS 2区域中(图1),所有湖北麦冬碱基序列中同时具有Nae I(GCCGGC)的酶切位点,而麦冬无此酶切位点,因此初步选定NaeI作为鉴别湖北麦冬和麦冬的特征性酶切位点。
4.2 PCR鉴别引物设计及酶切结果分析
鉴别引物HBMD-FP/RP为麦冬和湖北麦冬序列比对完全一致的区域设计的引物对,即麦冬和湖北麦冬均能扩增出条带,PCR反应扩增全长为377bp,其中NaeI酶切位点位于湖北麦冬序列的210-215bp处(图2)。湖北麦冬扩增产物被Nae I酶切为约213bp和164bp两条条带;而麦冬的扩增产物无此酶切位点,无法被酶切,仍为377bp的单一条带(图3)。
4.3方法稳定性考察
影响本方法重现性的因素包括PCR反应的稳定性、酶切反应的稳定性等因素。前者包括PCR反应体系的确立和PCR反应条件(退火温度、反应循环数等)的确立;后者包括酶切反应的温度和时间。因此,分别对以上影响因素进行实验考察。
4.3.1 PCR扩增稳定性的考察
本方法进行PCR反应所采用的引物为在麦冬和湖北麦冬序列比对完全一致的区域设计的鉴别引物,即不同麦冬和湖北麦冬均能扩增出条带。因此,本方法所采用的PCR扩增条件为一般通用性条件:反应总体系25μL,包含PCR反应缓冲液(2×)12.5μL,上、下游引物(10μmol/L)各0.5μL,DNA模板1μL,灭菌的去离子水(ddH
依据鉴别引物HBMD-FP/RP的Tm值,进行不同退火温度(52℃、56℃、58℃、60℃、60℃)的考察,结果如图4所示。湖北麦冬和麦冬在不同退火温度下都能得到约377bp的单一扩增条带,空白对照无任何条带扩增。但在60℃时目的扩增条带较弱,为了确保酶切反应中PCR产物的量,选择鉴别引物HBMD-FP/RP的退火温度为52-58℃。
对不同反应循环数和PCR仪进行考察,结果如图5所示。反应循环数在35和40时都有较强的单一扩增条带,故将反应循环数设定为35-40个循环。不同品牌的PCR仪在35和40循环均能扩增出明显的单一扩增条带,且无明显的非特异性扩增。
4.3.2酶切温度和时间的选择
依据限制性内切酶的使用说明,Nae I的酶切反应最佳温度为37℃。酶切反应时间分别设置15min,30min,60min和90min,结果发现在15min时,酶切效果已达到完全作用(图6),为确保内切酶的充分作用,建议选择30-60min作为酶切反应时间。
4.4方法适用性考察
对收集到的59批麦冬和湖北麦冬样品,分别进行PCR-RFLP实验,结果如图7~9所示。鉴别引物的PCR反应对麦冬和湖北麦冬均有约377bp的单一扩增条带,空白对照无任何扩增,表明结果未出现假阴性,且扩增产物丰度较好,PCR产物可以满足酶切反应所需的量;Nae I限制性内切酶反应对所有湖北麦冬PCR产物均切成了213bp和164bp两条带条,而对川麦冬和浙麦冬的PCR产物均无任何酶切,结果仍为377bp的单一条带。因此,可通过PCR-RFLP反应,检视结果在100-300bp之间有无两条DNA条带,进行湖北麦冬和麦冬的鉴别。
5总结和讨论
本发明所建立的湖北麦冬PCR-RFLP鉴别方法,通过比对麦冬和湖北麦冬的ITS序列,在ITS 2区域中的碱基差异区发现了湖北麦冬的特征性酶切位点(Nae I)。通过在该酶切位点两端合适位置设计鉴别引物,可对所有麦冬、湖北麦冬样品都扩增出377bp的DNA条带,并经Nae I酶切后,湖北麦冬样品的PCR产物可被酶切为213bp和164bp两条DNA条带,而麦冬样品仍为377bp的单一条带,以实现湖北麦冬和麦冬的有效鉴别。
对于该鉴别方法,最为关键的是限制性内切酶位点的保守性和特异性。通过对GenBank数据中提交的相关ITS 2序列(麦冬101条,湖北麦冬36条)考察,发现Nae I酶切位点仅存在于湖北麦冬的ITS2序列中,麦冬的ITS 2序列不存在该酶切位点,表明Nae I酶切位点在ITS 2区域中的具有较好的序列保守性;通过对收集的35批川麦冬、12批浙麦冬和12批湖北麦冬进行方法的适用性考察,该方法可实现湖北麦冬和麦冬的准确鉴别,也表明该方法在实际应用中具有较好的特异性。
综上所述,本发明建立的湖北麦冬PCR-RFLP鉴别方法,实验操作简单,具有较好的稳定性和适用性,鉴别结果准确、客观易判读,适合作为中药材湖北麦冬的分子鉴别方法,可作为补充检验方法在实际检验中发挥作用。
