一种酮还原酶及其应用
文献发布时间:2023-06-19 19:30:30
技术领域
本发明涉及生物化工领域,尤其涉及了一种酮还原酶,以及其在体外生物合成(R)-6-羟基-8-氯辛酸乙酯中的应用。
背景技术
(R)-6-羟基-8-氯辛酸乙酯是(R)-α-硫辛酸的一个手性中间体。硫辛酸(lipoicacid,LA,通常指α-硫辛酸)是不溶于水的白色或淡黄色晶体,广泛分布于动植物等生物组织中。α-硫辛酸是一种安全有效的强效抗氧化剂,被誉为“万能抗氧化剂”。硫辛酸具有缓解肌体过度疲劳,延缓衰老,预防记忆力衰退等功效。硫辛酸有两种对映异构体,其中(R)-α-硫辛酸比(S)-α-硫辛酸有效得多,(R)-α-硫辛酸属于维生素B类药物,在多酶复合体中作为辅酶起作用,并且在三羧酸循环和光合成中表现出关键性作用。临床上,(R)-α-硫辛酸越来越多地用于治疗神经性糖尿病,缺血再灌注等疾病;另外,(R)-α-硫辛酸对多种疾病也具有疗效,并能有效抑制HIV-1在细胞中的扩散。
随着硫辛酸越来越多的应用于医药、食品和保健品中,全球硫辛酸的年需求量持续增长,目前以大约10%的速度增长,但其产量远赶不上需求量,巨大的供应缺口使得硫辛酸在国内外市场上具有重要的市场地位。
目前硫辛酸主要通过化学合成生产,根据原料的不同分为两种:己二酸法和环己酮法。但它们都步骤繁琐,工艺复杂,且均采用化工原料,并在合成过程中大量使用有毒催化剂,产品的安全性受到严重的质疑,同时对环境造成严重的污染。另外,化学合成的硫辛酸是等量(R)-α-硫辛酸和(S)-α-硫辛酸构成的混合体,需进一步拆分,才能得到有生物活性的(R)-α-硫辛酸,而混旋硫辛酸与(R)-α-硫辛酸的价格相差巨大。
发明内容
发明目的:针对现有技术的不足,本发明所要解决的第一个技术问题是提供一种酮还原酶。
本发明还要解决的技术问题是提供上述酮还原酶在体外生物合成(R)-6-羟基-8-氯辛酸乙酯中应用及具体的制备方法。
技术方案:为了解决上述技术变基因的核苷酸问题,本发明提供了一种酮还原酶,所述酮还原酶的氨基酸序列选自SEQ ID NO.1、SEQ ID NO.2、SEQ ID NO.3、SEQ ID NO.4或SEQ ID NO.5。
氨基酸序列为SEQ ID NO.1的酮还原酶命名为SCR-1,氨基酸序列为SEQ ID NO.2的酮还原酶命名为SCR-2,氨基酸序列为SEQ ID NO.3的酮还原酶命名为SCR-3,氨基酸序列为SEQ ID NO.4的酮还原酶命名为SCR-4,氨基酸序列为SEQ ID NO.5的酮还原酶命名为SCR-5。
本发明还提供了编码上述的酮还原酶的基因或核酸。
进一步地,上述的酮还原酶的基因或核酸,所述酮还原酶的基因或核酸的核苷酸序列选自SEQ ID NO.6、SEQ ID NO.7、SEQ ID NO.8、SEQ ID NO.9、SEQ ID NO.10。
本发明还提供了上述的酮还原酶在体外生物合成(R)-6-羟基-8-氯辛酸乙酯中的应用。
本发明还提供了一种(R)-6-羟基-8-氯辛酸乙酯体外生物合成方法,所述方法包括以下步骤:
(1)上述的酮还原酶的基因的获得;
(2)构建含有上述酮还原酶的基因的重组载体,并将重组载体转入大肠杆菌内,培养得到重组大肠杆菌菌液;
(3)将重组大肠杆菌菌液裂解,得到粗酶液;
(4)将8-氯-6-氧代辛酸乙酯、磷酸盐缓冲溶液、粗酶液、辅酶因子混合,反应结束即得(R)-6-羟基-8-氯辛酸乙酯。
进一步地,步骤(2)中所述大肠杆菌菌液裂解条件为在20000-35000g/min离心30-60min。
进一步地,步骤(3)还包括粗酶液的纯化处理。
进一步地,粗酶液的纯化处理包括:将粗酶液流经Ni柱后用不同梯度的咪唑溶液进行洗脱,再使所得含酶量最高的Ni柱洗脱液流经Q柱,随后再用不同梯度的盐溶液(主要成分为NaCl)进行洗脱,得到初步纯化的含酶溶液,将初步纯化的含酶溶液进行透析,得纯化酶溶液。
进一步地,步骤(3)还包括将纯化处理后的酶溶液制为固定化酶。
进一步地,制作固定化酶的过程中固定化载体可选择但不限于氨基树脂和环氧树脂;反应体系的pH值为4-9反应时间为1-6h。
进一步地,步骤(4)中所述辅酶因子为NADH或NADPH。优选为NADPH,所述辅酶因子与8-氯-6-氧代辛酸乙酯的质量比为0.5-5:1,所述粗酶液与8-氯-6-氧代辛酸乙酯的质量比为0.002-0.01:1。
进一步地,步骤(4)中所述反应条件为25-45℃,优选为30℃;反应时间为2-12h,所述反应体系pH值为5-9,优选为6.5-7.5。
进一步地,步骤(4)后还包括提纯步骤:向(R)-6-羟基-8-氯辛酸乙酯溶液中加入有机溶剂乙酸乙酯、二甲苯或正庚烷进行萃取,干燥有机相,通过浓缩和重结晶得到白色晶体产物。
上述生物催化反应的反应式为:
有益效果:与现有技术相比,本发明具有如下突出的显著优点:本发明公开了一种酮还原酶,其作为生物催化剂,将8-氯-6-氧代辛酸乙酯转化为(R)-6-羟基-8-氯辛酸乙酯,有极佳的手性选择性,将相应手性带入合成路线,极大降低了生产成本,消除了副产物处理过程中产生的环境影响,且操作简单,条件温和,耗时较短,转化率和产物纯度均在87%以上,适合产业化应用。
附图说明
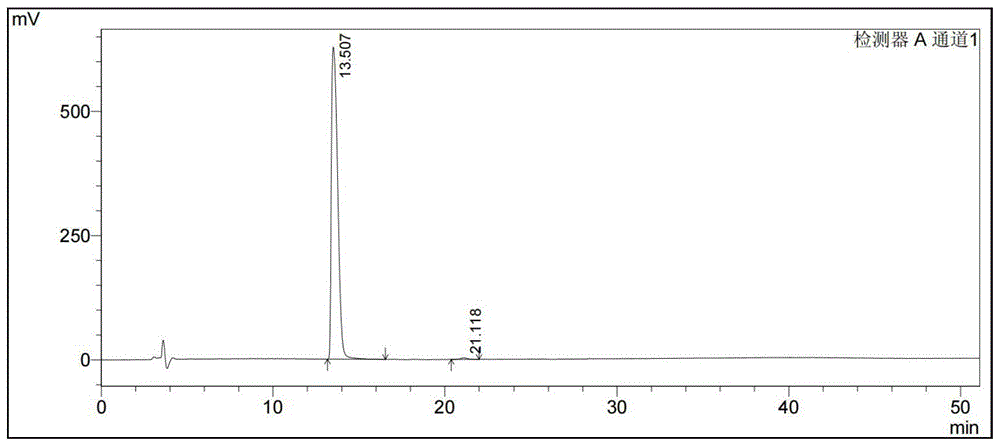
图1为8-氯-6-氧代辛酸乙酯的高效液相色谱图。
图2为(R)-6-羟基-8-氯辛酸乙酯的高效液相色谱图。
图3为本发明的生物催化合成方法制备(R)-6-羟基-8-氯辛酸乙酯过程中的高效液相色谱图。
具体实施方式
下面结合附图对本发明的技术方案作进一步说明。
下述实施例中所用载体pET28a、大肠杆菌DE3感受态细胞等生物材料均购自市场。PBS缓冲液制备方法:称取40g NaCl、1g KCl、7.2g Na
实施例1
S1载体构建与克隆:将核苷酸序列如SEQ ID NO.6所示基因用无缝克隆方式与载体pET28a连接获得重组载体pET28a-SCR-1,对重组载体采取如下操作:取10μl重组载体加入冰浴的100μl大肠杆菌E.coli BL21(DE3)感受态细胞,随后冰浴30min,42℃热激60s,再冰浴5min,向管中加入37℃无抗LB培养液300μl,37℃、200rpm摇床修复1h,随后涂在卡那抗性的固体LB平板上37℃培育,长出菌落后用高压灭菌的牙签挑取单菌落,先在含卡那抗性的LB平板上画线保种用,将相应的菌和板子上的画线区做上对应的记号;
S2验证:然后将加入T7通用引物的20μl PCR Mix体系搅拌均匀,进行PCR扩增,PCR反应条件为:95℃、15min,94℃变性15s,55℃退火15s,72℃延伸1min,进行30个循环,最后72℃,保温5min,PCR扩增后进行电泳观察结果得阳性克隆,即为含目标酶基因的重组大肠杆菌菌株:pET28a-SCR-1重组大肠杆菌;
S3酶的表达和提取:将pET28a-SCR-1重组大肠杆菌挑取到含卡那抗性的LB培养基中,于37℃下培养OD至1.0左右后加入终浓度0.2mM的IPTG,置于28℃诱导表达16h,然后将菌液以7000g/min离心6min收集菌体,倒掉上清培养基后,按菌体重量:PBS溶液=1g:5ml的比例用100mM PBS溶液将菌体重悬,将重悬后的菌体经高压细胞破碎仪破碎得含酶裂解液,35000g/min离心30min后提取上清液,得到目标酶的粗酶溶液。
S4纯化:使含酶的上清液流经Ni柱,随后用不同梯度的咪唑溶液进行洗脱,再使所得含酶量最高的Ni柱洗脱液流经Q柱,随后再用不同梯度的盐溶液(主要成分为NaCL)进行洗脱,得到初步纯化的含酶溶液,将初步纯化的含酶溶液进行12h透析,最终得到目标酶的纯化的酶溶液;
S5反应:在25mL玻璃反应瓶中,加入2g 8-氯-6-氧代辛酸乙酯底物、7.1g NADPH、5ml 50mM PBS缓冲液,再向反应瓶中加入5ml酮还原酶溶液(13.2mg/ml)开始反应;反应液温度为30℃,控制反应液pH为7.0,搅拌均匀后反应9h。
上述反应完成后,将反应后的溶液调至碱性(pH>11)后用等体积乙酸乙酯萃取两次并合并有机相,过0.22μm的滤膜后可取10μl溶液用高效液相色谱检测计算其转化率>92%,ee值>99%;随后用无水硫酸镁干燥有机相,旋转蒸发浓缩,降温重结晶后可得产物1.72g,纯度达99.7%。
实施例2
采用实施例1的S3步骤制备得到的粗酶溶液作为反应原料,进行如下反应。
在25mL玻璃反应瓶中,加入2g 8-氯-6-氧代辛酸乙酯底物、7.1g NADPH、5ml 50mMPBS缓冲液,再向反应瓶中加入5ml酮还原酶粗酶溶液开始反应;反应液温度为30℃,控制反应液pH为7.0,搅拌均匀后反应9h。
上述反应完成后,将反应后的溶液调至碱性(pH>11)后用等体积乙酸乙酯萃取两次并合并有机相,过0.22μm的滤膜后可取10μl溶液用高效液相色谱检测计算其转化率>89%,ee值>99%。随后用无水硫酸镁干燥有机相,旋转蒸发浓缩,降温重结晶后可得产物1.66g,纯度达99.5%。
实施例3
采用实施例1的S3步骤制备得到的粗酶溶液作为反应原料,进行如下反应。
在25mL玻璃反应瓶中,加入2g 8-氯-6-氧代辛酸乙酯底物、6.4g NADH,5ml 50mMPBS缓冲液,再向反应瓶中加入5ml酮还原酶粗酶溶液开始反应;反应液温度为30℃,控制反应液pH为7.0,搅拌均匀后反应9h。
上述反应完成后,将反应后的溶液调至碱性(pH>11)后用等体积乙酸乙酯萃取两次并合并有机相,过0.22μm的滤膜后可取10μl溶液用高效液相色谱检测计算其转化率>81%,ee值>99%。随后用无水硫酸镁干燥有机相,旋转蒸发浓缩,降温重结晶后可得产物1.54g,纯度达99.2%。
实施例4
采用实施例1的S3步骤制备得到的粗酶溶液作为反应原料,进行如下反应。
在25mL玻璃反应瓶中,加入2g 8-氯-6-氧代辛酸乙酯底物、7.1g NADPH,2ml50mMPBS缓冲液,再向反应瓶中加入8ml酮还原酶粗酶溶液开始反应;反应液温度为30℃,控制反应液pH为7.0,搅拌均匀后反应9h。
上述反应完成后,将反应后的溶液调至碱性(pH>11)后用等体积乙酸乙酯萃取两次并合并有机相,过0.22μm的滤膜后可取10μl溶液用高效液相色谱检测计算其转化率>93%,ee值>99%;随后用无水硫酸镁干燥有机相,旋转蒸发浓缩,降温重结晶后可得产物1.69g,纯度达99.7%。
实施例5
采用实施例1的S3步骤制备得到的粗酶溶液作为反应原料,进行如下反应。
在25mL玻璃反应瓶中,加入2g底物、7.1g NADPH,2ml 50Mm PBS缓冲液,再向反应瓶中加入8ml酮还原酶粗酶溶液开始反应;反应液温度为30℃,控制反应液pH为7.0,搅拌均匀后反应6h。
上述反应完成后,将反应后的溶液调至碱性(pH>11)后用等体积乙酸乙酯萃取两次并合并有机相,过0.22μm的滤膜后可取10μl溶液用高效液相色谱检测计算其转化率>92%,ee值>99%;随后用无水硫酸镁干燥有机相,旋转蒸发浓缩,降温重结晶后可得产物1.63g,纯度达99.7%。
实施例6
S3步骤中,将菌体重悬所用的PBS缓冲溶液更换为三乙醇胺缓冲液,其余制备方法同实施例1。最终所得反应结果用高效液相色谱检测计算底物转化率>89%,ee值>99%。随后用无水硫酸镁干燥有机相,旋转蒸发浓缩,降温重结晶后可得产物1.61g,纯度达99.3%。
实施例7
S1步骤中,选用的酮还原酶分别为SCR-2、SCR-3、SCR-4、SCR-5,S2、S3同实施例1,S3步骤后接实施例2制备方法,将粗酶溶液作为反应原料。
最终所得反应结果如下:
实施例8
S1-S4步骤同实施例1。
S5酶的固定化:将氨基树脂用50mM PBS缓冲液清洗3次后过滤,用50mM PBS溶液配制2%戊二醛溶液,将氨基树脂与2%戊二醛混合,比例为氨基树脂:2%戊二醛=1:4(质量/体积比),随后在23℃条件下搅拌/振摇1小时,然后过滤获得氨基树脂;用50mM PBS缓冲液清洗3次后过滤,再取约含200mg酮还原酶的S4制的酶溶液与5g氨基树脂混合,混合后在23℃下以80rpm的转速振摇18小时;然后过滤收集氨基树脂(滤液可用于测定酶的固定化率),用50mM PBS缓冲液清洗3次后过滤即获得固定化的酮还原酶。
S6固定化酶的填装:将固定化酶填装至柱式反应器中,即获得含固定化酮还原酶的柱式反应器。
S7反应液的配制:将20g 8-氯-6-氧代辛酸乙酯底物、75g NADPH用100ml 50mMPBS缓冲液,溶解配置成反应液,控制反应液pH为7.0。
S8反应:让反应液流经含固定化酮还原酶的柱式反应器,反应过程控制温度为30℃,控制流经时长(即反应时间)为4小时,然后收集从反应器流出的液体即为含(R)-6-羟基-8-氯辛酸乙酯的溶液。
将收集的溶液10倍稀释后过0.22μm的滤膜,取10μL上清液用高效液相色谱检测检测;经检测计算底物转化率>82%。随后用无水硫酸镁干燥有机相,旋转蒸发浓缩,降温重结晶后可得产物1.55g,纯度达99.5%。
实施例9
将S6步骤中的柱式反应器更换为罐式反应器,即获得含固定化酮还原酶的罐式反应器,以100rpm的转速搅拌反应4小时,其余步骤同实施例8。
将收集的溶液10倍稀释后过0.22μm的滤膜,取10μL上清液用高效液相色谱检测检测;经检测计算底物转化率>87%。随后用无水硫酸镁干燥有机相,旋转蒸发浓缩,降温重结晶后可得产物1.61g,纯度达99.4%。
实施例10
其余步骤同实施例8,S5步骤如下:
S5酶的固定化:将环氧基树脂用50mM PBS缓冲液清洗3次后过滤,再取约含200mg酮还原酶的S4制的酶溶液与7g环氧树脂混合,混合后在23℃下以200rpm的转速振摇18小时后静置20小时;然后过滤收集环氧基树脂(滤液可用于测定酶的固定化率),用50mM PBS缓冲液清洗3次后过滤即获得固定化的酮还原酶。
将收集的溶液10倍稀释后过0.22μm的滤膜,取10μL上清液用高效液相色谱检测检测;经检测计算底物转化率>90%。随后用无水硫酸镁干燥有机相,旋转蒸发浓缩,降温重结晶后可得产物1.71g,纯度达99.5%。
实施例11
将S6步骤中的柱式反应器更换为罐式反应器,即获得含固定化酮还原酶的罐式反应器,以100rpm的转速搅拌反应4小时,其余步骤同实施例10。
将收集的溶液10倍稀释后过0.22μm的滤膜,取10μL上清液用高效液相色谱检测检测;经检测计算底物转化率>94%。随后用无水硫酸镁干燥有机相,旋转蒸发浓缩,降温重结晶后可得产物1.76g,纯度达99.3%。
实施例12
步骤1-5同实施例10,其余步骤如下:
将固定化酶填装至罐式反应器中,即获得含固定化酮还原酶的罐式反应器;配制3L反应液,在配制时加入600g底物,2.3kg NADPH,3L 50mM PBS缓冲液,随后控制反应液pH为7.0;将反应液倒入罐式反应器中,以100rpm的转速搅拌反应4小时,整个反应过程中罐式反应器的温度都维持在30℃;收集从反应器流出的液体即为含(R)-6-羟基-8-氯辛酸乙酯的溶液,每100ml的反应液作为一个批次进行上述反应并进行收集,全部收集完成后进行检测。
将收集的溶液10倍稀释后过0.22μm的滤膜,取10μL上清液用高效液相色谱进行检测;检测到1-3批次的底物转化率皆>85%,4-15批次的底物转化率皆>80%,15-30批次的底物转化率皆>65%。收集所有批次的反应液,随后用无水硫酸镁干燥有机相,旋转蒸发浓缩,降温重结晶后可得产物435.9g,纯度达98.2%。
实施例13
S1步骤中,选用的酮还原酶分别为SEQ ID NO.2、SEQ ID NO.3、SEQ ID NO.4、SEQID NO.5,其余步骤同实施例11,最终反应结果如下:
以上所述仅为本发明的较佳实施例,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 酮还原酶及其在合成(1S)-2-氯-1-(3,4-二氟苯基)乙醇中的应用
- 酮还原酶及其在不对称合成R-3,5-双(三氟甲基)苯乙醇中的应用
- 产醛酮还原酶菌株、醛酮还原酶基因、载体、工程菌及应用
- 一种应用查尔酮还原酶合成二氢查尔酮的方法
