肿瘤特异性酶响应的光动力治疗纳米材料及其制备与应用
文献发布时间:2023-06-19 19:32:07
技术领域
本发明涉及一种肿瘤特异性酶响应的光动力治疗纳米材料及其制备与应用。
背景技术
近年来,金属有机框架(MOF),一类新兴的由有机离子桥接的金属离子或簇构成的杂化多孔材料,引起了越来越多的关注。MOF的优越性能,例如定义明确的孔径,可调整的组成和结构,可调整的尺寸,光热特性,光动力特性,高载药量和良好的生物相容性由于MOFs的纳米级合成简便,以及通过包含和表面化学的替代功能化,因此在MOFs的纳米医学应用领域取得了令人瞩目的成就,其中在光动力治疗方面由于其粒径和功能方面的优越性有着广泛的应用。光动力治疗(PDT)是涉及光和光敏化学物质的光疗法的一种形式,与分子氧结合使用可引起细胞死亡(光毒性)。PDT具有杀死微生物细胞的能力,包括细菌,真菌和病毒。光动力疗法已被证明是治疗局部实体肿瘤的一种非侵入性治疗方式。它可以在激光照射下产生活性氧(ROS)诱导高氧化应激,从而消融肿瘤细胞。
但是,光动力治疗在全身给药的情况下很难降低纳米粒子对正常细胞的毒性,导致光动力治疗对机体本身有较大副作用,所以开发肿瘤特异性刺激响应型的光动力治疗对于精准靶向治疗具有重要的意义。
发明内容
本发明所要解决的技术问题是如何开发肿瘤细胞特异性刺激响应型的光动力治疗方法和材料。本发明的目的是提供一种可控的光动力治疗纳米材料,来实现在治疗过程中对光动力效应进行调控。
为了解决以上技术问题,本发明提供一种肿瘤特异性酶响应的光动力治疗纳米材料,其由金属有机框架材料(MOF)、名为a链的单链DNA和名为b链的单链DNA构成;所述金属有机框架材料(MOF)为表面含有丰富的不饱和金属配位点的纳米粒子;所述b链含有与a链的反向互补区域,所述反向互补区域内修饰有淬灭基团并含有脱嘌呤嘧啶位点(AP位点),所述脱嘌呤嘧啶位点(AP位点)切除后将从所述反向互补区域游离出修饰有淬灭基团的短链;所述a链5’端修饰有磷酸基团,所述a链和所述b链反向互补结合为双链DNA(dsDNA),并通过磷酸基团和金属有机框架材料(MOF)中的不饱和金属配位点的相互作用固定于所述金属有机框架材料的表面。
上述纳米材料中,所述金属有机框架材料可为锆基金属有机框架材料(Zr-MOF)。
上述纳米材料中,所述锆基金属有机框架材料(Zr-MOF)可采用PCN-224。PCN-224为ZrOCl
上述纳米材料中,所述修饰有淬灭基团的短链,其与a链互补配对的长度小于等于9个核苷酸。
上述纳米材料中,所述a链和所述b链反向互补结合为双链DNA,结合后a链上的磷酸基团和b链上的淬灭基团之间的距离小于等于20个核苷酸。
上述纳米材料中,所述淬灭基团可修饰于b链任何位置,优选3’端;所述淬灭基团可为BHQ2或BHQ3。
上述纳米材料中,所述a链的核苷酸序列可如序列表序列1所示,其中第1位修饰有磷酸基团。
上述纳米材料中,所述b链的核苷酸序列可如序列表序列2所示,其中第12位的碱基T替换为AP位点,第20位修饰有淬灭基团。
本发明还提供使用上述纳米材料的制备方法,包括将所述a链和所述b链退火组装双链DNA,通过所述a链5’端的磷酸基团和所述金属有机框架材料中的不饱和金属配位点的相互作用将所述双链DNA固定于所述金属有机框架材料的表面,得到肿瘤特异性酶响应的光动力治疗纳米材料。
本发明还提供一种产品,其活性成分为所述纳米材料。
上述产品中,所述产品可为药物。所述产品可用于治疗癌症。所述癌症可为肺癌,如非小细胞肺癌。
为解决上述技术问题,本发明还提供了如下W1-W4的任一应用:
W1、上述纳米材料或制备方法在制备增强癌症治疗药物药效产品中的应用;
W2、上述纳米材料或制备方法在制备癌症治疗药物中的应用;
W3、上述纳米材料或制备方法在制备抑制癌细胞生长产品中的应用;
W4、上述纳米材料或制备方法在制备降低癌细胞细胞活力产品中的应用。
上述应用中,所述癌症治疗药物可为肺癌治疗药物。所述肺癌治疗药物可为非小细胞肺癌治疗药物。
上述应用中,所述癌症可为肺癌。所述癌细胞可为肺癌细胞,如A549细胞。
本发明构建的肿瘤特异性酶响应的光动力治疗纳米材料PCN-dsDNA(BHQ+APsite)进入肿瘤细胞时,肿瘤细胞中高表达的APE1可迅速作用于该纳米粒子中的b链上的AP位点,导致修饰于b链的淬灭基团游离出纳米粒子,纳米粒子的光动力效应得以恢复,通过光照激发光动力效应可产生大量活性氧(ROS)来杀伤细胞,同时由于细胞内氧化还原水平的上升,APE1的表达会进一步提高,进而有更多纳米粒子恢复光动力效应,以此来实现一种正反馈调节。而在正常细胞中,由于其中APE1表达量较低,不足以恢复纳米材料的光动力效应,因此对正常细胞无杀伤力。本发明将金属有机框架、核酸纳米结构结合,综合利用酶促反应和光动力效应,并利用细胞自身的机制进行放大,实现了对肿瘤细胞的特异性光动力治疗,在减少对正常细胞毒性的前提下对肿瘤细胞造成高杀伤力。
附图说明
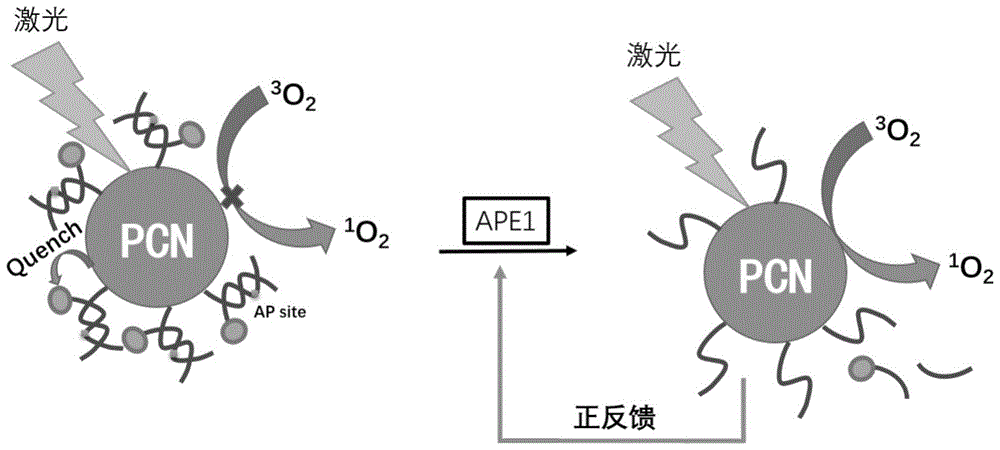
图1为本发明公开的肿瘤特异性酶调控的光动力治疗材料的结构和原理图。
图2为本发明公开的肿瘤特异性酶响应的光动力治疗材料的电镜成像图、电泳表征图以及Zeta电势表征图。图2的(A)图为PCN-224的电镜成像图;图2的(B)图为2%琼脂糖凝胶电泳图,其中泳道1为dsDNA,泳道2为游离dsDNA,泳道3为PCN-dsDNA(BHQ+APsite),泳道4为PCN降解后的PCN-dsDNA(BHQ+APsite);图2的(C)图为PCN-224的Zeta电势图;图2的(D)图为PCN-dsDNA的Zeta电势图。
图3为本发明公开的肿瘤特异性酶调控的光动力治疗材料在溶液中的光动力响应表征图。其中,PCN-dsDNA(BHQ+APsite)为本发明公开的肿瘤特异性酶调控的光动力治疗材料,PCN-dsDNA(BHQ)为无APsite标志的对照,PCN为PCN-224。
图4为本发明公开的肿瘤特异性酶调控的光动力治疗材料在肿瘤细胞A549中的产生的活性氧物种染色图。其中,PCN-dsDNA(BHQ+APsite)为本发明公开的肿瘤特异性酶调控的光动力治疗材料,PCN-dsDNA(BHQ)为无APsite标志的对照,PCN为PCN-224,CTRL为未经材料处理的空白对照,Hoechst为细胞核染料,DCFH-DA为活性氧物种探针,Merge为将细胞核成像和活性氧物种成像合并。
图5为本发明公开的肿瘤特异性酶调控的光动力治疗材料对肺癌细胞A549的细胞毒性图。其中,PCN-dsDNA(BHQ+APsite)为本发明公开的肿瘤特异性酶调控的光动力治疗材料,PCN-dsDNA(BHQ)为无APsite标志的对照,PCN为PCN-224,Contorl为未经材料处理的空白对照。
图6为本发明公开的肿瘤特异性酶调控的光动力治疗材料对肺癌细胞A549内APE1表达量的影响的Western blot表征图。其中,PCN-dsDNA(BHQ+APsite)为本发明公开的肿瘤特异性酶调控的光动力治疗材料,Control为未经材料处理的空白对照。
具体实施方式
下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。以下提供的实施例可作为本技术领域普通技术人员进行进一步改进的指南,并不以任何方式构成对本发明的限制。
下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的材料、试剂等,如无特殊说明,均为常规生化试剂,可从商业途径得到。
实施例1肿瘤特异性酶响应的光动力治疗纳米材料的构建及效果验证
1、构建肿瘤特异性酶响应的光动力治疗纳米材料
目前已经发现通过有机小分子光淬灭基团(例如black hole quencher系列)与光敏剂的作用可以将其光动力效应减小,因此可以利用淬灭基团与光敏剂组装成一个针对肿瘤标志物的特异性响应的开关,使得光动力治疗仅在肿瘤细胞内开启,从而减少光动力治疗对正常组织的毒性。人脱嘌呤/脱嘧啶核酸内切酶1(apurinic/apyrimidinicendonuclease1,APE1)是一种多功能酶,是碱基切除修复途径(Base excision repair,BER)的一部分,APE1在哺乳动物细胞中几乎负责全部的脱嘌呤/脱嘧啶位点(AP位点)加工,其已被证实与肿瘤发生发展及转移有关,这种酶在肿瘤细胞的细胞质中过量表达,被认为是一种肿瘤特异性酶。并且APE1对于细胞内的氧化还原水平有调节作用,其表达量在细胞内活性氧水平上升时会上调。综上,发明人拟利用具有淬灭基团和AP位点的DNA分子与MOF构建可控的光动力治疗纳米材料,以降低光动力治疗中对于正常组织的毒害。
发明人构建了一种肿瘤特异性酶响应的光动力治疗纳米材料,名称为PCN-dsDNA(BHQ+APsite),其结构图见图1,由金属有机框架材料(MOF)、名为a链的单链DNA和名为b链的单链DNA构成;所述金属有机框架材料(MOF)为表面含有丰富的不饱和金属配位点的纳米粒子;所述b链含有与a链的反向互补区域,所述反向互补区域内修饰有淬灭基团并含有脱嘌呤嘧啶位点(AP位点),所述脱嘌呤嘧啶位点(AP位点)切除后将从所述反向互补区域游离出修饰有淬灭基团的短链;所述a链5’端修饰有磷酸基团,所述a链和所述b链反向互补结合为双链DNA(dsDNA),并通过磷酸基团和金属有机框架材料(MOF)中的不饱和金属配位点的相互作用固定于所述金属有机框架材料的表面。
本实施例中所述金属有机框架材料为锆基金属有机框架材料(Zr-MOF),所述锆基金属有机框架材料(Zr-MOF)具体采用PCN-224。PCN-224为ZrOCl
本实施例的a链和b链具体见表1:a链全长28个碱基,b链全长20个碱基;磷酸基团标记在a链的5’端,淬灭基团标记在b链3’端;在a链的5’端修饰磷酸来确保核酸和Zr-MOF表面的Zr的相互作用连接;b链3’端修饰有淬灭基团(BHQ1),第12位为AP位点,第1-11位和第13-20位与a链互补配对;互补配对后,a链上的磷酸基团和淬灭基团之间的距离为8个核苷酸,磷酸基团和AP位点间的距离为18个核苷酸;AP位点距离淬灭基团3’端9个核苷酸,以确保在APE1作用切除AP位点后,修饰有淬灭基团的短链与a链互补配对的长度够短,可游离出纳米粒子,从而使纳米粒子恢复光动力效应。
表1各核酸序列
注:X为AP位点,PO
PCN-dsDNA(BHQ+APsite)的作用原理为:在激光环境下,正常细胞中,由于脱嘌呤嘧啶核酸内切酶1(APE1)的含量较少,淬灭基团可阻断光动力效应的进行,因此在正常细胞中光动力治疗(PDT)无法进行。而在激光环境下,肿瘤细胞中高表达的APE1可将材料上的AP位点切开,导致淬灭基团无法继续阻断光动力效应,从而使得肿瘤特异性酶APE1响应的光动力治疗纳米材料PCN-dsDNA(BHQ+APsite)在肿瘤细胞中进行光动力杀伤,并通过细胞自身的机制(APE1对于细胞内的氧化还原水平有调节作用,其表达量在细胞内活性氧水平上升时会上调)进行放大。
本发明肿瘤特异性酶APE1响应的光动力治疗纳米材料PCN-dsDNA (BHQ+APsite)的制备方法,包括将所述a链和所述b链退火组装双链DNA,通过a链5’端的磷酸基团和金属有机框架材料中的不饱和金属配位点的相互作用将所述双链DNA固定于所述金属有机框架材料的表面,得到肿瘤特异性酶响应的光动力治疗纳米材料。具体包括以下步骤:
A、光动力治疗纳米材料PCN-224的合成和表征
将H
B、带标记的双链DNA的制备
按照表1合成并修饰a链和b链。
制备带标记的双链DNA(dsDNA):建立30μL体系,反应缓冲液环境为1×HEPESbuffer(pH 7.4),分别加入a链和b链,使它们在体系中的浓度均为10μM,其余体积则用ddH
a链和b链稳定结合得到带标记的双链DNA,a链上的磷酸基团和淬灭基团之间的距离为8个核苷酸,磷酸基团和AP位点间的距离为18个核苷酸;AP位点距离淬灭基团3’端9个核苷酸。
C、肿瘤特异性酶响应的光动力治疗纳米材料PCN-dsDNA(BHQ+APsite)的合成
将步骤A合成的PCN-224和步骤B制备的带标记的双链DNA在HEPES缓冲溶液中过夜反应,得到肿瘤特异性酶响应的光动力治疗纳米材料PCN-dsDNA(BHQ+APsite),具体如下:
取制备好的PCN-224,用去离子水洗涤三次然后分散至水中过夜得到PCN-224的水溶液,浓度为500μg/mL;在2mL离心管中加入485μL的去离子水,再加入30μL的带标记的双链DNA(dsDNA,10μM),震荡仪中将300μL的PCN-224(500μg/mL)的水溶液缓慢滴加到离心管中,反应液在旋转摇床上过夜,然后在震荡仪中缓慢滴加100μL 1M HEPES buffer(pH 7.4),短暂超声后,继续摇床2h。反应结束后,用去离子水离心分离和洗涤两次(12000rpm,10min),使游离的DNA从体系中去除,得到肿瘤特异性酶响应的光动力治疗纳米材料PCN-dsDNA(BHQ+APsite)。最终将产品PCN-dsDNA(BHQ+APsite)重新分散到去离子水中,电镜成像图并通过2%琼脂糖凝胶电泳表征其合成。
表征结果见图2,如图2的(A)图表明PCN-224成功合成并未发生聚集沉降,并且图2的(B)图的电泳结果也表明了dsDNA偶联到了金属有机骨架PCN的表面,具体表现为泳道2比泳道1的条带要暗淡一些,泳道3没有条带,原因是金属有机骨架对于DNA染料的影响导致条带消失,而泳道4在用磷酸裂解掉PCN-dsDNA后条带又重新出现,表明DNA成功偶联到PCN上。DNA在偶联到PCN上之后会导致PCN纳米粒子表面的电势降低,如图2的(C)图和图2的(D)图所示,PCN-dsDNA纳米粒子表面的的电势要明显低于PCN表面的电势,表明了PCN-dsDNA的偶联成功。
dsDNA上淬灭基团与金属有机骨架PCN-224表面距离8个碱基,AP位点距离金属有机骨架PCN-224表面18个碱基。
设置对照,即以表1中未标记AP位点的c链(第12位的碱基T未替换为AP位点,其它氨基酸序列及修饰同b链)替换b链,保持其它步骤不变,得到无AP位点标志的对照PCN-dsDNA(BHQ)。
2、肿瘤特异性酶调控的光动力治疗材料对溶液的光动力效应检测
通过是否在双链DNA上标记AP位点来决定纳米材料的光动力效应是否被开启,通过DPBF来检测溶液体系中的活性氧(ROS)生成,活性氧可以氧化DPBF使其荧光降低,具体步骤如下:
将纳米材料PCN-dsDNA(BHQ+APsite)分散在96孔板的1×TAEbuffer体系中,形成40μg/mL的水溶液,将APE1按照1:20用无酶水稀释,取1μL加入体系,作用20-30min,加入二苯基异苯并呋喃(简称DPBF,100mg/mL)染料,激光处理10min(670nm,100mW/cm
结果见图3,表明PCN-dsDNA(BHQ+APsite)在APE1的作用下打开了纳米粒子的光动力效应,在激光处理下产生了活性氧,氧化DPBF导致其荧光降低,而PCN组也得到类似的结果,进一步证明了APE1打开了PCN-dsDNA(BHQ+APsite)的光动力效应,PCN-dsDNA(BHQ)组由于其缺少开关AP位点,所以APE1无法打开其光动力效应,进而无法在光照下产生活性氧,因此其荧光较高。
3、肿瘤特异性酶调控的光动力治疗材料用于对肺癌细胞A549的杀伤
基于上述合成的肿瘤特异性酶调控的光动力治疗材料PCN-dsDNA(BHQ+APsite),利用活性氧探针检测肿瘤细胞内的活性氧水平,来判断纳米材料的光动力效应,所用肿瘤细胞为A549,以PCN-dsDNA(BHQ)和PCN-224作为对照,同时设置空白对照,具体步骤如下:
(1)打开水浴锅并将水温调至37℃,从液氮中取出A549细胞,置于37℃水中快速融化,期间轻轻摇动,约1min后细胞融化,用75%酒精将冻存管擦拭干净,转移至超净台上,超净台应提前紫外灭菌并保持通风,在超净台上将冻存管中的细胞用移液枪移至培养瓶中,并加入5mL配置好的1640培养基,将培养瓶放入37℃,5%二氧化碳的培养箱中培养,显微镜观察细胞长势,如需要,在8小时后更换培养基。提前自-20℃冰箱中取出胰蛋白酶,放入37℃水浴锅化开,用75%酒精将冻存管擦拭干净,转移至超净台上。细胞在37℃,5%二氧化碳的恒温培育箱中培育细胞长至80%-90%便可传代。将原培养瓶中的培养基用移液枪吸走,倒入PBS清洗一次,用移液枪吸走,加胰蛋白酶1mL,覆满瓶底,37℃1min,加3mL培养基停止消化,显微镜察看细胞是不是从贴壁状变成游离状,用移液枪轻轻吹打细胞至细胞从瓶底脱落,自培养瓶中取2mL移植新培养瓶,加3mL 1640培养基至新培养瓶中,放于37℃,5%二氧化碳培育箱中培育。
(2)选细胞贴壁生长并且覆盖80%左右的细胞瓶进行操作,将培养基吸走,加入PBS清洗,吸走PBS,加1mL化开的胰蛋白酶消化1min,加1mL培养基停止消化并用移液枪将细胞吹打至全部悬浮,吸取1mL培养基移至1.5mL离心管中离心900r/min,10min,离心后弃去上清液,加入1640培养基1mL吹打混匀,吸取200μL放于共聚焦培养皿中过夜培养。取100μL纳米粒子(PCN-dsDNA(BHQ+APsite)、PCN-dsDNA(BHQ)、PCN-224以及空白共4个处理)加100μL 1640培养基混合均匀。将过夜培养的培养皿中的培养基吸走,加入上述混合培养基,加入细胞中孵育4h,吸走培养基,加入混有Hoechst 33342燃料的培养基,培养0.5h,激光照射10min(100mW/cm
(3)高倾斜光切片(HILO)显微镜检测
将上述的培养基取出吸走培养基,用PBS清洗一次,洗去细胞代谢物,吸走PBS。打开全内反射显微镜的电源和CCD,然后打开电脑中相应的程序,在油镜上滴油,将样品放于载物台上,打开激光以及汞灯,调整焦距,找到形态较好的细胞,拍摄明场下的细胞、激光发射源下的细胞,汞灯发射源下的细胞。
结果见图4,表明PCN组和PCN-dsDNA(BHQ+APsite)的活性氧物种探针成像有比较高的荧光响应,而空白对照和PCN-dsDNA(BHQ)有比较低的荧光响应,这说明PCN-dsDNA(BHQ)的光动力效应较低,无法在肿瘤细胞内产生大量的活性氧,而PCN-dsDNA(BHQ+APsite)由于肿瘤细胞内过量表达的APE1,其光动力效应被打开,可以产生大量活性氧。
4、CCK-8检测肿瘤特异性酶调控的光动力治疗材料对肿瘤细胞的毒性
基于上述合成的肿瘤特异性酶调控的光动力治疗材料PCN-dsDNA(BHQ+APsite),利用CCK-8试剂盒(Dojindo、PH632)来判断细胞存活率,来判断PCN-dsDNA(BHQ+APsite)对肿瘤细胞的杀伤力,所用肿瘤细胞为A549,以PCN-dsDNA(BHQ)和PCN-224作为对照,同时设置空白对照,具体实施步骤如下:
(1)将A549细胞从CO
(2)将种了A549细胞的96孔板从CO
(3)加完样后将96孔板放入CO
结果见图5,表明PCN-dsDNA(BHQ)由于没有开关AP位点,在肺癌细胞A549内过量表达的APE1无法解锁其光动力效应,因此其细胞存活率较高(84.7%),而PCN-dsDNA(BHQ+APsite)依赖于A549细胞内过量表达的APE1,其光动力效应被解锁,因此其细胞存活率较低(33.3%)。
综上,本发明构建的肿瘤特异性酶响应的光动力治疗纳米材料PCN-dsDNA(BHQ+APsite)对正常细胞毒性小,对肿瘤细胞具有APE1特异性诱导的显著杀伤力。本发明将金属有机框架、核酸纳米结构结合,综合利用酶促反应和光动力效应,并利用细胞自身的机制进行放大,实现了对肿瘤细胞的特异性光动力治疗,在减少对正常细胞毒性的前提下对肿瘤细胞造成高杀伤力。
以上对本发明进行了详述。对于本领域技术人员来说,在不脱离本发明的宗旨和范围,以及无需进行不必要的实验情况下,可在等同参数、浓度和条件下,在较宽范围内实施本发明。虽然本发明给出了特殊的实施例,应该理解为,可以对本发明作进一步的改进。总之,按本发明的原理,本申请欲包括任何变更、用途或对本发明的改进,包括脱离了本申请中已公开范围,而用本领域已知的常规技术进行的改变。按以下附带的权利要求的范围,可以进行一些基本特征的应用。
序列表
<110>北京化工大学
<120>肿瘤特异性酶响应的光动力治疗纳米材料及其制备与应用
<130>GNCSY212908
<160>2
<170>SIPOSequenceListing 1.0
<210>1
<211>28
<212>DNA
<213>人工序列(Artificial Sequence)
<400>1
ggcgaggttt cgcgtcgcag cgtgcacg 28
<210>2
<211>20
<212>DNA
<213>人工序列(Artificial Sequence)
<400>2
cgtgcacgct gtgacgcgaa20
- 一种近红外响应的光动力光热治疗纳米复合材料的制备及其应用
- 一种近红外响应的光动力光热治疗纳米复合材料的制备及其应用
