一种对虾肠道合成菌群及其筛选方法和应用
文献发布时间:2024-04-18 19:58:21
技术领域
本发明属于微生物技术领域,尤其是涉及一种对虾肠道合成菌群及其筛选方法和应用。
背景技术
凡纳滨对虾是我国最主要的对虾养殖品种。但是,随着对虾养殖集约化程度的提高,导致对虾疾病频发,极大地制约了我国对虾养殖产业的发展。抗生素和化学类药物一直被作为治疗和控制对虾疾病的主要手段。然而这些药物的滥用带来了许多的负面影响,如破坏对虾肠道菌群结构,危害对虾健康,影响食品安全等,严重了阻碍了对虾养殖产业的绿色健康发展。因此,亟需寻求一种绿色、安全、无公害的防治病害的方法。
目前水产养殖中应用较多的新型抗生素替代品主要有大蒜素、小肽、中草药饲料添加剂、酶制剂、微生物制剂等,其中微生物制剂具有绿色、安全、环保、无残留、无毒副作用等优点,在水产养殖产业中发展潜力巨大。但目前应用于水产养殖的商用微生物制剂多为人源或陆源产品,这些益生菌不能完全适应在水产动物消化道和水体环境,或者仅能短效发挥作用。而水产动物体内本身就存在丰富的益生菌资源,这些土著益生菌更容易适应水产动物消化道和水体环境,能够更好地发挥益生功能。同时,这些土著益生菌由于本身就来源于水产动物消化道,因此它们更容易长期定殖,且不易引起宿主和肠道微生物的排斥。
此外,相较于单一种类的功能菌,利用微生物之间相互作用构建的合成菌群具有独特的特征和功能,对环境具有更强的适应能力,更利于群落结构和功能的稳定,受到了广泛的关注和应用。因此,通过对虾肠道微生物群落的解析,构建抗病功能更为稳定的微生物合成菌群,能为缓解对虾病害提供一种新型的防治策略。
发明内容
本发明所要解决的技术问题是提供一种有效提高对虾的生长和抗病能力的对虾肠道合成菌群及其筛选方法和应用。
本发明解决上述技术问题所采用的技术方案为:一种对虾肠道合成菌群,所述的合成菌群为鲁杰氏菌TCW20、海角副球菌RBB26、脱醌杆菌TCG4、微杆菌HBG41和黏着杆菌BG12中任意两种或两种以上的混合菌种,其中所述的鲁杰氏菌(Ruegeriaprofundi)TCW20于2023年05月30日保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为CGMCC No.27496;
所述的脱醌杆菌(Demequina globuliformis)TCG4于2023年05月30日保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为CGMCC No.27497;
所述的海角副球菌(Paracoccus homiensis)RBB26于2023年05月30日保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为CGMCC No.27498;
所述的微杆菌(Microbacterium sp.)HBG41于2023年05月30日保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为CGMCC No.27499;
所述的海泥黏着杆菌(Tenacibaculum lutimaris)BG12,于2022年07月08日保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为CGMCC No.25267。
优先的,所述的合成菌群由鲁杰氏菌TCW20、海角副球菌RBB26、脱醌杆菌TCG4、微杆菌HBG41和黏着杆菌BG12组成。
优先的,所述的合成菌群由鲁杰氏菌TCW20、海角副球菌RBB26、脱醌杆菌TCG4、微杆菌HBG41和黏着杆菌BG12按总活菌数等比例进行混合而成。
上述对虾肠道合成的筛选方法,包括以下步骤:
(1)肠道菌株的分离鉴定
在无菌条件下采集健康对虾肠道样品与无菌磷酸缓冲液按质量体积浓度10~20%比例充分混匀后,静置5min后将上清液小心倒入另一无菌离心管中,然后经梯度稀释后,分别均匀涂布于2216E固体培养基上,30℃倒置培养1~2天,挑选单菌落进行鉴定,获得的纯菌株保存于-80℃冰箱;
(2)代表性菌株的筛选
基于对虾肠道微生物群落数据获得的病害相关的关键核心类群组成及对应的16SrRNA基因片段序列,筛选与关键核心类群相匹配的代表性菌株,分别命名为:鲁杰氏菌TCW20、脱醌杆菌TCG4、副球菌RBB26、微杆菌HBG41和黏着杆菌HBG23。
进一步,所述的2216E培养基配方为:蛋白胨1.0g~3.5g,酵母提取物0.25g~0.75g,四水磷酸铁0.005g,琼脂15g,海水750mL和蒸馏水250mL,调节pH至7.0~8.0。
上述对虾肠道合成菌群在制备副溶血弧菌抑制剂中的应用。
上述对虾肠道合成菌群在制备对虾养殖用益生菌添加剂中的应用。
与现有技术相比,本发明的优点在于:本发明涉及一种对虾抗病的合成菌群及其应用,该合成菌群中的5株菌株均从对虾肠道中分离获得,属于对虾肠道的土著微生物,其能快速适应养殖水体和对虾肠道环境;本发明提供的5株菌构成的合成菌群饲喂对虾后可以提高其对病原菌副溶血弧菌侵染的抗性,且抗弧菌侵染能力显著优于单个菌株添加时;使用该合成菌群作为对虾养殖的益生菌添加剂,可以提高对虾的生长和抗病能力;因此该合成菌群在水产动物养殖,尤其是对虾新型绿色饲料添加剂开发和抗生素代替品等研究上具有重大的经济价值。
上述鲁杰氏菌菌株,该菌株为TCW20菌株,分类命名为Ruegeriaprofundi,于2023年05月30日保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为CGMCCNo.27496,保藏地址为北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所;
上述脱醌杆菌菌株,该菌株为TCG4菌株,分类命名为Demequina globuliformis,于2023年05月30日保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为CGMCC No.27497,保藏地址为北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所;
上述海角副球菌菌株,该菌株为RBB26菌株,分类命名为海角副球菌(Paracoccushomiensis),于2023年05月30日保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为CGMCC No.27499,保藏地址为北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所;
上述微杆菌菌株,该菌株为HBG41菌株,分类命名为微杆菌(Microbacteriumsp.),于2023年05月30日保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为CGMCC No.27499,保藏地址为北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所;
上述海泥黏着杆菌菌株,该菌株为BG12菌株,分类命名为海泥黏着杆菌(Tenacibaculum lutimaris),于2022年07月08日保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为CGMCC No.25267,保藏地址为北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所。
附图说明
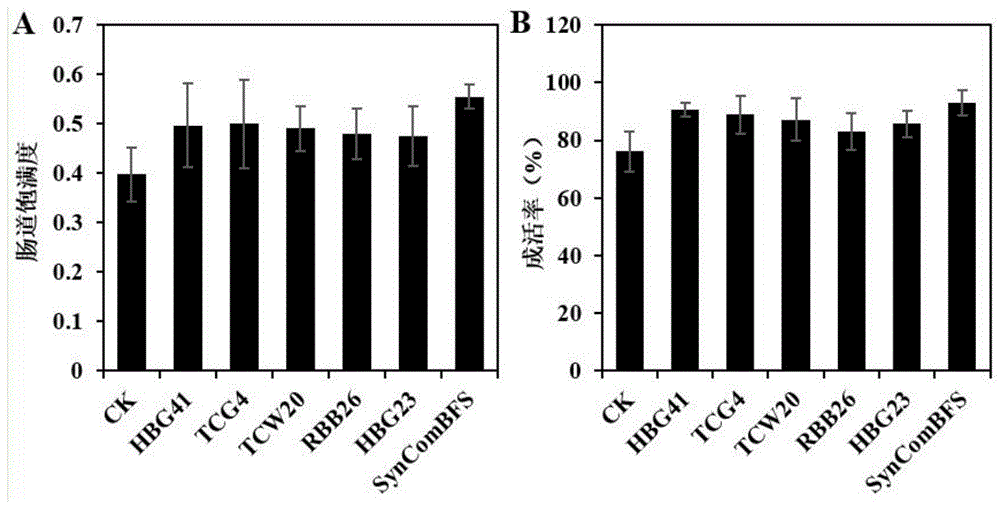
图1为单独5个菌株与合成菌群BFS添加对幼虾肠道饱满度(A)和成活率(B)的影响;
图2为单独5个菌株与合成菌群BFS添加对幼虾弧菌侵染抗性的影响;
图3为合成菌群BFS长期添加对对虾单虾体长(A)和体重(B)的影响;
图4为合成菌群BFS长期添加对对虾成活率(A)和产量(B)的影响;
图5为合成菌群BFS添加对发病对虾的存活率(A)和病虾占比(B)的影响。
具体实施方式
以下结合附图实施例对本发明作进一步详细描述。
实施例1
1、本发明菌株的分离鉴定
在无菌超净台上,用灭菌牙签挑取活虾肠道装入灭菌的2ml EP管中,按质量体积浓度10~20%的比例,加入高压灭菌的磷酸缓冲液(pH 7.0);剧烈震荡30s后置于28℃、180rpm摇床震荡培养30min;取适量培养后的培养液进行梯度稀释(10
提取纯化菌株的基因组DNA,以其为模板进行PCR扩增,所用引物为:27F:5'-AGAGTT TGATCC TGG CTCAG-3';1492R:5'-GGT TAC CTT GTTACGACT T-3'。扩增序列送至上海生工公司测序,然后将测序序列提交到EZBioCloud比对,对菌株进行命名,筛选关键核心类群相同属的菌株。
所述的2216E培养基配方为:蛋白胨1.0g~3.5g,酵母提取物0.25g~0.75g,四水磷酸铁0.005g,琼脂15g,海水750mL和蒸馏水250mL,调节pH至7.0~8.0。
2、本发明代表性菌株筛选
本发明前期研究发现,与传统换水模式相比,生物絮团模式养殖的对虾对副溶血弧菌侵染表现出明显的抗性,采用16S rRNA基因扩增子测序技术比较分析两种养殖模式下对虾肠道菌群存在显著差异,生物絮团模式养殖对虾肠道显著富集微杆菌、脱醌杆菌、副球菌、鲁杰氏菌和黏着杆菌等细菌类群。通过采用线性回归、随机森林模型等方法分析发现这些细菌类群的丰度与弧菌侵染后对虾的存活率呈显著正相关,为对虾抗病相关的关键核心类群。
基于对虾肠道微生物群落数据获得的病害相关的关键核心类群组成及对应的16SrRNA基因片段序列,提取对虾肠道关键核心类群的16S rRNA基因V3-V4区序列,将该序列与分离菌株16S rRNA基因全长序列进行比对,挑选与关键核心类群16S rRNA基因相似度在99%以上的分离菌作为其对应的代表性菌株,本次共筛选到5个不同属的代表菌株,分别为鲁杰氏菌TCW20、脱醌杆菌TCG4、副球菌RBB26、微杆菌HBG41和黏着杆菌HBG23。将以上5株菌等比例混合后获得合成菌群BFS。
实施例2
利用上述实施例1获得的合成菌群BFS添加抗弧菌侵染效果研究。
1、合成菌群BFS用于幼虾养殖实验
合成菌群BFS添加实验采用P10期对虾幼苗,在5L养殖桶中进行。每个养殖桶注入3L消毒海水,然后将P10幼虾按照每桶200~240尾的数量投放养殖桶中,实验共分为对照组、TCW20、TCG4、RBB26、HBG41、HBG23和合成菌群BFS添加组。添加方法如下:每次喂料前,将单菌或合成菌群BFS与饲料混合发酵10~30min,菌液浓度为10
2、合成菌群BFS添加后弧菌侵染抗性
养殖试验养殖6d后进行弧菌侵染实验,在实验室自制的650mL培养瓶中进行(见发明人专利:一种用于实验室的对虾小型无菌养殖装置,专利号:ZL202023034540.1)。实验前,从每桶中随机挑选上150只幼虾,分装入6个含有500mL消毒海水的培养瓶中,每瓶25只幼虾,随机分为两组,一组加入副溶血弧菌攻毒,一组作为空白对照,侵染48h时统计幼虾存活率。结果如图2所示,表明弧菌侵染48h时,添加单菌、合成菌群BFS组和对照组的幼虾成活率有显著差异,且添加合成菌群BFS对弧菌侵染抗性的提升作用显著高于添加任何一株单菌。
实施例3
利用上述实施例1获得的合成菌群BFS进行长周期养殖实验。
本实验在规范一致的帆布池养殖桶(500L)中进行,该养殖桶配有一致的增氧系统、排换水装置等。每个养殖桶中放入规格为0.25g虾苗400尾,分别设置对照组和合成菌群BFS组。添加方法如下:每次喂料前,将合成菌群BFS与饲料混合发酵10~30min,菌液浓度为10
实施例4
利用上述实施例1获得的合成菌群BFS进行发病对虾的治疗实验。
在养殖过程中,放养P10幼虾的一个养殖桶在养殖33天时发生弧菌病害,导致养殖桶中90%的幼虾死亡,存活幼虾中大约50%的仍有病害症状。为了验证合成菌群BFS是否可以缓解幼虾病害症状,将存活对虾随机放入5L养殖桶中,每桶15只幼虾,共设置10个养殖桶。将10个养殖桶分成2组,分别为对照组和添加合成菌群BFS组。添加方法如下:每次喂料前,将合成菌群BFS与饲料混合发酵10~30min,菌液浓度为10
上述说明并非对本发明的限制,本发明也并不限于上述举例。本技术领域的普通技术人员在本发明的实质范围内,做出的变化、改型、添加或替换,也应属于本发明的保护范围。
- CpG ODN在促进凡纳滨对虾对虾生长和改善肠道菌群中的应用
- 乙醇梭菌蛋白在促进凡纳滨对虾生长、改善肠道菌群中的应用
