基于非编码piRNA-X717的角膜痛治疗药物
文献发布时间:2024-04-18 19:58:21
技术领域
本发明属于眼部核酸治疗药物技术领域,具体涉及piRNA-X717抑制剂在制备用于预防或治疗神经病理性角膜痛的药物中的应用。
背景技术
干眼症(Dry eye disease,DED)的干眼样症状包括眼睛干涩、发痒、刺痛、迎风流泪等,其眼部慢性疼痛是患者最希望解决的临床症状。在干眼症中,多数患者可由眼科因素,如泪膜异常、睑板腺功能障碍或上皮损伤诱发;然而仍有30-40%的患者角膜疼痛等不适感持续存在,该部分患者对传统局部治疗如人工泪液、激素、营养因子等药物无效,常伴有角膜触诱发痛和痛觉过敏(即角膜痛觉敏化现象),给患者带来极大困扰。
干眼症致角膜痛患者角膜基底下神经丛常形态常出现异常变化,如角膜神经新生、增厚、神经丛密度降低、形态弯曲及角膜边缘串珠样改变。这种角膜痛觉症状(重)与临床体征(轻)不相符的现象提示,神经病理性疼痛调控机制可能参与其中。并且这种改变与焦虑、抑郁及压力较大等心理因素以及躯体感觉障碍(如慢性疼痛)有关,涉及中枢神经系统,最终导致角膜部位的神经病理性疼痛。
神经病理性角膜痛(NCP)也被称为角膜神经痛、角膜痛、角膜异常性疼痛或角膜神经病,通常认为是一种发生在角膜的、由神经系统原发性损伤或功能障碍引起的疼痛[1]。眼部局部疾病如干眼症、化学烧伤、眼部手术、带状疱疹性眼炎、感染性角膜炎、复发性糜烂、辐射性角膜病、隐形眼镜磨损角膜等常见眼表炎症和眼部创伤性疾病均能引起NCP发生[2,3]。目前用于NCP的治疗药物主要包括三环类抗抑郁药、抗惊厥药卡马西平、纳曲酮、曲马多和钙通道α2-δ配体等;辅助疗法包括认知行为疗法和神经阻滞等[4]。尚无针对NCP发病机制的靶向治疗药物和方法,临床中采用上述单一的治疗药物或方法常常效果不佳,联合治疗效果也不尽人意。因此迫切需要寻找新的NCP防治的有效靶点和药物。
非编码RNA中的小RNA分为三类,即微小RNA,小干扰RNA以及piRNA。其中piRNA主要表达于生殖细胞中,是一类新型单链非编码小RNA,长度为24~31nt,piRNA通过抑制转座子活性持续维持生物基因组完整性和稳定性[5],在多种疾病中发挥重要调控作用。piRNA最早发现于哺乳动物的精原细胞,随后研究者发现在其它组织中亦有piRNA表达。已有证据显示,piRNA在中枢和外周神经系统海马树突棘形成以及坐骨神经损伤等过程中,均能发挥调控功能[6]。近来研究发现,piRNA-DQ541777能参与坐骨神经损伤引起的神经病理性疼痛发生过程[7]。
参考文献:
1.Saldanha,I.J.,et al.,Research Questions and Outcomes Prioritized byPatients With Dry Eye.JAMA Ophthalmology,2018.136(10):p.1170-1179.
2.Galor,A.,et al.,Neuropathic Ocular Pain due to Dry Eye isAssociated with Multiple Comorbid Chronic Pain Syndromes.The Journal of Pain,2016.17(3):p.310-318.
3.Guerrero-Moreno,A.,et al.,Morphological and Functional Changes ofCorneal Nerves and Their Contribution to Peripheral and Central SensoryAbnormalities.Frontiers In Cellular Neuroscience,2020.14:p.610342.
4.Galor,A.,et al.,Neuropathic pain and dry eye.The Ocular Surface,2018.16(1):p.31-44.
5.Herrmann,J.E.,et al.,STAT3 is a critical regulator of astrogliosisand scar formation after spinal cord injury.The Journal of Neuroscience:theOfficial Journal of the Society For Neuroscience,2008.28(28):p.7231-7243.
6.Lee,E.J.,et al.,Identification of piRNAs in the central nervoussystem.RNA (New York,N.Y.),2011.17(6):p.1090-1099.
7.Zhang,C.,et al.,PiRNA-DQ541777Contributes to Neuropathic Pain viaTargeting Cdk5rap1.The Journal of Neuroscience:the Official Journal of theSociety For Neuroscience,2019.39(45):p.9028-9039.
发明内容
本发明的目的是克服现有技术的不足而提供一种piRNA-X717抑制剂,通过特异性地抑制眼部piRNA-X717表达来缓解干眼症或神经病理性角膜痛。
为解决上述问题,本发明提供如下技术方案:
本发明所述的一种piRNA-X717抑制剂包括piRNA-X717的互补RNA序列。
优选地,所述互补RNA序列包含如下序列:
5'-GGAGAGCGCGAACGCAGUCCCCCACUACCACAAAU-3'。
本发明进一步提供上述piRNA-X717抑制剂在制备预防或治疗神经病理性角膜痛药物中的应用。
优选地,所述药物中包含药学上可接受的辅料或载体。
优选地,所述载体为病毒载体或脂质体微囊。
优选地,所述病毒载体为慢病毒载体或腺病毒载体。
优选地,所述药物的剂型包括但不限于液体注射剂、粉针剂、乳剂、吸入剂、滴剂。
本发明第二方面提供一种预防或治疗神经病理性角膜痛的药物,所述药物靶向抑制piRNA-X717靶点。
本发明第三方面提供上述piRNA-X717抑制剂在制备预防或治疗干眼症药物中的应用。
本发明最后提供上述药物的制备方法,包括将piRNA-X717互补RNA序列采用载体进行包装后制得。
本发明的优点在于:本发明利用筛选获得的piRNA-X717作为干眼症及神经病理性角膜痛的治疗靶点,通过核酸类药物靶向抑制piRNA-X717能够有效地缓解干眼症及神经病理性角膜痛,为干眼症及角膜痛的治疗和预防药物研发提供了新的方向,同时也为其他疼痛类药物的研究提供了启示。
附图说明
图1为干眼症模型小鼠和假手术小鼠在接受手术后的角膜荧光素染色结果;其中,A图为角膜荧光素染色图,图B为荧光染色评分统计图,图C为眼泪分泌量统计图;
图2为干眼症模型小鼠和假手术小鼠在接受手术后的疼痛敏感性的测定结果;其中,A图为0.008g von Frey丝机械刺激角膜疼痛行为结果统计图,B图为0.02g von Frey丝机械刺激角膜疼痛行为结果统计图,C图为辣椒素化学刺激角膜疼痛行为结果统计图,D图为薄荷醇化学刺激角膜疼痛行为结果统计图。
图3为干眼症模型小鼠和假手术小鼠在接受手术后的长链RNA-Pllp高通量测序后的差异表达;
图4为干眼症模型小鼠和假手术小鼠在接受手术后的长链RNA-Pllp在不同时间点的测定结果;
图5为干眼症模型小鼠和假手术小鼠在接受手术后的长链RNA-Pllp在体内不同组织的表达;在图1-5中,Lnc-Pllp或LncRNA-Pllp均代表长链非编码RNA-Pllp。
图6为三叉神经节立体定位注射长链非编码RNA-Pllp慢病毒后小鼠三叉神经节内病毒的测定结果和长链RNA-Pllp的表达情况。其中,A图为三叉神经节慢病毒注射后荧光共聚焦照片,B图为三叉神经节注射后PCR检测的长链非编码RNA-Pllp荧光表达量。
图7为lncRNA-Pllp慢病毒给药后各组小鼠的疼痛敏感性的测定结果,其中,A图为0.008g von Frey丝机械刺激角膜疼痛行为结果统计图,B图为0.02g von Frey丝机械刺激角膜疼痛行为结果统计图,C图为辣椒素化学刺激角膜疼痛行为结果统计图,D图为薄荷醇化学刺激角膜疼痛行为结果统计图。Lenti-vector代表慢病毒空载体组,Lenti-GFAP-Pllp代表含GFAP启动子的LncRNA-Pllp过表达慢病毒。
图8为干眼症模型小鼠和假手术小鼠在接受手术后的piRNA-X717高通量测序后的差异表达;
图9为干眼症模型小鼠和假手术小鼠在接受手术后的piRNA-X717在不同时间点的测定结果;
图10为干眼症模型小鼠和假手术小鼠在接受手术后的piRNA-X717在体内不同组织的表达;
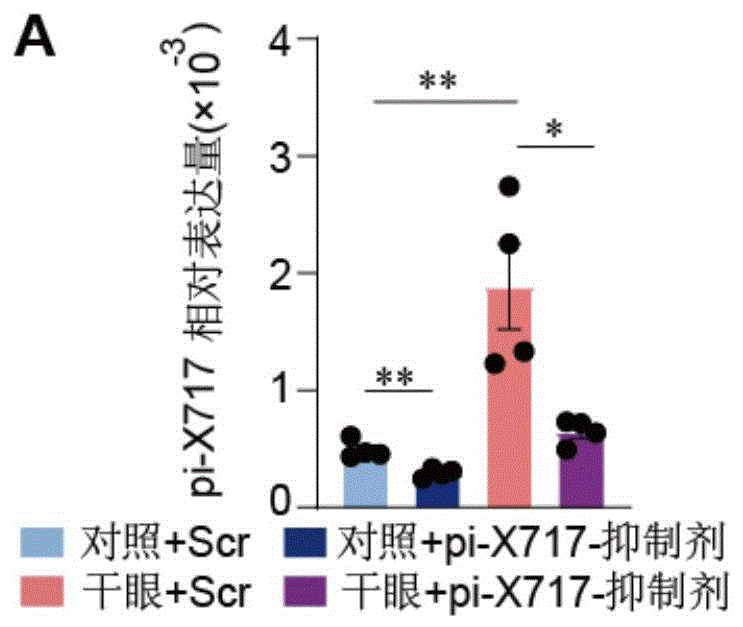
图11为三叉神经节立体定位注射piRNA-X717抑制剂后小鼠三叉神经节内piRNA-X717的表达情况。
图12为piRNA-X717抑制剂给药后各组小鼠的疼痛敏感性的测定结果,其中,A图为0.008g von Frey丝机械刺激角膜疼痛行为结果统计图,B图为0.02g von Frey丝机械刺激角膜疼痛行为结果统计图,C图为辣椒素化学刺激角膜疼痛行为结果统计图,D图为薄荷醇化学刺激角膜疼痛行为结果统计图。
图11-12中,pi-X717-inhibitor或pi-X717-抑制剂均代表piRNA-X717抑制剂给药操作,Scr代表对照序列给药操作,对照序列为piRNA-X717抑制剂序列长度相同的随机序列。
在图1-12中,干眼或干眼症代表干眼症模型组,对照组代表假手术组,pi-X717代表piRNA-X717。
图13为pre-lncRNA-Pllp与piRNA-X717结合位点的生物信息学分析结果图。
具体实施方式
为使本发明实现的技术手段、创作特征、达成目的与功效易于明白了解,下面结合具体实施方式,进一步阐述本发明。
实施例1:神经病理性角膜痛的治疗靶点筛选及长链RNA-Pllp靶点的获得:
1建立双侧眶外泪腺切除模型的手术步骤
将小鼠称重后,生理盐水稀释戊巴比妥钠至0.5%用以麻醉,腹腔注射(75mg/kg),使用血管钳夹掐脚趾无反应证实以达到所需麻醉深度。麻醉后使用碘伏消毒耳廓下缘皮肤,使用眼科剪在耳下剪出5-7mm的切口,轻柔分离并取出眶外泪腺,采用5-0非吸收性黑色尼龙丝线缝合皮肤,对侧重复上述操作。假手术组分离眶外泪腺但不进行摘除,术后复苏时使用电热毯(37℃)维持小鼠体温,苏醒后转移入原有笼位。
2双侧眶外泪腺切除的干眼症状评估
2.1泪液分泌量测试
在保证实验环境和场地的空气湿度、温度与照明一致情况下,使用酚红棉线检测小鼠的泪液分泌情况。小鼠麻醉后,将酚红棉线的一端置于小鼠结膜囊,具体位置为左眼中外1/3,靠近外眦处,计时5min,酚红棉线遇泪液变红,测量棉线变为红色的长度(以毫米为单位),作为检测泪液分泌能力的指标。结果如图1中C图所示。
2.2角膜荧光素钠染色
采用角膜荧光素钠染色来评估小鼠造模后干眼症引起的角膜损伤程度。向小鼠眼结膜囊内滴注0.5μL 0.25%荧光素钠溶液,期间轻柔闭合小鼠眼睑,滴注5s后观察,使用裂隙灯钴蓝光,对小鼠角膜荧光色素的分布情况和染色范围进行评估:无荧光染色为0分;仅存在点状染色,且零散分布,记为0.5分;荧光为点状,但分布密集,记为1分;如出现片状荧光,弥漫性染色覆盖不到三分之一的角膜,记为2分;弥漫性染色覆盖三分之一以上的角膜,记为3分;弥漫性染色覆盖三分之二以上的角膜,记为4分。结果如图1中A图和B图所示。
3角膜痛行为学评估
3.1角膜机械刺激检测
开始试验前,小鼠适应测试环境2小时;测试时,将小鼠轻轻地束缚,使用0.008g和0.02g的von Frey丝垂直刺激小鼠角膜中央,保证每次均达到细丝微微弯曲程度,左右眼各5次,合计10次,每天分上午和下午分别进行0.008g和0.02g的von Frey丝测试实验,记录小鼠出现眨眼反应的百分比。结果如图2中A图和B图所示。
3.2角膜热化学刺激和冷化学刺激检测
开始试验前,小鼠适应测试环境2小时;测试时,为固定小鼠躯体及头部,将小鼠轻轻地束缚,移液枪取2.5μL的2μM辣椒素或2.5μL的200μM薄荷醇,垂直滴入小鼠眼中,避免接触眼表,对小鼠的眨眼次数进行记录,时间限制30s。考虑到哺乳动物对眼部疼痛的反应除了眨眼还有闭眼,将小鼠完全闭眼1S的行为记录为一次眨眼。使用不同试剂进行实验时,两者之间至少间隔30min。结束后使用少量温生理盐水冲洗眼表,并放回原有笼位。结果如图2中C图和D图所示。
4RNA测序
RNA测序及生物学分析由生工生物科技有限公司提供技术支持。具体为:使用NanoDrop2000分光光度计评估RNA纯度和定量。接下来,根据制造商的说明,使用VAHTS通用V6 RNA seq文库制备试剂盒构建文库。使用llumina Novaseq 6000平台获得样品的单读测序读数,并使用HISAT2定位到参考基因组。计算每个基因的FPKM,使用HTSeq计数需要每个基因的读取计数。使用DESeq2进行差异表达基因分析。Q值<0.05,折叠变化>2或折叠变化<0.5被设置为差异基因。使用R(v 3.2.0)对差异基因进行分层聚类分析,以证明不同组中基因的表达模式。结果如图3中A图所示。
5信息学分析
1)将RNA-Seq得到的测序数据进行质量控制检测,随后采用SOAPnuke(v1.5.2)过滤原始数据,去除低质量数据,删除未知碱基比例大于5%的数据;FASTQ形式存储数据;
2)参考华大基因北京基因组研究所建立的数据库BGI,使用Bowtie2(v2.2.5)匹配测序数据;
3)使用Cufflinks软件包的Cuffdiff软件筛选差异表达基因,确定两组间的差异表达基因的标准如下:两样本读数总和≥10,log2RPKM Fold change>1,FDR纠正p值,计算Q值,p≤0.05且Q≤0.05认为表达有显著差异。
4)火山图:获得差异RNA分子列表,使用p=0.05,FC=2作为阈值,使用R包ggplot2对分子的差异信息进行展示。
5)热图:使用DESeq2(v1.30.1)计算差异表达RNA,获得差异RNA分子列表之后,使用R包pheatmap(v1.0.12)对标准化的表达值绘制聚类热图。
6)蛋白互作网络分析:利用相互作用基因检索搜索工具STRING提供蛋白质相互作用的预测和实验信息,该数据库的预测方法来自基因融合、共表达实验、数据库和文本挖掘等。通过设置组合评分>0.4作为可靠性阈值,将基因列表上传后,使用基于web的STRING数据库(http://string-db.org/)产生蛋白互作预测。基于相互作用关系建立蛋白互作网络,采用Cytoscape软件可视化分析结果。计算每个蛋白的连通性程度,即其连接的蛋白数量,以评估其在该网络中的重要性。
6荧光定量PCR
使用诺唯赞RNA提取试剂盒提取总RNA。具体为:使用玻璃研磨器将三叉神经节组织在提取液中研磨裂解,随后通过离心柱法去除gDNA并富集RNA,RNA长期保存于负80℃冰箱备用。取1μg的RNA,根据诺唯赞逆转录试剂盒要求加入随机引物后逆转录为cDNA。cDNA长期保存于负80℃冰箱备用。随后,设计PCR板,每孔取500ngcDNA,根据诺唯赞SYBR GreenRT-qPCR试剂盒说明,加入SYBR Green试剂,正向引物和反向引物,按表1程序进行RT-qPCR,并在BioRad RT-qPCR系统上进行测定。使用GAPDH作为lncRNA的RT-qPCR的管家基因,特异引物的序列见表2。引物合成由中国上海生工生物工程股份有限公司提供技术支持。
表1 RT-qPCR程序
表2引物序列信息
进一步申请人利用RT-qPCR验证高通量测序结果的可靠性,检测了上调差异较大的lncRNA-131434、lncRNA-152461和下调差异较大的lncRNA-208792、lncRNA-141467、lncRNA-Pllp在三叉神经节中的表达水平,如图3中B图和C图所示,lncRNA-131434(lncRNA-434)、lncRNA-152461(lnc-461)干眼症组较对照组显著上调,lncRNA-208792(lnc-792)、lncRNA-141467(lnc-467)、lncRNA-Pllp(lnc-Pllp)干眼症组较对照组显著下调,结果与测序结果基本一致。依据Foldchange>2,FDR<0.01进行排序,对照组三叉神经节中检测测序结果中排序靠前的差异表达lncRNA,其中lncRNA-Pllp丰度值最高,为71.6,lncRNA-Pllp在干眼症组三叉神经节中的表达水平较对照组三叉神经节组织增加了4倍以上,因此申请人最终选择lncRNA-Pllp作为靶标分子进行后续研究。lncRNA-Pllp的序列如SEQ ID NO.1所示。
实施例2:长链RNA-Pllp慢病毒过表达药物的制备:
1.载体构建
以cDNA为扩增模板,PCR扩增目的片段,将扩增产经琼脂糖凝胶电泳验证后切胶纯化。之后将100ng PCDH载体单酶切酶切,接着65℃10min灭活内切酶,加入连接酶将目的片段连至载体,再将连好的载体质粒导入DH5α感受态细胞中,涂板,挑菌鉴定后并放大培养,提取质粒。
2.慢病毒包装
采用三质粒系统进行慢病毒包装,使用LipofectamineTM 2000将核心质粒与PSPAX2质粒、PMD2G质粒按照4μg:3μg:1μg于EP管中室温静置20min,接着混合液加入无血清培养基的HEK293T细胞中,4-6小时后弃去培养基,换成含10%胎牛血清的培养基培养,48h后收取上清,通过0.45μm的滤器过滤到Millipore超滤管中进行离心浓缩,取上清分装后冻存至-80℃超低温冰箱。
实施例3:利用RNA-Pllp抑制剂缓解神经病理性角膜痛实验:
将实施例2中制备的慢病毒药物液体制剂对三叉神经节局部施用,具体为:
三叉神经节立体定位注射
(1)立体定位注射仪校准:滑尺垂直、稳固,螺丝对应数值显示清楚准确。将立体定位仪底座铺一块软性泡沫海绵用以支撑小鼠身体,并且拉开小鼠舌头,颈部自然伸展,保持呼吸道通畅,身体覆盖纱布以保温;
(2)按照前述方法使用0.5%的戊巴比妥钠腹腔注射麻醉,剃毛机剃光小鼠头顶部位毛发;
(3)调整小鼠身体高度与头部一致,使用横杆、耳杆固定小鼠头部,轻按头部时不出现晃动为宜,注意双侧耳杆固定差值不超过1mm以保证小鼠在正中位置;
(3)剪开皮肤,钝性分离皮下筋膜及软组织,3%H
(4)根据前囟调整定位仪X、Y、Z轴读数均为0后,移动Y轴,将微量注射器对准后囟,调整前后囟高度一致,高度差小于0.5mm;
(5)以后囟为原点,参考三叉神经节坐标(X=1.65,Y=2.65,Z=-6.35),双侧颅骨牙科钻钻孔后,将0.5μL注射溶液缓慢匀速下降至设定位置,以0.05μL/min速度缓慢注射,完毕后静止15min,使注射溶液充分浸润三叉神经节组织。
为阐明lncRNA-Pllp对NCP小鼠角膜痛行为学的影响,本申请构建了含卫星细胞GFAP启动子的lncRNA-Pllp过表达病毒,小鼠双侧眶外泪腺切除术致干眼症建立神经病理性角膜痛模型后三叉神经节立体定位注射lenti-GFAP-Pllp过表达慢病毒,图6结果显示注射重组慢病毒后三叉神经节卫星细胞中lncRNA-Pllp表达量特异性上调。
干眼症小鼠双侧三叉神经节立体定位注射慢病毒3天后,行为学测试发现0.008g和0.02g von Frey丝机械刺激角膜痛显著缓解,并维持到注射后第9天(如图7中A图和B图所示)。辣椒素和薄荷醇化学刺激角膜痛亦显著缓解,并维持到注射后第9天(如图7中C图和D图所示)。结果表明特异上调三叉神经节卫星细胞lncRNA-Pllp表达能缓解机械刺激和化学刺激引起的角膜疼痛。
实施例4:由lncRNA-Pllp靶点筛选获得piRNA-X717靶点:
为寻找调节lncRNA-Pllp剪切成熟的piRNA,首先本申请解析了NCP模型小鼠的三叉神经节中的piRNA差异表达谱。双侧泪腺切除后21d,提取三叉神经节RNA行高通量测序,显示,piRNA表达谱发生差异变化。聚类分析后绘制聚类表达情况,见热图分析(图8),红色代表干眼症组较对照组中上调的piRNA,蓝色代表干眼症组较对照组中下调的piRNA。图8中4004-x717即为piRNA-717。
根据ensembl数据库和piRNABank获取未剪切成熟的lncRNA-Pllp前体(pre-lncRNA-Pllp)序列和piRNA-X717序列,通过miRanda(v3.3a)对pre-lncRNA-Pllp(图中为pre-lncPllp)和piRNA-X717的碱基互补进行预测,使用Adobe Illustrator对结果进行可视化展示,绿色和粉色分别对应两个潜在的结合位置,两个区域分别对应lncRNA的第82-116、790-826碱基区域,图中对每个剪切位置的序列进行了标注,其中"|"代表外显子和内含子的连接边界。初步确定了候选piRNA中piRNA-X717与pre-lncRNA-Pllp间存在结合位点。piRNA-X717在NCBI数据库中尚未注释,为本申请新发现的piRNA,其序列为5'-CCUCUCGCGUUGCGUCAGGGGGUGAUGGUGUUUA-3'。如图13所示,信息学分析显示pre-lncRNA-Pllp与piRNA-X717存在两处结合位点:绿色代表结合位点1,粉红色代表结合位点2,长方形框线内为配对碱基互补序列。因此申请人将piRNA-X717作为lncRNA-Pllp上游剪切的目标分子进行后续相关实验。
实施例5:piRNA-X717抑制剂及其角膜痛治疗药物的制备:
按如下序列合成piRNA-X717的反向互补碱基序列作为piRNA-X717抑制剂进行三叉神经节立体定位注射。具体操作同实施例3。
piRNA-X717的反向互补碱基序列:
5'-GGAGAGCGCGAACGCAGUCCCCCACUACCACAAAU-3'
注射前使用无RNA酶ddH
实施例6:利用piRNA-X717抑制剂缓解神经病理性角膜痛实验:
干眼症模型组小鼠双侧三叉神经节立体定位注射piRNA-X717-inhibitor后,进行角膜痛敏行为学检测。如图12所示,注射后1d显著逆转了机械刺激痛觉过敏和化学痛觉过敏,4d时除薄荷醇引起的化学痛敏抑制明显外,机械刺激痛觉敏化和辣椒素引起的化学痛觉敏化相较干眼症+Scr组逆转作用逐渐减弱,机械刺激痛觉过敏和化学痛觉过敏样行为恢复,无统计学意义。
2d后分离三叉神经节组织RNA进行RT-qPCR检测。图11结果显示,干眼症+piRNA-X717-抑制剂组小鼠较干眼症+Scr组piRNA-X717表达显著下降,干眼症+Scr组较对照组+Scr组piRNA-X717表达显著上调。提示,抑制piRNA-X717减轻了NCP诱导角膜痛敏。
荧光定量PCR
使用诺唯赞RNA提取试剂盒提取总RNA。具体为:使用玻璃研磨器将三叉神经节组织在提取液中研磨裂解,随后通过离心柱法去除gDNA并富集RNA,RNA长期保存于负80℃冰箱备用。取1μg的RNA,根据诺唯赞逆转录试剂盒要求加入随机引物后逆转录为cDNA。cDNA长期保存于负80℃冰箱备用。随后,设计PCR板,每孔取500ng cDNA,根据诺唯赞SYBR GreenRT-qPCR试剂盒说明,加入SYBR Green试剂,正向引物和反向引物,按表1程序进行RT-qPCR,并在BioRad RT-qPCR系统上进行测定。使用GAPDH作为lncRNA的RT-qPCR的管家基因,特异引物的序列见表4。引物合成由中国上海生工生物工程股份有限公司提供技术支持。
表3RT-qPCR程序
表4引物序列信息
荧光定量PCR的结果如图9和图10所示。干眼症组的piRNA-X717表达量显著高于对照组。
由技术常识可知,本发明可以通过其它的不脱离其精神实质或必要特征的实施方案来实现。因此,上述公开的实施方案,就各方面而言,都只是举例说明,并不是仅有的。所有在本发明范围内或在等同于本发明的范围内的改变均被本发明包含。
- 长非编码核糖核酸MRAK009713小干扰RNA在制备神经病理痛药物中的应用
- 长非编码核糖核酸uc.48+小干扰核糖核酸在制备糖尿病并发神经病理痛药物中的应用
