促进牡丹籽油积累的PoSTYK基因、载体、重组菌和应用
文献发布时间:2024-04-18 19:58:26
技术领域
本发明属于分子生物学领域,具体得涉及一种促进牡丹籽油积累的PoSTYK基因、载体、重组菌和应用。
背景技术
牡丹(Paeonia suffruticosa Andr.)为芍药科(Paeoniaceae)芍药属(Paeonia)多年生小灌木。牡丹在我国种植历史悠久,始于南北朝,繁荣于隋唐,有着极高的观赏价值、文化价值、药用价值和油用价值。对于油用牡丹的价值研究起源于1997年,油用牡丹是指出油率大于22%的种的统称,目前‘凤丹’和紫斑牡丹是油用牡丹的主要推广品种或种。作为木本油料新兴作物,紫斑牡丹瓣化程度低,具有种子产油高、油质好的特点。‘凤丹’牡丹品系具有花量大、萌蘖少和籽实多的特点。近年来,随着社会发展,人们对食用油的品质提出了更高的要求,营养价值丰富、具有保健效果的牡丹籽油引起了广泛关注,使得油用牡丹成为我国独有的新兴产业。因为牡丹籽油含有丰富的ɑ-亚麻酸、油酸和亚油酸等不饱和脂肪酸,牡丹籽油于2011年获批为新资源食品。与其他常见油料作物相比,牡丹籽油中富含较多的不饱和脂肪酸,含量为92%,其中亚麻酸为38.25%,显著高于其他油料作物。
油质蛋白(Oleosin)是贮油细胞器-油体(Oil bodys,OBs)的主要结构蛋白,能够调控油体的大小、数目以及种子含油量,。前期研究发现油质蛋白OLE-SL可被磷酸化,但其如何被磷酸化以及其磷酸化是否参与调控油体进而调控脂肪酸积累的尚未可知,阐明该科学问题对解析种子油脂积累的调控机理和选育高油牡丹良种具有重要意义。
发明内容
本发明针对上述技术问题提供一种促进牡丹籽油积累的PoSTYK基因
所述基因能够促进种子低分子量油质蛋白(OLE-SL)的磷酸化进而调控牡丹籽油积累。
本发明是通过如下技术方案来实现的:
一种促进牡丹籽油积累的PoSTYK基因,所述基因的核苷酸序列为SEQNO.1。
本发明还提供一种重组载体,所述载体含有所述PoSTYK基因。
本发明还提供一种重组菌,所述重组菌含有所述重组载体。
本发明还提供所述PoSTYK基因的应用,所述应用方法为在牡丹中超表达所述PoSTYK基因,以提高牡丹籽中油体数目。
本发明还提供所述重组载体的应用,所述应用方法为在牡丹中超表达所述PoSTYK基因,以提高牡丹籽中油体数目。
本发明还提供所述重组菌的应用,所述应用方法为在牡丹中超表达所述PoSTYK基因,以提高牡丹籽中油体数目。
本发明与现有技术相比的有益效果:
本发明提供了一种能够促进牡丹籽油积累的PoSTYK基因,所述基因能够促进蛋白OLE-SL的磷酸化进而调控牡丹籽油积累,所述基因在牡丹中超表达能够使超表达株系种子中的油体显著变小,数目增多,表明STYK能够调控油体形态,增加油体数目。
附图说明
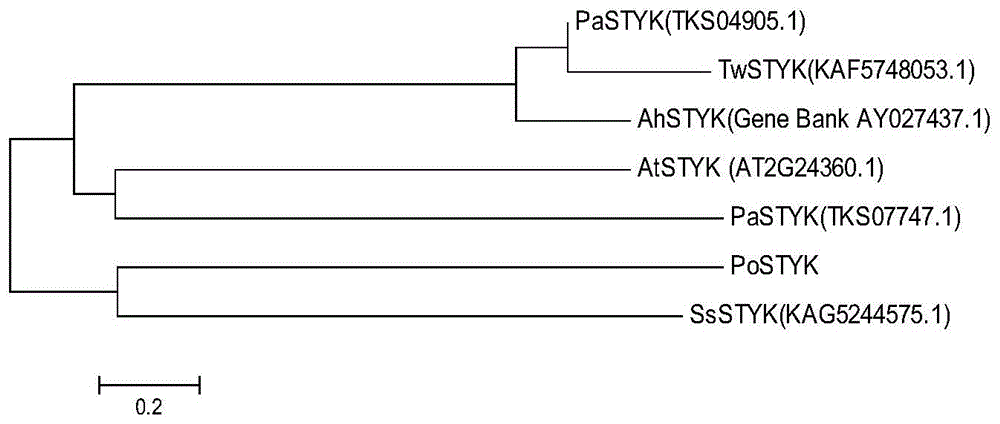
图1为系统发育树图;
图2为PoSTYK基因在‘凤丹’种子不同组织、不同时期的表达模式,其中
a:PoSTYK的组织表达模式图;b:PoSTYK在种子发育过程中的表达模式图,作图数据是三次生物学的平均值±标准差,*代表显著性差异(采用单因素方差进行分析,*:p<0.05,**:p<0.01,***:p<0.001);
图3为PoSTYK-GFP亚细胞定位图;Nile RED:尼罗红染色;GFP:激发荧光;Bright:明场下观察到的结果;Merge:对尼罗红、GFP和明场进行重叠的复合结果;
图4原核表达载体构建结果的凝胶电泳图;M:DL 2000Marker;P:阳性对照,N:阴性对照,a:pGEX-4T-1-PoSTYK ORF扩增;b:pGEX-4T-1-PoSTYK菌液PCR;c:pGEX-4T-1-PoSTYK转化BL21(DE3)菌株菌液PCR(GST);
图5为MBP-OLE-SL和GST-PoSTYK蛋白纯化图;
图6为Pull down鉴定PoSTYK与PoOLE-SL的互作;
图7为体外激酶检测实验a:ATP-剩余标准曲线;b:PoSTYK激酶活性检测;
图8为pBI121-PoSTYK载体构建电泳图谱M:DL 2000Marker;P:阳性;N:阴性;
图9为PoSTYK转基因筛选结果图,a:pBI121-PoSTYK转基因拟南芥筛选;b:pBI121-PoSTYKDNA鉴定;M:DL 2000Marker;c:pSuper1300-PoSTYK qRT-PCR;
图10为PoSTYK转基因拟南芥种子脂肪酸含量变化图,数据是三次生物学的平均值±标准差,*代表显著性差异(采用单因素方差进行分析,*:p<0.05);
图11为OE-PoSTYK油体观察图,a:油体观察;b:油体直径统计;c:油体数量统计Nile RED:尼罗红染色;Bright:明场下观察到的结果;Merge:对尼罗红、和明场进行重叠的复合结果。
具体实施方式
下面通过实施例来对本发明的技术方案作进一步解释,但本发明的保护范围不受实施例任何形式上的限制。
1.供试材料:供试材料为7-8年生的‘凤丹’健壮植株,取自青岛农业大学,将授粉后天数记为处理时间。授粉后30d-120d,每隔10d取样一次,液氮速冻后,置于-80℃冰箱备用,另取根、茎、叶和花用于组织表达分析。
本生烟草(Nicotiana benthamiana)为实验室留存。
拟南芥(Arabidopsis thaliana)哥伦比亚型(Columbia)实验室留存。
PoOLE-SL-GFP超表达株系为实验室留存。
2.常用载体及菌株:大肠杆菌(E.coli)菌株DH5ɑ、农杆菌菌株GV3101、pBI121载体、pSuper 1300-GFP载体、PPR3-N、pSPYCE、PSPYNE73、pGEX4T-1(由植物遗传与发育实验室保存)。
BL21(DE3)、酵母菌株NMY51(购自上海唯地)。
3.主要酶及试剂:限制性内切酶、ApexHF HSDNA聚合酶预混液、EVO M-MLV反转录预混型试剂盒、
LB Broth、LB Broth withAgar、氨苄青霉素、卡那霉素、利福平、乙酰丁香酮、二甲基亚砜、MES。
GST结合缓冲液(购自上海生工)、GST琼脂糖填料(购自上海生工)、GST标签蛋白纯化磁珠(购自上海翌圣)、SDS-PAGE聚丙烯酰胺凝胶试剂盒。
抗生素的配制:
Kan(卡那霉素):称取1g粉末加入ddH
Amp(氨苄霉素):称取1g粉末加入ddH
Rif(利福平):称取1g粉末加入DMSO中溶解定容至20mL,有机滤膜过滤后分装,浓度为50mg/mL。
培养基的配制:
LB液体培养基:称取25g LB broth粉末加入1L ddH
LB固体培养基:称取40g LB broth with Agar粉末加入1L ddH2O,121℃灭菌20min,根据需求加入相应抗生素,倒平板,密封后,4℃保存。
1/2MS培养基:称取15g蔗糖、8g琼脂和2.37g Ms(不含琼脂和蔗糖),加入1LddH
拟南芥侵染液:称取30g蔗糖和4.7g MS加ddH
烟草侵染液:称取2.132g MES、2.033g MgCL
MBP结合缓冲液(1L):Tris-HCL(pH7.4)2.423g、NaCL 11.688g、EDTA 0.146g、β-巯基乙醇0.699mL添加1L超纯水。
5×电泳缓冲液:称取Tris 15g、甘氨酸72g、SDS10g、ddH
转膜缓冲液(1L):称取甘氨酸14.4g、Tris 3.03g、甲醇200mL、ddH
TBST:Tris(pH 7.5)3.08g、NaCl 8.166g、Tween-200.5mL、ddH
MBP裂解缓冲液(100mL):MBP结合缓冲液、DTT、PMSF。
GST裂解缓冲液(100mL):GST结合缓冲液、DTT、PMSF。
MBP洗脱缓冲液(5mL):称取10mg麦芽糖溶解于5mL MBP结合缓冲液。
GST洗脱缓冲液(5mL):称取7.69mg谷胱甘肽溶解于5mL GST洗脱缓冲液。
4.主要仪器
紫外超净工作台、紫外分光光度计、高速冷冻离心机(Heal Force)、移液器(Eppendorf)、荧光实时定量PCR仪、pH测定仪、徕卡激光共聚焦显微镜(Leica TCS-SP2)、恒温光照培养箱。
实施例1PoSTYK的克隆及分析
1.PoSTYK的挖掘与分析
本研究以拟南芥AtSTYK序列为种子序列,利用本地转录组数据库Blast并下载‘凤丹’PoSTYK碱基序列,利用DNAMAN翻译氨基酸序列。使用ExPASy网站在线工具Compute p I/Mw tool对蛋白基本生化特点进行分析。利用TMHMM Server和ProtScale在线分析工具对蛋白亲疏水性进行分析。通过NCBI的BLAST工具获取其他物种STYK序列,利用MEGA 5软件分析蛋白保守序列,并构建Neighbor-joining系统发生进化树。
1.1牡丹种子RNA的提取
牡丹不同时期种子及根、茎、叶、花的总RNA提取参照TaKaRa MiniBEST Plant RNAExtraction Kit试剂盒说明进行。
1.2cDNA的合成
参照Evo M-MLV反转录预混型试剂盒说明书,按照两步法,去除基因组DNA、反转录反应。
2.PoSTYK的表达模式
2.1qRT-PCR引物设计
以泛素基因(ubiquitin)为内参,利用NCBI(https://blast.ncbi.nlm.nih.gov/Blast.cgi)在线设计实时定量引物(表1),由生工(上海)合成。
表1.基因实时定量引物
2.2qRT-PCR反应
根据SYBR GreenPro Taq HS预混型qPCR试剂盒,配制20μL实时定量荧光PCR反应体系,反应体系见表2,设置三个样品重复、三次技术重复。反应在Applied BiosystemsQuant Studio
表2.PCR扩增体系
3.亚细胞定位
3.1 PoSTYK融合表达载体的构建
3.1.1引物设计
利用CE Design V1.04设计PoSTYK基因与pSuper1300(GFP)载体重组的特异性引物,引物序列见表3。
表3.PoSTYK连GFP引物
3.1.2目的基因的扩增、回收
将不同时期‘凤丹’种子的cDNA作为扩增模板,以2×ApexHFFS PCR Master Mix扩增PoSTYK开放性阅读框,参照试剂说明进行扩增反应,并将扩增产物进行凝胶电泳检测。检测条带与目的基因产物大小一致。
对上述条带进行切胶,参照Fast
3.1.3酶切
采用XbaI、KpnI酶切位点对pSuper-1300(GFP)进行双酶切,将混合液置于PCR仪器中37℃保温30min,50℃反应20min。
3.1.4连接
使用ABclonal MultiF SeamLess Assembly Mix对目的基因与上述酶切液进行重组,反应体系如下表4。反应条件为50℃下反应15min。
表4.重组反应体系
3.1.5转化至大肠杆菌DH5ɑ感受态
(1)从-80℃冰箱中取出DH5ɑ感受态,置于冰上融化;
(2)将10μL重组质粒用移液枪转移至DH5ɑ感受态;
(3)冰浴30min,42℃45sec;
(4)加入800μL不含抗生素的LB液体培养基;
(5)将转化后的菌液放入37℃摇床,设置转速为200rpm复苏60min;
(6)将上述菌液5000rpm离心30sec,留50μL上清重悬后涂布到含Kan的LB固体培养基上过夜培养。
3.1.6菌液PCR、提取质粒
挑取单克隆进行培养,对浑浊的菌株进行PCR鉴定,将阳性条带对应菌株送测序比对序列,将与PoSTYK序列比对一致的序列对应的菌株过夜扩大培养,提取重组质粒。
3.1.7转化至农杆菌GV3101感受态
(1)从-80℃冰箱中取出GV3101感受态,置于冰上融化;
(2)吸取10μL上述质粒转移至GV3101感受态;
(3)冰浴5min、液氮5min、37℃水浴5min、冰浴5min;
(4)加入800μL不含抗生素的LB液体培养基,将转化菌液放入28℃摇床,设置转速为200rpm,复苏2-3h;
(5)5000rpm离心30sec,留50μL上清重悬后涂布到含Kan+Rif的LB固体培养基上,倒置培养72h;
(6)挑取单菌落进行菌液PCR,对扩增产物进行凝胶电泳检测,选取与目的条带大小一致的菌液进行保菌。
3.2本生烟草的准备
(1)在经过杀菌的超净工作台中,在装有烟草种子的EP管中加入100μL次氯酸钠和900μL的吐温水;
(2)放于37℃摇床中,200rpm,振荡1h;
(3)在EP管中加入吐温水,手摇振荡,清洗6次,每次2min;
(4)加ddH
(5)4℃培养3-5天,光照培养一周左右得到幼苗;
(6)幼苗移栽后覆保鲜膜,一周后揭膜,注意浇水和施肥,培养3周左右即可进行后续遗传转化实验。
3.3本生烟草的瞬时表达
将含有GFP-PoSTYK重组质粒的农杆菌、保护菌P19进行扩摇,测定OD值至0.6-0.8,4000rpm离心5min用侵染液重悬,测定OD值0.6-0.8,将上述两种菌按1:1的比例进行配比后,静置2h,对三周龄的烟草进行遗传转化,用无菌注射器注射烟草下表皮,暗处理1d,光处理3d。
3.4激光共聚焦显微镜观察
在载玻片中央滴一滴清水,撕取烟草下表皮展在清水中,滴加5μg/mL的尼罗红染液对其染色。用蒸馏水冲洗后将盖玻片从一侧盖上,用滤纸从一侧吸出多余的水分,制作成临时装片。用特定激发波长对装片进行观察。
4.Pull down验证PoSTYK与PoOLE-SL互作
4.1载体构建
利用CE Design V1.04设计PoSTYK基因与pGEX4T-1(GST)、pMAL-c5x(MBP)和pET28ɑ(His)载体重组的特异性引物,引物序列见下表5。利用所述引物进行PCR扩增,PCR反应体系见表6,反应程序见表7,扩增产物进行琼脂糖凝胶电泳并回收目的基因。
表5为引物序列
表6.PCR反应体系
表7.重组反应反应程序
采用EcoR I和Xho I酶切位点对pGEX4T-1(GST)进行双酶切,采用Nde I和EcoR I酶切位点对pMAL-c5x(MBP)进行双酶切,采用Xba I和Xho I对pET28ɑ(His)进行双酶切,将混合液置于PCR仪器中37℃反应30min,50℃反应20min。连接,大肠杆菌遗传转化。
4.2转化BL21(DE3)菌株
取出BL21(DE3)菌株冰上融化;用移液器吸取10μL重组质粒转移至BL21(DE3)中;冰浴30min,42℃45sec;加入800μL不含抗生素的LB液体培养基;设置摇床温度为37℃转速为200rpm,摇床中复苏60min。将上述菌液5000rpm离心30sec,留50μL上清重悬后涂布到含Kan的LB固体。
4.3融合蛋白表达与纯化
(1)将-80℃中保存的含GST-STYK融合载体的BL21菌株小摇30mL菌于37℃,200rpm,4h培养至饱和;
(2)取10mL菌液加入300mL LB+Amp培养基,设置摇床温度为37℃,转速设置为200rpm,培养2h,OD
(3)加入0.4mM IPTG过夜诱导,按照诱导条件(IPTG浓度0.4mM、诱导时间12h、温度16℃、120rpm)进行诱导;
(4)打开离心机预冷至4℃,设置转速为5000rpm离心5min收集菌体,用预冷的GST结合缓冲液洗菌3次,每次5mL;
(5)加入15mL GST裂解缓冲液(含1mM PMSF、1mM DTT现用现配(重悬菌体;
(6)超声破碎菌体:探头深入液面1/3处,保持冰浴;按照设置(超声4sec,间隔6ecs,共50次,40%,8min)操作;
(7)超声后将菌液装到50mL的离心管中,在4℃下,离心机转速设置为10000rpm,离心30min;
(8)留取超声后上清及沉淀跑胶检测;
(9)平衡GST结合树脂:新的蛋白纯化柱用5mL双蒸水润湿;用2mL的结合缓冲液润洗一次;将蛋白纯化柱的底部堵住先加入2mL结合缓冲液,后加入200μL的GST琼脂糖凝胶,去掉底部的堵塞物,结合缓冲液从GST琼脂糖凝胶中滤出,再加入2mL的结合缓冲液,过滤,重复2次;
(10)超声后离心,将上清液收集到新的离心管中,过柱结合珠子,上样量每次不超过3mL,收集流穿液再过柱一次,所有过程都在4℃进行;
(11)倒掉收集液,堵住,用2mL结合缓冲液洗柱子,重复4次,堵住,倒收集液;期间配置洗脱液;
(12)加GST洗脱液1mL(现用现配),冲起树脂,静置15min,吸取上清再次吹起树脂,静置15min,拔开,收集液体至超滤浓缩管,离心至100μL;
(13)在纯化后的蛋白中加入10%的甘油,置于-80℃保存。
4.4互作分析
(1)取100μL磁珠加入500μL PBS缓冲液平衡磁珠,吹打混匀后的EP管置于磁力架上,重复两次,将含有GST标签诱饵蛋白的样品加入到备好的磁珠中,颠倒混匀。将离心管置于水平摇床上,室温孵育60min;
(2)将孵育后的离心管置于磁分离器,1min,待溶液变澄清后,用移液器移出上清液,保留,以备取样检测。向离心管中加入5倍悬浮液体积的洗杂液,使用枪头反复吹打5-10次,将离心管置于磁分离器上,大约1min,待溶液变澄清后,用移液器吸弃上清液。重复上述步骤2次。得到GST诱饵蛋白-磁珠复合物;
(3)目标蛋白与诱饵蛋白-磁珠复合物结合。将含有目标蛋白的样品加入到处理好的诱饵蛋白-磁珠复合物中,颠倒混匀。将离心管置于混合仪上,室温孵育60min;
(4)洗杂。将离心管置于磁分离器,大约1min,待溶液变澄清后,用移液器移出上清液,保留,以备取样检测。向离心管中加入5倍悬浮液体积的洗杂液,使用枪头反复吹打5-10次,将离心管置于磁分离器上,大约1min,待溶液变澄清后,用移液器吸弃上清液。重复上述步骤2次;
(5)目的蛋白的洗脱在上述离心管中加入3-5倍磁珠体积的洗脱液,用移液器吹打5次,然后在室温下置于翻转混合仪或者手工轻轻翻转离心管,5-10min后,置于磁分离器上,大约1min,待溶液变澄清后,吸取上清液,收集洗脱组分,即得到靶蛋白和目标蛋白复合物。再重复操作两次,分别收集洗脱组分,留待检测;
4.5进行SDS-PAGE凝胶电泳。
(1)提前预冷转膜缓冲液,电泳结束后,用Bio-Rad湿转转印仪将蛋白转印至PVDF膜上(膜预先用甲醇浸泡5min),转印时从负极到正极依次是:湿转夹(黑色)→海绵垫→滤纸→SDS-PAGE胶→PVDF膜→滤纸→海绵垫→湿转夹(白色),确保各层之间没有气泡,恒压100V,转膜时间60min,转膜过程始终在低温进行。
(2)将转膜完毕的PVDF膜放入含5%脱脂牛奶的封闭液中(40mL TBST缓冲液中加入2g脱脂奶粉),室温封闭2h。
(3)弃去封闭液,将一抗按具体实验所需比例稀释到TBST中,PVDF膜4℃过夜。弃去一抗,用TBST洗3次,每次15min。
(4)用TBST将辣根过氧化物酶标记的山羊抗小鼠二抗按1:5000比例稀释,PVDF膜室温孵育1h。
(5)弃去二抗,用TBST洗涤3次,每次15min。
(6)用上海生工公司的ECL试剂盒中的增强液和发光液按1:1混合,均匀涂于PVDF膜带有蛋白的一面上,显色5-10min,吸去膜边缘多余的液体,活体荧光成像仪曝光。
4.6 PoSTYK磷酸化PoOLE-SL
(1)取出-80℃中储存的STYK激酶与OLE-SL蛋白,置于冰上融化。样品检测前需平衡至室温,并混匀。
(2)ATP标准曲线设置:设置0、1、2、4、8、16、32、64、128、200μM标准品孔,每孔50μl。
(3)ATP用激酶反应缓冲液稀释。将反应物置于30℃水浴锅中,孵育30min。
(4)在样品孔和标准品孔中,加入50μl Kinase-Lumi
(5)室温反应10min,用多功能酶标仪进行化学发光检测。
(6)根据标准曲线计算出样品孔中剩余的ATP量,随后根据酶活力的定义计算出酶活性。
5结果与分析
5.1PoSTYK的克隆及分析
从模式植物拟南芥网站TAIR(https://www.arabidopsis.org/cgi-bin/Blast/TAIRblast.pl)查找到AtSTYK(AT2G24360),在本地转录组数据库中Blast,并获得‘凤丹’PoSTYK的序列。设计特异性扩增引物,以各时期‘凤丹’种子cDNA混样为模板,克隆到了一个PoSTYK的基因,全长1251bp。与本地PoSTYK参考序列数据进行比对,结果显示克隆序列与本地PoSTYK序列一致,仅有一处位点发生突变,说明成功克隆到PoSTYK基因。
在NCBI中查找到了不同的物种的STYK,并与PoSTYK进行了多序列比对,构建了系统发育树(图1),PoSTYK与SsSTYK聚在一起,同源性较高。通过NCBI中BLASTP对PoSTYK蛋白进行保守结构域分析,结果显示PoSTYK具有STKc_MAP3K-like保守结构域,属于PKc激酶家族的成员。
5.2PoSTYK在‘凤丹’中的时空表达分析
利用实时荧光定量PCR对根、茎、叶、花和种子中PoSTYK基因的表达量进行了检测,结果显示PoSTYK基因在‘凤丹’种子和茎中的表达量较高(图2中的a)。然后,检测了‘凤丹’不同发育时期种子中PoSTYK的表达,发现随着‘凤丹’种子的发育PoSTYK的表达如图2中的b所示,这与前期鉴定的PoOLE-SL表达趋势基本一致。
5.3亚细胞定位
尼罗红是一种能够将油脂染色的荧光染料,因此可以用来观察油体的位置、形态和大小。PoSTYK-GFP融合蛋白的亚细胞定位结果显示,绿色荧光(PoSTYK-GFP)与红色荧光(尼罗红染色油体)相重合,而对照组中GFP填充了整个细胞,表明PoSTYK能够与油体共定位(图3)。而油质蛋白PoOLE-SL是油体的结构蛋白,位于油体表面,因此PoSTYK与PoOLE-SL存在共定位,有相互作用的基础条件。
5.4pull down鉴定PoSTYK和PoOLE-SL的互作
本实验利用Pull down技术进行验证,设计融合蛋白相关引物,进行琼脂糖凝胶电泳检测,得到与PoSTYK序列大小一致的产物后进行回收(图4中的a),双酶切GST载体,将产物使用同源重组酶进行连接,构建GST-PoSTYK重组载体,连接产物转化DH5ɑ感受态。挑取长势良好的大肠杆菌进行PCR鉴定(图4中的b),将阳性条带对应的菌株送测序。提取序列正确的重组质粒转BL21(DE3)菌株,挑取单菌落进行PCR鉴定(图4中的c)。
5.5GST-PoSTYK蛋白诱导纯化
将含有PoSTYK-GST重组质粒的BL21菌株进行扩大培养,按照1:30的比例将菌液加入至含有Amp的LB液体培养基中,培养至OD值为0.6-0.8。GST-PoSTYK(分子量为72.3kDa)在16℃12h 150rpm的条件下,采用0.4mM IPTG诱导融合蛋白表达量。将诱导后的菌株按照离心集菌、洗杂、超声破碎、离心、过GST琼脂糖凝胶和洗脱,MBP-OLE-SL按照前期条件进行纯化。对GST-PoSTYK和MBP-OLE-SL进行SDS-PAGE检测纯化(图5)。
5.6GST Pull down验证PoSTYK与PoOLE-sl之间的互作
本实验采用体内实验鉴定和验证了PoSTYK和PoOLE-SL的互作,现采用体外GSTPull down实验验证两者间的互作。如图6所示,GST和GST-STYK分别与MBP-OLE-SL孵育后,混合液经GST吸附柱后吸附纯化后,转至PVDF膜上,先后按GST抗体、MBP抗体和HRP GoatAnti-mouse IgG(H+L)对膜孵育杂交。GST与MBP-OLE-SL共同孵育的泳道中,仅检测到GST,没有检测到MBP-OLE-SL;GST-STYK与MBP-OLE-SL共同孵育的泳道中,既检测到了GST-STYK,也检测到了MBP-OLE-SL(图6),表明PoSTYK与PoOLE-SL之间存在互作。
5.7PoSTYK磷酸化PoOLE-SL的鉴定
PoOLE-SL在拟南芥中能够被磷酸化,利用BIFC、酵母双杂交和Pull down实验证明PoSTYK能够与PoOLE-SL互作,推测PoSTYK作为激酶能够磷酸化PoOLE-SL,因此利用体外激酶检测实验对PoSTYK能否磷酸化PoOLE-SL进行鉴定。在纯化后的GST-PoSTYK和PoOLE-SL原核表达蛋白中,加入激酶缓冲液,孵育后借助酶标仪读取数据。激酶在反应过程中,可将ATP的磷酸基团转移至底物的羟基上,从而使ATP变成ADP,根据ATP的减少量来定量激酶的活性,借助荧光素酶催化荧光素来检测激酶活性。以PoOLE-SL为底物,建立“剩余ATP-荧光素荧光”标准曲线(图7中的a),然后进行组合实验,结果显示与单独的OLE-SL和PoSTYK相比,PoSTYK和OLE-SL共同孵育后的溶液中添加荧光素酶,荧光显著较低,表示ATP的消耗量增加(图7中的b),该结果说明PoSTYK具有激酶活性,并且能够磷酸化PoOLE-SL。
实施例2PoSTYK的功能鉴定
1.PoSTYK转基因拟南芥功能鉴定
1.1构建pBI121-PoSTYK超表达载体
1.1.1设计引物
设计pBI21-PoSTYK的无缝克隆引物(表8.)对PoSTYK的开放阅读框进行扩增,构建超表达载体。参照试剂说明进行扩增反应,并将扩增产物进行凝胶电泳检测,回收目的基因。
表8.PoSTYK连接pBI121载体所需引物
1.1.2酶切
采用Xba I和Sma I酶切位点对pBI121载体进行双酶切,将混合液置于PCR仪器中37℃反应30min,50℃反应20min。
1.1.3连接
使用ABclonal MultiF SeamLess Assembly Mix对目的基因与上述酶切液进行重组,反应体系如下表9。反应条件为50℃下反应15min。
表9.重组反应体系
1.1.4转化至大肠杆菌DH5ɑ感受态
从-80℃冰箱中取出DH5ɑ感受态,置于冰上融化;将10μL重组质粒用移液枪转移至DH5ɑ感受态;冰浴30min,42℃45sec;加入800μL不含抗生素的LB液体培养基;将转化后的菌液放入37℃摇床,设置转速为200rpm复苏60min;将上述菌液5000rpm离心30sec,留50μL上清重悬后涂布到含Kan的LB固体2.4.1.6菌液PCR、提取质粒培养基上过夜培养。
挑取单菌落于1.5mL离心管中进行培养,以此菌液为模板进行PCR扩增。对扩增产物进行凝胶电泳检测,将有条带的菌液送上海生工进行测序。比对序列,将序列结果正确的菌株扩摇并提取质粒,转化农杆菌(同实施例1中),
1.2农杆菌介导转化拟南芥
准备野生型拟南芥(同实施例1中),将含有pBI121-PoSTYK的农杆菌扩摇至OD0.6~0.8,4000rpm,离心10min,配置侵染液(MS、蔗糖、琼脂、Sweet-L77、蒸馏水)将离心后的菌体重悬,重悬后的菌体调节OD
1.3转基因阳性株系鉴定
利用蘸花法侵染两次的拟南芥,3-4周后收获T
DNA提取
(1)取植株新鲜叶片置于液氮中充分研磨,研磨至细粉状;
(2)加入400μL溶液PA和5μL的巯基还原剂,颠倒混匀,静置10min;
(3)加入140μL组分PB,颠倒混匀后,12000rpm,离心10min;
(4)将上清转移至含等体积组分PC的EP管中,颠倒混匀,加入混合液1/2体积的无水乙醇,充分混匀;
(5)将上述混合液加入吸附柱,离心5min,弃废液;
(6)加入含无水乙醇的漂洗液,12000rpm,离心1min;
(7)重复步骤6,12000rpm,空离2min;
(8)室温静置10min,更换收集管,加入预热的洗脱液,室温静置5min,12000rpm,离心2min。
1.4表型观察及qRT-PCR分析
1.4.1种子油分测定
(1)称取一定量的种子研磨干燥粉7-11mg,加入0.2mL的氯仿/甲醇(2:1,V/V),再加入0.3mL的HCl/MeOH(5%,V/V),加入250μg十三酸甲酯,(补充加入十九酸为第二个内标)作为内标,之后于85℃加热1h;
(2)用1mL正己烷在室温提取甲酯化产品1h;
(3)将正己烷提取物稀释10倍以后用于GC定量。
1.4.2种子油体观察
(1)将转基因种子转移至1.5mL EP管中,加入ddH
(2)借助解剖镜剥去中种皮,露出圆白的胚;
(3)用5μg/mL的尼罗红进行染色,37℃染色30min,每隔10min上下颠倒一次,充分染色;
(4)PBS(10mM)清洗拟南芥的胚3-4次;
(5)制作临时装片,用60%的甘油封片;共聚焦显微镜下在530nm波长下观察。
2.PoSTYK功能鉴定
2.1超表达载体的构建
利用特异性引物扩增PoSTYK序列,并进行凝胶电泳检测,电泳结果显示目的条带大小符合预期(图8中的a)。按照无缝克隆方法,将目的条带与载体连接后转化DH5ɑ大肠杆菌菌株,然后将转化完成的DH5ɑ涂布在含有抗生素的平板上,选取生长良好的单克隆菌株。为避免出现空载体自连的菌株,进行PCR鉴定,选择目的条带大小与PoSTYK相符的菌株送公司测序(图8中的b),将测序结果与目的序列进行比对,确认克隆无误。然后,提取重组质粒并转化至农杆菌GV3101菌株,将菌株涂布至含有Kan和Rif的培养基上,挑取单克隆菌株进行PCR鉴定,筛选出阳性菌株(图8中的c)。
2.2转基因拟南芥的获得
利用蘸花法对拟南芥进行农杆菌侵染后,收集侵染后的种子。采用含有Kan抗生素的1/2MS培养基进行筛选,培养皿中大部分的幼苗叶片白化,随着时间的增长幼苗枯萎,只有少数幼苗能够在筛选培养基上茁壮成长(图9中a)。为进一步鉴定是否为假阳性植株,取幼嫩莲座叶提取DNA,PCR扩增后进行凝胶电泳,含有目的条带的为阳性植株(图9中的b)。
由农杆菌介导的转化实验包括两方面:一是外源基因的整合,二是外源基因的稳定表达。外源基因的表达通常受到多种因素的影响,因此外源基因转化成功后还需要对其表达水平进行检测,采用实时荧光定量PCR技术可以对转基因植株的表达水平进行检测。取转基因和野生型株系幼嫩叶片提取RNA,反转录后得到cDNA并进行实时荧光定量PCR检测。结果显示,与野生型株系相比,转基因株系的PoSTYK表达量显著上升。
2.3转基因拟南芥种子的油分测定
选择野生型以及转基因株系3、11和14(图9中的c),通过GC-MS进行种子脂肪酸含量测定,发现转PoSTYK基因种子中软脂酸(C16:0)、(C16:1)、硬脂酸(C18:0)、油酸(C18:1)、亚油酸(C18:2)、ɑ-亚麻酸(C18:3)、花生一烯酸(C20:1)、花生二烯酸(C20:2)、γ-亚麻酸(C20:3)和芥酸(C22:1)均有不同程度的提高,其中花生一烯酸和总脂肪酸含量均显著提高(图10)。
为进一步研究PoSTYK在种子脂肪酸积累中的作用,对转基因株系和野生型种子进行尼罗红染色,并在激光共聚焦显微镜下观察。结果显示,与野生型株系相比,超表达株系种子中的油体显著变小,数目增多(图11),表明STYK能够调控油体形态,增加油体数目。而前人研究表明,油体形态和大小主要由油质蛋白直接调控,因此此结果为STYK与OLE的互作提供了作证。
PoSTYK的核苷酸序列:
ATGATTGGAAAAATGGTGGACGGTTCAAAATTCCCCGGAATTATAGGTCAC
AATAATAATAATGAAAACAATTACTATGATTTCACACAAGGGTTTTACCAAA
AACTGGGTGAGGGTTCAAACATGTCCATCGACAGTTTGCAGACTAGCAAT
GCCGGTGGGTCAGTTTCAATGTCTGTGGATAACAGTAGCGTTGGGTCGAAT
GATTCCCTAACACATATCTTAAGCCACCCAGGACTAAAGCCCGTGAGCCAC
AATTTTTCTGTAGGGCACAGTGTTCTGCGTCCAGGAAAGGTCACCCATGCA
CTAAATGATGATGCTTTGGCACAAGCACTGATGGATAGTAGATATCCAACTG
AGGGTTTAGAAAATTATGATGAATGGACAATCGATTTGAGGAGGCTTAATAT
GGGGATGGCTTTTGCACAAGGAGCTTTTGGGAAACTATACAGAGGGACAT
ACAATGGTGAAGATGTGGCAATTAAGATTCTGGAAAGGCCTGAGAACAGT
GCGGAGAAGGCTCAGTTTATGGAGCAACAGTTCCAGCAAGAAGTGATGAT
GTTGGCGACGTTGAAGCATAGGAACATTGTTCGGTTTATTGGAGCTTGTCG
CAAGCCCTTAGTTTGGTGTATTGTTACGGAGTATGCTAAGGGAGGTTCAGT
TAGGCAGTTTTTGAACCGGAGGGAAAATAGGGCAGTGCCATTGAAATTGG
CAGTTAAACAGGCTCTTGATGTTGCGAGGGGCATGGCATATGTGCATGGAC
TCGGGTTCATTCACAGGGATTTGAAGTCAGATAACCTTTTAATTTCTGCTGA
TAAGTCCATAAAAATTGCAGATTTTGGTGTTGCCCGGATTGAGGTTCAAAC
AGAAGGAATGACGCCCGAGACAGGGACATACCGCTGGATGGCTCCGGAAA
TGATACAACACAGGCCTTACACACAAAAAGTAGATGTTTATAGCTTTGGGA
TAGTGCTGTGGGAGCTCATTACAGGTTCGCTGCCCTTTCAGAACATGACAG
CCGTTCAGGCAGCATTTGCTGTGGTGAACAAGGGCGTCCGACCCATCATCC
CGAGCGACTGTCTCCCTGTGCTCGCCGAGATCATGACTCGTTGCTGGGATG
CCAACCCTGAAGTCCGCCCACCTTTTGCTGAAATTGTCACCATGCTGGAGA
ATGCAGAGGTGGAGATACTGACAACTGCACGCAAAGCAAGATTCAGGTGT
TGCATTACTCAGCCAATGACAACCGACTGA。
- 一种台湾金线莲的苯丙氨酸解氨酶及其编码基因、重组载体、重组工程菌及应用
- 一种福建金线莲的苯丙氨酸解氨酶及其编码基因、重组载体、重组工程菌及应用
- 蛋白质及基因的应用、以及重组载体、表达盒、重组菌及构建方法
- 一种Nucyep酶的编码基因、重组表达载体、重组工程菌及其制备方法和应用
- 一种7β-羟基类固醇脱氢酶突变体、编码序列、重组表达载体、基因工程菌及应用
- 一种促进不结球白菜开花的基因及其载体、重组菌和应用
- 一种促进不结球白菜开花的基因及其载体、重组菌和应用
