线粒体向淋巴器官中的移植以及用于该移植的组合物
文献发布时间:2023-06-19 11:14:36
技术领域
本发明提供用于线粒体向淋巴器官中的单离和移植的方法、使用本说明书中记载的方法制备的细胞组合物、以及用于制造本说明书中记载的细胞的方法。
背景技术
线粒体功能障碍、例如呼吸链复合物的障碍是线粒体疾病和衰老的重要原因。线粒体功能的降低对于与线粒体疾病和衰老相关疾病有关的多个主要器官的细胞产生影响。此外,线粒体的功能缺陷对免疫活性细胞的能量代谢产生影响。例如,参与天然免疫的单核细胞系巨噬细胞、树突细胞的能量主要依靠不依赖于线粒体的无氧糖酵解。另外还表明,记忆T细胞和调节性T细胞经由脂肪酸氧化而依赖于氧化磷酸化(OXPHOS)。此外,衰老所伴随的T细胞功能的降低被报道为所谓免疫老化的典型征兆。
发明内容
本申请致力于通过线粒体的单离和移入来增强或改善胸腺等淋巴器官的功能的尚未实现的需求。此外,本发明致力于有关单离线粒体向贴壁细胞和悬浮细胞两者中的移植的尚未满足的需求。
根据本发明,在Ndufs4敲除小鼠中确认到胸腺的萎缩和获得性免疫系统细胞的减少。Ndufs4是编码线粒体的呼吸链复合物I的亚基的基因,该基因异常导致线粒体的呼吸链复合物I的功能丧失。与此相对,对胸腺局部给药线粒体时,得到了线粒体广泛分布于胸腺组织中的结果。胸腺是与获得性免疫系统细胞的发达有关的重要器官。特别是T细胞,在胸腺中产生,并在胸腺中成熟。因此,认为对胸腺给药线粒体至少部分地减轻特别是由T细胞的异常引起的获得性免疫异常。
在一些方式中,本发明的方法包括将完整的外源性线粒体移植至受体细胞中的步骤,该步骤包括:(a)对从供体细胞单离出的线粒体进行纯化的步骤;(b)以足以生成表达膜转运序列的单离出的线粒体的时间将包含膜转运序列的一种以上肽与单离出的线粒体进行共培养的步骤;和(c)将表达膜转运序列的单离出的线粒体移植至受体细胞中的步骤。在一些方式中,一种或两种以上肽可以包含作为细胞膜穿透肽、线粒体膜融合肽或这两者的膜转运序列。
在一些方式中,一种或两种以上肽为肽复合物。在一些方式中,肽复合物包含肽和脂质。在一些方式中,脂质结合在肽的N末端。在一些方式中,脂质结合在肽的C末端。在一些方式中,脂质能够将肽埋入线粒体膜中。
一些方式进一步包括将单离出的线粒体与一种以上部分进行共培养。在某一方式中,一种或两种以上部分包含聚乙二醇。在某一方式中,一种或两种以上部分包含核酸适配体。
一些实施方式进一步包括在单离线粒体之前使来自供体细胞的线粒体活化。在一些实施方式中,线粒体的活化使用包封有化学物质的线粒体靶向载体(例如MITO-Porter)来进行。在某一实施方式中,化学试剂选自由辅酶Q10(CO-Q-10)、白藜芦醇、烟酰胺核糖、N-乙酰半胱氨酸、α-生育酚、ω-3脂肪酸、葡糖胺、肌酸一水合物、乙酰左旋肉碱、表儿茶素、檞皮素、自噬诱导剂和细胞凋亡抑制剂组成的组。辅酶Q10可以为还原型。
在一些方式中,供体细胞来源于可以包括胸腺、脾脏、淋巴结、心脏、肺、胰脏、肝脏、皮肤、肾脏、血液、肌肉或淋巴管的器官。在一些方式中,供体细胞选自由成纤维细胞、肝细胞、血小板、肌细胞和诱导多能干细胞(iPSC)组成的组。在一些方式中,供体细胞包括自体或同种异系的细胞。
在一些实施方式中,受体细胞为来源于包括胸腺、脾脏、淋巴结、心脏、肺、胰脏、肝脏、皮肤、肾脏、血液、淋巴管、眼、鼻或耳的器官的细胞。在一些方式中,受体细胞为诱导多能干细胞(iPSC)。在一些方式中,受体细胞来源于具有衰老相关疾病的宿主。在一些方式中,受体细胞来源于衰老的宿主(例如,40岁以上的宿主、45岁以上的宿主、50岁以上的宿主、55岁以上的宿主、60岁以上的宿主、65岁以上的宿主和70岁以上的宿主)。在一些方式中,受体细胞来源于具有线粒体疾病的宿主。在一些实施方式中,受体细胞为选自由胸腺、脾脏、淋巴结、心脏、肺、胰脏、肝脏、皮肤、肾脏、血液、骨髓、滑膜、淋巴管、脑、眼、鼻和耳组成的组中的器官(例如完整器官)中的细胞。
一些实施方式进一步包括在体内实施移植。在一些方式中,在体内实施移植包括线粒体靶向载体(例如MITO-Porter)。在一些方式中,线粒体靶向载体(例如MITO-Porter)包含结合在线粒体靶向载体(例如MITO-Porter)的表面的一种或两种以上肽。在一些方式中,结合在线粒体靶向载体(例如MITO-Porter)的表面的一种或两种以上肽与用于与单离出的线粒体进行共培养的一种或两种以上肽相同。在一些方式中,线粒体靶向载体(例如MITO-Porter)包含选自由CO-Q-10、白藜芦醇、烟酰胺核糖、N-乙酰半胱氨酸、α-生育酚、ω-3脂肪酸、葡糖胺、肌酸一水合物、乙酰左旋肉碱、表儿茶素、檞皮素、自噬诱导剂和细胞凋亡抑制剂组成的组中的至少一种化学试剂。
在一些方式中,移植对选自由心脏、肝脏、耳、眼、胸腺、脑、肺、内皮细胞、淋巴结、骨髓、血液、淋巴管、鼻、脾脏和滑膜组成的组中的器官进行。在一些方式中,移植对选自由胸腺、脾脏和骨髓组成的组中的器官进行。在一些方式中,移植对初级淋巴组织进行。在一些方式中,移植对次级淋巴组织进行。作为初级淋巴组织,可以列举骨髓和胸腺,作为次级淋巴组织,可以列举脾脏、淋巴结和派氏结。
在一些方式中,移植使用介入放射学(IVR)-计算机断层摄影(CT)来进行。在具体的实施方式中,IVR-CT为X射线CT。
在一些方式中,移植通过胸腺内注射来进行。
一些实施方式进一步包括使用移植后支持。
在一些实施方式中,移植后支持包括适当的身体运动或规定的呼吸方法。
在一个方式中,提供使用本说明书中提供的方法制备的细胞组合物。
在另一方式中,提供制造使用本说明书中记载的方法中的任意一种方法制备的细胞的方法。
另外,本发明中还可以提供以下的发明。
[1]一种将完整的外源性线粒体移植至受体细胞中的方法,其包括下述步骤:
(a)对从供体细胞单离出的线粒体进行纯化;
(b)以足以生成表达膜转运序列的单离出的线粒体的时间将单离出的线粒体与包含膜转运序列的一种以上肽进行共培养;
(c)将表达膜转运序列的单离线粒体移植至受体细胞中。
[2]如上述[1]所述的方法,其中,包含膜转运序列的一种以上肽选自由细胞膜穿透肽和线粒体膜融合肽组成的组。
[3]如上述[1]或[2]所述的方法,其中,一种以上肽为肽复合物。
[4]如上述[3]所述的方法,其中,肽复合物包含肽和脂质。
[5]如上述[4]所述的方法,其中,脂质结合在肽的N末端。
[6]如上述[4]所述的方法,其中,脂质结合在肽的C末端。
[7]如上述[4]~[6]中任一项所述的方法,其中,脂质能够将肽埋入线粒体膜中。
[8]如上述[1]~[7]中任一项所述的方法,其中,进一步包括将单离线粒体与一种以上部分进行共培养。
[9]如上述[8]所述的方法,其中,一种以上部分包含聚乙二醇。
[10]如上述[8]所述的方法,其中,一种以上部分包含核酸适配体。
[11]如上述[1]~[10]中任一项所述的方法,其中,进一步包括在单离上述线粒体之前使来自上述供体细胞的上述线粒体活化。
[12]如上述[11]所述的方法,其中,使线粒体活化的步骤使用包封有化学物质的线粒体靶向载体(例如MITO-Porter)来进行。
[13]如上述[12]所述的方法,其中,上述化学试剂选自由CO-Q-10、白藜芦醇、烟酰胺核糖、N-乙酰半胱氨酸、α-生育酚、ω-3脂肪酸、葡糖胺、肌酸一水合物、乙酰左旋肉碱、表儿茶素、檞皮素、自噬诱导剂和细胞凋亡抑制剂组成的组。
[14]如上述[1]~[13]中任一项所述的方法,其中,供体细胞来源于选自由胸腺、脾脏、淋巴结、心脏、肺、胰脏、肝脏、皮肤、肾脏、血液、肌肉和淋巴管组成的组中的器官。
[15]如上述[1]~[14]中任一项所述的方法,其中,供体细胞选自由成纤维细胞、肝细胞、血小板、肌细胞和诱导多能干细胞(iPSC)组成的组。
[16]如上述[1]~[15]中任一项所述的方法,其中,供体细胞包括自体产生的细胞或同种异系的细胞。
[17]如上述[1]~[16]中任一项所述的方法,其中,受体细胞为来源于选自由胸腺、脾脏、淋巴结、心脏、肺、胰脏、肝脏、皮肤、肾脏、血液、淋巴管、眼、鼻和耳组成的组中的器官的细胞。
[18]如上述[1]~[17]中任一项所述的方法,其中,受体细胞为诱导多能干细胞(iPSC)。
[19]如上述[1]~[18]中任一项所述的方法,其中,受体细胞来源于具有衰老相关疾病的宿主。
[20]如上述[1]~[19]中任一项所述的方法,其中,受体细胞来源于具有线粒体疾病的宿主。
[21]如上述[1]~[20]中任一项所述的方法,其中,受体细胞存在于选自由胸腺、脾脏、淋巴结、心脏、肺、胰脏、肝脏、皮肤、肾脏、血液、骨髓、滑膜、脑、淋巴管、眼、鼻和耳组成的组中的完整器官中。
[22]如上述[1]~[21]中任一项所述的方法,其中,进一步包括在体内进行上述移植的步骤。
[23]如上述[22]所述的方法,其中,在体内实施移植的步骤包括线粒体靶向载体(例如MITO-Porter)。
[24]如上述[23]所述的方法,其中,上述线粒体靶向载体(例如MITO-Porter)包含结合在上述线粒体靶向载体(例如MITO-Porter)的表面的一种以上肽。
[25]如上述[24]所述的方法,其特征在于,结合在上述线粒体靶向载体(例如MITO-Porter)的上述表面的一种以上肽与用于与上述单离出的线粒体进行共培养的一种以上肽相同。
[26]如上述[23]~[25]中任一项所述的方法,其中,线粒体靶向载体(例如MITO-Porter)包含选自由CO-Q-10、白藜芦醇、烟酰胺核糖、N-乙酰半胱氨酸、α-生育酚、ω-3脂肪酸、葡糖胺、肌酸一水合物、乙酰左旋肉碱、表儿茶素、檞皮素、自噬诱导剂和细胞凋亡抑制剂组成的组中的至少一种化学物质。
[27]如上述[22]~[26]中任一项所述的方法,其中,移植对选自由心脏、肝脏、耳、眼、胸腺、脑、肺、内皮细胞、淋巴结、骨髓、血液、肾脏、淋巴管、鼻、脾脏和滑膜组成的组中的器官进行。
[28]如上述[22]~[27]中任一项所述的方法,其中,移植使用介入放射学(IVR)-计算机断层摄影(CT)来进行。
[29]如上述[28]所述的方法,其特征在于,上述IVR-CT为X射线CT。
[30]如上述[22]~[29]中任一项所述的方法,其中,移植通过胸腺内注射来进行。
[31]如上述[1]~[30]中任一项所述的方法,其中,进一步包括进行移植后支持。
[32]如上述[31]所述的方法,其中,上述移植后支持体包括适当的身体运动或规定的呼吸方法。
[33]一种细胞组合物,其是使用上述[1]~[32]中任一项所述的方法制备的。
[34]使用上述[1]~[33]中任一项所述的方法制备的细胞的制造方法。
另外,根据本发明,提供以下的发明。
[1A]一种包含线粒体的药物制剂,其被给药于选自由初级淋巴组织和次级淋巴组织组成的组中的至少一种组织。
[2A]如上述[1A]所述的药物制剂,其中,线粒体为单离出的线粒体。
[3A]如上述[1A]或[2A]所述的药物制剂,其中,线粒体为进行了线粒体活化剂处理的线粒体。
[4A]如上述[1A]所述的药物制剂,其中,线粒体为存在于细胞内的形态。
[5A]如上述[4A]所述的药物制剂,其中,细胞为非免疫细胞。
[6A]如上述[5A]所述的药物制剂,其中,细胞为选自由心肌干细胞和心肌祖细胞组成的组中的细胞。
[7A]如上述[4A]所述的药物制剂,其中,细胞为进行了线粒体活化处理的免疫细胞。
[8A]如上述[4A]或[7A]所述的药物制剂,其中,细胞为具有MITO-Porter的免疫细胞。
[9A]如上述[1A]~[8A]中任一项所述的药物制剂,其中,给药对象具有存在功能异常的线粒体。
[10A]线粒体在制造包含线粒体的药物制剂中的应用,该药物制剂被给药于选自由初级淋巴组织和次级淋巴组织组成的组中的至少一种组织。
[11A]如上述[10A]所述的应用,其中,线粒体为单离出的线粒体。
[12A]如上述[10A]或[11A]所述的应用,其中,线粒体为进行了线粒体活化剂处理的线粒体。
[13A]如上述[10A]所述的应用,其中,线粒体为存在于细胞内的形态。
[14A]如上述[10A]所述的应用,其中,细胞为非免疫细胞。
[15A]如上述[10A]所述的应用,其中,细胞为选自由心肌干细胞和心肌祖细胞组成的组中的细胞。
[16A]如上述[10A]所述的应用,其中,细胞为进行了线粒体活化处理的免疫细胞。
[17A]如上述[13A]或[16A]所述的应用,其中,细胞为具有MITO-Porter的免疫细胞。
[18A]如上述[10A]~[17A]中任一项所述的应用,其中,给药对象具有存在功能异常的线粒体。
附图说明
图1示出野生型(WT)、Ndufs4杂合子敲除小鼠(Het)和Ndufs4纯合子敲除小鼠(Homo)的胸腺中的细胞数的比较。
图2示出野生型(WT)、Ndufs4杂合子敲除小鼠(Het)和Ndufs4纯合子敲除小鼠(Homo)的单位体重(BW)的胸腺中的细胞数的比较。
图3示出野生型(WT)、Ndufs4杂合子敲除小鼠(Het)和Ndufs4纯合子敲除小鼠(Homo)的单位体重(BW)的CD4/CD8双阴性细胞的数量的比较。
图4示出野生型(WT)、Ndufs4杂合子敲除小鼠(Het)和Ndufs4纯合子敲除小鼠(Homo)的单位体重(BW)的CD4/CD8双阳性细胞的数量的比较。
图5示出野生型(WT)、Ndufs4杂合子敲除小鼠(Het)和Ndufs4纯合子敲除小鼠(Homo)的脾脏中的总单核细胞数的比较以及B细胞的祖细胞(B细胞祖细胞)在全部细胞中所占比例的比较。
图6示出野生型(WT)、Ndufs4杂合子敲除小鼠(Het)和Ndufs4纯合子敲除小鼠(Homo)的骨髓中的造血祖细胞的单离方案及之后的培养实验的方案。
图7示出对野生型(WT)、Ndufs4杂合子敲除小鼠(Het)和Ndufs4纯合子敲除小鼠(Homo)的造血祖细胞进行培养后的CD45阳性细胞的数量的比较。
图8示出对野生型(WT)、Ndufs4杂合子敲除小鼠(Het)和Ndufs4纯合子敲除小鼠(Homo)的造血祖细胞进行培养后的Mac1+骨髓细胞的数量的比较。
图9示出对野生型(WT)、Ndufs4杂合子敲除小鼠(Het)和Ndufs4纯合子敲除小鼠(Homo)的造血祖细胞进行培养后的CD19阳性B细胞的数量的比较。
图10示出对放射性照射后的野生型(WT)、Ndufs4杂合子敲除小鼠(Het)和Ndufs4纯合子敲除小鼠(Homo)移植正常的骨髓单核细胞的实验的方案。
图11示出进行了骨髓移植的野生型小鼠与未进行骨髓移植的小鼠的存活曲线的比较。
图12示出进行了骨髓移植的Ndufs4纯合子敲除小鼠与未进行骨髓移植的Ndufs4纯合子敲除小鼠的存活曲线的比较。
图13示出供体骨髓在进行了骨髓移植的野生型小鼠、杂合子敲除小鼠、纯合子敲除小鼠中的成活状况。作为阴性对照,也示出供体骨髓在未进行骨髓移植的纯合子敲除小鼠中的成活。
图14示出将进行了线粒体活化处理的CPC(MITO-Cell)移植至胸腺表面3天后的胸腺中的来源于MITO-Cell的线粒体的分布。
图15示出将进行了线粒体活化处理的CPC(MITO-Cell)移植至胸腺表面3天后的胸腺中的来源于MITO-Cell的线粒体的分布。
图16是对检测线粒体在细胞间的移动的检测系统进行说明的图。
图17是将线粒体染成红色的小鼠CPC和线粒体染成绿色的小鼠CPC以1:1的比率共培养24小时后的细胞的荧光显微镜图像。左侧面板为红色图像,中央面板为绿色图像,右侧面板为重叠图像。重叠图像中箭头所示的细胞为黄色,检测出线粒体在细胞间产生了移动。
图18是将线粒体染成绿色的H9c2细胞和线粒体染成红色的CPC共培养24小时后的细胞的荧光显微镜图像。左侧面板中示出了红色与绿色图像的重叠图像,箭头所示的细胞为黄色,检测出线粒体在细胞间产生了移动。右侧的重叠图像为左侧图像的四角区域的放大图。
图19是将线粒体染成绿色的H9c2细胞和线粒体染成红色的CPC共培养24小时后的细胞的荧光显微镜图像。左侧面板为红色图像,中央面板为绿色图像,右侧面板为重叠图像。重叠图像中箭头所示的细胞为黄色,检测出线粒体在细胞间产生了移动。下方为另一视野。
图20是示出来自MITO-Cell的RES-MITO-Porter的细胞间移动的图。
图21是示出来自MITO-Cell的RES-MITO-Porter的细胞间移动的图。
图22是示出线粒体从野生型的CPC移动至Ndufs4纯合子敲除小鼠的CPC的图。
具体实施方式
如本说明书中所提供,本发明涉及为了恢复靶免疫细胞的功能、促进健康的免疫系统,通过将具有更少基因突变的健康的线粒体移植至胸腺等淋巴器官中来改善T细胞等免疫细胞的质和量的技术方案。因此,改良的免疫细胞能够改善线粒体和衰老相关疾病。
4.1高度纯化的线粒体的制备
如本说明书所公开,高品质且高纯度的单离线粒体的制备可以通过从供体组织中提取细胞并将它们大量培养来进行。本说明书中提供的方法能够进行综合线粒体移植(IMiT)。在一些方式中,最先单离线粒体。单离线粒体优选在线粒体内膜中具有膜电位。本说明书中,“单离”在涉及线粒体的描述的情况下是指将其从细胞内取出。本说明书中,“纯化”是指通过进一步分离出混入在单离物中的至少一种以上的成分来提高纯化度。
首先,从供体组织中提取细胞,并大量培养。在某一方式中,供体组织来源于健康的供体。在某一方式中,与其使用肝细胞、血小板、肌细胞或iPSC等每个细胞具有高线粒体含量的细胞,不如使用能够安全地大量培养的成纤维细胞。成纤维细胞例如可以通过皮肤活检而得到。因此,在一些方式中,对供体进行组织活检,提取足够量的成纤维细胞。在特定的实施方式中,组织活检来源于直径约4mm的组织切片。在其他实施方式中,成纤维细胞由市售的供给源得到。在具体的实施方式中,市售的成纤维细胞按照GCP基准制备。在一些方式中,对供体进行组织活检,提取足够量的间充质干细胞或心肌干细胞(或心肌祖细胞)。
如本说明书中所公开,单离前的线粒体的活化能够产生更高品质的线粒体。因此,在一些方式中,在单离前使成纤维细胞的线粒体功能活化。在特定的方式中,将单离出的高品质的线粒体移植至具有异常线粒体基因和呼吸链复合物活性的受体细胞中。需要说明的是,在又一方式中,将单离出的高品质的线粒体移植至具有来源于母系遗传的异常线粒体基因的受体细胞中。在又一方式中,将单离出的高品质的线粒体移植至具有来源于核基因的异常线粒体基因的受体细胞中。
本领域技术人员可以理解使线粒体活化的方法。使线粒体活化的方法可以使用例如WO2018/092839中公开的方法。另外,例如,在一些实施方式中,线粒体功能可以通过将CoQ-10封装在线粒体靶向载体(例如MITO-Porter)中并将其与供体细胞(例如成纤维细胞等)共培养来活化。在一些实施方式中,线粒体靶向载体(例如MITO-Porter)可以封装不同的化学试剂。作为能够使线粒体活化的其他药剂,可以列举CO-Q-10、白藜芦醇、烟酰胺核糖、N-乙酰半胱氨酸、α-生育酚、ω-3脂肪酸、葡糖胺、肌酸一水合物、乙酰左旋肉碱、表儿茶素、檞皮素、自噬诱导剂和细胞凋亡抑制剂,但不限定于这些。
线粒体靶向载体是在膜表面露出有线粒体靶向分子的囊泡,囊泡例如为由脂质双重膜构成的脂质体,可以是以二油酰磷酰乙醇胺(DOPE)、磷脂酸(PA)和/或鞘磷脂(SM)作为构成成分的脂质体。作为线粒体靶向分子,可以列举例如R8肽、线粒体靶向信号(MTS)肽(Kong,BW.et al.,Biochimica et Biophysica Acta 2003,1625,pp.98-108)和S2肽(Szeto,H.H.et al.,Pharm.Res.2011,28,pp.2669-2679)等多肽;以及亲脂性三苯基
在一些方式中,可以通过使用洋地黄皂苷提高包含线粒体的细胞的膜穿透性而从细胞内单离高品质的线粒体。
在又一方式中,通过将单离出的线粒体与两种具有膜转运序列的肽进行共培养而对线粒体的外膜的表面赋予膜转运功能。在某一实施方式中,两种肽为细胞膜穿透肽和线粒体膜融合肽等包含膜转运序列的肽。
在其他方式中,肽为肽结合物。肽结合物可以包含肽和脂质。脂质可以结合在肽的N末端、肽的C末端、或其两末端。在某一方面,脂质能够将肽埋入线粒体膜中。
因此,在一些方式中,方法进一步包括将单离出的线粒体与一种以上部分进行共培养。在某一方式中,一种或两种以上部分包含聚乙二醇。在其他方式中,一种或两种以上部分包含核酸适配体。
在一些方式中,线粒体的移植使用海藻糖缓冲液来进行。
4.2.1分离或单离出的线粒体的移植
线粒体功能障碍是线粒体疾病、免疫异常和衰老的重要原因。多数主要器官受到线粒体功能障碍的影响。此外,线粒体功能障碍有时会使天然免疫和获得性免疫两者产生不均衡,在线粒体疾病和衰老中发挥重要的作用。
在免疫活性细胞中被报告了能量代谢异常。参与天然免疫的单核细胞系巨噬细胞和树突细胞的能量依靠不依赖于线粒体的无氧糖酵解。参与获得性免疫的效应T细胞还利用线粒体的氧化磷酸化(OXPHOS)。记忆T细胞和调节性T细胞通过脂肪酸的氧化而依赖于OXPOS。如此可以预测,由于具有线粒体功能障碍的免疫活性细胞、特别是T细胞活性的降低而引起获得性免疫的降低。实际上,衰老所伴随的T细胞功能的降低已经作为所谓的免疫老化的典型征兆进行了报道。
在胸腺中,由造血干细胞分化出初始的胸腺祖细胞,通过增殖(至100万倍)和分化、例如T细胞受体(TCR)基因的重构、表达TCR识别自身MHC的T细胞的选择(阳性选择)、识别自身抗原的T细胞的除去(阴性选择)而生长为成熟的CD4和CD8表达T细胞。髓质和皮质的胸腺基质的胸腺上皮细胞(TEC)有助于胸腺的T细胞的分化。在正常的器官组织中,上皮细胞密接而排列成片状,另一方面,TEC具有海绵样结构。初始的胸腺祖细胞一边在以三维结构存在的TEC之间从皮质移动至髓质一边增殖、分化、成熟,然后从胸腺移动出来。
在小鼠组织中研究了受到作为氧化还原相关蛋白修饰的使用一氧化氮的翻译后修饰的半胱氨酸S-亚硝酰化(S-nitrosylation),表明胸腺是与脑、心脏、肺、肝脏、肾脏类似的高度依赖线粒体的器官。因此,TEC和T细胞的线粒体功能的降低有可能引起胸腺中的T细胞成熟过程的异常、以及CD8+T细胞和CD4+细胞的减少、CD4+初始T细胞的减少、记忆T细胞的增加等T细胞亚群的变化,另外还可能引起增殖期中的T细胞上的受体的异常表达,这有可能与在胸腺萎缩时观察到的衰老免疫系统类似地导致免疫耐受的减弱。此外,已知胸腺的淋巴细胞在青春期(10多岁左右)最多,胸腺的峰值重量为30~40g,然后迅速消退,到70岁几乎枯竭。
胸腺的皮质基质细胞中的活性氧种(ROS)的过量产生与胸腺萎缩有关。由胸腺基质细胞的线粒体功能的降低导致的ATP产生能力的降低和ROS的过量产生可能是胸腺萎缩的主要原因。实际上,在线粒体的双链DNA暂时被切断的模型动物中,从生长的初期阶段即观察到胸腺的退化。在具有变异(mtDNA)复制酶DNA聚合酶γ(POLG)的小鼠中也观察到胸腺萎缩。
因此,通过将基因变异少的健康线粒体移植至胸腺中来支持TEC和T细胞的线粒体功能是恢复胸腺功能、延缓胸腺萎缩的新方法。T细胞的质和量的改善带来健康的免疫系统,可以期待对线粒体和衰老相关疾病的改善效果。
在一些方式中,制备单离线粒体,并赋予膜转运信号。这样,提高了膜穿透性的线粒体接着被转运至细胞中。在一些方式中,制备高度纯化的单离线粒体,并赋予高膜转运信号。膜转运信号高的线粒体接着被转运至细胞中。
如本说明书所公开,在某一方式中,在线粒体单离之前或单离之后,线粒体可以任意地在供体细胞内被活化。本说明书中,将使线粒体活化的处理称为“线粒体活化处理”。为了使线粒体活化,可以使用包括但不限定于使用包封有化学物质的线粒体靶向载体(例如MITO-Porter)的各种方法。化学试剂可以为能够使线粒体活化的任意试剂。例如,药剂可以为CO-Q-10、白藜芦醇、烟酰胺核糖、N-乙酰半胱氨酸、α-生育酚、ω-3脂肪酸、葡糖胺、肌酸一水合物、乙酰左旋肉碱、表儿茶素、檞皮素、自噬诱导剂或细胞凋亡抑制剂。在一些方式中,药剂可以为针对线粒体呼吸链复合物I、III和IV中的任意一者以上或全部的给电子体。在一些方式中,药剂可以为针对线粒体呼吸链复合物I、III和IV中的任意一者以上或全部的底物。在一些方式中,药剂可以为生物相容性的抗氧化剂。在一些方式中,药剂可以为白藜芦醇。
如本说明书所公开,线粒体可以从供体细胞进行单离。在一些方式中,供体细胞来源于脾脏、淋巴结、心脏、肺、胰脏、肝脏、皮肤、肾脏、血液、肌肉和淋巴管等器官。在具体的实施方式中,供体细胞选自由成纤维细胞、肝细胞、血小板、肌细胞和iPSC组成的组。供体细胞可以为自体移植也可以为同种异系移植,可以根据受体细胞中的线粒体功能的异常特性适当选择为自体移植或为同种异系移植。
在一些实施方式中,受体细胞来源于胸腺、脾脏、淋巴结、心脏、肺、胰脏、肝脏、皮肤、肾脏、血液、淋巴管、眼、鼻和耳等器官。在具体的实施方式中,受体细胞为诱导多能干细胞(iPSC)。
在特定的实施方式中,可以移植两个类型的细胞:贴壁性胸腺上皮细胞(TEC)和悬浮性胸腺淋巴细胞。在具体的实施方式中,受体细胞为贴壁性TEC、悬浮性胸腺淋巴细胞、或这两者。在其他方式中,受体细胞为心脏的心肌细胞、肝脏的肝细胞和脑的神经元等来源于市售器官的贴壁细胞。
从供体细胞向受体细胞的线粒体的移植能够有助于包括但不限定于线粒体功能的受体细胞的功能的改善。因此,在一些方式中,受体细胞为需要具有正常功能的线粒体或改良的线粒体的细胞。因此,在一些方式中,受体细胞来源于具有衰老相关疾病的宿主。在其他方式中,受体细胞来源于具有线粒体疾病的宿主。
在某一方式中,受体细胞可以位于完整器官内。例如,受体细胞可以来源于胸腺、脾脏、淋巴结、心脏、肺、胰脏、肝脏、皮肤、肾脏、血液、淋巴管、眼、鼻和耳等器官,细胞可以位于器官内。
线粒体移植后的受体细胞中的线粒体功能的改善可以与摄入至受体细胞中的具有正常功能的供体线粒体或高品质供体线粒体的数量成比例。在某一方式中,受体细胞通过巨胞饮摄入供体线粒体。在特定的方式中,向供体线粒体中添加具有细胞膜转运序列的肽来改善通过巨胞饮进行的线粒体摄入。例如,通过将MELAS胞质杂种细胞(MELAS cybridcell)与赋予了高膜转运信号的线粒体进行共培养,能够实现迅速且长期的线粒体摄入。在又一方式中,外源性线粒体的摄入能够增强内源性线粒体的功能。
最佳的细胞膜转运序列根据对象的细胞型而不同。在一些方式中,线粒体能够表达以一个或两个以上受体细胞型为标靶的一个或两个以上膜转运序列。例如,线粒体能够表达以TECs等上皮细胞和悬浮性胸腺淋巴细胞为标靶的两种以上的不同的膜转运肽的混合物。
线粒体通过体细胞核移植也可传递。但是,由于使用体细胞核移植的移植后的核与线粒体间缺乏一贯的协调性所致的异种抗原性,存在免疫排斥的风险。线粒体移植的主要目的在于活化内源性线粒体功能,由于局部移植线粒体,因此同种异系抗原性的风险降低。因此,在一些方式中,完整的自体移植片线粒体向受体细胞中的移植不具有免疫原性。在其他方式中,完整的同种异系移植片线粒体向受体细胞中的移入不具有免疫原性。
损伤的线粒体可能造成细胞的障碍。因此,本说明书中,“完整”是指没有损伤或损伤少至不造成细胞的障碍的程度。本说明书中,“完整”可以是指在生理学上维持正常的功能。本说明书中,“完整”可以是指线粒体保持了外膜和内膜。本说明书中,“完整”可以是指线粒体(的内膜)具有膜电位。本说明书中,“完整”可以是指线粒体不具有损伤。
4.2.2单离出的细胞的移植
线粒体包含在细胞内。因此,线粒体的移植也可以通过移植细胞来实现。根据本实施例,得到了线粒体通过细胞移植而广泛分布于胸腺中的结果。根据本实施例表明,线粒体不是停留于细胞内而是在细胞间移动。因此,移植包含健康线粒体(例如基因变异少的健康线粒体)的细胞的方法具有与移植线粒体的方法同等的优点。
如本说明书所公开,细胞可以在给药之前被活化。本发明中,为了使线粒体活化,可以使用包括但不限于使用包封有化学物质的线粒体靶向载体(例如MITO-Porter)的各种用于线粒体活化的方法。化学试剂可以为能够使线粒体活化的任意试剂。例如,药剂可以为CO-Q-10、白藜芦醇、烟酰胺核糖、N-乙酰半胱氨酸、α-生育酚、ω-3脂肪酸、葡糖胺、肌酸一水合物、乙酰左旋肉碱、表儿茶素、檞皮素、自噬诱导剂或细胞凋亡抑制剂。
如本说明书所公开,所给药的细胞可以来源于胸腺、脾脏、淋巴结、心脏、肺、胰脏、肝脏、皮肤、肾脏、血液、淋巴管、眼、鼻和耳等器官或组织。在一些方式中,所给药的细胞可以为组织干细胞。在某一方式中,所给药的细胞可以为心肌干细胞或心肌祖细胞。在特定的实施方式中,可以移植两个类型的细胞中的任意一者:贴壁性胸腺上皮细胞(TEC)和悬浮性胸腺淋巴细胞。在具体的实施方式中,所给药的细胞为贴壁性TEC、悬浮性胸腺淋巴细胞、或这两者。在其他方式中,所给药的细胞可以为心脏的心肌细胞、肝脏的肝细胞和脑的神经元等细胞、例如来源于市售器官的贴壁细胞。所给药的细胞对于被给药的个体而言可以为自体也可以为同种异系。
如本说明书所公开,所给药的细胞可以为能够对被给药的组织中的细胞供给线粒体的细胞。这样的细胞可以通过下述检测来确认:将被给药的组织中的细胞与所给药的细胞进行共培养,确认是否从所给药的细胞向被给药的组织中的细胞供给线粒体。通过共培养能够对被给药的组织中的细胞供给线粒体的细胞在本发明中能够用作所给药的细胞。能否供给线粒体可以通过对所给药的细胞中包含的线粒体进行标记来确认。线粒体的标记可以利用荧光标记来进行。作为荧光标记,可以使用能够对线粒体进行荧光标记的各种标记。在检测前,可以将所给药的细胞供于线粒体活化处理。在一些对象中,所给药的细胞可以为心肌干细胞或心肌祖细胞。
根据本发明,线粒体能够在细胞间移动。因此认为,细胞自身不需要在其所移植的器官中成活。因此,在某一方式中,被给药于初级淋巴组织和次级淋巴组织的细胞例如可以为非免疫细胞。作为非免疫细胞,可以列举成熟的免疫细胞和未成熟的免疫细胞(例如发育中的免疫细胞)。在某一方式中,被给药于初级淋巴组织和次级淋巴组织的细胞例如还可以为非造血干细胞,可以为非造血祖细胞,可以为非淋巴系共同祖细胞,可以为非NK细胞/非T细胞祖细胞,可以为非髓系共同祖细胞、非粒细胞/巨噬细胞系祖细胞,或者可以为非巨噬细胞/树突细胞祖细胞,可以为非肥大细胞祖细胞。
4.3移植的方法和部位
据报道,造血干细胞可直接安全地注入至胸腺中,并分化成T细胞。在某一方式中,线粒体或细胞可以直接注入至对象(或患者)的胸腺组织(例如基质)中。
因此,在一些方式中,线粒体或细胞移植可以按照本说明书中记载的方法在体内进行。在一些方式中,体内移植包括利用线粒体靶向载体(例如MITO-Porter)的移植、包含线粒体靶向载体的线粒体的移植、或包含线粒体靶向载体的细胞的移植。线粒体靶向载体(例如MITO-Porter)可以包含结合在线粒体靶向载体(例如MITO-Porter)的表面上的一种以上肽。
线粒体或细胞的移植可以对选自由心脏、肝脏、耳、眼、胸腺、脑、肺、内皮细胞、淋巴结、骨髓、血液、脾脏、肾脏、淋巴管、鼻和滑膜组成的组中的器官或组织进行。在特定的方式中,线粒体或细胞的移植可以对选自由胸腺、脾脏和骨髓组成的组中的器官或组织进行。在这些方式中,线粒体或细胞的移植可以通过向这些器官或组织(优选初级淋巴组织和次级淋巴组织中的任意一种组织;例如选自由胸腺、脾脏和骨髓组成的组中的器官或组织;例如胸腺)内的注射来进行。
在特定的方面,线粒体靶向载体(例如MITO-Porter)可以包含CO-Q-10、白藜芦醇、烟酰胺核糖、N-乙酰半胱氨酸、α-生育酚、ω-3脂肪酸、葡糖胺、肌酸一水合物、乙酰左旋肉碱、表儿茶素、檞皮素、自噬诱导剂和细胞凋亡抑制剂等化学物质,但不限定于这些。
介入放射学(IVR)-计算机断层摄影(CT)是放射线诊断技术的治疗性应用,在CT引导下将穿刺针或导管插入至体内来支援治疗。特别是X射线CT不仅提高空间分辨率、对比度分辨率还提高时间分辨率,能够进行CT观察下的实时穿刺。基于以上,为了多次进行摘出的线粒体或细胞向胸腺内的注入,可以考虑使用X射线CT等IVR-CT。在某一方式中,可以使用IVR-CT进行向胸腺中的直接注射。在具体的实施方式中,可以使用X射线CT进行向胸腺中的直接注入。
在一些实施方式中,通过完整线粒体或细胞的移植,能够减轻胸腺的萎缩,能够在胸腺内促进T细胞的分化和成熟。在某一方式中,通过线粒体或细胞的移植引起的T细胞的增加能够补正外周血中的T细胞的质和量的异常。这可能还会对胸腺的萎缩所致的免疫老化带来回春效果。
在又一实施方式中,自身免疫T细胞的功能恢复通过调节局部的天然免疫和获得性免疫能够带来病情的改善(免疫耐受的恢复)。
4.4移植后
在一些具体例中,为了促进移植器官功能的改善,根据病情从移植后早期开始进行预定的康复。在具体的实施方式中,实施有氧运动,使线粒体的摄入显著增加,改善受体细胞的功能。
T细胞功能的测定可以使用本技术领域中公知的方法来进行。例如,在一些方式中,线粒体功能可以在外周血T细胞中测定。
4.5本发明的线粒体制剂或细胞制剂
根据本发明,提供用于给药于选自由心脏、肝脏、耳、眼、胸腺、脑、肺、内皮细胞、淋巴结、骨髓、血液、脾脏、肾脏、淋巴管、鼻和滑膜组成的组中的器官或组织(优选初级淋巴组织和次级淋巴组织中的任意一种组织;例如选自由胸腺、脾脏和骨髓组成的组中的器官或组织;例如胸腺)的、包含线粒体的药物制剂。另外,根据本发明,本发明的药物制剂提供用于给药于选自由心脏、肝脏、耳、眼、胸腺、脑、肺、内皮细胞、淋巴结、骨髓、血液、脾脏、肾脏、淋巴管、鼻和滑膜组成的组中的器官或组织(优选初级淋巴组织和次级淋巴组织中的任意一种组织;例如选自由胸腺、脾脏和骨髓组成的组中的器官或组织;例如胸腺)的、包含细胞的药物制剂。
在一些方式中,所给药的细胞为进行了线粒体活化处理的线粒体或细胞,被给药的器官或组织可以为选自由心脏、肝脏、耳、眼、胸腺、脑、肺、内皮细胞、淋巴结、骨髓、血液、脾脏、肾脏、淋巴管、鼻和滑膜组成的组中的器官或组织(优选初级淋巴组织和次级淋巴组织中的任意一种组织;例如选自由胸腺、脾脏和骨髓组成的组中的器官或组织;例如胸腺)。
在一些方式中,所给药的细胞为心肌干细胞或心肌祖细胞,被给药的器官或组织可以为选自由心脏、肝脏、耳、眼、胸腺、脑、肺、内皮细胞、淋巴结、骨髓、血液、脾脏、肾脏、淋巴管、鼻和滑膜组成的组中的器官或组织(优选初级淋巴组织和次级淋巴组织中的任意一种组织;例如选自由胸腺、脾脏和骨髓组成的组中的器官或组织;例如胸腺)。
在一些方式中,所给药的细胞为进行了线粒体活化处理的线粒体、心肌干细胞或心肌祖细胞,被给药的器官或组织可以为选自由心脏、肝脏、耳、眼、胸腺、脑、肺、内皮细胞、淋巴结、骨髓、血液、脾脏、肾脏、淋巴管、鼻和滑膜组成的组中的器官或组织(优选初级淋巴组织和次级淋巴组织中的任意一种组织;例如选自由胸腺、脾脏和骨髓组成的组中的器官或组织;例如胸腺)。
本发明的药物制剂可以用于在线粒体存在功能异常的患者中提高胸腺功能。在该方式中,可以胸腺内给药本发明的药物制剂。
本发明的药物制剂可以用于在线粒体存在功能异常的患者中对胸腺萎缩进行处置。在该方式中,可以胸腺内给药本发明的药物制剂。
本发明的药物制剂可以用于在线粒体存在功能异常的患者中提高骨髓功能。在该方式中,可以骨髓内给药本发明的药物制剂。
本发明的药物制剂可以用于在线粒体存在功能异常的患者中提高免疫功能。在该方式中,可以对优选初级淋巴组织和次级淋巴组织中的任意一种组织、例如选自由胸腺、脾脏和骨髓组成的组中的器官或组织局部给药本发明的药物制剂。
本发明的药物制剂可以用于对线粒体存在功能异常的患者进行处置。在该方式中,可以对选自由心脏、肝脏、耳、眼、胸腺、脑、肺、内皮细胞、淋巴结、骨髓、血液、脾脏、肾脏、淋巴管、鼻和滑膜组成的组中的器官或组织(优选初级淋巴组织和次级淋巴组织中的任意一种组织;例如选自由胸腺、脾脏和骨髓组成的组中的器官或组织;例如胸腺)局部给药本发明的药物制剂。
本发明的药物制剂可以包含线粒体或细胞和赋形剂。赋形剂例如为药学上可接受的赋形剂。作为药学上可接受的赋形剂,没有特别限定,可以列举例如pH调节剂、盐、表面活性剂、防腐剂、稳定剂和等渗剂。
在一个方面,提供线粒体或细胞在制造本发明的药物制剂中的应用。
4.6给药本发明的线粒体或细胞的对象
本说明书中,对象或患者可以为哺乳动物,可以列举例如人等灵长类、犬和猫等宠物动物。本说明书中,“患者”是指具有疾病或病理状态的对象。根据本发明,给药本发明的线粒体或细胞的对象可以为线粒体功能存在异常的对象、例如线粒体病的患者。线粒体病的患者可以为线粒体的基因组存在异常的患者或核基因组存在异常的患者。线粒体病的患者可以为遗传性线粒体病的患者或后天性线粒体病的患者。根据本发明,给药本发明的线粒体或细胞的对象可以为线粒体功能存在异常且具有萎缩的胸腺的对象。胸腺的萎缩可以通过与年龄与对象相同的个体所具有的通常的胸腺进行比较来确定。根据本发明,给药本发明的线粒体或细胞的对象可以为线粒体功能存在异常且免疫功能存在异常的对象。线粒体功能的异常例如可以通过将线粒体的膜电位与健康者的线粒体的膜电位进行比较来确定。
实施例
Ndufs4基因在人体中存在于常染色体上,编码线粒体内膜的呼吸链复合物I(NADH:泛醌氧化还原酶)的18kDa的辅助亚基(NADH:泛醌氧化还原酶核心亚基S4)。Ndufs4基因的变异与常染色体劣性的线粒体的呼吸链复合物I的缺乏有关。该复合物I的缺乏被认为是线粒体中的氧化磷酸化损伤的频率最高的酶缺陷。本实施例中发现,在Ndufs4敲除小鼠中,与野生型和杂合子相比,胸腺显著萎缩。
分别回收野生型、杂合子和Ndufs4敲除小鼠(分别为4周龄、n=14~16)的外周血,对血液成分进行分析。Ndufs4敲除小鼠(杰克森实验室,品系号:027058)如Kruse SE etal.,Cell Metabolism.,7(4):312-320,2008所记载。血液成分的分析结果如表1所示。
[表1]
表1:野生型、杂合子和Ndufs4敲除小鼠的外周血的成分
如表1所示,在Ndufs4敲除小鼠中,确认到全血细胞数的减少。如表1所示,在Ndufs4敲除小鼠中,确认到淋巴细胞和B细胞的统计学上显著的减少。
从野生型、杂合子小鼠和Ndufs4敲除小鼠中分别摘除胸腺,计数胸腺中的胸腺细胞的数量。其结果是,如图1所示,在Ndufs4纯合子敲除小鼠中,胸腺细胞数比野生型和杂合子显著减少。另外,如图2所示,在Ndufs4纯合子敲除小鼠中,单位体重(BW)的胸腺细胞数也比野生型和杂合子显著减少。进而,利用流式细胞术从胸腺细胞中计数出CD4/CD8双阴性T细胞的数量、CD4/CD8双阳性T细胞的数量。其结果是,如图3所示,在Ndufs4敲除小鼠中确认到单位体重的CD4/CD8双阴性细胞的细胞数比野生型和杂合子减少的倾向。另外,如图4所示,在Ndufs4敲除小鼠中,单位体重的CD4/CD8双阳性T细胞的细胞数比野生型和杂合子在统计学上显著减少。这样,在Ndufs4敲除小鼠中,胸腺发生了萎缩,胸腺细胞数和单位体重的CD4/CD8双阳性T细胞的细胞数比野生型和杂合子在统计学上显著减少。胸腺细胞数和单位体重的CD4/CD8双阳性T细胞的细胞数的减少程度比CD4/CD8双阴性T细胞大,这表明胸腺中的T细胞的发达与胸腺中的线粒体功能的异常有关。
使Ndufs4杂合子小鼠彼此交配,将作为同窝出生仔畜得到的野生型、杂合子和Ndufs4敲除小鼠(3周龄、雌性)的脾脏分别摘除,利用流式细胞术,基于AA4.1、CD45R和B220的表达对聚集在脾脏中的B细胞的祖细胞进行分析。其结果是,如图5所示,相对于野生型和杂合子,在Ndufs4敲除小鼠中,总单核细胞数显著降低,并且B细胞的祖细胞的比例也降低。
从Ndufs4敲除小鼠的骨髓中单离造血祖细胞,验证其增殖能力和分化能力。如图6所示,使Ndufs4杂合子小鼠彼此交配,从作为同窝出生仔畜得到的野生型、杂合子和Ndufs4敲除小鼠(4周龄)采集骨髓。使用磁珠,除去谱系标志物(Mac1、Gr1、B220、CD3、TER119)阳性的细胞。然后,将1×10
如图10所示,将Ndufs4敲除小鼠(CD45.2+)(5周龄)作为受体,全身照射950rad的放射线,给药CD45.1+的6~7周龄小鼠的2×10
在本实施例中,进行向Ndufs4敲除小鼠的胸腺中移植健全线粒体的实验。
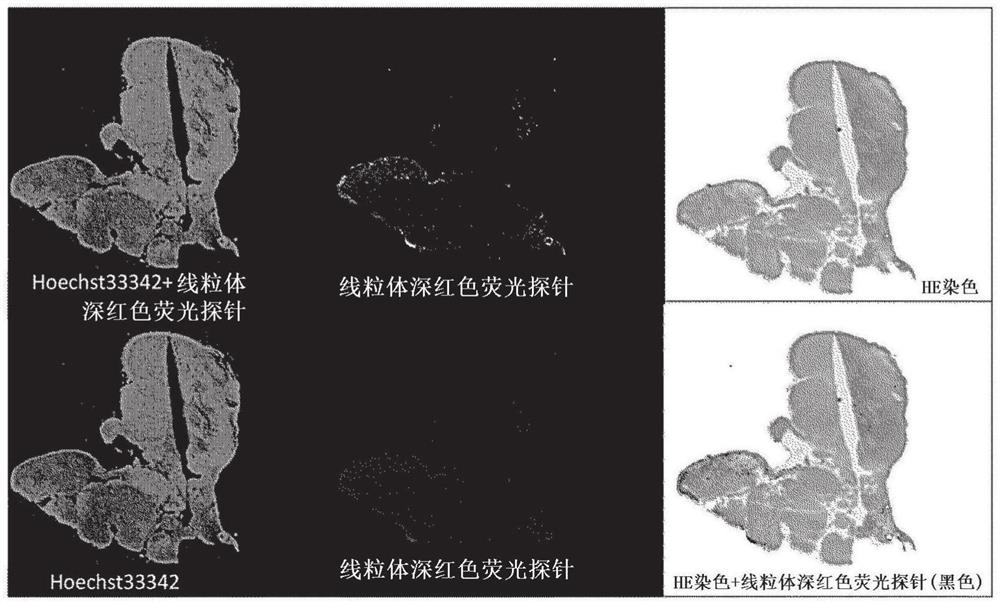
作为健全线粒体的来源,使用小鼠心脏内干细胞(CPC)。将CPC在DMEM-F12培养基中在37℃下培养24小时。添加按照WO2018/092839中公开的过程制作的RES-线粒体靶向载体(例如MITO-Porter),温育2小时,将RES-线粒体靶向载体(例如MITO-Porter)导入至CPC中。将所得到的细胞称为MITO-Cell。RES-线粒体靶向载体(例如MITO-Porter)为包封有白藜芦醇的线粒体靶向脂质体,脂质体是由1,2-二油酰-sn-甘油-3-磷酰乙醇胺(DOPE)和鞘磷脂(SM)以9:2的摩尔比构成、并且通过进一步导入有脂质量的10%的Stearyl S2而具有线粒体靶向性的脂质体。在导入有RES-MITO-Porter的细胞中,白藜芦醇被送达至线粒体,线粒体得到强化,如WO2018/092839中所示(例如,移植至阿霉素诱发心肌症大鼠模型中的CPC改善细胞存活率,MITO-Cell(在WO2018/092839中被称为MA-Cell)比CPC更进一步大幅改善细胞存活率)。
使用线粒体深红色荧光探针(MITO Tracker deep red)(Thermo fisherScientific公司制)对MITO-Cell进行染色。由此,MITO-Cell中的线粒体被染色。染色后将MITO-Cell(1.0×10
在本实施例中,证实线粒体在细胞间移动。例如,证实从CPC向Ndufs4的细胞供给线粒体。
本实施例中,将线粒体分开染色后的细胞群进行共培养,培养后确认有无染成二色的细胞。该实验体系中显示出,染成二色的细胞中包含由两个以上的细胞供给的线粒体,即,显示出线粒体从某一细胞移动至其他细胞。
更具体而言,如图16所示,为了能够区分来源于不同细胞的线粒体,将一个细胞群中包含的线粒体和另一个细胞群中包含的线粒体分开染色。更具体而言,使用线粒体绿色荧光探针(Mito tracker Green)对一个细胞群的线粒体进行染色以使其发出绿色的荧光,使用线粒体深红色荧光探针对另一个细胞群的线粒体进行染色以使其发出红色的荧光。然后,将两个细胞群在一种培养液中进行共培养。在该实验体系中,若线粒体在细胞间移动,则染成红色的线粒体和染成绿色的线粒体在一个细胞中共存,在一个细胞中发出红色和绿色两种荧光或者发出黄色的荧光。
将小鼠CPC(红色)与小鼠CPC(绿色)共培养,24小时后利用CLSM观察到的结果示于图17。如图17所示,在一部分细胞中,观察到显示黄色荧光的细胞(参见白色箭头)。由此显示出,在CPC间进行了线粒体的移动。另外,将作为大鼠心脏横纹肌细胞的H9c2细胞(绿色)与CPC(红色)共培养,24小时后利用CLSM进行观察的结果示于图18和19。如图18和19所示,在一部分细胞中,观察到显示黄色荧光的细胞(参见白色箭头)。根据共培养中的细胞的观察,发现线粒体在细胞间移动。另外,线粒体从CPC向H9c2的移动多于从H9c2向CPC的移动。另外,其结果是,发出红色荧光的细胞的数量维持,另一方面,发出绿色荧光的细胞的数量减少,发出黄色荧光的细胞的数量增加。这暗示出线粒体容易从干细胞向成熟细胞移动。
进一步,对于线粒体从MITO-Cell向H9c2细胞的移动也进行了确认。使用硝基苯并
将从Ndufs4敲除小鼠单离出的CPC(绿色)与从野生型小鼠单离出的CPC(红色)进行共培养,观察细胞间的线粒体的移动。于是,如图22所示,在从Ndufs4敲除小鼠单离出的CPC的细胞质中,确认到发出红色荧光的线粒体的存在(参见最右下方面板)。该结果是显示出线粒体从野生型小鼠的CPC向Ndufs4敲除小鼠的CPC移动的结果。
Ndufs4敲除小鼠是编码线粒体的呼吸链复合物I的18kDa的辅助亚基的基因的敲除,线粒体功能存在异常。Ndufs4敲除小鼠的表型特别强地表现在免疫细胞中,具有与野生型相比发生了萎缩的胸腺。这样的异常不是局限于Ndufs4敲除小鼠中观察到的异常,而是在其他线粒体功能存在异常的模型动物中也共同地观察到的异常(Pint M,et al.,CellDeath&Differ.,2017,24(2)288-99)和Dai Y,et al.,Mitochondrion.,2013,13(4):282-291)。已知随着衰老也会产生线粒体功能的异常(Zhang R,et al.,BMC Genomics.,2017,18(1):890),并且还已知随着衰老会产生胸腺的萎缩。特别是胸腺的大小在10多岁左右达到峰值,然后迅速萎缩,到70岁几乎消失(Lynch HE et al.,Trends Immunol.,2009,30(7):366-73)。胸腺的萎缩可能是由于作为对线粒体的依赖度高的细胞的胸腺间质细胞(Doulias PT et al.,Sci Signal.,2013,6(256):rs1)中的活性氧的过量产生而发生的(Griffith AV et al.,Cell Rep.,2015,12(7):1071-9)。另外已知,在衰老引起的胸腺萎缩中也产生免疫异常(Taub DD and Longo DL,Immunol Rev.,2005,205:72-93)。由此可见,线粒体功能的异常与胸腺的异常和免疫系统的异常之间具有相关性。
另外,有报道称,在尾静脉给药间充质干细胞(MSC)时,胸腺的萎缩和胸腺淋巴细胞的异常得到改善(Jung WS et al.,Cell Biol Int.,2014,38(10):1106-17)。另外,有报道称,线粒体的呼吸链复合物I功能存在障碍的MSC的培养液通过细胞外颗粒介导线粒体移动,但未观察到胸腺萎缩和胸腺淋巴细胞的异常的改善(Morrison T et al.,Am JRespirCrit Care Med.,2017,196(10):1275-1286)。
对Ndufs4敲除小鼠的胸腺给药野生型CPC的结果,野生型CPC中包含的健全线粒体广泛分布在胸腺组织中。根据培养实验,线粒体能够在细胞间移动,特别是具有从野生型细胞向Ndufs4敲除小鼠的细胞移动的能力。另外,线粒体未必局限于细胞内,而是在细胞间频繁移动。由此认为,根据本发明,通过将健全的具有呼吸链复合物的线粒体移植至胸腺中,能够使线粒体广泛分布在胸腺中。该实验结果显示出,通过将健全的具有呼吸链复合物的线粒体移植至线粒体功能降低的组织中,在组织中,该健全的具有呼吸链复合物的线粒体广泛分布在组织中。由此,根据本发明,提供下述方法:通过将健全的具有呼吸链复合物的线粒体局部注射至线粒体功能存在异常的个体的胸腺中,向胸腺供给健全的具有呼吸链复合物的线粒体。
认为胸腺中的线粒体功能的恢复可诱导胸腺功能降低的恢复、胸腺萎缩的改善和免疫异常的改善。因此,在供给了健全的具有呼吸链复合物的线粒体的胸腺中,认为其功能降低和功能异常得到挽救,本发明可在线粒体功能存在异常的个体(例如,线粒体病的患者或60岁以上的个体)的处置中有用。
特别是在供给了活化的线粒体的胸腺中,认为其功能降低和功能异常得到更强的挽救(WO2018/092839)。因此,本发明中,提供向胸腺供给活化的线粒体的方法,可在线粒体功能存在异常的个体(例如,线粒体病的患者或60岁以上的个体)的处置中有用。
- 线粒体向淋巴器官中的移植以及用于该移植的组合物
- 用于评估肾移植中急性排斥反应的组合物和方法
