一种高通量高精度检出多种病原菌的引物组、试剂盒及方法
文献发布时间:2023-06-19 19:30:30
技术领域
本申请涉及分子检测技术领域,具体涉及一种高通量高精度检出多种病原菌的引物组、试剂盒及方法。
技术背景
血流感染(bloodstream infection,BSI)是临床上重症感染性疾病之一,包括感染性心内膜炎,中心静脉导管相关血流感染,原发性菌血症以及由局部感染(如脓肿,尿路感染或者肺炎)引起的血流感染,由于近年来引起血流感染的病原菌对常用抗感染药物的耐药性增加,使血流感染的诊断及治疗面临严峻的挑战。重症血流感染发病急,进展快,致病性复杂,因此能否及时而准确的诊断病原的同时接受适当的抗菌治疗是决定患者死亡率和预后的关键因素。目前,临床感染诊断的方法依然是基于微生物培养的方法(血培养)和一些其他辅助诊断的方法包括显微镜检,染色镜检及质谱等。但这些方法都受限于较低的培养阳性率(<60%)和较长的培养周期(>2d)。尽管近些年研发出了基于聚合酶链反应的分子诊断试剂盒,因具有较好的灵敏度和特异性从而在市场上快速的普及开来,但由于血液样本自身的特殊性(成人菌血症患者外周血中细菌浓度1-10cfu/ml),使得绝大多数的检测血流感染的分子诊断产品,都以血培养阳性样本作为待测样本,同样受到上述局限性的影响。
而宏基因组技术因无需培养,无需预设和较高的病原体检测阳性率,已逐渐受到临床关注。2019年美国karius通过评估脓毒症患者血浆中的病原微生物游离DNA(cfDNA)的检测价值,证明mNGS的敏感性显著高于传统血培养技术,但众所周知,该技术受限于人源宿主的干扰,目前主流的检测针对血液样本均采用血浆cfDNA检测方法,即将血浆中的微生物细胞游离脱氧核糖核酸(microbial cell-free deoxyribonucleic acid,mcfDNA)作为待测靶标,但其同样存在明显的缺陷,一方面是血浆中存在的cfDNA微乎其微,同时半衰期比较短,样本在采集时会受抗凝剂的干扰而影响检测质量,造成假阳性或假阴性的结果;另一方面如果只检测血浆中的cfDNA那么势必会丢弃掉像布鲁氏杆菌,恙虫病东方体等胞内菌,同样会造成样本的漏检。因此开发出一种基于测序技术的全血样本(血浆+血细胞)的鉴定方法是十分必要的。
目前主流的测序方法主要是高通量测序方法,包括二代测序和三代测序。其中三代测序如纳米孔测序以其超长序列读长,实时数据产生和设备便携等卓越特征,已是目前比较快速便捷,灵敏的测序方法。因此当全血样本搭配纳米孔测序时,即可激发其优势。
相比于宏基因组测序,靶向测序技术可直接从样本中对感兴趣的基因组区域进行分离检测。通过靶向测序可有针对性的对病原微生物进行检测,有利于增加序列数据中病原体的数量和比例,从而提高对目标微生物检测的灵敏度,这种方式相比于宏基因组更加高效且经济。绝大多数被开发的靶向产品都是使用高度保守的引物对临床样本中与特定类型相对应的所有微生物进行通用PCR扩增和检测,也就是说都是基于细菌23s rRNA;16srRNA进行的基因扩增或者基于真菌ITS进行的基因扩增。此方法虽然对目标微生物的灵敏性更高,但同时也限制了可以识别的潜在病原微生物的精确度。
为了精准检出样本中多种病原微生物,通常在16s和ITS扩增的基础上还需要搭配其他基因位点的引物进行第二轮扩增或多重扩增,使样本中一些丰度较低的病原微生物富集方可检出,例如,专利申请202110863381.6披露的“一种基于纳米孔测序仪的微生物快速鉴定方法”中,使用16s和ITS通用引物第一轮扩增后还需结合100条Barcode引物进行第二轮扩增方能从样本中检出低丰度的白色念珠菌和金黄色葡萄球菌。专利申请202110647811.0记载的“一种靶向测序法检测血流感染的引物池、试剂盒及方法”中涉及32对引物对组成的引物池用来分别特异性地扩增32种特定的病原微生物。
使用通用引物可以尽可能多地扩增多种病原微生物,但却未必能从样本中有限丰度的模板中精确检出目标病原微生物,同时如果样本涉及人体来源的样品,通用引物的使用还可能产生引物二聚体、通用引物与人源模板的非特异性结合、扩增的情形;而要想精准地富集扩增样本中丰度较低的目标病原微生物,又需要针对每种特定的病原微生物的特异性区域设计引物,从而使引物数量过于庞大,扩增体系过于复杂,降低体系的配置效率并增加检测成本的同时也未必能保证较高的检测灵敏度。
因此,如何使用最少的引物数量来高精确度地从样本中尽可能多地检出多种丰度较低的具体病原微生物,同时兼顾高灵敏度,是目前本领域存在的一大技术难题。
发明内容
为了克服本领域现有技术存在的上述不足,出于解决本领域存在的上述无法在降低引物组成数量、提高可精准检出的微生物种属数量同时兼顾检测的高特异性和高灵敏度这几方面同时满足的问题的目的,本发明提供一种高通量高精度检出多种病原菌的引物组、试剂盒及方法。
本发明的技术方案如下:
一种高通量高精度检出多种病原微生物的引物组合,其特征在于,包括:引物池1、引物池2、引物池3;所述引物池1由引物对1、引物对2、引物对3、引物对4、引物组5组成;所述引物池2由引物对6、引物对7、引物对8、引物对9组成;所述引物池3由引物对10、引物组11、引物对12、引物对13、引物对14、引物对15、引物对16组成;所述引物对1由引物ITS-4-F和引物ITS-4-R组成;所述引物对2由引物16S_27F和引物16S_1492R组成;所述引物对3由引物RpoB_staph_F和引物RpoB_staph_R组成;所诉引物对4由引物RpoB_strep_2_F和引物RpoB_strep_2_R组成;所述引物组5由引物RpoB_strep_two-F1、引物RpoB_strep_two-F2和引物RpoB_strep_two-R组成;所述引物对6由引物EF-Tu_1_F和引物EF-Tu_1_R组成;所述引物对7由引物16S_63F和引物16s-1542R;所述引物对8由引物ITS_F和引物ITS_R组成;所述引物对9由引物Saureu_F和引物Saureu_R组成;所述引物对10由引物dnaK_F和引物dnaK_R组成;所述引物对11由引物pyrG_F和引物pyrG_R组成;所述引物对12由引物RpoB_1_F和引物RpoB_1_R组成;所述引物对13由引物gyrB_F和引物gyrB_R组成;所述引物对14由引物17kDa_F和引物17kDa_R组成;所述引物对15由引物Paerug_F和引物Paerug_R组成;所述引物对16由引物rplB_F和引物rplB_R组成;所述引物ITS-4-F选自:具有SEQ ID NO.1所示序列的单链DNA或具有与SEQ ID NO.1同源性90%以上的序列的DNA;所述引物ITS-4-R选自:具有SEQ ID NO.2所示序列的单链DNA或具有与SEQ ID NO.2同源性90%以上的序列的DNA;所述引物16S_27F选自:具有SEQ ID NO.3所示序列的单链DNA或具有与SEQ ID NO.3同源性90%以上的序列的DNA;所述引物16S_1492R选自:具有SEQ ID NO.4所示序列的单链DNA或具有与SEQ ID NO.4同源性90%以上的序列的DNA;所述引物RpoB_staph_F选自:具有SEQID NO.5所示序列的单链DNA或具有与SEQ ID NO.5同源性90%以上的序列的DNA;所述引物RpoB_staph_R选自:具有SEQ ID NO.6所示序列的单链DNA或具有与SEQ ID NO.6同源性90%以上的序列的DNA;所诉引物RpoB_strep_2_F选自:具有SEQ ID NO.7所示序列的单链DNA或具有与SEQ ID NO.7同源性90%以上的序列的DNA;所述引物RpoB_strep_2_R选自:具有SEQ ID NO.8所示序列的单链DNA或具有与SEQ ID NO.8同源性90%以上的序列的DNA;所述引物RpoB_strep_two-F1选自:具有SEQ ID NO.9所示序列的单链DNA或具有与SEQ IDNO.9同源性90%以上的序列的DNA;所述引物RpoB_strep_two-F2选自:具有SEQ ID NO.10所示序列的单链DNA或具有与SEQ ID NO.10同源性90%以上的序列的DNA;所述引物RpoB_strep_two-R选自:具有SEQ ID NO.11所示序列的单链DNA或具有与SEQ ID NO.11同源性90%以上的序列的DNA;所述引物EF-Tu_1_F选自:具有SEQ ID NO.12所示序列的单链DNA或具有与SEQ ID NO.12同源性90%以上的序列的DNA;所述引物EF-Tu_1_R选自:具有SEQ IDNO.13所示序列的单链DNA或具有与SEQ ID NO.13同源性90%以上的序列的DNA;所述引物16S_63F选自:具有SEQ ID NO.14所示序列的单链DNA或具有与SEQ ID NO.14同源性90%以上的序列的DNA;所述引物16s-1542R选自:具有SEQ ID NO.15所示序列的单链DNA或具有与SEQ ID NO.15同源性90%以上的序列的DNA;所述引物ITS_F选自:具有SEQ ID NO.16所示序列的单链DNA或具有与SEQ ID NO.16同源性90%以上的序列的DNA;所述引物ITS_R选自:具有SEQ ID NO.17所示序列的单链DNA或具有与SEQ ID NO.17同源性90%以上的序列的DNA;所述引物Saureu_F选自:具有SEQ ID NO.18所示序列的单链DNA或具有与SEQ IDNO.18同源性90%以上的序列的DNA;所述引物Saureu_R选自:具有SEQ ID NO.19所示序列的单链DNA或具有与SEQ ID NO.19同源性90%以上的序列的DNA;所述引物dnaK_F选自:具有SEQ ID NO.20所示序列的单链DNA或具有与SEQ ID NO.20同源性90%以上的序列的DNA;所述引物dnaK_R选自:具有SEQ ID NO.21所示序列的单链DNA或具有与SEQ ID NO.21同源性90%以上的序列的DNA;所述引物pyrG_F选自:具有SEQ ID NO.22所示序列的单链DNA或具有与SEQ ID NO.22同源性90%以上的序列的DNA;所述引物pyrG_R选自:具有SEQ IDNO.23所示序列的单链DNA或具有与SEQ ID NO.23同源性90%以上的序列的DNA;所述引物RpoB_1_F选自:具有SEQ ID NO.24所示序列的单链DNA或具有与SEQ ID NO.24同源性90%以上的序列的DNA;所述引物RpoB_1_R选自:具有SEQ ID NO.25所示序列的单链DNA或具有与SEQ ID NO.25同源性90%以上的序列的DNA;所述引物gyrB_F选自:具有SEQ ID NO.26所示序列的单链DNA或具有与SEQ ID NO.26同源性90%以上的序列的DNA;所述引物gyrB_R选自:具有SEQ ID NO.27所示序列的单链DNA或具有与SEQ ID NO.27同源性90%以上的序列的DNA;所述引物17kDa_F选自:具有SEQ ID NO.28所示序列的单链DNA或具有与SEQ IDNO.28同源性90%以上的序列的DNA;所述引物17kDa_R选自:具有SEQ ID NO.29所示序列的单链DNA或具有与SEQ ID NO.29同源性90%以上的序列的DNA;所述引物Paerug_F选自:具有SEQ ID NO.30所示序列的单链DNA或具有与SEQ ID NO.30同源性90%以上的序列的DNA;所述引物Paerug_R选自:具有SEQ ID NO.31所示序列的单链DNA或具有与SEQ ID NO.31同源性90%以上的序列的DNA;所述引物rplB_F选自:具有SEQ ID NO.32所示序列的单链DNA或具有与SEQ ID NO.32同源性90%以上的序列的DNA;所述引物rplB_R选自:具有SEQ IDNO.33所示序列的单链DNA或具有与SEQ ID NO.33同源性90%以上的序列的DNA。
上机测序时,所述引物池1所在扩增体系的扩增产物、引物池2所在扩增体系的扩增产物和引物池3所在扩增体系的扩增产物的体积比为:5∶(1-2)∶2。优选地,所述引物池1所在扩增体系的扩增产物、引物池2所在扩增体系的扩增产物和引物池3所在扩增体系的扩增产物的体积比为:5∶2∶2。所述病原微生物选自:埃希菌属、不动杆菌属、克雷伯菌属、假单胞菌属、肠球菌属、凝固酶阳性葡萄球菌属、凝固酶阴性葡萄球菌属、肠杆菌属、分枝杆菌属、链球菌属、念珠菌属。
所述的一种高通量高精度检出多种病原微生物的引物组合在非诊断目的地检测病原微生物或者制备检测病原微生物试剂方面的用途。
所述病原微生物选自:埃希菌属、不动杆菌属、克雷伯菌属、假单胞菌属、肠球菌属、凝固酶阳性葡萄球菌属、凝固酶阴性葡萄球菌属、肠杆菌属、分枝杆菌属、链球菌属、念珠菌属;优选地,所述埃希菌属包括大肠埃希菌;所述不动杆菌属包括鲍曼不动杆菌;所述克雷伯菌属包括肺炎克雷伯菌;所述假单胞菌属包括铜绿假单胞菌;所述肠球菌属包括:粪肠球菌,屎肠球菌;所述凝固酶阳性葡萄球菌属包括:金黄色葡萄球菌;所述凝固酶阴性葡萄球菌属包括:表皮葡萄球菌;所述肠杆菌属包括:阴沟肠杆菌复合群;所述分枝杆菌属包括:结核分枝杆菌复合群;所述链球菌属包括:化脓链球菌、猪链球菌;所述念珠菌属包括:白色念珠菌。
一种高通量高精度检出多种病原微生物的试剂盒,其特征在于,包括:所述的一种高通量高精度检出多种病原菌的引物组合。所述的一种高通量高精度检出多种病原微生物的试剂盒还包括:PCR常规试剂、和/或,测序常规试剂。
一种非诊断目的地高通量高精度检出多种病原微生物的方法,其特征在于,采用所述的一种高通量高精度检出多种病原微生物的引物组合、或,采用所述的一种高通量高精度检出多种病原微生物的试剂盒对待测样本进行PCR扩增。
每微升PCR扩增体系包含:0.5μl的PCR反应混合液、0.2μM的上游引物F工作液、0.2μM的下游引物R工作液、0.3μl的模板;优选地,所述PCR反应混合液为2×Phanta FlashMaster Mix;所述模板为样本提取的DNA或样本;优选地,所述样本选自:微生物培养物、血液;优选地,所述PCR扩增程序包括:98℃30s;以98℃10s、55℃5s、68℃10s为1个循环,共28个循环;68℃1min;
优选地,所述病原微生物选自:埃希菌属、不动杆菌属、克雷伯菌属、假单胞菌属、肠球菌属、凝固酶阳性葡萄球菌属、凝固酶阴性葡萄球菌属、肠杆菌属、分枝杆菌属、链球菌属、念珠菌属。
优选地,所述埃希菌属包括大肠埃希菌;所述不动杆菌属包括鲍曼不动杆菌;所述克雷伯菌属包括肺炎克雷伯菌;所述假单胞菌属包括铜绿假单胞菌;所述肠球菌属包括:粪肠球菌,屎肠球菌;所述凝固酶阳性葡萄球菌属包括:金黄色葡萄球菌;所述凝固酶阴性葡萄球菌属包括:表皮葡萄球菌;所述肠杆菌属包括:阴沟肠杆菌复合群;所述分枝杆菌属包括:结核分枝杆菌复合群;所述链球菌属包括:化脓链球菌、猪链球菌;所述念珠菌属包括:白色念珠菌。
在一些国家或地区的专利法允许的情况下,本发明还请求保护所述的一种高通量高精度检出多种病原微生物的引物组合、或,所述的一种高通量高精度检出多种病原微生物的试剂盒在从人体或动物样本中检出病原微生物方面的用途。
本发明提供一种基于纳米孔测序平台的用于全血样本建库的引物组,其特征在于,所述引物组包括通用引物和特异性引物,所述通用引物分别针对ITS、16s、rplB、pyrG、EF-TU、gyrB、17kDa、dnaK和RpoB,所述特异性引物分别针对金黄色葡萄球菌yqiL基因和铜绿假单胞菌oprL基因。本发明采用上述引物组合可以仅以9个位点的16对(组)引物就能覆盖几乎所有的人体感染的病原微生物并将它们精确地检出,这些病原微生物包括:埃希菌属、不动杆菌属、克雷伯菌属、假单胞菌属、肠球菌属、凝固酶阳性葡萄球菌属、凝固酶阴性葡萄球菌属、肠杆菌属、分枝杆菌属、链球菌属、念珠菌属。而本发明的引物组合又涉及ITS和16s通用引物,所以本发明的引物组合不仅限于检出上述病原微生物,还可几乎覆盖性地扩增出所有的细菌和真菌,本发明因检出目标的特定性以及时间、成本、篇幅有限并不能提供所有的各类细菌和真菌的实验数据。本发明在实验例部分提供了本发明引物组合扩增并检出肠道沙门菌、单核细胞增生李斯特菌、新生隐球菌、酿酒酵母、枯草芽孢杆菌、发酵乳杆菌的实验数据。
所述通用引物和特异性引物序列具体如SEQ ID NO.1-33所示。
本发明发现仅仅将上述16对(组)引物混合PCR仍然存在一定比例的人源模板的非特异性结合和非特异性扩增,甚至人源非特异性扩增占比高达86%,如图1所示。
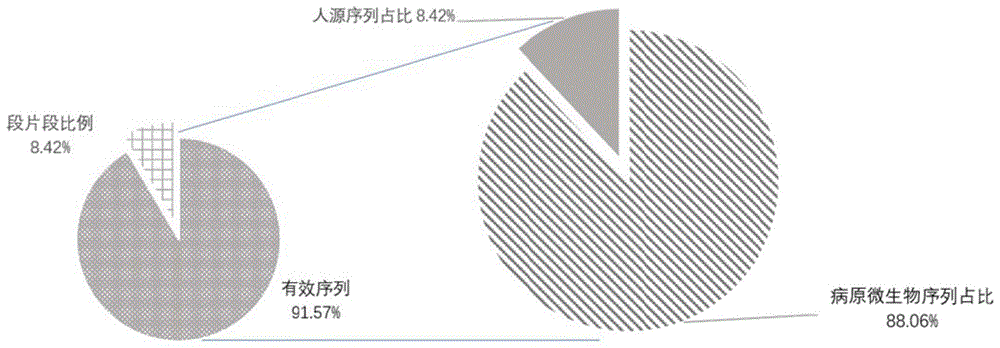
影响目标微生物的检出精确度,因此本发明将16对引物进行了分池,发现按照ITS_4、16S_27/1492、RpoB_staph、RpoB_strep、RpoB_strep_two(引物对1、引物对2、……、引物组5)组成引物池1,EF-TU、16S_63/1542、ITS_2、Saureu(引物对6至引物对9)组成引物池2,dnaK、pyrG、RpoB_1、gyrB、17kDa、Paerug、RplB(引物对10至引物对16)组成引物池3分别组成扩增体系扩增后得到产物再分别进行上机测序人源非特异性扩增占比可降低至10.74%(图2),为进一步降低人源非特异性扩增占比,本发明在上面分池的基础上进一步将各分池扩增的产物按比例混合后再进行纯化、上机测序,如此得到的人源非特异性扩增占比最低,仅为5.7%(图3)。
所述引物分3个引物池进行扩增,引物池1引物序列如SEQ ID NO.1-11所示,所述引物池2引物序列如SEQ ID NO.12-19所示,所述引物池3引物序列如SEQ ID NO.20-33所示;优选地,所述引物池1、引物池2和引物池3的扩增产物体积比为:5∶(1-2)∶2。
本领域公知,多重PCR中引物数量与预期检测的靶标微生物的种属数量呈正比,而降低引物数量与扩大可检出的种属数量之间是矛盾的,本发明通过充分发挥通用引物+特异性引物的组合优势很好地解决了这一矛盾。本发明通过特异性引物选取的位点考虑到覆盖微生物种属的多重性,可实现跨种属间的特异性扩增,使得以最少的引物数量检测尽可能多地微生物种属成为可能,同时又通过引物分池和合理配比避免了这种跨种属间扩增产生的人源模板的非特异性扩增。本领域公知,高通量(可检出的微生物种属数量)和高精度(可精确鉴别的特定微生物种属及其最低检出限、灵敏度)在一定程度上存在矛盾,本发明的引物组合很好地克服这一矛盾,同时做到通量与精度双高是本发明对现有技术作出的最大贡献。
本发明基于所述引物组开发出了一种多重扩增体系,此体系可以做到在不扩大宿主含量及比例的同时最大程度的对病原微生物进行富集。在此扩增体系中设计的16对(组)引物可对细菌,真菌进行扩增,在即不损失检测病原微生物广度的同时保证了病原微生物的精度。
因血液样本自身的特殊性(人源比例高而病原比例低),导致其不同于其他样本类型,因此本申请在不去宿主的情况下,通过多重扩增体系进行建库,最终搭载纳米孔测序技术进行上机检测,整个流程高效且快速,检测时间可小于6h。为解决上述技术问题,本申请基于多重扩增体系进行建库,搭载纳米孔测序技术进行上机检测,整个流程高效且快速,检测时间可小于6h。
一种用于全血样本建库试剂盒,其特征在于,包含所述的引物组。
一种基于纳米孔测序平台的全血样本的建库方法,其特征在于,所述方法包括如下步骤:
1)核酸提取步骤:对全血样本进行核酸提取;
2)靶向扩增步骤:基于所述引物组对提取的核酸进行靶向扩增;
所述引物组包括通用引物和特异性引物;
3)扩增产物混合步骤;
4)扩增产物纯化步骤;
5)测序文库构建步骤:基于商品化文库构建试剂盒对扩增产物进行文库构建。
所述通用引物分别针对ITS、16s、rplB、pyrG、EF-TU、gyrB、17kDa、dnaK和RpoB基因,所述特异性引物分别针对金黄色葡萄球菌yqiL基因和铜绿假单胞菌oprL基因;
优选的,所述通用引物和特异性引物序列具体如SEQ ID NO.1-33所示。
所述引物分3个引物池进行扩增,引物池1引物序列如SEQ ID NO.1-11所示,所述引物池2引物序列如SEQ ID NO.12-19所示,所述引物池3引物序列如SEQ ID NO.20-33所示。
所述引物池1、引物池2和引物池3的扩增产物体积比为5∶(1-2)∶2,优选5∶2∶2。
一种全血样本的测序方法,其特征在于,采用所述引物组在纳米孔测序平台进行文库上机测序的步骤。
一种全血样本的检测方法,其特征在于,包括上述全血样本的测序方法,并进一步包括,对测序数据进行生物信息学分析步骤。
本申请的第一目的在于提供一种一种高通量高精度检出多种病原菌的引物组合,包括SEQ ID NO.1-33所示的引物序列。
本申请的第二目的在于提供一种基于纳米孔测序平台的全血样本鉴定方法,所述方法通过高效提取及建库流程,可有效的鉴定病原微生物种属信息。还提供一种基于纳米孔测序平台的全血样本建库方法,所述方法无需去除宿主DNA,使用靶向PCR的方法富集病原微生物从而完成建库并满足测序需要。
具体的,本申请提出如下技术方案:
本申请首先提供一种基于纳米孔测序平台的全血样本的建库方法,其特征在于,所述方法包括如下步骤:
1)核酸提取步骤:对全血样本进行核酸提取;
2)靶向扩增步骤:基于靶向引物对提取的核酸进行靶向扩增;
所述靶向引物包括通用引物和特异性引物;
3)扩增产物混合步骤;
4)扩增产物纯化步骤;
5)测序文库构建步骤:基于商品化文库构建试剂盒对扩增产物进行文库构建。
进一步的,所述通用引物分别针对ITS、16s、rplB、pyrG、EF-TU、gyrB、17kDa、dnaK、RpoB基因,所述特异性引物分别针对金黄色葡萄球菌yqiL基因和铜绿假单胞菌oprL基因。
进一步优选的,所述通用引物和特异性引物序列具体如SEQ ID NO.1-33所示。
进一步的,所述引物分3个引物池进行扩增,引物池1引物序列如SEQ ID NO.1-11所示,所述引物池2引物序列如SEQ ID NO.12-19所示,所述引物池3引物序列如SEQ IDNO.20-33所示。
进一步优选的,所述引物池1、引物池2和引物池3的扩增产物体积比为:5∶(1-2)∶2;更进一步优选的,所述比例为5∶2∶2。
本申请还提供一种全血样本的测序方法,包括上述任一所述方法,并进一步包括采用纳米孔测序平台进行文库上机测序的步骤。
本申请还提供一种全血样本的检测方法,包括上述方法,并进一步包括,对测序数据进行生物信息学分析步骤。
本申请还提供一种基于纳米孔测序平台的用于全血样本建库的引物组,所述引物组包括通用引物和特异性引物,所述通用引物分别针对ITS、16s、rplB、pyrG、EF-TU、gyrB、17kDa、dnaK和RpoB,所述特异性引物分别针对金黄色葡萄球菌yqiL基因和铜绿假单胞菌oprL基因。
进一步的,所述通用引物和特异性引物序列具体如SEQ ID NO.1-33所示。
进一步的,所述引物分3个引物池进行扩增,引物池1引物序列如SEQ ID NO.1-11所示,所述引物池2引物序列如SEQ ID NO.12-19所示,所述引物池3引物序列如SEQ IDNO.20-33所示。
进一步优选的,所述引物池1、引物池2和引物池3的扩增产物体积比为:5:(1-2):(1-2):2,更进一步优选的,所述比例为5:2:2。
本申请还提供一种用于全血样本建库试剂盒,包含上述任一所述的引物组。
本申请提供一种基于纳米孔测序平台的全血样本的建库及鉴定方法。本申请方法无需去除宿主DNA,使用靶向PCR富集病原微生物从而完成建库并满足测序需要,本申请避免血液样本中胞内菌的漏检,显著提高病原菌的检出。
本申请有益技术效果:
1)本申请开发出一种针对全血样本的多重引物扩增的建库方法,该方法通过对靶向引物的特殊设计(通用引物结合特异引物)和筛选优化(序列优化、分组优化、比例优化),保证了多重扩增体系的有效性和高效性,在无需去除宿主基因组DNA的基础上,有效靶向富集病原微生物而不富集宿主核酸,使三代测序平台即使在低浓度全血感染样本情况下,同样可以准确有效的病原检出。
2)本申请开发的基于全血样本检测方法,可对血流样本中的肠杆菌科、葡萄球菌属、链球菌属、不动杆菌属、铜绿假单胞属、洋葱伯克霍尔德、立克次氏体、分支杆菌属等多种微生物进行检出,保证了检出结果的真实性和可靠性,可极大程度上避免血液样本中胞内菌漏检,进而提高病原菌鉴定的准确性。
3)本申请整个测序检测流程可在6h内快速完成对于全血样本的检测,即全流程运行时间短,结果准,成本优等特性。
4)本发明的引物组合能同时检出至少20种病原微生物,实现高通量检测;同时在模板来自人源样本时,检测准确度可高达94.3%,并且检测灵敏度极高,最低检出限可低至1CFU/ml或1拷贝/ml。
附图说明
图1为本发明实验例3对引物组合未分池时扩增产物中产物来源占比结果。
图2为本发明实验例3对引物组合按表4左起第3列进行分池后扩增产物中产物来源占比结果。
图3为本发明实验例3对引物组合按表4左起第3列进行分池后各引物池的扩增产物按比例混合后进行上级测序结果中,扩增产物中产物来源占比结果。
具体实施方式
下面将结合实施例对本申请的实施方案进行详细描述,但是本领域技术人员将会理解,下列实施例仅用于说明本申请,而不应视为限制本申请的范围。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市场购买获得的常规产品。
生物材料的来源
实验例1和3使用的全血样本来自北京协和医院。
实验例4使用的埃希菌属:大肠埃希菌ATCC 43888;不动杆菌属:鲍曼不动杆菌ATCC 19606;克雷伯菌属:肺炎克雷伯菌ATCC BAA-1705;假单胞菌属:铜绿假单胞菌ATCC27853;肠球菌属:粪肠球菌ATCC 700802,屎肠球菌ATCC700221;凝固酶阳性葡萄球菌属:金黄色葡萄球菌ATCC BAA1747;凝固酶阴性葡萄球菌属:表皮葡萄球菌ATCC 12228;肠杆菌属:阴沟肠杆菌复合群ATCC 13047;链球菌属:化脓链球菌ATCC 19615;念珠菌属:白色念珠菌ATCC 18804均购自ATCC。
分枝杆菌属:结核分枝杆菌复合群为临床样本,来自北京协和医院。
部分术语定义
除非在下文中另有定义,本申请具体实施方式中所用的所有技术术语和科学术语的含义意图与本领域技术人员通常所理解的相同。虽然相信以下术语对于本领域技术人员很好理解,但仍然阐述以下定义以更好地解释本申请。
如本申请中所使用,术语“包括”、“包含”、“具有”、“含有”或“涉及”为包含性的(inclusive)或开放式的,且不排除其它未列举的元素或方法步骤。术语“由…组成”被认为是术语“包含”的优选实施方案。如果在下文中某一组被定义为包含至少一定数目的实施方案,这也应被理解为揭示了一个优选地仅由这些实施方案组成的组。
在提及单数形式名词时使用的不定冠词或定冠词例如“一个”或“一种”,“所述”,包括该名词的复数形式。
本申请中的术语“大约”表示本领域技术人员能够理解的仍可保证论及特征的技术效果的准确度区间。该术语通常表示偏离指示数值的±10%,优选±5%。
此外,说明书和权利要求书中的术语第一、第二、第三、(a)、(b)、(c)以及诸如此类,是用于区分相似的元素,不是描述顺序或时间次序必须的。应理解,如此应用的术语在适当的环境下可互换,并且本申请描述的实施方案能以不同于本申请描述或举例说明的其它顺序实施。
第1组实施例、本发明的引物组合
本组实施例提供一种高通量高精度检出多种病原微生物的引物组合。本组所有的实施例都具备如下共同特征:所述引物组合包括:引物池1、引物池2、引物池3;所述引物池1由引物对1、引物对2、引物对3、引物对4、引物组5组成;所述引物池2由引物对6、引物对7、引物对8、引物对9组成;所述引物池3由引物对10、引物组11、引物对12、引物对13、引物对14、引物对15、引物对16组成;所述引物对1由引物ITS-4-F和引物ITS-4-R组成;所述引物对2由引物16S_27F和引物16S_1492R组成;所述引物对3由引物RpoB_staph_F和引物RpoB_staph_R组成;所诉引物对4由引物RpoB_strep_2_F和引物RpoB_strep_2_R组成;所述引物组5由引物RpoB_strep_two-F1、引物RpoB_strep_two-F2和引物RpoB_strep_two-R组成;所述引物对6由引物EF-Tu_1_F和引物EF-Tu_1_R组成;所述引物对7由引物16S_63F和引物16s-1542R;所述引物对8由引物ITS_F和引物ITS_R组成;所述引物对9由引物Saureu_F和引物Saureu_R组成;所述引物对10由引物dnaK_F和引物dnaK_R组成;所述引物对11由引物pyrG_F和引物pyrG_R组成;所述引物对12由引物RpoB_1_F和引物RpoB_1_R组成;所述引物对13由引物gyrB_F和引物gyrB_R组成;所述引物对14由引物17kDa_F和引物17kDa_R组成;所述引物对15由引物Paerug_F和引物Paerug_R组成;所述引物对16由引物rplB_F和引物rplB_R组成;所述引物ITS-4-F选自:具有SEQ ID NO.1所示序列的单链DNA或具有与SEQ ID NO.1同源性90%以上的序列的DNA;所述引物ITS-4-R选自:具有SEQ ID NO.2所示序列的单链DNA或具有与SEQ ID NO.2同源性90%以上的序列的DNA;所述引物16S_27F选自:具有SEQ IDNO.3所示序列的单链DNA或具有与SEQ ID NO.3同源性90%以上的序列的DNA;所述引物16S_1492R选自:具有SEQ ID NO.4所示序列的单链DNA或具有与SEQ ID NO.4同源性90%以上的序列的DNA;所述引物RpoB_staph_F选自:具有SEQ ID NO.5所示序列的单链DNA或具有与SEQ ID NO.5同源性90%以上的序列的DNA;所述引物RpoB_staph_R选自:具有SEQ IDNO.6所示序列的单链DNA或具有与SEQ ID NO.6同源性90%以上的序列的DNA;所诉引物RpoB_strep_2_F选自:具有SEQ ID NO.7所示序列的单链DNA或具有与SEQ ID NO.7同源性90%以上的序列的DNA;所述引物RpoB_strep_2_R选自:具有SEQ ID NO.8所示序列的单链DNA或具有与SEQ ID NO.8同源性90%以上的序列的DNA;所述引物RpoB_strep_two-F1选自:具有SEQ ID NO.9所示序列的单链DNA或具有与SEQ ID NO.9同源性90%以上的序列的DNA;所述引物RpoB_strep_two-F2选自:具有SEQ ID NO.10所示序列的单链DNA或具有与SEQ ID NO.10同源性90%以上的序列的DNA;所述引物RpoB_strep_two-R选自:具有SEQ IDNO.11所示序列的单链DNA或具有与SEQ ID NO.11同源性90%以上的序列的DNA;所述引物EF-Tu_1_F选自:具有SEQ ID NO.12所示序列的单链DNA或具有与SEQ ID NO.12同源性90%以上的序列的DNA;所述引物EF-Tu_1_R选自:具有SEQ ID NO.13所示序列的单链DNA或具有与SEQ ID NO.13同源性90%以上的序列的DNA;所述引物16S_63F选自:具有SEQ ID NO.14所示序列的单链DNA或具有与SEQ ID NO.14同源性90%以上的序列的DNA;所述引物16s-1542R选自:具有SEQ ID NO.15所示序列的单链DNA或具有与SEQ ID NO.15同源性90%以上的序列的DNA;所述引物ITS_F选自:具有SEQ ID NO.16所示序列的单链DNA或具有与SEQ IDNO.16同源性90%以上的序列的DNA;所述引物ITS_R选自:具有SEQ ID NO.17所示序列的单链DNA或具有与SEQ ID NO.17同源性90%以上的序列的DNA;所述引物Saureu_F选自:具有SEQ ID NO.18所示序列的单链DNA或具有与SEQ ID NO.18同源性90%以上的序列的DNA;所述引物Saureu_R选自:具有SEQ ID NO.19所示序列的单链DNA或具有与SEQ ID NO.19同源性90%以上的序列的DNA;所述引物dnaK_F选自:具有SEQ ID NO.20所示序列的单链DNA或具有与SEQ ID NO.20同源性90%以上的序列的DNA;所述引物dnaK_R选自:具有SEQ IDNO.21所示序列的单链DNA或具有与SEQ ID NO.21同源性90%以上的序列的DNA;所述引物pyrG_F选自:具有SEQ ID NO.22所示序列的单链DNA或具有与SEQ ID NO.22同源性90%以上的序列的DNA;所述引物pyrG_R选自:具有SEQ ID NO.23所示序列的单链DNA或具有与SEQID NO.23同源性90%以上的序列的DNA;所述引物RpoB_1_F选自:具有SEQ ID NO.24所示序列的单链DNA或具有与SEQ ID NO.24同源性90%以上的序列的DNA;所述引物RpoB_1_R选自:具有SEQ ID NO.25所示序列的单链DNA或具有与SEQ ID NO.25同源性90%以上的序列的DNA;所述引物gyrB_F选自:具有SEQ ID NO.26所示序列的单链DNA或具有与SEQ IDNO.26同源性90%以上的序列的DNA;所述引物gyrB_R选自:具有SEQ ID NO.27所示序列的单链DNA或具有与SEQ ID NO.27同源性90%以上的序列的DNA;所述引物17kDa_F选自:具有SEQ ID NO.28所示序列的单链DNA或具有与SEQ ID NO.28同源性90%以上的序列的DNA;所述引物17kDa_R选自:具有SEQ ID NO.29所示序列的单链DNA或具有与SEQ ID NO.29同源性90%以上的序列的DNA;所述引物Paerug_F选自:具有SEQ ID NO.30所示序列的单链DNA或具有与SEQ ID NO.30同源性90%以上的序列的DNA;所述引物Paerug_R选自:具有SEQ IDNO.31所示序列的单链DNA或具有与SEQ ID NO.31同源性90%以上的序列的DNA;所述引物rplB_F选自:具有SEQ ID NO.32所示序列的单链DNA或具有与SEQ ID NO.32同源性90%以上的序列的DNA;所述引物rplB_R选自:具有SEQ ID NO.33所示序列的单链DNA或具有与SEQID NO.33同源性90%以上的序列的DNA。
在优选的实施例中,上机测序时,所述引物池1、引物池2和引物池3的扩增产物体积比为:5∶(1-2)∶2。在进一步优选的实施例中,所述引物池1、引物池2和引物池3的扩增产物体积比为:5∶2∶2。
在具体的实施例中,所述病原微生物包括但不限于:埃希菌属、不动杆菌属、克雷伯菌属、假单胞菌属、肠球菌属、凝固酶阳性葡萄球菌属、凝固酶阴性葡萄球菌属、肠杆菌属、分枝杆菌属、链球菌属、念珠菌属。
因本发明的引物组合涉及16S、ITS等通用引物,因此除了上述病原微生物以外,本发明还可检测如下病原微生物:肠道沙门菌、单核细胞增生李斯特菌、新生隐球菌等;除上述病原微生物以外,本发明还可检测如下微生物:酿酒酵母、枯草芽孢杆菌、发酵乳杆菌等真菌或细菌。
需要说明的是:因为16s rDNA是细菌染色体上编码rRNA相对应的DNA序列,该段序列存在于所有已知细菌的基因组中。本发明的引物组合中涉及的16对(组)引物经计算模拟可以对所有已知细菌的rDNA片段引发扩增,因此理论上在适宜条件下可以有效检出样本中的所有已知细菌,而不仅限于上文提到的种类。上文提到的种类是经实验验证的除16s之外的其余引物可检出的微生物。ITS的情况与16s类似,唯一不同的是ITS片段存在于真菌基因组中。本发明可检测到的细菌真菌范围:包含几乎全部细菌和真菌,而并不局限于上文罗列的微生物种属以及下文实验例记载的微生物种属,因时间、成本、篇幅所限,无法对全部可检出微生物的提供实验验证数据。
更具体地,所述埃希菌属包括大肠埃希菌;所述不动杆菌属包括鲍曼不动杆菌;所述克雷伯菌属包括肺炎克雷伯菌;所述假单胞菌属包括铜绿假单胞菌;所述肠球菌属包括:粪肠球菌,屎肠球菌;所述凝固酶阳性葡萄球菌属包括:金黄色葡萄球菌;所述凝固酶阴性葡萄球菌属包括:表皮葡萄球菌;所述肠杆菌属包括:阴沟肠杆菌复合群;所述分枝杆菌属包括:结核分枝杆菌复合群;所述链球菌属包括:化脓链球菌;所述念珠菌属包括:白色念珠菌。
第2组实施例、本发明的引物组合的用途
本组实施例提供第1组实施例任一项所提供的一种高通量高精度检出多种病原微生物的引物组合在非诊断目的地检测病原微生物或者制备检测病原微生物试剂方面的用途。
在具体的实施例中,所述病原微生物选自:埃希菌属、不动杆菌属、克雷伯菌属、假单胞菌属、肠球菌属、凝固酶阳性葡萄球菌属、凝固酶阴性葡萄球菌属、肠杆菌属、分枝杆菌属、链球菌属、念珠菌属。
因本发明的引物组合涉及16S、ITS等通用引物,因此除了上述病原微生物以外,本发明还可检测如下病原微生物:肠道沙门菌、单核细胞增生李斯特菌、新生隐球菌等;除上述病原微生物以外,本发明还可检测如下微生物:酿酒酵母、枯草芽孢杆菌、发酵乳杆菌。
更具体地,所述埃希菌属包括大肠埃希菌;所述不动杆菌属包括鲍曼不动杆菌;所述克雷伯菌属包括肺炎克雷伯菌;所述假单胞菌属包括铜绿假单胞菌;所述肠球菌属包括:粪肠球菌,屎肠球菌;所述凝固酶阳性葡萄球菌属包括:金黄色葡萄球菌;所述凝固酶阴性葡萄球菌属包括:表皮葡萄球菌;所述肠杆菌属包括:阴沟肠杆菌复合群;所述分枝杆菌属包括:结核分枝杆菌复合群;所述链球菌属包括:化脓链球菌、猪链球菌;所述念珠菌属包括:白色念珠菌。
第3组实施例、本发明的试剂盒
本组实施例提供一种高通量高精度检出多种病原微生物的试剂盒。本组所有的实施例都具备如下共同特征:所述试剂盒包括:第1组实施例任一项所提供的一种高通量高精度检出多种病原菌的引物组合。
在进一步的实施例中,所述的一种高通量高精度检出多种病原微生物的试剂盒还包括:PCR常规试剂、和/或,测序常规试剂。
在具体的实施例中,所述病原微生物选自:埃希菌属、不动杆菌属、克雷伯菌属、假单胞菌属、肠球菌属、凝固酶阳性葡萄球菌属、凝固酶阴性葡萄球菌属、肠杆菌属、分枝杆菌属、链球菌属、念珠菌属。
因本发明的引物组合涉及16S、ITS等通用引物,因此除了上述病原微生物以外,本发明还可检测如下病原微生物:肠道沙门菌、单核细胞增生李斯特菌、新生隐球菌等;除上述病原微生物以外,本发明还可检测如下微生物:酿酒酵母、枯草芽孢杆菌、发酵乳杆菌。
更具体地,所述埃希菌属包括大肠埃希菌;所述不动杆菌属包括鲍曼不动杆菌;所述克雷伯菌属包括肺炎克雷伯菌;所述假单胞菌属包括铜绿假单胞菌;所述肠球菌属包括:粪肠球菌,屎肠球菌;所述凝固酶阳性葡萄球菌属包括:金黄色葡萄球菌;所述凝固酶阴性葡萄球菌属包括:表皮葡萄球菌;所述肠杆菌属包括:阴沟肠杆菌复合群;所述分枝杆菌属包括:结核分枝杆菌复合群;所述链球菌属包括:化脓链球菌;所述念珠菌属包括:白色念珠菌。
第4组实施例、本发明的检测方法
本组实施例提供一种非诊断目的地高通量高精度检出多种病原微生物的方法。本组所有的实施例都具备如下共同特征:采用第1组实施例任一项所提供的一种高通量高精度检出多种病原微生物的引物组合、或,采用第3组实施例任一项所提供的一种高通量高精度检出多种病原微生物的试剂盒对待测样本进行PCR扩增。
在具体的实施例中,每微升PCR扩增体系包含:0.5μl的PCR反应混合液、0.2μM的上游引物F工作液、0.2μM的下游引物R工作液、0.3μl的模板;
优选地,所述PCR反应混合液为2×Phanta Flash Master Mix;
所述模板为样本提取的DNA或样本;
优选地,所述样本选自:微生物培养物或血液;
优选地,所述PCR扩增程序包括:98℃30s;以98℃10s、55℃5s、68℃10s为1个循环,共28个循环;68℃1min。
在进一步的实施例中,对PCR扩增的产物进行测序,并将测序结果进行生物信息学分析。
具体地,所述生物信息系分析指:将测序结果的序列与微生物序列库比对,同源性匹配的微生物种属即为检出的病原微生物。
在具体的实施例中,所述病原微生物包括但不限于:埃希菌属、不动杆菌属、克雷伯菌属、假单胞菌属、肠球菌属、凝固酶阳性葡萄球菌属、凝固酶阴性葡萄球菌属、肠杆菌属、分枝杆菌属、链球菌属、念珠菌属。
因本发明的引物组合涉及16S、ITS等通用引物,因此除了上述病原微生物以外,本发明还可检测如下病原微生物:肠道沙门菌、单核细胞增生李斯特菌、新生隐球菌等;除上述病原微生物以外,本发明还可检测如下微生物:酿酒酵母、枯草芽孢杆菌、发酵乳杆菌。
更具体地,所述埃希菌属包括大肠埃希菌;所述不动杆菌属包括鲍曼不动杆菌;所述克雷伯菌属包括肺炎克雷伯菌;所述假单胞菌属包括铜绿假单胞菌;所述肠球菌属包括:粪肠球菌,屎肠球菌;所述凝固酶阳性葡萄球菌属包括:金黄色葡萄球菌;所述凝固酶阴性葡萄球菌属包括:表皮葡萄球菌;所述肠杆菌属包括:阴沟肠杆菌复合群;所述分枝杆菌属包括:结核分枝杆菌复合群;所述链球菌属包括:化脓链球菌;所述念珠菌属包括:白色念珠菌。
本申请是基于纳米孔测序平台的全血样本的建库方法,其特征在于,所述方法包括如下步骤:1)核酸提取步骤:对全血样本进行核酸提取;2)靶向扩增步骤:基于靶向引物对提取的核酸进行靶向扩增;所述靶向引物包括通用引物和特异性引物;3)扩增产物混合步骤;4)扩增产物纯化步骤;5)测序文库构建步骤:基于商品化文库构建试剂盒对扩增产物进行文库构建。
在一些实施方式中,所述通用引物分别针对ITS、16s、rplB、pyrG、EF-TU、gyrB、17kDa、dnaK、RpoB基因,所述特异性引物分别针对金黄色葡萄球菌yqiL基因和铜绿假单胞菌oprL基因;在一些实施方式中,所述通用引物和特异性引物序列具体如SEQ ID NO.1-33所示;在一些实施方式中,所述引物分3个引物池进行扩增,引物池1引物序列如SEQ IDNO.1-11所示,所述引物池2引物序列如SEQ ID NO.12-19所示,所述引物池3引物序列如SEQID NO.20-33所示;在一些实施方式中,所述引物池1、引物池2和引物池3的扩增产物体积比为:5∶(1-2)∶2;在一些具体实施方式中,所述比例为5∶2∶2。
本申请的全血样本的测序方法,包括上述任一所述方法,并进一步包括采用纳米孔测序平台进行文库上机测序的步骤。
本申请的全血样本的检测方法,包括上述方法,并进一步包括,对测序数据进行生物信息学分析步骤。
本申请的基于纳米孔测序平台的用于全血样本建库的引物组,所述引物组包括通用引物和特异性引物,所述通用引物分别针对ITS、16s、rplB、pyrG、EF-TU、gyrB、17kDa、dnaK和RpoB,所述特异性引物分别针对金黄色葡萄球菌yqiL基因和铜绿假单胞菌oprL基因。在一些实施方式中,所述通用引物和特异性引物序列具体如SEQ ID NO.1-33所示。在一些实施方式中,所述引物分3个引物池进行扩增,引物池1引物序列如SEQ ID NO.1-11所示,所述引物池2引物序列如SEQ ID NO.12-19所示,所述引物池3引物序列如SEQ ID NO.20-33所示;在一些实施方式中,所述引物池1、引物池2和引物池3的扩增产物体积比为:5∶(1-2)∶2;在一些具体实施方式中,所述比例为5∶2∶2。
下面结合具体实验例来阐述本申请的技术效果。
实验例1、本申请方法流程建立
1.样本前处理
取全血样本加入商品化DNA/RNA裂解液,充分混匀后离心处理。
2.核酸提取
采用商品化试剂盒进行核酸提取,提取方式按照试剂盒说明书要求进行提取。
3.靶向扩增
基于设计的靶向引物体系,使用诺唯赞生物技术有限公司2×Phanta FlashMaster Mix(P510)试剂
盒进行靶向扩增,具体体系如下表1所示:
将配置好的反应体系混匀后,瞬时离心,在PCR仪上进行扩增反应。扩增程序如下表2所示:
表2
所述通用引物和特异性引物,共16对,共分3个引物池(引物池1、2、3),每个引物池内引物将F端和R端分开进行配制,混池时从工作液中每个取2μl到20μlPCR反应体系中,引物终浓度为0.2μM per primer。
引物池1中的引物:每对引物以相同的浓度(0.2μM per primer)进行混合,混合后形成引物池1;(只要保证每个引物浓度是0.2μM就可以,体积可大可小)。
引物池2中的引物:每对引物同样以相同的浓度(0.2μM per primer)进行混合,混合后形成引物池2。
引物池3中的引物:每对引物以相同的浓度(0.2μM per primer)进行混合,混合后形成引物池3。
在扩增的时候是3个引物池单独进行扩增,比如要扩增引物池1,需要加入10μlmaster mix,2μl混好的引物池1-F端,2μl混好的引物1-R端和6μl提取DNA-总共20μl进行扩增;这里只扩增了引物池1;而引物池2,同样也需要10μl master mix,2μl混好的引物2-F端,2μl混好的引物2-R端和6μl提取DNA-总共20μl进行扩增;引物池3同理。在三个引物池都扩增好后,再将三个引物池所在的扩增体系所得的扩增产物按照:5∶(1-2)∶2优选5:2:2的体积比混合在一起,也就是15μl:(2-6μl):6μl,一共27μl。后续的纯化会使用这27μl进行。
4.扩增产物混合
PCR反应结束后,按照如下体积将每个样本3个引物池的扩增产物混入一个新的1.5ml离心管中。
表3
5.扩增产物纯化
选择商品化纯化磁珠进行纯化,纯化方式按照磁珠纯化说明书要求进行纯化。
6.文库构建
使用ONT商品化文库构建试剂盒进行文库构建。
7.磁珠纯化:选用商品化试剂盒进行纯化。
8.文库上机:使用ONT(Oxford Nanopore)SQK-PBK004试剂盒进行上机前准备。
9.测序运行:采用三代纳米孔测序平台GridION进行测序。
10.生信分析:对测序下机数据进行生信分析。
实验例2、本发明引物组合的获得
为实现血流感染的精准评估,需要对全血样本中病原菌全面靶向,本申请通探索研究,寄希望全面覆盖血液中诸如所述病原微生物选自:埃希菌属、不动杆菌属、克雷伯菌属、假单胞菌属、肠球菌属、凝固酶阳性葡萄球菌属、凝固酶阴性葡萄球菌属、肠杆菌属、分枝杆菌属、链球菌属、念珠菌属等,通过引物设计和序列优化,本申请最终确立用于本申请后续检测的引物序列如下表4所示。而为建库测序需要,所有F/R扩增引物序列在5'端需加入如下序列:
测序F-TTTCTGTTGGTGCTGATATTGC(SEQ ID NO.34)
测序R-ACTTGCCTGTCGCTCTATCTTC(SEQ ID NO.35)。
上述引物为测序所需的接头序列,需要加上才能进行测序。
表4
/>
/>
其中,W=A or T;R=A or G;Y=C or T;K=G or T;M=A or C;V=A,C or G;N=A,C,G,or T。
实验例3、本发明引物组分池及配比实验
用实验例2表4的引物组合,在未进行分池时进行了30例临床样本测试,扩增产物中产物来源占比结果如图1所示,图1中,30例临床样本平均数值人源非特异扩增占比可以达到86%。
将表4的引物组合按表4左起第3列进行分池后分别进行PCR扩增,同样进行了30例临床样本测试,扩增产物中产物来源占比结果如图2所示,图2中,30例临床样本在进行分池后人源非特异扩增占比降低到11.55%。
将表4的引物组合按表4左起第3列进行分池后分别进行PCR扩增,各引物池所在的扩增体系得到的扩增产物按照:5∶(1-2)∶2优选5:2:2的体积比混合再进行纯化、上机测序、生信分析。同样进行了30例临床样本测试,扩增产物中产物来源占比结果如图3所示,图3中,30例临床样本在进行分池后人源非特异扩增占比降低到8.42%。
人源非特异性扩增占比的计算方法为:对扩增产物的测序结果进行生信分析,测序得到的每条序列经过质控评价后如果合格则归为有效序列。每条有效序列分别与人源基因组数据库和病原菌基因组数据库进行序列比对,能与病原菌基因组数据库比对上的序列为病原菌序列,能与人源基因组数据库比对上的序列为人源非特异性扩增序列,图1-图3中的人源非特异性扩增占比就是人源非特异性扩增序列的数量占测序结果中所有有效序列的数量总和的比值。
上述人源非特异性扩增占比的计算方法为本领域技术人员根据分子生物学领域的基本常识并结合分子生物学领域的常规技术手段(例如,扩增、测序、生信分析、序列比对等)可以常规计算得到的。
实验例4、临床样本实际检测
a)样本制备
取17例临床血培养有明确病原微生物的全血样本,取1ml全血样本通过步骤1,步骤2提取核酸后,按照本申请确立的最优实验例流程进行建库测序,上机测序时长为2h。样本均正常建库并获得测序数据,测序数据的深度保持一致。
b)不同临床血液样本检测结果如下表5所示:
表5
结果表明,本申请的多重靶向测序检验结果与常规培养结果一致性达88.2%(15/17),仅有2例结果与常规血培养不一致,说明本检测流程在面对真实临床血液样本时具有可靠的细菌/真菌检测能力。
上表中样本X16对应的一行结果中,对照方法X-pert为检测本领域公知的检测结核分枝杆菌的金标准,该方法的操作是本领域技术人员熟知的常规技术手段。
实验例5、微生物培养物的检测实验
本实验例使用肠球菌属(屎肠/粪肠)、埃希菌属(大肠埃希菌)、不动杆菌属(鲍曼不动)、假单胞菌属(铜绿)、克雷伯菌属(肺克)、凝固酶阳性葡萄球菌(金葡)、凝固酶阴性葡萄球菌属(表葡)、肠杆菌属(阴沟)、链球菌属(化脓链球菌)、念珠菌属(白念),
一、微生物培养物的检测限,灵敏度实验
本实验例制备两个参考盘,每个参考盘中包括4种病原微生物(选取4种病原微生物是为了尽可能模拟真实临床血流感染样本,因为一般血流感染的样本中所感染的病原菌种类<4种)
(一)制备参考盘1
参考盘1:使用商业化ATCC菌种,选取4种ATCC的菌株(下表6)进行活化培养,培养后将其与健康人血液进行混合,每次实验进行10次技术重复。混合后使用天根生化科技(北京)有限公司微量样品基因组DNA提取试剂盒(DP316)进行提取得到参考盘1的核酸。
表6
样本前处理及建库上机
将参考盘1参照发明方案详细描述中步骤1-9处理,所有样本均构建为合格的测序文库
上机检测
将参考盘1构建好的文库进行上机测序,并采取同样的测序深度
(二)制备参考盘2
参考盘2:使用商业化ATCC菌种,选取4种ATCC的菌株(下表7)进行活化培养,培养后将其与健康人血液进行混合,每次实验进行10次技术重复。混合后使用天根生化科技(北京)有限公司微量样品基因组DNA提取试剂盒(DP316)进行提取得到参考盘2的核酸。
表7
样本前处理及建库上机
将参考盘2参照发明方案详细描述中步骤1-9处理,所有样本均构建为合格的测序文库
上机检测
将参考盘2构建好的文库进行上机测序,并采取同样的测序深度
(三)具体检测结果如下:
表8为参考盘1和参考盘2检测限和灵敏度结果:
表8
/>
二、商业化标准品及临床全血样本检验本发明引物组的性能
(一)制备标准品1
标准品1使用商业化zymo Research公司生产的标准菌株ZymoBIOMICS MicrobialCommunity Stan dard(D6300)作为验证的输入,它是由精确确定量比例的临床上非常常见的8种细菌和2种真菌组成,总体的GC含量分布很广(15%-85%),将其掺入到10
表9
样本前处理及建库上机
将标准品1和临床样本按照发明方案详细描述中步骤1-9处理,所有样本均构建为合格的测序文库上机检测
将标准品1和临床样本构建好的文库进行上机测序,并采取同样的测序深度
(二)具体检出结果如下
表10为标准品1和临床样本的检出结果:
表10
上表10的数据证明本发明的引物组合检测标准品1和临床样本中的20种菌检出性能过关,且在多种菌混合模板中仍能高灵敏度地精准鉴别出各类病原菌。
最后应说明的是:以上各实施例仅用以说明本申请的技术方案,而非对其限制;尽管参照前述各实施例对本申请进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本申请各实施例技术方案的范围。
