KDM1A在抑制RNA病毒刺激下干扰素IFNβ表达中的应用
文献发布时间:2023-06-19 10:11:51
技术领域
本发明专利属于生物工程领域,具体是指通过改变组蛋白去甲基化酶基因KDM1A的表达量或者活性在抑制RNA病毒刺激下干扰素IFNβ表达中的应用。
背景技术
病毒等病原体侵入机体后首先会激活机体的天然免疫系统。以RNA病毒为例,当RNA病毒入侵后会被RIG-I,MDA等模式识别受体所识别,进而将信号呈递给位于线粒体上的MAVS,再激活下游的TBK1,而TBK1则发挥其激酶活性磷酸化位于胞质的IRF3,磷酸化了的IRF3可以入核,定位到IFNβ的启动子上促进其表达以及下游抗病毒因子的表达和释放。然而当机体对于病原体的免疫反应过于激烈时,则容易引发细胞因子风暴。
目前,细胞因子风暴的成因还不是非常明确,一般认为是免疫系统对新的、高致病的病原体产生的过激反应,即:免疫调控网络失衡、负反馈的缺失和正反馈的不断自我放大,使得多种细胞因子异常升高,最终导致细胞因子风暴。如上文所述,当IFNβ等细胞因子表达后,NK(自然杀伤)细胞会被激活分泌IFN-γ进而激活巨噬细胞,活化后的巨噬细胞释放大量的TNF-α、IL-12等更多的细胞因子反过来活化NK细胞。由此形成正反馈调节,细胞因子剧烈增多。正常情况下,一旦机体在“正反馈”调节下控制住入侵的病原体,抗原信号提呈给适应性免疫系统的信号减弱,细胞因子释放就会开始减少,炎症反应也会逐步减弱,从而形成“负反馈”(负循环)调节。然而,当机体遭受猛烈的病毒攻击时,比如SARS、新冠病毒等冠状RNA,机体免疫系统在“正反馈”的作用下释放大量的细胞因子,细胞因子信号被极度放大,而机体的“负反馈”调控太弱太迟,就可能导致机体免疫调控网络失衡,引起细胞因子风暴而导致疾病恶化。
KDM1A是首个被发现的组蛋白去甲基化酶,负责组蛋白H3第四位和第九位上的赖氨酸的一二甲基化的去除。当发挥第四位上的赖氨酸甲基化去除的功能时表现出一个协同抑制因子的作用,而当去除第九位上赖氨酸的甲基化时主要是一个协同激活因子的作用。但是这些去甲基化作用都需要RCOR1/CoREST的存在,否则KDM1A无法单独行使去甲基化酶的功能。除了去除组蛋白上的甲基化修饰,有报道指出,KDM1A也可以去掉TP53第三百七十位上赖氨酸的二甲基化修饰,进而抑制TP53与下游靶标基因的相互作用,使p53信号通路被抑制。除此之外,KDM1A还能对DNA甲基化酶DNMT1进行去甲基化促进DNMT1的稳定性。
因此,研究KDM1A,开发KDM1A的更多功能显得很有必要。
发明内容
发明人在天然免疫信号通路和表观遗传修饰酶之间的关系有较长时间的研究,之前的研究发现甲基化酶WDR82和具有甲基化酶重要结构域SET结构域的TTLL12都对RIG-I信号通路有显著的影响。而我们现在的研究则发现了,KDM1A这一去甲基化酶在RIG-I信号通路中同样能够发挥影响,敲低KDM1A后,在仙台病毒刺激下,RIG-I信号通路激活程度明显下降,IFNβ等细胞因子的激活明显降低。这一发现则为抗病毒的研究提供了新的靶点,同时也为调节病毒刺激干扰素等细胞因子的产生提供了新思路。(组蛋白去甲基化酶基因KDM1A以下简称KDM1A)
本发明旨在至少在一定程度上解决现有技术中存在的技术问题之一,为此,提供一种
通过抑制组蛋白去甲基化酶基因KDM1A表达或抑制组蛋白去甲基化酶基因KDM1A表达产物的活性在抑制RNA病毒刺激下干扰素IFNβ表达中的应用,尤其指非治疗非诊断方面的应用。
在本发明的技术方案中,本发明提供一种通过RNA干扰抑制组蛋白去甲基化酶基因KDM1A表达的siRNA在抑制RNA病毒刺激下干扰素IFNβ表达中的应用,尤其指非治疗非诊断方面的应用。
在本发明的技术方案中,本发明提供一种通过RNA干扰抑制组蛋白去甲基化酶基因KDM1A表达的siRNA在制备抑制RNA病毒刺激下干扰素IFNβ表达的药物中的应用。
在本发明的技术方案中,所述siRNA的核苷酸序列如SEQ ID NO:1所示。
在本发明的技术方案中,所述siRNA的核苷酸序列还可以如SEQ ID NO:2所示。
在本发明的技术方案中,本发明还提供一种通过小分子抑制剂抑制组蛋白去甲基化酶基因KDM1A表达产物的活性在抑制RNA病毒诱导干扰素IFNβ表达中的应用,尤其指非治疗非诊断方面的应用。
在本发明的技术方案中,本发明还提供一种通过小分子抑制剂抑制组蛋白去甲基化酶基因KDM1A表达产物的活性在制备抑制RNA病毒刺激下干扰素IFNβ表达的药物中的应用。
在本发明的技术方案中,所述小分子抑制剂为2-PCPA。
在本发明的技术方案中,所述RNA病毒包括仙台病毒SeV、口炎疱疹病毒VSV中的一种或多种。
在本发明的技术方案中,所述RNA病毒刺激为RNA病毒在哺乳动物细胞中的感染、复制,所述哺乳动物细胞包括HEK293细胞、HEK293T细胞、MEF细胞和RKO细胞。
解晶晶、张守平等人在Regulatory roles of c-jun in H5N1 influnza virusreplication and host inflammation.BBA molecular basis of disease,2014,1842(12):2479-2488中已经公开发表了IFNβ的抑制表达促进了RNA病毒诱导炎症的发生。
在本发明的技术方案中,提供一种通过抑制组蛋白去甲基化酶基因KDM1A表达在抑制RNA病毒感染及诱导炎症中的应用,尤其指非治疗非诊断方面的应用。
在本发明的技术方案中,本发明提供一种通过RNA干扰抑制组蛋白去甲基化酶基因KDM1A表达的siRNA在抑制RNA病毒感染及诱导炎症中的应用,尤其指非治疗非诊断方面的应用。
在本发明的技术方案中,本发明提供一种通过RNA干扰抑制组蛋白去甲基化酶基因KDM1A表达的siRNA在制备抑制RNA病毒感染及诱导炎症的药物中的应用。
在本发明的技术方案中,所述siRNA的核苷酸序列如SEQ ID NO:1所示。
在本发明的技术方案中,所述siRNA的核苷酸序列还可以如SEQ ID NO:2所示。
在本发明的技术方案中,本发明还提供一种通过小分子抑制剂抑制组蛋白去甲基化酶基因KDM1A表达在抑制RNA病毒感染及诱导炎症中的应用,尤其指非治疗非诊断方面的应用。
在本发明的技术方案中,本发明还提供一种小分子抑制剂2-PCPA在制备抑制RNA病毒感染及诱导炎症的药物中的应用。
在本发明的技术方案中,所述小分子抑制剂为2-PCPA。
本发明的有益效果在于:
1、本发明确定了KDM1A基因与RNA病毒感染的关系,KDM1A基因可以作为RNA病毒感染的治疗靶点;
2、本发明研究表明抑制KDM1A能够抑制降低RNA病毒刺激下干扰素IFNβ等细胞因子的激活,可应用于RNA病毒诱导的细胞因子风暴及炎症相关疾病,为临床上RNA病毒感染、及相关疾病的评估和研究提供了新的理论依据。
附图说明
图1为稳定表达HA-KDM1A的HEK293T细胞系和对照HEK293T细胞系(HA-vec)这两种细胞系外源HA-KDM1A的表达情况的结果示意图;
图2为过表达KDM1A的HEK293T细胞系和对照组HEK293T细胞系分别用仙台病毒SeV刺激下的细胞中的干扰素IFNβ表达情况结果示意图;
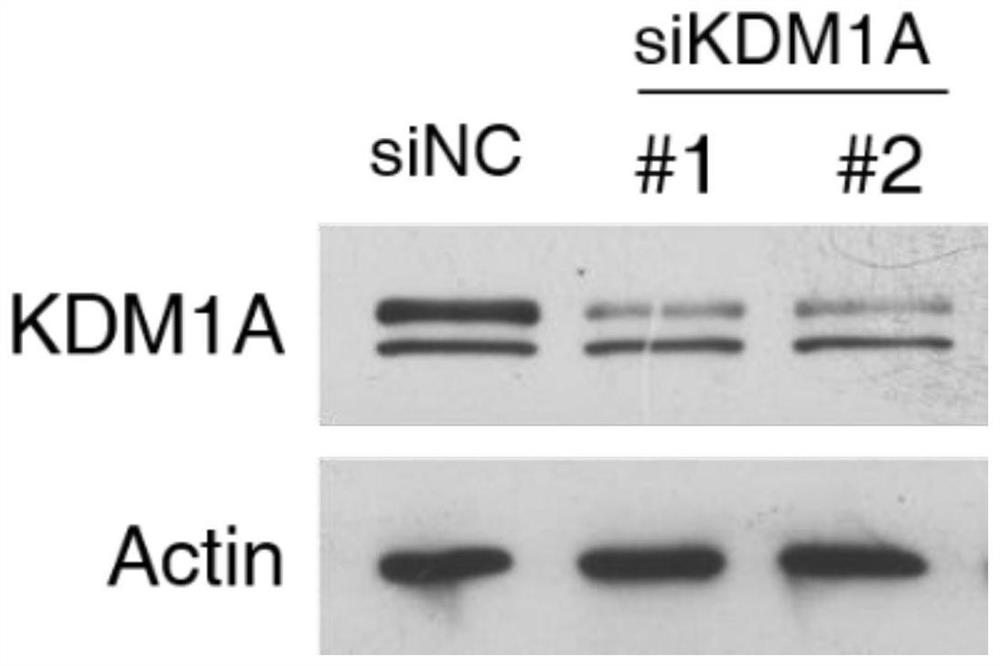
图3为敲低KDM1A的HEK293T细胞系和对照HEK293T细胞系中内源KDM1A的表达情况的结果示意图;
图4为敲低KDM1A的HEK293T细胞系和对照组HEK293T细胞系分别用仙台病毒SeV刺激下的细胞中的干扰素IFNβ表达情况结果示意图;
图5为2-PCPA处理HEK293细胞系和对照组HEK293T细胞系分别用仙台病毒SeV刺激下的细胞中的干扰素IFNβ表达情况示意图。
具体实施方式
下面将结合实施例对本发明的方案进行解释。本领域技术人员将会理解,下面的实施例仅用于说明本发明,而不应视为限定本发明的范围。实施例中未注明具体技术或条件的,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。
本发明中涉及到的简称、英文名、中文名的对应关系如下表所示。
实施例1:在HEK293T细胞系中过量表达KDM1A能够上调SeV(仙台病毒)刺激下干扰素IFNβ的表达
1、用酶切酶连法构建pHAGE-HA-KDM1A的质粒
根据pHAGE-HA载体上的酶切位点及NCBI上KDM1A的mRNA序列选择合适的核酸内切酶并设计PCR扩增引物,本实验室常用的BamH I在KDM1A上有酶切位点,但考虑到无BglII的酶切位点,利用BamH I和BglII的同尾酶特性,设计引物时在正向引物加入BglII的酶切位点序列,而在酶切载体时使用BamH I进行酶切。
(1)KDM1A PCR引物设计如下:
正向引物:AAAAAGATCTATGTTGTCTGGGAAGAAGGC
反向引物:TTTTCTCGAGTCACATACTTGGGGACTGCT
(2)利用已有cDNA进行PCR扩增得到在两端带有酶切位点的KDM1A片段,其扩增体系及程序如下:
扩增体系为:
扩增程序为:
分别使用BamH I和Xho I以及Bgl II和Xho I的双酶组合对pHAGE-HA和KDM1A的PCR片段进行酶切过夜,回收酶切产物并纯化。
(3)对酶切后的pHAGE-HA载体和KDM1A片段进行连接,连接体系如下:
(4)转化涂平板
向连接产物中加入100μl DH5α感受态细胞,混匀后冰上放置30分钟,42℃热激90秒后加入900μL无抗性的LB培养基,37℃培养1小时后低转速离心,弃掉900μL的上清,留100μL重悬菌液,用涂布平板法将菌液涂到氨苄抗性的平板上。37℃培养箱培养12小时。
(5)挑单克隆扩增
挑取平板上生长的单菌落并接种于一定体积的LB液体培养基中,37℃培养12小时。
(6)提取质粒
高转速离心收集大肠杆菌,根据试剂盒说明书提取质粒DNA
(7)测序验证
将质粒DNA送交公司进行测序并与NCBI上的KDM1A的mRNA序列进行比对,选取比对完全相同的质粒进行下一步实验。
2、构建稳定表达HA-KDM1A的HEK293T(人肾上皮永生化细胞)细胞系
(1)获得带有HA-KDM1A的慢病毒
首先在293FRT细胞系中将HA-KDM1A质粒与包装质粒psPAX2和pMG2.D以2:1:1的比例共转,转染48小时后收集细胞培养基并用0.45μm滤器过滤得到病毒悬液,放于负八十摄氏度下保存。
(2)事先准备好待感染的HEK293细胞系,将病毒加入HEK293T细胞中并根据总的培养基体积以一定比例加入聚凝胺polybrene,感染24小时后换液。加入筛选抗生素嘌呤霉素进行筛选,最终活下来的细胞即为所需的HA-KDM1A稳定表达细胞系。
通过Western Blot技术分别检测稳定表达HA-KDM1A的HEK293T细胞系和对照HEK293T细胞系(HA-vec)这两种细胞系外源HA-KDM1A的表达情况,结果如图1所示,由图1可以看出,稳定表达HA-KDM1A的HEK293T细胞系相对于对照组HEK293T细胞系,其KDM1A过量表达。
3、在KDM1A过量表达的HEK293T细胞系(稳定表达HA-KDM1A的HEK293T细胞系)和对照组HEK293T细胞系中分别加入10MOI SeV刺激12小时。
4、提取细胞总RNA:根据艾德莱公司的RNA提取试剂盒说明书操作。
5、获得cDNA:根据诺唯赞公司的反转录试剂盒说明书操作。
6、设计IFNβ检测引物:
IFNβ正向引物:AAAGAAGCAGCAATTTTCAG
IFNβ反向引物:CTGTCCTTGAGGCAGTATTC
7、通过Q-PCR进行检测:将合适浓度的cDNA、5μM的检测引物以及诺唯赞公司的Q-PCR mix buffer以1:1:2的比例混合,总体积为10μL。
Q-PCR程序如下:
经过计算得到IFNβ的相对表达量,并计算KDM1A对于IFNβ表达的影响。
KDM1A过量表达的HEK293T细胞系和对照组HEK293T细胞系,用仙台病毒SeV刺激12小时,提取细胞mRNA,用q-PCR检测干扰素IFNβ表达水平,结果如图2所示,由图2可以看出,KDM1A过量表达的HEK293T细胞系干扰素IFNβ表达量高。由此可知,HEK293T细胞中过量表达KDM1A可以上调RNA病毒刺激下的细胞中的干扰素IFNβ表达。
实施例2:敲低KDM1A能抑制SeV(仙台病毒)刺激下干扰素IFNβ的表达
1、设计KDM1A的siRNA
根据NCBI中的KDM1A编码序列设计siRNA,具体如下:
siKDM1A 1#:5’-AAGGAAAGCUAGAAGAAAAUU-3’(SEQ ID NO:1)
siKDM1A 2#:5’-CAGAAGGCCUAGACAUUAAUU-3’(SEQ ID NO:2)
siNC:5’-UUCUCCGAACGUGUCACGUTT-3’(NC为阴性对照,其序列不针对任何基因)
2、转染siRNA:
(1)配制转染试剂:首先将1μL的siRNA和2μL的脂质体lipofectamine2000分别加入到100μL的无血清培养基OPTI-DMEM中,放置数分钟后将二者混匀,放置20分钟后待用。
(2)取生长良好的HEK293T细胞,对于每个六孔板的孔加入4*100000个新消化的HEK293T细胞,并加入(1)中配制好的siRNA转染试剂,继续培养即得到敲低KDM1A的HEK293T细胞系。
通过Western Blot技术分别检测敲低KDM1A的HEK293T细胞系和对照HEK293T细胞系(HA-vec)这两种细胞系外源HA-KDM1A的表达情况,结果如图3所示,由图3可以看出,敲低KDM1A的HEK293T细胞系相对于对照组HEK293T细胞系,其KDM1A表达弱。
3、在转染siNC的对照组HEK293T细胞系和转染siRNA(siKDM1A 1#、siKDM1A 2#)的敲低KDM1A的HEK293T细胞系中用10MOI SeV处理12小时。
4、提取细胞总RNA。
5、获得cDNA。
6、通过Q-PCR检测上述两种细胞系中IFNβ的表达情况。
敲低KDM1A的HEK293T细胞系和对照组HEK293T细胞系,用仙台病毒SeV刺激12小时,提取细胞mRNA,用q-PCR检测干扰素IFNβ表达水平,结果如图4所示,由图4可以看出,敲低KDM1A的HEK293T细胞系干扰素IFNβ表达量较低。由此可知,HEK293T细胞中敲低KDM1A可以下调RNA病毒刺激下的细胞中的干扰素IFNβ表达。
实施例3:在HEK293T细胞系中用2-PCPA抑制基因KDM1A表达产物的活性能够下调SeV刺激下干扰素IFNβ的表达
Dawn M Z Schmidt等人在trans-2-Phenylcyclopropylamine is a mechanism-based inactivator of the histone demethylase LSD1.Biochemistry,2007,46:4408-4416中公开了2-PCPA是基因KDM1A表达产物活性的抑制剂。
1、在DMSO处理的对照组HEK293T细胞系和2-PCPA处理的HEK293T细胞系中用10MOISeV处理9小时和12小时,其中DMSO和2-PCPA处理24小时,2-PCPA处理的浓度为500mM。
2、提取细胞总RNA。
3、获得cDNA。
4、通过Q-PCR检测上述两种细胞系中IFNβ的表达情况。
在DMSO处理的对照组HEK293T细胞系和2-PCPA处理的HEK293T细胞系,用仙台病毒SeV刺激9小时和12小时,提取细胞mRNA,用q-PCR检测干扰素IFNβ表达水平,结果如图5所示,由图5可以看出,2-PCPA处理的HEK293T细胞系干扰素IFNβ表达量较低。由此可知,2-PCPA处理可以下调RNA病毒刺激下的细胞中的干扰素IFNβ表达。
尽管上面已经示出和描述了本发明的实施例,可以理解的是,上述实施例是示例性的,不能理解为对本发明的限制,本领域的普通技术人员在本发明的范围内可以对上述实施例进行变化、修改、替换和变型。
序列表
<110> 武汉大学
<120> KDM1A在抑制RNA病毒刺激下干扰素IFNβ表达中的应用
<160> 2
<170> SIPOSequenceListing 1.0
<210> 1
<211> 21
<212> RNA
<213> 人工序列(Artificial Sequence)
<400> 1
aaggaaagcu agaagaaaau u 21
<210> 2
<211> 21
<212> RNA
<213> 人工序列(Artificial Sequence)
<400> 2
cagaaggccu agacauuaau u 21
- KDM1A在抑制RNA病毒刺激下干扰素IFNβ表达中的应用
- KDM1A在抑制RNA病毒刺激下干扰素IFNβ表达中的应用
