用于条件性激活免疫球蛋白分子的结合部分
文献发布时间:2023-06-19 10:14:56
本申请要求2018年5月14日提交的第62/671,344号、2018年5月14日提交的第62/671,349号、2018年11月6日提交的第62/756,429号和2018年11月6日提交的第62/756,453号美国临时申请的权益,所述临时申请中的每一个均通过引用整体并入本文。
本说明书中所提及的所有出版物、专利和专利申请均通过引用并入本文,其程度犹如具体地且单独地指出每个单独的出版物、专利或专利申请均通过引用而并入,并且犹如以其整体阐述。
背景技术
T细胞接合物将T细胞暂时栓系在肿瘤细胞上,并介导T细胞指导的肿瘤杀伤。T细胞接合物(engager),如兰妥莫单抗(blinatumomab)
存在以下需求:延长治疗性、诊断性或成像分子在循环中的半衰期,并且还改善其在没有非特异性结合的情况下达到预期位置(例如肿瘤细胞)内的其靶标的能力。
发明内容
一个实施方案提供了一种包含非CDR环和可切割连接体的结合部分,其中所述部分能够掩蔽结合分子与其靶标的结合,其中所述结合分子包括免疫球蛋白分子或非免疫球蛋白分子。在一些实施方案中,所述部分是天然肽、合成肽、工程化支架或工程化大体积血清蛋白。在一些实施方案中,所述工程化支架包括sdAb、scFv、Fab、VHH、III型纤连蛋白结构域、免疫球蛋白样支架、DARPin、胱氨酸结肽、脂质运载蛋白、三螺旋束支架、蛋白G相关的白蛋白结合模块,或DNA或RNA适体支架。在一些实施方案中,所述部分能够与大体积血清蛋白结合。在一些实施方案中,所述非CDR环来自可变域、恒定域、C1-set域、C2-set域、I-域或其任意组合。在一些实施方案中,所述部分进一步包含互补决定区(CDR)。在一些实施方案中,所述部分能够与大体积血清蛋白结合。在一些实施方案中,所述大体积血清蛋白是延长半衰期的蛋白质。在一些实施方案中,所述大体积血清蛋白是白蛋白、转铁蛋白、IgG1、IgG2、IgG4、IgG3、IgA单体、因子XIII、纤维蛋白原、IgE或五聚体IgM。在一些实施方案中,所述大体积血清蛋白是白蛋白、转铁蛋白、因子XIII或纤维蛋白原。在一些实施方案中,所述结合部分内的CDR提供对所述大体积血清蛋白具有特异性的结合位点。在一些实施方案中,所述结合部分能够通过所述结合部分与所述靶抗原结合域或非免疫球蛋白结合部分之间的特异性分子间相互作用来掩蔽所述靶抗原结合域(如免疫球蛋白分子)或非免疫球蛋白结合分子与其靶标的结合。在一些实施方案中,所述结合部分内的非CDR环提供对所述结合部分与所述靶抗原结合域(如免疫球蛋白分子)或非免疫球蛋白结合分子的结合具有特异性的结合位点。
在一些实施方案中,所述结合部分包含对免疫球蛋白轻链具有特异性的结合位点。在一些实施方案中,所述免疫球蛋白轻链是不含Igκ的轻链。在一些实施方案中,所述CDR提供对所述大体积血清蛋白或所述免疫球蛋白轻链具有特异性的结合位点。在一些实施方案中,所述免疫球蛋白分子是靶抗原结合域。在一些实施方案中,所述部分与所述靶抗原结合域结合。在一些实施方案中,所述部分与所述靶抗原结合域共价连接。在一些实施方案中,所述部分能够通过所述结合部分与所述靶抗原结合域之间的特异性分子间相互作用来掩蔽所述靶抗原结合域与其靶标的结合。在一些实施方案中,所述非CDR环提供对所述部分与所述靶抗原结合域的结合具有特异性的结合位点。在一些实施方案中,在切割所述可切割连接体时,所述结合部分与所述靶抗原结合域分离,并且所述靶抗原结合域与其靶标结合。在一些实施方案中,所述靶抗原结构域与肿瘤抗原结合。在一些实施方案中,所述肿瘤抗原包括EpCAM、EGFR、HER-2、HER-3、c-Met、FoIR、PSMA、CD38、BCMA和CEA、5T4、AFP、B7-H3、CDH-6、CAIX、CD117、CD123、CD138、CD166、CD19、CD20、CD205、CD22、CD30、CD33、CD352、CD37、CD44、CD52、CD56、CD70、CD71、CD74、CD79b、DLL3、EphA2、FAP、FGFR2、FGFR3、GPC3、gpA33、FLT-3、gpNMB、HPV-16E6、HPV-16E7、ITGA2、ITGA3、SLC39A6、MAGE、间皮素、Muc1、Muc16、NaPi2b、柄蛋白-4、CDH-3、CDH-17、EPHB2、ITGAV、ITGB6、NY-ESO-1、PRLR、PSCA、PTK7、ROR1、SLC44A4、SLITRK5、SLITRK6、STEAP1、TIM1、Trop2或WT1。在一些实施方案中,所述靶抗原结构域与免疫检查点蛋白结合。在一些实施方案中,所述免疫检查点蛋白是CD27、CD137、2B4、TIGIT、CD155、ICOS、HVEM、CD40L、LIGHT、OX40、DNAM-1、PD-L1、PD1、PD-L2、CTLA-4、CD8、CD40、CEACAM1、CD48、CD70、A2AR、CD39、CD73、B7-H3、B7-H4、BTLA、IDO1、IDO2、TDO、KIR、LAG-3、TIM-3或VISTA。在一些实施方案中,所述靶抗原结合域与T细胞结合。在一些实施方案中,所述靶抗原结合域与CD3结合。在一些实施方案中,所述可切割连接体包含切割位点。在一些实施方案中,所述切割位点被蛋白酶识别。在一些实施方案中,所述蛋白酶切割位点被丝氨酸蛋白酶、半胱氨酸蛋白酶、天冬氨酸蛋白酶、苏氨酸蛋白酶、谷氨酸蛋白酶、金属蛋白酶、明胶酶或天冬酰胺肽裂合酶识别。在一些实施方案中,所述蛋白酶切割位点被组织蛋白酶B、组织蛋白酶C、组织蛋白酶D、组织蛋白酶E、组织蛋白酶K、组织蛋白酶L、激肽释放酶、hK1、hK10、hK15、纤溶酶、胶原酶、IV型胶原酶、溶基质蛋白酶、因子Xa、胰凝乳蛋白酶样蛋白酶、胰蛋白酶样蛋白酶、弹性蛋白酶样蛋白酶、枯草杆菌蛋白酶样蛋白酶、猕猴桃蛋白酶、菠萝蛋白酶、钙蛋白酶、胱天蛋白酶、胱天蛋白酶-3、Mir1-CP、木瓜蛋白酶、HIV-1蛋白酶、HSV蛋白酶、CMV蛋白酶、凝乳酶、肾素、胃蛋白酶、蛋白裂解酶、豆荚蛋白、疟原虫天冬氨酸蛋白酶、nepenthesin、金属外肽酶、金属内肽酶、基质金属蛋白酶(MMP)、MMP1、MMP2、MMP3、MMP7、MMP8、MMP9、MMP10、MMP11、MMP 12、MMP13、MMP14、ADAM9、ADAM10、ADAM12、尿激酶纤溶酶原激活物(uPA)、肠激酶、前列腺特异性靶标(PSA,hK3)、白介素-1β转化酶、凝血酶、FAP(FAP-α)、二肽基肽酶、II型跨膜丝氨酸蛋白酶(TTSP)、嗜中性粒细胞弹性蛋白酶、组织蛋白酶G、蛋白酶3、嗜中性粒细胞丝氨酸蛋白酶4、肥大细胞类糜蛋白酶和肥大细胞类胰蛋白酶识别。
一个实施方案提供了一种条件活性结合蛋白,其包含结合部分(M),所述结合部分包含非CDR环、可切割连接体(L)、第一靶抗原结合域(T1)和第二靶抗原结合域(T2),其中所述第一靶抗原结合域(T1)包含免疫球蛋白分子,其中所述非CDR环能够与所述第一靶抗原结合域结合,并且其中所述结合部分能够掩蔽所述第一靶抗原结合域与其靶标的结合。在一些实施方案中,所述结合部分能够与延长半衰期的蛋白质结合。在一些实施方案中,所述结合部分是天然肽、合成肽、工程化支架或工程化血清大体积蛋白。在一些实施方案中,所述工程化支架包括sdAb、scFv、Fab、VHH、III型纤连蛋白结构域、免疫球蛋白样支架、DARPin、胱氨酸结肽、脂质运载蛋白、三螺旋束支架、蛋白G相关的白蛋白结合模块,或DNA或RNA适体支架。在一些实施方案中,所述非CDR环来自可变域、恒定域、C1-set域、C2-set域、I-域或其任意组合。在一些实施方案中,所述结合部分进一步包含互补决定区(CDR)。在一些实施方案中,所述结合部分包含对大体积血清蛋白具有特异性的结合位点。在一些实施方案中,所述大体积血清蛋白是白蛋白、转铁蛋白、IgG1、IgG2、IgG4、IgG3、IgA单体、因子XIII、纤维蛋白原、IgE或五聚体IgM。在一些实施方案中,所述结合部分进一步包含对免疫球蛋白轻链具有特异性的结合位点。在一些实施方案中,所述免疫球蛋白轻链是不含Igκ的轻链。在一些实施方案中,所述CDR提供对所述大体积血清蛋白或所述免疫球蛋白轻链或其任意组合具有特异性的结合位点。在一些实施方案中,所述结合部分能够通过所述结合部分与所述第一靶抗原结合域之间的特异性分子间相互作用来掩蔽所述第一靶抗原结合域与其靶标的结合。在一些实施方案中,所述非CDR环提供对所述结合部分与所述第一靶抗原结合域的结合具有特异性的结合位点。在一些实施方案中,所述第一或第二靶抗原结合域与肿瘤抗原结合。在一些实施方案中,所述肿瘤抗原包括以下至少一种:EpCAM(示例性蛋白质序列包含UniProtkB ID No.P16422)、EGFR(示例性蛋白质序列包含UniProtkB IDNo.P00533)、HER-2(示例性蛋白质序列包含UniProtkB ID No.P04626)、HER-3(示例性蛋白质序列包含UniProtkB ID No.P21860)、c-Met(示例性蛋白质序列包含UniProtkB IDNo.P08581)、FoIR(示例性蛋白质序列包含UniProtkB ID No.P15238)、PSMA(示例性蛋白质序列包含UniProtkB ID No.Q04609)、CD38(示例性蛋白质序列包含UniProtkB IDNo.P28907),BCMA(示例性蛋白质序列包含UniProtkB ID No.Q02223)和CEA(示例性蛋白质序列包含UniProtkB ID No.P06731)、5T4(示例性蛋白质序列包含UniProtkB IDNo.Q13641)、AFP(示例性蛋白质序列包含comprises UniProtkB ID No.P02771)、B7-H3(示例性蛋白质序列包含UniProtkB ID No.Q5ZPR3)、CDH-6(示例性蛋白质序列包含UniProtkBID No.P97326)、CAIX(示例性蛋白质序列包含UniProtkB ID No.Q16790)、CD117(示例性蛋白质序列包含UniProtkB ID No.P10721)、CD123(示例性蛋白质序列包含UniProtkB IDNo.P26951)、CD138(示例性蛋白质序列包含UniProtkB ID No.P18827)、CD166(示例性蛋白质序列包含UniProtkB ID No.Q13740)、CD19(示例性蛋白质序列包含UniProtkB IDNo.P15931)、CD20(示例性蛋白质序列包含UniProtkB ID No.P11836)、CD205(示例性蛋白质序列包含UniProtkB ID No.O60449)、CD22(示例性蛋白质序列包含UniProtkB IDNo.P20273)、CD30(示例性蛋白质序列包含UniProtkB ID No.P28908)、CD33(示例性蛋白质序列包含UniProtkB ID No.P20138)、CD352(示例性蛋白质序列包含UniProtkB IDNo.Q96DU3)、CD37(示例性蛋白质序列包含UniProtkB ID No.P11049)、CD44(示例性蛋白质序列包含UniProtkB ID No.P16070)、CD52(示例性蛋白质序列包含UniProtkB IDNo.P31358)、CD56(示例性蛋白质序列包含UniProtkB ID No.P13591)、CD70(示例性蛋白质序列包含UniProtkB ID No.P32970)、CD71(示例性蛋白质序列包含UniProtkB IDNo.P02786)、CD74(示例性蛋白质序列包含UniProtkB ID No.P04233)、CD79b(示例性蛋白质序列包含UniProtkB ID No.P40259)、DLL3(示例性蛋白质序列包含UniProtkB IDNo.Q9NYJ7)、EphA2(示例性蛋白质序列包含UniProtkB ID No.P29317)、FAP(示例性蛋白质序列包含UniProtkB ID No.Q12884)、FGFR2(示例性蛋白质序列包含UniProtkB IDNo.P21802)、FGFR3(示例性蛋白质序列包含UniProtkB ID No.P22607)、GPC3(示例性蛋白质序列包含UniProtkB ID No.P51654)、gpA33(示例性蛋白质序列包含UniProtkB IDNo.Q99795)、FLT-3(示例性蛋白质序列包含UniProtkB ID No.P36888)、gpNMB(示例性蛋白质序列包含UniProtkB ID No.Q14956)、HPV-16E6(示例性蛋白质序列包含UniProtkB IDNo.P03126)、HPV-16E7(示例性蛋白质序列包含UniProtkB ID No.P03129)、ITGA2(示例性蛋白质序列包含UniProtkB ID No.P17301)、ITGA3(示例性蛋白质序列包含UniProtkB IDNo.P26006)、SLC39A6(示例性蛋白质序列包含UniProtkB ID No.Q13433)、MAGE(示例性蛋白质序列包含UniProtkB ID No.Q9HC15)、mesothelin(示例性蛋白质序列包含UniProtkBID No.Q13421)、Muc1(示例性蛋白质序列包含UniProtkB ID No.P15941)、Muc16(示例性蛋白质序列包含UniProtkB ID No.Q8WX17)、NaPi2b(示例性蛋白质序列包含UniProtkB IDNo.O95436)、Nectin-4(示例性蛋白质序列包含UniProtkB ID No.Q96918)、CDH-3(示例性蛋白质序列包含UniProtkB ID No.Q8WX17)、CDH-17(示例性蛋白质序列包含UniProtkB IDNo.E5RJT3)、EPHB2(示例性蛋白质序列包含UniProtkB ID No.P29323)、ITGAV(示例性蛋白质序列包含UniProtkB ID No.P06756)、ITGB6(示例性蛋白质序列包含UniProtkB IDNo.P18564)、NY-ESO-1(示例性蛋白质序列包含UniProtkB ID No.P78358)、PRLR(示例性蛋白质序列包含UniProtkB ID No.P16471)、PSCA(示例性蛋白质序列包含UniProtkB IDNo.O43653)、PTK7(示例性蛋白质序列包含UniProtkB ID No.Q13308)、ROR1(示例性蛋白质序列包含UniProtkB ID No.Q01973)、SLC44A4(示例性蛋白质序列包含UniProtkB IDNo.Q53GD3)、SLITRK5(示例性蛋白质序列包含UniProtkB ID No.Q8IW52)、SLITRK6(示例性蛋白质序列包含UniProtkB ID No.Q9HY7)、STEAP1(示例性蛋白质序列包含UniProtkB IDNo.Q9UHE8)、TIM1(示例性蛋白质序列包含UniProtkB ID No.Q96D42)、Trop2(示例性蛋白质序列包含UniProtkB ID No.P09758)或WT1(示例性蛋白质序列包含UniProtkB IDNo.P19544),或其任意组合。在一些实施方案中,所述第一或第二靶抗原结合域与免疫检查点蛋白结合。在一些实施方案中,所述免疫检查点蛋白是以下至少一种:CD27(示例性蛋白质序列包含UniProtkB ID No.P26842)、CD137(示例性蛋白质序列包含UniProtkB IDNo.Q07011)、2B4(示例性蛋白质序列包含UniProtkB ID No.Q9bZW8)、TIGIT(示例性蛋白质序列包含UniProtkB ID No.Q495A1)、CD155(示例性蛋白质序列包含UniProtkB IDNo.P15151),ICOS(示例性蛋白质序列包含UniProtkB ID No.Q9Y6W8)、HVEM(示例性蛋白质序列包含UniProtkB ID No.O43557)、CD40L(示例性蛋白质序列包含UniProtkB IDNo.P29965)、LIGHT(示例性蛋白质序列包含UniProtkB ID No.O43557)、OX40(示例性蛋白质序列包含UniProtkB ID No.)、DNAM-1(示例性蛋白质序列包含UniProtkB IDNo.Q15762)、PD-L1(示例性蛋白质序列包含UniProtkB ID No.Q9ZQ7)、PD1(示例性蛋白质序列包含UniProtkB ID No.Q15116)、PD-L2(示例性蛋白质序列包含UniProtkB IDNo.Q9BQ51)、CTLA-4(示例性蛋白质序列包含UniProtkB ID No.P16410)、CD8(示例性蛋白质序列包含UniProtkB ID No.P10966,P01732)、CD40(示例性蛋白质序列包含UniProtkBID No.P25942)、CEACAM1(示例性蛋白质序列包含UniProtkB ID No.P13688)、CD48(示例性蛋白质序列包含UniProtkB ID No.P09326)、CD70(示例性蛋白质序列包含UniProtkB IDNo.P32970)、AA2AR(示例性蛋白质序列包含UniProtkB ID No.P29274)、CD39(示例性蛋白质序列包含UniProtkB ID No.P49961)、CD73(示例性蛋白质序列包含UniProtkB IDNo.P21589)、B7-H3(示例性蛋白质序列包含UniProtkB ID No.Q5ZPR3)、B7-H4(示例性蛋白质序列包含UniProtkB ID No.Q7Z7D3)、BTLA(示例性蛋白质序列包含UniProtkB IDNo.Q76A9)、IDO1(示例性蛋白质序列包含UniProtkB ID No.P14902)、IDO2(示例性蛋白质序列包含UniProtkB ID No.Q6ZQW0)、TDO(示例性蛋白质序列包含UniProtkB IDNo.P48755)、KIR(示例性蛋白质序列包含UniProtkB ID No.Q99706)、LAG-3(示例性蛋白质序列包含UniProtkB ID No.P18627)、TIM-3(也称为HAVCR2,示例性蛋白质序列包含UniProtkB ID No.Q8TDQ0)或VISTA(示例性蛋白质序列包含UniProtkB ID No.Q9D659)。在一些实施方案中,所述第一或第二靶抗原结合域与免疫细胞结合。
在一些实施方案中,所述第一或第二靶抗原结合域与T细胞结合。在一些实施方案中,所述第一或第二靶抗原结合域与CD3结合。在一些实施方案中,所述结合部分(M)、可切割连接体(L)、第一靶抗原结合域(T1)和第二靶抗原结合域(T2)为以下构型之一:M:L:T1:T2和T2:T1:L:M。在一些实施方案中,所述结合部分包含白蛋白结合域(抗Alb),所述第一靶抗原结合域(T1)包含CD3结合域(例如,抗CD3scFV),并且ProTriTAC分子具有以下取向:抗Alb:抗CD3:T2。在一些实施方案中,所述结合部分包含白蛋白结合域(抗Alb),所述第二靶抗原结合域(T2)包含CD3结合域(例如,抗CD3 scFV),并且ProTriTAC分子具有以下取向:抗Alb:T1:抗CD3。在某些实例中,所述T1结构域是肿瘤抗原结合域,例如但不限于抗EGFR结构域、抗MSLN结构域、抗BCMA结构域、抗EpCAM结构域、抗PSMA结构域或抗DLL3结构域。
在一些实施方案中,所述可切割连接体包含切割位点。在一些实施方案中,所述切割位点被蛋白酶识别。在一些实施方案中,所述蛋白酶切割位点被丝氨酸蛋白酶、半胱氨酸蛋白酶、天冬氨酸蛋白酶、苏氨酸蛋白酶、谷氨酸蛋白酶、金属蛋白酶、明胶酶或天冬酰胺肽裂合酶识别。在一些实施方案中,所述蛋白酶切割位点被组织蛋白酶B、组织蛋白酶C、组织蛋白酶D、组织蛋白酶E、组织蛋白酶K、组织蛋白酶L、激肽释放酶、hK1、hK10、hK15、纤溶酶、胶原酶、IV型胶原酶、溶基质蛋白酶、因子Xa、胰凝乳蛋白酶样蛋白酶、胰蛋白酶样蛋白酶、弹性蛋白酶样蛋白酶、枯草杆菌蛋白酶样蛋白酶、猕猴桃蛋白酶、菠萝蛋白酶、钙蛋白酶、胱天蛋白酶、胱天蛋白酶-3、Mir1-CP、木瓜蛋白酶、HIV-1蛋白酶、HSV蛋白酶、CMV蛋白酶、凝乳酶、肾素、胃蛋白酶、蛋白裂解酶、豆荚蛋白、疟原虫天冬氨酸蛋白酶、nepenthesin、金属外肽酶、金属内肽酶、基质金属蛋白酶(MMP)、MMP1、MMP2、MMP3、MMP7、MMP8、MMP9、MMP10、MMP11、MMP 12、MMP13、MMP14、ADAM9、ADAM10、ADAM12、尿激酶纤溶酶原激活物(uPA)、肠激酶、前列腺特异性靶标(PSA,hK3)、白介素-1β转化酶、凝血酶、FAP(FAP-α)、二肽基肽酶、II型跨膜丝氨酸蛋白酶(TTSP)、嗜中性粒细胞弹性蛋白酶、组织蛋白酶G、蛋白酶3、嗜中性粒细胞丝氨酸蛋白酶4、肥大细胞类糜蛋白酶和肥大细胞类胰蛋白酶识别。在一些实施方案中,所述条件活性结合蛋白进一步包含与所述结合部分结合的半衰期延长结构域,其中所述半衰期延长结构域为所述结合蛋白提供安全开关,并且其中在所述连接体被切割时,所述结合蛋白通过所述结合部分和所述半衰期延长结构域与所述第一靶抗原结合域分离而激活,从而使所述结合蛋白与所述安全开关分离。在一些实施方案中,所述连接体的切割在肿瘤微环境中发生。
一个实施方案提供了一种条件活性结合蛋白,其包含经由结合部分内的非CDR环与靶抗原结合域连接的结合部分,其中所述结合部分进一步与半衰期延长结构域连接,并且包含可切割连接体,其中所述靶抗原结合域包含免疫球蛋白分子,其中所述结合蛋白在其通过所述连接体的切割被激活之前具有延长的半衰期,并且其中在激活时,所述结合部分和所述半衰期延长结构域与所述靶抗原结合域分离,并且其中所述结合蛋白在其活化状态下不具有延长的半衰期。在一些实施方案中,所述连接体的切割在肿瘤微环境中发生。
在一些实施方案中,所述非CDR环包括以下至少一个的CC’环:骆驼科VHH结构域、人VH结构域、人源化VH结构域或单结构域抗体。在一些实施方案中,所述结合部分包含对CD3e结构域具有特异性的结合位点,并且其中所述对CD3e结构域具有特异性的结合位点包含至少一个以下基序:QDGNE、QDGNEE、DGNE和DGNEE。
附图说明
本发明的新颖特征在所附权利要求书中具体阐述。通过参考以下对利用本发明原理的说明性实施方案加以阐述的详细描述以及附图,将会对本发明的特征和优点获得更好的理解,在这些附图中:
图1示出了示例性免疫球蛋白结构域的可变域,其包含互补决定区(CDR1、CDR2和CDR3)和连接β链的非CDR环(AB、CC'、C"D、EF和DE)。
图2A-2B提供了本公开的条件活性结合蛋白的各个结构域的示例性排列。图2A:版本1。图2B:版本2。
图3显示了本公开的示例性条件活性靶标结合蛋白。
图4A-4C显示了三特异性分子(ProTriTAC)的活化和可能的作用模式。图4A显示了循环中、肿瘤环境中和循环中的ProTriTAC分子。图4B显示了栓系至抗白蛋白结合部分的连接体中蛋白酶可切割位点的示例性序列,而图4C显示了SDS-PAGE凝胶,其示出处于可活化(前药)和活化(活性药物)状态的ProTriTAC。
图5A-B示出了用于制备并纯化本文所述的分子的过程。图5A显示了用于制备ProTriTAC分子的示意性流程图,而图5C显示了SDS-PAGE凝胶,其示出三种纯化的ProTriTAC分子。
图6A-B显示了暴露于不同应激条件的ProTriTAC分子的分析型大小排阻色谱图,图6A中为图形形式,图6B中为相应的数据。图6B提供了图6A的数据。
图7显示了示例性ProTriTAC分子在NSG小鼠中的HCT116结直肠肿瘤异种移植模型中的蛋白酶依赖性抗肿瘤活性。
图8A-8D显示了示例性ProTriTAC和对照分子的各种设计。图8A:对照#1;图8B:对照#2;图8C:ProTriTAC;图8D:活化的ProTriTAC。
图9显示了示例性ProTriTAC和对照分子的药代动力学谱。
图10显示了示例性ProTriTAC分子的转化和半衰期。
图11显示了示例性ProTriTAC分子及其转化的活性药物形式的血浆清除率。
图12显示了示例性ProTriTAC分子、其转化的活性药物形式和对照不可切割的ProTriTAC分子的CD3结合潜力。
图13显示了示例性ProTriTAC分子、其转化的活性药物形式和对照不可切割的ProTriTAC分子的人原代T细胞结合潜力。
图14显示了示例性ProTriTAC分子、其转化的活性药物形式和对照不可切割的ProTriTAC分子的T细胞杀伤潜力。
图15显示了包含如本文所述的结合部分的示例性三特异性分子(在本文中也称为ProTriTAC或可活化的ProTriTAC)的示意结构。
图16A-16E显示了将功能性掩蔽和半衰期延长组合在一起的前药分子的示例性示意结构。图16A显示了包含抗白蛋白部分和可切割连接体的前药分子,该抗白蛋白部分包括掩蔽部分,该可切割连接体连接该抗白蛋白部分和药物。图16B显示了包含抗白蛋白部分和可切割连接体的前药分子,该抗白蛋白部分包含通过连接体连接的两个肽基序,其中之一包括掩蔽部分,该可切割连接体将该白蛋白结合部分连接至药物。图16C显示了包含通过可切割连接体与药物连接的修饰的白蛋白(含有掩蔽部分)的前药分子。图16D显示了包含与药物连接的修饰的白蛋白(含有掩蔽部分和蛋白酶切割位点)的前药分子。图16E显示了活化的前药。在每个示意结构(图16A-16D)中,药物分子在功能上被抗白蛋白部分或修饰的白蛋白掩蔽,从而不结合其靶标,或者不在不希望的位点被激活,或者不在非靶位点被结合,从而创建药物池(drug sink)。
图17A-17E显示了将功能性掩蔽和半衰期延长组合在一起的ProTriTAC分子的示例性示意结构。图17A显示了包含抗白蛋白部分和可切割连接体的ProTriTAC分子,该抗白蛋白部分包括掩蔽部分,该可切割连接体连接该抗白蛋白部分和T细胞接合物分子。图17B显示了包含抗白蛋白部分和可切割连接体的ProTriTAC分子,该抗白蛋白部分包含通过连接体连接的两个肽基序,其中之一包括掩蔽部分,该可切割连接体将该白蛋白结合部分连接至T细胞接合物分子。图17C显示了包含通过可切割连接体与T细胞接合物连接的修饰的白蛋白(含有掩蔽部分)的ProTriTAC分子。图17D显示了包含与T细胞接合物连接的修饰的白蛋白(含有掩蔽部分和蛋白酶切割位点)的ProTriTAC分子。图17E显示了活化的ProTriTAC。在每个示意结构(图17A-17D)中,ProTriTAC分子内的靶标结合界面在功能上被抗白蛋白部分或修饰的白蛋白掩蔽,从而不结合其靶标,或者不在不希望的位点被激活,或者不在非靶位点被结合,从而创建池(sink)。
图18显示了本公开的示例性ProTriTAC分子和TriTAC分子的抗肿瘤活性。
图19显示了本公开的示例性ProTriTAC分子和TriTAC分子的药代动力学谱。
图20A-20F显示了在施用本公开的示例性ProTriTAC分子或TriTAC分子后的混合异种移植个体肿瘤体积。图20A示出了GFP TriTAC的结果。图20B示出了EGFR ProTriTAC(NCLV)的结果。图20C示出了EGFR ProTriTAC(L001)的结果。图20D示出了EGFR ProTriTAC(L041)的结果。图20E示出了EGFR ProTriTAC(L040)的结果。图20F示出了EGFR ProTriTAC(L045)的结果。
图21A-21C显示了在施用本公开的示例性ProTriTAC分子或TriTAC分子后的细胞因子水平(IFN-γ(图21A)、IL-6(图21B)和IL-10;图21C)。
图22A-22E显示了在施用本公开的示例性ProTriTAC分子和TriTAC分子后,小鼠的体重变化百分比。图22A示出了30μg/kg的结果;图22B示出了100μg/kg的结果;图22C示出了300μg/kg的结果;图22D示出了1000μg/kg的结果;并且图22E提供了在各种浓度下的保护倍数。
图23A-23C显示了在施用不同浓度的本公开的示例性ProTriTAC分子(含有不可切割的或可切割连接体)后,小鼠的体重变化百分比。图23A示出了300μg/kg的结果;图23B示出了1000μg/kg的结果;图23C提供了在各种浓度下的保护倍数。
图24A-24C显示了在施用不同浓度的含有不可切割连接体的ProTriTAC分子(ProTriTAC(NCLV))(图24C)、TriTAC分子(图24A)或含有可切割连接体的ProtriTAC分子(图24B)后,小鼠中的天冬氨酸转氨酶(AST)的血清浓度。
图25A-25C显示了在施用不同浓度的含有不可切割连接体的ProTriTAC分子(ProTriTAC(NCLV))(图25C)、TriTAC分子(图25A)或含有可切割连接体的ProtriTAC分子(图25B)后,小鼠中的丙氨酸转氨酶(ALT)的血清浓度。
图26A-26B显示了在施用不同浓度的EGFR ProTriTAC分子或EGFR ProTriTAC(NCLV)分子后,食蟹猴中的ALT(右图;图26B)或AST(左图;图26A)的血清浓度。
图27A-27D显示了以不同浓度施用GFP TriTAC分子、EGFR TriTAC分子或EGFRProTriTAC分子后,小鼠中的肿瘤体积。图27A显示了GFP TriTAC(300μg/kg)和EGFR TriTAC(10μg/kg)。图27B显示了EGFR TriTAC(30μg/kg和100μg/kg)。图27C显示了EGFR TriTAC(300μg/kg)和EGFR ProTriTAC(30μg/kg和100μg/kg)。图27D显示了EGFR ProTriTAC(300μg/kg和1000μg/kg)。
图28显示了在施用不同浓度的GFP TriTAC、EGFR TriTAC和EGFR ProTriTAC分子后,小鼠中的ALT和AST的血清浓度。
图29显示了CD3ε表位向本公开的结合部分的CC'环中的移植。HuCD3e:SEQ ID NO:901;CC10:SEQ ID NO:260;CC12:SEQ ID NO:259;且CC16:SEQ ID NO:261。
图30显示了在蛋白裂解酶引起的肿瘤相关蛋白酶激活后,本公开的结合部分从含有该结合部分的ProTriTAC分子上的分离。
图31显示了ProTriTAC分子的CD3结合,其具有或没有活化,含有本公开的示例性结合部分。
图32显示了ProTriTAC分子的细胞杀伤潜力,其具有或没有活化,含有本公开的示例性结合部分。
图33显示了软文库诱变方法,进行该方法是为了探索本公开的示例性结合部分内的非CDR环。
图34示出了在针对HSA(人血清白蛋白,或者在本文中也称为白蛋白)淘选后,软文库诱变方法的结果,进行该方法是为了探索本公开的示例性结合部分内的非CDR环。
图35示出了本公开的结合部分能够通过空间掩蔽和特异性掩蔽来扩大包含它的分子(例如,ProTriTAC分子)的治疗窗。
图36提供了使用含有本文所述的抗EpCAM结构域和抗CD3结构域的本公开的示例性融合蛋白,用NCI-H508细胞进行的代表性T细胞依赖性细胞毒性测定的结果。
图37提供了使用含有本文所述的抗EpCAM结构域和抗CD3结构域的本公开的示例性融合蛋白进行的代表性T细胞依赖性细胞毒性测定的结果。
图38提供了使用含有本文所述的抗EpCAM结构域和抗CD3结构域的本公开的示例性融合蛋白进行的代表性T细胞依赖性细胞毒性测定的结果。
图39提供了使用含有本文所述的抗EpCAM结构域和抗CD3结构域的本公开的示例性融合蛋白进行的代表性T细胞依赖性细胞毒性测定的结果。
图40提供了使用含有本文所述的人源化抗EpCAM结构域和抗CD3结构域的本公开的示例性融合蛋白进行的代表性T细胞依赖性细胞毒性测定的结果。
图41A-41C显示了在施用本公开的示例性EpCAM ProTriTAC分子和EpCAM TriTAC分子后,小鼠的体重变化百分比。
具体实施方式
虽然本文已经显示并描述了本发明的优选实施方案,但是对于本领域技术人员显而易见的是,这些实施方案仅以示例的方式提供。在不脱离本发明的情况下,本领域技术人员现将想到许多变化、改变和替换。应当理解,在实施本发明的过程中可以采用本文所述的本发明实施方案的各种替代方案。旨在以所附权利要求书限定本发明的范围,由此涵盖在这些权利要求范围内的方法和结构及其等同物。
在某些实施方案中,本文提供了ProTriTAC分子(在本文中也称为前三特异性(protrispecific)分子),其为被设计为在肿瘤微环境中具有条件活性的T细胞接合物前药。在一些情况下,这使得靶向更广泛选择的肿瘤抗原(例如实体瘤抗原)成为可能。在一些实例中,ProTriTAC分子将几种前药方法的理想属性组合在一起,包括但不限于:空间掩蔽和特异性掩蔽的组合,其中在一些情况下,空间掩蔽是通过被ProTriTAC分子中的抗白蛋白结构域识别的白蛋白实现的,并且在一些情况下,特异性掩蔽是通过抗白蛋白结构域(在一些实例中)与ProTriTAC分子的靶抗原结合域(例如,在一些实例中为抗CD3 scFv结构域)之间的特异性分子间相互作用实现的;通过激活条件性活化的ProTriTAC分子获得的,前药与活性药物的半衰期差异所赋予的额外安全性;与不同的肿瘤靶标结合物即插即用的能力。
某些定义
本文使用的术语仅用于描述特定情况的目的,而非限制性的。除非上下文另有明确规定,否则如本文所用的单数形式“一个”、“一种”和“该”也意欲包括复数形式。此外,就具体实施方式和/或权利要求书中使用的术语“包括”、“包含”、“具有”或其变化形式而言,这些术语旨在以与术语“包含”类似的方式为包含性的。
术语“约”或“大约”意指在本领域普通技术人员测定的特定值的可接受误差范围内,该可接受误差范围将部分取决于该值如何测量或测定,例如,测量系统的局限性。例如,根据给定值的实践,“约”可以表示在1个或大于1个标准差内。在本申请和权利要求书中描述特定值的情况下,除非另有说明,否则术语“约”应被认为意指该特定值的可接受误差范围。
术语“个体”、“患者”或“受试者”可互换使用。这些术语都不需要或局限于以卫生保健工作者(例如,医生、注册护士、从业护士、医师助理、护理员或临终关怀工作人员)的监护(例如,持续的或间歇的)为特征的情形。
如本文所用的,“单链Fv”或“scFv”是指结合蛋白,其中传统双链抗体的重链和轻链的可变域连接形成一条链。通常,将连接肽插入两条链之间,以允许正确折叠和产生活性结合位点。
如本文所意指的,“蛋白酶的切割位点”或“蛋白酶切割位点”是可以被蛋白酶例如基质金属蛋白酶或弗林蛋白酶切割的氨基酸序列。这样的位点的实例包括可以被金属蛋白酶切割的Gly-Pro-Leu-Gly-Ile-Ala-Gly-Gln或Ala-Val-Arg-Trp-Leu-Leu-Thr-Ala,以及被弗林蛋白酶切割的Arg-Arg-Arg-Arg-Arg-Arg。在治疗性应用中,蛋白酶切割位点可被靶细胞例如癌细胞或受感染细胞或病原体产生的蛋白酶切割。
如本文所用的,“消除半衰期”以其普通含义使用,如在Goodman和Gillman的ThePharmaceutical Basis of Therapeutics 21-25(Alfred Goodman Gilman、LouisS.Goodman和Alfred Gilman编著,第六版1980)中所述。简言之,该术语意在包括药物消除的时间过程的定量量度。大多数药物的消除是指数式的(即,遵循一级动力学),因为药物浓度通常并未接近消除过程的饱和所需的浓度。指数过程的速率可由其速率常数k或由其半衰期t
如本文所用的,“治疗剂”包括“结合分子”。
如本文所用的,术语“结合分子”是可以与靶分子、细胞、复合物和/或组织结合的任何分子或其部分或片段,并且包括蛋白质、核酸、碳水化合物、脂质、低分子量化合物及其片段,各自具有与可溶性蛋白、细胞表面蛋白、细胞表面受体蛋白、细胞内蛋白质、碳水化合物、核酸、激素或低分子量化合物(小分子药物)或其片段中的一种或多种结合的能力。在一些情况下,该结合分子是属于免疫球蛋白超家族的蛋白质或非免疫球蛋白结合分子。该“结合分子”不包括细胞因子。
如本文所用的,术语“属于免疫球蛋白超家族的蛋白质”或“免疫球蛋白分子”包括包含免疫球蛋白折叠的蛋白质,如抗体及其靶抗原结合片段、抗原受体、抗原呈递分子、自然杀伤细胞上的受体、抗原受体辅助分子、白细胞上的受体、IgSF细胞粘附分子、生长因子受体和受体酪氨酸激酶/磷酸酶。
术语“抗体”包括任何同种型的抗体或免疫球蛋白,保持与抗原特异性结合的抗体片段,包括但不限于Fab、Fv、scFv和Fd片段,嵌合抗体、人源化抗体、单链抗体(scAb)、单结构域抗体(dAb)、单结构域重链抗体、单结构域轻链抗体、双特异性抗体、多特异性抗体,以及包含抗体的抗原结合(在本文中也称为抗原结合)部分和非抗体蛋白质的融合蛋白。在一些实例中,抗体被可检测地标记,例如用放射性同位素、生成可检测产物的酶、荧光蛋白等标记。在一些情况下,抗体进一步缀合至其他部分,如特异性结合对的成员,例如生物素(生物素-抗生物素蛋白特异性结合对的成员)等。在一些情况下,抗体结合至固体支持物,包括但不限于聚苯乙烯板或珠子等。该术语还包括Fab'、Fv、F(ab')2和/或其他保持与抗原特异性结合的抗原结合片段,以及单克隆抗体。如本文所用的,单克隆抗体是由一组相同的细胞产生的抗体,所有这些细胞都是通过重复细胞复制从单细胞产生的。即,细胞的克隆仅产生单个抗体种类。尽管可以使用杂交瘤生产技术来产生单克隆抗体,但是也可以使用本领域技术人员已知的其他生产方法(例如,由抗体噬菌体展示文库得到的抗体)。在一些情况下,抗体是单价或二价的。在一些情况下,抗体是Ig单体,它是由四条多肽链组成的“Y形”分子:通过二硫键连接的两条重链和两条轻链。
如本文所用的术语“非免疫球蛋白结合分子”包括但不限于例如生长因子、激素、信号蛋白、炎性介质、配体、受体或其片段,能够与其天然受体结合的天然激素或其变体;能够与互补序列或可溶性细胞表面或细胞内核酸/多核苷酸结合蛋白结合的核酸或多核苷酸序列,能够与其他碳水化合物结合部分、细胞表面或细胞内蛋白结合的碳水化合物结合部分,与可溶性或细胞表面或细胞内靶蛋白结合的低分子量化合物(药物)。在一些情况下,非免疫球蛋白结合分子包括凝血因子、血浆蛋白、融合蛋白和成像剂。非免疫球蛋白结合分子不包括细胞因子。
如本文意指的“细胞因子”是指细胞间信号传导分子及其活性片段和部分,其参与哺乳动物体细胞的调节。包括许多细胞因子家族,例如白介素、干扰素和转化生长因子。
如本文所用的,免疫球蛋白(Ig)分子内的“非CDR环”是多肽的除抗体的互补决定区(CDR)以外的区域。这些区域可以衍生自抗体或抗体片段。这些区域也可以是合成或人工衍生的,例如通过诱变或多肽合成。
在具有9条β链(例如VH、VL、骆驼科VHH、sdAb)的Ig、Ig样或β-夹心支架中,非CDR环可指AB、CC’、C”D、EF环或连接邻近C末端的β链的环。在具有7条β链(例如CH、CL、adnectin、Fn-III)的Ig、Ig样或β-夹心支架中,非CDR环可指AB、CD和EF环或连接邻近C末端的β链的环。在其他Ig样或β夹心支架中,非CDR环是采用在Halaby 1999出版物(Prot Eng Des Sel12:563-571)中建立的框架来连接邻近C末端的β链或拓扑学上等同的残基的环。
在非β-夹心支架(例如,DARPin、affimer、affibody)中,“非CDR环”是指这样的区域:其(1)适于序列随机化以允许对第二抗原的工程化特异性,并且(2)通常在支架上使用的主要特异性决定区的远端,以允许支架同时与两种抗原接合而没有空间干扰。为此,可以采用在Skrlec2015出版物(Trends in Biotechnol,33:408-418)中建立的框架定义主要特异性决定区。下面列出了框架的摘录。
如本文所用的,“靶抗原结合域”是指靶向特定抗原的区域。靶抗原结合域包含,例如,sdAb、scFv、可变重链抗体(VHH)、重链可变域(VH)或轻链可变域(VL)、全长抗体或对特定抗原具有结合亲和力的其他任何肽。靶抗原结合域不包括细胞因子。
如本文所用的,“TriTAC”是指并非条件激活的三特异性结合蛋白。
结合部分、可切割连接体和条件活性结合蛋白
在一些实施方案中,本公开提供了能够掩蔽结合分子与其靶标的相互作用的结合部分。在一些实施方案中,本公开的结合部分包含掩蔽部分和可切割连接体,如蛋白酶可切割连接体。在一些实施方案中,本公开的结合部分包含掩蔽部分(例如,修饰的非CDR环序列)和不可切割连接体。如图35所示,该结合部分能够通过空间掩蔽和特异性掩蔽两者协同扩大包含该部分的分子的治疗窗。在一些实例中,该结合分子是属于免疫球蛋白超家族的蛋白质,如包含免疫球蛋白折叠的靶抗原结合域。在一些实施方案中,该结合分子是非免疫球蛋白蛋白质。在一些实施方案中,该结合部分将空间掩蔽(例如,通过与大体积血清白蛋白结合)和特异性掩蔽(例如,通过与抗CD3 scFv结构域的CDR结合的非CDR环)组合起来。在一些情况下,修饰该结合部分内的非CDR环不影响白蛋白结合。在一些情况下,蛋白酶可切割连接体使得能够在单个蛋白水解事件中激活包含结合部分的前药分子(例如包含本文所述的结合部分、CD3结合域和白蛋白结合域的ProTriTAC分子),从而允许在肿瘤微环境中更有效地转化前药分子。此外,在一些情况下,与肿瘤相关的蛋白水解激活揭示出在激活后具有最小肿瘤外活性的活性T细胞接合物(例如包含本文所述的结合部分、CD3结合域和白蛋白结合域的ProTriTAC分子)。在一些实施方案中,本公开提供了半衰期延长的T细胞接合物形式(ProTriTAC),其包含本文所述的结合部分,在一些情况下,其代表用来工程改造条件活性T细胞接合物的新的改进方法。
图4B提供了包含如本文所述的示例性结合部分(抗白蛋白sdAb)的示例性ProTriTAC分子的示意图,以及凝胶,其显示了在通过蛋白酶可切割连接体的切割而激活之前和之后的ProTriTAC,而图4A显示了其可能的作用模式。图15显示了包含如本文所述的结合部分的示例性三特异性分子(在本文中也称为ProTriTAC或可活化的ProTriTAC)的示意结构,其具有工程化的非CDR环。示例性的三特异性分子含有包含可切割连接体(包含蛋白酶可切割的位点的这类连接体,在本文中也称为底物连接体)的抗白蛋白结构域和掩蔽结构域;抗CD3结合域;以及在一些情况下是非免疫球蛋白分子的抗靶标结构域(对肿瘤抗原具有特异性)。在一些情况下,抗白蛋白结构域中的非CDR环能够结合并掩蔽抗靶标结构域。在一些情况下,抗白蛋白结构域中的非CDR环能够结合并掩蔽抗CD3结构域。在一些实施方案中,该结合部分包含对结合白蛋白具有特异性的CDR环。
在第一实施方案中,本文提供了掩蔽靶抗原结合域的结合并且能够与诸如半衰期延长蛋白等大体积血清蛋白结合的结合部分。在某些情况下,第一实施方案的结合部分进一步包含与其附接的可切割连接体。可切割连接体,例如,包含蛋白酶切割位点或pH依赖性切割位点。在某些情况下,可切割连接体仅在肿瘤微环境中被切割。因此,在一些实例中,与延长半衰期的蛋白质结合、与可切割连接体连接并进一步与靶抗原结合域结合的第一实施方案的结合部分将靶抗原结合域在循环中维持在惰性状态,直到可切割连接体在肿瘤微环境中被切开。因此,通过使用第一实施方案的结合部分(其充当安全开关,该安全开关将靶抗原结合部分保持在惰性状态,直到其到达肿瘤微环境,在其中通过连接体的切割而被条件地激活并能够结合其靶抗原),延长了靶抗原结合域如抗体或其抗原结合片段在体循环中的半衰期。
在第二实施方案中,提供了一种掩蔽非免疫球蛋白结合分子与其靶标之间的相互作用的结合部分。在某些情况下,第二实施方案的结合部分能够与大体积血清蛋白结合。在一些情况下,第二实施方案的结合部分进一步包含与其附接的可切割连接体。可切割连接体,例如,包含蛋白酶切割位点或pH依赖性切割位点。在某些情况下,可切割连接体仅在肿瘤微环境中被切割。在一些情况下,非免疫球蛋白结合分子被第二实施方案的结合部分维持在惰性状态,并通过连接体的切割而激活,例如在靶环境中。在一些情况下,可切割连接体在肿瘤微环境中被切开,并且在这类情况下,肿瘤微环境是靶环境。因此,通过使用第二实施方案的结合部分(其充当安全开关,该安全开关将非免疫球蛋白结合分子保持在惰性状态,直到其到达靶环境,在其中通过连接体的切割而被条件地激活),延长了非免疫球蛋白结合分子在体循环中的半衰期。在所述非免疫球蛋白结合分子是成像剂的第二实施方案的一些实例中,当可切割连接体被切割时,所述成像剂在靶环境中被激活。在这类情况下,靶环境是将要使用成像剂成像的组织或细胞或任何生物环境。
以上描述的安全开关具有若干优点;一些实例包括(i)扩大免疫球蛋白分子如靶抗原结合域、非免疫球蛋白结合分子的治疗窗;(ii)当包含根据第一或第二实施方案的结合部分的条件活性蛋白处于体循环中时,通过将免疫球蛋白分子如靶抗原结合域、非免疫球蛋白结合分子维持在惰性状态来减少靶标介导的药物处置;(iii)降低不希望的活化蛋白质在体循环中的浓度,从而使化学、制备和控制相关的杂质的扩散最小化,所述杂质例如是预活化的药物产品,内源性病毒、宿主细胞蛋白质、DNA、浸出物、消泡剂、抗生素、毒素、溶剂、重金属;(iv)降低不希望的活化蛋白质在体循环中的浓度,从而使与产品相关的杂质、聚集体、分解产物、由于以下原因导致的产物变体的扩散最小化:氧化,脱酰胺,变性,MAb中的C末端Lys丢失;(v)防止免疫球蛋白分子如靶抗原结合域或非免疫球蛋白结合分子在循环中的异常激活;(vi)减少与活化种类从病变组织或其他病理生理学状况(例如肿瘤、自身免疫病、炎症、病毒感染、组织重塑事件(如心肌梗死、皮肤伤口愈合)或外部损伤(如X射线、CT扫描、UV暴露))泄漏相关的毒性;以及(vii)减少免疫球蛋白分子如靶抗原结合域或非免疫球蛋白结合分子的非特异性结合。此外,在安全开关激活后,或者换句话说,在其断裂后,免疫球蛋白分子如靶抗原结合域、非免疫球蛋白结合分子与安全开关分离,从而提供延长的半衰期,因此从循环中清除。
另外,在一些情况下,第一、第二和第三实施方案的结合部分用来生成生物制剂的“生物更佳”形式。通常,制备生物更佳形式的分子,例如抗体或其抗原结合片段,涉及获取起始分子,并对其进行特定改变以改善其参数,从而使其成为更有效、给药频率更低、靶向性更好和/或耐受性更好的药物。因此,与延长半衰期的蛋白质结合并通过切割可切割连接体而在肿瘤微环境中被条件地激活的被第一实施方案的结合部分掩蔽的靶抗原结合域,使靶抗原结合域具有明显更长的血清半衰期,并降低其在循环中的不希望的活化的可能性,从而产生靶抗原结合域的“生物更佳”形式。类似地,在一些情况下,第二实施方案的结合部分用来生成非免疫球蛋白结合分子的生物更佳形式。因此,在多个实施方案中,提供了免疫球蛋白分子、非免疫球蛋白结合分子的生物更佳形式,其中生物更佳功能归因于分别根据第一或第二实施方案的结合部分。
本文所述的结合部分包含至少一个非CDR环。在一些实施方案中,非CDR环提供了关于第一实施方案的结合部分与靶抗原结合域的结合的结合位点。在第一实施方案的一些实例中,非CDR环提供了关于第一实施方案的结合部分与免疫球蛋白分子如靶抗原结合域的结合的结合位点。在第二实施方案的一些实例中,非CDR环提供了关于第二实施方案的结合部分与非免疫球蛋白结合分子的结合的结合位点。在一些情况下,第一实施方案的结合部分例如通过空间阻塞、通过特定分子间相互作用或两者的组合来掩蔽靶结合域与靶抗原的结合。在一些情况下,第二实施方案的结合部分还通过空间阻塞、通过特定分子间相互作用或两者的组合来掩蔽非免疫球蛋白结合分子与其靶标的结合。
在一些实施方案中,本文所述的结合部分进一步包含互补决定区(CDR)。在一些情况下,所述结合部分是衍生自免疫球蛋白分子(Ig分子)的结构域。Ig可以是任何类别或亚类(IgG1、IgG2、IgG3、IgG4、IgA、IgE、IgM等)。Ig分子的多肽链折叠成一系列由环连接的平行β链。在可变区中,三个环构成确定该分子的抗原结合特异性的“互补决定区”(CDR)。IgG分子包含通过二硫键相互连接的至少两条重(H)链和两条轻(L)链或其抗原结合片段。每条重链由重链可变区(在本文中缩写为VH)和重链恒定区组成。重链恒定区由CH1、CH2和CH3这三个结构域组成。每条轻链由轻链可变区(在本文中缩写为VL)和轻链恒定区组成。轻链恒定区由一个结构域CL组成。VH和VL区可进一步细分为超变区,被称为互补决定区(CDR),其序列是高度可变的,并且/或者参与抗原识别和/或通常形成在结构上限定的环,其中散布有更保守的区域,被称为框架区域(FR)。每个VH和VL由三个CDR和四个FR组成,从氨基末端到羧基末端按以下顺序排列:FR1,CDR1,FR2,CDR2,FR3,CDR3,FR4。在本公开的一些实施方案中,FR1、FR2、FR3和FR4的至少一些或全部氨基酸序列是本文所述结合部分的“非CDR环”的一部分。如图1所示,免疫球蛋白分子的可变域具有以两个折叠排列的几条β链。免疫球蛋白轻链和重链的可变域均包含三个高变环或互补决定区(CDR)。V结构域的这三个CDR(CDR1、CDR2、CDR3)在β桶的一端聚簇。CDR是连接免疫球蛋白折叠的β链B-C、C'-C"和F-G的环,而连接免疫球蛋白折叠的β链AB、CC'、C"-D和E-F的底部环以及连接免疫球蛋白折叠的D-E链的顶部环是非CDR环。在本公开的一些实施方案中,恒定域CH1、CH2或CH3的至少一些氨基酸残基是本文所述结合部分的“非CDR环”的一部分。在一些实施方案中,非CDR环包含Ig或Ig样分子的C1-set域的AB、CD、EF和DE环中的一个或多个;Ig或Ig样分子的C2-set域的AB、CC'、EF、FG、BC和EC'环;Ig或Ig样分子的I(中间)-set域的DE、BD、GF、A(A1A2)B和EF环。
在可变域内,认为CDR负责抗原识别和结合,而认为FR残基是CDR的支架。然而,在某些情况下,一些FR残基在抗原识别和结合中起重要作用。影响Ag结合的框架区残基分为两个类别。第一个是与抗原接触的FR残基,因此是结合位点的一部分,并且这些残基中的一些在序列上与CDR接近。其他残基是在序列上远离CDR但在分子的3-D结构(例如重链中的环)中与其接近的残基。
在一些实施方案中,对非CDR环进行修饰,以生成对大体积血清蛋白如白蛋白具有特异性的抗原结合位点。预期可以使用各种技术来修饰非CDR环,例如定点诱变、随机诱变、插入至少一个对于非CDR环氨基酸序列而言为外来的氨基酸、氨基酸置换。在一些实例中,将抗原肽插入非CDR环。在一些实例中,用抗原性肽置换非CDR环。在一些情况下,用来生成抗原结合位点的修饰仅在一个非CDR环中。在其他情况下,修饰超过一个非CDR环。例如,该修饰在图1所示的任一个非CDR环中,即AB、CC'、C"D、EF和D-E。在一些情况下,该修饰在DE环中。在其他情况下,该修饰在AB、CC'、C"–D、E-F这所有四个环中。在某些实例中,本文所述的结合部分经由其AB、CC'、C"D或EF环与免疫球蛋白分子,例如靶抗原结合域、非免疫球蛋白结合分子结合,并且经由其B-C、C'-C”或F-G环与大体积血清蛋白如白蛋白结合。在某些实例中,第一实施方案的结合部分经由其AB、CC'、C"D和EF环与靶抗原结合域结合,并且经由其BC、C'C"和FG环与大体积血清蛋白如白蛋白结合。
在某些实例中,第一实施方案的结合部分经由AB、CC'、C"D和E-F环中的一个或多个与靶抗原结合域结合,并且经由BC、C'C"和FG环中的一个或多个与大体积血清蛋白如白蛋白结合。在某些实例中,第一实施方案的结合部分经由其AB、CC'、C"D或EF环与大体积血清蛋白如白蛋白结合,并且经由其BC、C'C"或FG环与靶抗原结合域结合。在某些实例中,第一实施方案的结合部分经由其AB、CC'、C"D和EF环与大体积血清蛋白如白蛋白结合,并且经由其BC、C'C"和FG环与靶抗原结合域结合。在某些实例中,第一实施方案的结合部分经由AB、CC'、C"D和E-F环中的一个或多个与大体积血清蛋白如白蛋白结合,并且经由BC、C'C"和FG环中的一个或多个与靶抗原结合蛋白结合。
在某些实例中,第二实施方案的结合部分经由AB、CC'、C"D和E-F环中的一个或多个与非免疫球蛋白分子结合,并且经由BC、C'C"和FG环中的一个或多个与大体积血清蛋白如白蛋白结合。在某些实例中,第二实施方案的结合部分经由其AB、CC'、C"D或EF环与大体积血清蛋白如白蛋白结合,并且经由其BC、C'C"或FG环与非免疫球蛋白分子结合。在某些实例中,第二实施方案的结合部分经由其AB、CC'、C"D和EF环与大体积血清蛋白如白蛋白结合,并且经由其BC、C'C"和FG环与非免疫球蛋白分子结合。在某些实例中,第二实施方案的结合部分经由AB、CC'、C"D和E-F环中的一个或多个与大体积血清蛋白如白蛋白结合,并且经由BC、C'C"和FG环中的一个或多个与非免疫球蛋白分子结合。
所述结合部分是任何种类的多肽。例如,在某些情况下,所述结合部分是天然肽、合成肽或纤连蛋白支架或工程化的大体积血清蛋白。大体积血清蛋白包括,例如,白蛋白、纤维蛋白原或球蛋白。在一些实施方案中,所述结合部分是工程化支架。工程化支架包括,例如,sdAb、scFv、Fab、VHH、III型纤连蛋白结构域、免疫球蛋白样支架(如Halaby等人,1999.Prot Eng 12(7):563-571所提出的)、DARPin、胱氨酸结肽、脂质运载蛋白、三螺旋束支架、蛋白G相关的白蛋白结合模块,或DNA或RNA适体支架。
在一些情况下,第一实施方案的结合部分与至少一个靶抗原结合域结合。在进一步的实施方案中,第一实施方案的结合部分内的非CDR环提供了针对至少一个靶抗原结合域的结合位点。在一些情况下,该靶抗原结合域与病变细胞或组织例如肿瘤或癌细胞的表面上表达的靶抗原结合。靶抗原包括但不限于EpCAM、EGFR、HER-2、HER-3、c-Met、FoIR、PSMA、CD38、BCMA和CEA、5T4、AFP、B7-H3、CDH-6、CAIX、CD117、CD123、CD138、CD166、CD19、CD20、CD205、CD22、CD30、CD33、CD352、CD37、CD44、CD52、CD56、CD70、CD71、CD74、CD79b、DLL3、EphA2、FAP、FGFR2、FGFR3、GPC3、gpA33、FLT-3、gpNMB、HPV-16E6、HPV-16E7、ITGA2、ITGA3、SLC39A6、MAGE、间皮素、Muc1、Muc16、NaPi2b、柄蛋白-4、CDH-3、CDH-17、EPHB2、ITGAV、ITGB6、NY-ESO-1、PRLR、PSCA、PTK7、ROR1、SLC44A4、SLITRK5、SLITRK6、STEAP1、TIM1、Trop2或WT1。
在一些情况下,第一实施方案的结合部分经由其非CDR环与第一靶抗原结合域结合,并且第一靶抗原结合域进一步连接至第二靶抗原结合域。第一和第二靶抗原结合域的实例包括但不限于T细胞接合物、双特异性T细胞接合物、双重亲和力重靶向抗体、重链可变域(VH)、轻链可变域(VL)、包含VH和VL结构域的scFv、包含Valpha和Vbeta结构域的可溶性TCR片段、单结构域抗体(sdAb)或骆驼科来源的纳米抗体的可变域(VHH)、非Ig结合域,即抗体模拟物,如anticalins、affilins、affibody分子、affimers、affitins、alphabodies、avimers、DARPins、fynomers、kunitz结构域肽,以及单抗体(monobodies)、配体或肽。在一些实施方案中,第一或第二靶抗原结合域是VHH结构域。在一些实施方案中,第一或第二靶抗原结合域是sdAb。在一些情况下,第一靶抗原结合域对肿瘤抗原如EGFR是特异性的,而第二靶抗原结合域对CD3是特异性的。第一靶抗原结合域与其靶标例如肿瘤抗原如EGFR的结合被第一实施方案的结合部分经由其非CDR环所掩蔽。图3显示了一种示例性的条件活性蛋白,其包含根据第一实施方案的结合部分。
在一些情况下,第二实施方案的结合部分内的非CDR环提供了针对非免疫球蛋白结合分子的结合位点。
在一些情况下,所述结合部分包含针对大体积血清蛋白的结合位点。在一些实施方案中,所述结合部分内的CDR提供针对大体积血清蛋白的结合位点。在一些实例中,所述大体积血清蛋白是球蛋白、白蛋白、转铁蛋白、IgG1、IgG2、IgG4、IgG3、IgA单体、因子XIII、纤维蛋白原、IgE或五聚体IgM。在一些实施方案中,所述结合部分包含针对免疫球蛋白轻链的结合位点。在一些实施方案中,所述CDR提供针对免疫球蛋白轻链的结合位点。在一些实例中,该免疫球蛋白轻链是无Igκ的轻链或无Igλ的轻链。
在一些实例中,所述结合部分包含任何类型的结合域,包括但不限于来自单克隆抗体、多克隆抗体、重组抗体、人抗体、人源化抗体的结构域。在一些实施方案中,所述结合部分是单链可变片段(scFv)、可溶性TCR片段、单结构域抗体如重链可变域(VH)、轻链可变域(VL)和骆驼科来源的纳米抗体的可变域(VHH)。在其他实施方案中,所述结合部分是非Ig结合域,即,抗体模拟物,如anticalins、affilins、affibody分子、affimers、affitins、alphabodies、avimers、DARPins、fynomers、kunitz结构域肽和单抗体(monobodies)。
本文预期在本公开的一些实施方案中,本文所述的结合部分包含至少一个可切割连接体。在一方面,可切割连接体包含具有以序列特异性方式被识别并切割的序列的多肽。在某些实例中,该切割是酶切,基于可切割连接体的pH敏感性,或通过化学降解。在一些情况下,本文考虑的条件活性结合蛋白包含蛋白酶可切割连接体,其被基质金属蛋白酶(MMP)例如MMP9以序列特异性方式识别。在一些情况下,蛋白酶可切割连接体被MMP9识别,包含具有氨基酸序列PR(S/T)(L/I)(S/T)的多肽。在一些情况下,被MMP9识别的蛋白酶可切割连接体包含具有氨基酸序列LEATA的多肽。在一些情况下,蛋白酶可切割连接体被MMP11以序列特异性方式识别。在一些情况下,被MMP11识别的蛋白酶可切割连接体包含具有氨基酸序列GGAANLVRGG(SEQ IN NO:3)的多肽。在一些情况下,蛋白酶可切割连接体被表3中公开的蛋白酶识别。在一些情况下,蛋白酶可切割连接体被表3中公开的蛋白酶识别,包含具有选自表3中公开的序列的氨基酸序列(SEQ ID NO:1-42、53和58-62)的多肽。在一些情况下,可切割连接体具有如SEQ ID No.59所示的氨基酸序列。在一些情况下,可切割连接体被MMP9、蛋白裂解酶、尿激酶纤溶酶原激活物(uPA)识别,并且具有如SEQ ID No.59所示的氨基酸序列。
在本公开的一些实施方案中,本文所述的结合部分包含至少一个不可切割连接体。在一些实例中,不可切割连接体包含如SEQ ID No.51、SEQ ID No.302、SEQ ID No.303、SEQ ID No.304或SEQ ID No.305所示的序列。
蛋白酶是在一些情况下以序列特异性方式切割蛋白质的蛋白质。蛋白酶包括但不限于丝氨酸蛋白酶、半胱氨酸蛋白酶、天冬氨酸蛋白酶、苏氨酸蛋白酶、谷氨酸蛋白酶、金属蛋白酶、天冬酰胺肽裂合酶、血清蛋白酶、组织蛋白酶、组织蛋白酶B、组织蛋白酶C、组织蛋白酶D、组织蛋白酶E、组织蛋白酶K、组织蛋白酶L、激肽释放酶、hK1、hK10、hK15、纤溶酶、胶原酶、IV型胶原酶、溶基质蛋白酶、因子Xa、胰凝乳蛋白酶样蛋白酶、胰蛋白酶样蛋白酶、弹性蛋白酶样蛋白酶、枯草杆菌蛋白酶样蛋白酶、猕猴桃蛋白酶、菠萝蛋白酶、钙蛋白酶、胱天蛋白酶、胱天蛋白酶-3、Mir1-CP、木瓜蛋白酶、HIV-1蛋白酶、HSV蛋白酶、CMV蛋白酶、凝乳酶、肾素、胃蛋白酶、蛋白裂解酶、豆荚蛋白、疟原虫天冬氨酸蛋白酶、nepenthesin、金属外肽酶、金属内肽酶、基质金属蛋白酶(MMP)、MMP1、MMP2、MMP3、MMP7、MMP8、MMP9、MMP13、MMP11、MMP14、尿激酶纤溶酶原激活物(uPA)、肠激酶、前列腺特异性靶标(PSA,hK3)、白介素-1β转化酶、凝血酶、FAP(FAP-α)、二肽基肽酶、II型跨膜丝氨酸蛋白酶(TTSP)、嗜中性粒细胞丝氨酸蛋白酶、组织蛋白酶G、蛋白酶3、嗜中性粒细胞丝氨酸蛋白酶4、肥大细胞类糜蛋白酶和肥大细胞类胰蛋白酶。
已知蛋白酶是由某些病变细胞和组织,例如肿瘤或癌细胞分泌的,从而产生富含蛋白酶的微环境或蛋白酶丰富的微环境。在一些情况下,受试者的血液富含蛋白酶。在一些情况下,围绕肿瘤的细胞将蛋白酶分泌到肿瘤微环境中。分泌蛋白酶的围绕肿瘤的细胞包括但不限于肿瘤基质细胞、肌成纤维细胞、血细胞、肥大细胞、B细胞、NK细胞、调节性T细胞、巨噬细胞、细胞毒性T淋巴细胞、树突细胞、间充质干细胞、多形核细胞和其他细胞。在一些情况下,蛋白酶存在于受试者的血液中,例如靶向在微生物肽中发现的氨基酸序列的蛋白酶。该特征允许诸如抗原结合蛋白等靶向治疗剂具有额外的特异性,因为除了在靶细胞或组织的富含蛋白酶的微环境中以外,T细胞不会被抗原结合蛋白结合。
因此,包含可切割连接体的结合部分掩蔽了第一或第二靶抗原结合域与其各自靶标的结合。在一些实施方案中,该结合部分与第一靶抗原结合域结合,后者进一步与第二靶抗原结合域结合,其顺序如下:结合部分(M):可切割连接体(L):第一靶抗原结合域(T1):第二抗原结合域(T2)。在其他实例中,结构域按以下任一个顺序来组织:M:L:T2:T1;T2:T1:L:M;T1:T2:L:M。该结合部分进一步结合延长半衰期的蛋白质,如白蛋白,或如下所述的其任何其他靶标。在一些情况下,该结合部分是白蛋白或包含针对白蛋白的结合位点。在一些情况下,该结合部分包含针对IgE的结合位点。在一些实施方案中,该结合部分包含针对无Igκ的轻链的结合位点。
条件活性结合蛋白的靶标
本文所述的条件活性结合蛋白通过切割附接至所述条件活性蛋白内的结合部分的至少一个可切割连接体而被激活。预期在一些情况下,该活化的结合蛋白与参与疾病、病症或病况和/或与之相关的靶抗原结合。特别是,预期与增生性疾病、肿瘤疾病、炎性疾病、免疫病症、自身免疫病、传染性疾病、病毒性疾病、变态反应、寄生虫反应、移植物抗宿主病或宿主抗移植物病相关的靶抗原是本文公开的活化结合蛋白的靶标。
在一些实施方案中,该靶抗原是肿瘤细胞上表达的肿瘤抗原。肿瘤抗原是本领域公知的,并且包括,例如,EpCAM、EGFR、HER-2、HER-3、c-Met、FoIR、PSMA、CD38、BCMA和CEA、5T4、AFP、B7-H3、CDH-6、CAIX、CD117、CD123、CD138、CD166、CD19、CD20、CD205、CD22、CD30、CD33、CD352、CD37、CD44、CD52、CD56、CD70、CD71、CD74、CD79b、DLL3、EphA2、FAP、FGFR2、FGFR3、GPC3、gpA33、FLT-3、gpNMB、HPV-16E6、HPV-16E7、ITGA2、ITGA3、SLC39A6、MAGE、间皮素、Muc1、Muc16、NaPi2b、柄蛋白-4、CDH-3、CDH-17、EPHB2、ITGAV、ITGB6、NY-ESO-1、PRLR、PSCA、PTK7、ROR1、SLC44A4、SLITRK5、SLITRK6、STEAP1、TIM1、Trop2或WT1。
在一些实施方案中,靶抗原是免疫检查点蛋白。免疫检查点蛋白的实例包括但不限于CD27、CD137、2B4、TIGIT、CD155、ICOS、HVEM、CD40L、LIGHT、OX40、DNAM-1、PD-L1、PD1、PD-L2、CTLA-4、CD8、CD40、CEACAM1、CD48、CD70、A2AR、CD39、CD73、B7-H3、B7-H4、BTLA、IDO1、IDO2、TDO、KIR、LAG-3、TIM-3或VISTA。
在一些实施方案中,靶抗原是细胞表面分子,如蛋白质、脂质或多糖。在一些实施方案中,靶抗原在肿瘤细胞、病毒感染的细胞、细菌感染的细胞、受损红细胞、动脉斑块细胞、发炎或纤维化组织细胞上。在一些实施方案中,靶抗原包含不是细胞因子的免疫应答调节物。免疫应答调节物的实例包括但不限于B7-1(CD80)、B7-2(CD86)、CD3或GITR。
在一些实施方案中,第一靶抗原结合域或第二靶抗原结合域包括抗EGFR结构域、抗EpCAM结构域、抗DLL3结构域、抗MSLN结构域、抗PSMA结构域、抗BDMA结构域或其任意组合。在一些实施方案中,第一靶抗原结合域或第二靶抗原结合域包括抗EGFR sdAb、抗EpCAMsdAb、抗DLL3 sdAb、抗MSLN sdAb、抗PSMA sdAb、抗BDMA sdAb或其任意组合。
在一些实施方案中,本公开的抗EGFR结构域包含选自SEQ ID No.55和737-785的氨基酸。在一些实施方案中,本公开的抗PSMA结构域包含选自SEQ ID No.57-73的氨基酸。在一些实施方案中,本公开的抗BCMA结构域包含选自SEQ ID No.91-214的氨基酸。在一些实施方案中,本公开的抗MSLN结构域包含选自SEQ ID No.215-258的氨基酸。在一些实施方案中,本公开的抗DLL3结构域包含选自SEQ ID No.306-736的氨基酸。在一些实施方案中,本公开的抗EpCAM结构域包含选自SEQ ID No.804-841的氨基酸。
在一些实施方案中,第一靶抗原结合域或第二靶抗原结合域包含抗CD3结构域。在一些实施方案中,该抗CD30结构域包含抗CD3 scFV。在一些实施方案中,该抗CD3 scFv包含选自SEQ ID No.74-90和794的氨基酸序列。
结合蛋白变体
如本文所用的,术语“结合蛋白变体”是指本文所述的条件活性靶标结合蛋白的变体和衍生物,其含有如上所述的结合部分,该结合部分包含与免疫球蛋白结合分子如第一或第二靶抗原结合域、非免疫球蛋白结合分子结合的非CDR环。在某些实施方案中,涉及本文所述的条件活性靶标结合蛋白的氨基酸序列变体。例如,在某些实施方案中,预期本文所述的条件活性靶标结合蛋白的氨基酸序列变体改善该结合蛋白的结合亲和力和/或其他生物学性质。用于制备氨基酸变体的示例性方法包括但不限于将适当的修饰引入编码抗体的核苷酸序列中,或者通过肽合成。这类修饰包括,例如,抗体的氨基酸序列内的残基的缺失和/或插入和/或置换。
可对各个结构域进行缺失、插入和置换的任意组合以得到最终构建体,条件是最终构建体具有期望的特性,例如抗原结合。在某些实施方案中,提供了具有一个或多个氨基酸置换的结合蛋白变体。用于置换诱变的感兴趣的位点包括CDR和框架区。可将氨基酸置换引入感兴趣的条件活性蛋白的各个结构域中,并针对所需活性,例如,保留/改善的抗原结合、降低的免疫原性或改善的抗体依赖性细胞介导的细胞毒性(ADCC)或补体依赖性细胞毒性(CDC)来筛选产物。保守和非保守的氨基酸置换均考虑用于制备抗体变体。
在用来产生变异条件活性抗体的置换的另一个实例中,亲本抗体的一个或多个高变区残基被置换。通常,之后基于与亲本抗体相比的所需性质的改善,例如,增加的亲和力、降低的亲和力、降低的免疫原性、增加的结合的pH依赖性来选择变体。例如,可以使用例如基于噬菌体展示的亲和力成熟技术,如本文所述和本领域已知的技术,来生成亲和力成熟的变异抗体。
在另一个实例中,在亲本条件活性抗体的高变区(HVR)中进行置换以生成变体,然后基于结合亲和力,即通过亲和力成熟来选择变体。在亲和力成熟的一些实施方案中,通过多种方法中的任一种(例如,易错PCR、链改组或寡核苷酸定点诱变)向选择用于成熟的可变基因中引入多样性。然后创建次级文库。然后筛查文库以鉴别具有所需亲和力的任何抗体变体。引入多样性的另一种方法涉及HVR定向方法,其中若干个HVR残基(例如,一次4-6个残基)被随机化。参与抗原结合的HVR残基可以例如使用丙氨酸扫描诱变或建模来特异性鉴别。置换可以在亲本抗体序列内的一个、两个、三个、四个或更多个位点处。
在一些实施方案中,本文所述的条件活性结合蛋白包含VL结构域或VH结构域或两者,所述结构域具有分别对应于天然存在的VL或VH结构域的氨基酸序列的氨基酸序列,但是已经“人源化”,即通过用存在于来自人类的常规4链抗体(例如,如上所述)的VL或VH结构域中相应位置处的一个或多个氨基酸残基替换所述天然存在的VL或VH结构域(特别是框架序列中)的氨基酸序列中的一个或多个氨基酸残基。这可以按本领域已知的方式进行,该方式对于本领域技术人员将会是显而易见的,例如基于本文的进一步描述。此外,应当注意,本公开的此类人源化条件活性靶标结合抗体以本质上已知的任何合适的方式获得,因此不严格限于使用包含天然存在的VL和/或VH结构域的多肽作为起始材料获得的多肽。在一些另外的实施方案中,如本文所述的条件活性靶标结合抗体包含VL和VH结构域,所述结构域具有分别对应于天然存在的VL或VH结构域的氨基酸序列的氨基酸序列,但是已经“骆驼化”,即通过用存在于重链抗体的VL或VH结构域中的相应位置处的一个或多个氨基酸残基替换来自常规4链抗体的天然存在的VL或VH结构域的氨基酸序列中的一个或多个氨基酸残基。此类“骆驼化”置换优选地在形成VH-VL界面和/或存在于VH-VL界面处的氨基酸位置处以及/或者在所谓的骆驼科标志残基处插入(参见例如WO 94/04678,以及Davies和Riechmann(1994和1996))。优选地,用作生成或设计骆驼化单结构域的起始材料或起始点的VH序列优选地是来自哺乳动物的VH序列,更优选地是人类的VH序列,如VH3序列。然而,应当注意,在某些实施方案中,本公开的此类骆驼化条件活性抗体以本领域已知的任何合适的方式获得,因此不严格限于使用包含天然存在的VL和/或VH结构域的多肽作为起始材料获得的多肽。例如,“人源化”和“骆驼化”均通过分别提供编码天然存在的VL和/或VH结构域的核苷酸序列,然后分别以新核苷酸序列编码“人源化”或“骆驼化”条件活性抗体的方式改变所述核苷酸序列中的一个或多个密码子来进行。然后可以表达该核酸,以便提供所需的靶抗原结合能力。或者,在其他实施方案中,使用已知的肽合成技术,从包含VL和/或VH结构域的天然存在的抗体的氨基酸序列从头合成“人源化”或“骆驼化”条件活性抗体。在一些实施方案中,使用已知的肽合成技术,分别从包含VL和/或VH结构域的天然存在的抗体的氨基酸序列或核苷酸序列从头合成“人源化”或“骆驼化”条件活性抗体,分别设计编码本公开的所需人源化或骆驼化条件活性结构域抗体的核苷酸序列,然后使用已知的核酸合成技术从头合成,之后使用已知的表达技术表达由此获得的核酸,以提供本公开的所需条件活性抗体。
用于从VL或VH结构域的天然存在的序列开始获得本公开的条件活性结合蛋白和/或编码该条件活性结合蛋白的核酸的其他合适方法和技术包括,例如,以合适的方式组合一个或多个天然存在的VL或VH序列(诸如一个或多个框架(FR)序列和/或互补决定区(CDR)序列)的一个或多个部分,以及/或者一个或多个合成或半合成序列,以及/或者CH2结构域的天然存在的序列,以及CH3结构域的天然存在的序列(其包含相对于同二聚体更有利于形成异二聚体的氨基酸置换),以便提供本公开的条件活性结合蛋白或编码该条件活性结合蛋白的核苷酸序列或核酸。
亲和力成熟
在为了治疗应用设计条件活性结合蛋白时,期望产生例如调节靶标的功能活性的蛋白质以及/或者改善的结合蛋白(如具有更高特异性和/或亲和力的结合蛋白)以及/或者在特定的细胞或组织环境中具有更高生物利用度或更稳定或更可溶的结合蛋白。
本公开中描述的条件活性结合蛋白表现出改善的针对靶标例如细胞表面上表达的肿瘤抗原的结合亲和力。在一些实施方案中,使用任何已知的亲和力成熟技术(例如诱变、链改组、CDR氨基酸置换)使本公开的条件活性结合蛋白发生亲和力成熟,以增加其与靶标的结合亲和力。氨基酸置换可以是保守的或半保守的。例如,甘氨酸、丙氨酸、缬氨酸、亮氨酸和异亮氨酸等氨基酸通常可以相互置换(具有脂肪族侧链的氨基酸)。在这些可能的置换中,通常使用甘氨酸和丙氨酸相互置换,因为它们具有相对短的侧链,并且使用缬氨酸、亮氨酸和异亮氨酸相互置换,因为它们具有疏水性的较大脂肪族侧链。可以经常相互置换的其他氨基酸包括但不限于:苯丙氨酸、酪氨酸和色氨酸(具有芳香族侧链的氨基酸);赖氨酸、精氨酸和组氨酸(具有碱性侧链的氨基酸);天冬氨酸和谷氨酸(具有酸性侧链的氨基酸);天冬酰胺和谷氨酰胺(具有酰胺侧链的氨基酸);以及半胱氨酸和甲硫氨酸(具有含硫侧链的氨基酸)。在一些实施方案中,通过筛查组合文库来分离条件活性靶标结合蛋白,例如,通过生成噬菌体展示文库并筛查这样的文库以获得对靶抗原具有所需结合特性的抗体,该靶抗原例如是细胞表面上表达的肿瘤抗原。
条件活性结合蛋白修饰
本文所述的条件活性结合蛋白包括衍生物或类似物,其中(i)氨基酸被不是由遗传密码编码的氨基酸残基置换,(ii)成熟多肽与另一化合物如聚乙二醇融合,或(iii)额外的氨基酸与该蛋白质融合,如前导序列或分泌序列或用来阻断免疫原性结构域和/或用于纯化该蛋白质的序列。
典型的修饰包括但不限于乙酰化、酰化、ADP-核糖基化、酰胺化、黄素的共价附接、血红素部分的共价附接、核苷酸或核苷酸衍生物的共价附接、脂质或脂质衍生物的共价附接、磷脂酰肌醇的共价附接、交联、环化、二硫键形成、脱甲基化、共价交联的形成、胱氨酸的形成、焦谷氨酸的形成、甲酰化、γ羧化、糖基化、GPI锚形成、羟基化、碘化、甲基化、肉豆蔻酰化、氧化、蛋白水解加工、磷酸化、异戊二烯化、外消旋化、硒化、硫酸化、转移RNA介导的向蛋白质添加氨基酸,如精氨酰化和泛素化。
在本文所述的条件活性结合蛋白中的任何位置进行修饰,所述位置包括肽骨架、氨基酸侧链和氨基或羧基末端。可用于修饰条件活性结合蛋白的某些常见肽修饰包括糖基化、脂质附接、硫酸化、谷氨酸残基的γ-羧化、羟基化、多肽中的氨基或羧基或两者被共价修饰的封闭,以及ADP-核糖基化。
在一些实施方案中,本公开的条件活性结合蛋白与药物缀合,以形成抗体-药物缀合物(ADC)。通常,ADC用于肿瘤学应用,其中使用抗体-药物缀合物局部递送细胞毒性剂或细胞抑制剂允许将药物部分靶向递送至肿瘤,这可实现更高的功效、更低的毒性等。
编码结合部分或条件活性结合蛋白的多核苷酸
在一些实施方案中,还提供了编码本文所述的结合部分的多核苷酸分子。在一些实施方案中,该多核苷酸分子以DNA构建体的形式提供。在其他实施方案中,该多核苷酸分子以信使RNA转录物的形式提供。
在一些实施方案中,还提供了编码本文所述的条件活性结合蛋白的多核苷酸分子。在一些实施方案中,该多核苷酸分子以DNA构建体的形式提供。在其他实施方案中,该多核苷酸分子以信使RNA转录物的形式提供。
所述多核苷酸分子通过已知方法构建,例如通过将编码由肽连接体隔开,或在其他实施方案中通过肽键直接连接的各个结合域(例如结合部分、靶抗原结合域等)的基因组合到单个基因构建体中,该单个基因构建体与合适的启动子以及可选的合适的转录终止子可操作地连接,并且将其在细菌或其他适当的表达系统例如CHO细胞中表达。根据所采用的载体系统和宿主,可使用任何数目的合适的转录和翻译元件,包括组成型和条件活性启动子。选择启动子,以使其驱动多核苷酸在相应宿主细胞中的表达。
在一些实施方案中,将本文所述的多核苷酸插入到载体如表达载体中,所述载体代表另外的实施方案。该重组载体可根据已知方法来构建。特别感兴趣的载体包括质粒、噬菌粒、噬菌体衍生物、病毒(virii)(例如,逆转录病毒、腺病毒、腺伴随病毒、疱疹病毒、慢病毒等)和粘粒。
可利用多种表达载体/宿主系统,以包含并表达编码所述条件活性结合蛋白的多肽的多核苷酸。表达载体的实例是用于在大肠杆菌中表达的pSKK(Le Gall等人,J ImmunolMethods.(2004)285(1):111-27),或用于在哺乳动物细胞中表达的pcDNA5(Invitrogen)。
因此,在一些实施方案中,如本文所述的结合部分或包含该结合部分的条件活性结合蛋白如下产生:将编码如上所述的结合部分或结合蛋白的载体引入到宿主细胞中,并在使得所述结合部分或结合蛋白或其结构域得到表达的条件下培养所述宿主细胞。
药物组合物
在一些实施方案中,本文还提供药物组合物,其包含治疗有效量的本公开的条件活性结合蛋白和至少一种药学上可接受的载体。术语“药学上可接受的载剂”包括但不限于不干扰成分的生物活性的有效性且对所施用的患者无毒的任何载剂。合适的药物载剂的实例是本领域公知的,并且包括磷酸盐缓冲盐水溶液、水、乳液如水包油乳液、各种类型的润湿剂、无菌溶液等。这样的载剂可通过常规方法配制,并且可以以合适的剂量施用于受试者。优选地,该组合物是无菌的。这些组合物还可含有辅料如防腐剂、乳化剂和分散剂。在一些情况下,通过包含各种抗细菌剂和抗真菌剂来确保阻止微生物的作用。
本文所述的条件活性结合蛋白被考虑用作药物。给药通过不同方式实现,例如,通过静脉内、腹膜内、皮下、肌肉内、局部或真皮内给药。在一些实施方案中,给药途径取决于疗法的种类和药物组合物中包含的化合物的种类。给药方案将由主治医师根据其他临床因素来确定。对于任何一名患者的剂量依赖于许多因素,包括患者体型、体表面积、年龄、性别、待施用的具体化合物、给药时间和途径、疗法的种类、总体健康和其他同时施用的药物。“有效剂量”是指活性成分的量,该量足以影响疾病的病程和严重程度,从而导致这种病理学的减轻或缓解,并且可使用已知方法来确定。
治疗方法
在一些实施方案中,本文还提供了用于刺激有需要的个体的免疫系统的方法和用途,其包括施用本文所述的条件活性结合蛋白。在一些情况下,施用诱导和/或保持对表达靶抗原的细胞的细胞毒性。在一些情况下,表达靶抗原的细胞是癌细胞或肿瘤细胞、病毒感染的细胞、细菌感染的细胞、自身反应性T或B细胞、受损红细胞、动脉斑块或纤维化组织。在一些实施方案中,靶抗原是免疫检查点蛋白。
本文还提供了用于治疗与靶抗原相关的疾病、病症或病况的方法和用途,其包括向有需要的个体施用本文所述的条件活性结合蛋白。与靶抗原相关的疾病、病症或病况包括但不限于病毒感染、细菌感染、自身免疫病、移植排斥、动脉粥样硬化或纤维化。在其他实施方案中,与靶抗原相关的疾病、病症或病况为增生性疾病、肿瘤性疾病、炎性疾病、免疫性病症、自身免疫病、传染性疾病、病毒性疾病、变态反应、寄生虫反应、移植物抗宿主病或宿主抗移植物病。在一个实施方案中,与靶抗原相关的疾病、病症或病况为癌症。在一种情况下,该癌症为血液系统癌症。在另一个情况下,该癌症为黑素瘤。在进一步的情况下,该癌症为非小细胞肺癌。在更进一步的情况下,该癌症为乳腺癌。
在一些实施方案中,如本文所用的,“治疗”或“处理”是指治疗性处理,其中目的是减缓(减轻)不期望的生理病况、病症或疾病,或是获得有益或期望的临床结果。对于本文所述的目的,有益或期望的临床结果包括但不限于症状的减轻;病况、病症或疾病程度的减小;病况、病症或疾病状态的稳定(即不恶化);病况、病症或疾病的延迟发作或进展减缓;病况、病症或疾病状态的改善;以及病况、病症或疾病的可检测到的或不可检测的缓解(部分或全部的)或者增强或改善。治疗包括引发临床上显著的反应,而没有过高水平的副作用。治疗还包括与不接受治疗的情况下预期的生存期相比延长生存期。在其他实施方案中,“治疗”或“处理”是指预防性措施,其中目的是例如在易患疾病的人(例如,携带诸如乳腺癌等疾病的遗传标志物的个体)中,延迟不希望的生理病况、病症或疾病的发作或者降低其严重程度。
在本文所述的方法的一些实施方案中,本文所述的条件活性结合蛋白与用于治疗特定疾病、病症或病况的药剂联合施用。药剂包括但不限于涉及抗体、小分子(例如,化疗药物)、激素(甾体、肽等)的疗法、放射疗法(γ射线、X射线,和/或放射性同位素、微波、UV辐射等的定向递送)、基因疗法(例如,反义,逆转录病毒疗法等)和其他免疫疗法。在一些实施方案中,本文所述的条件活性结合蛋白与止泻剂、止吐剂、镇痛药、阿片类药物和/或非甾体抗炎剂联合施用。在一些实施方案中,本文所述的条件活性结合蛋白在手术之前、期间或之后施用。
实施例
以下实施例进一步说明所描述的实施方案,而非限制本公开的范围。
获得了包含能够结合白蛋白的CDR环和非CDR环的工程化蛋白质支架的序列。使用重叠PCR在非CDR环区域中引入随机突变,从而生成文库。将所得序列克隆到噬菌体展示载体中,从而生成噬菌体展示文库。用该文库转化大肠杆菌细胞,并用来构建噬菌体展示文库。使用固定的对EGFR具有特异性的靶抗原结合域进行ELISA。选择对EGFR具有高特异性的克隆。通过如前所述重新随机化非CDR环区域中的残基进行亲和力成熟。
进行所得蛋白质的非CDR环区域的序列比对,以确定对EGFR结合靶抗原结合域具有高亲和力的蛋白质之间的序列保守性。对这些序列保守区域内的一个或多个氨基酸进行定点诱变,以生成另外的蛋白质。在ELISA中测量所得蛋白质与固定的靶标为EGFR的靶抗原结合域的结合。选择对靶抗原结合域具有最高亲和力的蛋白质。
将该结合部分的序列克隆到载体中,该载体包含可切割连接体的序列和与第二靶抗原例如CD3结合的第二靶抗原结合域的序列。在异源表达系统中表达所得载体,以获得包含结合部分的条件活性靶标结合蛋白,该结合部分包含可切割连接体和非CDR环以及对白蛋白具有特异性的CDR环,所述非CDR环提供对靶标为EGFR的靶抗原结合域具有特异性的结合位点。
获得了包含能够结合白蛋白的CDR环和非CDR环的工程化蛋白质支架的序列。使用重叠PCR在非CDR环区域中引入随机突变,从而生成文库。将所得序列克隆到噬菌体展示载体中,从而生成噬菌体展示文库。用该文库转化大肠杆菌细胞,并用来构建噬菌体展示文库。使用固定的对CD3具有特异性的靶抗原结合域进行ELISA。选择对CD3具有高特异性的克隆。通过如前所述重新随机化非CDR环区域中的残基进行亲和力成熟。
进行所得蛋白质的非CDR环区域的序列比对,以确定对EGFR结合靶抗原结合域具有高亲和力的蛋白质之间的序列保守性。对这些序列保守区域内的一个或多个氨基酸进行定点诱变,以生成另外的蛋白质。在ELISA中测量所得蛋白质与固定的靶标为CD3的靶抗原结合域的结合。选择对靶抗原结合域具有最高亲和力的蛋白质。
将该结合部分的序列克隆到载体中,该载体包含可切割连接体的序列和与第二靶抗原例如EGFR结合的第二靶抗原结合域的序列。在异源表达系统中表达所得载体,以获得包含结合部分的条件活性靶标结合蛋白,该结合部分包含可切割连接体和非CDR环以及对白蛋白具有特异性的CDR环,所述非CDR环提供对靶标为CD3的靶抗原结合域具有特异性的结合位点。
将过表达EGFR并表现出基质金属蛋白酶低表达的细胞分别与根据本公开的示例性条件活性结合蛋白和非条件活性对照结合蛋白一起孵育。还将表达正常水平的EGFR和蛋白酶的细胞与根据本公开的条件活性结合蛋白和非条件活性对照结合蛋白一起孵育。这两种蛋白质均包含对PSMA具有特异性的靶抗原结合域。
结果表明,在不存在蛋白酶分泌的情况下,本公开的条件活性结合蛋白与表达蛋白酶的细胞相互作用,但是不与在缺乏蛋白酶的细胞表面上表达的EGFR相互作用。相反,非条件活性对照结合蛋白缺乏与缺乏蛋白酶的细胞相比选择性结合表达蛋白酶的细胞的能力。因此,本公开的示例性条件活性结合蛋白受体例如在降低肿瘤外毒性方面是有利的。
将鼠肿瘤系CT26皮下植入Balb/c小鼠中,并在植入后第7天测量肿瘤的平均大小。用示例性条件活性结合蛋白治疗测试小鼠,该结合蛋白具有对CTLA4具有特异性的靶抗原结合域和对CD3具有特异性的另一个靶抗原结合域,其中该CTLA4或CD3特异性结构域经由其CDR环与结合部分结合,该结合部分包含可切割连接体,并与白蛋白结合。用含有CD3/CTLA4特异性结构域但不含结合部分或可切割连接体的结合蛋白处理对照小鼠,并且没有条件活性。结果表明,与不含具有非CDR环的部分的比较结合蛋白相比,采用本公开的示例性条件活性结合蛋白的治疗更有效地抑制了肿瘤。
过表达CTLA-4并表现出基质金属蛋白酶低表达的细胞分别与本公开的示例性CTLA4特异性条件活性结合蛋白或对照CTLA-4结合抗体一起孵育,该CTLA4特异性条件活性结合蛋白含有经由其非CDR环与CTLA4结合域结合并经由其CDR与白蛋白结合的结合部分;该对照CTLA-4结合抗体不含经由其非CDR环与CTLA4结合域结合并经由其CDR与白蛋白结合的结合部分。还将表达正常水平的抗原和蛋白酶的细胞与示例性CTLA4特异性条件活性结合蛋白或对照CTLA4结合抗体一起孵育。
结果表明,在不存在蛋白酶分泌的情况下,本公开的条件活性结合蛋白与表达蛋白酶的细胞结合,但是不与缺乏蛋白酶的抗原表达细胞结合。相反,对照抗体缺乏与缺乏蛋白酶的细胞相比选择性结合表达蛋白酶的细胞的能力。因此,本公开的示例性条件活性结合蛋白例如在降低肿瘤外毒性方面是有利的。
A)示例性ProTriTAC分子的表达、纯化和稳定性
将示例性ProTriTAC(也称为前三特异性)分子的序列克隆到哺乳动物表达载体pcDNA 3.4(Invitrogen)中,其之前为前导序列,之后为6x组氨酸标签。将Expi293F细胞(Life Technologies A14527)以0.2-8×1e6个细胞/ml悬浮保持在Optimum GrowthFlasks(Thomson)中的Expi 293培养基中。根据Expi293 Expression System Kit(LifeTechnologies,A14635)方案,将纯化的质粒DNA转染到Expi293细胞中,并在转染后保持4-6天。或者,将三特异性分子的序列克隆到哺乳动物表达载体pDEF38(CMC ICOS)中,转染到CHO-DG44 dhfr-细胞中,生成稳定的池,并在纯化之前在生产培养基中培养可达12天。使用带有蛋白A尖端的Octet RED 96仪器(ForteBio/Pall),且使用对照三特异性蛋白质制作标准曲线,对条件培养基中示例性三特异性蛋白质的量进行定量。过滤来自任一宿主细胞的条件培养基,并通过亲和色谱法和脱盐色谱法进行部分纯化。随后通过离子交换对三特异性蛋白质进行精制,并在合并级分后将其配制在含有赋形剂的中性缓冲液中。使用AcquityBEH SEC200 1.7u 4.6x 150mm柱(Waters Corporation),并在1290LC系统上在中性pH的含有赋形剂的水性/有机流动相中解析,通过SDS-PAGE和分析型SEC估计最终纯度,并用Chemstation CDS软件(Agilent)对峰进行积分。如图5所示,通过运行SDS-PAGE分析从CHO宿主细胞纯化的三特异性蛋白质。
将两种制剂中纯化的前三特异性蛋白质再分装到无菌管中,并通过五个冻融循环施加应激,每个冻融循环各自包括在-80℃和室温下超过1小时,或者在37℃下孵育1周。通过使用UV透明96孔板(Corning3635)和SpectraMax M2和SoftMaxPro软件(MolecularDevices)的UV光谱法、SDS-PAGE和分析型SEC,评估应激后样品的浓度和浊度,并与对照非应激样品的相同分析进行比较。对于从293宿主细胞中纯化的单个示例性三特异性ProTriTAC分子,对照样品和应激样品的分析型SEC的色谱图的叠加图在图6中示出。
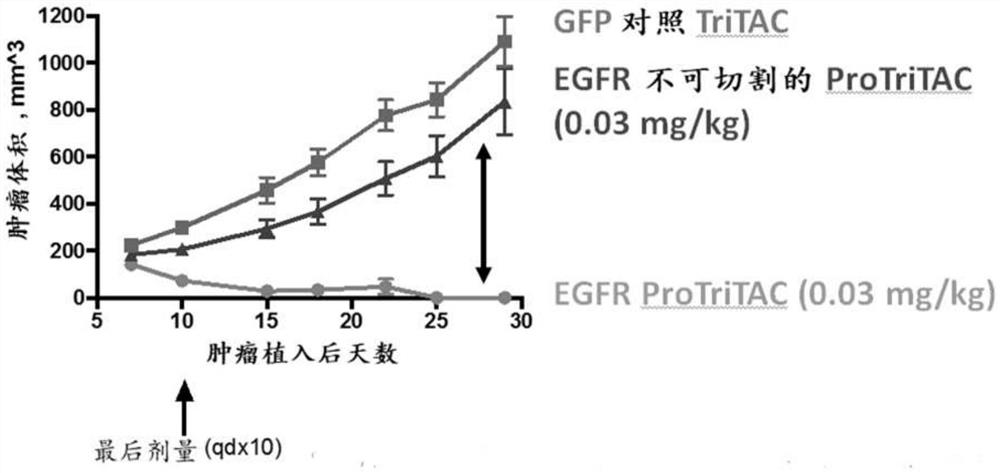
B)ProTriTAC在啮齿动物肿瘤异种移植模型中表现出有效的、蛋白酶依赖性抗肿瘤活性
在免疫受损的NCG小鼠中,在与扩充的人T细胞混合的HCT116皮下异种移植肿瘤中,评价示例性ProTriTAC分子(SEQ ID NO:46)的体内抗肿瘤活性,该ProTriTAC分子含有EGFR结合域作为靶标结合域、CD3结合域以及包含掩蔽部分(SEQ ID NO:50)和可切割连接体(SEQ ID NO:53)的白蛋白结合域。在研究中还使用了不可切割的EGFR靶向ProTriTAC分子(SEQ ID NO:47)和GFP靶向ProTriTAC分子(SEQ ID NO:49)。具体而言,在第0天每只小鼠将5x10
C)在为期三周的食蟹猴药代动力学研究中证明了ProTriTAC在体内的功能性掩蔽和稳定性
将单剂量的PSMA靶向ProTriTAC(SEQ ID NO:43)、不可切割的PSMA靶向ProTriTAC(SEQ ID NO:44)、非掩蔽/不可切割的TriTAC(SEQ ID NO:52)和模拟蛋白酶激活的PSMA靶向ProTriTAC(SEQ ID NO:45)的活性药物通过静脉内注射以0.1mg/kg施用至食蟹猴,该PSMA靶向ProTriTAC含有PSMA结合域作为靶标结合域、CD3结合域以及包含掩蔽部分(SEQID NO:50)和可切割连接体的白蛋白结合域(SEQ ID NO:53)。在图9所示的时间点收集血浆样品。上述测试分子的设计在图8中示出。如上所述,使用采用生物素化重组人PSMA(R&Dsystems)的配体结合测定以及在MSD测定(Meso Scale Diagnostic,LLC)中使用磺基标记的抗CD3独特型抗体克隆的11D3,确定各种测试分子的浓度。使用Phoenix WinNonlin药代动力学软件,使用与静脉内团注给药途径一致的非房室方法,估计药代动力学参数。
为了计算测试分子的体内转化率(即PSMA靶向ProTriTAC、不可切割的PSMA靶向ProTriTAC、非掩蔽/不可切割的PSMA靶向ProTriTAC的转化率),通过求解以下微分方程组估算活性药物在循环中的浓度,其中P为前药的浓度,A为活性药物的浓度,k
根据经验确定食蟹猴中前药、活性药物、非掩蔽不可切割的前药对照和不可切割的前药对照的清除率(k
k
根据经验确定前药在循环中的初始浓度,并假设活性药物的初始浓度为零。进一步的计算表明,包含蛋白酶可切割连接体的ProTriTAC在循环中足够稳定,每194小时具有50%的非肿瘤介导的转化,根据经验确定该分子的t
图11显示,由于模拟活化ProTriTAC分子的活性药物从循环中迅速清除,并且ProTriTAC和对照非掩蔽不可切割的ProTriTAC具有更长的半衰期,因此,ProTriTAC与活化ProTriTAC循环暴露之间有显著的>200倍的差异。还观察到掩蔽但不可切割的ProTriTAC对照分子比非掩蔽不可切割的ProTriTAC对照在循环中存在的时间更长,从而表明掩蔽在延长循环半衰期(t
D)ProTriTAC分子的蛋白酶激活导致体外活性显著增强
本研究的目的是评估蛋白酶可激活的ProTriTAC分子、不可切割的ProTriTAC分子和模拟蛋白酶激活的ProTriTAC分子的重组活性药物片段在CD3结合和T细胞介导的细胞杀伤中的相对效力。模拟蛋白酶激活的ProTriTAC分子的活性药物片段含有CD3结合域和靶抗原结合域,但缺乏白蛋白结合域。而蛋白酶可激活的ProTriTAC分子含有包含掩蔽结构域和蛋白酶可切割位点的白蛋白结合域、CD3结合域和靶抗原结合域。不可切割的ProTriTAC分子缺乏蛋白酶可切割的位点,但在其他方面与蛋白酶可激活的ProTriTAC分子相同。
纯化的ProTriTAC(在图12-14中标记为前药)、不可切割的ProTriTAC(在图12-14中标记为前药(不可切割的))和模拟蛋白酶激活的ProTriTAC的重组活性药物片段(在图12-14中标记为活性药物)在ELISA测定中测试与重组人CD3的结合(图12),在流式细胞术分析中测试与纯化的人原代T细胞的结合(图13),并在T细胞依赖性细胞毒性测定中测试功能效力(图14)。
对于ELISA,在多孔板中,将指定浓度的可溶性测试分子(即活性药物、前药和前药(不可切割的))与固定的重组人CD3ε(R&D Systems)在补充有15mg/mL人血清白蛋白的PBS中于室温下孵育1小时。使用SuperBlock(Thermo Fisher)封闭板,使用含有0.05%吐温-20的PBS洗涤,并使用非竞争性抗CD3独特型单克隆抗体11D3,随后使用过氧化物酶标记的第二抗体和TMB-ELISA底物溶液(Thermo Fisher)进行检测。图12中示出的结果表明,与不可切割的前药相比,模拟蛋白酶激活的ProTriTAC分子的活性药物片段在结合CD3方面的效力约高250倍。表6中提供了EC
对于通过流式细胞术确定的与人原代T细胞的结合,在多孔板中,在含有2%胎牛血清和15mg/ml人血清白蛋白的PBS的存在下,将指定浓度(图13中所示)的可溶性测试分子(即活性药物、前药和前药(不可切割的))与纯化的人原代T细胞一起在4℃下孵育1小时。用含有2%胎牛血清的PBS洗涤板,使用AlexaFluor 647标记的非竞争性抗CD3独特型单克隆抗体11D3进行检测,并使用FlowJo 10(FlowJo,LLC)分析数据。图13中示出的结果表明,与不可切割的前药相比,模拟蛋白酶激活的ProTriTAC分子的活性药物片段在结合人原代T细胞方面的效力高1000倍以上。表7中提供了细胞杀伤的EC
对于在T细胞依赖性细胞毒性测定中的功能效力,在多孔板中,将图14中示出的指定浓度的可溶性测试分子(即活性药物、前药和前药(不可切割的))与纯化的静息人T细胞(效应细胞)和HCT116癌细胞(靶细胞)以10:1的效:靶比在37℃下孵育48小时。HCT116靶细胞系已用萤光素酶报道基因稳定转染,以允许通过ONE-Glo(Promega)进行特异性T细胞介导的细胞杀伤测量。图14中示出的结果表明,与不可切割的前药相比,模拟蛋白酶激活的ProTriTAC分子的活性药物片段在T细胞介导的癌细胞杀伤方面的效力高约500倍。表8中提供了EC
本研究的目的是探索含有不同连接体的ProTriTAC分子的抗肿瘤活性。7周龄的NSG雌性小鼠用于该研究。在研究开始时,在第0天,向NSG雌性小鼠注射2.5x 10
在以下实施例中使用的ProTriTAC分子和ProTriTAC NCLV分子以EGFR为靶标,并具有各个结构域的以下取向:(抗白蛋白结合域(sdAb):抗CD3结构域(scFV):抗EGFR结构域(sdAb))。表6中列出的ProTriTAC分子之间的唯一区别是连接体序列。每天施用ProTriTAC分子、ProTriTAC NCLV分子或GFP TriTAC分子(GFP TriTAC分子具有各个结构域的以下取向:抗GFP sdAb:抗Alb sdAb:抗CD3scFv),持续10天(即,在向动物注射肿瘤细胞和扩充的细胞后的第10天施用最终剂量),并在第10天施用最终剂量之前数天开始,定期测量肿瘤体积。
如图18所示,与ProTriTAC NCLV分子的GFP TriTAC对照相比,含有连接体序列L001、L045、L040和L041的ProTriTAC分子表现出更有效的抗肿瘤活性。数据的统计显著性通过重复测量单向ANOVA-Dunnett事后检验来确定。将每组小鼠的平均肿瘤体积与接受NCLV分子的小鼠组的平均肿瘤体积进行比较。
还评估了如上所述施用各种分子后的药代动力学,数据示于图19中。施用后,对照GFP TriTAC分子迅速从循环中清除,而NCLV分子在循环中保留的时间最长。除了含有连接体序列L001的ProTriTAC的清除速度几乎与对照GFP TriTAC一样快以外,测试ProTriTAC分子的药代动力学清除曲线在GFP TriTAC与NCLV之间。
在混合异种移植模型中评价了表9中列出的ProTriTAC分子、对照GFP TriTAC分子和ProTriTAC NCLV分子,以确定含有不同连接体的ProTriTAC分子在体内的功效。如先前实施例(实施例7)中所述,通过向7周龄的NSG小鼠注射2.5x 10
观察到与用对照GFP TriTAC分子治疗的小鼠组或用ProTriTAC NCLV分子治疗的小鼠组相比,在用含有连接体L040的示例性ProTriTAC分子治疗的动物中,肿瘤生长具有统计学显著的延迟。对于含有连接体序列L001、L041和L045的ProTriTAC分子也有类似的观察结果。数据在表20中示出。
也可以使用其他细胞系,如A549(非小细胞肺癌)细胞、DU-145(前列腺癌)细胞、MCF-7(乳腺癌)细胞、Colo 205(结肠癌)细胞、3T3/]GF-IR(小鼠成纤维细胞)细胞、NCIH441细胞、HEP G2(肝细胞瘤)细胞、MDA MB 231(乳腺癌)细胞、HT-29(结肠癌)细胞、MDA-MB-435s(乳腺癌)细胞、U266细胞、SH-SYSY细胞、Sk-Mel-2细胞、NCI-H929、RPM18226和A431细胞,用异种移植模型进行类似的研究。
在该研究中,食蟹猴用三种不同浓度(30μg/kg;300μg/kg;和1000μg/kg)的示例性含有不可切割连接体的EGFR靶向ProTriTAC分子(ProTriTAC(NCLV))或三种不同浓度(10μg/kg;30μg/kg;和100μg/kg)的示例性EGFR靶向TriTAC分子(SEQ ID No.793)治疗。
如图21所示,在施用ProTriTAC(NCLV)分子后4小时,与施用EGFR靶向TriTAC分子相比,IFN-γ、IL-6和IL-10水平显著降低。
在该研究中,评估了示例性EGFR靶向ProTriTAC分子的耐受性。在研究开始时,即第0天,向7周龄NSG雌性无肿瘤小鼠中腹膜内注射2x 10
如图22所示,即使在1000μg/kg的最高剂量时,含有不可切割连接体的EGFR靶向ProTriTAC分子(ProTriTAC(NCLV))和GFP TriTAC(用作阴性对照)在小鼠中也很好地耐受。含有L001连接体序列的EGFR靶向ProTriTAC分子在100μg/kg剂量时良好耐受,而EGFR靶向TriTAC在30μg/kg的剂量时良好耐受。因此观察到,在小鼠中,含有L001连接体序列的ProTriTAC使耐受性提高了约3倍,而ProTriTAC(NCLV)使耐受性提高了约30倍。ProTriTAC(NCLV)和TriTAC分子在小鼠中的最大耐受剂量与在食蟹猴中观察到的一致。
为了进一步探索连接体在EGFR靶向ProTriTAC分子在小鼠中的耐受性中的作用,将连接体序列从L001变为L040。在该实验中,在研究开始时,即第0天,向7周龄NSG雌性无肿瘤小鼠皮下注射5x10
在该研究中,小鼠接受了各种浓度的EFGR靶向TriTAC分子、含有连接体序列L001的EGFR靶向ProTriTAC分子(ProTriTAC(L001))和含有不可切割连接体的EGFR靶向ProTriTAC分子(ProTriTAC(NCLV))。通过测量ALT(丙氨酸转氨酶)和AST(天冬氨酸转氨酶)的血清浓度来评估耐受性。结果在图24A、24B和24C以及图25A、25B和25C中示出。观察到在以最高0.3mg/kg的剂量施用ProTriTAC(L001)后,AST和ALT的血清浓度未升高,在以最高1mg/kg的剂量施用ProTriTAC(NCLV)后,AST和ALT的血清浓度未升高。与之相比,在以0.3mg/kg的剂量施用TriTAC分子后,AST和ALT的血清浓度未升高。
在另一项研究中,食蟹猴用各种浓度的EFGR靶向TriTAC分子和含有不可切割连接体的EGFR靶向ProTriTAC分子(ProTriTAC(NCLV))治疗。通过测量ALT(丙氨酸转氨酶)和AST(天冬氨酸转氨酶)的血清浓度来评估耐受性。结果在图26中示出。观察到在以最高1000μg/kg的剂量施用ProTriTAC(NCLV)后,AST和ALT的血清浓度未升高。与之相比,在以10μg/kg的剂量施用TriTAC分子后,AST和ALT的血清浓度未升高。
该研究的目的是通过在相同荷瘤小鼠中测量抗肿瘤活性和可观察到的中靶毒性来评价治疗窗的扩大。7周龄的NSG雌性小鼠用于该研究。
在研究开始时,在第0天,向NSG雌性小鼠注射2.5x 10
通过在第14天用卡尺测量原始肿瘤植入部位上方的红色瘢痕性皮肤病变的半径,并应用方程面积=π*(病变半径)
(图27和28的)结果表明,当在相同荷瘤小鼠上测量功效和毒性时,示例性蛋白酶可切割的EGFR ProTriTAC的效力比EGFR TriTAC低3倍,但耐受性高30倍(即,治疗窗提高了10倍),如下表所总结的。这将使得使ProTriTAC的剂量是TriTAC的约3倍,以获得至少相同的效率和更好的耐受性。
获得了包含非CDR环(AB、EF、C”D和CC’)的结合部分的序列。将人CD3ε序列的一部分与甘氨酸残基一起移植到结合部分内的非CDR环的CC’环中,以进一步延伸CC环。图29示出了三个不同的变体,其包含CC’环的10、12或16个氨基酸的延伸。在变体CC10的情况下,移植到CC’环中以代替野生型序列APGKG的人CD3ε序列部分是QDGNEE(SEQ ID NO.801),并且另外插入了4个甘氨酸残基以延伸CC’环。在变体CC12的情况下,移植到CC’环中以代替野生型序列APGKG的人CD3ε序列部分是QDGNEEMGG(SEQ ID No.802),并且另外插入了3个甘氨酸残基以延伸CC’环。在变体CC12的情况下,移植到CC’环中以代替野生型序列APGKG的人CD3ε序列部分是QDGNEEMGG(SEQ ID NO.803),并且另外插入了7个甘氨酸残基以延伸CC’环。如上所述,将包含含有CD3ε序列的延伸非CDR环的结合部分克隆到载体中,该载体进一步包含蛋白酶可切割连接体、含有CD3结合域的scFv和EGFR结合域的编码序列,以表达ProTriTAC分子。ProTriTAC分子含有本公开的示例性结合部分、CD3结合scFv和EGFR结合域。随后将ProTriTAC分子暴露于与肿瘤相关的蛋白酶——蛋白裂解酶,以测定在切割蛋白酶可切割连接体后该分子的活化,该切割将包含可切割连接体的结合部分(在图29和30中描绘为aALB)与分子的其余部分分开,即与含有CD3结合域(在图29和30中描绘为aCD3)和EGFR结合域(aEGFR)的scFv分开。图30显示了在用蛋白裂解酶处理后,ProTriTAC分子的活化,其含有CC’非CDR环的CC10、CC12或CC16变体、CD3结合scFv,形式为VH-VL(左图)或VL-VH(右图)。在结合部分中含有野生型CC’环的ProTriTAC分子用作蛋白酶激活试验的对照。另外,不是“前(pro)”形式的TriTAC分子,即包括与ProTriTAC分子相同的结构域的分子,不同之处在于它具有半衰期延长结构域,如白蛋白,而不是结合部分,也用蛋白裂解酶处理,并用作对照。结果表明,ProTriTAC分子在切割后被激活,以生成游离白蛋白结合域(在图30中描绘为游离aALB),而白蛋白结构域并未与TriTAC分子分离。因此,与TriTAC形式不同,含有本公开的结合部分的ProTriTAC分子在肿瘤微环境中切割后能够容易地从半衰期延长结构域上解离,从而能够在活化后从体循环中迅速清除。
进行了进一步的研究以测定含有人CD3ε的结合部分与CD3的结合。观察到在人血清白蛋白的存在下,含有具有人CD3ε的结合部分的ProTriTAC分子的活化形式在结合CD3方面的效力是其不含该结合部分的活化形式的约20倍。结果在图31中示出。
还在一项研究中测定了含有本文所述结合部分的ProTriTAC分子的细胞杀伤潜力,在该研究中,在人血清白蛋白的存在下,用ProTriTAC分子或其活化形式处理CaOV4细胞系。如图32所示,含有CC’非CDR环的CC16变体的ProTriTAC分子在杀死癌细胞方面的效力是从白蛋白结合域上分离的其活化形式的约50倍。观察到的总掩蔽是由于与人血清白蛋白结合而引起的立体掩蔽与CC’非CDR环中CC16掩蔽引起的特异性掩蔽的组合。
为了确定最适合于修饰的非CDR环(AB、CC、C”D和EF)中的位置,以创建掩蔽能力,使用四组包含随机化简并“NNK”密码子且具有不同环长度的重叠DNA寡核苷酸装配并生成了文库,如以下示意图所示:
AB环寡核苷酸:
WT:LVQPGN(20%)(SEQ ID NO:903)
AB0:XXXXXX(20%)
AB1:XXXXXXX(20%)
AB2:XXXXXXXX(20%)
AB3:XXXXXXXXX(20%)
CC'环寡核苷酸:
WT:APGKG(20%)
CC0:XXXXX(20%)
CC1:XXXXXX(20%)
CC2:XXXXXXX(20%)
CC3:XXXXXXXX(20%)
C”D环寡核苷酸:
WT:DSVKGR(20%)(SEQ ID NO:904)
CD0:XXXXXX(20%)
CD1:XXXXXXX(20%)
CD2:XXXXXXXX(20%)
CD3:XXXXXXXXX(20%)
EF环寡核苷酸:
WT:SLRPED(20%)(SEQ ID NO:905)
EF0:XXXXXX(20%)
EF1:XXXXXXX(20%)
EF2:XXXXXXXX(20%)
EF3:XXXXXXXXX(20%)
注意:“X”表示随机化残基(“NNK”密码子),其可以是20种天然氨基酸以及终止密码子中的任何一种。目标是使每个非CDR环的约20%为野生型。这些野生型寡核苷酸用作内部基准,以评估每个环对修饰(序列组成和/或长度变化)的耐受性。难以忍受变化的环很容易恢复为野生型;相反,高度适应改变的环将保持多样化的序列组库。为此,如图33所示,在用HSA淘选之前,从原始文库中对24个克隆进行测序,以验证非CDR环的随机化。在针对HSA的两轮噬菌体淘选后,对30个克隆进行测序以检查非CDR环组成。结果显示,在4个非CDR环中有3个(AB、C”D和EF)主要利用20%的野生型寡核苷酸并恢复为野生型,这表明它们与野生型序列相比可能较不受欢迎。然而,CC’环保持了多样性的序列组库(在序列和长度两方面),这表明CC’环可能是最能容忍随机化的环,我们可以利用它来对相邻结构域进行特定的掩蔽,如图34所示。
用在Expi293细胞中表达的纯化的EpCAM蛋白免疫美洲驼。由循环的B细胞构建用于表达抗体重链可变域的噬菌体展示文库。参见van der Linden,de Geus,Stok,Bos,vanWassenaar,Verrips,and Frenken.2000.J Immunol Methods 240:185–195。通过在大肠杆菌中表达抗EpCAM蛋白,制备周质提取物,并使用比色ELISA针对人和食蟹猴EpCAM结合活性筛选蛋白质,针对与EpCAM的结合筛选噬菌体克隆。鉴定了38个独特的仅重链的序列(SEQID No.804-841),其相对于用人和/或食蟹猴EpCAM蛋白的对照,在ELISA筛选中产生了信号(如表10所示)。
将从实施例15选择的抗EpCAM仅重链单结构域抗体克隆到用于表达重组蛋白的DNA构建体中。这些表达构建体均编码信号肽。设计一组抗EpCAM构建体(SEQ ID No.842至868)以表达融合蛋白,该融合蛋白在成熟分泌的融合蛋白的N末端上具有人源化抗CD3scFv结构域,随后是美洲驼抗EpCAM结构域,这两个结构域通过序列GGGGSGGGS连接,并且在C末端具有HHHHHH。设计第二组抗EpCAM构建体(SEQ ID No.869至895)以表达融合蛋白,该融合蛋白在成熟分泌的融合蛋白N端上具有美洲驼抗EpCAM结构域,随后是人源化的抗CD3-scFv结构域,这两个结构域通过序列GGGGSGGGS连接,并在C末端具有HHHHHH。
将这些抗EpCAM/抗CD3(从N末端到C末端)或抗CD3/抗EpCAM(从N末端到C末端)融合蛋白构建体转染到Expi293细胞中。通过使用Octet仪器,采用链霉亲和素,并加载生物素化的CD3-Fc融合蛋白,对来自转染的Expi293细胞的条件培养基中抗EpCAM/抗CD3融合蛋白的量进行定量,并使用与抗EPCAM/抗CD3蛋白具有相似分子量的抗CD3融合蛋白作为标准。
在T细胞依赖性细胞毒性测定中测试条件培养基。参见Nazarian AA,ArchibequeIL,Nguyen YH,Wang P,Sinclair AM,Powers DA.2015.J Biomol Screen.20:519-27。在该测定中,将表达EpCAM的萤光素酶标记的NCI-H508细胞与纯化的人T细胞组合,并滴定抗EpCAM/抗CD3融合蛋白或抗CD3/抗EpCAM。假设如果该融合蛋白指导T细胞杀死NCI-H508细胞,则在实验开始后48小时进行的萤光素酶测定中的信号应减少。图36-39以图形格式提供了TDCC数据。来自TDCC测定的EC
使用具有已知浓度的抗EpCAM/抗CD3或抗CD3/抗EpCAM融合蛋白的条件培养基,测量融合蛋白对人和食蟹猴EpCAM蛋白的结合亲和力。在带有链霉亲和素尖端的Octet仪器中加载生物素化的人或食蟹猴EpCAM蛋白,并通过测量抗EPCAM/抗CD3融合蛋白或抗CD3/抗EpCAM融合蛋白与生物素化EpCAM蛋白的结合的结合速率和解离速率来计算K
通过将它们的CDR序列移植到人种系序列上,同时保留一些美洲驼框架序列以确保抗体不丧失活性,对实施例15中鉴别的三个美洲驼抗EpCAM抗体序列进行人源化(SEQ IDNo.896至898)。
将这些序列克隆到表达构建体中,用于在Expi293细胞中表达抗EpCAM/抗CD3融合蛋白(SEQ ID No.899至901),如实施例16所述。
如实施例16所述对存在于条件培养基中的抗EpCAM/抗CD3融合蛋白的量进行定量。如实施例16所述测量这些人源化蛋白质对人、食蟹猴和小鼠EpCAM的亲和力。从这些测量值计算出的相对K
如实施例16所述评估存在于条件培养基中的抗EpCAM/抗CD3融合蛋白的T细胞杀伤潜力。结果在表15和图40中提供。
在该研究中,评估了示例性EpCAM靶向ProTriTAC分子的耐受性。在研究开始时,即在第0天,向7周龄NSG雌性无肿瘤小鼠腹膜内注射2x 10
如图41A-41C所示,即使在1mg/kg的最高剂量时,含有不可切割连接体的EpCAM靶向ProTriTAC分子(ProTriTAC(NCLV))(SEQ ID No.908)和GFP TriTAC(用作阴性对照)在小鼠中也很好地耐受。含有L040连接体序列的EpCAM靶向ProTriTAC分子(SEQ ID No.907)在1mg/kg的最高测试剂量时良好耐受,而EpCAM靶向TriTAC(SEQ ID No.906)在0.1mg/kg时良好耐受。因此观察到,与EpCAM靶向TriTAC相比,含有L040连接体序列的EpCAM靶向ProTriTAC在小鼠中的耐受性提高了至少约10倍。
在异种移植模型中评价本公开的EpCAM靶向融合蛋白(例如,融合蛋白,其为包含抗EpCAM仅重链单结构域抗体、抗CD3 scFv和抗白蛋白结构域的三特异性蛋白质)。为了确定示例性EpCAM靶向融合蛋白在体内的功效,使用了多种异种移植肿瘤模型。用于异种移植肿瘤研究的常见肿瘤细胞系的实例包括A549(非小细胞肺癌)细胞、DU-145(前列腺癌)细胞、MCF-7(乳腺癌)细胞、Colo 205(结肠癌)细胞、3T3(小鼠成纤维细胞)细胞、NCI H441细胞、HEP G2(肝细胞瘤)细胞、MDA MB 231(乳腺癌)细胞、HT-29(结肠癌)细胞、MDA-MB-435s(乳腺癌)细胞、U266细胞、SH-SYSY细胞、Sk-Mel-2细胞、NCI-H929、RPM18226和A431细胞。对免疫缺陷的NOD/scid小鼠进行亚致死照射(2Gy),并将1X 10
与相应媒介物处理的对照组相比,预期用示例性EpCAM靶向三特异性蛋白质治疗的动物具有统计学上显著的肿瘤生长延迟。
这是用于研究本公开的示例性EpCAM靶向三特异性抗原结合蛋白作为上皮卵巢癌治疗的I/II期临床试验。
1.研究结果:
2.主要:示例性EpCAM靶向三特异性蛋白质的最大耐受剂量。
3.次要:确定示例性EpCAM靶向三特异性蛋白质的体外反应是否与临床反应相关
I期
4.最大耐受剂量(MTD)在该试验的I期部分确定。
1.1最大耐受剂量(MTD)在该试验的I期部分中确定。
1.2满足合格性标准的患者加入针对前述实施例的EPCAM靶向三特异性蛋白质的试验。
1.3目标是确定前述实施例的EpCAM靶向三特异性蛋白质可以在参与者中安全地施用而没有严重的或难以处理的副作用的最高剂量。给定的剂量取决于之前已经入选该研究的参与者的数目以及剂量耐受程度。并非所有参与者都接受相同的剂量。
II期
2.1随后的II期部分以MTD进行治疗,目的是确定采用示例性EpCAM靶向三特异性蛋白质的疗法是否会导致至少20%的反应率。II期的主要结果---确定采用EPCAM靶向三特异性蛋白质的疗法是否会致使至少20%的患者实现临床反应(强烈反应(blastresponse)、轻微反应、部分反应或完全反应)。
合格性:
·经组织学或细胞学证实的上皮卵巢癌。在一线铂类化疗失败后可能有复发的上皮卵巢癌或疾病进展,且不超过一种既往铂类方案治疗
·足够的骨髓功能、肾功能、肝功能和超声心动图检查实验室值
III期
5.3.1随后的III期部分使用示例性EpCAM靶向三特异性蛋白质来进行,其中评估次要终点,如反应率(RR)、患者记录的结果(PRO)、无进展生存率(PFS)、无进展生存期、进展时间(TIP)、总生存率、健康相关的生活质量评估、总生存率的参与者数量、反应持续时间、反应时间、反应参与者数量以及肿瘤生长时间等。
序列表
- 用于条件性激活免疫球蛋白分子的结合部分
- 含有Fc区的条件性活化的结合部分
