Rho抑制剂盐酸法舒地尔的新用途
文献发布时间:2023-06-19 11:30:53
技术领域
本发明属于医学技术领域,尤其是一种Rho抑制剂盐酸法舒地尔的新用途。
背景技术
VAV3是鸟苷酸交换因子,其可激活GTP酶(RhoA,Racl和Cdc42)对Rho相关信号通路进行调节。VAV3在多种肿瘤的增殖和转移过程中起到重要作用。并且VAV3高表达被认为是卵巢癌病人不良预后的独立风险指标。
Rho抑制剂盐酸法舒地尔,是一种新型、高效的血管扩张药,防治慢性缺血性脑血管痉挛。研究发现辛伐他汀与法舒地尔联合用药加强了对Rho激酶的抑制作用,提示他汀类药物能够有效预防冠脉的痉挛,可明显改善缺血心肌的血供。一种名为BA-210的药物(Cethrin)在临床前动物研究中显示有望用于治疗脊髓损伤(SCI)。肉毒梭菌C3外酶选择性地修饰Rho亚型,可渗透细胞的C3现在被局部应用以治疗脊髓损伤。
目前临床Rho抑制剂主要作用于心脑血管。被FDA批准的Rho抑制剂有盐酸法舒地尔,作为一种新型、高效的血管扩张药,临床上可以有效缓解脑血管痉挛,改善蛛网膜下隙出血(SAH)患者的预后,在日本于1995年正式批准进入临床,防治慢性缺血性脑血管痉挛。研究发现辛伐他汀在改变RhoA蛋白的相对活性、Rho激酶的相对活性等方面,其作用效果与法舒地尔相当,二者联合用药加强了对Rho激酶的抑制作用,提示他汀类药物能够有效预防冠脉的痉挛,可明显改善缺血心肌的血供。一种名为BA-210的药物(Cethrin)可以阻止Rho的激活,并已在临床前动物研究中显示有望用于治疗脊髓损伤(SCI)。肉毒梭菌C3外酶是细菌ADP-核糖转移酶的原型,通过ADP-核糖的共价附着,选择性地修饰Rho亚型RhoA、RhoB和RhoC,可渗透细胞的C3现在被局部应用以治疗脊髓损伤。
目前临床治疗恶性卵巢肿瘤会依赖于术后化疗和放疗,对人体危害大。另外,针对恶性卵巢癌的诊断治疗周期长,不能预判,基本都是针对手术后相应的治疗。
通过检索,尚未发现与本发明专利申请相关的专利公开文献。
发明内容
本发明的目的在于克服现有技术中的不足之处,提供一种Rho抑制剂盐酸法舒地尔的新用途。
本发明解决其技术问题所采用的技术方案是:
一种Rho抑制剂盐酸法舒地尔在作为或制备卵巢癌的药物方面中的应用。
而且,所述卵巢癌为A/A基因型卵巢癌。
而且,在治疗A/A基因型的相对恶性的卵巢癌病人时,将化疗药物与其参与的通路的Rho抑制剂盐酸法舒地尔联合用药治疗。
而且,检测SNP位点预判是A/A基因型后,针对Rho通路用药。
而且,AA高表达VAV3,SNP通过调控VAV3进而调控卵巢癌,通过抑制VAV3参与的Rho通路防治卵巢癌。
本发明取得的优点和积极效果为:
1、本发明通过Rho抑制剂的干预作用来提高A/A基因型卵巢癌患者的治疗效果,减小传统方法放疗化疗对人体的危害。
2、本发明Rho抑制剂盐酸法舒地尔在使用时,检测SNP位点预判是AA后,针对Rho通路用药,相对可以做到“早治疗”。
3、目前Rho盐酸法舒地尔主要作用于心脑血管,没有直接应用到抑制卵巢肿瘤增殖方面,且治疗卵巢癌的方法都在后期,手术切除和后期化疗,盐酸法舒地尔作为一种Rho抑制剂在临床开展了新用途,可以抑制卵巢肿瘤增殖,不单一针对心脑血管疾病。
4、建议临床上在治疗A/A基因型卵巢癌病人时,将化疗药物与Rho抑制剂联合用药治疗,从而防止由于高表达的VAV3激活Rho相关信号通路而导致不良预后,达到延长卵巢癌病人的生存期目的。
附图说明
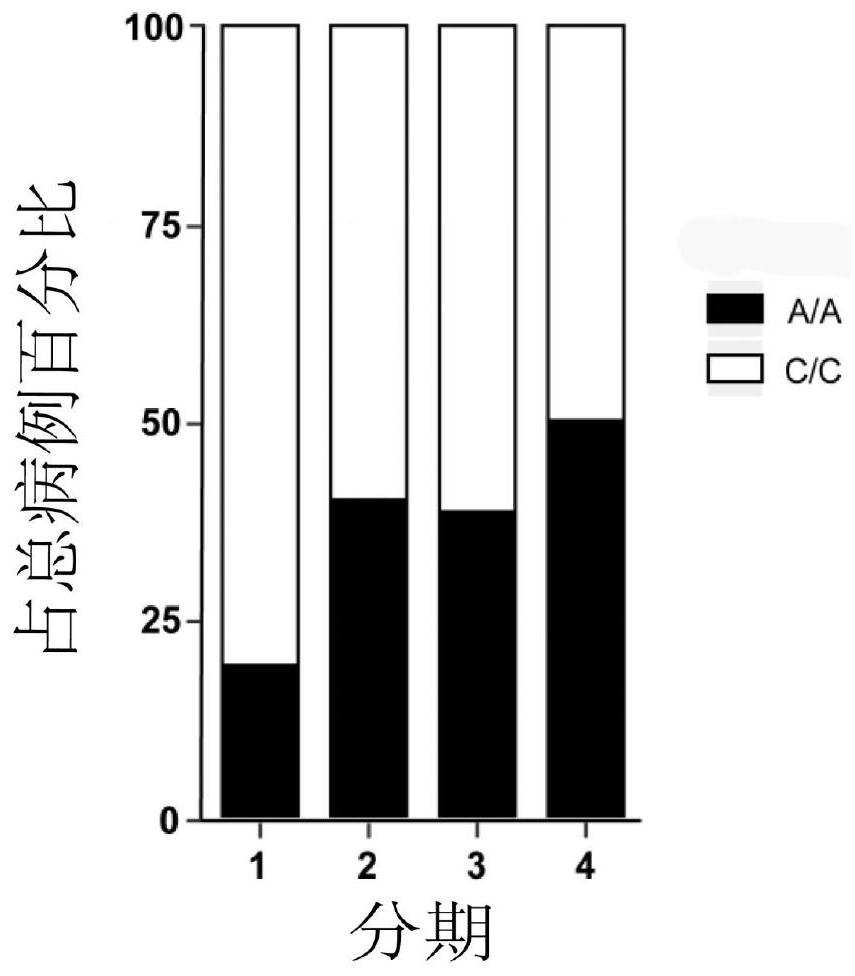
图1为本发明中不同基因型在各期病人中占比图;
图2为本发明中不同基因型与病人预后相关性图;
图3为本发明中CRISPR/Cas9基因编辑技术在两个细胞系中的应用图;
图4为本发明中等位基因特异性环状染色体构象捕获实验(4C)流程图;
图5为本发明中4C、免疫共沉淀数据分析图;
图6为本发明中染色体构象捕获(3C)结果分析图;
图7为本发明中不同细胞系VAV3表达检测图;
图8为本发明中在人原发性卵巢癌组织中,rs1192691和VAV3表达存在线性相关图;
图9为本发明中关于Rho抑制剂盐酸法舒地尔药物的动物实验流程图;
图10为本发明中关于Rho抑制剂盐酸法舒地尔药物的动物皮下肿瘤图;
图11为本发明中Rho抑制剂盐酸法舒地尔药物干预后皮下肿瘤的体积测量曲线图。
具体实施方式
下面结合实施例,对本发明进一步说明,下属实施例是叙述性的,不是限定性的,不能以下述实施例来限定本发明的保护范围。
本发明中所使用的原料,如无特殊说明,均为常规市售产品,本发明中所使用的方法,如无特殊说明,均为本领域常规方法,本发明所用各物质质量均为常规使用质量。
一种Rho抑制剂盐酸法舒地尔在作为或制备卵巢癌的药物方面中的应用。
较优地,所述卵巢癌为A/A基因型卵巢癌。
较优地,在治疗A/A基因型的相对恶性的卵巢癌病人时,将化疗药物与其参与的通路的Rho抑制剂盐酸法舒地尔联合用药治疗。
较优地,检测SNP位点预判是A/A基因型后,针对Rho通路用药。
较优地,AA高表达VAV3,SNP通过调控VAV3进而调控卵巢癌,通过抑制VAV3参与的Rho通路防治卵巢癌。
具体地,相关制备及检测如下:
SNP-rs1192691(A/C)是紧邻中心体周围的异染色质的非编码区变异位点,与卵巢癌患者预后不良相关。通过等位基因特异性环状染色体构象捕获测序分析和免疫共沉淀数据分析证明该位点A等位基因促进VAV3表达,而C等位基因通过跨染色体相互作用抑制VAV3表达。因此,本发明展示了一个SNP通过靶基因VAV3的染色体间调控调控卵巢癌恶性肿瘤的新模型,支持这一模型的是,无论在RNA水平还是蛋白水平上,VAV3在SKOV3(A/A)细胞中的表达均高于SKOV3(C/C)细胞。rs1192691等位基因是一个独立的卵巢癌不良预后指标,本发明可以通过Rho抑制剂法舒地尔的联合治疗来提高A/A基因型卵巢癌患者的治疗效果。
类似的,也可以通过其他的Rho抑制剂(不只是盐酸法舒地尔)的联合治疗来达到提高A/A基因型卵巢癌患者治疗效果的目的。
通过对100例卵巢癌患者rs1192691位点进行基因型检测并与预后进行关联分析,发现A/A基因型在晚期病人中相对早期病人占比更高(见图1),且A/A基因型病人预后更差(见图2)。本实验利用CRISPR/Cas9基因编辑技术成功获得了OVCA432(A/A),OVCA432(C/C),SKOV3(A/A),SKOV3(C/C)卵巢癌细胞系(见图3)。
首先,在细胞系OVCA432(A/C)中针对rs1192691位点进行了等位基因特异性环状染色体构象捕获测序分析(见图4)。其次,在SKOV3(A/A)和SKOV3(C/C)细胞中进行芯片测序,结合两次数据分析,发现了一个位于1号染色体上跨越14kb的特定区域,在4C筛选中,该区域在SKOV3(C/C)细胞中与SNP位点rs1192691相互作用,而在SKOV3(A/A)细胞中没有发现。与C等位基因特异性DNA相互作用相比,该区域的H3K27ac富集峰仅在SKOV3(A/A)细胞中检测到,而在SKOV3(C/C)细胞中未检测到。该增强子位于VAV3基因的第二个内含子中,位于VAV3 TSS下游17kb处。A等位基因在增强子上特异性富集H3K27ac,同时A等位基因在VAV3启动子上特异性富集H3K4me3(见图5)。为了更直接地确定VAV3是否是靶基因,使用染色体构象捕获(3C)来检测增强子和VAV3启动子的物理邻近。在SKOV3(A/A)细胞中发现VAV3启动子和增强子之间有很强的关联,而在SKOV3(C/C)细胞中则没有(见图6)。这些数据支持了一个模型,该位点A等位基因促进VAV3表达而C等位基因通过跨染色体相互作用抑制VAV3表达。支持这一模型的是,在RNA水平和蛋白水平,VAV3在A基因型细胞中的表达均高于C基因型细胞(见图7)。此外,在人原发性卵巢癌组织中,rs1192691和VAV3表达存在相关性(P=0.0373,线性回归模型),说明A等位基因与VAV3表达增加相关(见图8)。
Vav3蛋白作为小GTPases Rac1和RhoA的GEF。一旦成为GTP结合形式,Rac1和RhoA调节细胞迁移、质膜突起和细胞骨架重组。VAV3在肿瘤的发生和转移中起重要作用,RhoA和Rac1是VAV3诱导的细胞转化和细胞形态所必需因素。针对VAV3参与的Rho通路机制进行动物实验。本申请人采用异种移植模型,将SKOV3(A/A)和SKOV3(C/C)细胞分别皮下接种到BALB/C裸鼠。每种细胞分两组小鼠,皮下肿瘤接后给对照组小鼠腹腔注射生理盐水,给实验组小鼠腹腔注射Rho抑制剂盐酸法舒地尔(天津红日制药,30mg/kg/day),每隔一天测量一次种植瘤大小,直到接种肿瘤后35天处死小鼠,取出肿瘤(见图9,10)。SKOV3(A/A)组小鼠在Rho抑制剂盐酸法舒地尔干预后,肿瘤体积和质量明显小于对照组,SKOV3(C/C)组小鼠对照组和实验组没有明显差异(见图11)。该体内药物实验进一步验证了该SNP位点通过调控VAV3表达进而对卵巢癌恶性程度进行调控,且通过干扰Rho通路而抑制肿瘤的增殖。
尽管为说明目的公开了本发明的实施例,但是本领域的技术人员可以理解:在不脱离本发明及所附权利要求的精神和范围内,各种替换、变化和修改都是可能的,因此,本发明的范围不局限于实施例所公开的内容。
- Rho抑制剂盐酸法舒地尔的新用途
- 盐酸法舒地尔溶液的新用途
