黄药子肝毒性成分及其确定方法
文献发布时间:2023-06-19 12:11:54
技术领域
本发明属于生物医药技术领域,涉及黄药子肝毒性成分,具体涉及黄药子肝毒性成分的敲出对照试验方法。
背景技术
黄药子为薯蓣科薯蓣属多年生草本植物黄独块茎,又名黄独、黄药根、黄药、黄药脂、山慈姑、金线吊虾蟆、铁秤砣等。主产于湖南、湖北、江苏等地,山东、河南、安徽、浙江、福建等地亦有种植。黄药子性凉、味苦,具有凉血、降火、清瘿、解毒的功效,其药理作用及临床应用古书早有记载,药用价值较高且应用广泛。现代临床多将黄药子用于甲状腺肿、吐血衄血、食道癌、胃癌、淋巴结核、乳腺肿瘤等疾病的治疗,但发现黄药子具有肝毒性,其毒性严重制约了临床作用的发挥。因此,黄药子具有肝毒性成分的确定,是探究黄药子肝毒性机理的关键。
黄药子中含有茋类、黄酮类、甾体、二萜内酯类以及其他等多种化合物,但是目前针对黄药子中具体某一种化学成分的药理作用及其相关机制的研究尚集中在少数化合物中,如山药皂苷元、黄独素等,其余化合物的药理作用及其机制还有待进一步探究(朱大成等,江西中医药大学学报,2020,32(02),117-121)。现代研究表明,二萜内酯类化合物是黄药子的主要有效及毒性成分,已发现的二萜内酯类成分主要有黄独素A-M、8-表黄独素乙酸酯(EEA)等,其中以黄独素B和8-表黄毒素乙酸酯为主(李俊等,中华中医药学刊,2020,38(12),100-103)。以黄独素B为代表的二萜内酯类成分,既是黄药子的活性成分,又是其毒性成分(李军等,中国老年学杂志,2019,39(15),3846-3848)。
关于黄药子肝毒性的毒理学研究,主要从代谢激活、氧化应激、线粒体损伤和细胞凋亡等方面探讨黄药子的肝毒性机制。基于L-02细胞进行6种黄毒素(Diosbulbins)平行的体外毒性筛选,得出包括黄毒素B在内的多种黄毒素是黄药子肝脏毒性的物质基础(苏钰文等,2012年中国药学大会暨第十二届中国药师周论文集)。梁玉琼等的研究得出,黄药子总皂苷(TSRD)连续给药对小鼠肝脏具有一定的毒性,其机制可能与氧化应激损伤,诱导肝组织Nrf2及CYP2E1表达有关(中华中医药学刊,2020年10期)。
随着近年来关于黄药子毒性成分和毒理学机制的研究不断深入,对黄药子肝毒理机制的认识也变得更加客观和清晰。但是,黄药子肝脏毒性的物质基础仍没有明确具体的组分,以及各组分对肝毒理机制的影响程度仍需要进一步探究。
发明内容
由上述可知,以黄独素B为代表的二萜内酯类化合物是黄药子的主要有效及毒性成分,现有研究普遍认为包括黄独素B在内的多种组分是黄药子肝脏毒性的物质基础。通过检索现有文献,本领域普通技术人员易于知晓,黄药子肝脏毒性的物质基础,或者引发黄药子肝脏毒性的具体成分,目前尚未确定;并且,本领域普通技术人员,包括本领域的研究人员,普遍认知包括黄毒素B在内的多种黄毒素是黄药子肝脏毒性的物质基础。
本发明的目的在于确定黄药子肝毒性成分具体是什么物质,或者说,确切给出黄药子中的哪种组分才能是黄药子肝脏毒性的物质基础,以消除本领域普通技术人员,包括本领域的研究人员对黄药子肝脏毒性物质基础的偏见或误解。
为了实现上述发明意图,本发明通过敲除黄药子全成分提取物中的黄毒素B(DSB),比较敲除黄毒素B前后黄药子提取物的肝毒性,经动物试验获知,黄药子肝毒性成分是黄毒素B,并且只(仅)是黄毒素B,敲除黄毒素B的黄药子提取物并不表现出明显的肝脏毒性。
本发明给出了所述黄药子肝毒性成分的确定方法,具体地,从黄药子全组分提取物中敲除黄毒素B,分别表征黄毒素B、不含黄毒素B的黄药子提取物的肝毒性,确定黄药子肝毒性成分是黄毒素B,并且只是黄毒素B。
基于本发明的研究成果,请求保护一种药物。这种药物具有致肝毒性,其组分含有黄毒素B。另外,本发明请求保护这种药物在致肝毒性方面的用途。
基于本发明的研究成果,请求保护一种药物。这种药物的组分含有敲除黄毒素B的黄药子提取物。本发明获知,敲除黄毒素B的黄药子提取物不具有致肝毒性,或者表现出较低的,临床应用上可以接受的致肝毒性。另外,本发明请求保护这种药物在疾病治疗方面的用途。这种用途与黄药子在临床应用上的用途一致,或者与黄药子在临床应用上的用途有所区别。
本领域普通技术人员,包括本领域的研究人员,制备本发明所述药物,除含有黄毒素B或含有敲除黄毒素B的黄药子提取物外,还包括医药领域可接受的辅料、载体或助剂。对此,本发明不做进一步的详实阐述。
与现有技术相比,本发明所述黄药子肝毒性成分及其确定方法的有益效果或优点:本发明的主要贡献在于确定黄药子肝毒性成分是黄毒素B,并且仅是黄毒素B,敲除黄毒素B的黄药子提取物并不表现出明显的肝脏毒性;再者,本发明消除了本领域普通技术人员,包括本领域的研究人员对黄药子肝脏毒性物质基础的偏见或误解。
附图说明
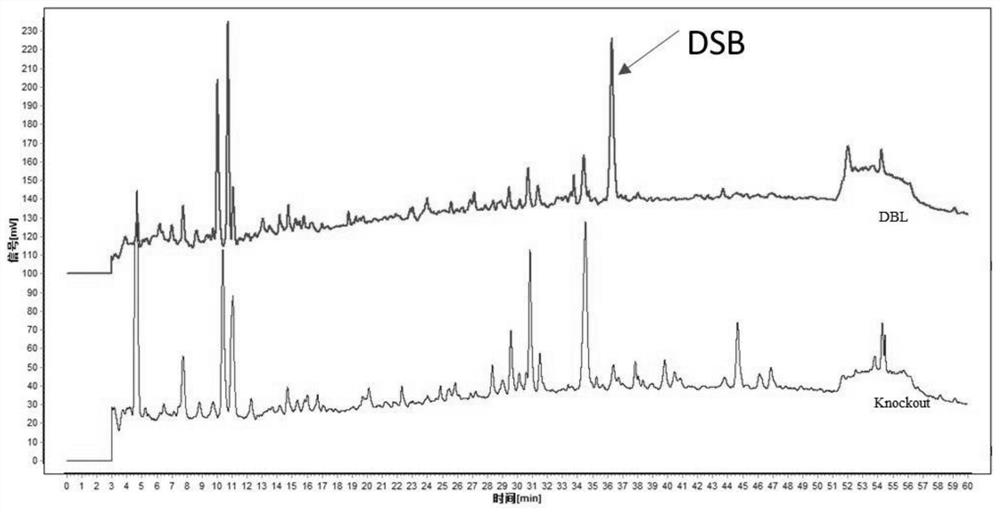
图1是黄药子提取液(DBL)和敲除黄毒素B的黄药子提取液(敲除液,Knockout)在210nm下的色谱图。
图2是黄毒素B在210nm下的色谱图。
图3是黄药子提取液和敲除液中黄独素B的含量测定色谱图。
图4是对照组(Vehicle)、敲除DSB组(Knockout)、DBL组、DSB组雄性昆明小鼠灌胃36h后的丙氨酸转氨酶(ALT)活性对比图。
图5是对照组(Vehicle)、敲除DSB组(Knockout)、DBL组、DSB组雄性昆明小鼠灌胃36h后的天冬氨酸转氨酶(AST)活性对比图。
图6是黄药子提取液在微粒体孵育体系中产生的NAC-DSB-NAL结合物的MS/MS谱图。
图7是敲除液在微粒体孵育体系中产生的NAC-DSB-NAL结合物在LC/Q-TrapMS获得的提取离子(m/z676→553)谱图。
图8是黄药子提取液在微粒体孵育体系中产生的NAC-DSB-NAL结合物在LC/Q-TrapMS获得的提取离子(m/z676→553)谱图。
图9是DSB在微粒体孵育体系中产生的NAC-DSB-NAL结合物的在LC/Q-TrapMS获得的提取离子(m/z676→553)谱图。
图10是用黄药子提取液灌胃雄性昆明小鼠36h后产生的DSB肝蛋白结合物水解物的MS/MS谱图。
图11是用敲除DSB的黄药子提取液灌胃雄性昆明小鼠36h后产生的肝蛋白水解物在LC/Q-TrapMS获得的提取离子(m/z592→503)色谱图。
图12是用黄药子提取液灌胃雄性昆明小鼠36h后产生的肝蛋白水解物在LC/Q-TrapMS获得的提取离子(m/z592→503)色谱图。
图13是用DSB单体灌胃雄性昆明小鼠36h后产生的肝蛋白水解物在LC/Q-TrapMS获得的提取离子(m/z592→503)色谱图。
图14是敲除DSB前后DSB蛋白加合物含量的比较图。
图15是敲除DSB前后DSB蛋白加合物的抗体免疫荧光图像。
具体实施方式
下面,结合实施例对本发明的技术方案进行说明,但是,本发明并不限于下述的实施例。
一、黄药子有效成分的提取和黄毒素B的分离纯化
取黄药子饮片9.5kg,加10倍体积的蒸馏水浸泡1h后,煎煮1h;过滤煎煮液,滤渣加8倍蒸馏水重复煎煮、过滤2次,每次1h。合并3次提取液,浓缩至10L,加入95%乙醇调整提取液中乙醇比例至75%,边加便搅拌,之后静置24h。抽滤沉淀液后使用3倍体积的75%乙醇洗涤滤饼,合并滤液。回收乙醇后置于80℃水浴,浓缩溶液至1.2L。
取0.6L浓缩液(另0.6L置于冰箱保存),使用氯仿反复萃取,回收氯仿得19.85g浸膏,采用硅胶层析柱进行分离,使用不同比例的石油醚-丙酮冲洗,收集含黄独素B部位,回收溶剂后,使用乙腈进行反复重结晶,得到6.048g纯度较高的黄独素B,经氢核磁鉴定为黄独素B。
按比例合并敲除黄独素B的各部位溶液,回收溶剂得干浸膏,确保敲除黄独素B的干浸膏中不含有黄独素B,使用前用温水溶解稀释至0.6L得到储备液。
二、黄药子提取液和敲除液的制备和分析
取适量黄药子提取液和敲除液使用60%乙腈稀释60倍后,使用N-乙酰半胱氨酸(NAC)和N-乙酰赖氨酸(NAL)对微粒体代谢中间体进行捕获。
将提取液在小鼠肝微粒体中孵育,孵育液中加入NAC和NAL作为捕获剂。孵育得到的产物通过ABSCIEX5500Q-Trap质谱的MRM离子对扫描分析m/z676→553,在小鼠肝微粒体中都检测到NAC/NAL衍生的吡咯结合物(图6),其在质谱中的保留时间为4.83min(图9)。通过MRM-EPI对结合物扫描得到了二级质谱图,在二级图谱中有结合物的特征性碎片m/z503、m/z517、m/z547(图6)。肝微粒体孵育得到的产物也通过LC/Q-TOFMS进行了分析,从高分辨质谱上得到的结合物的[M+H]+为676.2480。这些结果(图6-图9)证实黄药子中黄独素B能够被小鼠肝微粒体代谢活化成为较为活泼的亲电中间体,进而能够被亲核性成分捕获,从而被检测分析。
使用HPLC测定和比较黄药子提取液(DBL)和敲除黄毒素B的黄药子提取液(敲除液,Knockout)在210nm下的色谱。使用HPLC测定黄毒素B在210nm下的色谱。采用上述方法分离纯化黄毒素B,经HPLC纯度检测,纯度较高,氢核磁数据分析鉴定为黄独素B。经指纹图谱(图1和图2)分析,敲除液和黄药子提取溶液相似度为75.9%,和共有峰生成的标准图谱相似度为97.2%。
取适量黄药子提取液和敲除液,使用60%乙腈稀释600,000倍后,使用山奈素作为内标,黄独素B为对照,60%乙腈为空白对照,通过使用LC/Q-TrapMS对提取离子(m/z367.1→339.2)测定提取液和敲除液中黄独素B的含量。结果(图3),提取液(DBL)中黄独素B含量为3.717mg/g药材(图3C),敲除液(Knockout)中黄独素B含量为0.0632mg/g药材(图3D)。从含量测定结果可知说明黄毒素B敲除率为98.3%,说明敲除效果良好,黄毒素B被成功敲除。
三、动物实验
雄性昆明小鼠(18-20g)购自长沙天勤生物技术有限公司(中国,长沙)。所有动物研究均按照贵州医科大学动物实验伦理审查委员会批准的程序进行,并按照《实验动物护理和使用指南》(美国国家卫生研究院)进行。动物被放在一个温度控制在26℃的房间里,可以自由地获得水和食物。将小鼠随机分为对照组(0.5%CMC-Na)、敲除DSB组、DBL组、DSB组,共4组。实验分两部分进行。
第一部分每组4只小鼠。取适量的黄药子提取液、敲除液,使用0.5%羧甲基纤维素钠(0.5%CMC-Na)溶液稀释成4g/ml的灌胃液。敲除组和DBL组每只小鼠灌胃剂量为2.69g/kg,DSB组给药剂量为10mg/kg。灌胃4h后,处死,取肝脏进行免疫组化分析。
第二部分每组8只小鼠。敲除组和DBL组每只灌胃剂量为40.36g/kg,DSB组给药剂量为150mg/kg。灌胃36h后,麻醉,采集血液和肝脏。从每个新鲜血样中制备血清,用于在VITROS5600全自动生化免疫分析仪(Otrho-ClinicalDiagnostics,美国)上测定丙氨酸转氨酶(ALT)和天冬氨酸转氨酶(AST)。部分肝脏用于病例分析(H&E),其他肝脏用于分析DSB蛋白加合物含量。
与空白组相比,敲除组小鼠血清没有明显的ALT、AST增加,然而DBL和DSB组小鼠血清检测到了显著的谷丙转氨酶(ALT)和谷草转氨酶(AST)增加,其中DBL组为敲除组的28倍(图4、图5)。
使用DTT,α-糜蛋白酶和链霉蛋白酶E先后对灌胃提取液36小时后的小鼠肝组织进行水解处理,离心后使用ABSCIEX5500Q-Trap质谱的MRM离子对扫描分析m/z632→503,在小鼠肝组织水解物中都检测到Cys-DSB-Lys衍生的加合物,其在质谱中的保留时间为5.56min左右(图11、图12、图13)。通过MRM-EPI对结合物扫描得到了二级质谱图,在二级图谱中有结合物的特征性碎片m/z277、m/z346、m/z374、m/z475、m/z503、m/z529(图10)。蛋白结合产物也通过LC/Q-TOFMS进行了分析,从高分辨质谱上得到的结合物的[M+H]+为632.1897。这些结果证实黄药子中黄独素B的代谢产物与小鼠肝蛋白发生了加合。并且灌胃敲除液和提取液小鼠黄独B-肝蛋白加合物水平差异明显,提取液是敲除液的47倍(图14)。此外,通过组织免疫荧光实验也发现,随着给药剂量中DSB含量的递增,小鼠肝组织切片中的DSB-肝脏蛋白多克隆抗体结合区域荧光逐渐增强(图15),这进一步说明黄独素B-肝蛋白共价的存在,并且与DSB代谢活化成正相关。
如上所述,即可较好地实现本发明,上述的实施例仅仅是对本发明的优选实施方式进行描述,并非对本发明的范围进行限定,在不脱离本发明设计精神的前提下,本领域普通技术人员对本发明的技术方案做出的各种改变和改进,均应落入本发明确定的保护范围内。
- 黄药子肝毒性成分及其确定方法
- 香原料特征成分质谱数据库的建立方法、装置及香料成分确定方法、系统
