嗜黏蛋白阿克曼氏菌菌株及其用途
文献发布时间:2023-06-19 12:24:27
技术领域
本申请要求在韩国知识产权局于2018年10月11日提交的韩国专利申请第10-2018-0121137号和2019年10月10日提交的韩国专利申请第10-2019-0125670号的权益,所述申请中的每个均通过引用整体并入本文。
本发明涉及有效抑制食欲并预防、减轻、缓解和治疗代谢性疾病的嗜黏蛋白阿克曼氏菌(Akkermansia muciniphila)SNUG-61027菌株(保藏号KCTC 13530BP)及其用途。
背景技术
肥胖症是由于饮食习惯的改变(例如高热量饮食、缺乏运动等)而在人体中积累过多脂肪引起的疾病,与2型糖尿病、心血管疾病、肝病和各种癌症的发作有关,并因此具有重要的临床意义。另一方面,已知肠道微生物与诸如肥胖症和糖尿病的代谢性疾病密切相关,特别是,已发现用抗糖尿病药物二甲双胍治疗的小鼠肠道中的嗜黏蛋白阿克曼氏菌菌株增加,并且当向高脂饮食小鼠施用该菌株时,葡萄糖内稳态得到改善,由此该菌株作为潜在的抗肥胖症药物引起了人们的注意,并为抗肥胖症药剂的研究提供了新的范例。
为了了解已在接近人类细胞总数10倍的肠道微生物中验证了抗肥胖症功效的嗜黏蛋白阿克曼氏菌菌株的抗肥胖作用机理,已进行了各种研究,然而,传统研究集中在抗肥胖症指标上,例如减轻体重、改善慢性代谢性炎症、恢复受损的屏障或改善血脂指标。
然而,抗肥胖症作用除了上述指标外还具有多种机理,特别是最近报道了诱导褐脂与肠道微生物相互作用,该肠道微生物与维持体温内稳态的机制有关。脂肪组织分为以甘油三酯形式存储能量的白色脂肪组织和将能量以热量释放的褐色脂肪组织,褐色脂肪组织通过组织特异性UCP-1因子诱导能量消耗,从而起到调节葡萄糖内稳态和增加胰岛素敏感性的作用。
同时,食欲调节激素胰高血糖素样肽(GLP-1)是通过食物摄入而由回肠分泌的激素,该激素增加饱腹感,调节食欲并诱导胰腺分泌胰岛素,从而调节血糖水平。
GLP-1由作为一种回肠和结肠中存在的肠道内分泌细胞的L细胞分泌。
已知GLP-1与对糖尿病的治疗作用、对肥胖症的治疗作用、对心脏病的治疗作用、对脑血管疾病的治疗作用以及对神经细胞炎症的治疗作用(Salcedo I等人,对胰高血糖素样肽1(GLP-1)的神经保护和神经营养作用:治疗神经退行性疾病和脑血管疾病的新兴机会(Neuroprotective and neurotrophic actions on glucagon-like peptide-1(GLP-1):an emerging opportunity to treat neurodegenerative and cerebrovasculardisorders.英国药理学杂志(British Journal of Pharmacology)(2012)166,1586-1599)英国药理学杂志(2012)166,1586-1599)、对动脉粥样硬化的治疗作用(Burgmaier M等人,胰高血糖素样肽1(GLP-1)及其裂解产物GLP-1(9-37)和GLP-1(28-37)稳定了apoe-/-小鼠的动脉粥样硬化病变(Glucagon-like peptide-1(GLP-1)and its split products GLP-1(9-37)and GLP-1(28-37)stabilize atherosclerotic lesions in apoe-/-mice).动脉粥样硬化(Atherosclerosis)(2013)231,427-435)有关。
此外,GLP-1涉及通过刺激由胰腺进行葡萄糖依赖性胰岛素分泌、增强胰岛素基因表达、促进胰腺β细胞增殖的作用、促进胰腺β细胞存活的作用、抑制胰高血糖素的作用、降低血糖水平等来显示对糖尿病的治疗作用,并且涉及通过降低胃排空率、抑制食欲、增强饱腹感和抑制食物摄入来显示对肥胖症的治疗作用。此外,GLP-1显示了对心脏病具有治疗作用,该治疗作用通过保护心肌细胞免受局部缺血的作用和增强具有心脏病发作风险的患者的心脏功能的作用而产生(Sokos,G.G.等人,胰高血糖素样肽1输注改善慢性心力衰竭患者的左心室射血分数和功能状态(Glucagon-like peptide-1 infusion improves leftventricular ejection fraction and functional status in patients with chronicheart failure).J.Card.Fail.(2006)12:694-699.,Ban,K.等人,胰高血糖素样肽-1受体依赖性和非依赖性途径均介导胰高血糖素样肽-1受体的心脏保护和血管舒张作用(Cardioprotective and vasodilatory actions of glucagon-like peptide-1receptor are mediated through both glucagon-like peptide-1 receptor-dependentand-independent pathways).Circulation(2008)117:2340-2350)。
已知GLP-1的分泌通过作为一种G蛋白偶联受体(GPCR)的TGR5和GPR119的激活(Reimann,F.等人,L细胞中的葡萄糖感测:原代细胞研究(Glucose sensing in L cells:aprimary cell study).Cell Metab.(2008)8:532-539;Lauffer,L.M.等人,GPR119对于油酰乙醇胺诱导的肠内分泌L细胞分泌胰高血糖素样肽-1至关重要(GPR119 is essentialfor oleoylethanolamide-induced glucagon-like peptide-1secretion from theintestinal enteroendocrine L-cell).Diabetes(2009)58:1058-1066),或α-味导素的激活(Jang,H.J.等人,2007.肠表达的味导素和味觉受体调节胰高血糖素样肽1的分泌(Gutexpressed gustducin and taste receptors regulate secretion of glucagon-likepeptide-1).Proceeding of the National Academy of Science 104,1506915074.)来促进。特别地,已知在褐色脂肪组织和肌肉中表达的G蛋白偶联受体(GPCR)TGR5(GPR131)的激活增加了能量消耗,因此显示出对肥胖症的治疗作用,这与肝病的改善有关(Lieu T等人,GPBA:胆汁酸的G蛋白偶联受体,是消化和感觉障碍的新兴治疗靶标(GPBA:A G protein-coupled receptor for bile acids and an emerging therapeutic target fordisorders of digestion and sensation).British Journal of Pharmacology(2013),印刷中)。并且据报道抑制动脉硬化(Pols TWH等人,TGR5激活通过减少巨噬细胞炎症抑制动脉粥样硬化(TGR5 activation inhibits atherosclerosis by reducing macrophageinflammation).Cell Metabolism(2011)14,747)。
此外,肥胖患者中过度积累的甘油三酯不仅存储在脂肪组织中,而且存储在肝脏或肌肉中,以诱导胰岛素抵抗。因此,消耗过多储存的甘油三酯可以预防和治疗由此引起的根本性肥胖症和代谢性疾病。脂肪细胞大致分为白色脂肪细胞、褐色脂肪细胞和米黄色脂肪细胞。白色脂肪细胞存储在甘油三酯的大脂肪球中,主要存在于腹部,并且已知对健康起负面作用。据报道,与白色脂肪细胞相比,褐色脂肪细胞包含更多的线粒体和小尺寸的脂肪球,并且褐色脂肪细胞可以通过产热和适当锻炼维持体温来诱导。对于由高脂饮食引起的肥胖,被诱导含有大量褐色脂肪细胞的小鼠通过诱导体重减轻和热量消耗增加而对肥胖和代谢性疾病有效。此外,褐色脂肪细胞表达大量的UCP-1(解偶联蛋白-1)蛋白,已知该蛋白通过在脂肪细胞中消耗热量而不存储热量而在产热中起决定性作用。除了褐色脂肪细胞,米黄色脂肪细胞也被认为是重要的脂肪细胞。米黄色脂肪细胞由对健康有害的白色脂肪细胞受诸如运动或寒冷的刺激而被诱导,白色脂肪细胞的性状减少,但变得具有褐色脂肪细胞的特征,导致UCP-1表达增加。与小鼠中发现的褐色脂肪细胞相似,已知这些米黄色脂肪细胞也对肥胖症和代谢性疾病有益。
[现有技术文献]
1.韩国专利第10-1809172号
2.韩国专利公开第10-2015-0133646号
发明内容
技术问题
在这些情况下,为了有效地预防和治疗代谢性疾病,本发明人通过使用目前用于抗肥胖症研究的嗜黏蛋白阿克曼氏菌(Akkermansia muciniphila)菌株的标准菌株(Akk;美国典型培养物保藏中心,保藏号ATCC BAA-835)和分离自健康韩国人粪便的嗜黏蛋白阿克曼氏菌SNUG-61027菌株的分离株(保藏号KCTC13530),发现了嗜黏蛋白阿克曼氏菌增强UCP-1因子影响褐色脂肪活性并诱导小肠中食欲调节激素GLP-1的表达。
另外,本发明人发现了,该途径依赖于宿主的IL-6细胞因子而被诱导,并且最终鉴定了在抗肥胖症机制中促进GLP-1分泌诱导的嗜黏蛋白阿克曼氏菌菌株、该菌株的培养液、细菌细胞、上清液、提取物或级分,或来源自该菌株的靶蛋白,从而完成了本发明。
技术方案
作为实现该目的的一个方面,本发明的实施方式提供了保藏号为KCTC 13530BP的嗜黏蛋白阿克曼氏菌(Akkermansia muciniphila,Akk)SNUG-61027菌株。关于菌株的具体信息如下。
保藏机构名称:韩国生命工学研究院
保藏号:KCTC 13530BP
保藏日期:2018年5月25日
本发明的菌株包含由SEQ ID NO:1的核苷酸序列组成的16S rDNA。
本发明的另一种实施方式提供了用于抑制食欲或预防、减轻或治疗代谢性疾病的药物组合物,其包含嗜黏蛋白阿克曼氏菌SNUG-61027(保藏号KCTC 13530BP)菌株或其培养液作为活性成分。
如本文所用,术语“培养液”是指包含菌株、其代谢物、额外营养素等的完整培养基溶液,所述完整培养基溶液是通过在能够提供营养素的培养基中将菌株培养一定时间,从而使嗜黏蛋白阿克曼氏菌SNUG-61027(保藏号KCTC 13530BP)菌株可以在体外生长和存活而获得的,但这是包括所有无细胞培养上清液及其提取物和级分的概念。从培养液中去除了细胞的液体也称为“上清液”,上清液可以通过以下方式获得:通过将培养液放置一定的时间,并且仅取上层中的液体,除去下层中的沉淀部分,通过过滤去除细菌细胞,或通过离心培养液以除去下部的沉淀物而仅取上部的液体。
“细菌细胞”是指本发明的菌株本身,并且包括从发酵食品中分离和选择的菌株本身,或者从通过培养分离株而获得的培养液中分离的菌株。通过离心培养液以取下层中沉淀的部分,或者通过将培养液放置一定的时间,然后因为细胞沉淀物由于重力而沉淀到培养液的下层而去除上部的液体,可以获得细菌细胞。
此外,本发明的嗜黏蛋白阿克曼氏菌SNUG-61027(保藏号KCTC 13530BP)的菌株培养液、细菌细胞或上清液的提取物可以是用乙酸乙酯(EtOAc)或乙醇(乙醇;EtOH)提取的提取物,但不限于此。此外,本发明的嗜黏蛋白阿克曼氏菌SNUG-61027菌株的培养液、细菌细胞或上清液的级分可以是通过用甲醇对乙酸乙酯提取物进行分级而得到的级分,但不限于此。根据本领域熟知的常规分级方法,可以获得本发明的嗜黏蛋白阿克曼氏菌(保藏号KCTC13530BP)菌株的培养液、上清液或提取物的级分,例如,它可以通过色谱法使用阴离子交换柱或尺寸柱等获得。
如本文所用,术语“代谢性疾病”是指由慢性代谢性障碍引起的在单个个体中出现的诸如葡萄糖耐量受损、糖尿病、脂肪肝、高血压、血脂异常、肥胖症、心血管动脉粥样硬化等各种疾病中的一种或两种或多种障碍。例如,代谢性疾病可以是选自葡萄糖耐量受损、糖尿病、动脉硬化、高脂血症、高胆固醇血症、脂肪肝、心血管疾病和肥胖症中的任一种。
根据本发明,诱导IL-6水平增加、GLP-1表达增加和褐色脂肪活性增加可以对代谢性疾病表现出有益的作用,并且进一步预防、减轻或治疗代谢性疾病。
本发明的另一种实施方式提供了用于抑制食欲或预防、减轻或治疗代谢性疾病的药物组合物,其包含由SEQ ID NO:2的氨基酸序列组成的B2UM07蛋白作为活性成分。
当使用LC/MS-MS在本发明的功效级分中进行蛋白质鉴定时,通过常见菌株的NCBI数据库匹配来鉴定B2UM07蛋白质,其信息如下。
基因:Amuc_1631
UniProtKB-B2UM07
蛋白质名称-羧基末端蛋白酶
生物体:嗜黏蛋白阿克曼氏菌
B2UM07蛋白可以来源于嗜黏蛋白阿克曼氏菌菌株,并且特别地,嗜黏蛋白阿克曼氏菌菌株可以是SNUG-61027菌株(保藏号KCTC 13530BP)。
除了由SEQ ID NO:2的氨基酸序列组成的蛋白质之外,该序列的变体也被认为包括在本发明的范围内。变体是由氨基酸序列组成的蛋白质,该氨基酸序列具有类似于SEQID NO:2的氨基酸序列的功能性特征并由核苷酸序列编码,尽管该核苷酸序列或氨基酸序列是变化的。具体地,本发明的蛋白质可包含与SEQ ID NO:2的氨基酸序列具有至少70%、更优选至少80%、甚至更优选至少90%、最优选至少95%序列同源性的氨基酸序列。
此外,本发明提供了编码B2UM07蛋白的基因。本发明的基因包含各自编码B2UM07蛋白的基因组DNA和cDNA。优选地,该基因可以包含编码SEQ ID NO:2的蛋白质的核苷酸序列。
此外,核苷酸序列的变体被包括在本发明的范围内。具体地,变体基因可包含与编码SEQ ID NO:2的蛋白质的核苷酸序列具有至少60%、更优选至少70%、甚至更优选至少80%、最优选至少90%的序列同源性的核苷酸序列。
本发明的另一方面提供了重组载体,其包含编码本发明的B2UM07蛋白的基因。如本文所用,术语“重组”是指其中细胞复制异源核酸,表达核酸或表达由异源核酸编码的肽、异源肽或蛋白质的细胞。重组细胞可以以有义或反义形式表达在天然形式的细胞中不能发现的基因或基因片段。此外,重组细胞可以表达天然状态的细胞中发现的基因,但是该基因被修饰并通过人工方式重新引入细胞中。
“载体”用于指递送至细胞内部的DNA片段或核酸分子。该载体可以复制DNA,并且可以在宿主细胞中独立复制。此外,本发明提供了用重组载体转化的转化体。作为将载体转化到大肠杆菌中的方法,可以使用本领域通常已知的方法,例如利用CaCl
本发明的药物组合物可以通过各种途径施用于包括人在内的哺乳动物。如本文所用,术语“施用”是指使用任何合适的方法将预定物质引入个体,并且施用方式可以是本领域常用的任何方式,例如,该物质可以通过口服、皮肤、静脉内、肌内、皮下途径等施用,优选地,可以通过口服途径施用。本发明的药物组合物可以按照常规方法配制成口服制剂(例如散剂、颗粒剂、片剂、胶囊剂、混悬剂、乳剂、糖浆剂)或非口服制剂(例如软膏剂、气雾剂、透皮药物、栓剂和无菌可注射溶液)后使用。本发明的药物组合物可以进一步包含药学上合适的和生理上可接受的佐剂,例如载体(carrier)、赋形剂和稀释剂等。
可以包含在本发明的药物组合物中的载体、赋形剂和稀释剂可以是乳糖、右旋糖、蔗糖、山梨糖醇、甘露糖醇、木糖醇、赤藓糖醇、麦芽糖醇、淀粉、阿拉伯胶、藻酸盐、明胶、磷酸钙、硅酸钙、纤维素、甲基纤维素、微晶纤维素、聚乙烯吡咯烷酮、水、羟基苯甲酸甲酯、羟基苯甲酸丙酯、滑石、硬脂酸镁和矿物油。当配制成制剂时,可以使用稀释剂或赋形剂,例如常用的填充剂、增重剂、粘合剂、润湿剂、崩解剂、表面活性剂。
在将本发明的药物组合物施用于人的具体的实施方式中,本发明的药物组合物可以单独施用,但是考虑到施用方式和标准药学实践,通常可以通过与选定的药物载体混合来施用。例如,可以以包含淀粉或乳糖的片剂形式、以仅包含本发明的活性成分或包含除活性成分以外的赋形剂的胶囊剂形式、或以包含用于调味或着色的化学药剂的酏剂或混悬剂的形式口服、颊内或舌下施用包含本发明的嗜黏蛋白阿克曼氏菌菌株的组合物。
本发明的药物组合物的剂量可以根据患者的年龄、体重、性别、剂型、健康状况和疾病的严重程度而变化,并且根据医生或药剂师的决定,可按固定的时间间隔以分开的剂量每天一次至多次给药。例如,基于活性成分的含量,日剂量可以为0.1至500mg/kg,优选0.5至300mg/kg。以上剂量作为平均情况而示例,并且其剂量可以根据个体差异而增加或减少。
本发明的另一种实施方式提供了用于抑制食欲或减轻或缓解代谢性疾病的保健功能食品,其包含嗜黏蛋白阿克曼氏菌菌株SNUG-61027(保藏号KCTC 13530BP)或其培养液、上清液、提取物或级分作为活性成分。
代谢性疾病可能是葡萄糖耐量受损、糖尿病、动脉硬化、高脂血症、高胆固醇血症、脂肪肝、心血管疾病或肥胖症。
根据本发明,可以诱导IL-6水平增加、GLP-1表达增加和褐色脂肪活性增加,从而对代谢性疾病表现出有益的作用,进一步地,可以缓解或治疗代谢性疾病。
另外,本发明提供了用于抑制食欲或减轻或缓解代谢性疾病的保健功能食品,其包含由SEQ ID NO:2的氨基酸序列组成的B2UM07蛋白作为活性成分。
代谢性疾病可能是葡萄糖耐量受损、糖尿病、动脉硬化、高脂血症、高胆固醇血症、脂肪肝、心血管疾病或肥胖症。
B2UM07蛋白可以来源于嗜黏蛋白阿克曼氏菌菌株,并且特别地,嗜黏蛋白阿克曼氏菌可以是SNUG-61027菌株(保藏号KCTC 13530BP),细节如上所述。
保健功能食品可以是各种饮料、发酵乳、食品添加剂等。
保健功能食品中所含的作为活性成分的嗜黏蛋白阿克曼氏菌菌株的含量没有特别限定,可以根据食品形式、期望用途等适当地改变,例如,其可以以食品总重量的0.01重量%至15重量%的量添加,并且基于100ml,可以以0.02至10g,优选0.3至1g的量添加保健饮料组合物。
在本发明的保健功能食品中的饮料中,对液体成分没有特别的限制,只是嗜黏蛋白阿克曼氏菌作为必需成分以指定的比例被包含,并且各种调味剂或天然碳水化合物可以作为普通饮料中的其他成分被包含。
上述天然碳水化合物的实例可以是常见的糖,例如单糖(例如葡萄糖、果糖等)、二糖(例如麦芽糖、蔗糖等)和多糖(例如糊精、环糊精等),以及糖醇(例如木糖醇、山梨糖醇、赤藓糖醇等)。作为除上述调味剂以外的调味剂,有利地,可以使用天然调味剂(奇异果甜蛋白、甜菊提取物(例如莱鲍迪苷A、甘草甜素等)和合成调味剂(糖精、阿斯巴甜等)。天然碳水化合物的比例通常为每100ml本发明的组合物约1至20g,优选约5至12g。
除上述之外,本发明的保健功能食品可包含各种营养素、维生素、矿物质(电解质)、调味剂(例如合成调味剂和天然调味剂)、着色剂和增强剂(奶酪、巧克力等)、果胶酸及其盐、藻酸及其盐、有机酸、保护性胶体增稠剂、pH控制剂、稳定剂、防腐剂、甘油、醇、用于碳酸饮料的碳酸化剂等。
此外,本发明的保健功能食品可包含用于制备天然果汁和果汁饮料以及蔬菜饮料的水果。这些组分可以单独使用或组合使用。尽管这些添加剂的比例不是很重要,但是通常每100重量份的本发明的健康功能食品,所述添加剂为0至约20重量份的范围。
本发明的另一种实施方式提供了嗜黏蛋白阿克曼氏菌SNUG-61027菌株(保藏号KCTC 13530BP)或其培养液、上清液、提取物或级分在抑制食欲或预防、治疗、减轻或缓解代谢性疾病中的用途。
用于本发明的用途的嗜黏蛋白阿克曼氏菌SNUG-61027菌株(保藏号KCTC13530BP)可包含由SEQ ID NO:1的核苷酸序列组成的16S rDNA。
本发明的用途所适用的代谢性疾病可以是葡萄糖耐量受损、糖尿病、动脉硬化、高脂血症、高胆固醇血症、脂肪肝、心血管疾病或肥胖症。
另外,本发明的另一种实施方式提供了由SEQ ID NO:2的氨基酸序列组成的B2UM07蛋白在抑制食欲或预防、治疗、减轻或缓解代谢性疾病中的用途。
用于本发明的用途的B2UM07蛋白可以来源于嗜黏蛋白阿克曼氏菌菌株。
用于本发明的用途的嗜黏蛋白阿克曼氏菌菌株可以是SNUG-61027菌株(保藏号KCTC 13530BP)。
本发明提供了抑制食欲或预防、治疗、减轻或缓解代谢性疾病的方法,该方法包括用嗜黏蛋白阿克曼氏菌SNUG-61027菌株(保藏号KCTC 13530BP)或其培养液、上清液、提取物或级分治疗的步骤。
在抑制食欲或预防、治疗、减轻或缓解代谢性疾病的方法中使用的嗜黏蛋白阿克曼氏菌SNUG-61027菌株(保藏号KCTC 13530BP)可包含由SEQ ID NO:1的核苷酸序列组成的16S rDNA。
本发明的方法所适用的代谢性疾病可以是葡萄糖耐量受损、糖尿病、动脉硬化、高脂血症、高胆固醇血症、脂肪肝、心血管疾病或肥胖症。
本发明提供了抑制食欲或预防、治疗、减轻或缓解代谢性疾病的方法,该方法包括用由SEQ ID NO:2的氨基酸序列组成的B2UM07蛋白治疗的步骤。
在本发明的方法中使用的B2UM07蛋白可以来源于嗜黏蛋白阿克曼氏菌菌株。
在本发明的方法中使用的嗜黏蛋白阿克曼氏菌菌株可以是SNUG-61027菌株(保藏号KCTC 13530BP)。
有益效果
除了嗜黏蛋白阿克曼氏菌的抗肥胖症作用中的体重减轻和葡萄糖内稳态调节外,本发明证实了激活褐色脂肪的作用和分泌食欲调节激素GLP-1的能力,而且还证实了这些功效取决于宿主IL-6中特定的细胞因子。另外,本发明已经鉴定了GLP-1诱导能力显著增强的新型嗜黏蛋白阿克曼氏菌SNUG-61027菌株(保藏号KCTC 13530BP),并且证实了从嗜黏蛋白阿克曼氏菌菌株的培养液中分离出的B2UM07(P9)蛋白显示出非常优异的GLP-1诱导能力、维持体内葡萄糖内稳态的能力以及减轻体重的作用。因此,该新型嗜黏蛋白阿克曼氏菌菌株和B2UM07蛋白可有效地用于抑制食欲或治疗或预防代谢性疾病。
附图说明
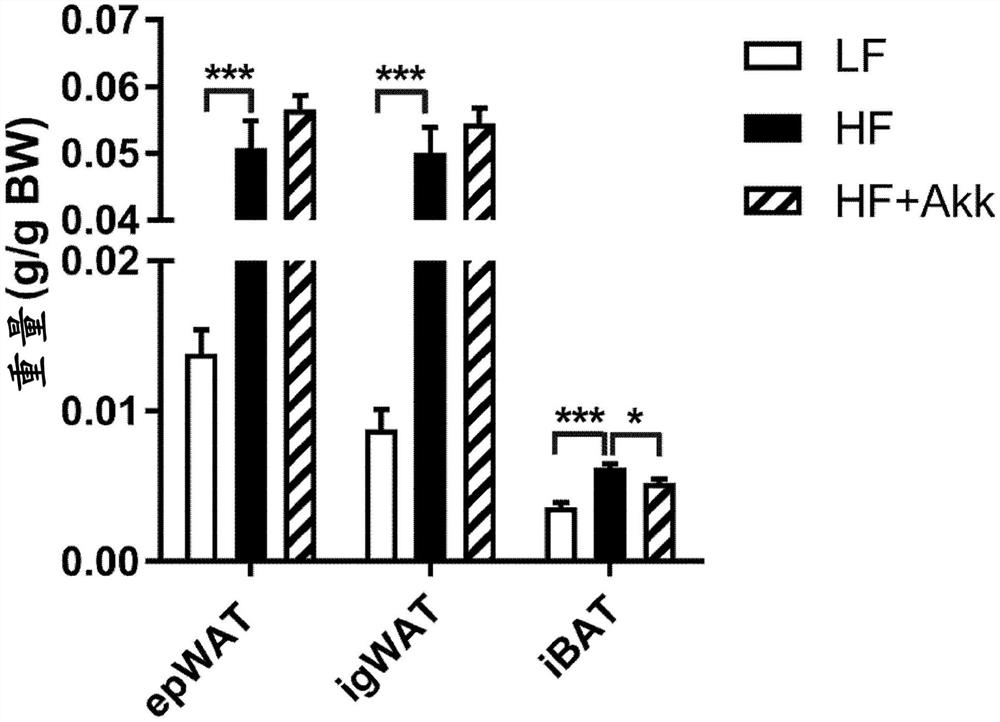
图1显示了在向高脂饮食小鼠模型中施用嗜黏蛋白阿克曼氏菌(Akk)菌株后对肝脏和褐色脂肪重量的改善作用的实验结果。
图2显示了qPCR实验的结果,该结果证实了嗜黏蛋白阿克曼氏菌菌株使UCP-1表达以及与褐色脂肪有关的标志物增加。
图3示出了qPCR实验的结果,该结果证实了嗜黏蛋白阿克曼氏菌菌株使小肠中的IL-6细胞因子和GLP-1增加。
图4显示了证实嗜黏蛋白阿克曼氏菌菌株介导的褐色脂肪表现和产热依赖于IL-6细胞因子的实验结果。
图5显示了体外实验结果(ELISA),该结果证实了由嗜黏蛋白阿克曼氏菌表达GLP-1是由细菌分泌的物质引起的。
图6显示了体外实验结果,该结果证实了由嗜黏蛋白阿克曼氏菌表达GLP-1是由短链脂肪酸(SCFA)以外的要素引起的。
图7A显示了通过嗜黏蛋白阿克曼氏菌的大小分级监测GLP-1的可诱导性的体外实验结果,图7B显示了用蛋白酶K(PK)处理后,对GLP-1诱导性级分(100K,300K)表达GLP-1进行监测的实验结果。
图8显示了针对级分诱导GLP-1,GLP-1诱导性级分(100K)的阴离子交换柱和尺寸排阻柱分级的实验结果。
图9显示了使用LC/MS-MS对嗜黏蛋白阿克曼氏菌的GLP-1诱导性级分(100K,m2-m4,G17-G20)进行定性蛋白质分析的结果。
图10显示了监测纯化的候选蛋白(SDS-PAGE凝胶)对GLP-1的诱导能力的实验结果。
图11显示了证实腹膜内施用的靶蛋白的体内葡萄糖内稳态能力的实验结果。
图12显示了确认口服施用的靶蛋白的体内葡萄糖内稳态能力的实验结果。
具体实施方式
在下文中,将参考实施例描述本发明。然而,这些实施例仅用于说明目的,本发明的范围不限于此。
实施例1.向高脂饮食小鼠模型施用嗜黏蛋白阿克曼氏菌(Akk)菌株后降低肝脏和褐色脂肪重量的效果分析
在补充有0.5%粘蛋白的脑心浸液(BHI)固体培养基中厌氧培养嗜黏蛋白阿克曼氏菌(ATCC BAA-835,Akk)菌株72小时,并确保得到储备液。摄入高脂饮食(60%脂肪)(HF+Akk,n=8只/组)的同时,每天向6周龄的雄性C57BL/6小鼠以4×10
结果,证实了与HF组相比,HF+Akk组的腹股沟白色脂肪组织(igWAT)和附睾白色脂肪组织(EpiWAT)的重量没有显著变化,但肩胛间褐色脂肪组织(iBAT)的重量显著减少。此外,当进行褐色脂肪(iBAT)和肝组织重量与体重的相关性分析时(图1B),证实了褐色脂肪和肝脏组织重量占体重的很大的比例,从而褐色脂肪和肝脏重量减少暴露了嗜黏蛋白阿克曼氏菌的可能的靶组织。
此外,作为通过苏木精曙红染色(H&E染色)比较各组的褐色脂肪组织和肝脏组织的脂肪大小的结果,观察到与对照组相比,嗜黏蛋白阿克曼氏菌施用组的褐色脂肪组织和肝组织的脂肪细胞大小显著减小(图1C和图1D)。
因此,作为实验结果,证实了嗜黏蛋白阿克曼氏菌有助于减少褐色脂肪组织的重量、脂肪细胞大小和肝脏组织的重量(图1A至图11D)。
实施例2.嗜黏蛋白阿克曼氏菌菌株增加UCP-1表达和褐色脂肪相关标志物
在褐色脂肪组织(iBAT)中,对作为褐色脂肪激活标志物的解偶联蛋白(UCP-1)进行免疫组织化学(IHC)染色,并对各组比较(图2A)。在提取组织RNA并合成cDNA之后,通过qPCR确认UCP-1的基因表达,并且还确认了褐色脂肪分化相关标志物(CIDEA、PRDM16、PPARGC1α、爱帕琳肽(Apelin))(图2B)。
作为实验结果,证实了与非喂养组相比,高脂诱导的嗜黏蛋白阿克曼氏菌喂养小鼠中褐色脂肪组织中的棕色脂肪相关标志物显著增加,并且用与褐色脂肪活性有关的UCP-1因子对组织进行的染色结果也证实了这种增加。因此,证实了嗜黏蛋白阿克曼氏菌诱导褐色脂肪的机理。
实施例3.嗜黏蛋白阿克曼氏菌菌株增加回肠和结肠中的IL-6细胞因子和GLP-1
从回肠和结肠组织中提取RNA并合成cDNA后,比较各组的免疫细胞因子标志物(TNF-α、IL-1β、IL-18、IL-6、IL-10)的表达水平(图3A和图3B)。
当用三种类型的乳酸杆菌属(Lactobacillus)菌株(KCTC2180、KCTC3112、KCTC1048)、三种类型的双歧杆菌属(Bifidobacterium)菌株(KCTC3127、KCTC3128、KCTC3352)或嗜黏蛋白阿克曼氏菌(Akk)处理小鼠肠道细胞系(CT26细胞)时,比较IL-6细胞因子表达的能力。将来自大肠杆菌的脂多糖(LPS)用作阳性对照(图3C)。
通过qPCR鉴定了在回肠组织中诱导肠分泌的食欲调节激素、胰高血糖素样肽-1(GLP-1)表达的相关基因(gcg、pcsk1、pcsk2)(图3D)。
作为实验结果,证实了通过施用嗜黏蛋白阿克曼氏菌,小鼠回肠和结肠细胞中的IL-6细胞因子显著增加,并且血清中食欲调节激素胰高血糖素样肽-1(GLP-1)的表达显著增加(图3A至图3D)。特别是,与其他乳酸杆菌属和双歧杆菌属菌株相比,小鼠回肠细胞系显示嗜黏蛋白阿克曼氏菌显著提高了IL-6水平。
实施例4.嗜黏蛋白阿克曼氏菌菌株的褐色脂肪表现和放热反应是否依赖于IL-6细胞因子
监测了嗜黏蛋白阿克曼氏菌的褐色脂肪激活功效是否依赖于IL-6细胞因子。
为此目的,分别用高脂饮食(60%高脂;HF)饲料喂养6周龄雄性C57BL/6野生型(WT)小鼠和IL-6基因缺陷小鼠(IL-6KO),同时,每天以4×10
禁食16小时后,分离褐色脂肪组织,提取RNA,合成cDNA,然后通过qPCR确认UCP-1的表达(图4A)。通过使用数字温度计(TESTO925)测量直肠温度(图4B)。使用红外热像仪(FLIR)测量褐色脂肪的皮肤温度(图4C和图4D)。
为了测量血清中GLP-1的浓度,在早晨禁食5小时后以2g/kg的浓度口服施用葡萄糖。10分钟后,通过眶后窦采血收集血浆,并将其置于补充有1μg/ml抑二肽素A(6019;Tocris)的维持冷却的管中,该抑二肽素A抑制GLP-1的半衰期。离心(4,000×g,10分钟)后,将上清液在-80℃下冷冻。此后,通过小鼠GLP-1ELISA试剂盒测量GLP-1的表达(图4E)。
通过qPCR,针对WT小鼠和IL-6KO小鼠评估了与在回肠和结肠组织中诱导GLP-1表达(gcg、pcsk1、pcsk2)有关的基因(图4F至图4H)。
作为实验结果,通过施用嗜黏蛋白阿克曼氏菌而增加表达的褐色脂肪相关基因UCP-1的表达在IL-6基因缺陷的小鼠中没有增加(图4A)。同样,当用红外照相机监控或用直肠温度计测量褐色脂肪区域的皮肤表面温度时,证实了IL-6KO小鼠没有显示出由于褐色脂肪激活而产生热量(图4B至图4D)。此外,与WT小鼠不同,IL-6KO小鼠的血清中GLP-1的浓度反而降低了,并且诱导GLP-1表达的基因(gcg、pcsk1、pcsk2)的水平没有变化,因此证实了,回肠中的食欲调节激素GLP-1升高也取决于IL-6(图4E至图4H)。
实施例5证实嗜黏蛋白阿克曼氏菌表达GLP-1是由于细菌分泌物质而引起的(体外)
将Akk菌株(嗜黏蛋白阿克曼氏菌ATCC BAA-835)或嗜黏蛋白阿克曼氏菌SNUG-61027菌株在0.5%粘蛋白培养基中培养,然后在补充有0.1%或5%胎牛血清(FBS)的BHI培养基中培养36小时以进行液体培养。
将分泌GLP-1的NCI-H716(ATCC CCL-251)细胞系以2×10
作为实验的结果,当用活细菌细胞和嗜黏蛋白阿克曼氏菌的上清液处理GLP-1诱导细胞系(L细胞)时,证实了用活细菌处理未检测到GLP-1,而当用上清液处理时,GLP-1高度表达,并且用SNUG-61027菌株的表达水平显著高于用ATCC BAA-835的表达水平(图5A)。此外,当用SNUG-61027菌株的培养上清液处理时,GLP-1的表达水平以剂量依赖的方式增加(图5B)。
实施例6证实嗜黏蛋白阿克曼氏菌导致GLP-1表达是由于其他因素而不是短链脂肪酸引起的(体外)
为了分析嗜黏蛋白阿克曼氏菌分泌的短链脂肪酸(SCFA),使用GC-MS监测代表性的短链脂肪酸、乙酸盐、丙酸盐和丁酸盐的表达(图6A)。用乙酸盐、丙酸盐(1mM,10mM)和菌株培养上清液(100%v/v)处理两小时后,监测GLP-1的表达水平(图6B)。
作为实验的结果,证实了嗜黏蛋白阿克曼氏菌分泌乙酸盐和丙酸盐(图6A)。但是,乙酸盐和丙酸盐诱导的GLP-1的量显著低于嗜黏蛋白阿克曼氏菌的培养上清液表达的GLP-1(图6B)。因此,发现由嗜黏蛋白阿克曼氏菌诱导的GLP-1中涉及乙酸盐和丙酸盐以外的要素。
实施例7使用尺寸筛(size filter)、阴离子交换柱和尺寸柱(size colum)对GLP-1诱导级分(100K)进行分离和鉴定
为了分离培养液中的活性物质,使用尺寸筛获得级分。将它们浓缩后,监测GLP-1的诱导能力证实了在100kDa至300kDa的级分中表达了高水平的GLP-1。此外,为了除去有效级分(100K至300K,30K至100K)中的蛋白质,用浓度为100μg/ml的蛋白酶K(PK)在55℃下处理1小时,然后在90℃下灭活10分钟,并测量GLP-1表达。结果,证实了GLP-1表达不是由去除蛋白质的级分诱导的。由此,证实了级分中的蛋白质诱导GLP-1表达。为了对100kDa至300kDa(100K)的嗜黏蛋白阿克曼氏菌上清液进行再分级,使用MonoQ阴离子交换柱(MomoQ5/50,GE Healthcare)和AKTAexplorer系统(GE Healthcare)进行快速蛋白液相色谱(FPLC)。注入80μg/ml的100K级分,并将样品以1ml/分钟的速率进行分级。然后,将每个级分用L细胞处理,并测量GLP-1的表达水平。作为实验结果,证实了m2-m4级分以高浓度表达GLP-1(图8A)。
然后,将m2-m4级分用30K筛浓缩,并将浓缩的样品再次使用GPC尺寸柱(GPC/SEC)进行FPLC。为了分级,使用hiload 16/600Superdex pg(GE Healthcare)AKTAexplorer系统以3ml/分钟的速率将样品分级。以相同的方式,用每种级分处理L细胞,证实了GLP-1表达的能力。作为实验结果,证实了G17-G20级分高水平表达GLP-1(图8B)。
实施例8使用LC/MS-MS定性分析嗜黏蛋白阿克曼氏菌的GLP-1诱导性级分(100K,m2-m4,G17-G20)蛋白
通过LC/MS-MS定性分析从嗜黏蛋白阿克曼氏菌的上清液中获得的样品1)100K浓缩物,样品2)MonoQ浓缩物和样品3)GPC浓缩物。排除了可在上清液基的础培养基中发现的牛相关蛋白,并监测了每个级分中鉴定出的蛋白的数量。
为此,对通过尺寸筛获得的每种样品进行定性分析,将GPC浓缩物中出现的10种蛋白质或肽(视为最终浓缩物)按强度列出,并与其他级分中出现水平进行比较。使用LC-MS/MS(Nanoflow Easy-nLC 100/Q Exactive质谱仪)分析仪器。使用Maxquant软件1.5对其进行处理,并使用通用蛋白质资源(Universal Protein Resource)(Uniprot)蛋白质数据库进行注释,从而定性分析蛋白质。对于总蛋白质和多肽,仅选择错误发现率<1%的蛋白质和多肽。
作为实验结果,在其中候选蛋白被认为是最浓缩的样品3)G17-G20级分中鉴定了10种蛋白质(图9A和图9B)。
实施例9通过纯粹地纯化的候选蛋白证实GLP-1的诱导性
克隆来自嗜黏蛋白阿克曼氏菌的浓缩级分的10种蛋白质,并在大肠杆菌BL21细胞中表达,然后纯化每种蛋白质。10种蛋白质中的一种(β-半乳糖苷酶)由于无法克隆有效的表达载体而在以下步骤被排除。然后,通过SDS-PAGE验证了9种蛋白质的表达和纯化。使用Amuc1100作为阳性对照,Amuc1100是来源于嗜黏蛋白阿克曼氏菌的蛋白,已知该蛋白具有抗肥胖症功能(Plovier H.等人,来自嗜黏蛋白阿克曼氏菌或巴氏灭菌细菌的纯化膜蛋白改善肥胖症和糖尿病小鼠的新陈代谢(A purified membrane protein from Akkermansiamuciniphila or the pasteurized bacterium improves metabolism in obese anddiabetic mice).Nat Med.(2017)23:107-113)。用每种分离的蛋白处理L细胞,以确认GLP-1的表达。
为此目的,将合成的靶蛋白插入具有IPTG诱导型启动子的pET-21b质粒(Novagen)中,并使用his-tag进行纯化。这通过SDS-PAGE凝胶来证实。通过用合成质粒转化BL21大肠杆菌菌株并进行培养,可以大规模生产和纯化蛋白质,在定量浓度后用蛋白质处理NCI-H716细胞系。
作为实验结果,有趣的是,证实了GLP-1的表达是由蛋白质B2UKW8(P1)、B2URM2(P5)和B2UM07(P9)诱导的,特别地,证实了证实在10μg/ml和100μg/ml下,B2UM07蛋白诱导的GLP-1的水平均显著高于Amuc1100蛋白(图10C)。
实施例10证实靶蛋白的体内葡萄糖稳态能力(正常饮食,腹膜内施用)
为了证实所鉴定的靶蛋白是否能改善了体内的葡萄糖内稳态能力,将P1(B2UKW8)、P5(B2UKW8)和P9(B2UM07)蛋白以100μg/小鼠的浓度腹膜内施用至正常饮食小鼠一周,然后测试葡萄糖耐量。
为此,将3种有效蛋白(P1、P5、P9)每天以100μg/200μl的浓度腹膜内施用至正常饮食小鼠,在第7天将体重与非施用组进行比较(n=8/组,图11C),然后在施用后14天,以2g/kg的浓度口服施用葡萄糖,随后在15至120分钟测量血糖作为定时葡萄糖耐量测试(图11A和图11B)。
实验的结果证实,施用P9(B2UM07)的组比其他组维持显著更低的血糖。这显示出比已知赋予葡萄糖耐量的来源于嗜黏蛋白阿克曼氏菌的Amuc1100蛋白更有效。P1(B2UKW8)和P5(B2UKW8)仅显示葡萄糖耐量趋势,但是在P9组的情况下,还证实了体重减轻是显著的(图11C)。
实施例11证实靶蛋白的体内葡萄糖内稳态能力(高脂饮食,口服施用)
为了证实所鉴定的靶蛋白是否能改善体内的葡萄糖内稳态的能力,将P9(B2UM07)蛋白以100μg/小鼠的浓度口服施用至高脂饮食小鼠,持续8周,并进行了葡萄糖耐量测试。口服施用葡萄糖(2g/kg)后测量血糖15至120分钟。
作为实验的结果,与高脂饮食小鼠组相比,P9(B2UM07)施用组显示出对体重增加的显著抑制作用,并且该作用大于Amuc1100施用组的作用(图12A)。另外,证实了在葡萄糖施用后30分钟,与高脂饮食小鼠组相比,葡萄糖内稳态能力被显著调节(图12B和图12C)。
PCT/RO/134表
- 嗜黏蛋白阿克曼氏菌菌株及其用途
- 嗜黏蛋白阿克曼菌EB-AMDK19菌株及其用途
