一种多能干细胞定向分化为功能性心肌的方法
文献发布时间:2023-06-19 09:24:30
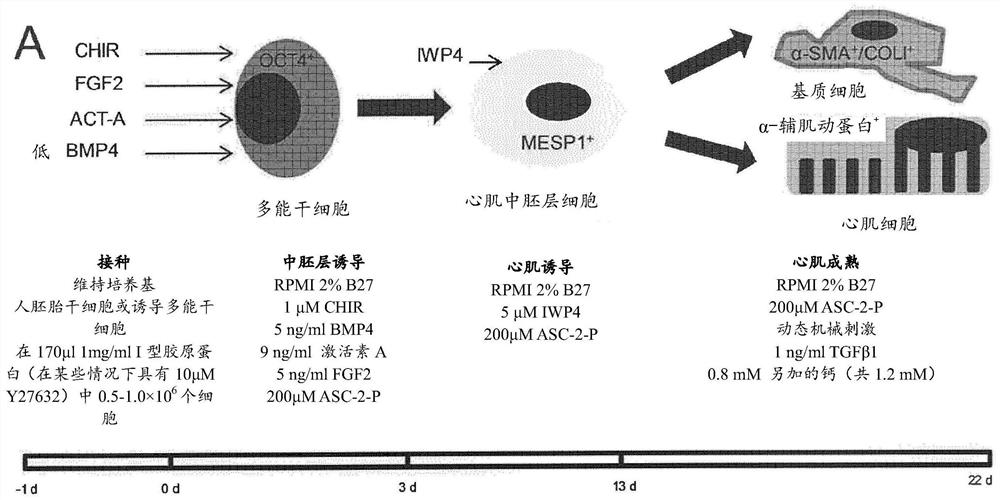
背景技术
如今人多能干细胞(hPSC)广泛地用于提供理论上无限的且同时大量供应的人心肌细胞(Kehat等,J Clin Invest 108,407-414(2001);Takahashi等,Cell 131,861-872(2007);Zhang等,Circ Res 104,e30-41(2009))。人心肌细胞源自人胚胎干细胞(hESC)(Thomson等,Science 282,1145-1147(1998))和诱导多功能干细胞(hIPSC)(Takahashi等,Cell 131,861-872(2007)),并且人心肌细胞具有包括发育模型(Lian等,Stem Cells 2012(2012))、药物疗效和/或安全性筛选(Schaaf等,PLoS ONE 6,20(2011))、肥厚建模和再生应用的已证明的多目的用途。此外,对于hIPSC技术的最新进展,可以在体外产生显示遗传性基因疾病表型的心肌细胞(Carvajal-Vergara,X.等,Nature465,808-812(2010);Itzhaki等,Nature 471,225-229(2011);Malan等,Circ Res(2011);Moretti等,N Engl JMed 363,1397-1409(2010);Yazawa等,Nature 471,230-234(2010))。
目前普遍认为,源自活检的人心肌细胞的低密度2D培养会导致心肌细胞表型和形态的快速改变(Bird等,Cardiovasc Res 58,423-434(2003)),从而使其体内状况结果的推断变得困难。为了获得更能代表体内条件的心肌细胞表型,采用心肌组织工程(Eschenhagen等,FASEB J 11,683-694(1997);Zimmermann等,Biotechnol Bioeng 68,106-114(2000),Zimmermann等,Circ Res 90,223-230(2002);Tulloch等,Circ Res 109,47-59(2011);Tiburcy等,Circ Res 109,1105-1114(2011);Eschenhagen等,Am J PhysiolHeart Circ Physiol 303,11(2012))来产生与自然的心肌组织具有类似性质的构建体。
组织工程目前的观念学是产生/分离所需的一种或多种细胞类型,并将这些细胞类型接种于工程化的环境中从而促进其分化并产生体内样组织。因此,组织工程可被认为是一个低效过程的原因有两个:1)组织/分化培养物的分离破坏了胞外环境,从而破坏发育信息(如细胞-细胞的互联性、几何细胞定位、细胞-ECM的连通性),为了重新建立环境,需要细胞外基质(ECM)生产的大量增加(Hudson等,Tissue Eng Part A 17,2279-2289(2011));和2)hPSC细胞系间的分离过程是可变的,并能导致大量的细胞死亡。
文献中报道的其它试验方案可能需要对试验方案进行修改从而实现多个hPSC细胞系中相似的心肌细胞效率。然而,发明人得到的结果证明分化试验方案的改变可极大地影响心肌细胞的表型(如证明dorsomorphin可极大地影响生物工程化心肌(BHM))。这可导致组织工程化心肌性能改变,从而可掩盖不同实验条件或遗传性疾病模型的效果,因此当在不同细胞系中应用不同试验方案时必须小心。
一些近期公开的试验方案实现了将相同的试验方案应用于多个细胞系,它们还能产生高纯度的心肌细胞。然而,纯的心肌细胞不能促进功能性组织工程化心肌的形成,并且功能性组织工程化心肌的形成需要心肌细胞和基质细胞两者(Naito等,Circulation 114,I72-78(2006),Hudson等.Tissue Eng Part A 17,2279-2289(2011))。
因此,本领域仍然需要能够克服上述缺点的用于生产生物工程化人心肌的方法。
稳健的分化试验方案的开发是允许持续生产BHM的非常重要的步骤。在本研究的>18个独立实验中产生了n>140BHM,并且每个BHM都表现出自发搏动活动。此外,该试验方案实现了采用相同的试验方案从多个hPSC细胞系生产BHM。另外,能免除所有的分离步骤,使hPSC直接分化为生物工程化心肌,因而保留了组织的发育记忆、防止了任何组织重建响应并提供更精确的人心肌发育的体外模型。
本发明涉及一种用于从多能干细胞生产生物工程化心肌的方法,所述方法包括如下步骤:
(i)在基础培养基中培养多能干细胞,所述基础培养基包含有效量的(a)BMP4、激活素A、FGF2、GSK3-抑制剂,和(b)得到终浓度为0.5-50mg/ml白蛋白、1-100μg/ml转铁蛋白、0.1-10μg/ml乙醇胺、0.003-0.3μg/ml亚硒酸钠、0.4-40μg/ml L-肉碱HCl、0.1-10μg/ml氢化可的松、0.05-5μl/ml脂肪酸补充剂、0.0001-0.1μg/ml三碘-L-甲状腺原氨酸(T3)的无血清补充剂,由此诱导所述多能干细胞的中胚层分化;
(ii)在基础培养基中培养步骤(i)中得到的细胞,所述基础培养基包含有效量的Wnt-信号传导通路抑制剂和如步骤(i)中的无血清补充剂,由此诱导所述细胞的心肌分化;和
(iii)在机械刺激下,在基础培养基中培养步骤(ii)中得到的细胞,所述基础培养基包含有效量的如步骤(i)中的无血清补充剂,由此促进心肌成熟。
实施本发明所公开的方法,通过在胶原蛋白水凝胶中hPSC的定向组织形成产生源自人多能干细胞(hPSC)的生物工程化心肌(BHM)。为了形成BHM,采用定向无血清诱导试验方案来模拟体内发育,该试验方案使组织发展通过不同的、已知的发育阶段,通过多能性、早期中胚层、心肌祖细胞、未成熟心肌细胞和最终成为较成熟的心肌组织,该组织包含50%心肌细胞,剩余主要为基质细胞部分(fraction)。发明人优化了其无血清BHM试验方案并发现个别BHM性能高度依赖于特定刺激,因此表明最佳BHM性能需要多个外源刺激。最终,产生了可节律性收缩的BHM,其具有可测量的收缩力,响应增加的静息长度、钙浓度和β-肾上腺素能刺激而起博和收缩的能力。这一BHM试验方案无需修改即可持续从多个hPSC细胞系生产BHM(每个进行的实验中的每个BHM)。
本发明的数据表明本文公开的BHM试验方案是一种稳健的、无血清的和重现性好的生产用于多种用途的人心肌的方法。例如,还证明了BHM是一个有潜力的人心肌发育模型,并表明BMP信号传导的抑制导致了具有降低的收缩强度的较不成熟的心肌表型。
因此,本发明还涉及采用根据本发明所述的方法生产的BHM。
进一步考虑的是根据本发明的BHM在用于药物毒性筛选的体外模型中的用途。换言之,本发明还涉及一种用于筛选药物毒性的方法,所述方法包括使根据本发明的BHM与待筛选的药物接触的步骤。
此外,本发明涉及根据本发明的BHM在用于测试药物候选试剂的心肌功能调节的体外方法中的用途。因此,本文还描述了一种用于测试心肌功能调节的方法,所述方法包括使根据本发明的BHM与药物候选试剂接触的步骤。
最后,本发明还涉及根据本发明的BHM作为研究工具的用途,以及根据本发明的BHM在医药中的用途。
一种用于从多能干细胞生产生物工程化心肌的方法,所述方法包括如下步骤:
(i)在基础培养基中培养多能干细胞,所述基础培养基包含有效量的(a)BMP4、激活素A、FGF2、GSK3-抑制剂,和(b)得到终浓度为0.5-50mg/ml白蛋白、1-100μg/ml转铁蛋白、0.1-10μg/ml乙醇胺、0.003-0.3μg/ml亚硒酸钠、0.4-40μg/ml L-肉碱HCl、0.1-10μg/ml氢化可的松、0.05-5μl/ml脂肪酸补充剂、0.0001-0.1μg/ml三碘-L-甲状腺原氨酸(T3)的无血清补充剂,由此诱导所述多能干细胞的中胚层分化;
(ii)在基础培养基中培养步骤(i)中得到的细胞,所述基础培养基包含有效量的Wnt-信号传导通路抑制剂和如步骤(i)中所定义的无血清补充剂,由此诱导所述细胞的心肌分化;和
(iii)在机械刺激下,在基础培养基中培养步骤(ii)中得到的细胞,所述基础培养基包含有效量的如步骤(i)中的无血清补充剂,由此促进心肌成熟。
在优选的实施方案中,所述多能干细胞为灵长类动物来源的多能干细胞;更优选地,所述多能干细胞为人多能干细胞。多能干细胞能够分化为机体的每一细胞类型。因此,人多能干细胞为获得真正的人心脏细胞提供了独特的机会。目前,最常用的多能细胞为胚胎干细胞(ESC)或诱导多能干细胞(iPSC)。人ESC-细胞系最初由Thomson和同事(Thomson等,Science282:1145-1147(1998);以全文引用的方式并入本文)建立。近期,人ESC研究使将机体细胞重新编程为ES样细胞的新技术得到开发。这一技术是由Yamanaka和同事在2006年(Takahashi&Yamanaka Cell 126:663-676(2006);以全文引用的方式并入本文)开发的。得到的诱导多能细胞(iPSC)表现出了与ESC非常相似的行为,并且重要的是其还能分化为机体的每一细胞。此外,据报道,孤雌生殖干细胞也有可能适于BHM生产(Didié等,J ClinInvest.123,1285-1298(2013);以全文引用的方式并入本文)。因此,多能干细胞可选自胚胎干细胞、诱导多能干细胞和孤雌生殖干细胞。然而,在本发明的上下文中,所述多能干细胞不是采用涉及改变人类种系遗传特性或涉及用于工业或商业目的的人胚胎的用途的工艺生产的。
用于步骤(i)的基础培养基可选自DMEM/F12、StemPro、Iscove’s培养基、αMEM、DMEM和RPMI。优选地,用于步骤(i)的基础培养基为补充了丙酮酸盐的RPMI。然而,任何合适的基础培养基均可用于所述方法。基础培养基为商购可获得的或可以根据公开可获得的、如来自ATCC的目录的配方进行制备。
如果认为合适,可以向所述基础培养基中补充非必需氨基酸。若将αMEM用作基础培养基,则该基础培养基中无需另外补充非必需氨基酸。作为组合补充剂,所述非必需氨基酸为商购可获得的。例如,这种补充剂包含750mg/L甘氨酸、890mg/L L-丙氨酸、1320mg/LL-天冬酰胺、1330mg/L L-天冬氨酸、1470mg/L L-谷氨酸、1150mg/L L-脯氨酸和1050mg/LL-丝氨酸。
如上所述,步骤(i)的基础培养基包含有效量的BMP4、激活素A、FGF2和GSK3-抑制剂。例如,这种基础培养基包含1-20ng/ml、优选地2-15ng/ml、更优选地2.5-10ng/ml、更优选地3-8ng/ml、最优选地4-6ng/ml和甚至最优选地约5ng/ml的BMP4;
0.1-10ng/ml、优选地1-9ng/ml、更优选地2-8ng/ml、甚至更优选地3-7ng/ml、最优选地4-6ng/ml和甚至最优选地约5ng/ml的FGF2;
1-20ng/ml、优选地2.5-18ng/ml、更优选地5-16ng/ml、甚至更优选地7.5-14ng/ml、再更优选地8-12ng/ml、最优选地8.5-10ng/ml和甚至最优选地约9ng/ml的激活素A。
步骤(i)的基础培养基中的GSK3-抑制剂可选自,例如CHIR99021、CHIR98014、SB216763、TWS119、Tideglusib、SB415286和LY2090314。然而,任何适于本发明的方法的GSK3-抑制剂都可采用。在优选的实施方案中,步骤(i)的基础培养基中的GSK3-抑制剂为CHIR99021。
本领域技术人员应当理解,GSK3-抑制剂的有效量的浓度随所讨论的抑制剂的有效性和抑制常数变化。在本发明的上下文中,本文所采用的在GSK3-抑制剂上下文中的术语“有效量”意在表示酶失活浓度。例如,当GSK3-抑制剂为CHIR99021时,步骤(i)中的基础培养基包含0.1-10μM的CHIR99021,优选地0.2-9μM、更优选地0.3-8μM、甚至更优选地0.4-7μM、再更优选地0.5-6μM、更优选地0.6-5μM、更优选地0.7-4μM、甚更优选地0.8-3μM、最优选地0.9-2μM和甚至最优选地约1μM的CHIR99021。应当理解,任何受体/酶激动剂或抑制剂的有效浓度随相应化合物的有效性和生物活性变化。
将应用于所述方法的步骤(i)、(ii)和(iii)中的无血清补充剂配制成得到终浓度为0.5-50mg/ml(优选地1-40mg/ml,更优选地2-30mg/ml,再更优选地3-20mg/ml,最优选地4-10mg/ml和甚至最优选地4.5-7.5mg/ml,如约5mg/ml)白蛋白;
1-100μg/ml(优选地2-90μg/ml,更优选地3-80μg/ml,甚至更优选地4-70μg/ml,再更优选地5-60μg/ml,更优选地6-50μg/ml,更优选地7-40μg/ml,更优选地8-30μg/ml,更优选地9-20μg/ml,如约10μg/ml)转铁蛋白;
0.1-10μg/ml(优选地0.2-9μg/ml,更优选地0.3-8μg/ml,甚至更优选地0.4-7μg/ml,再更优选地0.5-6μg/ml,更优选地0.6-5μg/ml,更优选地0.7-4μg/ml,更优选地0.8-3μg/ml,更优选地1-2.5μg/ml,如约2μg/ml)乙醇胺;
0.003-0.3μg/ml(优选地0.005-0.2μg/ml,更优选地0.01-0.1μg/ml,甚至更优选地0.02-0.05μg/ml和最优选地约0.03μg/ml,如约0.032μg/ml)亚硒酸钠;
0.4-40μg/ml(优选地0.5-30μg/ml,更优选地1-20μg/ml,甚至更优选地2-10μg/ml,最优选地3-5μg/ml和甚至最优选地约4μg/ml)L-肉碱HCl;
0.1-10μg/ml(优选地0.2-9μg/ml,更优选地0.3-8μg/ml,甚至更优选地0.4-7μg/ml,再更优选地0.5-6μg/ml,更优选地0.6-5μg/ml,更优选地0.7-4μg/ml,更优选地0.8-3μg/ml,更优选地0.9-2μg/ml,如约1μg/ml)氢化可的松;
0.05-5μl/ml(优选地0.1-4μl/ml,更优选地0.2-3μl/ml,甚至更优选地0.3-3μl/ml,最优选地0.4-2μl/ml和甚至最优选地0.45-1μl/ml,如约0.5μl/ml)脂肪酸补充剂,和
0.0001-0.1μg/ml(优选地0.001-0.01μg/ml,更优选地0.002-0.0075μg/ml,甚至更优选地0.003-0.005μg/ml和最优选地约0.004μg/ml)的三碘-L-甲状腺原氨酸(T3)。
此外,所述无血清补充剂可进一步包含一种或多种选自维生素A、D-半乳糖、L-肉碱、亚油酸、亚麻酸、孕酮和腐胺的组分。这些组分有利于细胞的生存力。技术人员已知或可通过常规方法简单地确定相应组分的适宜浓度。
步骤(i)中提及的无血清补充剂也是商购可获得的。例如,可采用
如下文实施例中证明的,将有效量的抗坏血酸或其盐或其衍生物包含在步骤(i)的基础培养基中被证明是有利的。在优选的实施方案中,步骤(i)的基础培养基包含10-1000μM、优选地50-400μM、更优选地100-300μM、甚至更优选地150-250μM和最优选地约200μM的抗坏血酸或其盐或其衍生物。所述抗坏血酸可以以游离形式或作为盐递送。由于抗坏血酸为活性成分,因此可以采用向细胞提供抗坏血酸的任何抗坏血酸的盐或衍生物,条件是反离子对细胞没有不利影响。如实施例中所示,一种合适的抗坏血酸的盐或衍生物为抗坏血酸-2-磷酸。
可通过监测中胚层分化的诱导效率来优化步骤(i)的时长及因子如BMP4、激活素A、FGF2和GSK3-抑制剂的浓度。这可通过监测细胞表面或多能性标记物的表达,即通过(a)TRA-1-60和OCT4阳性细胞(多能干细胞)的减少和(b)MIXL1和Mesp1阳性细胞(中胚层)的增加(还参见本文图4f)来实现。
简言之,将细胞用乙醇固定,用标准试验方案封闭,然后用针对TRA-1-60、OCT4、MIXL1和/或Mesp1的一级抗体(参见下表2)在封闭缓冲液中染色45min,可选地,随后用二级抗体(若一级抗体不是荧光标记的)在封闭缓冲液和Hoechst中于4℃下染色30min(参见下表2)。BD LSRII用于流式细胞术分析(BD Biosystems)。根据前向-侧向散射情况(profile)对活细胞群设门。采用BD FACSDiva软件(BD Bioscience)或Cyflologic v1.2.1(CyfloLtd)分析。若有以下情况则表明了中胚层分化诱导:
(a)活细胞群中少于50%、优选地少于40%、更优选地少于30%、甚至更优选地少于20%、最优选地少于10%和甚至最优选地少于5%的细胞对TRA-1-60呈阳性;和/或活细胞群中少于50%、优选地少于40%、更优选地少于30%、甚至更优选地少于20%、最优选地少于10%和甚至最优选地少于5%的细胞对OCT4呈阳性;和
(b)活细胞群中多于20%、优选地多于30%、更优选地多于40%、甚至更优选地多于50%和最优选地多于60%的细胞对MIXL1呈阳性;和/或活细胞群中多于20%、优选地多于30%、更优选地多于40%、甚至更优选地多于50%和最优选地多于60%的细胞对Mesp1呈阳性。
通常,步骤(i)进行48-96h。优选地,步骤(i)进行60-84h,和更优选地,步骤(i)进行66-78h。
用于步骤(ii)的基础培养基可选自DMEM/F12、StemPro、Iscove’s培养基、αMEM、DMEM和RPMI。优选地,用于步骤(ii)的基础培养基为补充了丙酮酸盐的RPMI。然而,任何合适的基础培养基均可用于所述方法。
如果认为合适,可以向步骤(ii)的基础培养基中补充非必需氨基酸。若将αMEM用作步骤(ii)的基础培养基,则该基础培养基中无需另外补充非必需氨基酸。作为组合补充剂,所述非必需氨基酸为商购可获得的。例如,这种补充剂包含750mg/L甘氨酸、890mg/L L-丙氨酸、1320mg/L L-天冬酰胺、1330mg/L L-天冬氨酸、1470mg/L L-谷氨酸、1150mg/L L-脯氨酸和1050mg/L L-丝氨酸。
步骤(ii)中的基础培养基可独立地选自应用于步骤(i)的基础培养基。然而,在优选的实施方案中,步骤(i)和步骤(ii)中的基础培养基相同。
步骤(ii)的基础培养基中的Wnt-信号传导通路抑制剂可以是可适于应用在本发明的方法中的任何Wnt-信号传导通路抑制剂。优选地,所述Wnt-信号传导通路抑制剂选自IWP4,IWP2,IWR-1,IWP1,IWP3,IWR-2,IWR-3,IWR-4,IWR-5,XAV939,DKK1,槲皮素(quercetin),ICG-001,扑蛲灵(pyrvinium),CCT031374,iCRT-3、5、14,CPG049090和NC043。更优选地,所述Wnt-信号传导通路抑制剂选自IWP4,IWP2,IWR-1,IWP1,IWP3,IWR-2,IWR-3,IWR-4,IWR-5,XAV939,DKK1。如下文实施例中所证明的,在步骤(ii)的基础培养基中的一个特别有用的Wnt-信号传导通路抑制剂为IWP4。
步骤(ii)中提及的无血清补充剂如上文步骤(i)中所定义。应用于步骤(i)和步骤(ii)的无血清补充剂可以相同或不同。同样,
本领域技术人员应当理解,Wnt-信号传导通路抑制剂的有效量的浓度随所讨论的抑制剂的有效性和抑制常数变化。例如,当Wnt-信号传导通路抑制剂为IWP4时,步骤(ii)中的基础培养基可包含0.1-10μM的IWP4,优选地1-9μM、更优选地2-8μM、甚至更优选地3-7μM、再更优选地4-6μM和最优选地约5μM的IWP4。应当理解,任何受体/酶激动剂或抑制剂的有效浓度随相应化合物的有效性和生物活性变化。
如下文实施例中证明的,将有效量的抗坏血酸或其盐或其衍生物包含在步骤(ii)的基础培养基中被证明是有利的。在优选的实施方案中,步骤(ii)的基础培养基包含10-1000μM、优选地50-400μM、更优选地100-300μM、甚至更优选地150-250μM和最优选地约200μM的抗坏血酸或其盐或其衍生物。所述抗坏血酸可以以游离形式或作为盐递送。由于抗坏血酸为活性成分,因此可以采用向细胞提供抗坏血酸的任何抗坏血酸的盐或衍生物,条件是反离子对细胞没有不利影响。如实施例中所示,一种用于步骤(ii)的基础培养基中的合适的抗坏血酸的盐或衍生物为抗坏血酸-2-磷酸。
可通过监测细胞心肌分化的诱导效率来优化步骤(ii)的时长及剩余成分如Wnt-信号传导通路抑制剂的浓度。这可通过监测分化标记物的表达,即通过Nkx2.5和辅肌动蛋白的增加来实现。
简言之,将细胞用乙醇固定,封闭,然后用针对Nkx2.5和/或辅肌动蛋白的一级抗体(参见下表2)在封闭缓冲液中染色45min,可选地,随后用二级抗体(若一级抗体不是荧光标记的)在封闭缓冲液和Hoechst中于4℃下染色30min(参见下表2)。BD LSRII用于流式细胞术分析(BD Biosystems)。根据前向-侧向散射情况对活细胞群设门。采用BD FACSDiva软件(BD Bioscience)或Cyflologic v1.2.1(Cyflo Ltd)分析。若活细胞群中多于20%、优选地多于30%、更优选地多于40%、甚至更优选地多于50%和最优选地多于60%的细胞对Nkx2.5呈阳性;和/或活细胞群中多于20%、优选地多于30%、更优选地多于40%、甚至更优选地多于50%和最优选地多于60%的细胞对辅肌动蛋白呈阳性(还参见本文的图4d和4f),则表明了心肌的分化诱导。
通常,步骤(ii)进行8-12天。优选地,步骤(ii)进行9-11天,和最优选地,步骤(ii)进行10天。
用于步骤(iii)的基础培养基可选自DMEM/F12、StemPro、Iscove’s培养基、αMEM、DMEM和RPMI。优选地,所述用于步骤(iii)的基础培养基为补充了丙酮酸盐的RPMI。然而,任何合适的基础培养基均可用于本方法。
如果认为合适,可以向步骤(iii)的基础培养基中补充非必需氨基酸。若将αMEM用作步骤(iii)的基础培养基,则该基础培养基中无需另外补充非必需氨基酸。作为组合补充剂,所述非必需氨基酸为商购可获得的。例如,这种补充剂包含750mg/L甘氨酸、890mg/L L-丙氨酸、1320mg/L L-天冬酰胺、1330mg/L L-天冬氨酸、1470mg/L L-谷氨酸、1150mg/L L-脯氨酸和1050mg/L L-丝氨酸。
步骤(iii)中的基础培养基可独立地选自应用于步骤(i)和/或步骤(ii)的基础培养基。然而,在优选的实施方案中,步骤(ii)和步骤(iii)中的基础培养基相同。更优选地,步骤(i)、(ii)和(iii)中的基础培养基相同。
如下文实施例中证明的,将有效量的抗坏血酸或其盐或其衍生物包含在步骤(iii)的基础培养基中被证明是有利的。在优选的实施方案中,步骤(iii)的基础培养基包含10-1000μM、优选地50-400μM、更优选地100-300μM、甚至更优选地150-250μM和最优选地约200μM的抗坏血酸或其盐或其衍生物。所述抗坏血酸可以以游离形式或作为盐递送。由于抗坏血酸为活性成分,因此可以采用向细胞提供抗坏血酸的任何抗坏血酸的盐或衍生物,条件是反离子对细胞没有不利影响。如实施例中所示,一种用于步骤(iii)的基础培养基中的合适的抗坏血酸的盐或衍生物为抗坏血酸-2-磷酸。
步骤(iii)中提及的无血清补充剂如上文步骤(i)中所定义。应用于步骤(i)、(ii)和(iii)的无血清补充剂可以相同或不同。同样,
步骤(iii)的基础培养基中进一步包含有效量的TGFβ1。例如,步骤(iii)的基础培养基可包含0.1-10ng/ml的TGFβ1,优选地0.2-9ng/ml、更优选地0.3-8ng/ml、甚至更优选地0.4-7ng/ml、再更优选地0.5-6ng/ml、更优选地0.6-5ng/ml、更优选地0.7-4ng/ml、更优选地0.8-3ng/ml、最优选地0.9-2ng/ml和甚至最优选地约1ng/ml的TGFβ1。
如实施例中所示,若步骤(iii)中的基础培养基不包含有效量的FGF2,则对心肌成熟是有利的。与之相反,已证明钙提高心肌成熟。因此,在优选的实施方案中,步骤(iii)的基础培养基包含0.5-3mM Ca
通常,本发明的方法的步骤(iii)是在机械刺激下,如在本领域公知的拉伸装置(stretch device)上进行的。优选地,所述拉伸装置将静态的、位相性的的或动态的拉伸应用于BHM。更具体地,机械拉伸可以是(a)静态的,(b)动态的或(c)相对于弹性负荷可伸缩的(flexible)。优选地,步骤(iii)中所述机械刺激为动态机械刺激或静态拉伸。在更优选的实施方案中,步骤(iii)中所述机械刺激为针对弹性负荷以利于增张力性收缩的动态机械刺激。
通过对自发或电刺激收缩的光学检测来测试是否促进了心肌成熟。优选地,通过等长收缩实验来监测心肌成熟,其中>0.01mN的颤搐力发展是心肌成熟的标志。
简言之,在向含有(所有以mM表示):120NaCl、1MgCl
通常,步骤(iii)进行至少72h。尽管对步骤(iii)的时长没有特别的上限,但是所述步骤通常进行少于100天。在具体的实施方案中,步骤(iii)可进行4-50天,如约15天。
在本发明的方法的步骤(i)之前可为接种步骤,其中在合适的模具中以(2.5-6×10
用于接种步骤的培养基通常包含0.2-2mg/ml(优选地0.3-1.9mg/ml,更优选地0.4-1.8mg/ml,甚至更优选地0.4-1.7mg/ml,再更优选地0.5-1.6mg/ml,更优选地0.6-1.5mg/ml,更优选地0.7-1.4mg/ml,更优选地0.8-1.3mg/ml,更优选地0.9-1.2mg/ml,如约1mg/ml)胶原蛋白。优选地,所述胶原蛋白为医用级的,并选自I型胶原蛋白、III型胶原蛋白、V型胶原蛋白及它们的混合物。在更优选的实施方案中,所述胶原蛋白的至少90%为I型胶原蛋白。然而,所述胶原蛋白还可进一步包含一种或多种选自弹性蛋白、层粘连蛋白、副层粘蛋白(entactin)、巢蛋白、蛋白聚糖和纤连蛋白的细胞外基质组分。通常,所述胶原蛋白的确切组成将取决于其源自哪里的来源。优选地,所述胶原蛋白是人来源的,但是还考虑到牛或猪来源的或海洋生物来源的,如源自藻类或鱼来源的胶原蛋白。另外,还可采用重组胶原蛋白。
为了达到适宜的细胞密度,对于一些多能细胞系,向用于接种步骤的培养基中补充ROCK-抑制剂可能是有帮助的。因此,在优选的实施方案中,用于接种步骤的培养基进一步包含ROCK-抑制剂。所述ROCK-抑制剂可以是可适合应用于本发明的方法的任何ROCK-抑制剂。优选地,所述ROCK-抑制剂选自Y27632、H-1152P、Thiazovivin、法舒地尔、羟基法舒地尔、GSK429286A和RKI-1447,优选地选自Y27632、H-1152P、Thiazovivin、法舒地尔、羟基法舒地尔,和更优选地所述ROCK-抑制剂选自Y27632或H-1152P。如下文实施例中所证明的,一个特别有用的ROCK-抑制剂为Y27632。
本领域技术人员应当理解,ROCK-抑制剂的有效量的浓度随所讨论的抑制剂的有效性和抑制常数变化。例如,当ROCK-抑制剂为Y27632时,用于接种步骤的培养基可包含1-50μM、优选地2.5-40μM、更优选地5-30μM、甚至更优选地7.5-20μM、更优选地8-12μM和最优选地约10μM的Y27632。
应当理解,任何受体/酶激动剂或抑制剂的有效浓度随相应化合物的有效性和生物活性变化。
除了以上公开的方法,本发明进一步涉及通过所述方法生产的BHM。尽管在我们的BHM试验方案中观察到了增加的成熟度,但是还应当注意所述BHM仍是一个相对不成熟的组织。与成人的心脏组织相比,所述BHM仍然具有较差的β-MHC/α–MHC比率,和低的但是仍然保留的祖基因(如ISL1)的表达。然而,在适宜的培养条件下,采用生物物理刺激的延长培养可进一步增加成熟度。已有形态学证据表明,这也适用于BHM系统中的情况。
通过本文公开的方法获得的BHM呈现以下特点:其能在直到至少3Hz的多个频率下起博,呈现高于0.2mM(优选地在生理范围4-8mM内)的钙EC
简言之,在含有(所有以mM表示):120NaCl、1MgCl
通过本文公开的方法获得的BHM的另一特点是其包含CD90
BHM可为研究在无血清环境中驱动成熟的机制提供良好的模型系统,并且我们已证明增加培养时间,成熟度将增加(我们发现了增加的异丙肾上腺素敏感性和改善的组织形态)。长期(至少63天)BHM培养而不丧失功能的性能还表明长期的药物安全性和有效性实验是可能的。因此,在优选的实施方案中,通过本文公开的方法获得的BHM可维持至少63天。
在采用传统分化方法之后进行组织工程,分化培养物需要大量的消化试验方案,以便得到心肌组织工程应用所需要的单一细胞/小簇。这些消化试验方案破坏发育过程中形成的胞外环境和空间分布,因此可能难以控制对心肌分化试验方案的抑制效应。
通过采用BHM作为模型,我们证明了影响早期发育(ASC-2-P,dorsomorphin)和后期发育(机械刺激、FGF2、TGFβ1和钙浓度)的因子对BHM的功能和性能具有深远影响。因此,我们的BHM试验方案在发育过程研究中将是一个有用的工具,其不仅能控制心脏发育,还能控制组织形成和性能。
因此,通过本文公开的方法获得的BHM可以适当地用作研究工具。例如,设想通过本文公开的方法获得的BHM在用于药物毒性筛选的体外模型中的用途。换言之,设想一种用于筛选药物毒性的方法,所述方法包括使通过本文公开的方法获得的BHM与待筛选药物接触的步骤。可选地,通过本文公开的方法获得的BHM可用于测试药物候选药剂的心肌功能调节的体外方法中。因此,本文还公开了一种用于测试心肌功能调节的方法,所述方法包括使根据本发明的BHM与药物候选药剂接触的步骤。
最后,通过本文公开的方法获得的BHM可用于医药。仅仅作为一个例子,设想通过本文公开的方法获得的BHM可有利地用于心脏修复。
通过以下实施方案进一步描述本发明:
一种用于从多能干细胞生产生物工程化心肌的方法,所述方法包括如下步骤:
(i)在基础培养基中培养多能干细胞,所述基础培养基包含有效量的(a)BMP4、激活素A、FGF2、GSK3-抑制剂,和(b)得到终浓度为0.5-50mg/ml白蛋白、1-100μg/ml转铁蛋白、0.1-10μg/ml乙醇胺、0.003-0.3μg/ml亚硒酸钠、0.4-40μg/ml L-肉碱HCl、0.1-10μg/ml氢化可的松、0.05-5μl/ml脂肪酸补充剂、0.0001-0.1μg/ml三碘-L-甲状腺原氨酸(T3)的无血清补充剂,由此诱导所述多能干细胞的中胚层分化;
(ii)在基础培养基中培养步骤(i)中得到的细胞,所述基础培养基包含有效量的Wnt-信号传导通路抑制剂和如步骤(i)中的无血清补充剂,由此诱导所述细胞的心肌分化;和
(iii)在机械刺激下,在基础培养基中培养步骤(ii)中得到的细胞,所述基础培养基包含有效量的如步骤(i)中的无血清补充剂,由此促进心肌成熟。
2.根据实施方案1所述的方法,其中所述多能干细胞为灵长类动物来源的多能干细胞,优选地为人多能干细胞。
3.根据实施方案1或2所述的方法,其中所述多能干细胞选自胚胎干细胞、诱导多能干细胞和孤雌生殖干细胞。
4.根据实施方案1-3中任一项所述的方法,其中步骤(i)的基础培养基包含10-1000μM、优选地50-400μM、更优选地100-300μM、甚至更优选地150-250μM和最优选地约200μM的抗坏血酸或其盐或其衍生物。
5.根据实施方案4所述的方法,其中所述抗坏血酸的盐或衍生物为抗坏血酸-2-磷酸。
6.根据实施方案1-5中任一项所述的方法,其中步骤(i)进行48-96h;优选地,步骤(i)进行60-84h,更优选地,步骤(i)进行66-78h。
7.根据实施方案1-6中任一项所述的方法,其中步骤(i)的基础培养基包含1-20ng/ml、优选地2-15ng/ml、更优选地2.5-10ng/ml、更优选地3-8ng/ml、最优选地4-6ng/ml和甚至最优选地约5ng/ml的BMP4。
8.根据实施方案1-7中任一项所述的方法,其中步骤(i)的基础培养基包含0.1-10ng/ml、优选地1-9ng/ml、更优选地2-8ng/ml、甚至更优选地3-7ng/ml、最优选地4-6ng/ml和甚至最优选地约5ng/ml的FGF2。
9.根据实施方案1-8中任一项所述的方法,其中步骤(i)的基础培养基包含1-20ng/ml、优选地2.5-18ng/ml、更优选地5-16ng/ml、甚至更优选地7.5-14ng/ml、再更优选地8-12ng/ml、最优选地8.5-10ng/ml和甚至最优选地约9ng/ml的激活素A。
10.根据实施方案1-9中任一项所述的方法,其中步骤(i)的基础培养基中的GSK3-抑制剂选自CHIR99021、CHIR98014、SB216763、TWS119、Tideglusib、SB415286和LY2090314。
11.根据实施方案10所述的方法,其中步骤(i)的基础培养基中的GSK3-抑制剂为CHIR99021。
12.根据实施方案11所述的方法,其中步骤(i)中的基础培养基包含0.1-10μM的CHIR99021,优选地0.2-9μM、更优选地0.3-8μM、甚至更优选地0.4-7μM、再更优选地0.5-6μM、更优选地0.6-5μM、更优选地0.7-4μM、更优选地0.8-3μM、最优选地0.9-2μM和甚至最优选地约1μM的CHIR99021。
13.根据实施方案1-12中任一项所述的方法,其中步骤(i)中的无血清补充剂包含0.1-10%的B27或减去胰岛素的B27,优选地0.5-8%、更优选地1-6%、甚至更优选地1.5-4%和最优选地约2%B27或减去胰岛素的B27。
14.根据实施方案1-13中任一项所述的方法,其中所述用于步骤(i)的基础培养基为DMEM/F12、StemPro、Iscove’s培养基、αMEM、DMEM和RPMI。
15.根据实施方案14所述的方法,其中所述用于步骤(i)的基础培养基为补充了丙酮酸盐的RPMI。
16.根据实施方案1-15中任一项所述的方法,其中步骤(ii)的基础培养基中的Wnt-信号传导通路抑制剂选自IWP4,IWP2,IWR-1,IWP1,IWP3,IWR-2,IWR-3,IWR-4,IWR-5,XAV939,DKK1,槲皮素(quercetin),ICG-001,扑蛲灵(pyrvinium),CCT031374,iCRT-3、5、14,CPG049090和NC043;优选地选自IWP4,IWP2,IWR-1,IWP1,IWP3,IWR-2,IWR-3,IWR-4,IWR-5,XAV939,DKK1。
17.根据实施方案16所述的方法,其中步骤(ii)的基础培养基中的Wnt-信号传导通路抑制剂为IWP4。
18.根据实施方案17所述的方法,其中步骤(ii)的基础培养基包含0.1-10μM的IWP4,优选地1-9μM、更优选地2-8μM、甚至更优选地3-7μM、再更优选地4-6μM和最优选地约5μM的IWP4。
19.根据实施方案1-18中任一项所述的方法,其中步骤(ii)的基础培养基包含10-1000μM、优选地50-400μM、更优选地100-300μM、甚至更优选地150-250μM和最优选地约200μM的抗坏血酸或其盐或其衍生物。
20.根据实施方案19所述的方法,其中所述抗坏血酸的盐或衍生物为抗坏血酸-2-磷酸。
21.根据实施方案1-20中任一项所述的方法,其中步骤(ii)进行8-12天;优选地,步骤(ii)进行9-11天,和最优选地,步骤(ii)进行10天。
22.根据实施方案1-21中任一项所述的方法,其中步骤(ii)中的无血清补充剂包含0.1-10%的B27或减去胰岛素的B27,优选地0.5-8%、更优选地1-6%、甚至更优选地1.5-4%和最优选地约2%B27或减去胰岛素的B27。
23.根据实施方案1-22中任一项所述的方法,其中用于步骤(ii)中的基础培养基为DMEM/F12、StemPro、Iscove’s培养基、αMEM、DMEM和RPMI。
24.根据实施方案23所述的方法,其中所述用于步骤(ii)的基础培养基为补充了丙酮酸盐的RPMI。
25.根据实施方案1-24中任一项所述的方法,其中步骤(iii)的基础培养基进一步包含10-1000μM、优选地50-400μM、更优选地100-300μM、甚至更优选地150-250μM和最优选地约200μM的抗坏血酸或其盐或其衍生物。
26.根据实施方案25所述的方法,其中所述抗坏血酸的盐或衍生物为抗坏血酸-2-磷酸。
27.根据实施方案1-26中任一项所述的方法,其中步骤(iii)进行至少72h;优选地,步骤(iii)进行少于100天,更优选地,步骤(iii)进行4-50天,和最优选地,步骤(iii)进行约15天。
28.根据实施方案1-27中任一项所述的方法,其中步骤(iii)中的无血清补充剂包含0.1-10%的B27或减去胰岛素的B27,优选地0.5-8%、更优选地1-6%7、甚至更优选地1.5-4%和最优选地约2%B27或减去胰岛素的B27。
29.根据实施方案1-28中任一项所述的方法,其中用于步骤(iii)中的基础培养基为DMEM/F12、StemPro、Iscove’s培养基、αMEM、DMEM和RPMI。
30.根据实施方案29所述的方法,其中所述用于步骤(i)的基础培养基为补充了丙酮酸盐的RPMI。
31.根据实施方案1-30中任一项所述的方法,其中步骤(iii)的基础培养基进一步包含0.1-10ng/ml、优选地0.2-9ng/ml、更优选地0.3-8ng/ml、甚至更优选地0.4-7ng/ml、再更优选地0.5-6ng/ml、更优选地0.6-5ng/ml、更优选地0.7-4ng/ml、更优选地0.8-3ng/ml、最优选地0.9-2ng/ml和甚至最优选地约1ng/ml TGFβ1。
32.根据实施方案1-31中任一项所述的方法,其中步骤(iii)的基础培养基不包含有效量的FGF2。
33.根据实施方案1-32中任一项所述的方法,其中步骤(iii)的基础培养基包含0.5-3mM Ca
34.根据实施方案1-33中任一项所述的方法,其中步骤(iii)中的机械刺激为动态机械刺激或静态拉伸。
35.根据实施方案34所述的方法,其中步骤(iii)中的机械刺激为动态机械刺激。
36.根据实施方案1-35中任一项所述的方法,在步骤(i)之前包括接种步骤,其中在合适的模具中以(2.5-6×10
37.根据实施方案36所述的方法,其中所述胶原蛋白为I型胶原蛋白。
38.根据实施方案36-37中任一项所述的方法,其中所述胶原蛋白为人来源的、牛来源的或海洋生物来源的。
39.根据实施方案36-38中任一项所述的方法,其中用于接种步骤的培养基进一步包含ROCK-抑制剂。
40.根据实施方案39所述的方法,其中所述ROCK-抑制剂选自Y27632、H-1152P、Thiazovivin、法舒地尔、羟基法舒地尔、GSK429286A和RKI-1447,优选地选自Y27632、H-1152P、Thiazovivin、法舒地尔、羟基法舒地尔,和更优选地所述ROCK-抑制剂为Y27632或H-1152P,和最优选地所述ROCK-抑制剂为Y27632。
41.根据实施方案40所述的方法,其中用于接种步骤的培养基包含1-50μM、优选地2.5-40μM、更优选地5-30μM、甚至更优选地7.5-20μM、最优选地8-12μM和最优选地约10μM的Y27632。
42.根据实施方案36-41中任一项所述的方法,其中所述接种步骤在步骤(i)之前18-30h进行。
43.根据实施方案1-42中任一项所述的方法生产的生物工程化人心肌(BHM)。
44.根据实施方案43所述的BHM,其能够在直到至少3Hz的多个频率下起博。
45.根据实施方案43或44所述的BHM,其响应增加的静息长度和静息张力呈现增加的颤搐张力。
46.根据实施方案43-45中任一项所述的BHM,其呈现大于0.2mM的钙EC
47.根据实施方案43-46中任一项所述的BHM,其呈现大于200μN的颤搐张力。
48.根据实施方案43-47中任一项所述的BHM,在0.6mM钙的起博条件下,其对1μM的异丙肾上腺素呈现大于40μN、优选地大于45μN、更优选地大于50μN的变力响应。
49.根据实施方案43-48中任一项所述的BHM,其包含心肌细胞和CD90
50.根据实施方案43-49中任一项所述的BHM,其可维持至少62天。
51.根据实施方案43-50中任一项所述的生物工程化人心肌(BHM)在用于筛选药物毒性的体外模型中的用途。
52.根据实施方案43-50中任一项所述的生物工程化人心肌(BHM)在用于测试药物候选药剂的心肌功能调节的体外方法中的用途。
53.根据实施方案43-50中任一项所述的生物工程化人心肌(BHM)作为研究工具的用途。
54.根据实施方案43-50中任一项所述的生物工程化人心肌(BHM),其用于医药。
55.根据实施方案43-50中任一项所述的生物工程化人心肌(BHM),其用于心脏修复。
附图说明
图1:用于稳健和有效的心肌分化的早期心肌分化的优化。(A)开发的心肌分化试验方案的示意图。(B、C)在2D培养中FGF-2的添加对心肌分化的作用。(D、E)在同时存在CHIR的2D培养中,改变BMP4浓度对心肌分化的作用。(F、G)从2D心肌分化试验方案中单独移除每一因子的作用,除了在3-13天每2-3天添加IWP4外,在0-3天每天添加所有因子。(H、I、J)采用qPCR对存在的污染细胞类型的测定。(K)心肌细胞标记物的免疫染色。(L)心肌细胞的流式细胞术(n=6个实验)。(M)基质细胞标记物的免疫染色。(N)基质细胞的流式细胞术(n=6个实验)。除另有说明外,所有数据为n=3个实验。qPCR数据(MESP-1、OCT4、SOX17和NEUROD1)被相对GAPDH标准化。采用ANOVA的图基事后多重比较检验(Tukey’s MultipleComparison Post Hoc test),*表示具有统计学显著差异(P<0.05)。**表示与无因子补充的样品相比,具有统计学显著差异。***表示与无因子补充的、补充了减去BMP4的所有因子的、补充减去ACT-A的所有因子的和补充减去IWP-4的所有因子的样品相比,具有统计学显著差异。
图2:从hPSC可直接形成BHM。(A)分化22天的BHM。(B)整体免疫染色。(C)响应钙浓度变化的等长颤搐张力(收缩力),n=7,源自4个实验。(D)多能性(TRA-1-60/OCT4)和心肌标记物(α-辅肌动蛋白)的流式细胞术情况(profile),n=3-4个实验。(E)在22天基质细胞标志物的流式细胞术,n=3个实验。(F)多能性、中胚层分化和心肌分化的标记物的qPCR表达情况;数据被相对GAPDH表达标准化,n=3个实验。采用ANOVA的图基事后多重比较检验,*表示与-1天相比具有统计学显著差异(P<0.05)。
图3:BHM培养条件的优化揭示了不同的参数对不同刺激的具体响应。(A)响应钙浓度的变化,ASC-2-P的补充改善了BHM、等长颤搐张力(收缩力),n=8-9,源自3个实验,采用双因素ANOVA的Bonferroni事后检验(Bonferroni post hoc test),*表示与对照组相比具有统计学显著差异(P<0.05)。(B)心肌细胞和基质细胞标记物的ASC-2-P实验的流式细胞术分析,n=7-8,源自3个实验。(C)响应钙浓度的变化,机械刺激改善了BHM的功能、等长颤搐张力(收缩力),n=9-11,源自4个实验,采用双因素ANOVA的Bonferroni事后检验,*表示与对照组相比,两种机械刺激方案均具有统计学显著差异(P<0.05)。(D)机械刺激装置。(E)在对照和机械刺激方案下的BHM的整体免疫染色。(F)响应钙浓度的变化,在心肌成熟期间加入的生长因子(FGF2:10ng/mL和TGFb1:1ng/mL)调节BHM的功能、等长颤搐张力(收缩力),n=9-11,源自4个实验。(G)采用流式细胞术对生长因子实验的心肌细胞尺寸的分析,n=6,源自3个实验,采用Student氏t-检验,*表示与对照组相比具有统计学显著差异(P<0.05)。(H)生长因子实验中的β-MHC/α-MHC比率的qPCR表达,n=3-6个实验,采用ANOVA的图基事后多重比较检验,*表示与对照组相比具有统计学显著差异(P<0.05)。(I)生长因子实验中的ANP和Sk Act的qPCR表达,n=3个实验。(J)响应钙浓度的变化,在心肌成熟期间将钙调节至1.2mmol/L改善了BHM的功能、等长颤搐张力(收缩力),n=10-11,源自4个实验,采用双因素ANOVA的Bonferroni事后检验,*表示与对照组相比具有统计学显著差异(P<0.05)。(K)钙实验中的BHM的静息张力,n=10-11,源自4个实验。(L)钙实验中的BHM的弹性模量,n=10-11,源自4个实验,采用ANOVA的图基事后多重比较检验,*表示与对照组相比具有统计学显著差异(P<0.05)。
图4:采用优化的试验方案生产的BHM呈现体内样特性。(A)BHM可以以多种速率电起博。(B)BHM以增加的颤搐张力(收缩力)来响应增加的长度(Frank-Starling机制)。(C)22日龄(源于之前数据)和29-30日龄的BHM的颤搐张力(收缩力)比较;对于22日龄组,n=11,源自4个实验;和对于29-30日龄组,n=7,源自2个实验。(D)在以0.6mM钙起博条件下,22日龄的BHM对异丙肾上腺素(1μmol/L)的变力响应。(E)在以0.6mM钙起博条件下,29-30日龄的BHM对异丙肾上腺素(1μmol/L)的变力响应。(F)年龄不同对异丙肾上腺素(1μmol/L)的变力响应的比较;对于22日龄组,n=11,源自4个实验;和对于29-30日龄组,n=7,源自2个实验;采用Student氏t-检验,*表示具有统计学显著差异(P<0.05)。
图5:BHM试验方案可用于所有所测试的PSC细胞系。(A、B、C)源自HES3-BHM的数据;(D、E、F)源自hIPS-G1-BHM的数据。(A、D)响应钙浓度的变化的等长颤搐张力(收缩力),每一细胞系n=4。(B、E)整体免疫染色。(C、F)心肌细胞和基质细胞的流式细胞术分析,每一细胞系n=3。
图6:多个hPSC细胞系的2D心肌分化。心肌细胞标记物(α-辅肌动蛋白,SIRPA)和基质细胞标记物(PDGFRα,α-SMA,I型胶原蛋白)的流式细胞术分析。
图7:采用BMP信号传导抑制作为实例,BHM可用于模拟发育过程。(A)在BHM形成的第13天的多个标记物的qPCR分析。(B)采用对α-辅肌动蛋白+细胞设门的流式细胞术分析细胞周期。(C)每个BHM的心肌细胞数。(D)响应钙浓度变化的等长颤搐张力(收缩力)。采用A+B)Student氏t-检验(n=3-4)或D)双因素ANOVA Sidak’s事后多重比较检验(two-wayANOVA Sidak’s Multiple Comparison post test),*表示与对照组相比,具有统计学显著差异(P<0.05)。
图8:用于2D心肌分化和BHM形成的试验方案的示意图。(A)用于图1所示的实验的试验方案。(B)用于图2所示的实验的试验方案。(C)用于图3所示的实验的试验方案—添加抗坏血酸。(D)用于图3所示的实验的试验方案—机械刺激和生长因子。(E)用于图3所示的实验的试验方案—添加钙离子。(F)用于图5所示的实验的试验方案。(G)用于图6所示的实验的试验方案。(H)用于图7所示的实验的试验方案。
图9:定制补充剂替代
以下实施例旨在进一步说明本发明,而不是限制本发明。实施例包含多个技术特征,应当理解本发明还涉及在这一示例部分中呈现的技术特征的组合。
图10:在心肌成熟期,具有TGFβ-1的培养基的补充以浓度依赖的方式(测试0.3-10ng/ml;n=5-7BHM/条件)增强BHM的收缩功能(FOC:收缩力)。
具体实施方式
已证明,非心肌细胞部分或基质细胞对工程化心脏组织的功能是必需的。为此,首先需要持续生产心肌细胞和成纤维细胞/基质细胞的心肌分化试验方案。在之前公开的2DhPSC分化试验方案(Hudson等,Stem Cells Dev 21,1513-1523(2012))的基础上,发明人针对产率和一致性对其心肌分化试验方案(图1a)进行了优化。若在中胚层诱导期稳定WNT的活性,则稳健性和效率将被提升是合理的。在培养的第3天,用qPCR分析中胚层诱导MESP1表达的替代标记物;随后在第16天,用流式细胞术分析α-辅肌动蛋白(心肌细胞标记物),发现其与博动活动量具有很好的关联。对于从之前公开的试验方案到新的试验方案的改进的最重要步骤示于图1。
早前的试验方案的前3天采用BMP4和激活素-A进行心肌中胚层诱导,随后采用WNT抑制剂IWP4进行心肌特异化(Hudson等,Stem Cells Dev 21,1513-1523(2012))。与在近期采用hPSC和体内发育的研究中发现FGF2是早期中胚层形成的必需要求相一致,在分化的前3天中5ng/ml FGF2的添加导致了MESP1表达呈升高趋势(图1b)和随后α-辅肌动蛋白呈升高趋势(图1c)。然而,与其在早期中胚层诱导中的必需角色一致的是,是增强的WNT信号传导帮助改善一致性和分化。为了增强WNT信号传导,采用CHIR99021,其是即使在典型WNT抑制剂存在的情况下,也诱导WNT信号传导的小分子GSK3β抑制剂。单独的CHIR或CHIR与用于图1b、图1c的分化因子一起不能诱导任何搏动活动。当改变BMP4浓度时,在BMP4浓度为5ng/ml时发现了最佳的和一致的MESP1诱导(图1d)和α-辅肌动蛋白表达(图1e)。然后将来自分化试验方案中的每一个因子单独移除,以证明其在MESP1有效和一致诱导(图1f)和随后的α-辅肌动蛋白表达(图1g)中的必要性。
为了形成BHM,基质细胞群的存在也非常重要。因此探讨了在优化的分化试验方案中是否存在基质细胞或其它潜在的污染细胞类型。对hPSC(OCT4,也称为POU5F1)(图1h)、内胚层(SOX17)(图1i)、神经(NEUROD1)(图1j)和早期中胚层(MESP1)(数据未给出)进行qPCR分析发现了非常低水平的潜在污染细胞群。与其它条件(无因子或不含IWP4,数据未给出)相比,在本发明的心肌分化培养物中发现了非常高度表达的NKX2-5和β-MHC(也称为MYH7)。此外发现了存在心肌细胞(图1k-l)和不同的基质细胞类型,包括:α-平滑肌肌动蛋白阳性细胞(α-SMA
在心肌分化试验方案优化之后,对这一假设验证其能否从hPSC直接形成BHM。采用具有另加的成熟步骤的新的无血清心肌分化试验方案(图1),其中将环(ring)从模型中移出并放置于静态拉伸器上(+10%的松弛长度),在含有5ng/ml FGF2和200μM抗坏血酸-2-磷酸(ASC-2-P)的培养基中。已发现这一试验方案在形成BHM中是有效的(图2a)。到第13天BHM开始在不同区域自发地收缩,到第15-17天所述收缩变为同步的和有节奏的,且所述收缩一直持续到第22天的分析(数据未给出)。BHM中的心肌细胞具有细长的和纹状的形态(图2b),且该BHM可电起博并具有响应钙浓度的可测量的收缩力(图2c)。
遵循已知发育途径的BHM发育。通过TRA-1-60
尽管概述于图2的BHM试验方案代表hPSC扩增和形成生物工程化心肌的第一个完全无血清过程,发明人假设优化能够产生具有更高功能性和更高一致性的组织。对于这些实验,由于颤搐张力依赖于各种各样的心肌特性,包括:心肌细胞数量和表型、成纤维细胞数量和表型、组织连接性、ECM组成、细胞-细胞连接性和ECM-细胞连接性,因此将收缩强度(颤搐张力/收缩力)看作功能的第一决定因素。以下作为发明人采用的第二因素:1)静息张力,因为其反映基质细胞功能和胞外基质生物学;2)心肌细胞尺寸,由于刺激如药物刺激;和3)细胞组成(心肌细胞:基质细胞),其是收缩性能的重要决定因素。发生改变的参数示于图3。
ASC-2-P增强BHM的功能性
抗坏血酸(维生素C)在胶原蛋白的适当合成中发挥主要作用,并且其为抗氧化剂。因此,考虑到胶原蛋白在发育中的重要性,假设在早期BHM培养、0-13天(在图2中,13-22天中已经添加了抗坏血酸)时补充的抗坏血酸(以更稳定形式的ASC-2-P)对BHM的功能性具有积极影响。结发现ASC-2-P显著地提高了BHM颤搐张力/收缩力(图3a),并在基质细胞部分没有改变的情况下诱导了心肌细胞部分呈升高趋势(图3b)。还发现在整个分化试验方案中,ASC-2-P的补充通过显著增加细胞的数量而不改变心肌分化的效率来改善发明人的2D试验方案中的分化(数据未给出)。因此,在2D和BHM形式中的ASC-2-P均可具有如最近研究(Cao等,Cell Res 22,219-236(2012))中所提出的增加的细胞存活性和/或祖细胞增殖。
BHM的功能依赖于机械刺激方案
接着,评估了静态拉伸和动态机械刺激如何影响BHM的功能。用于静态拉伸和动态机械刺激的装置示于图3d。静态拉伸和动态机械刺激都显著地增加BHM的颤搐张力/收缩力,并且两种机械刺激方案都导致了相似的BHM颤搐张力(图3c)。两种机械刺激方案均改善了BHM中心肌细胞的形态,导致形成紧密、细长的和纹状的肌束(图3d)。动态机械刺激优选于静态拉伸,因为其有利于增张力性收缩(Zimmermann等,Nat Med 12,452-458(2006))。
心肌细胞性能依赖于外源性生长因子
当加入FGF2时有降低颤搐张力/收缩力的趋势,而当加入TGFβ1时有增加颤搐张力的趋势(图3f)。因此,在于心肌成熟期间加入FGF2的早前实验中,这实际上不利于BHM的功能。发现FGF2和TGFβ1都诱导心肌细胞尺寸的增加(图3g)。TGFβ1的添加导致更成熟的β-MHC/α-MHC表达比率(人心脏=9)(图3h),而病理性肥大标记物ANP(也称为NPPA)下降(图3i)。FGF2的添加不改变β-MHC/α-MHC表达比率(图3h),但(可变地)诱导了病理性肥大标记物ANP(图3i)。这些一起表明两个因子都诱导肥大,这与体内结果一致。然而,FGF2可被看作病理性肥大诱导剂,而TGFβ1可被看作生理性肥大诱导剂。
在进一步的实验中,发明人探讨了,在心肌成熟期向培养基中补充浓度渐增的TGFβ-1是否对BHM的收缩功能有影响。发明人观察到了浓度依赖方式的BHM的收缩功能的增强(图10)。
与2D试验方案相比,发明人在早期的实验中发现BHM中的α-平滑肌肌动蛋白和I型胶原蛋白阳性细胞大量减少(图1n相对于图2e)。这可能是2D和BHM培养物中肌成纤维细胞/成纤维细胞的细微不同的反映。为了更均匀地检测hPSC来源的2D和BHM心肌分化培养物中心肌-成纤维细胞-样的细胞群,在接下来的实验中采用了针对典型CD90(也称为THY1)的抗体。
将细胞外钙调节至生理浓度改善了BHM的功能
人血清中的钙浓度受2.25-2.75mM和1.0-1.2mM(分别为总钙和离子钙)的生理钙浓度的严格调控。由于与生理钙相比,RPMI培养基中的钙浓度非常低(0.42mM),因此评估了游离钙浓度的调节是否改善BHM的成熟和功能性。将钙调节至1.2mM(采用0.2M CaCl
BHM可自发地和连贯地收缩,并能在直到至少3Hz的多个频率(覆盖在心脏发育期间观察到的搏动频率的范围)下电起博(图4a)。与Frank-Starling机制一致,响应静息长度(和静息张力)的增加(图4b),BHM还增加了颤搐张力(收缩力)。随着培养时间的增加,与之前的数据相比未发现BHM颤搐张力的改变,但是观察到了钙EC
接着,证明了优化的BHM(图5)和2D(图6)试验方案对多个hPSC细胞系起作用。对于这些分析,采用了HES2、HES3和hIPS-G1细胞系(采用无载体Cytotune重编程试剂盒重编程的牙髓成纤维细胞)。要着重注意的是,在2D和BHM试验方案中都发现,为了在初始24h接种期后使所有细胞系都达到相似的细胞密度,需要改变接种细胞数或使用Rho-相关的蛋白激酶抑制剂(10μM,Y-27632)(数据未给出)。当对特定细胞系应用所需的接种试验方案时,对这些细胞系可以不经修改而使用所述2D和BHM试验方案。
发现,与HES2细胞系(图3j)相比,HES3细胞系和hIPS细胞系生产具有较低的颤搐张力的BHM(图5a、图5d)。然而HES3和hIPS BHM具有相似的形态(图5b、图5e)。与HES2 BHM相比,HES3 BHM的心肌细胞部分与之相似(图5c),hIPS BHM的心肌细胞部分较低(图5f)。来自这些细胞系的BHM的功能性下降很可能是因为与HES2 BHM(0.74±0.13×10
即使采用由各种基因驱动的CRE将作用限制(或至少部分地限制)为发育中的心肌,BMP信号传导的抑制仍会导致胚胎死亡(综述请参见Kruithof等,Differentiation 84,89-102(2012))。在这些研究中,有多种归因于BMP信号传导的过程,包括:结构缺陷、包括小梁结构和壁厚的心肌性能、和包括祖基因的失调和上皮到间质转化(EMT)的下降的细胞表型。为了测定BMP信号传导仅对心肌发育的作用,而非对系统的影响和结构的限制,因此BHM被视为好的模型系统。
在这些实验中,添加2μmol/L的BMP受体信号传导抑制剂dorsomorphin,自第6天起更换每一培养液。在第13天时,dorsomorphin处理的BHM未能下调ISL1,而其他更成熟的心肌标记物NKX2-5和α-MHC的表达未改变(图7a)。当研究EMP相关基因时发现,CDH1、CHD2、SNAIL1或TGFβ2的表达未改变,这表明13天后的BHM中的EMT或调节EMT的因子未改变(图7a)。22天后使用流式细胞术发现,dorsomorphin处理的组中有更多的处于活跃细胞周期的心肌细胞(图7b)。但是发现,dorsomorphin的处理未改变心肌细胞数(图7c)。还发现,dorsomorphin处理的组中,每一BHM的总细胞数和心肌细胞(α-辅肌动蛋白
由于细胞周期活动的增加未导致心肌细胞数增加,也未导致颤搐张力下降,因此计算氧浓度是否可限制BHM中的心肌细胞数。为了确定是否是这种情况,基于文献中报道的模型和不同BHM条件下的参数(细胞数、心肌细胞部分和尺寸)得到数学建模的氧扩散情况。发现,当对对照BHM使用上述参数时,尽管心肌细胞数增加至125%,仍然无缺氧区(数据未给出)。
上述数据一起表明,采用dorsomorphin的BMP抑制导致了增殖状态的增加,这一结果与小鼠体内实验一致。但是心肌细胞数未增加,这表明细胞凋亡增加或心肌细胞为双核(bi-nucleating)。不论机制为何,BMP信号传导的抑制可重复地得到了产生较低收缩力(和每个心肌细胞的力也较低)和较差心肌组织的组织表型。
根据标准BHM试验方案,在无血清条件下从未分化的hESC产生BHM。所述标准的试验方案包括
结果显示
结论
采用在I型胶原蛋白水凝胶中的PSC的定向分化,本申请证明了在无血清条件下引导BHM组装是可能的。BHM具有多种应用,包括药物研究,发育过程、心脏成熟过程研究和潜在的再生应用。
在这些实施例中,通过采用多种培养形式和多个细胞系用于分化证明了该新开发的试验方案的稳健性。然而,应当注意的是,尽管实验-实验的分化效率一致,但当采用不同批次的试剂时则效率确实改变。因此,为了生产具有一致的和所定义性能的BHM用于体外和潜在的治疗应用,应慎重建立严格的试剂质量控制。
方法
从Gordon Keller获得HES2-ROSA26-RFP(Irion等,Nat Biotechnol 25,1477-1482(2007))细胞和从胚胎干细胞国际公司(Embryonic Stem Cell International,ESI,新加坡)获得HES3细胞。采用Cytotune重编程试剂盒(Applied Biosystems)并根据制造商的说明从源自人牙龈活检组织的成纤维细胞中产生hIPS。
对于IPS的产生,病毒转导后6天,将成纤维细胞平板接种在成纤维细胞培养基(DMEM高糖、2mmol/L谷氨酰胺、10%FBS(PAA)、100IU/ml青霉素、100μg/ml链霉素,除特别说明外的所有都来自Gibco)中的辐射的小鼠胚胎成纤维细胞上。第二天将上述培养基换为PSC-培养基(补充了20%敲除血清替代物(KSR,Gibco)、2mmol/L谷氨酰胺、100IU/ml青霉素、100μg/ml链霉素、1%非必需氨基酸(Gibco)和10ng/mL FGF2(Miltenyi Biotec)的敲除DMEM(Gibco))。机械地采集新出现的iPS群落并通过采用1mg/ml胶原蛋白酶NB6(CresentChemical Company)的每周传代来扩增。
对于实验,hPSC是在PSC-培养基中的辐射的人包皮成纤维细胞(HFF)上适应并培养的单个细胞,同时每天更换培养基并采用3分钟TrypLE(Gibco)处理(Ellerstrom等,StemCells 25,1690-1696(2007))每周传代。在表征实验或分化实验之前,将hPSC以对HES2细胞系而言2.5×10
采用测试试剂盒(Lonza)定期测试多能干细胞细胞系中的支原体并用标准测定对其表征。通过PCR(内源的OCT4、SOX2、KLF4、MYC),qPCR(OCT4、NANOG、REX1、DNMT3B)和免疫染色(OCT4、NANOG、TRA-1-60)来评估多能性标记物(Chan等,Nat Biotechnol 27,1033-1037(2009))。通过亚硫酸氢盐测序来证实OCT4启动子的去甲基化(Freberg等,Mol Biol Cell18,1543-1553(2007))。将核型分析用于确定是否存在任何遗传异常(Campos等,J Vis Exp4(2009))。通过从侧面注射4-6×10
对于分化实验,随后将hPSC在补充了1mmol/L丙酮酸钠、100IU青霉素、100μg/ml链霉素和2%B27补充剂(SF培养基,所有都来自Gibco)和各种所示因子的RPMI 1640中培养。用于这一研究的因子包括:L-抗坏血酸2磷酸倍半镁盐水合物(Sigma)、BMP4(R&DSystems)、激活素A(R&D Systems)、FGF2(Miltenyi Biotec)、dorsomorphin(Stemgent)、CHIR99021(Stemgent)、IWP4(Stemgent)和TGFβ1(Peprotech)。
对HES2细胞系进行心肌分化的优化。将HES2 hPSC以5×10
对HES2细胞系进行BHM形成的优化。将HES2 hPSC 1:1悬浮于的减去FGF-2的PSC-培养基和具有10ng/mL FGF2的HFF-条件培养基(HFF-CM–自5天汇集的辐射的HFF培养物中收获),并与I型胶原蛋白水凝胶混合。对于HES3和hIPS细胞系,向培养基中加入10μM的Y-27632。用酸溶的牛I型胶原蛋白(Devro)与等体积的2×DMEM(Gibco)配制I型胶原蛋白基质,并用0.1M氢氧化钠中和。配制hPSC/I型胶原蛋白基质,以得到1mg/ml的最终I型胶原蛋白浓度和5×10
通过用PBS冲洗,随后在具有20%胎牛血清(FBS,Applied Biosystems)的PBS中在1mg/ml的I型胶原蛋白酶(Sigma)中孵育1小时,将2D培养物分离。然后将细胞收集至试管中,用PBS冲洗并用0.25%胰蛋白酶-EDTA(Applied Biosystems)孵育5分钟,随后用含有FBS的培养基冲洗。
对于初始BHM消化试验方案,将BHM于37℃下在PBS的0.025mg/ml释放酶TM(Roche)、30mM的2,3-丁二酮一肟中分离60分钟。为了保持细胞表面标记物,采用与用于2D消化相同的试验方案分离BHM。
定量PCR(qPCR)
收获细胞、BHM或人心脏活检并贮藏在-80℃下直至采用Trizol(AppliedBiosystems)根据制造商的说明书提取RNA。然后用DNA酶(Roche)处理1μg的RNA,随后用高容量cDNA反转录试剂盒(Applied Biosystems)合成cDNA。
采用Fast SYBR Green Master Mix(Applied Biosystems)在384-孔形式的AB7900 HT(Applied Biosystems)上进行qPCR。由于我们发现GAPDH在我们所有的实验条件中都能一致性地表达,因此将其作为持家基因采用2
表1
1.Kattman等,Cell Stem Cell 8,228-240(2011)。
2.Neagoe等,Circulation 106,1333-1341(2002)。
3.Park等,Nature 451,141-146(2008)。
4.Freberg等,Mol Biol Cell 18,1543-1553(2007)。
将消化的心肌分化细胞平板接种在0.1%明胶包被的盖玻片,于20%FBS(Gibco)的补充了1mmol/L丙酮酸钠、100IU/ml青霉素和100μg/ml链霉素的RPMI 1640中放置24小时。然后在室温下,将细胞在Histofix(Roti)中固定10分钟。然后将细胞在5%FBS、1%牛血清白蛋白(Sigma)和0.5%Triton X-100(Sigma)的PBS(封闭缓冲液)中封闭30分钟。然后于室温下,在封闭缓冲液中用一级抗体将细胞染色90分钟,随后在封闭缓冲液和Hoechst中用二级抗体将细胞染色60分钟(表2)。采用蔡司710共聚焦显微镜(Zeiss 710confocalmicroscope)对染色的细胞进行成像。
表2抗体和染色剂(FC-流式细胞术,IF-免疫荧光)
于4℃下将BHM在Histofix中固定2-4小时。然后于4℃下,将BHM用一级抗体染色2-3天,随后用二级抗体和Phalloidin 546/Hoechst染色2-3天(表2)。采用蔡司710共聚焦显微镜对染色的BHM进行成像。
无论是活的细胞,还是在室温下用Histofix或乙醇固定了10分钟的细胞都被染色。对于细胞表面标记物(除TRA-1-60外),将细胞在5%FBS的PBS(细胞膜封闭缓冲液)中染色,而对于内部标记物将细胞在封闭缓冲液中染色。然后于4℃下,将细胞在封闭缓冲液中用一级抗体染色45分钟,随后在封闭缓冲液和Hoechst中用二级抗体染色30分钟(表2)。BDLSRII用于流式细胞术分析(BD Biosystems)。根据前向-侧向散射情况对活细胞群设门;基于Hoechst染色,对固定的细胞群设门。采用BD FACSDiva软件(BD Bioscience)或Cyflologic v1.2.1(Cyflo Ltd)分析。
在向含有(所有以mM表示):120NaCl、1MgCl
采用圆柱扩散的伪稳态近似值和浓度依赖的耗氧的数值分析来产生氧分布情况(方程1)。采用文献(Brown等,Biotechnol Bioeng 97,962-075(2007))中的和之前实验中所确定的参数(表3)。采用应用求解程序bvp4c和奇异项选择的MATLAB V12(Mathworks)进行数值分析和绘图。
方程1
表3:氧扩散模型参数
文献5.Brown等,Biotechnol Bioeng 97,962-975(2007)。
所有数据均以平均值±s.e.m表示。采用Graph Pad Prism或微软Excel将合适的统计分析用于图例中所示的每一数据集。
表4:定制补充剂(CMS)替代B27
在细胞培养合格的水中制备25×
参考文献列表
Kehat,I.等,Human embryonic stem cells can differentiate into myocyteswith structural and functional properties of cardiomyocytes.J Clin Invest108,407-414(2001)。
Takahashi,K.等,Induction of pluripotent stem cells from adult humanfibroblasts by de-fined factors.Cell 131,861-872(2007)。
Zhang,J.等,Functional cardiomyocytes derived from human inducedpluripotent stem cells.Circ Res 104,e30-41(2009)。
Thomson,J.A.等,Embryonic stem cell lines derived from humanblastocysts.Science 282,1145-1147(1998)。
Lian,X.,Zhang,J.,Zhu,K.,Kamp,T.J.&Palecek,S.P.Insulin InhibitsCardiac Mesoderm,not Mesendoderm,formation during Cardiac Differentiation ofHuman Pluripotent Stem Cells and Modulation of Canonical Wnt Signaling CanRescue this Inhibition.Stem Cells 31(3),447-457(2013)。Schaaf,S.等,Humanengineered heart tissue as a versatile tool in basic research and pre-clinical toxicology.PLoS ONE 6,20(2011)。
Carvajal-Vergara,X.等,Patient-specific induced pluripotent stem-cell-derived models of LEOPARD syndrome.Nature 465,808-812(2010)。
Itzhaki,I.等,Modelling the long QT syndrome with induced pluripotentstemcells.Nature 471,225-229(2011)。
Malan,D.,Friedrichs,S.,Fleischmann,B.K.&Sasse,P.Cardiomyocytesobtained from in-duced pluripotent stem cells with long-QT syndrome3recapitulate typical disease-specific features In Vitro.Circ Res 109(8),841-847(2011)。
Moretti,A.等,Patient-specific induced pluripotent stem-cell modelsfor long-QT syndrome.N Engl J Med 363,1397-1409(2010)。
Yazawa,M.等,Using induced pluripotent stem cells to investigatecardiac phenotypes in Timothy syndrome.Nature 471,230-234(2010)。
Bird,S.D.等,The human adult cardiomyocyte phenotype.Cardiovasc Res58,423-434(2003)。
Eschenhagen,T.等,Three-dimensional reconstitution of embryoniccardiomyocytes in a collagen matrix:a new heart muscle model system.FASEB J11,683-694(1997)。
Zimmermann,W.H.等,Tissue engineering of a differentiated cardiacmuscle construct.Circ Res 90,223-230(2002)。
Tulloch,N.L.等,Growth of engineered human myocardium with mechanicalloading and vascular coculture.Circ Res 109,47-59(2011)。
Tiburcy,M.等,Terminal differentiation,advanced organotypicmaturation,and modeling of hypertrophic growth in engineered hearttissue.Circ Res 109,1105-1114(2011)。
Eschenhagen,T.,Eder,A.,Vollert,I.&Hansen,A.Physiological aspects ofcardiac tissue engineering.Am J Physiol Heart Circ Physiol 303,11(2012)。
Hudson,J.E.,Brooke,G.,Blair,C.,Wolvetang,E.&Cooper-White,J.J.Development of my-ocardial constructs using modulus-matched acrylatedpolypropylene glycol triol substrate and different nonmyocyte cellpopulations.Tissue Eng Part A 17,2279-2289(2011)。
Hudson,J.,Titmarsh,D.,Hidalgo,A.,Wolvetang,E.&Cooper-White,J.Primitive cardiac cells from human embryonic stem cells.Stem Cells Dev 21,1513-1523(2012)。
Cao,N.等,Ascorbic acid enhances the cardiac differentiation ofinduced pluripotent stem cells through promoting the proliferation of cardiacprogenitor cells.Cell Res 22,219-236(2012)。
Kruithof,B.P.,Duim,S.N.,Moerkamp,A.T.&Goumans,M.J.TGFbeta and BMPsignaling in cardiac cushion formation:lessons from mice andchicken.Differentiation 84,89-102(2012)。
Brown,D.A.等,Analysis of oxygen transport in a diffusion-limitedmodel of engineered heart tissue.Biotechnol Bioeng 97,962-975(2007)。
Ellerstrom,C.,Strehl,R.,Noaksson,K.,Hyllner,J.&Semb,H.Facilitatedexpansion of hu-man embryonic stem cells by single-cell enzymaticdissociation.Stem Cells 25,1690-1696(2007)。
Chan,E.M.等,Live cell imaging distinguishes bona fide human iPS cellsfrom partially reprogrammed cells.Nat Biotechnol 27,1033-1037(2009)。
Freberg,C.T.,Dahl,J.A.,Timoskainen,S.&Collas,P.Epigeneticreprogramming of OCT4 and NANOG regulatory regions by embryonal carcinomacell extract.Mol Biol Cell 18,1543-1553(2007)。
Campos,P.B.,Sartore,R.C.,Abdalla,S.N.&Rehen,S.K.Chromosomal spreadpreparation of human embryonic stem cells for karyotyping.J Vis Exp 4(2009)。
Kattman,S.J.等,Stage-specific optimization of activin/nodal and BMPsignaling promotes cardiac differentiation of mouse and human pluripotentstem cell lines.Cell Stem Cell 8,228-240(2011)。
Neagoe,C.等,Titin isoform switch in ischemic human heartdisease.Circulation 106,1333-1341(2002)。
Park,I.H.等,Reprogramming of human somatic cells to pluripotency withdefined factors.Nature 451,141-146(2008)。
Thomson,J.A.,等,Embryonic stem cell lines derived from humanblastocysts.Science 282,1145-1147(1998)。
Takahashi,K.&Yamanaka,S.Induction of pluripotent stem cells frommouse embryonic and adult fibroblast cultures by defined factors.Cell 126,663-676(2006)。
Didié等,Parthenogenetic stem cells for tissue-engineered heartrepair.J Clin Invest.123,1285-1298(2013)。
Irion,S等,Identification and targeting of the ROSA26 locus in humanembryonic stem cells.Nat Biotechnol 25,1477-1482(2007)。
Naito,H.等,Optimizing engineered heart tissue for therapeuticapplications as surrogate heart muscle.Circulation 114,I72-78(2006)。
Zimmermann W.H.等,Three-dimensional engineered heart tissue fromneonatal rat cardiac myocytes.Biotechnol Bioeng 68,106-114(2000)。
Zimmermann W.H.等,Engineered heart tissue grafts improve systolic anddiastolic function in infarcted rat hearts.Nat Med 12,452-458(2006)。
序列表
<110> 修复股份有限公司
<120> 一种多能干细胞定向分化为功能性心肌的方法
<130> LC16310010P-D
<150> EP13185344.2
<151> 2013-09-20
<160> 80
<170> PatentIn version 3.5
<210> 1
<211> 22
<212> DNA
<213> 人工
<220>
<223> 引物 GAPDH F
<400> 1
cctcaagatc atcagcaatg cc 22
<210> 2
<211> 19
<212> DNA
<213> 人工
<220>
<223> 引物 GAPDH R
<400> 2
atgttctgga gagccccgc 19
<210> 3
<211> 19
<212> DNA
<213> 人工
<220>
<223> 引物 OCT4 F
<400> 3
cagtgcccga aacccacac 19
<210> 4
<211> 20
<212> DNA
<213> 人工
<220>
<223> 引物 OCT4 R
<400> 4
ggagacccag cagcctcaaa 20
<210> 5
<211> 20
<212> DNA
<213> 人工
<220>
<223> 引物 NANOG F
<400> 5
cagaaggcct cagcacctac 20
<210> 6
<211> 20
<212> DNA
<213> 人工
<220>
<223> 引物 NANOG R
<400> 6
attgttccag gtctggttgc 20
<210> 7
<211> 23
<212> DNA
<213> 人工
<220>
<223> 引物 REX1 F
<400> 7
caccgcctcc cttgggaatt cag 23
<210> 8
<211> 24
<212> DNA
<213> 人工
<220>
<223> 引物 REX1 R
<400> 8
tgttctgttc acacaggctc cagc 24
<210> 9
<211> 23
<212> DNA
<213> 人工
<220>
<223> 引物 DNMT3B F
<400> 9
ggcccaagta aacctagctc ggc 23
<210> 10
<211> 23
<212> DNA
<213> 人工
<220>
<223> 引物 DNMT3B R
<400> 10
atgcctggtg tctcccttca tgc 23
<210> 11
<211> 20
<212> DNA
<213> 人工
<220>
<223> 引物 MIXL1 F
<400> 11
ccgagtccag gatccaggta 20
<210> 12
<211> 19
<212> DNA
<213> 人工
<220>
<223> 引物 MIXL1 R
<400> 12
ctctgacgcc gagacttgg 19
<210> 13
<211> 21
<212> DNA
<213> 人工
<220>
<223> 引物 NKX2-5 F
<400> 13
acaacttcgt gaacttcggc g 21
<210> 14
<211> 22
<212> DNA
<213> 人工
<220>
<223> 引物 NKX2-5 R
<400> 14
gtggacactc ccgagttgct ct 22
<210> 15
<211> 20
<212> DNA
<213> 人工
<220>
<223> 引物 TBX5 F
<400> 15
tcataaccaa ggctggaagg 20
<210> 16
<211> 20
<212> DNA
<213> 人工
<220>
<223> 引物 TBX5 R
<400> 16
gcccgtcaca gaccatttat 20
<210> 17
<211> 20
<212> DNA
<213> 人工
<220>
<223> 引物 ISL1 F
<400> 17
cgccttgcag agtgacatag 20
<210> 18
<211> 20
<212> DNA
<213> 人工
<220>
<223> 引物 ISL1 R
<400> 18
ggactggcta ccatgctgtt 20
<210> 19
<211> 20
<212> DNA
<213> 人工
<220>
<223> 引物 MYH6 F
<400> 19
ctcctcctac gcaactgccg 20
<210> 20
<211> 21
<212> DNA
<213> 人工
<220>
<223> 引物 MYH6 R
<400> 20
cgacaccgtc tggaaggatg a 21
<210> 21
<211> 20
<212> DNA
<213> 人工
<220>
<223> 引物 MYH7 F
<400> 21
gaccagatga atgagcaccg 20
<210> 22
<211> 21
<212> DNA
<213> 人工
<220>
<223> 引物 MYH7 R
<400> 22
ggtgaggtcg ttgacagaac g 21
<210> 23
<211> 20
<212> DNA
<213> 人工
<220>
<223> 引物 MLC2v F
<400> 23
ggcgccaact ccaacgtgtt 20
<210> 24
<211> 20
<212> DNA
<213> 人工
<220>
<223> 引物 MLC2v R
<400> 24
acgttcactc gcccaagggc 20
<210> 25
<211> 21
<212> DNA
<213> 人工
<220>
<223> 引物 ACTA1 F
<400> 25
acccagatca tgtttgagac c 21
<210> 26
<211> 20
<212> DNA
<213> 人工
<220>
<223> 引物 ACTA1 R
<400> 26
tcataaatgg gcacgttgtg 20
<210> 27
<211> 20
<212> DNA
<213> 人工
<220>
<223> 引物 NPPA F
<400> 27
tctgccctcc taaaaagcaa 20
<210> 28
<211> 20
<212> DNA
<213> 人工
<220>
<223> 引物 NPPA R
<400> 28
tgtcctccct ggctgttatc 20
<210> 29
<211> 21
<212> DNA
<213> 人工
<220>
<223> 引物 CASQ2 F
<400> 29
tcttgcaggg cagaagaggg g 21
<210> 30
<211> 21
<212> DNA
<213> 人工
<220>
<223> 引物 CASQ2 R
<400> 30
ggacctgggc cacaagctca a 21
<210> 31
<211> 20
<212> DNA
<213> 人工
<220>
<223> 引物 NEUROD1 F
<400> 31
agccacggat caatcttctc 20
<210> 32
<211> 20
<212> DNA
<213> 人工
<220>
<223> 引物 NEUROD1 R
<400> 32
gcgtgcctct aatcatgaaa 20
<210> 33
<211> 20
<212> DNA
<213> 人工
<220>
<223> 引物 CDH1 F
<400> 33
gaacgcattg ccacatacac 20
<210> 34
<211> 20
<212> DNA
<213> 人工
<220>
<223> 引物 CDH1 R
<400> 34
attcgggctt gttgtcattc 20
<210> 35
<211> 20
<212> DNA
<213> 人工
<220>
<223> 引物 CDH2 F
<400> 35
cctggaacgc agtgtacaga 20
<210> 36
<211> 20
<212> DNA
<213> 人工
<220>
<223> CDH2 R
<400> 36
tggtttgacc acggtgacta 20
<210> 37
<211> 20
<212> DNA
<213> 人工
<220>
<223> 引物 SNAIL1 F
<400> 37
agcgagctgc aggactctaa 20
<210> 38
<211> 20
<212> DNA
<213> 人工
<220>
<223> 引物 SNAIL1 R
<400> 38
ggacagagtc ccagatgagc 20
<210> 39
<211> 23
<212> DNA
<213> 人工
<220>
<223> 引物 MESP1 F
<400> 39
agcccaagtg acaagggaca act 23
<210> 40
<211> 24
<212> DNA
<213> 人工
<220>
<223> MESP1 R
<400> 40
aaggaaccac ttcgaaggtg ctga 24
<210> 41
<211> 24
<212> DNA
<213> 人工
<220>
<223> 引物 SOX17 F
<400> 41
aggaaatcct cagactcctg ggtt 24
<210> 42
<211> 24
<212> DNA
<213> 人工
<220>
<223> 引物 SOX17 R
<400> 42
cccaaactgt tcaagtggca gaca 24
<210> 43
<211> 20
<212> DNA
<213> 人工
<220>
<223> 引物 ATP2A2 F
<400> 43
acctcatctc gtccaacgtc 20
<210> 44
<211> 20
<212> DNA
<213> 人工
<220>
<223> 引物 ATP2A2 R
<400> 44
tgtcaccaga ttgacccaga 20
<210> 45
<211> 20
<212> DNA
<213> 人工
<220>
<223> 引物 PLN F
<400> 45
acagctgcca aggctaccta 20
<210> 46
<211> 20
<212> DNA
<213> 人工
<220>
<223> PLN R
<400> 46
tccatgatac cagcaggaca 20
<210> 47
<211> 20
<212> DNA
<213> 人工
<220>
<223> 引物 RYR2 F
<400> 47
tgcaagactc accgaagatg 20
<210> 48
<211> 20
<212> DNA
<213> 人工
<220>
<223> 引物 RYR2 R
<400> 48
ccacccagac attagcaggt 20
<210> 49
<211> 20
<212> DNA
<213> 人工
<220>
<223> 引物 COL1A1 F
<400> 49
gtgctaaagg tgccaatggt 20
<210> 50
<211> 20
<212> DNA
<213> 人工
<220>
<223> 引物 COL1A1 R
<400> 50
accaggttca ccgctgttac 20
<210> 51
<211> 20
<212> DNA
<213> 人工
<220>
<223> 引物 COL3A1 F
<400> 51
ccaggagcta acggtctcag 20
<210> 52
<211> 20
<212> DNA
<213> 人工
<220>
<223> 引物 COL3A1 R
<400> 52
cagggtttcc atctcttcca 20
<210> 53
<211> 20
<212> DNA
<213> 人工
<220>
<223> 引物 COL5A1 F
<400> 53
gacacctcca actcctccaa 20
<210> 54
<211> 20
<212> DNA
<213> 人工
<220>
<223> 引物 COL5A1 R
<400> 54
agtgaactcc ccctccaagt 20
<210> 55
<211> 20
<212> DNA
<213> 人工
<220>
<223> 引物 COL4A1 F
<400> 55
gttggtctac cgggactcaa 20
<210> 56
<211> 20
<212> DNA
<213> 人工
<220>
<223> 引物 COL4A1 R
<400> 56
gttcacctct gatcccctga 20
<210> 57
<211> 20
<212> DNA
<213> 人工
<220>
<223> 引物 LAMC1 F
<400> 57
gtgagaggtg ccgagagaac 20
<210> 58
<211> 20
<212> DNA
<213> 人工
<220>
<223> 引物 LAMC1 R
<400> 58
gtgcttagag agcccacagg 20
<210> 59
<211> 20
<212> DNA
<213> 人工
<220>
<223> 引物 TGFB2 F
<400> 59
cgaacccaaa gggtacaatg 20
<210> 60
<211> 20
<212> DNA
<213> 人工
<220>
<223> 引物 TGFB2 R
<400> 60
taagctcagg accctgctgt 20
<210> 61
<211> 22
<212> DNA
<213> 人工
<220>
<223> 引物 TTN Ex49-50 F
<400> 61
gtaaaaagag ctgccccagt ga 22
<210> 62
<211> 21
<212> DNA
<213> 人工
<220>
<223> 引物 TTN Ex49-50 R
<400> 62
gctaggtggc ccagtgctac t 21
<210> 63
<211> 19
<212> DNA
<213> 人工
<220>
<223> 引物 TTN Ex107-108 F
<400> 63
cagcagaact cagaatcga 19
<210> 64
<211> 21
<212> DNA
<213> 人工
<220>
<223> 引物 TTN Ex107-108 R
<400> 64
atcaaaggac acttcacact c 21
<210> 65
<211> 21
<212> DNA
<213> 人工
<220>
<223> 引物 TTN Ex50-219 F
<400> 65
ccaatgagta tggcagtgtc a 21
<210> 66
<211> 21
<212> DNA
<213> 人工
<220>
<223> 引物 TTN Ex50-219 R
<400> 66
tacgttccgg aagtaatttg c 21
<210> 67
<211> 20
<212> DNA
<213> 人工
<220>
<223> 引物 endoOCT4 F
<400> 67
cctcacttca ctgcactgta 20
<210> 68
<211> 20
<212> DNA
<213> 人工
<220>
<223> 引物 endoOCT4 R
<400> 68
caggttttct ttccctagct 20
<210> 69
<211> 19
<212> DNA
<213> 人工
<220>
<223> 引物 endoSOX2 F
<400> 69
cccagcagac ttcacatgt 19
<210> 70
<211> 20
<212> DNA
<213> 人工
<220>
<223> 引物 endoSOX2 R
<400> 70
cctcccattt ccctcgtttt 20
<210> 71
<211> 20
<212> DNA
<213> 人工
<220>
<223> 引物 endoKLF4 F
<400> 71
gatgaactga ccaggcacta 20
<210> 72
<211> 20
<212> DNA
<213> 人工
<220>
<223> 引物 endoKLF4 R
<400> 72
gtgggtcata tccactgtct 20
<210> 73
<211> 20
<212> DNA
<213> 人工
<220>
<223> 引物 endoMYC F
<400> 73
tgcctcaaat tggactttgg 20
<210> 74
<211> 22
<212> DNA
<213> 人工
<220>
<223> 引物 endoMYC R
<400> 74
gattgaaatt ctgtgtaact gc 22
<210> 75
<211> 22
<212> DNA
<213> 人工
<220>
<223> 引物 SeV F
<400> 75
ggatcactag gtgatatcga gc 22
<210> 76
<211> 29
<212> DNA
<213> 人工
<220>
<223> 引物 SeV R
<400> 76
accagacaag agtttaagag atatgtatc 29
<210> 77
<211> 25
<212> DNA
<213> 人工
<220>
<223> 引物 BS OCT4-2 F
<400> 77
ttaggaaaat gggtagtagg gattt 25
<210> 78
<211> 30
<212> DNA
<213> 人工
<220>
<223> 引物 BS OCT4-2 R
<400> 78
tacccaaaaa acaaataaat tataaaacct 30
<210> 79
<211> 27
<212> DNA
<213> 人工
<220>
<223> 引物 BS OCT4-4 F
<400> 79
ggatgttatt aagatgaaga tagttgg 27
<210> 80
<211> 25
<212> DNA
<213> 人工
<220>
<223> 引物 BS OCT4-4 R
<400> 80
cctaaactcc ccttcaaaat ctatt 25
