一种茶树花青素还原酶蛋白抗原多肽及其抗体、检测试剂盒和应用
文献发布时间:2023-06-19 09:26:02
技术领域
本发明属于蛋白质检测技术领域,具体涉及一种茶树花青素还原酶蛋白抗原多肽及其抗体、检测试剂盒和应用。
背景技术
花青素还原酶1(Anthocyanidin reductase 1,ANR1)和花青素还原酶2(Anthocyanidin reductase 2,ANR2),ANR1和ANR2作为类黄酮生物合成代谢途径的结构酶之一。ANR1和ANR2均能够将矢车菊素催化形成儿茶素(C)和表儿茶素(EC),飞燕草色素催化成没食子儿茶素(GC)和表没食子儿茶素(EGC),因此,ANR1和ANR2均具有差向异构酶活性。ANR1和ANR2不仅是植物体内花青素代谢的关键酶,还对植物体内儿茶素合成积累起到关键调节作用。而茶树中花青素和儿茶素等类黄酮物质含量会因生长条件、品种及组织部位的不同而存在差异,这可能是由于ANR1和ANR2酶基因表达的差异,也可能是ANR1和ANR2蛋白表达上的差异。
从蛋白质表达水平上对后续研究和解释不同茶树品种,或者茶树不同组织、部位花青素和儿茶素等含量的差异有着重要的价值。然而,目前关于ANR1和ANR2蛋白水平上的研究仍然有限,并且没有针对ANR1和ANR2的商业化抗体出售,也不能检测其在蛋白水平上的表达情况,无法在蛋白表达水平上揭示ANR1和ANR2对茶树不同品种,不同组织、部位花青素和儿茶素等物质合成的调控作用。
发明内容
为了克服现有技术的不足和缺点,本发明的首要目的在于提供一种茶树花青素还原酶蛋白抗原多肽。
本发明的另一目的在于提供一种茶树花青素还原酶蛋白的免疫抗原和检测抗原。
本发明的再一目的在于提供一种抗茶树花青素还原酶蛋白的抗体。
本发明的第四个目的在于提供上述茶树花青素还原酶蛋白抗原多肽、免疫抗原、检测抗原和抗体的应用。
本发明的第五个目的在于提供一种茶树花青素还原酶的检测试剂盒,该试剂盒可实现商品化快速检测的目的。
本发明的目的通过下述技术方案实现:
一种茶树花青素还原酶蛋白抗原多肽,为茶树花青素还原酶1(ANR1)抗原多肽和花青素还原酶2(ANR2)蛋白抗原多肽中的至少一种,其中,茶树花青素还原酶1抗原多肽的氨基酸序列如SEQ ID No.1所示,茶树花青素还原酶2抗原多肽的氨基酸序列如SEQ IDNo.2所示;
一种茶树花青素还原酶蛋白的免疫抗原,为将上述茶树花青素还原酶蛋白抗原多肽与载体蛋白通过酰胺键偶联得到;
所述载体蛋白包优选为卵清蛋白或血蓝蛋白;
所述的偶联优选为SMCC法;
一种茶树花青素还原酶蛋白的检测抗原,为将上述茶树花青素还原酶蛋白抗原多肽与载体蛋白通过酰胺键偶联得到;
所述载体蛋白优选为牛血清白蛋白;
所述的偶联优选为戊二醛法;
一种抗茶树花青素还原酶蛋白抗原的抗体,为由上述茶树花青素还原酶蛋白的免疫抗原免疫动物产生的抗体;
所述的抗体优选为单克隆抗体和多克隆抗体中的至少一种;
在具体实施例中,所述的抗茶树花青素还原酶蛋白抗原的抗体,通过如下方法制备得到:
(1)将稀释后的上述茶树花青素还原酶蛋白的免疫抗原用福氏完全佐剂按体积比1:1的比例乳化后,在两只新西兰大白兔颈背部皮下进行多点注射免疫,免疫后间隔两周;
(2)首次免疫两周后,将稀释后的免疫抗原用福氏不完全佐剂按体积比1:1的比例乳化,然后对步骤(1)中免疫后的两只新西兰大白兔颈背部皮下进行多点注射免疫;免疫3次,每次间隔2周;
(3)采血,获得血清,纯化,得到抗茶树花青素还原酶蛋白抗原的抗体;
一种分泌上述抗茶树花青素还原酶蛋白抗原的抗体的杂交瘤细胞,由具有产生上述抗茶树花青素还原酶蛋白抗原的抗体的细胞同骨髓瘤细胞融合得到;
所述的茶树花青素还原酶蛋白抗原多肽、检测抗原、抗茶树花青素还原酶蛋白抗原的抗体在茶树花青素还原酶检测领域中的应用;
一种基于免疫反应技术的茶树花青素还原酶检测试剂盒,包含上述茶树花青素还原酶蛋白的检测抗原和/或上述抗茶树花青素还原酶蛋白抗原的抗体;
所述的免疫反应技术优选为免疫层析技术、ELISA技术、western-blot、免疫荧光原位杂交或免疫组化;
本发明相对于现有技术具有如下的优点及效果:
(1)本发明提供了茶树花青素还原酶1和花青素还原酶2蛋白抗原多肽,其氨基酸序列如SEQ ID No.1和SEQ ID No.2所示。本发明基于对不同茶树间ANR1和ANR2蛋白序列的保守结构域分析,找出不同茶树间ANR1一致氨基酸序列以及不同茶树间ANR2一致氨基酸序列,再比对ANR1和ANR2的差异氨基酸序列,并对一致氨基酸序列进行免疫原性、亲疏水性、表面可及性等分析,确定合适的一段胞内区多肽的氨基酸序列为抗原。经过验证该免疫抗原多肽能够免疫动物产生特异性抗体,且抗体效价较为理想,因此,本发明提供的抗原多肽具有较强的免疫原性,为在蛋白质表达水平上检测茶树花青素还原酶1和花青素还原酶2提供有效的检测物质。
(2)本发明提供了一种茶树花青素还原酶1和花青素还原酶2蛋白的免疫抗原,所述免疫抗原为将所述抗原多肽与载体蛋白通过酰胺键偶联得到;所述载体蛋白包括卵清蛋白或血蓝蛋白。在具体实施例中,本发明通过人工合成所述抗原多肽,再与马来酰亚氨活化的载体KLH偶联,将此偶联产物进行脱盐柱纯化后免疫新西兰大白兔能够产生效价理想且特异性识别ANR1和ANR2蛋白的抗体。
(3)本发明提供的抗茶树花青素还原酶1和花青素还原酶2蛋白抗原的抗体,为由所述免疫抗原免疫动物产生的抗体。在具体实施例中,采用所述免疫抗原多次免疫新西兰大白兔后,得到的兔源血清用ELISA法对抗体效价进行检测,效价达理想值后收集免疫兔源血清,并用Protein G蛋白纯化柱纯化抗体;对纯化后抗体进行特异性反应鉴定,鉴定结果表明产生的抗体可特异性识别ANR1和ANR2蛋白。
(4)本发明制备ANR1和ANR2抗体意义非常重大,不仅可以为该蛋白的功能研究奠定基础,同时对茶树体内后续开展类黄酮等物质代谢相关研究具有积极的参考意义。
附图说明
图1是ANR1和ANR2蛋白Western-blot分析图;其中,A为ANR1蛋白Western-blot分析结果,M代表标准预染蛋白,泳道1~8代表ANR1蛋白;B为茶树Actin总蛋白(内参用,由Actin抗体检测)Western-blot分析结果,M代表标准预染蛋白,泳道1~7代表Actin总蛋白;C为ANR2蛋白Western-blot分析结果,M代表标准预染蛋白,泳道1~8代表ANR2蛋白;D为茶树Actin总蛋白(内参用,由Actin抗体检测)Western-blot分析结果,M代表标准预染蛋白,泳道1~8代表茶树Actin总蛋白。
图2是本发明实施例提供的ANR1和ANR2蛋白抗原多肽的制备方法流程图。
具体实施方式
下面结合实施例及附图对本发明作进一步详细的描述,但本发明的实施方式不限于此。
本发明提供了茶树花青素还原酶1和花青素还原酶2蛋白抗原多肽,所述的花青素还原酶1多肽的氨基酸序列如SEQ ID No.1所示(C-NQKKTSHLL-ALKGS-NH
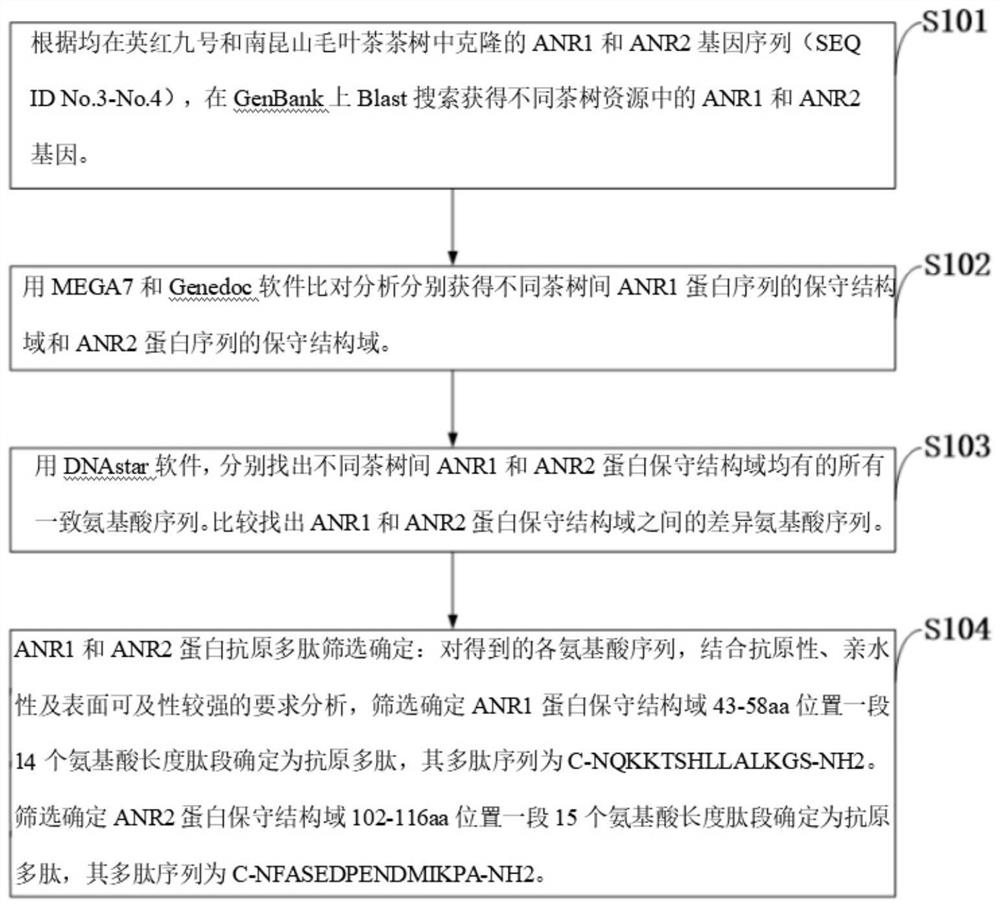
在本发明中,所述ANR1和ANR2蛋白抗原多肽的筛选方法见图2,包括以下步骤:
S101:根据均在英红九号和南昆山毛叶茶茶树中克隆的ANR1和ANR2基因序列(SEQID No.3~No.4),在GenBank上Blast搜索获得不同茶树资源中的ANR1和ANR2基因。
S102:用MEGA7和Genedoc软件比对分析分别获得不同茶树间ANR1蛋白序列的保守结构域和ANR2蛋白序列的保守结构域。
S103:用DNAstar软件,分别找出不同茶树间ANR1和ANR2蛋白保守结构域均有的所有一致氨基酸序列。比较找出ANR1和ANR2蛋白保守结构域之间的差异氨基酸序列。
S104:ANR1和ANR2蛋白抗原多肽筛选确定:对得到的各氨基酸序列,结合抗原性、亲水性及表面可及性较强的要求分析,筛选确定ANR1蛋白保守结构域43~58aa位置一段14个氨基酸长度肽段确定为抗原多肽,其多肽序列为C-NQKKTSHLLALKGS-NH
筛选确定ANR2蛋白保守结构域102~116aa位置一段15个氨基酸长度肽段确定为抗原多肽,其多肽序列为C-NFASEDPENDMIKPA-NH
本发明提供了一种茶树花青素还原酶1和花青素还原酶2蛋白的免疫抗原,所述免疫抗原为应用SMCC法(叶健强,余华,康润敏,严玉宝,谢晶,胡娟,廖党金,周岷江,肖璐,崔鹏博,曹冶,叶勇刚,于吉锋,李兴玉,林毅,潘梦,魏甬,戴卓建.恩拉霉素人工抗原的合成与鉴定[J].湖北农业科学,2019,58(07):92-95+156.)将上述抗原多肽与载体蛋白通过酰胺键偶联得到;所述载体蛋白包括卵清蛋白或血蓝蛋白。本发明还提供了一种茶树花青素还原酶1和花青素还原酶2蛋白的检测抗原,所述检测抗原为应用戊二醛法(谭兴梅.环鸟苷酸(cGMP)兔单抗的制备及竞争ELISA测定方法的建立[D].浙江大学,2016.)将所述多肽与载体蛋白通过酰胺键偶联得到;所述载体蛋白包括牛血清白蛋白。
在本发明中,由于化学合成的多肽抗原是小分子,属于半抗原,本身很难具有好的抗原性,只能诱导动物产生很弱的免疫反应,因此与载体蛋白交联是很重要的。载体蛋白含有很多抗原决定基,能够刺激T辅助细胞,进而诱导B细胞反应。用于与多肽交联的载体蛋白有多种,其中最普遍使用的载体是匙孔血蓝蛋白(keyhole limpet hemacyanin,KLH),牛血清白蛋白(bovine serumalbumin,BSA),卵清蛋白(ovalbumin,OVA)和牛甲状腺球蛋白(bovine thyroglobulin,THY)。试验证明,KLH具有更高的抗原性,与本发明的ANR1和ANR2抗原多肽交联后免疫原性最强,因此本发明选用KLH作为偶联载体蛋白制备免疫抗原。而BSA作为多肽载体蛋白,由于BSA经常被用做检测试验的阻断剂而使得该方法生产的抗体在应用上存在着一定的局限性,因此,采用BSA作为载体蛋白用于制备检测抗原。
本发明提供了一种抗茶树花青素还原酶1和花青素还原酶2蛋白抗原的抗体,由上述免疫抗原免疫动物产生的抗体。所述抗体优选包括单克隆抗体和多克隆抗体。所述多克隆抗体的制备方法优选包含如下步骤:对上述免疫抗原进行稀释至1mg/mL,用福氏完全佐剂按体积比1:1的比例乳化后,在两只新西兰大白兔颈背部皮下进行多点注射(每只注射1mL)免疫,免疫4次,每次间隔2周,并采血运用ELISA方法检测抗体效价;待抗体效价达1:80000后,收集血清经过纯化、ELISA和western blot鉴定后,得到抗ANR1和ANR2的多克隆抗体。当所述抗体为单克隆抗体时,本发明提供了一种分泌所述抗体的杂交瘤细胞。所述抗体经ANR1和ANR2的ELISA、Western bot、免疫荧光染色等实验证明其能识别ANR1和ANR2蛋白。所述ANR1和ANR2蛋白的多克隆抗体为进一步研究ANR1和ANR2蛋白的功能奠定了基础。
本发明提供了所述茶树花青素还原酶蛋白抗原多肽、所述检测抗原、所述抗体在茶树花青素还原酶检测领域中的应用。
本发明提供了一种基于免疫反应技术的茶树花青素还原酶1和花青素还原酶2检测试剂盒,包括所述检测抗原和/或所述抗体。本发明对所述免疫反应技术没有特殊限制,凡是利用抗原抗体结合形成复合物的检测方法均适用,例如包括免疫层析技术、ELISA技术、western-blot、免疫荧光原位杂交或免疫组化。本发明对所述试剂盒的制备方法没有特殊限制,采用本领域所熟知的制备方法即可。本发明对所述试剂盒的使用方法没有特殊限制,采用本领域所熟知的试剂盒的使用方法即可。
下面结合实施例对本发明提供的茶树花青素还原酶1和花青素还原酶2蛋白抗原多肽及其抗体、检测试剂盒和应用进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。
实施例1ANR1和ANR2蛋白多肽的设计及合成
(1)根据均在英红九号和南昆山毛叶茶茶树中克隆的ANR1和ANR2基因序列(SEQID No.3~No.4),在GenBank上Blast搜索获得不同茶树资源中的ANR1和ANR2基因。
ANR1基因序列(SEQ ID No.3):
ATGGAAGCCCAACCGACAGCTCCGAAGGCCGCATGTGTTGTTGGTGGCACCGGCTTCGTGGCGGCGACGCTCATCAAGTTGTTGCTTGAGAAAGGCTATGCGGTCAACACCACTGTCCGAGACCCAGGCAATCAGAAAAAGACCTCTCACCTTCTAGCACTAAAGGGTTCAGGCAACCTAAAAATCTTCCGAGCAGACCTCACCGATGAACAGAGCTTTGACGCCCCTGTAGCGGGTTGTGACCTGGTCTTCCATGTCGCTACACCAGTCAACTTTGCTTCCGAGGATCCAGAGAATGACATGATAAAACCAGCAATTCAAGGAGTAGTCAATGTTCTAAAAGCTTGTGCAAAAGCAGGAACGGTTAAACGTGTCATTTTAACATCATCAGCAGCTGCTGTATCGATCAATAAGCTCAATGGGACCGGCCTGGTCATGGATGAGAGTCACTGGACTGACACCGAGTTTTTGAATTCTGCGAAGCCGCCCACTTGGGGGTACCCTTTATCGAAAACACTAGCTGAGAAAGCTGCTTGGAAGTTTGCCGAAGAAAATAACATTAATCTTATCACTGTCATCCCAACTCTCATGGCCGGTCCGTCACTTACTGCAGATGTCCCTAGCAGTATTGGTCTTGCCATGTCCTTGATCACAGGGAATGAATTTCTCATAAATGGGTTGAAAGGTATGCAAATGCTGTCAGGCCCAATCTCCATCTCCCACGTGGAGGACGTTTGTCGTGCCCACGTGTTTGTGGCAGAGAAAGAATCGGCCTCTGGTCGATACATTTGTTGCGCTGTCAATACCAGTGTTCCCGAGCTAGCCAAGTTCCTCAACAAAAGATATCCAGAGTACAATGTCCCTACTGATTTTGGAGATTTTCCATCAAAAGCGAAGTTGATCCTCTCGTCTGAGAAGCTTACCAAAGAGGGATTTAGTTTCAAGTATGGGATCGAAGAAATTTACGATCAATCTGTGGAGTACTTCAAGGCTAAGGGGATTTTGAAGAATTGA;
ANR2基因序列(SEQ ID No.4):
ATGGCAATGGCAATGGCAACAACAACAACAACAACAACAACCAAACCGATGATCGGAGCGAAGGCGGCGTGTGTGGTTGGCGGCACCGGCTTCGTGGCTGCCACCCTTGTGAAGATGTTGCTAGAGAGAGGATATTCCGTCAACACCACTGTCAGGGACCCCGATAATAAGAAAAACTTCTCTCACCTCGTAGCACTGGAGGGTATGGGAAACTTAAAAATCTTCCGAGCAGACCTAACTGATGAACAGAGCTTTGATGCCCCCGTAGCCGGTTGTGACCTTGTTTTTGATGTTGCAACCCCAGTTAATTTTGCTTCTGAAGATCCAGAGAATGACATGATAAAGCCGGCAATCCAAGGAGTGCTTAATGTTTTAAAAGCCTGCGCGAAAGCAGGAACGGTTAAACGTGTCATTTTAACATCATCAGCAGCCTCTGTAACGATTAATCAGCTTGATGGAACGGGGCTTGTCATGGATGAGAGTCACTGGTCAGATGTCGAGTTTTTGACTTCTGTGAAGCCACCCACTTGGGGGTATCCTGTATCAAAGACACTAGCAGAGAAAGCAGCGTGGAAATTTGCTGAAGAAAATAACCTTAACCTCATAACTGTCGTCCCTACTCTTACAGCTGGTCCTTCTCTTACATCGGAAGTTCCTAATAGTATTGAACTTGCCATGTCCTTGATCACAGGGAATGAATTCCTCATAGATGGACTGAAAGGTATGCAGATACTGTCAGGTTCGATCTCAATTACCCACGTAGAGGATGTTTGTGGTGCGCACATATTTGTGGCGGAGAAAGAATCAGCTTGTGGTCGATACATTTGTTGTGGTGTCAATTCCAGTGTTCCAGAGCTTGCAAGGTTCTTGAACAAAAGATACCCCCAGTACAATGTTCCTACCAATTTTGGAGATTTGCCGTCCAAAGCCAAGTTGATCATCTCATCTGAAAAGCTTATCAAAGAAGGATTTAGTTTCAAGTATGGGATTGAAGAAATTTTTGACCACTCAGTGGCCTATTTGAAGACTAAGGGGCTTTTGCAGAACTGA;
(2)用MEGA7和Genedoc软件比对分析分别获得不同茶树间ANR1蛋白序列的保守结构域和ANR2蛋白序列的保守结构域。
(3)用DNAstar软件,分别找出不同茶树间ANR1和ANR2蛋白保守结构域均有的所有一致氨基酸序列。比较找出ANR1和ANR2蛋白保守结构域之间的差异氨基酸序列。
(4)ANR1和ANR2蛋白抗原多肽筛选确定:对得到的各氨基酸序列,结合抗原性、亲水性及表面可及性较强的要求分析,筛选确定ANR1蛋白保守结构域43~58aa位置一段14个氨基酸长度肽段确定为抗原多肽,其多肽序列为C-NQKKTSHLLALKGS-NH
实施例2
一.ANR1和ANR2蛋白抗原多肽制备及免疫方法
1.ANR1蛋白抗原多肽(NQKKTSHLLALKGS)、ANR2抗原多肽(NFASEDPENDMIKPA)由强耀生物公司合成。
2.ANR1和ANR2抗原多肽均与KLH、BSA偶联制备免疫抗原和检测抗原
(1)采用SMCC试剂盒(购自Thermo Fisher Scientific)对ANR1和ANR2抗原多肽分别与KLH偶联(偶联剂为Sulfo-SMCC)制备免疫抗原,具体方法为:称取4mg ANR1和ANR2抗原多肽分别溶解于0.4mL的PBS(pH 7.2,以下同),分别加入4mg Sulfo-SMCC,4℃孵育2h后,再分别加入25mg KLH溶液(浓度为20mg/mL)于ANR1-SMCC和ANR2-SMCC中,在4℃反应2h,并在PBS缓冲液中透析24h,得到ANR1-KLH和ANR2-KLH免疫抗原,置于-20℃保存。
采用BCA试剂盒(购自Thermo Fisher Scientific)测定ANR1-KLH和ANR2-KLH的浓度,将Solution B和Solution A按照体积比为1:50配制。用1×PBD稀释BSA标准蛋白浓度为0,25,125,250,500,750和1000μg/mL。在酶标仪上在562nm下测定吸光值,并绘制标准曲线。取25μL稀释适当倍数ANR1-KLH和ANR2-KLH抗原,加入200μL的BCA工作液,测定562nm下的吸光值,按照标准曲线计算对应稀释后的抗原浓度。
(2)ANR1和ANR2抗原多肽与BSA偶联(偶联剂为戊二醛)作为检测抗原
称取4mg ANR1和ANR2抗原多肽和4mg BSA蛋白,溶解于10mL 0.2mol/L PBS缓冲液,再加入1,4-二氧六环10mL混匀;将含有上述混合物的烧杯置于25℃水浴搅拌器中,搅拌5min后逐滴加入体积分数为0.25%的戊二醛溶液5mL,持续搅拌反应4h。反应结束后于4℃条件下透析72h,-20℃条件下冷冻干燥2d,得到ANR1-KLH和ANR2-KLH检测抗原,置于-20℃冰箱中保存。
3.用PBS缓冲液将免疫抗原分别稀释为1mg/mL,分装冻存于-20度冰箱。
4.第1天,取1mL浓度为1mg/mL的ANR1-KLH和ANR2-KLH免疫抗原各加入1mL福氏完全佐剂,乳化(检验乳化程度:将一滴乳化抗原液滴入生理盐水中,若不散开,表明已达到要求),对2只新西兰白兔(记为兔A和兔B,购于强耀生物有限公司)各注射1mL乳化后的ANR1-KLH免疫抗原,对另外2只新西兰白兔(记为兔C和兔D)各注射1mL乳化后的ANR2-KLH免疫抗原,均于颈背部皮下进行多点(至少8点)注射。
5.第15天,取1mL浓度为1mg/mL的ANR1-KLH和ANR2-KLH免疫抗原各加入1mL福氏不完全佐剂,乳化(检验乳化程度:将一滴乳化抗原液滴入生理盐水中,若不散开,表明已达到要求),对步骤4中的2只新西兰白兔(记为兔A和兔B)各注射1mL乳化后的ANR1-KLH免疫抗原,对步骤4中的另外2只新西兰白兔(记为兔C和兔D)各注射1mL乳化后的ANR2-KLH免疫抗原,均于颈背部皮下进行多点(至少8点)注射。
6.第29天,取1mL浓度为1mg/mL的ANR1-KLH和ANR2-KLH免疫抗原各加入1mL福氏不完全佐剂,乳化(检验乳化程度:将一滴乳化抗原液滴入生理盐水中,若不散开,表明已达到要求)),对步骤5中的2只新西兰白兔(记为兔A和兔B)各注射1mL乳化后的ANR1-KLH免疫抗原,对步骤5中的另外2只新西兰白兔(记为兔C和兔D)各注射1mL乳化后的ANR2-KLH免疫抗原,均于颈背部皮下进行多点(至少8点)注射。
7.第43天,取1mL浓度为1mg/mL的ANR1-KLH和ANR2-KLH免疫抗原各加入1mL福氏不完全佐剂,乳化(检验乳化程度:将一滴乳化抗原液滴入生理盐水中,若不散开,表明已达到要求)),对步骤6中的2只新西兰白兔(记为兔A和兔B)各注射1mL乳化后的ANR1-KLH免疫抗原,对步骤6中的另外2只新西兰白兔(记为兔C和兔D)各注射1mL乳化后的ANR2-KLH免疫抗原,均于颈背部皮下进行多点(至少8点)注射。
8.第53天,颈动脉取血,将步骤7中的兔子处死。
9.兔血在4℃放置过夜,离心(4℃,10000rpm)30分钟,收集上清。
二.抗ANR1和ANR2的多克隆抗体纯化流程:
1.按照常规方法将ANR1和ANR2蛋白抗原多肽分别连接到活化的Sulfolink Resin上,制备抗原亲和柱,1mL Sulfolink Resin偶联1mg多肽。
2.抗原亲和柱用10倍柱体积PBS平衡,流尽溶液;兔血清经0.45μm滤膜过滤。
3.过滤后的兔血清过抗原亲和柱,流尽溶液,收集流穿。
4.10倍柱体积PBS平衡,流尽溶液。
5.加入5mL抗体洗脱液,分管收集洗脱液,每管1mL。
6.收集的洗脱液检测280nm处的吸光度,吸光度大于1.0的组分合并,并采用PBS透析,得到纯化后的抗ANR1和ANR2的多克隆抗体;
7.纯化后的抗ANR1和ANR2的多克隆抗体鉴定(Elisa确定抗体效价)。
实施例4抗ANR1和ANR2的多克隆抗体的鉴定
一.ElISA抗体效价
1.包被:将实施例2步骤一制得的检测抗原(ANR1-KLH和ANR2-KLH检测抗原)用CBS(ELISA抗原包被缓冲液)稀释为1μg/mL,加入酶标板中,每孔100μL,4℃过夜。
2.封闭:将包被液弃去,每孔加入200μL封闭液(质量分数为5%脱脂奶粉),37℃放置1.5小时。
3.加入样本:弃去封闭液,加入样品(血清或者抗体),每孔100μL加入酶标板,37℃放置1小时。
4.洗涤:用自来水冲洗10次,拍干。
5.加入二抗:酶标羊抗兔(购自强耀生物)用封闭液稀释至工作浓度,每孔100μL加入酶标板,37℃放置30分钟。
6.洗涤:用自来水冲洗10次,拍干。
7.加入TMB显色底物:每孔100uL加入酶标板,37℃放置15分钟。
8.加入终止液:每孔加入50μL 2M H
9.读数:酶标仪OD
本实施例以ANR1和ANR2抗原多肽与BSA偶联(偶联剂为戊二醛)作为检测抗原,包被酶标板,以1:1250稀释的未免疫兔源兔血清作为阴性对照,将兔源血清及纯化后的抗体倍比稀释,应用ELISA方法检测,以与阴性血清的比值大于2.1判断为阳性。结果见表1和表2。
从表1中可以看出,纯化的抗ANR1的多克隆抗体的效价达到1:80000。
表1抗ANR1抗体效价
从表2中可以看出,纯化的抗ANR2的多克隆抗体的效价达到1:409600。
表2抗ANR2抗体效价
二.抗ANR1和ANR2的多克隆抗体的Western Blot鉴定
取1g茶鲜叶,在含有水不溶性PVPP(交联聚乙烯吡咯烷酮)的液氮中充分研磨。加入10mL预冷体积分数为10%TCA/丙酮溶液(含体积分数为0.07%β-巯基乙醇,1mmol/LPMSF),于-20℃沉淀3h。随后于4℃以12 000×g离心15min,弃上清。重复以上丙酮洗涤操作2至3次。使用SDS-PAGE进行蛋白质电泳,用考马斯亮蓝R-250对分离胶进行胶体染色3~5h。用湿法转印技术将凝胶中蛋白转到PVDF膜上,再经质量分数为5%脱脂奶粉对膜进行封闭,4℃下轻摇10~14h。加入1:5000稀释后的实施例3纯化后的抗ANR1和ANR2的多克隆抗体,在4℃孵育10~14h,TBST清洗3次。加入1:5000稀释的二抗(购自强耀生物的羊二抗)26℃轻摇1h,TBST清洗3次,然后加适量显影液通过显影仪显影。
结果如图1所示,本发明中的抗ANR1和ANR2的多克隆抗体可检测到40KD大小左右的蛋白条带,与ANR1(36.23kDa)和ANR2(37.50kDa)蛋白分子量大小相符。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
SEQUENCE LISTING
<110> 华南农业大学
<120> 一种茶树花青素还原酶蛋白抗原多肽及其抗体、检测试剂盒和应用
<130> 1
<160> 4
<170> PatentIn version 3.3
<210> 1
<211> 14
<212> PRT
<213> Artificial
<220>
<223> 花青素还原酶1多肽
<400> 1
Asn Gln Lys Lys Thr Ser His Leu Leu Ala Leu Lys Gly Ser
1 5 10
<210> 2
<211> 15
<212> PRT
<213> Artificial
<220>
<223> 花青素还原酶2多肽
<400> 2
Asn Phe Ala Ser Glu Asp Pro Glu Asn Asp Met Ile Lys Pro Ala
1 5 10 15
<210> 3
<211> 1014
<212> DNA
<213> Artificial
<220>
<223> ANR1基因序列
<400> 3
atggaagccc aaccgacagc tccgaaggcc gcatgtgttg ttggtggcac cggcttcgtg 60
gcggcgacgc tcatcaagtt gttgcttgag aaaggctatg cggtcaacac cactgtccga 120
gacccaggca atcagaaaaa gacctctcac cttctagcac taaagggttc aggcaaccta 180
aaaatcttcc gagcagacct caccgatgaa cagagctttg acgcccctgt agcgggttgt 240
gacctggtct tccatgtcgc tacaccagtc aactttgctt ccgaggatcc agagaatgac 300
atgataaaac cagcaattca aggagtagtc aatgttctaa aagcttgtgc aaaagcagga 360
acggttaaac gtgtcatttt aacatcatca gcagctgctg tatcgatcaa taagctcaat 420
gggaccggcc tggtcatgga tgagagtcac tggactgaca ccgagttttt gaattctgcg 480
aagccgccca cttgggggta ccctttatcg aaaacactag ctgagaaagc tgcttggaag 540
tttgccgaag aaaataacat taatcttatc actgtcatcc caactctcat ggccggtccg 600
tcacttactg cagatgtccc tagcagtatt ggtcttgcca tgtccttgat cacagggaat 660
gaatttctca taaatgggtt gaaaggtatg caaatgctgt caggcccaat ctccatctcc 720
cacgtggagg acgtttgtcg tgcccacgtg tttgtggcag agaaagaatc ggcctctggt 780
cgatacattt gttgcgctgt caataccagt gttcccgagc tagccaagtt cctcaacaaa 840
agatatccag agtacaatgt ccctactgat tttggagatt ttccatcaaa agcgaagttg 900
atcctctcgt ctgagaagct taccaaagag ggatttagtt tcaagtatgg gatcgaagaa 960
atttacgatc aatctgtgga gtacttcaag gctaagggga ttttgaagaa ttga 1014
<210> 4
<211> 1050
<212> DNA
<213> Artificial
<220>
<223> ANR2基因序列
<400> 4
atggcaatgg caatggcaac aacaacaaca acaacaacaa ccaaaccgat gatcggagcg 60
aaggcggcgt gtgtggttgg cggcaccggc ttcgtggctg ccacccttgt gaagatgttg 120
ctagagagag gatattccgt caacaccact gtcagggacc ccgataataa gaaaaacttc 180
tctcacctcg tagcactgga gggtatggga aacttaaaaa tcttccgagc agacctaact 240
gatgaacaga gctttgatgc ccccgtagcc ggttgtgacc ttgtttttga tgttgcaacc 300
ccagttaatt ttgcttctga agatccagag aatgacatga taaagccggc aatccaagga 360
gtgcttaatg ttttaaaagc ctgcgcgaaa gcaggaacgg ttaaacgtgt cattttaaca 420
tcatcagcag cctctgtaac gattaatcag cttgatggaa cggggcttgt catggatgag 480
agtcactggt cagatgtcga gtttttgact tctgtgaagc cacccacttg ggggtatcct 540
gtatcaaaga cactagcaga gaaagcagcg tggaaatttg ctgaagaaaa taaccttaac 600
ctcataactg tcgtccctac tcttacagct ggtccttctc ttacatcgga agttcctaat 660
agtattgaac ttgccatgtc cttgatcaca gggaatgaat tcctcataga tggactgaaa 720
ggtatgcaga tactgtcagg ttcgatctca attacccacg tagaggatgt ttgtggtgcg 780
cacatatttg tggcggagaa agaatcagct tgtggtcgat acatttgttg tggtgtcaat 840
tccagtgttc cagagcttgc aaggttcttg aacaaaagat acccccagta caatgttcct 900
accaattttg gagatttgcc gtccaaagcc aagttgatca tctcatctga aaagcttatc 960
aaagaaggat ttagtttcaa gtatgggatt gaagaaattt ttgaccactc agtggcctat 1020
ttgaagacta aggggctttt gcagaactga 1050
