一种改造的草甘膦核酸适配体及其应用
文献发布时间:2023-06-19 09:27:35
技术领域
本发明涉及核酸适配体技术领域,具体涉及一种改造的草甘膦核酸适配体及其应用。
背景技术
草甘膦是一种广效型的有机磷除草剂,一种非选择性内吸传导型茎叶处理除草剂,草甘膦的优异除草性能,极易被植物叶片吸收并传导至植物全身,对一年生及多年生杂草都有很高的活性,透过基因改造,可使作物能耐草甘膦。草甘膦本身对人体(尤其是消化系统)有轻微毒性,所以欧盟对食水中的残留草甘膦含量有严格的规定。根据德国莱比锡大学于2011年12月进行的一项研究,在受验的一批柏林市区居民的尿液样本内,所有样本均发现其残留草甘膦含量比欧盟食水内的残留标准高出5到20倍,足以证明草甘膦在人类的整条食物链内不断残留积累。中国标准规定农产品中有机磷农药最大的允许残留量为0.2mg·kg
核酸适配体是通过体外筛选技术(SELEX)筛选出的寡聚核苷酸片段,它能够与蛋白质或其它小分子物质特异结合,对于能够结合的适配体有非常强的识别能力和高度的亲和力。核酸适配体之所以能够在食品安全分析与生物医药研究方面具有广阔的应用前景,是因为高通量筛选的技术特点以及适配体精确识别、易体外合成与修饰的特性。随着核酸适配体筛选技术新进展,核酸适配体技术在在分子识别、药物筛选及分析检测等众多领域得到了广泛的应用。
基于适配体识别的农药检测仍处于初级阶段,因此筛选出更多能与各种农药分子高特异性、高亲和力结合的适配体,结合光化学,电化学等检测手段,建立更多的基于适配体识别的农药分析检测方法是未来的发展趋势。
发明内容
针对现有技术不足,本发明提供一种改造的草甘膦核酸适配体及其应用,其中改造后的草甘膦核酸适配体具有更高的活性和更加优越的特异性,提高了草甘膦农药检测的准确性。
采用草甘膦核酸适配C-SS8改造成C-SS8-37为对草甘膦农药进行检测,且C-SS8的DNA序列为:
5'-GCATACCGTCAATCGCTGCAGCGATTCAAGACGGTAAGT GGCAATCCCGCTCA-3',二级结构有3个Loop环,共53个碱基;
改造后的草甘膦核酸适配体C-SS8-37的序列为:
5'-GCATACCGTCAATCGCTGCAGCGATTCAAGACGGTAA-3',二级结构有2个Loop环,共37个碱基。
本发明的技术方案主要为:
1、草甘膦核酸适配体的筛选、分析、克隆和测序:
利用非固相化的SELEX技术从一个固定的随机适配体库中筛选草甘膦的核酸适配体,另对筛选得到的DNA序列进行结构分析;随着筛选轮数增加,草甘膦农药从固定的随机库中洗脱的ssDNA逐渐富集,经过13轮筛选,筛选效率从0.46%达到35.10%;对第13轮洗脱的ssDNA进行克隆和测序,最后筛选得到13条核酸适配体;
2、二级结构的预测:
采用DNAMAN软件预测其二级结构,发现每条核酸适配体的二级结构中均含有三个以上茎环结构;
3、适配体活性鉴定和改造:
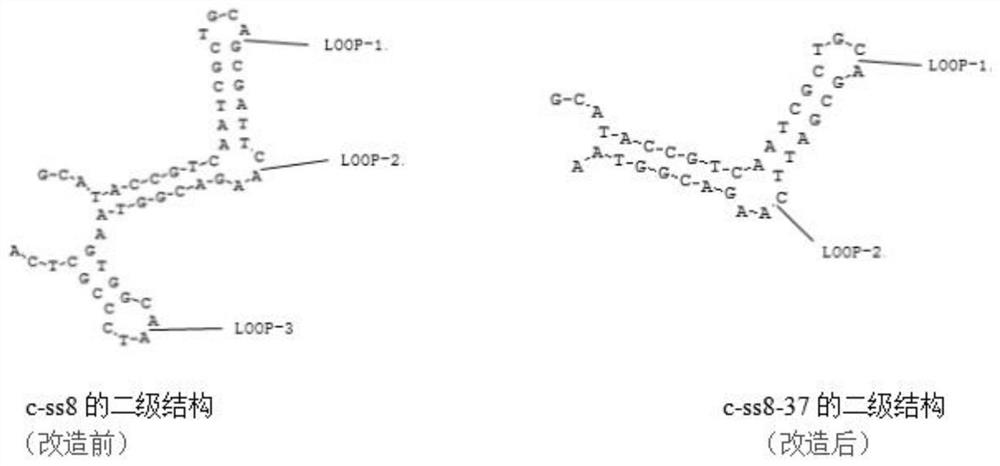
采用基于分子信标的荧光检测方法对前期筛选的13条适配体进行活性鉴定,并对活性最高的一条适配体进行了改造、鉴定。基于分子信标的荧光检测方法表明C-SS8的活性最高,其抑制率为62.56%;改造后适配体C-SS8-37的活性明显高于原适配体,抑制率为87.85%,其中C-SS8改造前后的二级结构图如图1所示。
4、基于分子信标的荧光检测法检测草甘膦
根据有机磷农药与分子信标竞争结合核酸适体的原理,建立了基于核酸适体与分子信标的草甘膦检测方法。设计的发夹结构的分子信标能成功打开与闭合,分子信标与核酸适体添加的比例为1:1,草甘膦农药与核酸适体的孵育时间为20min,分子信标的孵育时间为 80min。在最优试验条件下,草甘膦检测的标准曲线为 y=0.1028x+34.543,R
本发明提供一种改造的草甘膦核酸适配体及其应用,与现有技术相比优点在于:
提供了检测草甘膦的高特异性、高亲和力结合的适配体,根据有机磷农药与分子信标竞争结合的原理,建立草甘膦的检测方法,为草甘膦的检测开辟新途径,提高检测的准确性。
附图说明:
图1:为本发明C-SS8改造前的二级结构和改造后C-SS8-37的二级结构示意图;
图2:为本发明筛选草甘膦适配体的原理图;
图3:为本发明实施例1中每轮的筛选效率示意图;
图4:为本发明基于分子信标的荧光检测法鉴定适配体活性原理图;
图5:为本发明MB
图6:为本发明实施例2分子信标的验证示意图;
图7:为本发明实施例2分子信标的选择示意图;
图8:为本发明分子信标适配体活性鉴定结果示意图;
图9:为本发明草甘膦检测的标准曲线图。
具体实施方式
为使本发明实施例的目的、技术方案和优点更加清楚,下面结合本发明实施例对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
实施例1:
草甘膦核酸适配体筛选:
选取如下表1所示的合成单链DNA序列:
表1
SELEX筛选过程(筛选原理示意图如图2所示):
(1)将设计好的随机适配体库Library(2.0nmol)、固定序列B-B(10.0nmol)以及封闭序列P1(2.5nmol)和P2(2.5nmol)充分溶解在200μL筛选缓冲液1×SB体系中,于90℃的恒温水浴锅中热变性3min,冷却到室温后置于4℃冰箱中孵育过夜;
(2)次日吸取200μL链霉亲和素修饰的琼脂糖凝胶于带滤膜的离心柱中,用1×SB缓冲液反复洗涤离心柱中的链霉亲和素凝胶5次 (200μL/次,4℃600g离心1min),将孵育过夜的溶液全部加入,在避光条件下在旋转摇床上室温孵育40min,在4℃600g条件下离心1min将凝胶与液相分离;
(3)收集上述步骤(2)中溶液,测荧光值确定固定效率,根据固定前后溶液的荧光值变化,计算出随机适配体库在链霉亲和素凝胶表面的固定效率,固定效率计算公式为:
其中X表示随机适配体库的固定效率;H表示适配体库固定后滤液的荧光强度;Q表示适配体库孵育前溶液的荧光强度;
(4)第二轮及以后:根据实际ssDNA投入量,次级适配体库 ssDNA、上游引物序列P1、下游引物序列P2和固定序列B-B按1∶ 1.5∶1.5∶5的比例加入到44μL5×SB中,加入超纯水补至220μL,配制成220μL1×SB溶液体系,于90℃恒温水浴锅中加热变性3min,置于避光条件下室温孵育30min,然后按照上述(2)、(3)操作步骤操作;
(5)洗脱:固定上述随机序列的链霉亲和素凝胶用1×SB缓冲液洗涤5次(200μL/次,4℃600g离心1min),后加入200μL的1×SB 缓冲液,避光条件下于旋转摇床上室温孵育30min,4℃600g下离心 1min后,往孵育后的离心柱中加入200μL0.5mmol/L的草甘膦溶液(溶液为1×SB缓冲体系,草甘膦的浓度为0.5mmol/L)避光条件下在旋转摇床上室温孵育60min,4℃600g离心1min后,得滤液中ssDNA 为目标ssDNA,测定其荧光值,根据固定前后溶液体系中的荧光值以及经农药洗脱后滤液中的荧光值,计算出农药对固定在链霉亲和素凝胶表面的适配体的洗脱效率,即筛选效率,筛选效率计算公式为:
其中W表示筛选效率,T表示农药洗脱后的荧光值,H表示适配体库固定后滤液的荧光强度;Q表示适配体库孵育前溶液的荧光强度;
(6)PCR扩增:以农药洗脱下来的ssDNA为模板,以F-P3和 P2-B为引物进行PCR扩增(PCR扩增条件:94℃预变性5min,94℃变性30s,56℃退火30s,72℃延伸30s,循环轮数,72℃延伸10min),对每轮PCR扩增所需的模板添加量,引物F-P3和P2-B的添加量以及扩增的循环轮数进行优化,并用1.2%的琼脂糖凝胶电泳(电泳方法:随机取出两管PCR产物,分别取8μL用移液枪移入琼脂糖凝胶进样孔中,再加入8μL的DNAMaker作对比,在120V的电压下电泳25min后在JS-780型凝胶成像系统中鉴定)鉴定PCR的扩增效果,直至扩增条带明亮清晰且无非特异性扩增为止,最后回收扩增产物,用75%的乙醇沉淀PCR扩增产物,以少量糖原作为助沉剂,置于-20℃冰箱中静置沉淀3h;
(7)双链DNA的拆分:将沉淀的PCR扩增产物于4℃,12000rpm 条件下离心15min,倒去上清液,并用220μLBindingBuffer溶解沉淀产物,吸取200μL链霉亲和素凝胶于带滤膜的离心柱中,用Binding Buffer缓冲液洗涤5次(200μL/次),于4℃600g离心1min后,加入 200μL扩增沉淀产物溶解液,避光条件下于旋转摇床上室温孵育 40min,4℃600g离心1min,用BindingBuffer洗涤离心柱5次(200μL/ 次),4℃600g离心1min后往离心柱中加入200μL0.1mol/LNaOH,避光条件下于旋转摇床上室温孵育15min,dsDNA经过碱变性后拆分成ssDNA,4℃600g离心1min后,回收滤液,测荧光值,并以ssDNA 原库作为阳性对照组,在1.2%的琼脂糖凝胶中加样进行电泳,后用 1mol/LHCl调节滤液为中性,然后用75%的乙醇沉淀拆分产物,并以少量糖原作为助沉剂,置于-20℃冰箱中静置过夜;次日离心拆分产物(4℃,12000rpm,15min),离心后倒掉上清液,并用50μL超纯水溶解沉淀的拆分产物;用微量紫外分光光度计对拆分产物溶解液即次级适配体库中的ssDNA进行定量,将次级适配体库投入到下一轮的筛选中,重复上述筛选操作,当筛选效率升高到一定程度不再升高时,整个筛选结束;
(8)克隆测序:以P2、P3为引物,将最后一轮洗脱下来的ssDNA 进行PCR扩增,扩增产物用75%的乙醇在-20℃的冰箱中静置沉淀过夜,离心(4℃,12000rpm,15min)后,倒掉上清液,并用100μL 超纯水溶解沉淀的PCR扩增产物,后克隆和测序;
(9)适配体二级结构预测与分析:筛选获得的ssDNA两端的引物结合区不参与靶标分子的结合,因此将测序获得的ssDNA两端固定的引物结合序列截去,仅保留两段随机序列和中间的固定序列,用 DNAMAN软件对其进行二级结构预测,对预测出的二级结构进行分析,分析可能与农药靶分子结合的位点;
上述每轮的筛选效率结果如图3所示:随着筛选轮数的增加,从开始的0.46%逐渐升高到了第13轮的35.10%,草甘膦农药适配体逐渐富集,草甘膦适配体在固定的适配体库中的比例逐渐增加;当进一步增加筛选轮数时,筛选效率不再升高,筛选结束;随着草甘膦农药靶标分子对于ssDNA的筛选效率的不断增加,所筛选得到的ssDNA 对草甘膦农药靶标分子的亲和性也越来越好。
上述克隆后挑选有24个为阳性克隆,并用DNAMAN软件与原 ssDNA序列进行比对,共获得了13条ssDNA序列,其序列如下表2 所示:
表2
其中划线序列为ssDNA的恒定区域。由表2可以看出筛选出13 条草甘膦适体随机区的序列有部分相同的片段,SS4、SS7在随机区出现GCAG碱基序列;SS4、SS7、SS8、SS11、SS12、SS20、SS26、 SS27、SS34、SS36这10条ssDNA在随机区序列中出现GCA碱基序列;SS4、SS7、SS8、SS11、SS12、SS15、SS18、SS22、SS26这9 条ssDNA在随机区出现CCG碱基序列;SS18、SS26、SS34在随机区出现GGG碱基序列。说明在草甘膦适体筛选的过程中适体富集程度很高并且具有一定的同源性。
实施例2:
草甘膦核酸适配体的活性鉴定:
1、基于分子信标的荧光检测法鉴定适配体活性:
(1)分子信标的验证:取若干个1.5mL离心管,对照组CK
(2)分子信标的选择:取若干个1.5mL离心管,分别加入26μL 0.4mmol/L的ssDNA(13条ss-DNA混合,1×SB体系)(分子信标组加入26μL1×SB缓冲液),样品组加入52μL1mmol/L草甘膦(1×SB 体系),对照组和分子信标组加入52μL1×SB缓冲液,振荡混匀并于室温下孵育20min;后分别加入26μL0.4μmol/L的分子信标(1×SB 缓冲体系),振荡混匀(此时分子信标终浓度为0.1μmol/L,ss-DNA 终浓度为0.1μmol/L,草甘膦终浓度为0.5mmol/L),每组取100μL加入黑色96孔板,测定其荧光强度,做两次平行实验,按下方公式计算抑制率,绘制抑制率对时间的变化曲线,如图7所示。
式中:R—抑制率(%);C—对照组荧光强度;T—样品组荧光强度;B—分子信标组荧光强度。
(3)鉴定方法:取若干个1.5mL离心管,分别加入26μL 0.4mmol/L的ss-DNA(1×SB体系)(分子信标组加入26μL1×SB缓冲液),样品组加入52μL1mmol/L草甘膦(1×SB体系),对照组和分子信标组加入52μL1×SB缓冲液,振荡混匀并于室温下孵育20min;后分别加入26μL0.4μmol/L的分子信标(1×SB缓冲体系),振荡混匀(此时分子信标终浓度为0.1μmol/L,ss-DNA终浓度为0.1μmol/L,草甘膦终浓度为0.5mmol/L)。每组取100μL加入黑色96孔板,测定其荧光强度,做两次平行实验,按步骤(2)中的公式计算抑制率,绘制抑制率对时间的变化曲线如图8所示。
通过上述检测,由图6可知MB
实施例3:
适配体改造及其活性鉴定结果:
对上述实施例所选择的适配体C-SS8进行改造,改造后得 C-SS8-37,其具体改造的二级结构如图1所示,对C-SS8改造前后进行活性鉴定,结果如下表3所示:
表3
由上表可知,改造后适配体活性明显增强,抑制率达到了 87.85%,相较改造前抑制率增加了25%,适配体的活性明显提高。
实施例4:
对草甘膦的检测:
(1)标准曲线的建立:分别取26μL0.4μmol/L的C-SS8-37(1×SB 缓冲体系)于1.5mL的离心管中(分子信标组加入26μL1×SB缓冲液),样品组分别加入52μL0.05mmol/L(0.1mmol/L、0.2mmol/L、 0.3mmol/L、0.5mmol/L、0.7mmol/L、0.9mmol/L、1mmol/L)的草甘膦农药(1×SB缓冲体系),分子信标组和对照组加入52μL1×SB缓冲液,振荡混匀室温孵育20min,然后分别加入26μL0.4μmol/L的 MB
在建立标准曲线的基础上,按下面公式计算草甘膦的检出限。
DL=3σ/S
式中:DL为检出限;σ为对照组的标准偏差;S为校准标准曲线斜率;
如图9所示,标准曲线为y=0.1028x+34.543,线性范围为 100~450μmol/L,线性回归系数为R
实施例5:
水样中农药加标回收试验:
(1)水样的前处理
试验水样选取人工湖水,湖水用0.22μm的滤膜进行过滤,再用过滤水样配置成试验所需浓度农药(1×SB缓冲体系)的水样,待用。
(2)加标回收试验
分别取26μL0.4μmol/L的C-SS8-37(1×SB缓冲体系)与1.5mL 的离心管中(分子信标组加入26μL1×SB缓冲液),样品组的农药终浓度为0μmol/L,加标组分别加入52μL200μmol/L、52μL400μmol/L、 52μL600μmol/L、52μL800μmol/L的草甘膦(即加标量为100μmol/L、200μmol/L、300μmol/L、400μmol/L)。振荡混匀室温孵育20min,然后分别加入26μL0.4μmol/L的MB
式中:P为回收率;c1为样品组测得的农药终浓度;c2为加标组测得的农药终浓度;c3为加标浓度。
试验结果如下表4所示:
表4
由表6可知,水样中农药加标回收试验回收率在87.34%~95.74%之间,水样中农药加标回收试验的准确度较高。
上述实施例1-5中:
(1)筛选缓冲液(5×SB):Na
(2)筛选缓冲液(1×SB):Na
(3)结合缓冲液(Bindingbuffer):pH为7.2的磷酸钠缓冲溶液, NaCl浓度为0.15mol/L;
(4)50×TAE电泳缓冲液:取242gTris和37.2g乙二胺四乙酸二钠,用800mL超纯水溶解后加入57.1ml的冰乙酸混匀,NaOH调 pH至8.3,用超纯水定容至1L,使用时稀释至50倍即可;
(5)实施案例1中的荧光法测定:分别吸取6μL的ssDNA和 6μL固定后的滤液,用1×SB缓冲液稀释至60μL,取50μL溶液体系加样到选定的96孔板区域孔中,用多功能微孔板测定仪在激发波长 485nm和发射波长535nm下测定样品溶液的荧光值。
需要说明的是,在本文中,诸如第一和第二等之类的关系术语仅仅用来将一个实体或者操作与另一个实体或操作区分开来,而不一定要求或者暗示这些实体或操作之间存在任何这种实际的关系或者顺序。而且,术语“包括”、“包含”或者其任何其他变体意在涵盖非排他性的包含,从而使得包括一系列要素的过程、方法、物品或者设备不仅包括那些要素,而且还包括没有明确列出的其他要素,或者是还包括为这种过程、方法、物品或者设备所固有的要素。在没有更多限制的情况下,由语句“包括一个……”限定的要素,并不排除在包括所述要素的过程、方法、物品或者设备中还存在另外的相同要素。
以上实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的精神和范围。
- 一种改造的草甘膦核酸适配体及其应用
- 一种与草甘膦特异结合的核酸适配体及应用
