一种与茄子萼片颜色性状基因紧密连锁的CAPS分子标记及制备方法
文献发布时间:2023-06-19 09:27:35
技术领域
本发明属于分子生物学及茄子育种领域,更具体涉及一种茄子萼片颜色性状相关CAPS分子标记,同时涉及一种茄子萼片颜色性状相关CAPS分子标记的制备方法,还涉及一种茄子萼片颜色性状相关CAPS分子标记的用途。
背景技术
茄子(Solanum melongena L.)是茄科茄属草本植物,在世界各地广为栽培,联合国粮食及农业组织将其列为第四大蔬菜作物。分子标记作为一种重要的遗传标记,可用于园艺作物遗传图谱构建、QTL(quantitative trait locus)分析、分子标记辅助选择育种等研究中。其中,SSR(simple sequence repeats)、AFLP(amplified fragment lengthpolymorphism)以及CAPS(cleaved amplified polymorphism sequence)等分子标记已经在茄子、番茄、黄瓜等园艺作物基因定位、遗传多样性分析等领域广泛应用。
茄子萼片颜色是重要的果实品质性状,主要有绿、紫绿和紫萼等色泽的茄子品种类型。各地区对茄子果萼色的消费需求有所不同。目前绿萼片茄子在我国很多地区受到消费者的青睐。因此,萼片颜色逐渐发展成为茄子的重要性状之一,对于茄子的商品价值具有重要意义。
一段时间以来,人们从茄子萼片颜色划分、遗传规律等角度对茄子果萼色进行了一定的研究。部分研究显示,茄子果萼色性状属于核遗传,受到两对基因的控制,并可能存在显性上位作用。另有研究表明,根据F1代果萼颜色分析,认为果萼紫色对绿色部分显性,且果萼色级值次数呈单峰偏态分布,提示该性状为多基因控制的数量性状,茄子果萼色遗传符合两对加性-显性-上位性主基因+加性-显性-上位性多基因模型,两对主基因的效应均以加性效应为主,并且第一对主基因占主导地位。尽管已有一些关于茄子萼片颜色遗传相关的分析,但并没有明确其遗传机理,也没有相关连锁的DNA分子标记报道。
发明内容
本发明的目的是在于提供了一种与茄子萼片颜色性状紧密连锁的CAPS分子标记EGC277,该CAPS分子标记揭示了茄子萼片颜色性状紧密连锁基因PCR片段限制性长度变异的信息。目前,尚未有关于茄子萼片颜色性状紧密连锁的分子标记信息报道,本发明属于首次发现。
本发明的另一目的是在于提供了一种茄子萼片颜色性状相关CAPS分子标记及其制备方法。
该CAPS分子标记通过引物:F:TCATGTTCCATGTGATTGCC;R:TCCCTCCGGAAATTCTTCTT扩增;
该CAPS分子标记的扩增片段为277bp,序列如下(5’-3’):TCATGTTCCATGTGATTGCCAATTAATTTGTCTTTGTT
通过限制性内切酶BglII酶切之后,经琼脂糖凝胶电泳得到检测结果。该分子标记检测方法简单,结果易于观察分析。
本发明的再一目的是在于提供了一种茄子萼片颜色性状相关CAPS分子标记或引物在鉴别茄子萼片颜色基因型中的应用。该分子标记可以用于分子标记辅助育种,以及用于茄子萼片颜色遗传调控机理研究。本发明为茄子育种提供了新手段,可加速茄子萼片颜色性状的改良进程,提高育种的准确性和选择效率。
为了实现上述的目的,本发明采用以下技术措施:
1.一种茄子萼片颜色性状相关CAPS分子标记的筛选方法,它包括如下步骤:
(1)配制遗传群体:将绿色萼片茄子高代自交系品种GP05和紫色萼片茄子高代自交系品种PP05进行杂交、回交和自交,配置成遗传群体。
(2)测序DNA样品制备:利用CTAB法,提取绿萼片亲本和回交分离群体中极端性状(绿色萼片)单株DNA并混合,提取紫萼片茄子亲本及自交分离群体F2中极端性状(紫色萼片)单株DNA并混合,得到绿色萼片和紫色萼片两个茄子样本池。
(3)高通量测序筛选SNP位点:利用新一代Hiseq2500测序平台,进行全基因组测序,然后利用短序列比对软件进行全基因组比对,寻找绿色萼片茄子和紫色萼片茄子两个群体中可靠的SNP位点,获得目标性状(绿色萼片)关联区域。经分析,共筛选出42条与绿色萼片性状相关联的scaffold。
(4)SNP位点转化为CAPS分子标记:根据高通量测序法筛选到的42条scaffold中酶切位点的特征,设计了34对引物,并选择BglII、HindIII、MboI、NcoI、NdeI和XbaI作为鉴定限制性内切酶。在GP05和PP05的F2代以及其他不同亲本的品种茄子材料中,对候选CAPS分子标记进行分析,将34对引物分别进行PCR扩增,并对PCR产物进行酶切鉴定,分析酶切产物多态性。最终选择EGC277用于开发CAPS分子标记。该分子标记在两个群体中都能重复检测到,表现为与萼片颜色性状紧密连锁。其引物序列(5’-3’)为F:TCATGTTCCATGTGATTGCC;R:TCCCTCCGGAAATTCTTCTT,PCR产物大小为277bp,
扩增片段序列(5’-3’)为:
TCATGTTCCATGTGATTGCCAATTAATTTGTCTTTGTT
所用限制性内切酶为BglII,绿色萼片茄子PCR片段酶切产物大小为:39bp和238bp;紫色萼片茄子,其PCR片段酶切产物大小为277bp;过渡色萼片茄子,其PCR片段酶切产物大小为238bp和277bp。
本发明所用的亲本材料为绿色萼片茄子高代自交系品种GP05和紫色萼片茄子高代自交系品种PP05,均有武汉市蔬菜研究所茄果研究室技术人员育成。
与现有技术相比,本发明的优点在于:
本发明首次通过新一代高通量QTL-seq技术,对绿色萼片茄子和紫色萼片茄子全基因组多态性位点进行分析,并将SNP位点转化为CAPS分子标记,从中获得一个能有效甄别绿色萼片茄子的CAPS分子标记EGC277。在常规育种方法中,茄子萼片颜色表型鉴定,要等到挂果之后才能进行,费时费力而且效率低下。通过检测茄子绿色萼片性状紧密连锁基因,可以在苗期进行淘汰,不仅节约生产成本,而且大大提高选择效率。本发明中茄子绿色萼片紧密连锁CAPS分子标记检测方便快速,结果稳定,不受环境影响。通过PCR扩增、PCR产物酶切和电泳检测分析,即可预测茄子萼片颜色,进而准确快速筛选绿色萼片茄子单株。
附图说明
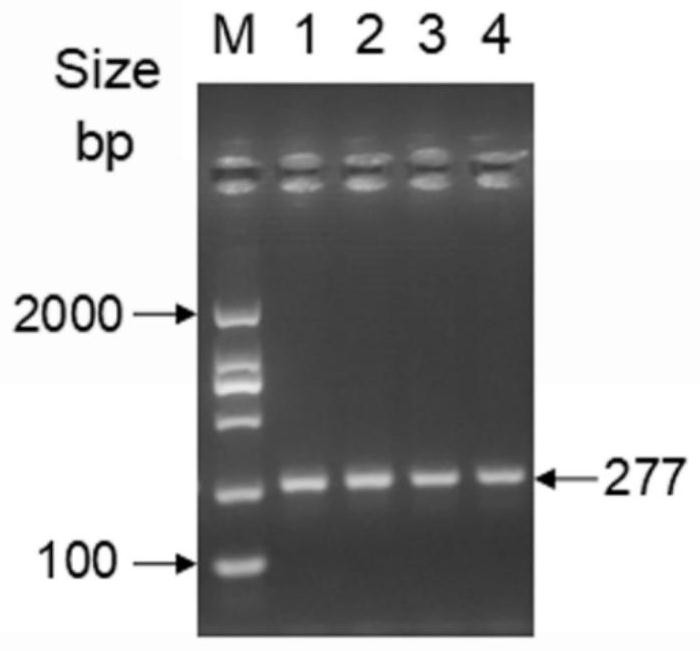
图1为一种EGC277 CAPS分子标记PCR扩增示意图。
泳道信息如下:M为DL2000 Marker,DL2000 DNA marker从上至下条带大小依次是2000bp、1000bp、750bp、500bp、250bp和100bp。1至4号泳道模板分别为PP05紫色萼片茄子、GP05绿色萼片茄子、PP05和GP05的F2代中紫萼片茄子和绿颜色萼片茄子的PCR扩增产物检测结果。
图2为一种EGC277CAPS分子标记酶切片段多态性示意图。
泳道信息如下:M为DL2000 Marker,DL2000 DNA marker从上至下条带大小依次是2000bp、1000bp、750bp、500bp、250bp和100bp。1至4号泳道模板分别为PP05紫色萼片茄子、GP05绿色萼片茄子、PP05和GP05的F2代中紫萼片茄子和绿颜色萼片茄子的酶切产物检测结果。
图3为一种EGC277 CAPS分子标记酶切片段多态性示意图。
M为DL2000 Marker,DL2000 DNA marker从上至下条带大小依次是2000bp、1000bp、750bp、500bp、250bp和100bp。A1-24、B1-24和C1-24分别代表不同地方来源的茄子酶切扩增产物检测结果。
具体实施方式
下面结合实施例及附图对本发明作进一步详细的描述,但本发明的实施方式不限于此。若未特别指明,实施例中所用的技术手段为本领域技术人员所熟知的常规手段。
实施例1:茄子萼片颜色遗传群体的构建和DNA提取
(1)群体构建
本发明实施例中使用茄子品种GP05(绿色萼片茄子)和PP05(紫色萼片茄子)为亲本,在春秋大棚进行杂交(正交)和自交,配制成遗传群体,即Pl、P2、和F2。遗传群体同时定值于大棚,不分离世代P1、P2、Fl各种30株,F2分离种240株,常规栽培管理。
两亲本和遗传群体的茄子达到商品成熟期,收获后进行鉴定。根据茄子种质资源描述规范,每株采收两个达到商品成熟、符合品系特征且发育正常的对茄,于深色背景板上拍摄果萼照片,室内进行比色分级。根据供试材料亲本及F2群体果萼颜色分离表现,为能尽可能覆盖所有中间过渡色类型和便于统计分析,将茄子种质资源描述规范定为绿、杂绿、紫绿、杂紫和紫色五类。
(2)DNA提取
亲本绿萼片茄子GP05和紫萼片茄子PP05分别为10个单株混合样提取DNA;从F2代中随机挑取22份绿色萼片植株(F2代中资源描述规范定为绿的株系),一起构成绿色萼片子代混池BSAg,从F2代中随机挑取22份紫色萼片茄子(F2代中资源描述规范定为紫的株系),一起构成紫色萼片茄子子代混池BSAp;共计4个样本池。
利用CTAB法提取以上四个样本池的叶片总DNA,具体步骤如下:取0.1克新鲜子叶,经液氮研磨或者钢珠打碎、2×CTAB裂解液裂解、氯仿抽提、异丙醇沉淀和70%乙醇洗涤等过程,最终DNA沉淀溶解于20μL TE溶液。用紫外分光光度计测定DNA的浓度,于-20℃冰箱中保存备用。
实施例2:高通量测序寻找绿色萼片茄子关联区域
(1)高通量测序:萼片颜色相关SNP筛选:利用Hiseq2500测序平台测序,对提取的茄子亲本GP05、PP05,以及茄子绿色萼片子代混池BSAg、茄子紫色萼片子代混池BSAp进行高通量测序。
(2)测序原始序列处理:将高通量测序得到的原始图像数据文件经碱基识别(basecalling)分析,转化为原始测序序列(raw data)。然后根据一定的规则,对测序得到的原始测序序列进行过滤处理,主要标准如为:1)去除带接头的reads对;2)当单端测序read中N的比例大于10%时,需要去除此对reads;3)当单端测序read中含有低质量(低于5)碱基数超过该条read长度比例的50%时,需要去除此对reads。过滤处理后得到的序列为cleanreads。
(3)SNP位点检测:将过滤之后得到的clean reads,比对到参考基因组(GenBankaccession No.BAUE00000000.1),并利用GATK软件对四个样本(GP05、PP05、BSAg和BSAp)进行SNP检测,然后用ANNOVAR软件对四个样本检测到的SNP位点的位置信息、类型进行注释。同样,分别利用GATK软件检测四个样本的InDel,利用ANNOVAR软件对四个样本检测到的InDel位点的位置信息、类型进行注释。
(4)目标性状区域定位:先对混池样本BSAg、BSAp中检测出来的SNP位点进行过滤:1)去除任意一个混池中reads支持数目小于5的位点;2)过滤亲本SNP类型为杂合的位点。从而得到高质量的可信SNP位点。然后通过QTL-seq方法,以两个混池样本SNP-index显著差异的位点,从将目标性状关联到基因组的相关区域。SNP-index的计算方法为:基因组上某一个位点支持突变碱基的reads署名/该位点总reads数目。然后计算两个混池间差异的SNP位点,SNP位点的差异可以用Δ(SNP-index)来衡量,计算方法为:Δ(SNP-index)=SNP-index(BSAg)-SNP-index(BSAp)。
(5)目标性状关联区域的确定:由于茄子参考基因组为scaffold水平(33873条),通过滑动窗口(窗口大小1kb,步长100bp)和拟合曲线的方法,对每条scaffold进行作图,选取存在Δ(SNP-index)值超过99%置信区间的scaffold,认为该scaffold与目标性状相关联。通过该方法一共筛选出42条与萼片颜色性状相关联的scaffold。
实施例3:多态性引物的设计与合成
根据高通量测序所获得的42条可能与绿色萼片性状相关联的scaffold序列特征,设计了34对Caps引物,并选择BglII、HindIII、MboI、NcoI、NdeI和XbaI作为鉴定限制性内切酶。通过这些引物,对两个亲本DNA进行PCR扩增,PCR扩增产物经限制性内切酶酶切后,再通过琼脂糖凝胶电泳和染色后,对条带的大小进行判别,筛选多态性引物。引物序列由北京奥克生物技术有限公司合成,限制性内切酶购于NEB公司。
实施例4:CAPS分子标记引物的筛选与检测方法
(1)从亲本中各随机选择10株DNA等量混合,作为筛选引物的模板。将引物溶解后,对亲本DNA进行PCR扩增。反应体系为:
其中,rTaq、DNA聚合酶配套缓冲液、dNTPs为Takara(中国大连)的产品。
(2)PCR扩增程序为:
(3)PCR产物酶切反应体系为(以BglII为例):
37℃恒温箱中孵育3小时,加入终止液终止反应。其中,限制性内切酶和限制性内切酶配套缓冲液为NEB公司产品。
(4)琼脂糖凝胶电泳、成像与分析:
制备浓度为1.5%的琼脂糖凝胶:称取0.3克琼脂糖,加入到含20mL 0.5×TBE缓冲液的三角瓶中,微波炉加热至琼脂糖完全溶解,溶液完全澄清时停止加热,冷却至55℃左右,加入1μL GeneRed核酸染液(天根生化科技(北京)有限公司)。待凝胶完全凝固后,放入水平电泳槽中,取9μL含终止液的酶切产物加入到凝胶点样孔中,接通电源进行电泳,电泳条件为:电泳仪电压200V,电泳时间18min。然后通过紫外凝胶成像系统(BIO-RAD Gel DocXR+凝胶成像分析系统)进行拍照。观察两亲本PCR产物酶切后条带位置差异。
(5)引物多态性鉴定:以亲本GP05和PP05的DNA为模板,通过PCR扩增,所合成的34对引物均能扩增出特异性条带。分别用相应的内切酶BglII、HindIII、MboI、NdeI、NcoI和XbaI酶切之后,电泳检测,发现有7对引物扩增片段的酶切产物呈现多态性。
(6)茄子绿色萼片CAPS分子标记的确定:以不同萼片颜色的茄子为材料,进一步验证上述呈现多态性的7对引物,以判断扩增产物酶切片段多态性是否与萼片颜色相关。最终发现,引物EGC277扩增片段酶切产物的多态性,与茄子萼片颜色连锁性较好。
该对引物序列为:EGC277_F:TCATGTTCCATGTGATTGCC;
EGC277_R:TCCCTCCGGAAATTCTTCTT。PCR扩增产物大小为277bp,
扩增片段序列(5’-3’)为:
TCATGTTCCATGTGATTGCCAATTAATTTGTCTTTGTT
以限制性内切酶BglII酶切之后,绿色萼片茄子酶切产物大小为:238bp和39bp;紫色萼片茄子为277bp;其他过渡色萼片茄子(茄子种质资源描述规范定杂绿、紫绿、杂紫的材料)为238bp和277bp。因此,最终EGC277确定为茄子绿色萼片相关的分子标记。
实施例5:CAPS分子标记EGC277在茄子萼片颜色甄别中的适用性鉴定
选择不同颜色萼片(绿、中间色和紫色)的茄子材料共计72份,这些材料均为本科室搜集不同地方来源的品种资源,这些材料与本发明中的亲本材料具有不同的地方来源,这些材料可作为测试该引物是否均有普遍适用性的供试材料。对本发明的CAPS分子标记进行验证。利用CTAB法提取上述茄子叶片的基因组DNA,将EGC277CAPS分子标记对应的引物用于PCR扩增,并用BglII对PCR扩增产物进行酶切和片段大小鉴定(见实施例4)。
(1)田间资源描述结果表明:
A1-23、B6、B20-24以及C17-24号共35个样本为绿萼片茄子,
A24、B1-5、B7、B8以及C1-10共18个样本为紫色萼片茄子;
B9-19以及C11-16共16个样本为中间色萼片茄子;
(2)EGC277 CAPS标记检测显示:
从图3可以看出:
1)在绿色萼片茄子中,该CAPS分子标记有32个样本酶切能够得到238bp的特有条带,有3个株系不符合标记检测结果,其中A1和A5酶切能够得到277bp和238bp的条带而A9仅能得到277bp的条带;
2)在紫色萼片茄子中,该CAPS分子标记在18个样本中酶切均能够得到277bp的条带,全部跟分子标记结果一致;
3)在中间色茄子中,该CAPS分子标记在12个样本中酶切能够得到277bp和238bp的条带,有3个株系符合分子标记检测结果,其中B11、B13和C13样本中酶切仅能够得到277bp的条带。
4)另外有3个株系没扩增出任何片段,编号分别为A3、A23和B15,这些材料可能DNA降解等因素未扩增出来,在最后的分析中已剔除。
在这个实施案例中,本发明开发出检测茄子绿色萼片的分子标记EGC277 CAPS及其检测引物,对于萼片颜色甄别的准确率高达89%(表3;69份材料中有62份田间资源性状观测结果与分子标记检测结果一致),且可以从叶片水平,在苗期进行鉴定,不仅节约生产成本,而且操作简便等特点,能够对茄子萼片颜色进行有效地检测,可用于萼片相关茄子的选育。
表3利用EGC277 CAPS分子标记鉴别茄子萼片颜色的数据。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
序列表
<110> 武汉市农业科学院
<120> 一种与茄子萼片颜色性状基因紧密连锁的CAPS分子标记及制备方法
<160> 3
<170> SIPOSequenceListing 1.0
<210> 1
<211> 277
<212> DNA
<213> 茄(Solanum melongena)
<400> 1
tcatgttcca tgtgattgcc aattaatttg tctttgttag atcggcagtc ggctcgacat 60
ccctcttgta attttttttt aaagagggta acgtggttaa attgatcact attgtccatg 120
cttttccaac ctctactttt ttcacaaaaa agtacacgtt gacccatcaa aaaatcacag 180
caaacgtacc ttccaagacg atttggttct tcatttttct ccatcatcga gcaatttgat 240
tgctttgatg ctaaaacaag aagaatttcc ggaggga 277
<210> 2
<211> 20
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 2
tcatgttcca tgtgattgcc 20
<210> 3
<211> 20
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 3
tccctccgga aattcttctt 20
