一种耐高温脂肪酶基因tllgold及其应用
文献发布时间:2023-06-19 09:29:07
技术领域
本发明涉及基因工程技术领域,特别涉及一种耐高温脂肪酶基因tllgold及其应用。
背景技术
脂肪酶(EC3.1.1.3)具有水解甘油三酯为游离脂肪酸和甘油的功能,同时能催化酯合成、酯交换、酸解等多种反应。因此,脂肪酶具有非常广泛的用途,例如:在食品中,脂肪酶能够用于水解食物原料中的油酯起到乳化增白、酯化增香的作用;在饲料中,脂肪酶可以水解原料中的油脂,提高动物对饲料中油脂的利用率;在生物能源领域,利用脂肪酶的转酯作用,可以生产生物柴油等清洁能源;在洗涤领域,可以用于去脂去污;在医药领域,可用于前体药物的合成和手性药物的拆分。
脂肪酶的工业应用不仅需要脂肪酶具有高活性,而且需要脂肪酶具有优秀的耐温性。例如在饲料加工过程中,饲料的制粒和干燥均需要高温,普通非耐高温脂肪酶在高温下很容易哀失活性;在油酯加工领域,脂肪酶用于大豆油脂脱胶时需要高温环境;在生物柴油生产领域也需要一定的高环境提高油酯原料的流动性提高转化效率。因此,耐高温脂肪酶具有广阔的工业应用前景。
发明内容
本发明的主要目的是提出一种脂肪酶基因tllgold及其应用,旨在提供一种可以编码得到耐高温的脂肪酶的脂肪酶基因。
为实现上述目的,本发明提出一种脂肪酶基因tllgold,用于编码耐高温脂肪酶,所述脂肪酶基因tllgold的核苷酸序列如SEQ ID NO:1所示。
本发明还提出一种耐高温脂肪酶TLLGold,所述耐高温脂肪酶TLLGold由如上所述的脂肪酶基因tllgold编码所得,所述耐高温脂肪酶TLLGold的氨基酸序列如SEQ ID NO:2所示。
本发明还提出一种重组表达载体,包括如上所述的脂肪酶基因tllgold。
本发明还提出一种如上所述的重组表达载体的制备方法,包括以下步骤:
将脂肪酶基因tllgold的两端分别引入限制性内切酶EcoR I和Not I,得到双酶切的脂肪酶基因片段;
将所述双酶切的脂肪酶基因片段插入表达载体中,得到重组表达载体。
本发明还提出一种重组表达菌株,包括如上所述的脂肪酶基因tllgold。
可选地,所述重组表达菌株的宿主细胞为毕赤酵母(Pichia pastoris)。
本发明还提出一种如上所述的重组表达菌株的制备方法,包括如下步骤:
将脂肪酶基因tllgold的两端分别引入限制性内切酶EcoR I和Not I,得到双酶切的脂肪酶基因片段;
将所述双酶切的脂肪酶基因片段插入表达载体中,得到重组表达载体;
将所述重组表达载体线性化之后导入宿主细胞中,获得重组表达菌株。
本发明还提出一种如上所述的耐高温脂肪酶TLLGold的制备方法,包括如下步骤:
将脂肪酶基因tllgold的两端分别引入限制性内切酶EcoR I和Not I,得到双酶切的脂肪酶基因片段;
将所述双酶切的脂肪酶基因片段插入表达载体中,得到重组表达载体;将所述重组表达载体线性化之后导入宿主细胞中,获得重组表达菌株;
培养所述重组表达菌株,从培养物中获得耐高温脂肪酶TLLGold。
本发明还提出一种水解油脂的方法,包括以下步骤:在水解油脂的反应中加入如上所述的耐高温脂肪酶TLLGold,其中,所述油脂包括植物油。
可选地,所述植物油为花生油、大豆油或菜籽油。
本发明提供的脂肪酶基因tllgold,是在原疏棉状嗜热丝孢菌(Thermomyceslanuginosus)的脂肪酶TLL(GenBank accession number:AF054513)的基础上,通过人工的理性设计改造对TLL进行了定点突变改造,得到改造后的脂肪酶TLLGold氨基酸序列,然后根据该脂肪酶TLLGold的氨基酸序列,人工重新设计脂肪酶基因的核苷酸序列,采用高频率的密码子替换低频率的密码子,降低了基因编码的mRNA的二级结构的复杂度和最小自由能,平衡基因中GC的含量及分布,移除基因中的重复序列和顺式作用单元,设计出了新型脂肪酶基因tllgold序列,由该脂肪酶基因tllgold编码所得的脂肪酶TLLGold具有耐高温的特点,在80℃环境下放置12h后仍然可以保持79%的酶活力,能够适用于多种需要脂肪酶耐高温的工业应用场景。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅为本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
图1为本发明实施例1中脂肪酶突变位点的设计图;
图2为本发明实施例1中原始脂肪酶基因tll中密码子使用频率的比较;
图3为本发明实施例1中优化后的脂肪酶基因tllgold中密码子使用频率的比较;
图4为本发明实施例2中构建的重组表达载体pPICZαA-tll的酶切检验结果;
图5为本发明实施例2中构建的重组表达载体pPICZαA-tllgold的酶切检验结果;
图6为本发明实施例3中构建的重组表达菌株在摇瓶中发酵后的发酵上清液的SDS-PAGE测试结果;
图7为本发明实施例3中构建的重组表达菌株在摇瓶中发酵后的发酵上清液的酶活测试结果;
图8为本发明实施例3中获得的耐高温脂肪酶TLLGold在80℃下、60min内酶活随时间的变化图;
图9为本发明实施例3中获得的耐高温脂肪酶TLLGold在80℃下、12h内酶活随时间的变化图;
图10为本发明实施例3中构建的耐高温脂肪酶TLLGold的重组表达菌株在不同发酵时间下的SDS-PAGE检测图;
图11为本发明实施例3中构建的耐高温脂肪酶TLLGold的重组表达菌株在发酵罐条件下上清液的酶活力和上清液的蛋白含量变化随时间的变化柱状图;
图12为本发明实施例3中获得的耐高温脂肪酶TLLGold对大豆油的转化率;
图13为本发明实施例3中获得的耐高温脂肪酶TLLGold对菜籽油的转化率;
图14为本发明实施例3中获得的耐高温脂肪酶TLLGold对花生油的转化率。
具体实施方式
为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
本发明提出一种脂肪酶基因tllgold,用于编码耐高温脂肪酶,所述脂肪酶基因tllgold的核苷酸序列如SEQ ID NO:1所示。
本发明提供的脂肪酶基因tllgold,是在原疏棉状嗜热丝孢菌(Thermomyceslanuginosus)的脂肪酶TLL(GenBank accession number:AF054513)的基础上,通过人工的理性设计改造对tll2a进行了定点突变改造,具体改造过程包括:通过定点突变的方法将第17位的丝氨酸突变为丙氨酸(S17A),在该位置引入一个疏水性氨基酸,加强酶分子的疏水性,从而增加其耐热性;将91位甘氨酸突变为丙氨酸(G91A),增强Lidα-螺旋的稳定性,同时特增强该Lid的疏水性,以便更好的进入疏水性的底物环境,从而增加酶活性;将第109位甘氨酸突变为丙氨酸(G109A),第114位苏氨酸突变为酪氨酸(T114Y),第154为缬氨酸突变为异亮氨酸(V154I),从而在空间上系在一起的三个氨基酸,突变之后,使局部形成一个疏水区域,可以提高酶分子的热稳定性。
由此得到改造后的脂肪酶TLLGold氨基酸序列,所述耐高温脂肪酶TLLGold的氨基酸序列如SEQ ID NO:2所示,然后根据该耐高温脂肪酶TLLGold的氨基酸序列,人工重新设计脂肪酶基因的核苷酸序列,采用高频率的密码子替换低频率的密码子,降低了基因编码的mRNA的二级结构的复杂度和最小自由能,平衡基因中GC的含量及分布,移除基因中的重复序列和顺式作用单元,从而提高重组菌株中耐高温脂肪酶的表达量,由此设计出了新型脂肪酶基因tllgold序列,然后通过人工合成的方法获得脂肪酶基因tllgold片段,由该脂肪酶基因tllgold编码所得的脂肪酶TLLGold具有耐高温的特点,在80℃环境下放置12h后仍然可以保持79%的酶活力,能够适用于多种需要脂肪酶耐高温的工业应用场景。
可以理解的是,定点突变技术以及人工合成基因的技术为本领域常规的方法,具体操作步骤为本领域技术人员所公知,在此不做赘述。原始脂肪酶TLL的氨基酸序列如SEQID NO:3所示,原始脂肪酶TLL的脂肪酶基因tll的核苷酸序列如SEQ ID NO:4所示。
本发明还提出一种重组表达载体,所述重组表达载体包括如上所述的脂肪酶基因tllgold。在脂肪酶TLLGold的氨基酸序列和脂肪酶基因tllgold的核苷酸序列确定的情况下,可以选择合适的表达载体或其他功能单位。对于重组表达载体的制备方法采用基因工程常规手段即可实现,在本发明具体实施时,例如可采用毕赤酵母表达载体pPICZαA,也可以选用其他毕赤酵母表达载体。
本发明还提出一种如上所述的重组表达载体的制备方法,包括以下步骤:
步骤S1、将脂肪酶基因tllgold的两端分别引入限制性内切酶EcoR I和Not I,得到双酶切的脂肪酶基因片段;
步骤S2、将所述双酶切的脂肪酶基因片段插入表达载体中,得到重组表达载体。
具体地,在本发明的一实施例中,所述表达载体为毕赤酵母表达载体pPICZαA,对应地,所述重组表达载体的制备方法包括:将脂肪酶基因tllgold的两端分别引入限制性内切酶EcoR I和Not I,得到双酶切的脂肪酶基因片段;然后将所述双酶切的脂肪酶基因片段插入到毕赤酵母表达载体pPICZαA,获得脂肪酶重组表达载体pPICZαA-tllgold。
本发明还提出一种重组表达菌株,包括如上所述的脂肪酶基因tllgold,所述重组表达菌株的表达产物为氨基酸序列如SEQ ID NO:2所述的耐高温脂肪酶TLLGold。所述重组表达菌株在构建时可以选用合适的宿主细胞,例如选择基因工程领域常用的宿主细胞均可,在本发明的一实施例中优选可选择毕赤酵母作为宿主细胞,脂肪酶在重组菌株中具有更高的表达量。
本发明还提出一种如上所述的重组表达菌株的制备方法,包括如下步骤:
步骤S10、将脂肪酶基因tllgold的两端分别引入限制性内切酶EcoR I和Not I,得到双酶切的脂肪酶基因片段;
步骤S20、将所述双酶切的脂肪酶基因片段插入表达载体中,得到重组表达载体;
步骤S30、将所述重组表达载体线性化之后导入宿主细胞中,获得重组表达菌株。
具体地,在本发明的一实施例中,所述表达载体为毕赤酵母表达载体pPICZαA,所述宿主细胞为毕赤酵母,对应地,所述重组表达菌株的制备方法包括:将脂肪酶基因tllgold的两端分别引入限制性内切酶EcoR I和Not I,得到双酶切的脂肪酶基因片段;然后将所述双酶切的脂肪酶基因片段插入到毕赤酵母表达载体pPICZαA,获得脂肪酶重组表达载体pPICZαA-tllgold;然后用限制性内切酶BamH I将所述重组表达载体pPICZαA-tllgold线性化,再通过电转化的方式将线性化之后的重组表达载体pPICZαA-tllgold导入毕赤酵母中,并在含有Zeocin
本发明还提出一种如上所述的耐高温脂肪酶TLLGold的制备方法,包括如下步骤:
步骤S100、将脂肪酶基因tllgold的两端分别引入限制性内切酶EcoR I和Not I,得到双酶切的脂肪酶基因片段;
步骤S100、将所述双酶切的脂肪酶基因片段插入表达载体中,得到重组表达载体;
步骤S300、将所述重组表达载体线性化之后导入宿主细胞中,获得重组表达菌株;
步骤S400、培养所述重组表达菌株,从培养物中获得耐高温脂肪酶TLLGold。
经过步骤S100至步骤S300获得所述重组表达菌株,然后对所述重组表达菌株进行发酵培养,从发酵上清液中获得表达产物,即获得所述耐高温脂肪酶。具体地,在本发明的一实施例中,所述表达载体为毕赤酵母表达载体pPICZαA,所述宿主细胞为毕赤酵母,对应地,所述耐高温脂肪酶TLLGold的制备方法包括:将脂肪酶基因tllgold的两端分别引入限制性内切酶EcoR I和Not I,得到双酶切的脂肪酶基因片段;然后将所述双酶切的脂肪酶基因片段插入到毕赤酵母表达载体pPICZαA,获得脂肪酶重组表达载体pPICZαA-tllgold;然后用限制性内切酶BamH I将所述重组表达载体pPICZαA-tllgold线性化,再通过电转化的方式将线性化之后的重组表达载体pPICZαA-tllgold导入毕赤酵母中,并在含有Zeocin
由本发明提供的核苷酸序列如SEQ ID NO:1所示的脂肪酶基因tllgold编码所得的耐高温脂肪酶TLLGold具有耐高温的特点,在80℃环境下放置12h后仍然可以保持79%的酶活力,能够适用于多种需要脂肪酶耐高温的工业应用场景,比如应用于水解食物原料中的油脂,水解动物饲料原料中的油脂,用于生产生物柴油等清洁能源,应用于洗涤领域起到去脂去污的目的,也可以应用于前体药物的合成和手性药物的拆分。基于此,本发明还提出一种水解油脂的方法,包括以下步骤:在水解油脂的反应中加入如上所述的耐高温脂肪酶TLLGold,其中,所述油脂包括植物油。
在实际操作时,将一定量的所述耐高温脂肪酶TLLGold加入到油脂,在一定条件下与油脂充分接触,即可实现油脂的水解。优选地,所述植物油为花生油、大豆油或菜籽油,本发明提供的脂肪酶基因tllgold编码所得的脂肪酶TLLGold对花生油、大豆油和菜籽油具有优良的水解能力。
以下结合具体实施例和附图对本发明的技术方案作进一步详细说明,应当理解,以下实施例仅仅用以解释本发明,并不用于限定本发明。
实施例1脂肪酶基因tllgold的构建
(1)在原疏棉状嗜热丝孢菌(Thermomyces lanuginosus)的脂肪酶TLL(GenBankaccession number:AF054513,序列如SEQ ID NO:3所示)的基础上,先对脂肪酶TLL进行定点突变改造,具体改造过程包括:通过定点突变的方法将第17位的丝氨酸突变为丙氨酸(S17A),在该位置引入一个疏水性氨基酸,加强酶分子的疏水性,从而增加其耐热性;将91位甘氨酸突变为丙氨酸(G91A),增强Lidα-螺旋的稳定性,同时特增强该Lid的疏水性,以便更好的进入疏水性的底物环境,从而增加酶活性;将第109位甘氨酸突变为丙氨酸(G109A),第114位苏氨酸突变为酪氨酸(T114Y),第154为缬氨酸突变为异亮氨酸(V154I),从而在空间上系在一起的三个氨基酸,突变之后,使局部形成一个疏水区域,可以提高酶分子的热稳定性。
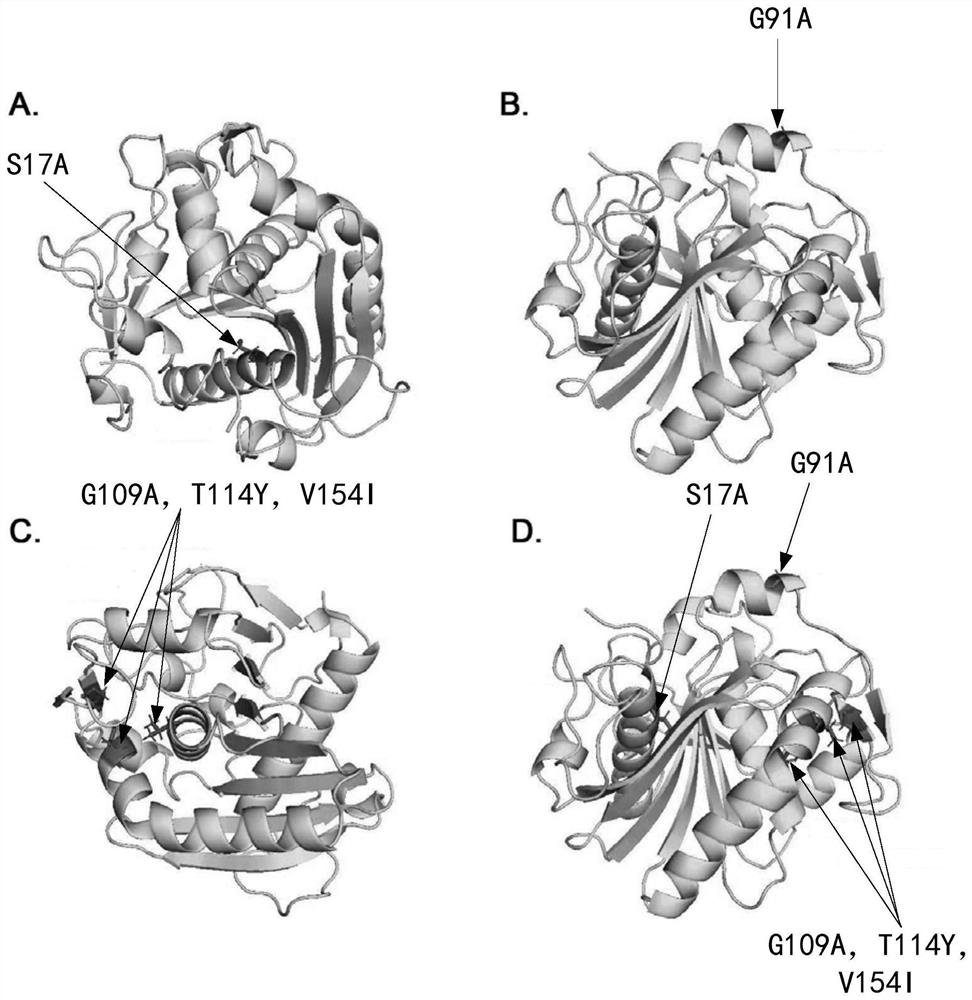
图1所示为步骤(1)中脂肪酶TLL突变位点的设计,其中:图1A为第17为丝氨酸突变为丙氨酸(S17A);图1B为第91位甘氨酸突变为丙氨酸(G91A);图1C为第109为甘氨酸突变为丙氨酸(G109A),第114位苏氨酸突变为酪氨酸(T114Y),第154为缬氨酸突变为异亮氨酸(V154I);图1D为各突变位点在脂肪酶中的位置。
(2)由步骤(1)得到改造后的脂肪酶TLLGold氨基酸序列如SEQ ID NO:2所示,然后根据该耐高温脂肪酶TLLGold的氨基酸序列,在线人工重新设计脂肪酶基因的核苷酸序列,采用高频率的密码子替换低频率的密码子,降低了基因编码的mRNA的二级结构的复杂度和最小自由能,平衡基因中GC的含量及分布,移除基因中的重复序列和顺式作用单元,从而提高重组菌株中耐高温脂肪酶的表达量,由此设计出了新型脂肪酶基因tllgold序列,然后通过人工合成的方法获得脂肪酶基因tllgold片段,其序列如SEQ ID NO:1所示。
图2和图3为原始脂肪酶TLL的脂肪酶基因tll(序列如SEQ ID NO:4所示)和改造后的耐高温脂肪酶TLLGold的脂肪酶基因tllgold中密码子的使用频率对比图,其中,图2为原始脂肪酶TLL前100个氨基酸的密码子使用频率图,图3为改造后的脂肪酶TLLGold前100个氨基酸的密码子使用频率图。由图2和图3可以看出,经本实施例优化后的脂肪酶TLLGold的密码子使用频率明显高于原始脂肪酶TLL。
实施例2重组表达载体的构建
(1)在设计耐高温脂肪酶基因tllgold时已经将两端加上酶切位点EcoR I和NotI,将该含该基因的质粒同时由EcoR I和Not I酶切并收集酶切产物;将载体pPICZαA同时由EcoR I和Not I酶切并收集酶切产物;其中,酶切体系为:20μL DNA、1μL EcoR I、1μL NotI、10μL的Buffer H加水补齐至100μL体积,在37℃条件下酶切4h;
(2)将上述tllgold基因的酶切产物和载体pPICZαA的酶切产物用T
(3)原始脂肪酶基因tll的重组表达载体采用与上述步骤(1)、(2)相同的方式构建,得到重组表达载体pPICZαA-tll。
图4至图5所示为本实施例构建的重组表达载体的酶切检验结果,其中,图4为原始脂肪酶基因tll的重组表达载体pPICZαA-tll的酶切检验结果(图4中:M为DL5000 DNAMarker,1泳道为重组表达载体pPICZαA-tll经EcoR I单酶切验证,2泳道为重组表达载体pPICZαA-tll经EcoR I和Not I双酶切验证),图5为改造后的脂肪酶基因tllgold的重组表达载体pPICZαA-tllgold的酶切检验结果(图5中:M为DL5000 DNA Marker,1和2泳道为重组表达载体pPICZαA-tllgold经EcoR I单酶切验证,3泳道为重组表达载体pPICZαA-tllgold经EcoR I和Not I双酶切验证)。
由图4和图5可以看出,单酶切验证在4.7kb位置有条带,双酶切验证在1.0kb、3.7kb位置有条带,说明原始脂肪酶基因tll和改造后的脂肪酶基因tllgold均成功连接至pPICZαA重组表达载体上。
实施例3重组表达菌株的构建及发酵培养生产脂肪酶
(1)将实施例3获得的重组表达载体pPICZαA-tllgold通过电转化的方法转入巴斯德毕赤酵母中,电转化方法如下:(i)采用Bgl II酶切pPICZαA-tllgold,使其线性;(ii)取10μL上述重组表达质粒线性化产物与90μL新鲜毕赤酵母感受态细胞混合,放在冰盒上冰浴5min;(iii)打开电转仪,调节电击参数,电压1600V,电阻200Ω,电容25μF,将冰浴的线性化产物与感受态细胞混合物转入冰上遇冷的电转杯进行电击;(iv)迅速向电转杯中加入1mL已在28℃预热的YPD,将转入1.5mL无菌离心管中,静置于28℃培养箱2h;(v)取100μL菌液涂布于含Zeocin抗性的YPD平板,于28℃培养箱中静置培养3天,待长出单菌落后,即获得含脂肪酶基因tllgold的毕赤酵母重组表达菌株。
(2)原始脂肪酶基因tll的重组表达菌株采用与上述步骤(1)相同的方式构建,得到含脂肪酶基因tll的毕赤酵母重组表达菌株。
(3)将上述步骤(1)和(2)得到的重组表达菌株接种于装有25mL YPD培养基中,28℃恒温振荡培养。当OD
(4)脂肪酶活性的测定:采用橄榄油乳化液4mL为底物,Tris-HCl(pH=7.0,50mM)5mL为缓冲液,加入1mL适当稀释过的发酵上清液,在40℃下反应10min,随后取出置冰上并加入20mL无水乙醇终止反应。样品组及对照组每瓶滴加25μL酚酞作为指示剂,用0.05mol/L氢氧化钠标准溶液滴定,当反应液显色红色时,以此判定为到达滴定终点;以样品组及对照组所消耗的氢氧化钠标准溶液的体积差值计算脂肪酶活力。
其中,实验组消耗氢氧化钠标准溶液的体积为V
脂肪酶的活性定义为:1mL液体酶在上述温度和pH条件下,1min水解底物产生1μmol的可滴定的脂肪酸,即为一个酶活力单位。
(5)蛋白含量测定采用Bradford法,具体操作步骤如下:分别取含10~100μg蛋白质溶液,用无菌双蒸水调体积至0.1mL;加入5mL蛋白试剂,充分震荡混匀,2~3min后于595nm处测定吸光度值。以0.1mL双蒸水及5mL蛋白试剂作为空白对照;用不同浓度的蛋白质溶液作标准曲线,绘制标准曲线作为定量依据。
图6所示为本实施例中原始脂肪酶基因tll的重组表达菌株和改造后的脂肪酶基因tllgold的重组表达菌株,经过发酵后上清液的SDS-PAGE测试结果,图6中:M为蛋白质Marker,泳道1-6为不同菌株。图7为原始脂肪酶基因tll的重组表达菌株和改造后的脂肪酶基因tllgold的重组表达菌株,经过发酵后上清液中酶活性的变化柱状图。
由图6和图7可以看出,优化后的脂肪酶TLLGold无论是在上清液中的蛋白质含量,还是脂肪酶的活性,均明显高于原始脂肪酶TLL。
实施例4脂肪酶的耐热性分析
(1)将原始脂肪酶TLL和优化后的耐高温脂肪酶TLLGold发酵产物上清液在80℃下放置处理,在0~60min内每10min取一次样,在0~12h内每1h取一次样,将处理后的样品进行酶活测定,设处理0min时的样品酶活为100%,计算处理不同时间的样品酶活。
图8和图9所示为原始脂肪酶TLL和优化后的脂肪酶TLLGold在80℃放置不同时间时的酶活,其中图8为在80℃放置0~60min时,每隔10min取样测得的酶活随时间的变化图;图9为在80℃放置0~12h时,每隔1h取样测得的酶活随时间的变化图。
由图8和图9可以看出,本发明实施例优化后的脂肪酶TLLGold的耐高温特性明显优于原始的脂肪酶TLL,具体表现在:在80℃放置处理60min,原始脂肪酶TLL的酶活力为未经80℃放置处理时的55%,优化后的脂肪酶TLLGold的酶活力保持率则为98%;在80℃放置处理6h时,原始脂肪酶TLL的剩余酶活力仅为未经80℃放置处理时的5%,而经改造优化后的脂肪酶TLLGold的酶活保持率则为91%;在80℃放置处理12h时,原始脂肪酶TLL则未检测出酶活力,而经重新设计优化后的脂肪酶TLLGold的仍保有79%的酶活力。
实施例5耐高温脂肪酶TLLGold在50L小型发酵罐中的产酶能力评估实验
(1)取优化后的耐高温脂肪酶TLLGold重组表达菌株接种于100mL YPD液体培养基28℃摇床震荡培养12h作为一级种子液,取60mL一级种子液接种于3L YPD液体培养基28℃摇床震荡培养14~16h作为二级种子液;配制28L无机盐基础培养基并作灭菌处理,并用氨水调pH值为5.5;将上述3L二级种子液转接入发酵罐中,其过程严格遵循无菌操作。
(2)发酵过程分为营养生长阶段及甲醇诱导阶段。营养生长阶段又可以细分快速生长阶段、营养流加阶段。快速生长阶段为0~20h左右,毕赤酵母利用基础无机盐培养基中的碳元素及无机盐等快速生长;营养流加阶段为20~28h,每1L流加液补充5mL微量元素、5mL生物素及甘油与葡萄糖(每升流加液含10g葡萄糖和10g甘油)溶液,时间持续8h。在发酵前28h,菌体生长状况良好,鲜重达到130g/L。
随后进入甲醇诱导阶段,在诱导阶段:按照甲醇比甘油为8:1的比例全程混饲诱导,同时添加微量元素与生物素溶液(每1L流加液补加5mL微量元素液和5mL生物素)。甲醇流加速度控制在2~4mL/L/h。在混饲诱导发酵过程中,细胞鲜重由诱导期的130g/L上升为175g/L,控制温度在29±0.5℃,通风比1:1.5,发酵液pH用氨水调节,使其维持在pH=5.5左右至发酵结束。发酵开始时每隔24h取样一次,并测定发酵上清液中脂肪酶的活性及蛋白含量。
图10所示为优化后的耐高温脂肪酶TLLGold重组菌株50-L发酵罐发酵后上清液的SDS-PAGE测试结果,图10中:M为蛋白质Marker,泳道1-8分别为发酵24h、48h、72h、96h、120h、144h、168h、192h的蛋白表达情况。图11为优化后的脂肪酶TLLGold重组菌株发酵后上清液的酶活以及其蛋白含量的变化。
由图10和图11可以看出,耐高温脂肪酶TLLGold重组菌株发酵192h后,脂肪酶活性达到29000U/mL,蛋白含量为4.6mg/mL。
实施例6耐高温脂肪酶TLLGold对菜籽油、花生油、大豆油的水解反应转化率测试
(1)菜籽油、花生油、大豆油中游离脂肪酶的测定:分别取5mL菜籽油、花生油、大豆油充分乳化,用5mL的pH7.0的Tris缓冲液重悬乳化液,以酚酞溶液作为指示剂,取30μL分别加入到不同油脂的乳化液中,用50mM氢氧化钠溶液滴定,可获得菜籽油、花生油、大豆油中游离脂肪酸的含量。
(2)脂肪酶TLLGold对来自菜籽粕的菜籽油、来自花生粕的花生油、来自大豆粕的大豆油水解反应转化率的测定:
取50mL菜籽油、花生油、大豆油充分乳化,并分别用45mL的pH7.0的Tris缓冲液重悬,加入5mL适当稀释的脂肪酶TLLGold,40℃水浴振荡反应6h;每小时分别取1mL样品采用实施例3中的氢氧化钠溶液滴定法分别测定脂肪酶TLLGold水解菜籽油、花生油、大豆油后释放出的游离脂肪酸的量。
图12、图13和图14分别为耐高温脂肪酶TLLGold对菜籽油、花生油、大豆油的水解曲线。由图12、图13和图14可以看出,在4h时,各油类已被水解87%以上,在6h时,耐高温脂肪酶TLLGold对各油类的水解达95%。
综上所述,本发明通过对原始脂肪酶TLL进行人工设计与改造氨基酸,得到了具有耐高温和高酶活力的耐高温脂肪酶TLLGold,显著提高了脂肪酶的耐高温特性和表达水平,其在50-L发酵罐中发酵,发酵192h时酶活可达到29000U/mL,说明本发明优化得到的耐高温脂肪酶TLLGold在耐高温特性和酶活上比原始脂肪酶TLL有了极大的提高,具有良好的应用潜力,尤其对来自花生粕、大豆粕和菜籽粕中的花生油、大豆油和菜籽油具有优良的水解能力;此外,本发明提供的耐高温脂肪酶TLLGold制备工艺简单且产量高,便于实现工业生产。
以上仅为本发明的优选实施例,并非因此限制本发明的专利范围,凡是利用本发明说明书及附图内容所作的等效结构或等效流程变换,或直接或间接运用在其他相关的技术领域,均同理包括在本发明的专利保护范围内。
SEQUENCE LISTING
<110> 武汉轻工大学
<120> 一种脂肪酶基因ttlgold及其应用
<130> 20201105
<160> 4
<170> PatentIn version 3.5
<210> 1
<211> 810
<212> DNA
<213> 人工合成
<400> 1
gaagttagtc aggatttatt caatcaattt aacctgtttg ctcaatacgc cgctgctgct 60
tactgcggta agaacaatga cgccccagcc ggtactaaaa taacttgcac tggtaatgct 120
tgtcctgagg tcgaaaaagc cgatgccacg ttcttgtatt cttttgaaga cagtggagtg 180
ggagacgtca cgggattctt ggcattggat aacactaaca agcttatagt actatctttc 240
agaggaagta gatccataga gaattggatt gcaaatctaa attttgatct gaaagagatc 300
aatgacatat gttccggatg tagagctcac gatggttttt actcctcttg gagatcagtc 360
gctgataccc tgagacaaaa agttgaggac gctgtgagag agcatcctga ttatcgtgta 420
gttttcacag gacattcact tggtggagct ttagcaacga tcgccggagc tgatcttaga 480
ggtaacggtt acgatatcga tgttttttct tacggcgctc caagagtcgg taacagagcc 540
tttgccgaat ttttaactgt ccagacgggt ggtactttat accgaattac ccacactaac 600
gacatcgttc caagacttcc accaagagag tttggttatt ctcactcatc tccagaatac 660
tggatcaaga gtggtactct ggttcctgtt actagaaatg acattgtcaa gatagaaggt 720
atcgacgcaa ctggaggaaa taatcagcct aatattccag acattcccgc tcatctatgg 780
tacttcggtt tgatcggaac ctgtctataa 810
<210> 2
<211> 269
<212> PRT
<213> 人工合成
<400> 2
Glu Val Ser Gln Asp Leu Phe Asn Gln Phe Asn Leu Phe Ala Gln Tyr
1 5 10 15
Ala Ala Ala Ala Tyr Cys Gly Lys Asn Asn Asp Ala Pro Ala Gly Thr
20 25 30
Lys Ile Thr Cys Thr Gly Asn Ala Cys Pro Glu Val Glu Lys Ala Asp
35 40 45
Ala Thr Phe Leu Tyr Ser Phe Glu Asp Ser Gly Val Gly Asp Val Thr
50 55 60
Gly Phe Leu Ala Leu Asp Asn Thr Asn Lys Leu Ile Val Leu Ser Phe
65 70 75 80
Arg Gly Ser Arg Ser Ile Glu Asn Trp Ile Ala Asn Leu Asn Phe Asp
85 90 95
Leu Lys Glu Ile Asn Asp Ile Cys Ser Gly Cys Arg Ala His Asp Gly
100 105 110
Phe Tyr Ser Ser Trp Arg Ser Val Ala Asp Thr Leu Arg Gln Lys Val
115 120 125
Glu Asp Ala Val Arg Glu His Pro Asp Tyr Arg Val Val Phe Thr Gly
130 135 140
His Ser Leu Gly Gly Ala Leu Ala Thr Ile Ala Gly Ala Asp Leu Arg
145 150 155 160
Gly Asn Gly Tyr Asp Ile Asp Val Phe Ser Tyr Gly Ala Pro Arg Val
165 170 175
Gly Asn Arg Ala Phe Ala Glu Phe Leu Thr Val Gln Thr Gly Gly Thr
180 185 190
Leu Tyr Arg Ile Thr His Thr Asn Asp Ile Val Pro Arg Leu Pro Pro
195 200 205
Arg Glu Phe Gly Tyr Ser His Ser Ser Pro Glu Tyr Trp Ile Lys Ser
210 215 220
Gly Thr Leu Val Pro Val Thr Arg Asn Asp Ile Val Lys Ile Glu Gly
225 230 235 240
Ile Asp Ala Thr Gly Gly Asn Asn Gln Pro Asn Ile Pro Asp Ile Pro
245 250 255
Ala His Leu Trp Tyr Phe Gly Leu Ile Gly Thr Cys Leu
260 265
<210> 3
<211> 269
<212> PRT
<213> Thermomyces lanuginosus
<400> 3
Glu Val Ser Gln Asp Leu Phe Asn Gln Phe Asn Leu Phe Ala Gln Tyr
1 5 10 15
Ser Ala Ala Ala Tyr Cys Gly Lys Asn Asn Asp Ala Pro Ala Gly Thr
20 25 30
Asn Ile Thr Cys Thr Gly Asn Ala Cys Pro Glu Val Glu Lys Ala Asp
35 40 45
Ala Thr Phe Leu Tyr Ser Phe Glu Asp Ser Gly Val Gly Asp Val Thr
50 55 60
Gly Phe Leu Ala Leu Asp Asn Thr Asn Lys Leu Ile Val Leu Ser Phe
65 70 75 80
Arg Gly Ser Arg Ser Ile Glu Asn Trp Ile Gly Asn Leu Asn Phe Asp
85 90 95
Leu Lys Glu Ile Asn Asp Ile Cys Ser Gly Cys Arg Gly His Asp Gly
100 105 110
Phe Thr Ser Ser Trp Arg Ser Val Ala Asp Thr Leu Arg Gln Lys Val
115 120 125
Glu Asp Ala Val Arg Glu His Pro Asp Tyr Arg Val Val Phe Thr Gly
130 135 140
His Ser Leu Gly Gly Ala Leu Ala Thr Val Ala Gly Ala Asp Leu Arg
145 150 155 160
Gly Asn Gly Tyr Asp Ile Asp Val Phe Ser Tyr Gly Ala Pro Arg Val
165 170 175
Gly Asn Arg Ala Phe Ala Glu Phe Leu Thr Val Gln Thr Gly Gly Thr
180 185 190
Leu Tyr Arg Ile Thr His Thr Asn Asp Ile Val Pro Arg Leu Pro Pro
195 200 205
Arg Glu Phe Gly Tyr Ser His Ser Ser Pro Glu Tyr Trp Ile Lys Ser
210 215 220
Gly Thr Leu Val Pro Val Thr Arg Asn Asp Ile Val Lys Ile Glu Gly
225 230 235 240
Ile Asp Ala Thr Gly Gly Asn Asn Gln Pro Asn Ile Pro Asp Ile Pro
245 250 255
Ala His Leu Trp Tyr Phe Gly Leu Ile Gly Thr Cys Leu
260 265
<210> 4
<211> 810
<212> DNA
<213> Thermomyces lanuginosus
<400> 4
gaggtctcgc aggatctgtt taaccagttc aatctctttg cacagtattc tgcagccgca 60
tactgcggaa aaaacaatga tgccccagct ggtacaaaca ttacgtgcac gggaaatgcc 120
tgccccgagg tagagaaggc ggatgcaacg tttctctact cgtttgaaga ctctggagtg 180
ggcgatgtca ccggcttcct tgctctcgac aacacgaaca aattgatcgt cctctctttc 240
cgtggctctc gttccataga gaactggatc gggaatctta acttcgactt gaaagaaata 300
aatgacattt gctccggctg caggggacat gacggcttca cttcgtcctg gaggtctgta 360
gccgatacgt taaggcagaa ggtggaggat gctgtgaggg agcatcccga ctatcgcgtg 420
gtgtttaccg gacatagctt gggtggtgca ttggcaactg ttgccggagc agacctgcgt 480
ggaaatgggt atgatatcga cgtgttttca tatggcgccc cccgagtcgg aaacagggct 540
tttgcagaat tcctgaccgt acagaccggc ggaacactct accgcattac ccacaccaat 600
gatattgtcc ctagactccc gccgcgcgaa ttcggttaca gccattctag cccagagtac 660
tggatcaaat ctggaaccct tgtccccgtc acccgaaacg atatcgtgaa gatagaaggc 720
atcgatgcca ccggcggcaa taaccagcct aacattccgg atatccctgc gcacctatgg 780
tacttcgggt taattgggac atgtctttag 810
