一种qPCR试剂盒及应用
文献发布时间:2023-06-19 09:30:39
技术领域
本发明涉及生物医学领域,具体涉及一种可定量检测接受CAR-T疗法病人血液中的CAR基因拷贝数的qPCR方法
背景技术
嵌合抗原受体T细胞(CAR-T)疗法是目前最为火热的过继细胞疗法之一,这种新型的癌症治疗方法是利用生物工程技术,在T细胞表面表达嵌合抗原受体,从而重定向T细胞使其能特异性结合肿瘤细胞发挥作用,再经过体外扩增后输送回患者体内,达到靶向杀伤肿瘤细胞的效果。CAR-T疗法根据其核心元件——T细胞表面表达的嵌合抗原受体(CAR)的结构的变化,已经经历了四代的演变和优化。第一代CAR的结构是将能特异性结合目标靶点的单链抗体(scFv)与CD3复合体中最具T细胞激活能力的ζ链融合,在scFv特异性结合相应受体后,有效激活T细胞,增强T细胞功能从而达到精准杀灭靶细胞的效果,但是CD3ζ信号激活域并不能促使T细胞的有效,持续的扩增,这使得第一代CAR-T疗法在临床应用于肿瘤患者中时,未产生显著的治疗效果。因此,在二代的CAR-T疗法当中,人们在一代CAR的结构基础上,在CD3ζ结构域的上游融合了另一共刺激结构域(CD28,4-1BB等)用于促进T细胞激活后的扩增或增加IL-2的释放,以助于CAR-T细胞杀灭靶细胞的效力更好发挥,随后的三代CAR-T疗法则是在二代疗法的基础上加入更多共刺激结构域(OX40,CD27,ICOS,MYD88-CD40等),尝试多共刺激结构域能否进一步增强CAR-T细胞的功能。而四代的CAR-T细胞(又称TRUCK细胞)疗法则联合了细胞因子(如IL-12等)用以加强CAR-T细胞免疫应答。直至目前,美国FDA已批准通过了两款不同的二代CAR-T疗法,作为治疗ALL和弥漫性大B细胞淋巴瘤(DLBCL)的推荐疗法,根据相关临床治疗数据显示,CAR-T疗法作用成果显著,其中对于晚期复发难治性ALL的完全缓解率(CR)更是达到令人惊奇的90%以上,成功挽救了无数血液瘤患者。截至到2019年6月,在全球范围内,约有超过100种CAR-T疗法的临床试验正在如火如荼的进行当中,繁多的CAR-T疗法和临床试验为临床试验的安全性提出了更为严苛的要求,急需一种能快速,灵敏的监控和观察患者体内CAR-T细胞增殖和变化过程的一种检测方法,以保证CAR-T疗法的安全性和助力对于CAR-T细胞疗法临床研究的深入。
定量实时聚合酶链反应(qPCR)是一种灵敏的核酸检测和定量方法。它广泛应用于基础和生物医学研究、体内诊断和应用测试。对于DNA样本中的一个或多个特定序列,qPCR可同时进行检测和定量。数量可以是绝对拷贝数,也可以是相对数量,当标准化为DNA输入或额外的正常化基因时。该程序遵循聚合酶链反应的一般原理;其主要特点是不同于普通PCR,即PCR产物在PCR结束时检测,扩增的DNA随着反应的进行而“实时”检测。目前定量PCR中检测产物的方法有两种,一种是插入双链DNA结合染料,另一种是使用荧光染料标记的探针。双链核酸专用的插层染料与双链核酸插入后,荧光增强,因此,核酸扩增过程中产生的双链核酸分子越多,荧光增强越高。因此,通过使用插层染料,可以实时检测双链PCR产物的合成,并且这种方法允许参考标准样品来确定初始DNA浓度。然而,作为结果,这种方法也有一个缺点,即正确的产物和非特异性产物(如引物二聚体)之间没有区别。而且,这种方法不能用来比较不同目标的水平。PCR产物的特异性可以通过使双链PCR产物逐渐升温形成特征性解离或熔融曲线来确定。通过熔融曲线分析,可以直观地观察底漆二聚体和非特异性产物的形成,从而监控qPCR的性能。另一方面,第二种方法,即基于探针的检测/定量,使用基于序列的基于DNA的荧光报告探针,该探针识别同一PCR扩增子中的其他特定序列。序列特异性探针只对感兴趣的序列进行定量,而不是所有的ds-DNA。这些探针含有荧光报告物,如荧光素、罗丹明等等,以及一种阻止荧光的猝灭剂。荧光报告基团和猝灭基团彼此靠近,以便猝灭基团防止荧光。一旦探针定位并与互补目标杂交,则报告基团和猝灭基团分离。根据所用探头的类型,将它们分开的方法也会有所不同。分离后,消除猝灭并产生荧光信号。然后测量信号来量化DNA的数量。
发明内容
发明目的
本发明提供一种qPCR试剂盒,其可以定量检测接受CAR-T疗法病人血液中的CAR基因拷贝数。
技术方案
一种qPCR试剂盒,其特征在于含有
针对CKDN-1内参基因的Forward Primer 1:GAAAGCTGACTGCCCCTATTTG,
Reverse primer 1:GAGAGGAAGTGCTGGGAACAAT;
TaqMan Probe 1序列为:5’-VIC-CTCCCCAGTCTCTTT-NFQ-MGB-3’;针对CAR基因的上下游引物序列分别为:
Forward Primer 2:CGACATCTATATCTGGGCTC,
Reverse primer 2:AAGGGTTGCTTGAAGATG;
TaqMan Probe 2序列为:5’-VIC-AGTCCTCCTGCTGAGCCTGG-NFQ-MGB-3’。
所述的qPCR试剂盒,其特征在于:试剂盒还有2×qPCR TaqMan Probe MasterMix、50×High or Low Rox、pCAR重组质粒和pCDKN-1重组质粒。
一种可定量检测接受CAR-T疗法病人血液中的CAR基因拷贝数的qPCR方法,其特征在于:包含以下步骤:
(1)选定人体细胞基因组中稳定表达的一单拷贝基因CKDN-1作为内参基因,根据内参基因及已知CAR基因的相应序列,设计特异性引物及探针引物,同时设计并合成分别包含CAR基因和CKDN-1基因片段序列的pCAR重组质粒和pCDKN-1重组质粒;
(2)制备qPCR反应液;
(3)以待测样本核酸、pCAR重组质粒和pCDKN-1重组质粒为模板,进行qPCR反应;
(4)采集荧光信号进行结果分析及定量计算,得出检测血样中的CAR基因拷贝数及占样本中总有核细胞的比值;
其中步骤(1)中引物,探针的序列如下:
针对CKDN-1内参基因的Forward Primer 1:GAAAGCTGACTGCCCCTATTTG,
Reverse primer 1:GAGAGGAAGTGCTGGGAACAAT;
TaqMan Probe 1序列为:5’-VIC-CTCCCCAGTCTCTTT-NFQ-MGB-3’;
针对CAR基因的上下游引物序列分别为:
Forward Primer 2:CGACATCTATATCTGGGCTC,
Reverse primer 2:AAGGGTTGCTTGAAGATG;
TaqMan Probe 2序列为:5’-VIC-AGTCCTCCTGCTGAGCCTGG-NFQ-MGB-3’。
所述的方法,其特征在于步骤(2)所述的qPCR反应液的组成为2×qPCR TaqManProbe Master Mix 5μL;10μmol/L的Forward Primer 1或2 0.2μL;10μmol/L的Reverseprimer 1或2 0.2μL;10μmol/L的TaqMan Probe 1或20.1μL;50×High or Low Rox 0.2μL;RNase-free Water加至9μL。
所述的方法,其特征在于步骤(3)中待测样本核酸及两种重组质粒作为模板加入量均为1μL,qPCR反应条件为:预变性95℃1分钟,变性95℃10s,退火60℃30s,40个循环。
所述的方法,其特征在于步骤(3)中两种重组质粒模板各根据梯度稀释的方法用水稀释得到100ng/μL--10-6ng/μL八个浓度梯度的质粒溶液。
有益效果
本发明提供一种qPCR试剂盒及建立了一种能快速定量检测病人血样中CAR基因拷贝数变化的qPCR技术方法,补全了临床实验过程中针对CAR-T疗法扩增监控方法的缺失。本发明采用TaqMan探针的逆转录定量聚合酶链反应(RT-qPCR)技术,在4h,24h的不同时间点均能有效检测到病人血样中的CAR基因拷贝数,为了解CAR-T细胞治疗过程中,患者体内的CAR-T细胞增殖和变化情况建立了一种非常简便、灵敏、高效、快捷、廉价的检测技术体系,适用于应用到CAR-T细胞治疗的各种临床监控体系当中
附图说明
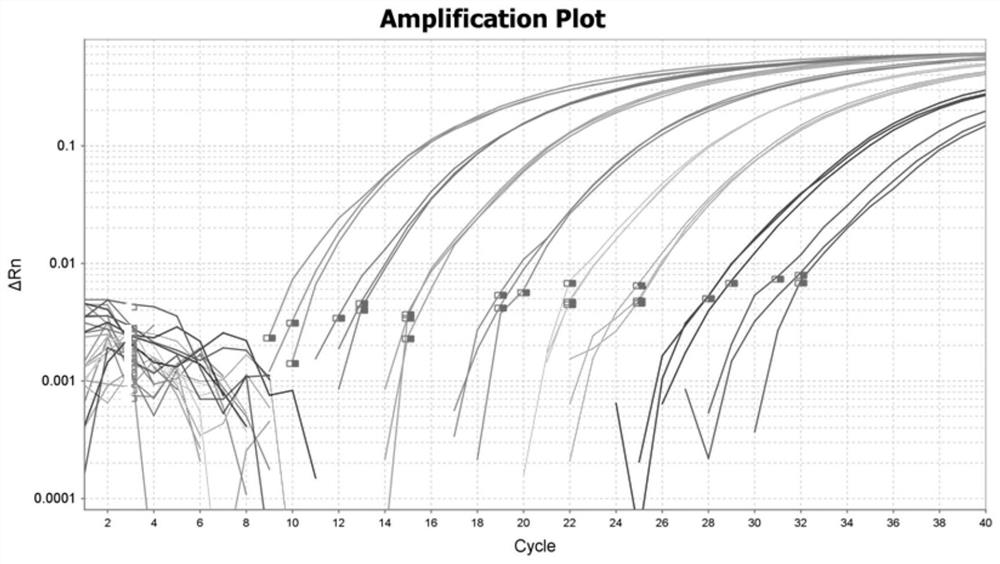
图1为CDKN-1质粒梯度稀释制作标曲所得到的扩增曲线
图2为CAR质粒梯度稀释制作标曲所得到的扩增曲线
图3为CKDN-1基因扩增标准曲线
图4为CAR基因扩增标准曲线
图5为病人回输CAR-T细胞后4h时的血样所得到的CDKN-1和CAR基因的扩增曲线
图6为病人回输CAR-T细胞后24h时的血样所得到的CDKN-1和CAR基因的扩增曲线
图7为重组质粒pCAR的质粒结构示意图
图8为重组质粒pCDKN-1的质粒结构示意图
图9为本发明示意图,其中第一至10试剂管依次为试剂管1-10,盒本体11。
具体实施方式
为了进一步阐述本发明所用的技术手段,以下通过具体实施方式来进一步解释本发明的技术方案,但本发明并非局限在实施例范围内。
本发明提供了一种将包括CAR和IL-7/IL-15慢病毒同时转导入T细胞的嵌合抗原受体T细胞的制备方法,包括纯化T细胞的获取、慢病毒的制备、嵌合抗原受体T细胞的获取、分泌型靶向HER2CAR-T细胞的特性检测。
实施例1
一种qPCR试剂盒,其特征在于含有试剂管和盒本体11;其中
第一试剂管1中设有针对CKDN-1内参基因的Forward Primer 1:GAAAGCTGACTGCCCCTATTTG,
第二试剂管2中设有针对CKDN-1内参基因的Reverse primer 1:GAGAGGAAGTGCTGGGAACAAT;
第三试剂管3中设有TaqMan Probe 1:5’-VIC-CTCCCCAGTCTCTTT-NFQ-MGB-3’;
第四试剂管4中设有针对CAR基因的Forward Primer 2:CGACATCTATATCTGGGCTC,
第五试剂管5内设有针对CAR基因的Reverse primer 2:AAGGGTTGCTTGAAGATG;
第六试剂管6内设有TaqMan Probe 2:5’-VIC-AGTCCTCCTGCTGAGCCTGG-NFQ-MGB-3’;
第七试剂管7内设有2×qPCR TaqMan Probe Master Mix;
第八试剂管8内设有50×High or Low Rox;
第九试剂管9内设有pCAR重组质粒
第十试剂管10内设有pCDKN-1重组质粒。
实施例2
1、准备样本和核酸提取
对于CAR-T回输后的临床样本,我们将所得病人全血通过Takara全血DNA提取试剂盒提取全血DNA,并在-20℃条件下保存备用。
2、引物和标准品质粒的合成
针对CAR基因和CKDN-1基因设计两对引物和探针。同时委托金唯智公司合成包含两种基因片段序列的两个重组质粒pCAR(质粒示意图见图6)与pCDKN-1(质粒示意图见图7)。
将pCAR和pCDKN-1两种重组质粒用灭菌水梯度稀释共八个梯度,得到从100ng/μL-10
其中:
针对CKDN-1内参基因的Forward Primer 1:
GAAAGCTGACTGCCCCTATTTG,
Reverse primer 1:GAGAGGAAGTGCTGGGAACAAT;
TaqMan Probe 1序列为:5’-VIC-CTCCCCAGTCTCTTT-NFQ-MGB-3’;针对CAR基因的上下游引物序列分别为:
Forward Primer 2:CGACATCTATATCTGGGCTC,
Reverse primer 2:AAGGGTTGCTTGAAGATG;
TaqMan Probe 2序列为:5’-VIC-AGTCCTCCTGCTGAGCCTGG-NFQ-MGB-3’。
3、进行qPCR反应
分别以病人全血样品提取DNA核酸、两个梯度稀释有八个梯度的重组质粒为模板,使用特异性引物和探针进行qPCR扩增反应,仪器通道同时选择VIC为Reporter和NFQ-MGB为Quencher进行实验。
(1)qPCR扩增反应的10μL反应体系为:模板DNA 1μl,反应液9μl;qPCR反应液的组成为2×qPCR TaqMan Probe Master Mix 5μL;10μmol/L的Forward Primer 0.2μL;10μmol/L的Reverse primer 0.2μL;10μmol/L的TaqMan Probe 0.1μL;50×High or Low Rox0.2μL;RNase-free Water加至9μL.
(2)qPCR扩增参数为:预变性95℃1分钟,变性95℃10s,退火60℃30s,40个循环。所得结果如图1,2,5,6所示。
4、样品中CAR基因绝对拷贝数计算
根据两个稀释有八个浓度梯度(100ng/μL--10
综上所述,本发明建立了一种能快速定量检测病人血样中CAR基因拷贝数变化的qPCR技术方法,补全了临床实验过程中针对CAR-T疗法扩增监控方法的缺失。采用TaqMan探针的逆转录定量聚合酶链反应(RT-qPCR)技术比SYBR Green的特异性好,有特异性探针,结果特性强。在4h,24h的不同时间点均能有效检测到病人血样中的CAR基因拷贝数,为了解CAR-T细胞治疗过程中,患者体内的CAR-T细胞增殖和变化情况建立了一种非常简便、灵敏、高效、快捷、廉价的检测技术体系,适用于应用到CAR-T细胞治疗的各种临床监控体系当中。
申请人声明,以上对本发明中涉及的技术手段及方案进行了详细阐述,但是其只是作为范例,本发明的保护范围并不局限于上述具体实例。所属技术领域的人员对本发明所做的任何等同变换或改进,均包括在本发明的保护范围及公开范围内。
序列表
<110> 山东省医学科学院附属医院 江苏艾洛特生物科技有限公司 江苏艾洛特医药研究院有限公司
<120> 一种qPCR试剂盒及应用
<160> 6
<170> SIPOSequenceListing 1.0
<210> 1
<211> 22
<212> DNA
<213> CKDN-1内参基因的Forward Primer 1(2 Ambystoma laterale x Ambystomajeffersonianum)
<400> 1
gaaagctgac tgcccctatt tg 22
<210> 2
<211> 22
<212> DNA
<213> CKDN-1内参基因的Reverse primer 1(2 Ambystoma laterale x Ambystomajeffersonianum)
<400> 2
gagaggaagt gctgggaaca at 22
<210> 3
<211> 15
<212> DNA
<213> TaqMan Probe 1(2 Ambystoma laterale x Ambystoma jeffersonianum)
<400> 3
ctccccagtc tcttt 15
<210> 4
<211> 20
<212> DNA
<213> CAR基因的Forward Primer 2(2 Ambystoma laterale x Ambystomajeffersonianum)
<400> 4
cgacatctat atctgggctc 20
<210> 5
<211> 18
<212> DNA
<213> CAR基因的Reverse primer 2(2 Ambystoma laterale x Ambystomajeffersonianum)
<400> 5
aagggttgct tgaagatg 18
<210> 6
<211> 20
<212> DNA
<213> TaqMan Probe 2(2 Ambystoma laterale x Ambystoma jeffersonianum)
<400> 6
agtcctcctg ctgagcctgg 20
