一种脐带血CIK细胞的扩增培养方法
文献发布时间:2023-06-19 09:40:06
技术领域
本发明涉及细胞培养技术领域,尤其涉及一种脐带血CIK细胞的扩增培养方法。
背景技术
CIK细胞本身就是人体内的一群异质细胞,具有高效杀伤感染、病变细胞的能力,只是在体质虚弱、亚健康人群中的CIK细胞由于生理方面的原因没有被激活,而CIK细胞经过体外激活扩增回输到体内后,CIK细胞会迅速活化攻击清除异常细胞。
当前脐带血主要根据细胞密度差异,借助离心产生的重力加速度,进行细胞的分离纯化进行血细胞分离。由于脐血与成人外周血相比,有核细胞数目多,富含造血干细胞,且脐血中红细胞体积较大,密度偏小。而常见淋巴细胞分离液密度介于1.075~1.090之间,主要适用于外周血分离,采用该方法应用到脐带血单个核细胞分离时会出现红细胞混杂,分层不明显的问题,干扰CIK细胞培养的效果。
发明内容
本发明提供了一种脐带血CIK细胞的扩增培养方法,解决了采用常规密度梯度离心方法分离脐带血单个核细胞分离会出现红细胞混杂,干扰CIK细胞培养的问题。
其具体技术方案如下:
本发明提供了一种脐带血CIK细胞的扩增培养方法,包括以下步骤:
步骤1:第0天,将脐带血单个核细胞接种于含IFN-γ和基础培养基的细胞培养袋进行培养;
步骤2:培养至第24h~26h后,加入OKT-3、IL-1α和IL-2继续培养;
步骤3:每天观测细胞培养状态,每隔2~3天进行细胞计数,若细胞出现增殖,补加IL-2和基础培养基继续培养,若细胞未出现增殖,于第4天补加IL-2;
步骤4:步骤3第一次补液后,每隔2~3天补加IL-2和基础培养基继续培养,培养至14~21天,收获脐带血CIK细胞。
IFN-γ:Ⅱ型干扰素,又称IFN-γ或免疫干扰素是由有丝分裂原刺激T淋巴细胞产生。干扰素是一种高效的抗病毒生物活性物质,又是一种具有广泛免疫调节作用的淋巴因子。
OKT-3:CD3单克隆抗体(OKT3)能针对CD3分子的单克隆抗体能够激发或阻断T细胞活化信号转导,清除效应T细胞或诱导调节T细胞的产生。具有激活T细胞增殖及活化作用。
IL-1α:白细胞介素-1,可使CD4+T细胞活化,促进B细胞生长和分化与IL-2或干扰素协同可以增强NK细胞活性。
IL-2:又称白细胞介素-2,是趋化因子家族的一种细胞因子。具有活化T细胞产生增殖,促进淋巴细胞生长、增殖、分化的多向性作用的细胞因子。
本发明中,细胞培养袋具有培养介质体积大,气体交换面积大的优点,可以在培养过程中将脐带血单个核细胞混杂的红细胞稀释,促进其自身快速代谢去除,避免红细胞混杂对培养效果影响,从而提高CIK细胞的纯度。本发明采用细胞培养袋进行培养,省去培养容器的蛋白包被的步骤,细胞培养袋操作简便,同样达到短时间(14d~21d)内CIK细胞快速活化扩增的目的。
本发明步骤1中,脐血单个核细胞的分离包括以下步骤:
将稀释后的脐血加入淋巴细胞分离液,800g离心30min,吸取白膜层进行重悬,600g离心10min,得到脐带血单个核细胞;
本发明中,脐血为新鲜采集不超过24h的脐带血,脐带血经称重后转移至离心管,吸取与脐血等体积的缓冲液加入离心管中混匀,得到稀释后的脐血,所述缓冲液优选为PBS、生理盐水或D-PBS缓冲液;再优选以2:1的体积比加至含淋巴细胞分离液的离心管中,使二者之间形成清晰的界面,优选以800g离心30min;所述离心后,离心管内的溶液分为4层,依次为血浆层、白膜层(CBMC层)、淋巴细胞分离液层、红细胞和粒细胞层,将含有CBMC的悬液吸出加入离心管中,优选再加入缓冲液重悬,以600g离心10min,弃上清,获得脐带血单个核细胞。
需要说明的是,由于常见淋巴细胞分离液密度介于1.075~1.090之间,主要适用于外周血分离,常规离心参数为2000rpm,离心20min。由于脐血与成人外周血相比,有核细胞数目多,富含造血干细胞,且脐血中红细胞体积较大,密度偏小。上述常规的密度梯度离心方法应用到脐带血分离时会出现红细胞混杂,分层不明显的问题,干扰影响下步细胞培养效果。本发明分离脐血单个核细胞时采用特定的离心参数800g离心30min,有利于细胞的分层,减少红细胞混杂的情况,本发明进一步在细胞洗涤过程中采用特定的离心参数600g离心10min,进一步有利于细胞的分层。
需要说明的是,常规的脐带血单个核细胞的接种密度为(1.0-2.0)×10
本发明步骤1中,所述IFN-γ在培养体系的终浓度为500-1500U/mL,优选为,更优选为1000U/mL。
本发明步骤2中,培养至24h~26h后(记为第1天),加入OKT-3、IL-1α和IL-2和基础培养基继续培养;所述OKT-3、所述IL-1α和所述IL-2同时在培养至24h、24.5h、25h、25.5h或26h内加入;
所述OKT-3、所述IL-1α和所述IL-2在培养体系的终浓度分别为30-70ng/mL、80-120U/mL、150-500U/mL,优选为40~60ng/mL、90~110U/mL、150~300U/mL,更优选为50ng/mL、100U/mL、200U/mL。
本发明步骤3具体为:培养至第3~4天,优选培养至第3天,若细胞明显增殖,补加IL-2和基础培养基,若细胞未明显增殖,于培养的第4天补加IL-2,确保整个培养过程中细胞密度为(2.0-4.5)×10
若细胞明显增殖时,补加IL-2在培养体系的终浓度为200-600U/mL,优选为200U/mL;若细胞未明显增殖,补加的IL-2在培养体系的终浓度为300-800U/mL,优选为200U/mL。
本发明步骤4中,在步骤3进行第一次补液后,每隔2~3天,优选每隔2天补加IL-2和基础培养基继续培养,培养至14~21天,优选培养至18天收获脐带血CIK细胞所述IL-2在培养体系的终浓度为250-800U/mL,优选为300-400U/mL,更优选为350U/mL。
本发明细胞培养初期,也即步骤1和步骤2中,细胞因子加入量较少,在步骤3和步骤4细胞因子的量逐渐加大,从而实现了CIK细胞快速增殖的目的。
本发明中,所述胎牛血清在步骤1、步骤2、步骤3和步骤4培养体系的终浓度为2-8vol%,优选为4.5vol%。
本发明中,所述培养优选在5%CO
所述基础培养基为含胎牛血清的无血清培养基;
所述无血清培养基选自GT-T551培养基、DWK培养基、Lonza培养基或X-VIVO 15培养基。
本发明在CIK细胞培养过程中,可根据细胞培养体系的体积及培养增殖情况进行分袋培养,所述细胞培养体系的体积可以为1200ml、1250ml、1300ml、1350ml、1400ml、1450ml、1500ml、1550ml、1600ml、1650ml、1700ml、1750ml或1800ml。
从以上技术方案可以看出,本发明具有以下优点:
本发明提供了一种脐带血CIK细胞的扩增培养方法,首次将细胞培养袋应用于脐带血分离的CIK细胞诱导培养,由于细胞培养袋具有培养介质体积大,气体交换面积大的优点,可以在培养过程中将脐带血单个核细胞混杂的红细胞稀释,促进其自身快速代谢去除,避免红细胞混杂对培养效果影响,从而提高CIK细胞的纯度。细胞培养袋操作简便,同样达到短时间(14d~21d)内CIK细胞快速活化扩增的目的。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动性的前提下,还可以根据这些附图获得其它的附图。
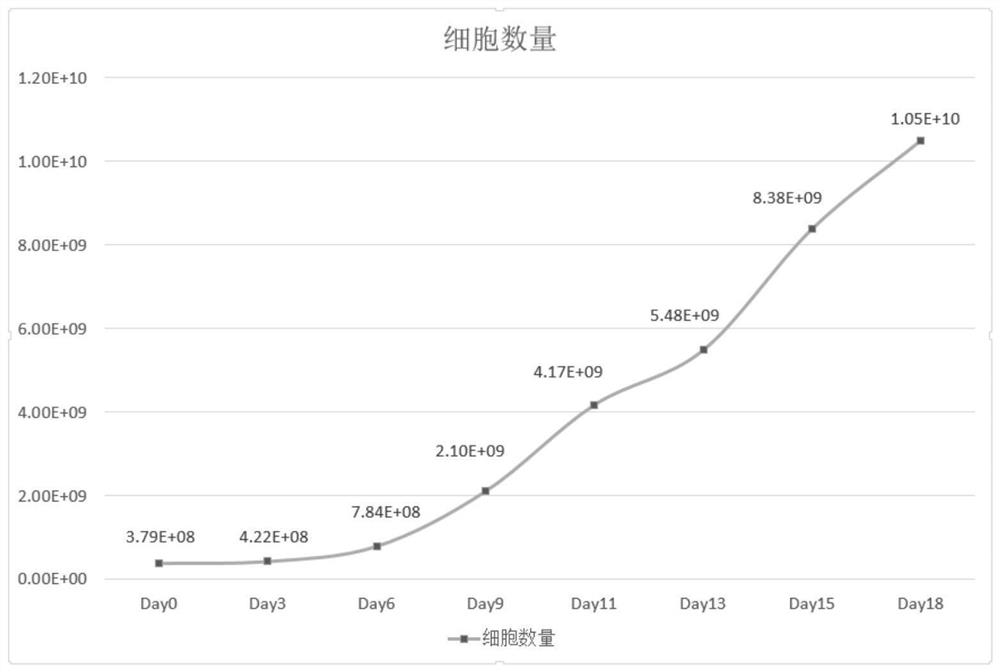
图1为本发明实施例2提供的脐带血CIK细胞增殖图;
图2为本发明实施例2提供的流式细胞检测图。
具体实施方式
为使得本发明的发明目的、特征、优点能够更加的明显和易懂,下面将对本发明实施例中的技术方案进行清楚、完整地描述,显然,下面所描述的实施例仅仅是本发明一部分实施例,而非全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其它实施例,都属于本发明保护的范围。
实施例1脐带血单个核细胞CBMC分离
(1)将85mL新鲜采集(不超过24h)的脐带血称重后转移至离心管。吸取与血液等体积的生理盐水加入离心管中,稀释血液并混合均匀。另取若干离心管,先用移液管向各管中加入淋巴细胞分离液,然后用移液管将稀释后的血液按2:1的比例缓慢加至淋巴细胞分离液的表面,使二者之间形成清晰的界面。将离心管配平后小心置于离心机中,800g离心30min。
(2)离心后小心取出离心管,从上到下分为4层,依次为血浆层、白膜层(CBMC层)、淋巴细胞分离液层、红细胞和粒细胞层。将上层含有CBMC的悬液吸出,转移至新的50mL离心管中。
(3)用移液管向离心管中加入适量RPMI-1640培养基重悬CBMC,600g离心10min。离心结束后弃上清,重复一次。加入适量的无血清培养基充分混匀细胞,计得CBMC细胞数3.79×108个。
实施例2 CIK细胞诱导扩增
(1)将实施例1分离得到的的CBMC中加入含2%胎牛血清的X-VIVO15无血清培养基重悬细胞沉淀,按2×10
(2)于培养24h后(第1天)补加50ng/mL OKT-3、100U/mL的IL-1α和200U/mL IL-2。
(3)每天观察培养液颜色及细胞状态,每隔2天取样进行细胞计数。根据细胞增殖情况,适当补加含2%胎牛血清的X-VIVO15培养基,同时按总量添加200U/mL IL-2,确保整个培养过程中细胞密度在2.0-4.5×10
(4)细胞培养18d时可将细胞离心收集,进行细胞计数与细胞活率检测及流式细胞检测,结果如图1和图2所示。
图1为本实施例提供的脐带血CIK细胞增殖图。图1的结果显示,细胞在18天内增殖约27倍。
图2为本实施例提供的流式细胞检测图。图2的结果显示,总T淋巴细胞(CD3+)占比99.96%,NKT细胞(CD3+CD56+)比率为34.19%。
实施例3
取另一份志愿者提供的95mL脐带血,使用与实施例1同样的分离CMBC方法,计得CBMC细胞数2.00×10^8,使用与实施例1同样的CIK培养方法。细胞培养18d时可将细胞收集,结果显示,细胞在18天内增殖约55倍;总T淋巴细胞(CD3+)占比99.30%,NKT细胞(CD3+CD56+)比率为20.37%。
以上所述,以上实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的精神和范围。
