切胶纯化同位素标记核酸探针的装置及刀具
文献发布时间:2023-06-19 09:40:06
技术领域
本发明属于生物技术领域,具体地说涉及一种切胶纯化同位素标记核酸探针的方法。本发明还涉及一种切胶纯化同位素标记核酸探针的装置。本发明还涉及一种切割电泳胶的刀具。
背景技术
同位素标记核酸探针具有灵敏度高、不改变核酸序列化学性质、可以检测皮克级目的片段的特性,在生命科学领域广泛使用。在用
国内发明专利CN106047863B公开了一种切胶纯化同位素标记核酸探针的方法。该方法包括如下步骤:步骤一:制备与目标同位素标记核酸探针具备相同碱基性质和碱基序列的核酸片段;步骤二:电泳分离所述核酸片段;步骤三:使用常规染色法定位所述核酸片段在电泳胶上的位置;步骤四:使用另一块与步骤二相同的电泳胶,采用与步骤二相同的条件,电泳分离目标同位素标记核酸探针;步骤五:经过与步骤二相同的时长后,停止电泳,切割步骤四所述电泳胶上的由步骤三所确定的位置处的胶块;步骤六:回收所述胶块中的同位素标记核酸探针。
发明专利CN106047863B提供了一种与同位素接触步骤少、操作同位素时间短的切胶纯化同位素标记核酸探针的方法。该方法通过预先确定电泳结束后同位素标记核酸探针在电泳胶上的具体位置,从而减少操作同位素所需的步骤和时间。该发明专利切胶纯化同位素标记核酸探针方法的不足之处在于:该方法需要使用两块电泳胶,要求两块电泳胶具备相同的化学和物理特性,并且要求在相同的条件下进行电泳。在实际操作过程中,由于是不同的两块电泳胶,而且是先后进行电泳,所以不太容易做到两块电泳胶的化学和物理性质绝对相同,也不太容易做到绝对相同的电泳条件。造成的结果是两块电泳胶上的核酸条带的位置发生偏移,从而降低了该方法切胶纯化探针的成功率。
发明内容
为克服上述切胶纯化同位素标记核酸探针的方法所存在的缺陷,本发明所要解决的技术问题是提供一种只需要使用一块电泳胶、一次电泳,即可完成的切胶纯化同位素标记核酸探针的方法。
与此相应,本发明另一个要解决的技术问题是提供一种应用紫外阴影法显示DNA条带的切胶纯化同位素标记核酸探针的装置。
另外,本发明又一个要解决的技术问题是提供一种快速切割电泳胶的刀具。
就切胶纯化同位素标记核酸探针的方法而言,为解决上述技术问题,本发明的方法由以下步骤组成:
步骤一:制备与目标同位素标记核酸探针具备相同碱基性质和碱基序列的核酸片段;
步骤二:电泳分离所述核酸片段和目标同位素标记核酸探针;
步骤三:使用紫外阴影法定位所述核酸片段在电泳胶上的位置;
步骤四:切割探针泳道对应位置处的胶块,回收目标同位素标记核酸探针。
目标同位素标记核酸探针可以是单链DNA、双链DNA、单链RNA或双链RNA中的任一种。
目标同位素标记核酸探针所使用的同位素可以是
本方法电泳采用的介质可以是聚丙烯酰胺凝胶。
放射性同位素和与其对应的非放射性同位素相比,具有相同的化学性质、分子量差异小。所以,同位素标记的核酸探针和与其对应的无标记的核酸片段在凝胶电泳过程中,具备相同的迁移率。使用紫外阴影法可以显现核酸片段泳道内的DNA条带。因为含量不足的原因探针泳道内的DNA条带无法通过紫外阴影法显现,但是其电泳后全长探针位置与核酸片段泳道内的DNA条带位置是一致的。切割探针泳道对应位置处的胶块,洗脱后即可获得全长探针。这是本方法的基本原理。
紫外阴影法原理:紫外光源在260nm波长从上方照射凝胶,凝胶内的DNA吸收紫外光,在石蜡膜或荧光薄层层析板的荧光背景下,DNA呈现深蓝色条带。
本发明切胶纯化同位素标记核酸探针的方法,使用无标记的核酸片段和目标同位素标记核酸探针在同一块凝胶的不同泳道内同步电泳。核酸片段使用紫外阴影法进行可视化定位,从而间接确定全长探针在凝胶上的位置。由于只需要使用一块电泳胶、一次电泳,从而从根本上解决了背景技术部分所述切胶纯化同位素标记核酸探针方法所要求的两块电泳胶具备相同的化学和物理特性,并且要求在相同的条件下进行电泳的问题。因为避免了先后使用两块电泳胶,从根本上避开了由此导致的核酸条带偏移问题,所以可显著提高切胶纯化探针的成功率。这是本发明的有益效果。
本发明共有四个步骤组成,背景技术部分所述的切胶纯化方法需要六个步骤。本发明只需要一块电泳胶一次电泳,而背景技术部分所述的切胶纯化方法需要两块电泳胶先后两次电泳。所以本发明更为简洁高效,节省时间,操作起来更加简单。这是本发明的又一个有益效果。
本发明的切胶纯化方法,在电泳时,核酸片段和核酸探针在电泳胶上位于相邻的两个泳道。这样,电泳结束后,使用紫外阴影法显现核酸片段,更容易定位探针泳道对应位置处的胶块。
本发明的切胶纯化方法,在电泳时,与核酸探针泳道相邻的两个泳道是核酸片段泳道。这样,电泳结束后,使用紫外阴影法显现核酸片段,更容易定位探针泳道对应位置处的胶块。
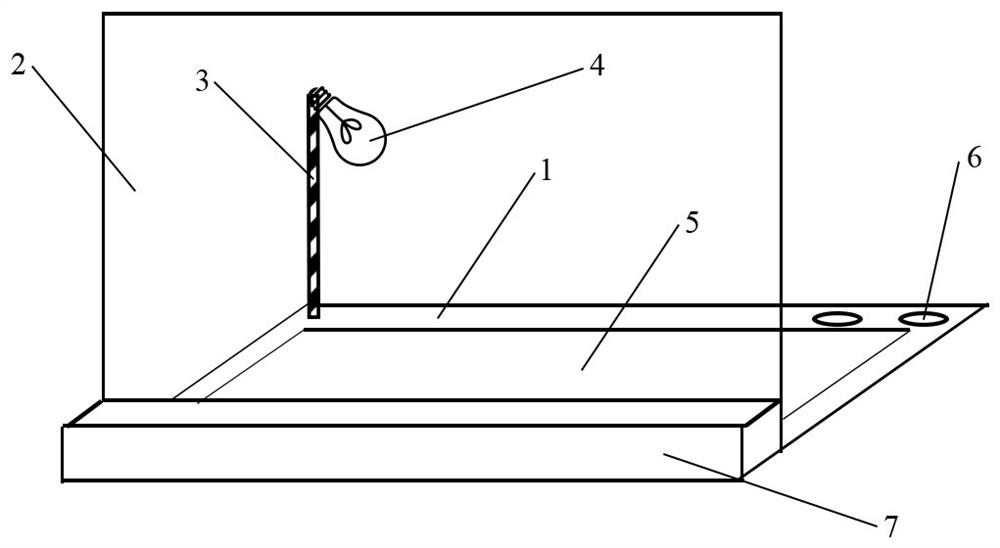
就切胶纯化同位素标记核酸探针的装置而言,本发明为解决所述技术问题的装置由底座和挡板组成,在底座上方设有紫外光源,紫外光源通过支架与底座连接,底座上设有显色面板。
此显色面板是一块荧光薄层层析板。此显色面板也可以是石蜡膜。
采用这样的结构后,由于紫外光源位于上方,发射出260nm波长的紫外光。紫外光从上方照射凝胶,凝胶内的DNA吸收紫外光,在石蜡膜或荧光薄层层析板的荧光背景下,DNA呈现深蓝色条带。全长探针位于探针泳道与此深蓝色条带相对应位置处。切割探针泳道对应位置处的胶块,洗脱后即可获得全长探针。
作为本发明切胶纯化同位素标记核酸探针装置的改进,该装置在底座上设有一个或多个挖孔,挖孔与各种规格的eppendorf离心管相匹配。eppendorf离心管的规格包括0.5ml、1.5 ml、5 ml等。采用这样的结构后,非常有利于在该装置上放置各种eppendorf离心管。切胶完成后,可以很方便地转移胶块至离心管。
作为本发明切胶纯化同位素标记核酸探针装置的进一步改进,该装置在挡板的外侧设有箱体。采用这样的结构后,可以把实验相关的常用耗材,如手套、离心管等放入箱体内,从而方便实验流程的完成。作为优化,箱体内放置保鲜膜和石蜡膜。这样,在需要的时候,可以很方便地使用。
就切割电泳胶的刀具而言,本发明为解决所述技术问题的刀具,由刀柄和刀头组成,刀头由四个刀片合围而成。
采用这样的结构后,由于刀头由四个刀片合围而成,切口呈口字形,所以只需切割一次,即可切下胶块。普通切割刀,如手术刀,切口呈一字型,需要切割四次才可以切下胶块。所以本发明的刀具可以显著缩短切胶时间。同时,由于本发明刀具的切口形状与电泳后核酸条带形状一致,所以,本发明的切胶刀具使用起来更为简单方便。
同位素具有强烈的放射性,能诱导细胞癌变及造成人体其他方面的伤害。这种放射性对人体的伤害与操作同位素的时间成正比。与同位素接触的时间越长,伤害越大。所以缩短操作时间非常有利于实验人员。
作为本发明切割电泳胶刀具的改进,该刀具的刀头的四个刀片是向内倾斜的。采用这样的结构后,由于四个刀片是向内倾斜的,所以刀口上缘的周长大于刀口下缘的周长,在切割凝胶时,刀口上缘可以更好地推开凝胶,从而让切割下的胶块更容易与原来的凝胶分离。作为优化,刀片向内倾斜的角度为5-15度。小于5度,作用不明显。大于15度,则切口倾斜过大,不利于切割胶块。
作为本发明切割电泳胶刀具的进一步改进,该刀具的刀柄和刀头为固定连接、卡扣连接或螺口连接方式中的一种。采用固定连接,刀具更为稳固耐用。采用卡扣连接或螺口连接,则方便更换刀头,有利于适应不同的切胶场景。
附图说明
下面结合附图和具体实施方式对本发明作进一步详细的说明。
图1是本发明的切胶纯化同位素标记核酸探针方法的流程图。
图2是本发明的切胶纯化同位素标记核酸探针方法的泳道示意图。
图3是使用本发明的方法所纯化探针的放射自显影图。
图4是本发明的切胶纯化同位素标记核酸探针装置的结构示意图。
图5是本发明的切割电泳胶刀具的结构示意图。
附图标记:1-底座,2-挡板,3-支架,4-紫外光源,5-显色面板,6-挖孔,7-箱体,21-刀柄,22-刀头,23-刀片,26-切口。
具体实施方式
如下的实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体实验条件的实验步骤或方法,通常按照常规实验条件,如Sambrook等编,《分子克隆:实验室手册》(New York:Cold Spring Harbor laboratory Press,2002)中所述的实验条件,或按照制造厂商所建议的实验条件。
本发明所指的“同位素”,如无特殊说明,一般是指具有放射性的同位素。
实施例1:
图1是本发明的切胶纯化同位素标记核酸探针方法的流程图。作为对比,右侧是现有切胶纯化同位素标记核酸探针的流程。虚线框表示该部分需要操作放射性同位素。
如图1所示,本发明的方法包括四个步骤。步骤一:制备与目标同位素标记核酸探针相对应的核酸片段;步骤二:电泳分离核酸片段和目标同位素标记核酸探针;步骤三:使用紫外阴影法定位核酸片段在电泳胶上的位置;步骤四:切割探针泳道对应位置处的胶块,回收探针。本发明的方法在一块电泳胶上完成,只需要一次电泳。
作为对比,现有切胶纯化同位素标记核酸探针的流程有六个步骤组成。该方法分为两个阶段,第一个阶段由前三个步骤组成,第二个阶段由后三个步骤组成。该方法需要使用两块电泳胶,先后进行两次电泳。第一阶段和第二阶段在不同的电泳胶上先后进行电泳。
制备目标同位素标记核酸探针。
本发明的方法适用于有特定序列的同位素标记核酸探针,可以使用各种已知的方法进行制备。这些方法包括:缺口平移法、末端加尾法、末端标记法、逆转录掺入法、体外转录法、PCR法。上述各种制备同位素标记核酸探针的方法有大量的参考文献及相应的商业化产品可用,如《分子克隆:实验室手册》、Invitrogen公司相关产品、Ambion公司相关产品等。核酸探针的序列可以是单链DNA、双链DNA、单链RNA或双链RNA,被标记的放射性同位素可以是
需要说明是,本发明的目的是提供一种切胶纯化同位素标记核酸探针的方法,所以制备同位素标记核酸探针只是为本发明提供工作对象,而不是本发明的步骤之一。
制备与目标同位素标记核酸探针相对应的核酸片段(步骤一)。
所谓与目标同位素标记核酸探针相对应的核酸片段,是指该核酸片段与目标同位素标记核酸探针具备相同的碱基性质和碱基序列。如目标同位素标记核酸探针是双链DNA,则所制备的核酸片段也是双链DNA,且两者的碱基序列相同。如目标同位素标记核酸探针是单链RNA,则所制备的核酸片段也是单链RNA,且两者的碱基序列相同。
制备与目标同位素标记核酸探针具备相同序列的核酸片段,可以采用与制备目标同位素标记核酸探针相同的方法,也可以是其他的方法,只要满足所制备的核酸片段与目标同位素标记核酸探针具备相同的碱基性质和碱基序列。如使用PCR法制备目标同位素标记核酸探针,则同样可以使用PCR法制备对应的核酸片段,也可以使用人工合成的方法制备对应的核酸片段。
电泳分离核酸片段和目标同位素标记核酸探针(步骤二)。
按照《分子克隆:实验室手册》或其他文献资料所记载的凝胶电泳法,电泳分离核酸片段和目标同位素标记核酸探针。优化的电泳介质是聚丙烯酰胺凝胶。
因为目标同位素标记核酸探针和与其对应的核酸片段的性质相同,分子量差异极小,所以在电泳时,迁移率是相同的。
使用紫外阴影法定位核酸片段在电泳胶上的位置(步骤三)。
图2是本发明的切胶纯化同位素标记核酸探针方法的泳道示意图。核酸片段和核酸探针在电泳胶上位于相邻的两个泳道,与核酸探针泳道相邻的两个泳道是核酸片段泳道,这样的泳道分布方式有利于指示探针位置,方便切割胶块。当然,也可以采用其他的泳道分布方式。
电泳结束后,将一张保鲜膜放在凝胶上,反转玻璃板,这样凝胶便转贴到保鲜膜上。然后将凝胶转移至本发明所述的切胶纯化同位素标记核酸探针的装置上。打开紫外光源,紫外光源在260nm波长从上方照射凝胶,凝胶内的DNA吸收紫外光,在石蜡膜或荧光薄层层析板的荧光背景下,DNA呈现深蓝色条带。
切割探针泳道对应位置处的胶块,回收探针(步骤四)。
因为放射性同位素和与其对应的非放射性同位素相比,具有相同的化学性质、分子量差异小。所以,同位素标记的核酸探针和与其对应的无标记的核酸片段在凝胶电泳过程中,具备相同的迁移率。
如图2的泳道1、泳道3所示,使用紫外阴影法可以显现核酸片段泳道内的DNA条带。如图2的泳道2所示,因为含量不足的原因探针泳道内的DNA条带无法通过紫外阴影法显现,但是其电泳后全长探针位置与核酸片段泳道内的DNA条带位置是一致的。切割探针泳道对应位置处的胶块,该位置如图2泳道2的方框所示。可以使用本发明的切割电泳胶刀具进行切割,也可以使用普通手术刀进行切割。
切割下的胶块使用《分子克隆:实验室手册》所描述的方法或商业化产品,如Ambion公司产品、Progema公司产品,回收所述胶块中的同位素标记核酸探针。
实施例2:
核酸探针合成。
按照试剂盒说明书,使用RNA体外转录系统Riboprobe in vitro TranscriptionSystem(Promega, USA)合成探针。简述如下:取5×缓冲液4μL,DTT(100mM)2μL,Ribonuclease Inhibitor 20u,rATP, rCTP and rGTP(2.5mM each)4μL,转录模板为pTRI-Actin-Mouse(0.5 μg/μl,Ambion,USA)1μl,SP6 RNA Polymerase 15u,[α-
核酸片段合成。
按照试剂盒说明书,使用RNA体外转录系统Riboprobe in vitro TranscriptionSystem(Promega, USA)合成RNA片段。简述如下:取5×缓冲液4μL,DTT(100mM)2μL,Ribonuclease Inhibitor 20u,rATP, rCTP, rGTP and rUTP(2.5mM each)4μL,转录模板为pTRI-Actin-Mouse(0.5 μg/μl,Ambion,USA)2μl,SP6 RNA Polymerase 15u,用水补足至20μL。混匀。按以下条件进行转录:37℃,60min。
聚丙烯酰胺凝胶电泳。
RNA片段和RNA探针的转录产物使用5% polyacrylamide/8M urea gel (0.75 mmthick) 恒压250V、60min电泳分离。
切胶纯化长度为334 nt的核酸探针。
以pTRI-Actin-Mouse为模板,以SP6 RNA聚合酶催化反应,制备获取RNA探针。并且以同样的方法获得334 nt的RNA片段。使用5% polyacrylamide/8M urea gel (0.75 mmthick) 恒压250V、60min电泳分离。使用紫外阴影法显现核酸片段位置,切割探针泳道内对应位置胶块用于洗脱,回收探针。经再次凝胶电泳,使用放射自显影法曝光。图3是使用本发明的方法所纯化探针的放射自显影图,确认探针回收成功。
实施例3:
图4是本发明的切胶纯化同位素标记核酸探针装置的结构示意图。图4所示切胶纯化同位素标记核酸探针装置由底座1和挡板2组成,在底座1上方设有紫外光源4,紫外光源4通过支架3与底座1连接,底座1上设有显色面板5。显色面板5为荧光薄层层析板,也可以是石蜡膜。底座1上设有两个挖孔6,两个挖孔6分别与1.5ml、5ml的eppendorf离心管相匹配。在挡板2的外侧设有箱体7。箱体7内放置有保鲜膜和石蜡膜,当然箱体7内也可以放置实验所需的其他物件。
使用方法:凝胶电泳结束后,将一张保鲜膜放在凝胶上,反转玻璃板,这样凝胶便转贴到保鲜膜上。然后将凝胶转移至本装置上。打开紫外光源,紫外光源在260nm波长从上方照射凝胶,凝胶内的DNA吸收紫外光,在石蜡膜或荧光薄层层析板的荧光背景下,DNA呈现深蓝色条带。即可以进行切胶操作。
实施例4:
图5是本发明的切割电泳胶刀具的结构示意图。图5所示切割电泳胶的刀具由刀柄21和刀头22组成,刀头22由四个刀片23合围而成。刀头22的刀片23向内倾斜的角度为0度,当然也可以是5度、10度、15度等其他倾斜角度。刀柄21和刀头22为固定连接,当然也可以是卡扣连接或螺口连接方式等其他连接方式。
使用方法:本发明切割电泳胶的刀具与其他普通刀具,如手术刀,的使用方式是一样的。因为本发明的刀具的刀头由四个刀片组成,所以一次切割即可完成一个口字形切口26,使胶块分离,非常节省时间。
在阅读了本发明的上述内容之后,本技术领域人员可以对本发明作各种修改或变动,如使用琼脂糖凝胶替代聚丙烯酰胺凝胶,使用其他同位素、其他的常规染色方法替代本发明的相应部分,这些等价形式同样落于本申请所附权利要求书所限定的范围内。
