一种生物素标记引物延伸方法及其应用
文献发布时间:2023-06-19 09:41:38
技术领域:
本发明属于生物化学技术领域,涉及到一种生物素标记引物延伸方法。
背景技术:
引物延伸方法(Primer Extension)是研究RNA各类性质的一种重要手段。该方法本质上是一种特殊的反转录方法,一条寡核苷酸引物退火结合到模板RNA链上,此时游离的dNTPs在反转录酶作用下延伸合成cDNA互补链,通过变性凝胶电泳及标记物示踪技术分离并展示反转录产物,达到研究模板RNA的目的。
传统引物延伸方法主要用于分析RNA结构以及表达水平。通过调整实验条件,引物延伸方法可满足不同的研究目的,其中包括但不限于:根据核酸互补配对原则,设计特异引物检测混合样品中目的RNA的存在;在变性凝胶电泳后,通过标记显影确定目的RNA 5‘末端位置,测定RNA分子量;加入过量引物情况下,根据标记物显影强度测定目的RNA表达水平等等。
引物延伸方法的可塑性和普适性使其成为近年来表观遗传学研究中RNA修饰的重要检测方法,该方法主要用于精确测定各类RNA修饰的发生位点。通过调整实验条件,引物延伸方法可对m
P
生物素(Biotin)属于B族维生素,又称为维生素H,是人体代谢必要的一种水溶性维生素。生物素具有紧密结合四聚体蛋白链霉亲和素(Streptavidin)的特性,是目前生化实验中一种无害标记物,常用于分子杂交实验如northernblot和southernblot等实验。生物素基本不受衰变影响,因此生物素标记相对传统同位素标记较为稳定,但其相对同位素标记灵敏度较低,因此在高精度的RNA修饰检测中,仍选用同位素作为标记物。
发明内容:
本发明的目的是提供了一种生物素标记引物延伸方法,该方法不仅解决了传统方法中的放射性危害问题的同时,还在精度上超过传统同位素方法,以及在实验安全性和周期上也实现了突破,使得引物延伸方法能被更广泛应用。
本发明的生物素标记引物延伸方法,是带有标记物的寡核苷酸引物退火结合到模板RNA链上,游离的dNTPs在反转录酶作用下延伸合成cDNA互补链,通过变性凝胶电泳及标记物示踪分离并展示反转录产物,其特征在于,所述的带有标记物的寡核苷酸引物是带有生物素标记的寡核苷酸引物。
优选,所述的带有标记物的寡核苷酸引物是5’端带有生物素标记的寡核苷酸引物。
本发明的第二个目的是利用上述生物素标记引物延伸方法检测m
优选为:
一、试剂配方
A、混合液A
Primer 1pmol/μL 1μL
Total RNA 2000ng/μL 1μL
DEPC treated water 8μL
C、混合液B
C、混合液C
D、高分辨率尿素丙烯酰胺TBE凝胶50mL体系
E、ddNTP混合液配制1mL体系
ddATP混合液:ddATP(5mM)120μL+dNTP(1mM each)80μL+Tris-HCL(1M,pH 8.0)10μL+EDTA(10mM,pH 8.0)10μL+H
ddCTP混合液:ddCTP(5mM)80μL+dNTP(1mM each)80μL+Tris-HCL(1M,pH 8.0)10μL+EDTA(10mM,pH 8.0)10μL+H
ddTTP混合液:ddATP(5mM)160μL+dNTP(1mM each)80μL+Tris-HCL(1M,pH 8.0)10μL+EDTA(10mM,pH 8.0)10μL+H
ddGTP混合液:ddATP(5mM)40μL+dNTP(1mM each)80μL+Tris-HCL(1M,pH 8.0)10μL+EDTA(10mM,pH 8.0)10μL+H
F、Sanger测序marker制备体系15μL体系
按照以下PCR反应程序进行扩增:
二、步骤:
a、提取待测样品的总RNA;
b、合成5’端带有生物素标记的寡核苷酸引物,并稀释至工作浓度1pmol/μL;
c、根据混合液A配方要求混合引物和RNA;
d、将混合液A置于70℃金属浴中加热3-10分钟,立即放冰上冷却5分钟;
e、将冷却后的混合液A置于42℃金属浴中加热10分钟,取出置于室温;
当检测M3U修饰时:
f、配制混合液B并加入至混合液A中,42℃金属浴反应1小时,反应完成后可将产物置于-20℃长期保存或直接用于下一步实验;
g、根据配方E/F制备sanger测序marker;
h、根据配方D配制高分辨率尿素丙烯酰胺TBE凝胶;
i、分别将反应产物和sanger引物与2×RNAloading按1:1比例混合,置于95℃金属浴中3分钟,立即冰浴5分钟,上样;
j、在1×TBE缓冲条件下,以150V恒压电泳3小时彻底分离引物延伸产物,准备转膜;
k、切割目的条带所在区域凝胶,以1×TBE缓冲液为介质,恒压20V转膜30分钟,将cDNA产物转移至尼龙膜上;
l、晾干尼龙膜,以254nm紫外线照射膜表面2分钟,将核酸交联固定于膜上;
m、对尼龙膜上生物素标记产物进行封闭,使标记于核酸分子上的生物素结合HRP偶联的链霉素,通过化学发光显影进行示踪。
或当检测2’-O-甲基化修饰时:
f、按照混合液C的配方配制高浓度及低浓度dNTP两份混合液C,分别加入混合液A,42℃反应1小时,-20℃保存。
g、配制高分辨率尿素丙烯酰胺TBE凝胶;
h、分别向高低dNTP两组引物延伸产物中按比例1:1加入2×RNAloading,金属浴95℃变性5分钟,立即冰水浴5分钟;
i、将高低dNTP两组引物延伸产物加入凝胶中,在TBE缓冲液环境中,以恒压150V电泳3小时分离产物,准备转膜;
j、切割目的条带所在区域凝胶,以1×TBE缓冲液为介质,恒压20V转膜30分钟,将cDNA产物转移至尼龙膜上;
h、晾干尼龙膜,以254nm紫外线照射膜表面2分钟,将核酸交联固定于膜上;
k、对尼龙膜上生物素标记产物进行封闭,使标记于核酸分子上的生物素结合HRP偶联的链霉素,通过化学发光显影进行示踪。
优选,所述的待测样品为酿酒酵母,并检测M3U修饰位点时,其5’端带有生物素标记的寡核苷酸引物是5’端带有生物素标记的5’-CGACATCGAAGAATCAAAAA-3(如SEQ ID NO.1所示)。
优选,所述的待测样品是果蝇时,并检测M3U修饰位点时,其5’端带有生物素标记的寡核苷酸引物是5’端带有生物素标记的5’-GGTAAAACTAACCTGTCTCA-3’(如SEQ ID NO.2所示)。
优选,所述的待测样品是果蝇,并检测2’-O-甲基化修饰位点时,其5’端带有生物素标记的寡核苷酸引物是5’端带有生物素标记的5’-CCTGTCTCACGACGGTCTAA-3’(如SEQ IDNO.3所示)。
本发明具有以下有益效果:
磷32同位素标记物是传统引物延伸方法的首选标记物。使用同位素的同时,需要处理其放射性带来的实验安全风险以及泄漏风险,其特有的衰变性质不仅增加了保存难度,同时也限制了实验周期,这两个特性使同位素成为引物延伸实验的一大限制。本发明优化了实验条件,使用稳定无害的生物素标记代替同位素标记,提供了一种非同位素标记的引物延伸方法,该方法解决了同位素方法的安全性问题,同时增加了检测精度并缩短了实验周期。
附图说明:
图1为生物素标记引物延伸方法检测酿酒酵母25S rRNA中m
图2为生物素标记引物延伸方法检测黑腹果蝇28S rRNA中2’-O-甲基化位点显影图;
图3为生物素与同位素标记引物延伸方法检测果蝇m
具体实施方式:
下面结合实施例及附图对本发明作进一步详细的描述,但本发明的实施方式不限于此。
实施例相关试剂配方
1.混合液A
Primer(1pmol/μL) 1μL
Total RNA(2000ng/μL) 1μL
DEPC treatedwater 8μL
2.混合液B(使用Promega M-MLV反转录酶货号:M1701)
3.混合液C(高低dNTP配方)
4.高分辨率尿素丙烯酰胺TBE凝胶(50mL体系)
5.ddNTP混合液配制(1mL体系)
ddATP混合液:ddATP(5mM)120μL+dNTP(1mM each)80μL+Tris-HCL(1M,pH 8.0)10μL+EDTA(10mM,pH 8.0)10μL+H
ddCTP混合液:ddCTP(5mM)80μL+dNTP(1mM each)80μL+Tris-HCL(1M,pH 8.0)10μL+EDTA(10mM,pH 8.0)10μL+H
ddTTP混合液:ddATP(5mM)160μL+dNTP(1mM each)80μL+Tris-HCL(1M,pH 8.0)10μL+EDTA(10mM,pH 8.0)10μL+H
ddGTP混合液:ddATP(5mM)40μL+dNTP(1mM each)80μL+Tris-HCL(1M,pH 8.0)10μL+EDTA(10mM,pH 8.0)10μL+H
6.Sanger测序marker制备体系(15μL体系)
按照以下PCR反应程序进行扩增:
实施例1(酿酒酵母RNA m
实施原理:
引物延伸方法利用m
实施步骤:
1、在YPD固体培养基中划线培养获取单菌落酿酒酵母(Saccharomycescerevisiae)。取单菌落酵母细胞于200mLYPD液体培养基中,培养24到36小时。
2、离心收集酵母细胞,使用TRIZOL法提取酵母总RNA。
3、合成5’端带有生物素标记的寡核苷酸引物(生物素标记引物:5’-CGACATCGAAGAATCAAAAA-3’),并稀释至工作浓度(1pmol/μL)。
4、根据混合液A配方要求混合引物和酵母RNA。
5、将混合液A置于70℃金属浴中加热3分钟,立即放冰上冷却5分钟。
6、将冷却后的混合液A置于42℃金属浴中加热10分钟,取出置于室温。
7、配制混合液B并加入至混合液A中,42℃金属浴反应1小时,反应完成后可将产物置于-20℃长期保存或直接用于下一步实验。
8、根据配方5/6制备sanger测序marker。
9、根据配方4配制高分辨率尿素丙烯酰胺TBE凝胶。
10、分别将反应产物和sanger引物(生物素标记引物:5’-CGACATCGAAGAATCAAAAA-3’)与2×RNAloading按1:1比例混合,置于95℃金属浴中3分钟,立即冰浴5分钟,上样。
11、在1×TBE缓冲条件下,以150V恒压电泳3小时彻底分离引物延伸产物,准备转膜。
12、切割目的条带所在区域凝胶,以1×TBE缓冲液为介质,恒压20V转膜30分钟,将cDNA产物转移至尼龙膜上。
13、晾干尼龙膜,以254nm紫外线照射膜表面2分钟,将核酸交联固定于膜上。
14、使用试剂盒(碧云天化学发光显影试剂盒)对尼龙膜上生物素标记产物进行封闭,使标记于核酸分子上的生物素结合HRP偶联的链霉素,通过化学发光显影进行示踪。
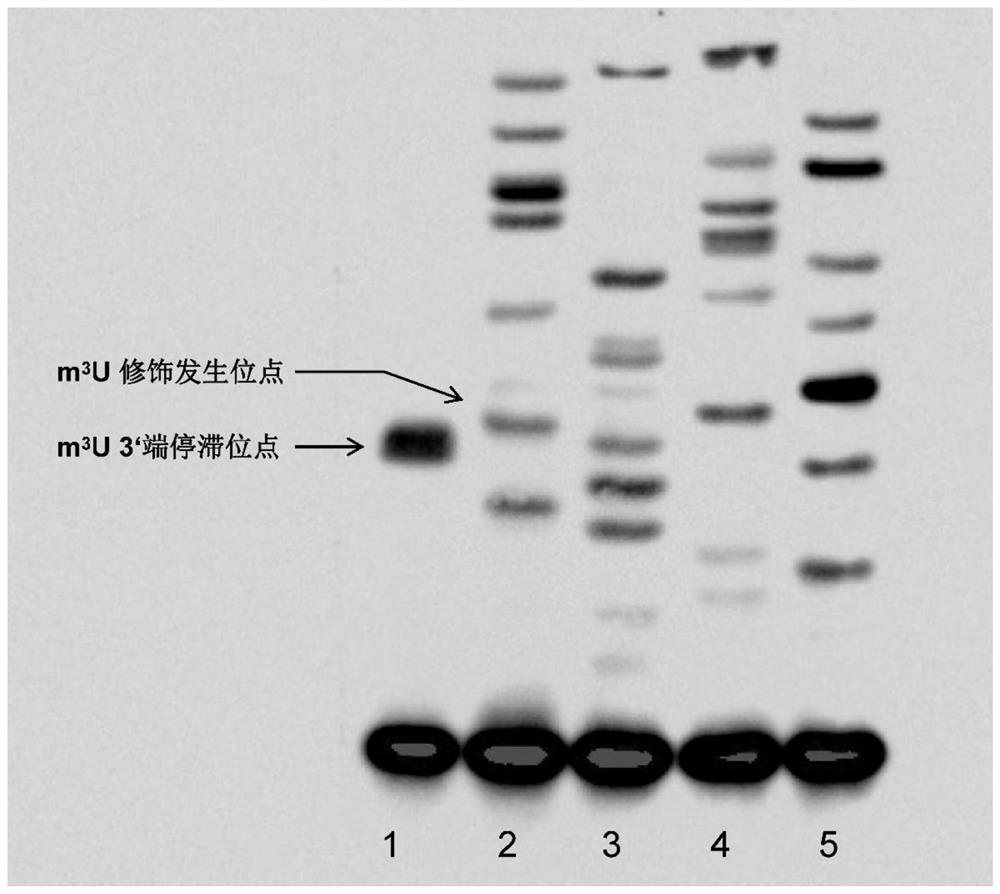
15、对显影结果(图1)进行分析,图1为尼龙膜上生物素信号显影图,1号样品表示引物延伸产物,条带为反转录停滞产物,停滞位点位于m3U发生3’端前一碱基;2至4号样品分别为加入ddATP,ddTTP,ddCTP,ddGTP混合液制备的sanger测序marker,根据marker与目的条带的相对定位确定m
实施例2(果蝇RNA2’-O甲基化修饰检测)
实施原理:
在引物延伸过程中,RNA上的2’-O-甲基化修饰对反转录酶具有阻滞作用,该作用主要受dNTP浓度影响。在高dNTP浓度条件下,2’-O-甲基化对反转录酶阻滞较弱,而在低dNTP浓度条件下,2’-O-甲基化对反转录酶阻滞作用较大,反转录过程中形成部分停滞cDNA产物,通过生物素标记和凝胶电泳展示这类停滞产物,可确定2’-O-甲基化修饰发生位点。
实施步骤:
1、选取20只果蝇(Drosophila melanogaster)成虫,液氮速冻后充分研磨成碎片,使用TRIZOL法提取果蝇总RNA。
2、合成5’端标记生物素标记引物(生物素标记引物:5’-CCTGTCTCACGACGGTCTAA-3’),稀释至工作浓度(1pmol/μL)。
3、根据配方配制混合液A。
4、将混合液A置于70℃金属浴中加热10分钟,立即放冰上冷却5分钟。
5、将冷却后的混合液A置于金属浴42℃中加热10分钟,取出置于室温。
6、配制高浓度(1mM,25微升体系,终浓度)及低浓度(0.05mM,25微升体系,终浓度)dNTP两份混合液C,分别加入混合液A,42℃反应1小时,-20℃保存。
7、配制高分辨率尿素丙烯酰胺TBE凝胶。
8、分别向高低dNTP两组引物延伸产物中按比例(1:1)加入2×RNAloading,金属浴95℃变性5分钟,立即冰水浴5分钟。
9、将高低dNTP两组引物延伸产物加入凝胶中,在TBE缓冲液环境中,以恒压150V电泳3小时分离产物。
参考实施例1完成后续步骤,观察显影图(图2)中高dNTP组与低dNTP组条带区别,确定2‘-O-甲基化修饰位点。图2为尼龙膜上生物素信号显影图,使用相同引物在不同dNTP浓度条件处理下的引物延伸产物显影图。下方条带均为游离引物,在低dNTP浓度下(0.05mM),引物延伸过程遭遇2‘-O-甲基化时受到阻滞作用较高,产生停滞条带,表示修饰位点;在高dNTP浓度下(1mM),引物延伸过程几乎不受甲基化阻滞,因此没有产生停滞条带,通过对比高低dNTP处理组条带区别,可定性定位2‘-O-甲基化。
实施例3:生物素引物延伸方法与传统同位素法显影精度对比
一、根据实施例1的方法用生物素标记引物(5’-GGTAAAACTAACCTGTCTCA-3’)对果蝇总RNA样品进行28S RNA上m
二、使用P32同位素标记引物(5’-GGTAAAACTAACCTGTCTCA-3’)对果蝇总RNA样品进行28S RNA上m
(一)、同位素标记引物延伸方法相关试剂配方(25μL体系)
A、反应液A
Primer(1pmol/μL) 2μL
Total RNA(2000ng/μL) 4μL
DEPC treatedwater 4μL
B、反应液B(使用PromegaAMV反转录酶,货号:M5101)
(二)同位素标记引物延伸方法实施步骤(所有操作均在1.5cm厚塑胶挡板保护下操作):
1、使用T4 PNK(T4多聚核苷酸激酶)在引物5’端标记磷32同位素。
2、根据反应液A配方混合同位素标记引物和果蝇总RNA。
3、将反应液置于金属浴中加热3分钟,立即放冰上5分钟。
4、将冷却后反应液A置于42℃金属浴中加热10分钟,室温冷却。
5、配制反应液B并加入反应液A,42℃金属浴反应45分钟,反应后产物4℃保存。
6、根据配方4配制高分辨率尿素丙烯酰胺TBE凝胶。
7、将反应产物与2×RNAloading按1:1比例混合,95℃金属浴加热3分钟,立即冰浴5分钟,上样20μL混合液。
8、在1×TBE缓冲条件下,以180V恒压电泳6小时彻底分离引物延伸产物。
9、将凝胶从胶板转移至同位素磷屏,收集凝胶中带有同位素的放射性信号,耗时24~36小时,随后使用Typhoon成像仪读取磷屏转化信号,实现同位素示踪显影,显影效果见图3。
将得到的显影图并根据示踪效果进行对比(图3),发现生物素标记引物延伸方法显影精度明显更高。
上述实施例为本发明较佳实施方式,但本发明实施方式不受上述实施例限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均因为等效的置换方式,都包含在本发明的保护范围之内。
序列表
<110> 广东省农业科学院植物保护研究所
<120> 一种生物素标记引物延伸方法及其应用
<160> 3
<170> SIPOSequenceListing 1.0
<210> 1
<211> 20
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 1
cgacatcgaa gaatcaaaaa 20
<210> 2
<211> 20
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 2
ggtaaaacta acctgtctca 20
<210> 3
<211> 20
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 3
cctgtctcac gacggtctaa 20
