蛋白质组合物及其应用与新发心房颤动筛查试剂盒
文献发布时间:2023-06-19 09:47:53
技术领域
本发明涉及分子生物学领域,尤其是涉及蛋白质组合物及其应用与新发心房颤动筛查试剂盒。
背景技术
心房颤动(房颤,AF)是临床上最常见的持续性心律失常,有30-50%的CABG术后患者新发房颤(POAF)。房颤时,心房由规律的窦性心律转变成无序的传导模式,它主要对患者造成三个方面的影响:1、心悸、胸闷、焦虑等症状;2、心室舒张末期容积下降,损害心功能;3、心房血栓、栓塞。术后房颤增加了心脏外科术后的死亡率。
虽有许多包括药物预防在内的治疗手段,但是成人心脏外科术后房颤发生率仍然很高,并且还在随着人口平均年龄的增加而增加。因目前针对房颤尚无有效治疗手段,阐明房颤的发生、维持机制,为房颤的有效药物研发提供新的有效靶点,对临床意义重大。虽然目前一些房颤的电、结构、收缩重构作用的机制已经有所进展,但更为深入的机制仍有待进一步研究。
蛋白质是行使细胞功能的基本单位,蛋白质组学是大规模的蛋白质水平的基因表达研究,包括结构组成蛋白、蛋白相互作用和蛋白的表达,它帮助阐明蛋白质转录后修饰,相比基因组学更加能够反映细胞的功能代谢方面的变化,蛋白质组的研究不仅能为生命活动规律提供物质基础,也能为众多种疾病机制的阐明及攻克提供理论根据和解决途径。通过对正常个体及病理个体间的蛋白质组比较分析,我们可以找到某些“疾病特异性的蛋白质分子”,它们可成为新药物设计的分子靶点,或者也会为疾病的早期诊断提供分子标志。目前对CABG术后房颤的蛋白质研究较少,这些蛋白大致可分为:1、热休克蛋白;2、抗氧化蛋白;3、细胞骨架蛋白;4、收缩蛋白;5、代谢相关蛋白。寻找更加准确、更加全面的蛋白,可为冠心病术后房颤发生发展和维持的机制提供理论依据,并可能为房颤提供具有意义的临床生物学标记物和药物治疗靶点。
发明内容
本发明所要解决的技术问题在于提供一种血液中多种蛋白质的组合物。
本发明所要解决的另一技术问题在于提供上述多蛋白组合物的应用。
本发明所要解决的另一技术问题在于提供一种新发心房颤动筛查试剂盒。
本发明采用的技术方案是:
一种血液中多蛋白组合物,由胆固醇酯转移蛋白抗体、转脂蛋白-C3抗体、磷脂转移蛋白抗体、谷胱甘肽过氧化物酶抗体、肌联蛋白组成。
上述多蛋白组合物在制备新发心房颤动检测制剂或医疗器械方面的应用。
上述多蛋白组合物可作为预测新发心房颤动的生物标志物进行制剂应用。
优选的,上述多蛋白组合物的应用,所述医疗器械为新发心房颤筛查试剂盒。
一种应用上述多蛋白组合物的房颤筛查试剂盒,包含5种蛋白检测组:
所述胆固醇酯转移蛋白标准品浓度为
0,0.78,1.56,3.12,6.25,12.5,25,50ng/ml;
所述生物素标记抗体为生物素化的抗胆固醇酯转移蛋白抗体;
所述辣根过氧化物酶标记亲和素为链霉亲和素;
所述生物素标记抗体稀释液为:0.05%叠氮钠,0.01M磷酸缓冲液pH 7.2;
所述辣根过氧化物酶标记亲和素稀释液:0.01M磷酸缓冲液pH7.2 0.05%硫柳汞;
所述样本稀释液为86%氯化钠、4.5%磷酸氢二钠、3.5%磷酸二氢钠、5%山羊血清,1%Proclin-300,pH值为6-7;
所述洗涤液:NaCl 9.0g,0.5%吐温20 5ml,加蒸馏水至1000ml;
所述底物溶液为3,3’,5,5’–四甲基联苯胺;
所述终止液:2mol/L硫酸;
上述内容通过常规方法即可制备得到。
上述内容的具体操作方法为:
1)取离体血浆样本,检测前在4摄氏度环境下过夜融化,2500rpm离心10min,用样本稀释液进行1:200倍稀释后进行检测;
2)标准品制备:将2份标准品离心30s后,用样品稀释液1ml充分溶解标准品(S8),使用移液器反复吹打至少5次,取1.5ml离心管7枚(S1-S7),各加入250μl样本稀释液,吸取250μl标准品S8到第一个离心管中(S7),轻轻吹打混匀;从S7中吸取250μl到第二个EP管中(S6),轻轻吹打混匀;以此类推进行标准品的倍比稀释;S1为样本稀释液;
3)操作步骤:
a)针对设置的标准品孔、待测样本孔,每孔分别加标准品或待测样本100μl,轻轻晃动混匀,贴上版贴,37摄氏度温育2.5小时;
b)弃去孔内液体,甩干;
c)每孔加生物素标记抗体100μl,贴上贴膜,37摄氏度温育1.5小时;
d)弃去孔内液体,甩干,用洗涤液洗板3次,每次浸泡2分钟,每孔加200μl,甩干;
e)每孔加辣根过氧化物酶标记亲和素标记亲和素工作液100μl,贴上贴膜,37摄氏度温育1小时;
f)弃去孔内液体,甩干,按第5步方法洗板3次,甩干;
g)每孔加底物溶液90μl,37摄氏度避光显色20分钟;
h)每孔加终止液50μl,终止反应;
i)反应终止后5分钟内用酶标仪在450nm处测量各孔的光密度(OD值);
4)数据处理:
使用CurveExpert(version 1.4)软件对OD值进行处理,使用标准品OD值绘制合适的标准曲线并得到相应函数后,将各样品孔OD值代入函数后得到各孔样本浓度值。
所述转脂蛋白-C3标准品浓度为0,15.6,31.25,62.5,125,250,500,1000ng/ml;
所述生物素标记抗体为生物素化的抗转脂蛋白-C3抗体;
所述辣根过氧化物酶标记亲和素为链霉亲和素;
所述生物素标记抗体稀释液为:0.05%叠氮钠,0.01M磷酸缓冲液pH7.2;
所述辣根过氧化物酶标记亲和素稀释液:0.01M磷酸缓冲液pH7.2 0.05%硫柳汞;
所述样本稀释液为85%氯化钠、5%磷酸氢二钠、4%磷酸二氢钠、5%山羊血清,1%Proclin-300,pH值为6-7;
所述洗涤液:NaCl 9.0g,0.5%吐温20 5ml,加蒸馏水至1000ml;
所述底物溶液为3,3’,5,5’–四甲基联苯胺;
所述终止液:2mol/L硫酸;
上述内容通过常规方法即可制备得到。
上述内容的具体操作方法为:
1)血浆样本检测前在4摄氏度环境下过夜融化,2500rpm离心10min,用样本稀释液进行1:400倍稀释后进行检测。
2)标准品制备:将2份标准品离心30s后,用样品稀释液1ml充分溶解标准品(S8),使用移液器反复吹打至少5次,取1.5ml离心管7枚(S1-S7),各加入150μl样本稀释液,吸取150μl标准品S8到第一个离心管中(S7),轻轻吹打混匀。从S7中吸取150μl到第二个EP管中(S6),轻轻吹打混匀。以此类推进行标准品的倍比稀释。S1为样本稀释液。
3)操作步骤:
a)设标准品孔,待测样本孔。每孔分别加相应浓度标准品或待测样本50μl;
b)立即加入辣根过氧化物酶标记亲和素50μl,再按同样顺序加入生物素标记抗体50μl,轻轻晃动混匀,贴上版贴,37摄氏度温育50分钟;
c)弃去孔内液体,甩干,用洗涤液洗板3次,每次浸泡2分钟,每孔加200μl,甩干;
d)每孔加底物溶液100μl,37摄氏度避光显色15分钟;
e)每孔加终止液50μl,终止反应;
f)反应终止后5分钟内用酶标仪在450nm处测量各孔的光密度(OD值)。
4)数据处理:
使用CurveExpert(version 1.4)软件对OD值进行处理,使用标准品OD值绘制合适的标准曲线并得到相应函数后,将各样品孔OD值代入函数后得到各孔样本浓度值。
所述磷脂转移蛋白标准品浓度为
0,2.34,4.68,9.375,18.75,37.5,75,150ng/ml;
所述生物素标记抗体为生物素化的抗磷脂转移蛋白抗体;
所述辣根过氧化物酶标记亲和素为链霉亲和素;
所述洗涤液:NaCl 9.0g,0.5%吐温20 6ml,加蒸馏水至1000ml;
所述底物溶液为3,3’,5,5’–四甲基联苯胺;
所述终止液:2mol/L硫酸。
上述内容通过常规方法即可制备得到。
上述内容的具体操作方法为:
1)血浆样本检测前在4摄氏度环境下过夜融化,2500rpm离心10min,用样本稀释液进行1:200倍稀释后进行检测。
2)标准品制备:将2份标准品离心30s后,用样品稀释液1ml充分溶解标准品(S8),使用移液器反复吹打至少5次,取1.5ml离心管7枚(S1-S7),各加入250μl样本稀释液,吸取250μl标准品S8到第一个离心管中(S7),轻轻吹打混匀;从S7中吸取250μl到第二个EP管中(S6),轻轻吹打混匀;以此类推进行标准品的倍比稀释;S1为样本稀释液;
3)操作步骤:
a)针对设置的标准品孔、待测样本孔,每孔分别加标准品或待测样本100μl,轻轻晃动混匀,贴上版贴,37摄氏度温育2.5小时;
b)弃去孔内液体,甩干;
c)每孔加生物素标记抗体100μl,贴上贴膜,37摄氏度温育2小时;
d)弃去孔内液体,甩干,用洗涤液洗板3次,每次浸泡2分钟,每孔加200μl,甩干;
e)每孔加辣根过氧化物酶标记亲和素标记亲和素工作液100μl,贴上贴膜,37摄氏度温育50分钟;
f)弃去孔内液体,甩干,按第5步方法洗板3次,甩干;
g)每孔加底物溶液90μl,37摄氏度避光显色20分钟;
h)每孔加终止液50μl,终止反应;
i)反应终止后5分钟内用酶标仪在450nm处测量各孔的光密度(OD值);
3)数据处理:
使用CurveExpert(version 1.4)软件对OD值进行处理,使用标准品OD值绘制合适的标准曲线并得到相应函数后,将各样品孔OD值代入函数后得到各孔样本浓度值。
所述谷胱甘肽过氧化物酶标准品浓度为
0,15.6,31.2,62.5,125,250,500,1000μIU/ml;
所述生物素标记抗体为生物素化的抗谷胱甘肽过氧化物酶抗体;
所述辣根过氧化物酶标记亲和素为链霉亲和素;
所述生物素标记抗体稀释液为:0.05%叠氮钠,0.01M磷酸缓冲液(PBS)pH7.2;
所述辣根过氧化物酶标记亲和素稀释液:0.01M磷酸缓冲液(PBS)pH7.20.05%硫柳汞;
所述样本稀释液为86%氯化钠、4.5%磷酸氢二钠、3.5%磷酸二氢钠、5%山羊血清,1%Proclin-300,pH值为6-7;
所述洗涤液:NaCl 9.0g,吐温20(0.5%)5ml,加蒸馏水至1000ml;
所述底物溶液为3,3’,5,5’–四甲基联苯胺;
所述终止液:2mol/L硫酸。
上述内容通过常规方法即可制备得到。
上述内容的具体操作方法为:
1)血浆样本检测前在4摄氏度环境下过夜融化,2500rpm离心10min,用样本稀释液进行1:2000倍稀释后进行检测。
2)标准品制备:将2份标准品离心30s后,用样品稀释液1ml充分溶解标准品(S8),使用移液器反复吹打至少5次,取1.5ml离心管7枚(S1-S7),各加入250μl样本稀释液,吸取250μl标准品S8到第一个离心管中(S7),轻轻吹打混匀。从S7中吸取250μl到第二个EP管中(S6),轻轻吹打混匀。以此类推进行标准品的倍比稀释。S1为样本稀释液。
3)操作步骤:
a)针对设置的标准品孔、待测样本孔,每孔分别加标准品或待测样本100μl,轻轻晃动混匀,贴上版贴,37摄氏度温育2.5小时;
b)弃去孔内液体,甩干;
c)每孔加生物素标记抗体100μl,贴上贴膜,37摄氏度温育2.5小时;
d)弃去孔内液体,甩干,用洗涤液洗板3次,每次浸泡2分钟,每孔加200μl,甩干;
e)每孔加辣根过氧化物酶标记亲和素标记亲和素工作液100μl,贴上贴膜,37摄氏度温育50分钟;
f)弃去孔内液体,甩干,按第5步方法洗板3次,甩干;
g)每孔加底物溶液90μl,37摄氏度避光显色20分钟;
h)每孔加终止液50μl,终止反应;
i)反应终止后5分钟内用酶标仪在450nm处测量各孔的光密度(OD值);
3)数据处理:
使用CurveExpert(version 1.4)软件对OD值进行处理,使用标准品OD值绘制合适的标准曲线并得到相应函数后,将各样品孔OD值代入函数后得到各孔样本浓度值。
所述肌联蛋白标准品浓度为0,23.5,47,94,187.5,375,750,1500pg/ml;
所述生物素标记抗体为生物素化的抗肌联蛋白抗体;
所述辣根过氧化物酶标记亲和素为链霉亲和素;
所述生物素标记抗体稀释液为:0.05%叠氮钠,0.01M磷酸缓冲液(PBS)pH7.2;
所述辣根过氧化物酶标记亲和素稀释液:0.01M磷酸缓冲液(PBS)pH7.20.05%硫柳汞;
所述样本稀释液为85%氯化钠、5%磷酸氢二钠、4%磷酸二氢钠、5%山羊血清,1%Proclin-300,pH值为6-7;
所述洗涤液:NaCl 9.0g,0.5%吐温20 5ml,加蒸馏水至1000ml;
所述底物溶液为3,3’,5,5’–四甲基联苯胺;
所述终止液:2mol/L硫酸。
上述内容通过常规方法即可制备得到。
上述内容的具体操作方法为:
1)血浆样本检测前在4摄氏度环境下过夜融化,2500rpm离心10min。
2)标准品制备:将2份标准品离心30s后,用样品稀释液1ml充分溶解标准品(S8),使用移液器反复吹打至少5次,取1.5ml离心管7枚(S1-S7),各加入250μl样本稀释液,吸取250μl标准品S8到第一个离心管中(S7),轻轻吹打混匀。从S7中吸取250μl到第二个EP管中(S6),轻轻吹打混匀。以此类推进行标准品的倍比稀释。S1为样本稀释液。
3)操作步骤:
a)针对设置的标准品孔、待测样本孔,每孔分别加标准品或待测样本100μl,轻轻晃动混匀,贴上版贴,37摄氏度温育2.5小时;
b)弃去孔内液体,甩干;
c)每孔加生物素标记抗体100μl,贴上贴膜,37摄氏度温育2小时;
d)弃去孔内液体,甩干,用洗涤液洗板3次,每次浸泡2分钟,每孔加200μl,甩干;
e)每孔加辣根过氧化物酶标记亲和素标记亲和素工作液100μl,贴上贴膜,37摄氏度温育50分钟;
f)弃去孔内液体,甩干,按第5步方法洗板3次,甩干;
g)每孔加底物溶液90μl,37摄氏度避光显色20分钟;
h)每孔加终止液50μl,终止反应;
i)反应终止后5分钟内用酶标仪在450nm处测量各孔的光密度(OD值);
3)数据处理:
使用CurveExpert(version 1.4)软件对OD值进行处理,使用标准品OD值绘制合适的标准曲线并得到相应函数后,将各样品孔OD值代入函数后得到各孔样本浓度值。
本发明的有益效果是:
本发明利用现代生物学技术和生物信息学分析对胆固醇酯转移蛋白,转脂蛋白-C3,磷脂转移蛋白,谷胱甘肽过氧化物酶,肌联蛋白的检测及功能进行了初步研究,高浓度的胆固醇酯转移蛋白、谷胱甘肽过氧化物酶、及肌联蛋白,低浓度的转脂蛋白-C3及磷脂转移蛋白具有预测先新发心房颤动的用途,可应用于制备检测制剂来早期干预;同时,依赖五种蛋白浓度分层分析还可应用于制备新发心房颤动筛查试剂盒,对新发心房颤动有着较好的评价效能和潜在的巨大应用价值。
附图说明
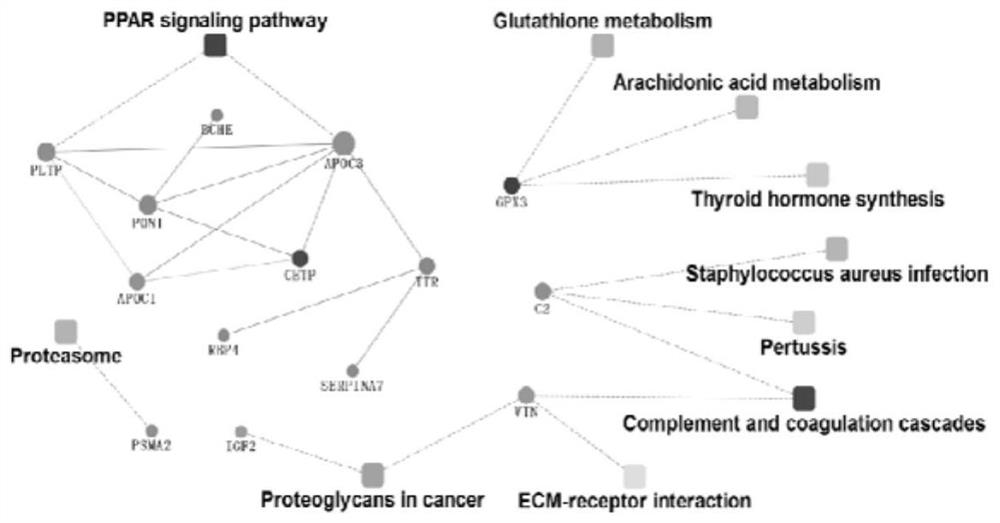
图1是蛋白质组学检测到的含有胆固醇酯转移蛋白,转脂蛋白-C3,磷脂转移蛋白,谷胱甘肽过氧化物酶,肌联蛋白的网络互作图;
图2是ELISA检测的胆固醇酯转移蛋白,转脂蛋白-C3,磷脂转移蛋白,谷胱甘肽过氧化物酶,肌联蛋白在新发心房颤动及未发生心房颤动患者中的含量,其中,CETP:胆固醇酯转移蛋白;APO-C3:转脂蛋白-C3;PLTP:磷脂转移蛋白;GPX3:谷胱甘肽过氧化物酶;TTN:肌联蛋白。
具体实施方式
为了使本领域的技术人员更好的理解本发明的技术方案,下面结合附图及具体实施方式对本发明所述技术方案作进一步的详细说明。
实施例1
1.人体血浆样本的收集
接受首次CABG的患者中,发生术后房颤的患者为实验组,维持窦性心律的患者为对照组。所有患者(实验组及对照组)均在手术前一天早晨,禁食>10h的情况下进行血样采集。每位患者自周围静脉采全血2ml,立即于2500rpm离心10分钟,分离上层血浆。再将分离的血浆分为数等份,置于血浆收集管中,置于-80摄氏度冰箱冻存待检。
2.蛋白质组学检测
1)血浆蛋白质组检测
采用iTRAQ联合多维液相色谱-质谱联用技术(LC-MS/MS)(Applied Biosystems,Foster City,CA)检测两组各混合样本中的蛋白质。
2)样品制备
a)购买高丰度蛋白去除试剂盒(ProteoExtractTM Albumin/IgG Removal Kit,CALBIOCHEM,USA),去除高丰度蛋白。
b)加入5倍体积的丙酮,-20℃沉淀1小时。4℃,10000g离心10分钟,收集沉淀。
c)将干燥后的粉末溶解液于样品裂解液中,30℃恒温水浴充分溶解蛋白。
d)将溶液在室温下15000g离心15min,取上清,并再次离心取上清,充分去除不容性杂质。
e)上清即为组织的总蛋白溶液,进行蛋白浓度测定并分装后储存于-80℃备用或直接用于iTRAQ分析。
3)样品定量
样品按定量原理:BCA(bicinchonininc acid)与二价铜离子的硫酸铜
等其他试剂组成的试剂,混合一起即成为苹果绿,即BCA工作试剂。在碱性条件下,BCA与蛋白质结合时,蛋白质将Cu2+还原为Cu+,一个Cu+螯合二个BCA分子,工作试剂由原来的苹果绿形成紫色复合物,该水溶性的复合物在562nm处显示最大吸光性,吸光度和蛋白浓度在广泛范围内有良好的线性关系,因此根据吸光值可以推算出蛋白浓度。
按照BCA方法定量样品中蛋白质。实验步骤如下:
a)以标准蛋白浓度为横坐标,OD562为纵坐标制作标准曲线图,求出回归方程。
b)用OD562的值对BSA浓度做标准曲线。
c)取适量体积的待测样品稀释10倍,检测样品吸光度,计算其平均OD562,代入回归方程,最后计算出待测样品的测得浓度,测得浓度乘以10后即为样品的真实浓度。
4)SDS-PAGE电泳样品检测实验
a)每个样品取10μg,采用12%SDS-PAGE进行分离。
b)分离后的凝胶采用考马斯亮兰染色法进行染色。具体操作如下:固定2小时;染色12小时;水洗至背景清晰。
c)染色后的凝胶应用ImageScanner扫描仪进行扫描,扫描模式为灰度
模式,光密度值为300dpi。
5)蛋白还原烷基化及酶解
具体步骤如下:
a)蛋白定量后每个样品各取100μg,采用5倍体积预冷丙酮进行沉淀,-20℃放置1小时,充分沉淀蛋白。
b)4℃,12,000rpm离心10分钟,取沉淀真空冷冻干燥。
c)采用50μl iTRAQ试剂盒中的Dissolution Buffer充分溶解蛋白沉淀,加入4μlReducing Reagent,60℃反应1小时。
d)加入2μl Cysteine-Blocking Reagent,室温反应10分钟,将还原烷基化后的蛋白溶液加入10K的超滤管中,12,000rpm离心20分钟,弃掉收集管底部溶液。
e)加入100μl Dissolution Buffer,12,000rpm离心20分钟,弃掉收集管底部溶液,重复3次。
f)更换新收集管,在超滤管中加入50μl浓度为50ng/μl的测序级胰蛋白酶溶液,37℃反应12小时。
g)12,000rpm离心20分钟,收集酶解后肽段,在超滤管中再加入50μl DissolutionBuffer,12000rpm离心20分钟,收集管底溶液并与前次溶液合并。
6)蛋白标记及质谱预实验
a)从冰箱中取出iTRAQ试剂,平衡到室温;
b)将iTRAQ试剂离心至管底;
c)用150μl异丙醇溶解iTRAQ试剂;
d)取50μl样品(100μg酶解产物)转移到新的离心管中,加入iTRAQ试剂后室温反应2小时;
e)加入100μl水终止反应;
f)混合所有标记样品,涡旋振荡,离心至管底;
g)真空冷冻干燥样品,留作iTRAQ分离鉴定。
7)2D-LC-MSMS分析反相色谱分离
a)冷冻干燥后的样品用110μL流动相A溶液溶解;
b)肽段分离在Agilent 1200HPLC上进行,购买色谱柱Agilent公司色谱柱,具体参数为:保护住芯:Analytical Guard Column 4.6*12.5mm 5-Micron.分离柱:Narrow-Bore2.1*150mm 5μm,检测波长:紫外210nm和280nm;流速:0.3ml/min,非线性二元梯度。
肽段色谱分离流动相比例时间表见表1。
表1
c)0-5分钟丢弃,6-45分钟每4.5分钟收集1管,46-50分钟收集成1管,总共10管样品溶液,然后将每管溶液彻底冷冻干燥。得到一维分离色谱图。
反向色谱-TripleTOF分析
a)将阳离子交换分离后冻干的多肽样品重新溶解于Nano-RPLC Buffer A中。
b)在线Nano-RPLC液相色谱在Eksigent nanoLC-Ultra
c)分析柱是C18反相色谱柱(75μm x 15cm C18-3μm
d)质谱采用TripleTOF5600系统(AB SCIEX)结合纳升喷雾III离子源(AB SCIEX,USA),喷雾电压为2.5kV,气帘气压为30PSI,雾化气压为5PSI,加热器温度为150℃,质谱扫描方式为信息依赖的采集工作模式下(IDA,Information Dependent Analysis),一级TOF-MS单张图谱扫描时间为250ms,每次IDA循环下最多采集35个电荷为2+到5+且单秒计数大于150的二级图谱,每次循环时间固定为2.5秒,碰撞室能量设定适用于所有前体离子碰撞诱导解离(CID),动态排除设置为18秒,约等于色谱半峰宽。
8)数据库检索
数据处理采用含Paragon algorithm算法的Protein Pilot Software v.5.0(ABSCIEX,USA)软件进行,本次实验使用的数据库为人数据库,数据库来源于Uniprot。蛋白质鉴定主要是通过实验串联质谱数据与数据库模拟得到的理论质谱数据进行匹配,从而得到蛋白质鉴定结果。设置参数如下:
蛋白质组质谱检索参数
Sample Type:iTRAQ 8plex(Peptide Labeled)
Cys.Alkylation:Iodoacetamide
Digestion:Trypsin
Instrument:TripleTOF 5600
Database:Homo Sapiens.fasta
Search Effort:Thorough
User Modified Parameter Files:No
蛋白质组学检测到的含有脂联素,丙氨酰膜氨基肽酶和多巴胺β-羟化酶的网络互作图见图1。
实施例2
酶联免疫吸附实验(enzyme-linked immunosorbent assay,ELISA)
采用ELISA法在新收取的血浆样本中对胆固醇酯转移蛋白,转脂蛋白-C3,磷脂转移蛋白,谷胱甘肽过氧化物酶,肌联蛋白进行了验证。实验原理:待测蛋白的抗体预埋于96孔板底部,标准品和样品加入后,其中的待测蛋白会与抗体结合。在去除未结合的基他底物后,加入待测蛋白的生物素共轭抗体。冲洗,加入抗生物素共扼辣根过氧化物酶标记抗体(HRP),通过冲洗去除未结合的HRP。加入显色剂,终止反应后,测量液体的吸光度。
包被有胆固醇酯转移蛋白抗体的多孔板
胆固醇酯转移蛋白纯品作为标准品
生物素标记抗体
辣根过氧化物酶标记亲和素
生物素标记抗体稀释液
辣根过氧化物酶标记亲和素稀释液
样本稀释液
洗涤液
底物溶液
终止液
其中
所述胆固醇酯转移蛋白标准品浓度为
0,0.78,1.56,3.12,6.25,12.5,25,50ng/ml;
所述生物素标记抗体为生物素化的抗胆固醇酯转移蛋白抗体;
所述辣根过氧化物酶标记亲和素为链霉亲和素;
所述生物素标记抗体稀释液为:0.05%叠氮钠,0.01M磷酸缓冲液pH 7.2;
所述辣根过氧化物酶标记亲和素稀释液:0.01M磷酸缓冲液pH7.2 0.05%硫柳汞;
所述样本稀释液为86%氯化钠、4.5%磷酸氢二钠、3.5%磷酸二氢钠、5%山羊血清,1%Proclin-300,pH值为6-7;
所述洗涤液:NaCl 9.0g,0.5%吐温20 5ml,加蒸馏水至1000ml;
所述底物溶液为3,3’,5,5’–四甲基联苯胺;
所述终止液:2mol/L硫酸。
具体操作方法为:
1)取离体血浆样本,检测前在4摄氏度环境下过夜融化,2500rpm离心10min,用样本稀释液进行1:200倍稀释后进行检测;
2)标准品制备:将2份标准品离心30s后,用样品稀释液1ml充分溶解标准品(S8),使用移液器反复吹打至少5次,取1.5ml离心管7枚(S1-S7),各加入250μl样本稀释液,吸取250μl标准品S8到第一个离心管中(S7),轻轻吹打混匀;从S7中吸取250μl到第二个EP管中(S6),轻轻吹打混匀;以此类推进行标准品的倍比稀释;S1为样本稀释液;
3)操作步骤:
a)针对设置的标准品孔、待测样本孔,每孔分别加标准品或待测样本100μl,轻轻晃动混匀,贴上版贴,37摄氏度温育2.5小时;
b)弃去孔内液体,甩干;
c)每孔加生物素标记抗体100μl,贴上贴膜,37摄氏度温育1.5小时;
d)弃去孔内液体,甩干,用洗涤液洗板3次,每次浸泡2分钟,每孔加200μl,甩干;
e)每孔加辣根过氧化物酶标记亲和素标记亲和素工作液100μl,贴上贴膜,37摄氏度温育1小时;
f)弃去孔内液体,甩干,按第5步方法洗板3次,甩干;
g)每孔加底物溶液90μl,37摄氏度避光显色20分钟;
h)每孔加终止液50μl,终止反应;
i)反应终止后5分钟内用酶标仪在450nm处测量各孔的光密度(OD值);
4)数据处理:
使用CurveExpert(version 1.4)软件对OD值进行处理,使用标准品OD值绘制合适的标准曲线并得到相应函数后,将各样品孔OD值代入函数后得到各孔样本浓度值。
包被有转脂蛋白-C3抗体的多孔板
转脂蛋白-C3纯品作为标准品
生物素标记抗体
辣根过氧化物酶标记亲和素
生物素标记抗体稀释液
辣根过氧化物酶标记亲和素稀释液
样本稀释液
洗涤液
底物溶液
终止液
其中:
所述转脂蛋白-C3标准品浓度为0,15.6,31.25,62.5,125,250,500,1000ng/ml;
所述生物素标记抗体为生物素化的抗转脂蛋白-C3抗体;
所述辣根过氧化物酶标记亲和素为链霉亲和素;
所述生物素标记抗体稀释液为:0.05%叠氮钠,0.01M磷酸缓冲液pH7.2;
所述辣根过氧化物酶标记亲和素稀释液:0.01M磷酸缓冲液pH7.2 0.05%硫柳汞;
所述样本稀释液为85%氯化钠、5%磷酸氢二钠、4%磷酸二氢钠、5%山羊血清,1%Proclin-300,pH值为6-7;
所述洗涤液:NaCl 9.0g,0.5%吐温20 5ml,加蒸馏水至1000ml;
所述底物溶液为3,3’,5,5’–四甲基联苯胺;
所述终止液:2mol/L硫酸。
具体操作方法为:
1)血浆样本检测前在4摄氏度环境下过夜融化,2500rpm离心10min,用样本稀释液进行1:400倍稀释后进行检测。
2)标准品制备:将2份标准品离心30s后,用样品稀释液1ml充分溶解标准品(S8),使用移液器反复吹打至少5次,取1.5ml离心管7枚(S1-S7),各加入150μl样本稀释液,吸取150μl标准品S8到第一个离心管中(S7),轻轻吹打混匀。从S7中吸取150μl到第二个EP管中(S6),轻轻吹打混匀。以此类推进行标准品的倍比稀释。S1为样本稀释液。
3)操作步骤:
a)设标准品孔,待测样本孔。每孔分别加相应浓度标准品或待测样本50μl;
b)立即加入辣根过氧化物酶标记亲和素50μl,再按同样顺序加入生物素标记抗体50μl,轻轻晃动混匀,贴上版贴,37摄氏度温育50分钟;
c)弃去孔内液体,甩干,用洗涤液洗板3次,每次浸泡2分钟,每孔加200μl,甩干;
d)每孔加底物溶液100μl,37摄氏度避光显色15分钟;
e)每孔加终止液50μl,终止反应;
f)反应终止后5分钟内用酶标仪在450nm处测量各孔的光密度(OD值)。
4)数据处理:
使用CurveExpert(version 1.4)软件对OD值进行处理,使用标准品OD值绘制合适的标准曲线并得到相应函数后,将各样品孔OD值代入函数后得到各孔样本浓度值。结果见附图2。
包被有磷脂转移蛋白抗体的多孔板
磷脂转移蛋白纯品作为标准品
生物素标记抗体
辣根过氧化物酶标记亲和素
洗涤液
底物溶液
终止液
其中:
所述磷脂转移蛋白标准品浓度为
0,2.34,4.68,9.375,18.75,37.5,75,150ng/ml;
所述生物素标记抗体为生物素化的抗磷脂转移蛋白抗体;
所述辣根过氧化物酶标记亲和素为链霉亲和素;
所述洗涤液:NaCl 9.0g,0.5%吐温20 6ml,加蒸馏水至1000ml;
所述底物溶液为3,3’,5,5’–四甲基联苯胺;
所述终止液:2mol/L硫酸。
上述内容通过常规方法即可制备得到。
上述内容的具体操作方法为:
1)血浆样本检测前在4摄氏度环境下过夜融化,2500rpm离心10min,用样本稀释液进行1:200倍稀释后进行检测。
2)标准品制备:将2份标准品离心30s后,用样品稀释液1ml充分溶解标准品(S8),使用移液器反复吹打至少5次,取1.5ml离心管7枚(S1-S7),各加入250μl样本稀释液,吸取250μl标准品S8到第一个离心管中(S7),轻轻吹打混匀;从S7中吸取250μl到第二个EP管中(S6),轻轻吹打混匀;以此类推进行标准品的倍比稀释;S1为样本稀释液;
3)操作步骤:
a)针对设置的标准品孔、待测样本孔,每孔分别加标准品或待测样本100μl,轻轻晃动混匀,贴上版贴,37摄氏度温育2.5小时;
b)弃去孔内液体,甩干;
c)每孔加生物素标记抗体100μl,贴上贴膜,37摄氏度温育2小时;
d)弃去孔内液体,甩干,用洗涤液洗板3次,每次浸泡2分钟,每孔加200μl,甩干;
e)每孔加辣根过氧化物酶标记亲和素标记亲和素工作液100μl,贴上贴膜,37摄氏度温育50分钟;
f)弃去孔内液体,甩干,按第5步方法洗板3次,甩干;
g)每孔加底物溶液90μl,37摄氏度避光显色20分钟;
h)每孔加终止液50μl,终止反应;
i)反应终止后5分钟内用酶标仪在450nm处测量各孔的光密度(OD值);
3)数据处理:
使用CurveExpert(version 1.4)软件对OD值进行处理,使用标准品OD值绘制合适的标准曲线并得到相应函数后,将各样品孔OD值代入函数后得到各孔样本浓度值。结果见附图2。
包被有谷胱甘肽过氧化物酶抗体的多孔板
谷胱甘肽过氧化物酶纯品作为标准品
生物素标记抗体
辣根过氧化物酶标记亲和素
洗涤液
底物溶液
终止液
其中:
所述谷胱甘肽过氧化物酶标准品浓度为
0,15.6,31.2,62.5,125,250,500,1000μIU/ml;
所述生物素标记抗体为生物素化的抗谷胱甘肽过氧化物酶抗体;
所述辣根过氧化物酶标记亲和素为链霉亲和素;
所述洗涤液:NaCl 9.0g,0.5%吐温20 6ml,加蒸馏水至1000ml;
所述底物溶液为3,3’,5,5’–四甲基联苯胺;
所述终止液:2mol/L硫酸。
上述内容通过常规方法即可制备得到。
上述内容的具体操作方法为:
1)血浆样本检测前在4摄氏度环境下过夜融化,2500rpm离心10min,用样本稀释液进行1:2000倍稀释后进行检测。
2)标准品制备:将2份标准品离心30s后,用样品稀释液1ml充分溶解标准品(S8),使用移液器反复吹打至少5次,取1.5ml离心管7枚(S1-S7),各加入250μl样本稀释液,吸取250μl标准品S8到第一个离心管中(S7),轻轻吹打混匀。从S7中吸取250μl到第二个EP管中(S6),轻轻吹打混匀。以此类推进行标准品的倍比稀释。S1为样本稀释液。
3)操作步骤:
a)针对设置的标准品孔、待测样本孔,每孔分别加标准品或待测样本100μl,轻轻晃动混匀,贴上版贴,37摄氏度温育2.5小时;
b)弃去孔内液体,甩干;
c)每孔加生物素标记抗体100μl,贴上贴膜,37摄氏度温育2.5小时;
d)弃去孔内液体,甩干,用洗涤液洗板3次,每次浸泡2分钟,每孔加200μl,甩干;
e)每孔加辣根过氧化物酶标记亲和素标记亲和素工作液100μl,贴上贴膜,37摄氏度温育50分钟;
f)弃去孔内液体,甩干,按第5步方法洗板3次,甩干;
g)每孔加底物溶液90μl,37摄氏度避光显色20分钟;
h)每孔加终止液50μl,终止反应;
i)反应终止后5分钟内用酶标仪在450nm处测量各孔的光密度(OD值);
3)数据处理:
使用CurveExpert(version 1.4)软件对OD值进行处理,使用标准品OD值绘制合适的标准曲线并得到相应函数后,将各样品孔OD值代入函数后得到各孔样本浓度值。结果见附图2。
包被有肌联蛋白抗体的多孔板
肌联蛋白纯品作为标准品
生物素标记抗体
辣根过氧化物酶标记亲和素
洗涤液
底物溶液
终止液
其中:
所述肌联蛋白标准品浓度为0,23.5,47,94,187.5,375,750,1500pg/ml;
所述生物素标记抗体为生物素化的抗肌联蛋白抗体;
所述辣根过氧化物酶标记亲和素为链霉亲和素;
所述洗涤液:NaCl 9.0g,0.5%吐温20 6ml,加蒸馏水至1000ml;
所述底物溶液为3,3’,5,5’–四甲基联苯胺;
所述终止液:2mol/L硫酸。
上述内容通过常规方法即可制备得到。
上述内容的具体操作方法为:
1)血浆样本检测前在4摄氏度环境下过夜融化,2500rpm离心10min。
2)标准品制备:将2份标准品离心30s后,用样品稀释液1ml充分溶解标准品(S8),使用移液器反复吹打至少5次,取1.5ml离心管7枚(S1-S7),各加入250μl样本稀释液,吸取250μl标准品S8到第一个离心管中(S7),轻轻吹打混匀。从S7中吸取250μl到第二个EP管中(S6),轻轻吹打混匀。以此类推进行标准品的倍比稀释。S1为样本稀释液。
3)操作步骤:
a)针对设置的标准品孔、待测样本孔,每孔分别加标准品或待测样本100μl,轻轻晃动混匀,贴上版贴,37摄氏度温育2.5小时;
b)弃去孔内液体,甩干;
c)每孔加生物素标记抗体100μl,贴上贴膜,37摄氏度温育2小时;
d)弃去孔内液体,甩干,用洗涤液洗板3次,每次浸泡2分钟,每孔加200μl,甩干;
e)每孔加辣根过氧化物酶标记亲和素标记亲和素工作液100μl,贴上贴膜,37摄氏度温育50分钟;
f)弃去孔内液体,甩干,按第5步方法洗板3次,甩干;
g)每孔加底物溶液90μl,37摄氏度避光显色20分钟;
h)每孔加终止液50μl,终止反应;
i)反应终止后5分钟内用酶标仪在450nm处测量各孔的光密度(OD值);
3)数据处理:
使用CurveExpert(version 1.4)软件对OD值进行处理,使用标准品OD值绘制合适的标准曲线并得到相应函数后,将各样品孔OD值代入函数后得到各孔样本浓度值。结果见附图2。
综上通过实施例1,发现术后心房颤动患者血浆中转脂蛋白-C3与磷脂转移蛋白蛋白较对照组下调,通过富集分析,这两个蛋白均被富集至过氧化物酶体增殖物激活受体-α(PPAR-α)通路中。这表明术后房颤患者体内PPAR-α通路可能存在下调现象。心房组织内的PPAR-α通路下调通过抑制脂肪酸β氧化和促进糖代谢而使心脏的能量代谢模式由以脂肪酸代谢为主型向葡萄糖代谢为主型转变。心房组织细胞膜表面脂肪酸转运蛋白可能存在下调,而糖转运蛋白可能存在上调的现象。从而导致心房内脂质减少而糖原积累增多。另外,葡萄糖在胞质内进行糖酵解产生NADP可以通过穿梭机制为线粒体电子传递链提供还原当量,它与线粒体内三羧酸循环产生的NADP一起增加呼吸链产生氧自由基,这些氧自由基可以使心房组织内处于氧化应激状态,并可以损伤心房肌细胞膜表面的离子通道,导致心房电重构。如上所述,PPAR-α的下调可能通过改变心房内能量代谢模式与增加氧自由基的产生使心房内出现代谢重构和电重构,增加心律失常的易感性。所以该组患者在接受术后容易产生房颤。谷胱甘肽是一种由谷氨酸、半胱氨酸和甘氨酸组成的短肽,存在于机体的各个器官与细胞中。它是一种抗氧化剂,可保护蛋白质分子中的巯基免遭氧化,保护巯基蛋白和酶的活性,起着直接或间接的基因表达调控、酶活性和代谢调节、细胞保护、氨基酸转运、免疫功能调节作用。氧化还原状态的平衡保证多种生物学过程的顺利进行,包括细胞信号转导,转录因子活性,核染色质重构,蛋白修饰,膜的完整性和线粒体功能的维持。在多种疾病的病理生理过程中都包含有由于活性氧的增加而导致的氧化还原状态失衡的状况。如粥样硬化,神经退行性变,癌症和心衰等。系统性炎症反应和心房内增加的活性氧物质被认为是房颤发生的原因,这些因素可以损伤心房收缩,破坏心肌纤维的能量代谢,并能缩短心房的有效不应期。哺乳动物细胞和组织中在过氧化氢存在的条件下,谷胱甘肽被谷胱甘肽过氧化物酶氧化为氧化型谷胱甘肽,然后在NADPH依赖的谷胱甘肽还原酶的作用下还原为还原型谷胱甘肽。谷胱甘肽的减少潜在的增加了细胞对氧化应激相关的不良结局的易感性。术后房颤患者血浆中谷胱甘肽过氧化物酶蛋白较对照组患者上调,通过富集分析,这个蛋白均被富集至谷胱甘肽代谢通路。这表明发生房颤患者在术前体内的氧化应激张力就较高,体内的谷胱甘肽代谢通路被激活,谷胱甘肽过氧化物酶上调,可能减少还原型谷胱甘肽的储备,导致心房组织内抗氧化能力不足。在接受心脏手术后,心房内活性氧增多,而降低的抗氧化能力导致了对术后房颤的易感性增加。
针对实施例1中蛋白质组学对于术后心房颤动患者筛查诊断的结果,实施例2采用ELSIA方法再次证实了与对照组相比,术后发生心房颤动患者血浆中胆固醇酯转移蛋白,谷胱甘肽过氧化物酶,肌联蛋白的浓度较高,转脂蛋白-C3,磷脂转移蛋白浓度较低。结果与实施例1一致,见图2。
以上所述实施例仅仅是对本发明的优选实施方式进行描述,并非对本发明的范围进行限定,在不脱离本发明设计精神的前提下,本领域普通工程技术人员对本发明的技术方案作出的各种变形和改进,均应落入本发明的权利要求书确定的保护范围内。
- 蛋白质组合物及其应用与新发心房颤动筛查试剂盒
- 蛋白质组合物及其应用与ST段抬高型心肌梗死早期筛查诊断试剂盒
