治疗癌症的方法
文献发布时间:2023-06-19 09:52:39
本申请根据35 U.S.C.§119(e)要求2018年4月17日提交的美国临时申请序列号62/659,016和2018年5月11日提交的美国临时申请序列号62/670,442的优先权,所述临时申请的全部公开内容以引用的方式并入本文中。
技术领域
本文中描述的本发明涉及用于靶向疗法的药物递送缀合物。本文中描述的本发明涉及用式1化合物治疗表达PSMA的癌症的方法。本文中描述的本发明还涉及用式1化合物治疗患者的表达PSMA的癌症的方法,其中疾病在用所述式1化合物治疗之后得到稳定。
背景技术
前列腺特异性膜抗原(PSMA)是具有约110kD分子量的II型细胞表面膜结合糖蛋白,包括胞内区段(氨基酸1到18)、跨膜域(氨基酸19到43)和广泛的胞外域(氨基酸44到750)。虽然目前认为胞内区段和跨膜域的功能并不显著,但胞外域参与几种不同的活动。PSMA在中枢神经系统中起作用,在其中将N-乙酰基-天冬氨酸谷氨酸(NAAG)代谢为谷氨酸和N-乙酰基天冬氨酸。因此,有时也称为N-乙酰基α连接的酸性二肽酶(NAALADase)。由于PSMA在近端小肠中的作用,PSMA有时也被称为叶酸水解酶I(FOLH I)或谷氨酸羧肽酶(GCPII),在近端小肠中,PSMA从聚-γ-谷氨酸叶酸去除γ-连接的谷氨酸且从肽和小分子去除α-连接的谷氨酸。
PSMA的命名很大程度上是由于其在前列腺癌细胞上的表达水平较高;然而,其对前列腺癌细胞的具体功能仍未解决。当与人体内的其它器官(例如肾脏、近端小肠和唾液腺)相比时,PSMA在恶性前列腺组织中过表达。与许多其它膜结合蛋白不同,PSMA以与细胞表面结合受体(例如维生素受体)类似的方式经历快速内化进入细胞中。PSMA通过网格蛋白包被的凹坑内化,随后可再循环至细胞表面或进入溶酶体。已提出,PSMA的二聚体和单体形式可相互转化,尽管相互转化的直接证据存在争议。即便如此,只有PSMA的二聚体拥有酶促活性,而单体则没有。
虽然仍在研究PSMA在前列腺细胞的细胞表面上的活性,但本发明人已认识到,PSMA代表将生物活性剂(包括药物化合物)选择性和/或特异性递送到这类前列腺细胞的可行靶标。一种这类药物化合物是化合物1
(又名(3S,10S,14S)-3-[(萘-2-基)甲基]-1,4,12-三氧-1-[(1R,4S)-4-[[2-[4,7,10-三(羧甲基)-1,4,7,10-四氮杂环十二烷-1-基]乙酰胺基]甲基]环己基]-2,5,11,13-四氮杂十六烷-10,14,16-三羧酸),其中
不受理论的束缚,认为PSMA-617由以下组成:药效基团配体谷氨酸-尿素-赖氨酸;螯合剂DOTA(能够络合177Lu);和连接这2个实体的连接子。进一步认为,基于尿素的结合基序允许药剂与疾病部位处的PSMA结合且由PSMA内化。进一步认为,177Lu-PSMA-617的结合通过内吞作用引起内化,且使配体和其结合的放射性物质在癌细胞内持续保留。
另一种这类化合物是PSMA成像缀合物4
(又名4,6,12,19-四氮杂二十烷-1,3,7-三羧酸、22-[3-[[[2-[[[5-(2-羧乙基)-2-羟苯基]甲基](羧甲基)氨基]乙基](羧甲基)氨基]甲基]-4-羟基-苯基]-5,13,20-三氧代-,(3S,7S)),其中
发明内容
在一些实施例中,本公开提供一种用于治疗需要这类治疗的患者的癌症的方法,所述方法包括向所述患者投予治疗有效量的化合物1。
在一些实施例中,本公开提供化合物1用于治疗患者的癌症的用途。在一些方面,所述用途包括向患者投予治疗有效量的化合物1。
在一些实施例中,本公开提供化合物1在制备适用于治疗患者的癌症的药物中的用途。在一些方面,药物包括治疗有效量的化合物1。
在这些实施例的一些方面,癌症是表达PSMA的癌症。在这些实施例的一些方面,化合物的纯度是至少约98%。在一些实施例中,癌症选自以下组成的组:神经胶质瘤、癌瘤、肉瘤、淋巴瘤、黑素瘤、间皮瘤、鼻咽癌、白血病、腺癌和骨髓瘤。
在这些实施例的一些方面,癌症选自以下组成的组:肺癌、骨癌、胰腺癌、皮肤癌、头部癌、颈部癌、皮肤黑素瘤、眼内黑素瘤、子宫癌、卵巢癌、子宫内膜癌、直肠癌、胃癌、结肠癌、乳腺癌、三阴性乳腺癌、转移性乳腺癌、输卵管癌、子宫内膜癌瘤、子宫颈癌、阴道癌、外阴癌、霍奇金氏病(Hodgkin's Disease)、食道癌、小肠癌、内分泌系统癌、甲状腺癌、甲状旁腺癌、非小细胞肺癌、肾上腺癌、软组织肉瘤、尿道癌、阴茎癌、前列腺癌、慢性白血病、急性白血病、淋巴细胞性淋巴瘤、胸膜间皮瘤、膀胱癌、伯基特淋巴瘤(Burkitt's lymphoma)、输尿管癌、肾癌、肾细胞癌、肾盂癌、中枢神经系统肿瘤(CNS)、原发性CNS淋巴瘤、脊髓轴肿瘤、神经胶质瘤、脑干神经胶质瘤、垂体腺瘤和胃食管交界处腺癌。在这些实施例的一些方面,癌症是原发性或继发性脑癌。在这些实施例的一些方面,癌症是前列腺癌。在这些实施例的一些方面,癌症是转移性前列腺癌。
在这些实施例的一些方面,化合物1以肠胃外剂型投予。在这些实施例的一些方面,肠胃外剂型选自以下组成的组:皮内、皮下、肌内、腹膜内、静脉内和鞘内。在这些实施例的一些方面,治疗有效量是约2GBq到约13GBq。在这些实施例的一些方面,治疗有效量是约4GBq到约11GBq。在这些实施例的一些方面,治疗有效量是约5GBq到约10GBq。在这些实施例的一些方面,治疗有效量是约6GBq到约9GBq。在这些实施例的一些方面,治疗有效量是约6.5GBq到约8.5GBq。在这些实施例的一些方面,治疗有效量是约7GBq到约8GBq。在这些实施例的一些方面,治疗有效量为约7.4GBq。在这些实施例的一些方面,总剂量是约15GBq至约200GBq。在这些实施例的一些方面,总剂量是约25GBq至约185GBq。在这些实施例的一些方面,总剂量是约35GBq至约150GBq。在这些实施例的一些方面,总剂量是约40GBq至约100GBq。在这些实施例的一些方面,总剂量是约44GBq。在这些实施例的一些方面,个体的最大治疗持续时间是约19至23个月。
在这些实施例的一些方面,治疗有效量是2GBq至13GBq。在这些实施例的一些方面,治疗有效量是4GBq至11GBq。在这些实施例的一些方面,治疗有效量是5GBq至10GBq。在这些实施例的一些方面,治疗有效量是6GBq至9GBq。在这些实施例的一些方面,治疗有效量是6.5GBq至8.5GBq。在这些实施例的一些方面,治疗有效量是7GBq至8GBq。在这些实施例的一些方面,治疗有效量是7.4GBq。
在这些实施例的一些方面,治疗有效量是约0.1mg/m
在这些实施例的一些方面,治疗有效量是0.1mg/m
在其它方面,本文中描述的方法和用途还包括对癌症的PSMA表达进行成像。在这些实施例的一些方面,成像的步骤在投予步骤之前发生。在这些实施例的一些方面,通过成像执行成像,其中成像选自以下组成的组:SPECT成像、PET成像、IHC和FISH。在这些实施例的一些方面,通过SPECT成像执行成像。
在这些实施例的一些方面,成像的步骤包括向患者投予式2的PSMA配体-成像缀合物
或其药学上可接受的盐,其中R'为氢,或R'选自以下组成的组:烷基、氨基烷基、羧基烷基、羟基烷基、杂烷基、芳基、芳基烷基和杂芳基烷基,其各自任选地被取代,且其中放射性核素与缀合物结合。
在这些实施例的一些方面,成像的步骤包括投予式3的PSMA配体-成像缀合物
或其药学上可接受的盐,其中R'是氢,或R'选自以下组成的组:烷基、氨基烷基、羧基烷基、羟基烷基、杂烷基、芳基、芳基烷基和杂芳基烷基,其各自任选地被取代,且其中M是放射性核素的阳离子。在这些实施例的一些方面,缀合物中的M或其药学上可接受的盐选自以下组成的组:镓的同位素、铟的同位素、铜的同位素、锝的同位素和铼的同位素。在这些实施例的一些方面,缀合物中的M或其药学上可接受的盐是锝的同位素。
在这些实施例的一些方面,PSMA配体-成像缀合物具有式2a
或其药学上可接受的盐,其中放射性核素与缀合物结合。在这些实施例的一些方面,PSMA配体-成像缀合物具有式3a
或其药学上可接受的盐。
在这些实施例的一些方面,成像的步骤包括向患者投予式4的PSMA配体-成像缀合物。
或其药学上可接受的盐,其中放射性核素与缀合物结合。在这些实施例的一些方面,放射性核素为
在其它方面,本文中描述的方法和用途还包括通过成像来确定患者的PSMA状态。在这些实施例的一些方面,成像是SPECT成像。在这些实施例的一些方面,患者的PSMA状态与对患者的临床益处相关。在这些实施例的一些方面,临床益处选自以下组成的组:抑制肿瘤生长、稳定疾病、部分反应和完全反应。在这些实施例的一些方面,临床益处是稳定疾病。在这些实施例的一些方面,PSMA阳性病变指示功能上活性的PSMA。
在这些实施例的一些方面,确定步骤包括向患者投予式2的PSMA配体-成像缀合物
或其药学上可接受的盐,其中R'是氢,或R'选自以下组成的组:烷基、氨基烷基、羧基烷基、羟基烷基、杂烷基、芳基、芳基烷基和杂芳基烷基,其各自任选地被取代,且其中缀合物与放射性核素结合。
在这些实施例的一些方面,确定步骤包括投予式3的PSMA配体-成像缀合物
或其药学上可接受的盐,其中R'是氢,或R'选自以下组成的组:烷基、氨基烷基、羧基烷基、羟基烷基、杂烷基、芳基、芳基烷基和杂芳基烷基,其各自任选地被取代,且其中M是放射性核素的阳离子。
在这些实施例的一些方面,缀合物中的M或其药学上可接受的盐选自以下组成的组:镓的同位素、铟的同位素、铜的同位素、锝的同位素和铼的同位素。在这些实施例的一些方面,缀合物中的M或其药学上可接受的盐是锝的同位素。在这些实施例的一些方面,PSMA配体-成像缀合物具有式2a
或其药学上可接受的盐,其中放射性核素与缀合物结合。
在这些实施例的一些方面,PSMA配体-成像缀合物具有式3a
或其药学上可接受的盐。
在这些实施例的一些方面,确定步骤包括向患者投予式4的PSMA配体-成像缀合物
或其药学上可接受的盐,其中放射性核素与缀合物结合。在这些实施例的一些方面,放射性核素为
在其它实施例中,本公开提供一种治疗需要这类治疗的患者的癌症的方法,所述方法包括向所述患者投予治疗有效量的化合物1
其中
在其它实施例中,本公开提供化合物1的用途
其中
在其它实施例中,本公开提供化合物1的用途
其中在制备适用于治疗患者的癌症的药物时,
在这些实施例的一些方面,患者已用至少一种先前治疗进行治疗。在这些实施例的一些方面,至少一种先前治疗选自以下组成的组:雄激素轴全身治疗、化学治疗药剂、手术、放射疗法、免疫疗法、光动力疗法、干细胞疗法和热疗。在这些实施例的一些方面,至少一种先前治疗是全身治疗。在这些实施例的一些方面,全身治疗选自以下组成的组:帕利伐米(palifosfamide)、5-氟尿嘧啶(5-fluorouracil)、卡培他滨(capecitabine)、培美曲塞(pemetrexed)、顺铂(cisplatin)、卡铂(carboplatin)、吉西他滨(gemcitabine)、紫杉醇(paclitaxel)、长春瑞滨(vinorelbine)、艾瑞布林(eribulin)、多西他赛(docetaxel)、环磷酰胺(cyclophosphamide)、阿霉素(doxorubicin)、雷戈拉非尼(regorafinib)和其组合。在这些实施例的一些方面,癌症是表达PSMA的癌症。在这些实施例的一些方面,化合物的纯度是至少约98%。
通过以下列举的条项来进一步描述本发明的实施例:
1.一种用于治疗需要这类治疗的患者的癌症的方法,所述方法包括向所述患者投予治疗有效量的式1或式2化合物
其中所述化合物与金属络合。
2.根据条项1所述的方法,其中所述癌症是表达PSMA的癌症。
3.根据条项1或2的方法,其中所述式1化合物的纯度是至少约98%。
4.根据前述条项中任一项所述的方法,其中所述癌症是前列腺癌。
5.根据前述条项中任一项所述的方法,其中所述癌症是转移性去势抵抗性前列腺癌。
6.根据前述条项中任一项所述的方法,其中所述式1化合物以肠胃外剂型投予。
7.根据条项6所述的方法,其中所述肠胃外剂型选自以下组成的组:皮内、皮下、肌内、腹膜内、静脉内和鞘内。
8.根据前述条项中任一项所述的方法,其中所述治疗有效量是约2GBq到约13GBq。
9.根据前述条项中任一项所述的方法,其中所述治疗有效量是约4GBq到约11GBq。
10.根据前述条项中任一项所述的方法,其中所述治疗有效量是约5GBq到约10GBq。
11.根据前述条项中任一项所述的方法,其中所述治疗有效量是约6GBq到约9GBq。
12.根据前述条项中任一项所述的方法,其中所述治疗有效量是约6.5GBq到约8.5GBq。
13.根据前述条项中任一项所述的方法,其中所述治疗有效量是约7GBq到约8GBq。
14.根据前述条项中任一项所述的方法,其中所述治疗有效量是约7.4GBq。
15.根据前述条项中任一项所述的方法,其还包括对所述癌症的PSMA表达进行成像。
16.根据条项15所述的方法,其中所述成像在投予步骤之前发生。
17.根据条项16所述的方法,其中所述成像通过成像执行,且其中所述成像选自以下组成的组:SPECT成像、PET成像、IHC和FISH。
18.根据条项17所述的方法,其中所述成像通过SPECT成像执行。
19.根据条项1到14中任一项所述的方法,其还包括通过成像来确定所述患者的PSMA状态。
20.根据条项19所述的方法,其中所述成像是SPECT成像。
21.根据条项20所述的方法,其中所述患者的所述PSMA状态与对所述患者的临床益处相关。
22.根据条项21所述的方法,其中所述临床益处选自以下组成的组:抑制肿瘤生长、稳定疾病、部分反应和完全反应。
23.根据条项22所述的方法,其中所述临床益处是稳定的疾病。
24.根据条项21所述的方法,其中至少一种PSMA阳性病变指示功能上活性的PSMA。
25.根据前述条项中任一项所述的方法,其中所述患者已用至少一种先前治疗进行治疗。
26.根据条项25所述的方法,其中所述至少一种先前治疗选自以下组成的组:雄激素轴全身治疗、化学治疗剂、手术、放射疗法、免疫疗法、光动力疗法、干细胞疗法和热疗。
27.根据条项26所述的方法,其中所述至少一种先前治疗是雄激素轴药物全身治疗。
28.根据条项26所述的方法,其中所述至少一种先前治疗选自以下组成的组:阿比特龙(abiraterone)、奥特隆(orteronel)、加勒泰隆(galeterone)、七氢呋喃(seviteronel)、阿帕鲁胺(apalutamide)、恩杂鲁胺(enzalutamide)和其组合。
29.根据条项25所述的方法,其中所述至少一种先前治疗选自以下组成的组:帕利伐米、5-氟尿嘧啶、卡培他滨、培美曲塞、顺铂、卡铂、吉西他滨、紫杉醇、长春瑞滨、艾瑞布林、多西他赛、环磷酰胺、阿霉素、雷戈拉非尼和其组合。
30.根据前述条项中任一项所述的方法,其中所述式1化合物与第二治疗组合投予。
31.根据条项30所述的方法,其中所述第二治疗是最佳支持性治疗。
32.根据条项30所述的方法,其中所述第二治疗是最佳护理标准治疗。
33.根据条项30所述的方法,其中所述第二治疗是最佳支持性/最佳护理标准治疗。
34.根据条项30所述的方法,其中所述第二治疗是雄激素轴全身治疗。
35.根据条项34所述的方法,其中所述雄激素轴全身治疗选自以下组成的组:阿比特龙、奥特隆、加勒泰隆、七氢呋喃、阿帕鲁胺、恩杂鲁胺和其组合。
36.根据条项30所述的方法,其中所述第二治疗是放射疗法。
37.根据条项30所述的方法,其中所述放射疗法是外部束放射疗法(EBRT)。
38.根据前述条项中任一项所述的方法,其中所述式1化合物以每周一次的时间表投予。
39.根据条项1到37中任一项所述的方法,其中所述式1化合物以每2周一次的时间表投予。
40.根据条项1到37中任一项所述的方法,其中所述式1化合物以每3周一次的时间表投予。
41.根据条项1到37中任一项所述的方法,其中所述式1化合物以每4周一次的时间表投予。
42.根据条项1到37中任一项所述的方法,其中所述式1化合物以每5周一次的时间表投予。
43.根据条项1到37中任一项所述的方法,其中所述式1化合物以每6周一次的时间表投予。
44.根据条项1到37中任一项所述的方法,其中所述式1化合物以每7周一次的时间表投予。
45.根据条项1到37中任一项所述的方法,其中所述式1化合物以每8周一次的时间表投予。
46.根据条项1到37中任一项所述的方法,其中所述式1化合物以每4到6周一次的时间表投予。
47.根据条项38到46中任一项所述的方法,其中将所述式1化合物投予持续所述时间表的约2到8个周期。
48.根据条项38到46中任一项所述的方法,其中将所述式1化合物投予持续所述时间表的约3到7个周期。
49.根据条项38到46中任一项所述的方法,其中将所述式1化合物投予持续所述时间表的约4到6个周期。
50.根据前述条项中任一项所述的方法,其中与所述化合物1或所述化合物2络合的所述金属选自以下组成的组:
51.根据条项50所述的方法,其中与所述化合物1络合的所述金属是
52.根据条项50所述的方法,其中与所述化合物1络合的所述金属是
附图说明
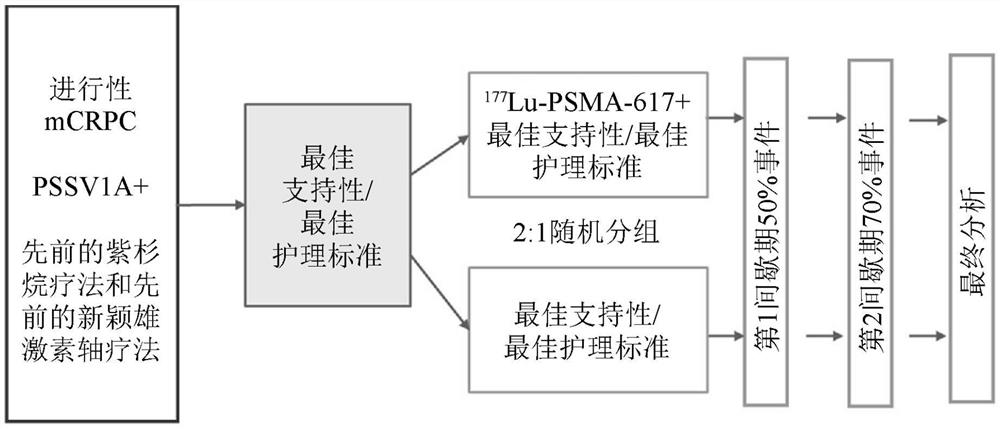
图1示出治疗方法设计的示意图。
具体实施方式
定义
根据本发明,“功能上活性的PSMA”是指与PSMA配体结合的细胞表面膜结合糖蛋白。将了解,PSMA配体对于本领域的技术人员是众所周知的,例如美国专利公开第US 2010/0324008 A1号中所描述的那些,其以引用的方式并入本文中。
根据本发明,“临床益处”是指患者对用化合物1治疗的反应,其中所述反应包含患者的总体生存期、接受使用化合物1的四个或更多个治疗周期(例如,治疗四周)的能力、抑制肿瘤生长、稳定疾病、部分反应和/或完全反应,以及美国食品药品管理局定义的其它临床益处。
根据本发明,“抑制肿瘤生长”是指在用化合物1进行治疗的过程中,肿瘤尺寸减小、肿瘤完全消失或患者肿瘤的生长小于30%。
根据本发明,“稳定疾病”意指在用化合物1进行治疗的过程中,患者没有疾病的实质性进展。
根据本发明,“部分反应”意指用化合物1治疗的患者的肿瘤尺寸减小30%或更多。
根据本发明,“完全反应”是指用化合物1治疗的患者中可检测疾病的消失。
根据本发明,“先前治疗”是指患者已用本领域已知的至少一种先前治疗进行治疗。将了解,先前治疗可以是本领域的技术人员已知的任何治疗,包含(但不限于)化学治疗剂、手术、放射疗法、免疫疗法、光动力疗法、干细胞疗法、热疗等。先前治疗可包含全身治疗,包含(但不限于)使用以下进行治疗:阿比特龙、奥特隆、加勒泰隆、七氢呋喃、阿帕鲁胺、恩杂鲁胺、帕利伐米、5-氟尿嘧啶、卡培他滨、培美曲塞、顺铂、卡铂、吉西他滨、紫杉醇、长春瑞滨、依立布林(eribulin)、多西他赛、环磷酰胺、阿霉素、雷戈拉非尼和其组合。
根据本发明,术语“烷基”包含任选地是支链的碳原子链。将进一步理解,在某些实施例中,烷基有利地具有有限的长度,包含C
根据本发明,术语“杂烷基”包含原子链,所述原子链包含碳和至少一个杂原子两者,且任选地是支链的。说明性杂原子包含氮、氧和硫。在某些变型中,说明性杂原子还包含磷和硒。
根据本发明,术语“芳基”包含具有6到14个环碳原子的单环和多环芳族碳环基团,所述环碳原子中的每一个可任选地被取代。本文中所描述的说明性芳族碳环基包含(但不限于)苯基、萘基等。根据本发明,术语“杂芳基”包含具有5到10个环原子的芳族杂环基,所述环原子中的每一个可任选地被取代。说明性的芳族杂环基包含(但不限于)吡啶基、嘧啶基、吡嗪基、三嗪基、四嗪基、喹啉基、喹唑啉基、喹喔啉基、噻吩基、吡唑基、咪唑基、恶唑基、噻唑基、异恶唑基、异噻唑基、恶二唑基、噻二唑基、三唑基、苯并咪唑基、苯并恶唑基、苯并噻唑基、苯并异恶唑基、苯并异噻唑基等。根据本发明,术语“杂芳基烷基”包含本文中所描述的“烷基”与本文中所描述的“杂芳基”的组合。根据本发明,术语“芳基烷基”包含本文中所描述的“烷基”与本文中所描述的“芳基”(例如,苄基)的组合。
如本文中所使用,术语“任选地被取代”包含氢原子由任选被取代的基团上的其它官能团取代。这类其它官能团说明性地包含(但不限于)氨基、羟基、卤素、硫醇、烷基、卤代烷基、杂烷基、芳基、芳基烷基、芳基杂烷基、杂芳基、杂芳基烷基、杂芳基杂烷基、硝基、磺酸和其衍生物、羧酸和其衍生物等。说明性地,氨基、羟基、硫醇、烷基、卤代烷基、杂烷基、芳基、芳基烷基、芳基杂烷基、杂芳基、杂芳基烷基、杂芳基杂烷基和/或磺酸中的任一个任选地被取代。
根据本发明,如本文中所使用的术语“投予”包含将本文中所描述的化合物1和PSMA配体-成像缀合物引入患者的所有方式,包含(但不限于)口服(po)、静脉内(iv)、肌肉内(im)、皮下(sc)、经皮、吸入、颊、眼、舌下、阴道、直肠等。本文中所描述的化合物1和PSMA配体成像缀合物可以单位剂型和/或含有常规无毒的药学上可接受的载剂、佐剂和媒剂的制剂的形式投予。
根据本发明,如本领域的技术人员通常所理解,“贝克勒尔(becquerel)”是指SI衍生的放射性单位。一贝克勒尔定义为一定量的放射性物质的活度,其中每秒一个原子核衰变。因此,贝克勒尔等于倒数秒s-1。本领域的技术人员中将贝克勒尔称为居里(Ci)的后继者,居里(Ci)是一种基于1克镭226的活度的较老的非SI放射性单位。将居里定义为3.7.1010s-1或37GBq。
根据本发明,“居里”或“Ci”意指本领域的技术人员通常理解的以法国物理学家和化学家玛丽·居里命名的放射性单位。前缀milli和micro来自公制,分别代表.001和.000001。因此,毫居里(mCi)是.001居里。微居里(μCi)为.000001居里。
详细描述
根据本文中所描述的申请人的发明,设想将以上概述中提供的编号条项的实施例或其任何组合与本专利申请的详细描述章节中所描述的实施例中的任一项相组合。
参照图1,可根据所示示意图描述方法设计。在一些实施例中,用于设计的分层因素包含(但不限于)血清乳酸脱氢酶(LDH)(≤260IU/L相比于>260IU/L)、肝转移的存在、ECOG评分(0到1相比于2)、将NAAD纳入最佳支持性/最佳护理标准等。在一些实施例中,主要终点可以是总体生存期。在一些实施例中,次要终点包含(但不限于)放射无进展生存期(rPFS)、RECIST响应、到第一次症状性骨骼事件(SSE)的时间等。在一些实施例中,额外次要终点包含(但不限于)安全性和耐受性、与石南花有关(heather-related)的生活质量(HRQoL;EQ-5D-5L、FACT-P和简要疼痛清单-简短形式[BPI-SF])、健康经济、无进展生存期(PFS)(放射、临床或PSA进展)、生化反应(例如PSA水平、碱性磷酸酶水平和/或乳酸脱氢酶水平)。在一些实施例中,本文中描述的治疗的终点可以是通过第二次PSA测量>/=4周确认的已实现自基线减少>/=50%的患者。在一些实施例中,本文中描述的治疗的终点可以是通过第二次PSA测量>/=4周确认的已实现自基线减少>/=40%的患者。在一些实施例中,本文中描述的治疗的终点可以是通过第二次PSA测量>/=4周确认的已实现自基线减少>/=30%的患者。
在一个实施例中,本文中描述的方法可用于人类临床医学和兽医学应用。因此,可以向“患者”投予本文中所描述的化合物1或PSMA配体-成像缀合物,且“患者”可以是人类,或在兽医学应用的情况下可以是实验室、农业、家养或野生动物。在一个方面,患者可以是人类;实验室动物,例如啮齿动物(例如小鼠、大鼠、仓鼠等)、兔、猴、黑猩猩;家畜,例如狗、猫和兔;农业动物,例如牛、马、猪、绵羊、山羊;以及人工饲养的野生动物,例如熊、熊猫、狮子、老虎、豹、大象、斑马、长颈鹿、大猩猩、海豚和鲸鱼。
在一些实施例中,具有PSMA阳性扫描的患者可以2:1比例随机分配,以接受化合物1加最佳支持性/最佳护理标准,或仅接受最佳支持性/最佳护理标准。在一些实施例中,最佳支持性/最佳护理标准可由治疗医师/研究者确定。在一些实施例中,最佳支持性/最佳护理标准可由治疗医师/研究者确定,但将排除研究药剂、细胞毒性化学疗法、其它全身放射性同位素和半体放射疗法。在一些实施例中,允许使用新颖雄激素轴药物[NAAD],例如阿比特龙或恩杂鲁胺。
在一些实施例中,将在整个6到10个月的治疗期中监测患者的生存期、疾病进展和不良事件。在一些实施例中,长期随访期可包含对生存期和治疗更新、不良事件评估以及用于血液学和化学测试的血液的收集。
在一些实施例中,患者为18岁或更大。在一些实施例中,患者是男性。在一些实施例中,患者先前已被诊断患有前列腺癌。在一些实施例中,患者先前已被诊断患有转移性去势抵抗性前列腺癌(mCRPC)。在一些实施例中,患者满足一或多个选自以下组成的组的标准:东方合作肿瘤小组(Eastern Cooperative Oncology Group;ECOG)表现状态为0到2;以及预期寿命至少6个月;前列腺癌的组织学、病理学和/或细胞学确认;
在一些实施例中,如果患者在约6个月先前治疗内已进行用锶-89、钐-153、铼-186、铼-188、镭223或半体放射的先前治疗中的多种中的一种,那么患者可以不接受治疗;先前靶向PSMA的放射性配体疗法;在治疗前约28天内进行过的先前全身抗癌疗法(例如,化学疗法、免疫疗法或生物疗法[包含单克隆抗体]);在治疗前约28天内先前投予研究药剂;对疗法或其类似物的成分的已知超敏反应;任何其它同时进行的细胞毒性化学疗法、免疫疗法、放射配体疗法或研究性疗法;在治疗约30天内输血;CNS转移病史,其已接受疗法(手术、放疗、伽玛刀)且在神经学上稳定、无症状,且出于维持神经系统完整性的目的而不接受皮质类固醇;在基线骨骼扫描中见到的超级扫描;有症状的脐带受压,或指示即将受压的临床或放射学发现;并发的严重(由医师确定)医学病况,包含(但不限于)纽约心脏协会(NewYork Heart Association)III级或IV级充血性心力衰竭、先天性长期QT综合征病史、不受控感染、活动性B型或C型肝炎或研究者认为将损害治疗或合作的其它显著共病病况;或被诊断出预期会改变预期寿命或可能干扰疾病评估的其它恶性肿瘤。
在各种实施例中,本文所描述的癌症可以是致瘤的癌细胞群,包含良性肿瘤和恶性肿瘤;或所述癌症可以是非致瘤的。癌症可自发产生,或通过例如存在于患者种系中的突变或体细胞突变的过程产生,或癌症可以是化学、病毒或放射诱导的。适用于本文中所描述发明的癌症包含(但不限于)神经胶质瘤、癌瘤、肉瘤、淋巴瘤、黑素瘤、间皮瘤、鼻咽癌、白血病、腺癌和骨髓瘤。
在一些方面,癌症可以是肺癌、骨癌、胰腺癌、皮肤癌、头部癌、颈部癌、皮肤黑素瘤、眼内黑素瘤、子宫癌、卵巢癌、子宫内膜癌、直肠癌、胃癌、结肠癌、乳腺癌、三阴性乳腺癌、转移性乳腺癌、输卵管癌、子宫内膜癌瘤、子宫颈癌、阴道癌、外阴癌、霍奇金氏病、食道癌、小肠癌、内分泌系统癌症、甲状腺癌、甲状旁腺癌、非小细胞肺癌、肾上腺癌、软组织肉瘤、尿道癌、阴茎癌、前列腺癌、慢性白血病、急性白血病、淋巴细胞性淋巴瘤、胸膜间皮瘤、膀胱癌、伯基特氏淋巴瘤、输尿管癌、肾癌、肾细胞癌、肾盂癌、中枢神经系统肿瘤(CNS)、原发性CNS淋巴瘤、脊髓轴肿瘤、神经胶质瘤、脑干神经胶质瘤、垂体腺瘤和胃食管连接处腺癌。
化合物1具有下式
其中
在其它实施例中,可以使用可通过PET成像、SPECT成像或类似方法检测的多种PSMA配体-成像缀合物中的任一种。成像的确切方式不限于本文中所描述的成像剂。总的来说,适用于本文中所描述的成像的PSMA配体-成像缀合物(包含由分子式描述的那些以及适用于PET成像、SPECT成像等的药剂)被称为“PSMA配体-成像缀合物”。
在一个实施例中,本文中所描述的化合物1和PSMA配体-成像缀合物与癌细胞上表达的PSMA结合。在一个说明性方面,由于PSMA在癌细胞上的优先表达(或过表达),与正常细胞相比,化合物1和PSMA配体-成像缀合物能够与癌细胞上的PSMA差异结合。
在本文中描述的方法的其它实施例中,提供了本文中描述的化合物1和PSMA配体-成像缀合物的药学上可接受的盐。本文中所描述的化合物1和PSMA配体-成像缀合物的药学上可接受的盐包含其酸加成盐和碱盐。
合适的酸加成盐由形成无毒盐的酸形成。说明性实例包含乙酸盐、天冬氨酸盐、苯甲酸盐、苯磺酸盐、碳酸氢盐/碳酸盐、硫酸氢盐/硫酸盐、硼酸盐、樟脑酸盐、柠檬酸盐、乙二磺酸盐、乙磺酸盐、甲酸盐、富马酸盐、葡糖酸盐、葡萄糖酸盐、葡糖醛酸盐、六氟磷酸盐、海苯酸盐(hibenzate)、氢氯化物/氯化物、氢溴化物/溴化物、氢碘化物/碘化物、羟乙磺酸盐、乳酸盐、苹果酸盐、马来酸盐、丙二酸盐、甲磺酸盐、甲基硫酸盐、萘甲酸盐、2-萘甲酸盐、烟酸盐、硝酸盐、乳清酸盐、草酸盐、棕榈酸盐、双羟萘酸盐、磷酸盐/磷酸氢盐/磷酸二氢盐、糖酸盐、硬脂酸盐、琥珀酸盐、酒石酸盐、甲苯磺酸盐和三氟乙酸盐。
本文中描述的化合物1和PSMA配体-成像缀合物的合适的碱盐由形成无毒盐的碱形成。说明性实例包含精氨酸、苄星(benzathine)、钙、胆碱、二乙胺、二元胺、甘氨酸、赖氨酸、镁、葡甲胺、醇胺、钾、钠、三甲胺和锌盐。还可形成酸和碱的半盐,例如半硫酸盐和半钙盐。
在一个实施例中,本文中所描述的化合物1和PSMA配体-成像缀合物可以与一或多种药学上可接受的载剂结合的制剂形式投予。载剂可以是赋形剂。载剂的选择在很大程度上取决于例如特定投药方式、载剂对溶解度和稳定性的影响以及剂型的性质的因素。适合于递送本文中所描述的化合物1和PSMA配体-成像缀合物的药物组合物和其制备方法对于本领域的技术人员将是显而易见的。这类组合物和其制备方法可以在例如以引用的方式并入本文中的《雷明顿:药学科学与实践(The Science&Practice of Pharmacy)》,第21版(Lippincott Williams&Wilkins,2005)中找到。
在一个说明性方面,药学上可接受的载剂包含生理相容的任何和所有溶剂、分散介质、包衣、抗细菌和抗真菌剂、等渗剂和吸收延迟剂等以及其组合。在一些实施例中,载剂适合于肠胃外投药。药学上可接受的载剂包含无菌水溶液或分散液以及用于临时制备无菌可注射溶液或分散液的无菌粉末。还可将补充活性化合物掺入本发明的组合物中。
在各种实施例中,液体制剂可包含悬浮液和溶液。这类制剂可包括载剂,例如水、乙醇、聚乙二醇、丙二醇、甲基纤维素或合适的油,以及一或多种乳化剂和/或悬浮剂。液体制剂也可通过固体重构来制备。
在一个实施例中,水性悬浮液可含有与适当赋形剂混合的活性材料。这类赋形剂是悬浮剂,例如羧甲基纤维素钠、甲基纤维素、羟丙基甲基纤维素、藻酸钠、聚乙烯吡咯烷酮、黄芪胶和阿拉伯胶;可以是天然存在的磷脂的分散剂或湿润剂,例如卵磷脂;环氧烷与脂肪酸的缩合产物,例如聚氧乙烯硬脂酸酯;环氧乙烷与长链脂族醇(例如十七烷氧基乙烯十六醇)的缩合产物;环氧乙烷与衍生自脂肪酸和己糖醇的偏酯的缩合产物,例如聚氧乙烯山梨糖醇单油酸酯;或环氧乙烷与衍生自脂肪酸和己糖醇酐的偏酯的缩合产物,例如聚氧乙烯脱水山梨糖醇单油酸酯。水性悬浮液还可含有一或多种防腐剂,例如抗坏血酸、乙酯、正丙酯或对羟基苯甲酸酯;或一或多种着色剂。
在一个说明性实施例中,适于通过添加水制备水性悬浮液的可分散粉末和颗粒提供了与分散剂或湿润剂、悬浮剂和一或多种防腐剂混合的活性成分。也可存在其它赋形剂,例如着色剂。
合适的乳化剂可以是天然存在的树胶,例如阿拉伯胶或黄芪胶;天然存在的磷脂,例如大豆卵磷脂;包含衍生自脂肪酸和己糖醇酐的偏酯的酯,例如脱水山梨糖醇单油酸酯,以及所述偏酯与环氧乙烷的缩合产物,例如聚氧乙烯脱水山梨糖醇单油酸酯。
在其它实施例中,组合物中可包含等渗剂,例如糖;多元醇,例如甘露醇、山梨糖醇或氯化钠。通过在组合物中包含延迟吸收的试剂(例如单硬脂酸盐和明胶),可以实现可注射组合物的延长吸收。
用于口服投药的说明性形式包含片剂、胶囊剂、酏剂、糖浆剂等。
取决于本文中所描述的癌症类型、投药途径和/或化合物1和/或PSMA配体-成像缀合物是局部投药还是全身投药,本文中考虑广泛范围的容许剂量,包含处于约1μg/kg到约1g/kg的范围内的剂量。在一些实施例中,本文中考虑以GBq为单位的容许剂量,包含处于约2GBq到约13GBq的范围内的剂量。剂量可以是单一的或分开的,且可根据广泛多种方案进行投予,包含q.d.、b.i.d.、t.i.d.或甚至每隔一天一次、每两周一次(b.i.w.)、每周一次、每月一次、每季度一次等。在这些情况中的每一种中,应理解,本文中所描述的治疗有效量对应于投药的情况,或替代地对应于由给药方案确定的每日、每周、每月或每季度的总剂量。在一些实施例中,式1化合物可每周一次、或每两周一次、或每三周一次、或每四周一次、或每五周一次、或每六周一次、或每七周一次、或每八周一次等投予。
在一个方面,可将本文中所描述的化合物1或PSMA配体-成像缀合物直接投予到血流、肌肉或内部器官中。用于这种肠胃外投药的合适途径包含静脉内、动脉内、腹膜内、鞘内、硬膜外、脑室内、尿道内、胸骨内、颅内、肿瘤内、肌内和皮下递送。肠胃外投药的合适手段包含针头(包含微针头)注射器、无针头注射器和输注技术。
在一个说明性方面,肠胃外制剂通常是水溶液,其可含有载剂或赋形剂,例如盐、碳水化合物和缓冲剂(优选地在3到9的pH下),但对于一些应用,可将所述制剂更合适地调配为待与合适媒剂(例如无菌、无热原水)结合使用的无菌非水溶液或干燥形式。在其它实施例中,本文中所描述的液体制剂中的任一种可适于肠胃外投予本文中所描述的化合物1或PSMA配体-成像缀合物。在无菌条件下,例如通过在无菌条件下冻干,肠胃外制剂的制备可使用本领域的技术人员熟知的标准药学技术容易地实现。在一个实施例中,可通过使用适当的调配技术(例如掺入溶解度增强剂)来增加用于制备肠胃外制剂的化合物1或PSMA配体-成像缀合物的溶解度。
在各种实施例中,可调配用于肠胃外投药的制剂以立即和/或调节释放。在一个说明性方面,本发明的活性剂(即化合物1或PSMA配体-成像缀合物)可以时间释放制剂(例如以包含缓释聚合物的组合物)的形式投予。可用将保护化合物1或PSMA配体-成像缀合物免于快速释放的载剂制备活性化合物1或PSMA配体-成像缀合物,例如控释制剂,包含植入物和微囊递送系统。可使用可生物降解的生物相容性聚合物,如乙烯乙酸乙烯酯、聚酸酐、聚乙醇酸、胶原蛋白、聚原酸酯、聚乳酸(polylactic acid)和聚乳酸(polylactic)、聚乙醇酸共聚物(PGLA)。制备这类制剂的方法是本领域技术人员通常已知的。在另一实施例中,在适当情况下,可连续投予本文中所描述的化合物1或PSMA配体-成像缀合物或包括化合物1或PSMA配体-成像缀合物的组合物。
在一个实施例中,提供了一种试剂盒。如果将投予活性化合物1与PSMA配体-成像缀合物的组合,那么便可以适合于依序投予或共同投予组合物的试剂盒的形式来组合两种或更多种药物组合物。这种试剂盒包括两种或更多种单独的药物组合物,其中的至少一种含有本文中所描述的化合物1或PSMA配体-成像缀合物,以及用于分开保存所述组合物的装置,例如容器、分开的瓶子或分开的箔包装。在另一实施例中,提供了在具有标签的容器中包括本文中所描述的化合物1或PSMA配体-成像缀合物中的一或多种的组合物,所述标签提供了将化合物1或PSMA配体-成像缀合物用于患者选择和/或治疗的说明书。
在一个实施例中,可通过以下操作来制备无菌可注射溶液:将所需量的活性剂与上述成分中的一种或组合掺入适当溶剂中,随后过滤灭菌。通常,通过将活性化合物1或PSMA配体-成像缀合物掺入无菌媒剂中来制备分散液,所述无菌媒剂含有分散介质和上述那些成分的任何额外成分。在用于制备无菌可注射溶液的无菌粉末的情况下,优选的制备方法是真空干燥和冷冻干燥,其从其先前无菌过滤的溶液中产生活性成分加任何额外所要成分的粉末,或可将所述成分一起无菌过滤。
可将所述组合物调配为溶液、微乳剂、脂质体或适合于高药物浓度的其它有序结构。载剂可以是溶剂或分散介质,其包含例如水、乙醇、多元醇(例如,甘油、丙二醇和液态聚乙二醇等)和其合适的混合物。在一个实施例中,可例如通过使用包衣(例如卵磷脂)在分散液的情况下通过维持所需粒度以及通过使用表面活性剂来维持适当的流动性。
可使用任何有效的投予化合物1的方案。举例来说,化合物1可以单剂量投予,或可将剂量分开且以多剂量每日方案投予。此外,可将例如每周一天到五天的交错方案用作每日治疗的替代方案,且出于本文中所描述方法的目的,这种间歇性或交错的每日方案被认为等效于每日治疗且被考虑。在一个说明性实施例中,利用多次注射化合物1治疗患者以治疗癌症。在一个实施例中,例如以12到72小时的间隔或以48到72小时的间隔多次向患者注射化合物1(优选地约2次到约50次)。可在初次注射之后以几天或几个月的间隔向患者投予化合物1的额外注射,且额外注射可预防癌症的复发。
可使用利用化合物1进行的任何合适的治疗过程。在一个实施例中,选择单独的剂量和剂量方案以提供在一个月内约15mg的总投予剂量。在一个说明性实例中,化合物1以每周五天,在每个4周周期的第1、2和3周中进行单日剂量投予,而在第4周中不投予剂量。在一替代实例中,化合物1以每周三天,在每个4周周期的第1周和第3周进行单日剂量投予,而在第2周和第4周中不投予剂量。在另一替代实例中,化合物1以每两周一次,在第1和第2周(即在3周周期的第1、4、8、11天)进行投予。在另一替代实例中,化合物1以每周一次,在第1和第2周(即3周周期的第1和第8天)进行投予。
化合物1的每日单位剂量可取决于患者的病况、所治疗的癌症、化合物1的投药途径和组织分布以及共同使用其它治疗(例如放射疗法或额外药物组合疗法)的可能性而有很大不同。投予患者的有效量基于体表面积、体重和医师对患者病况的评估。治疗有效剂量(在本文中也称为“治疗有效量”)可在例如约0.5mg/m
在一些实施例中,式1化合物可与第二治疗组合投予。在一些实施例中,第二治疗是最佳支持性治疗。在一些实施例中,第二治疗是最佳护理标准治疗。在一些实施例中,第二治疗是最佳支持性/最佳护理标准治疗。在一些实施例中,第二治疗是雄激素轴全身治疗。在一些实施例中,雄激素轴全身治疗选自以下组成的组:阿比特龙、奥特隆、加勒泰隆、七氢呋喃、阿帕鲁酰胺、恩杂鲁胺和其组合。在一些实施例中,第二治疗是放射疗法。在一些实施例中,放射疗法是外部束放射疗法(EBRT)。
本文中所描述的PSMA配体-成像缀合物和化合物1可含有一个或多个手性中心,或可另外能够以多种立体异构体形式存在。因此,应理解,本发明包含纯的立体异构体以及立体异构体的混合物,例如对映异构体、非对映异构体和对映异构体或非对映异构体富集的混合物。本文中所描述的PSMA配体-成像缀合物和化合物1可能够以几何异构体形式存在。因此,应理解,本发明包含纯的几何异构体或几何异构体的混合物。
应了解,本文中描述的PSMA配体-成像缀合物和化合物1可以非溶剂化形式以及溶剂化形式(包含水合形式)存在。一般来说,溶剂化形式等同于非溶剂化形式,且涵盖在本发明的范围内。本文中所描述的PSMA配体-成像缀合物和化合物1可以多种结晶或非晶形式存在。一般来说,所有物理形式对于本发明所考虑的用途是等同的,且意图处于本发明的范围内。
在另一实施例中,用于投予化合物1的组合物和/或剂型是由纯度为至少约90%、或约95%、或约96%、或约97%、或约98%、或约99%、或约99.5%的化合物1制备的。在另一实施例中,用于投予化合物1的组合物和/或剂型是由纯度为至少90%、或至少95%、或至少96%、或至少97%、或至少98%、或至少99%、或至少99.5%的化合物1制备的。
在另一实施例中,用于投予PSMA配体-成像缀合物的组合物和/或剂型是由纯度为至少约90%、或约95%、或约96%、或约97%、或约98%、或约99%、或约99.5%的PSMA配体-成像缀合物制备的。在另一实施例中,用于投予PSMA配体-成像缀合物的组合物和/或剂型是由纯度为至少90%、或至少95%、或至少97%、或至少98%、或至少99%、或至少99.5%的PSMA配体-成像缀合物制备的。
在另一实施例中,用于投予PSMA配体-成像缀合物的组合物和/或剂型是由放射化学纯度为至少约90%、或约95%、或约96%、或约97%、或约98%、或约99%、或约99.5%的PSMA配体-成像缀合物制备的。在另一实施例中,用于投予PSMA配体-成像缀合物的组合物和/或剂型是由纯度为至少90%、或至少95%、或至少96%、或至少97%、或至少98%、或至少99%、或至少99.5%的PSMA配体-成像缀合物制备的。
可使用任何常规技术来测量本文中所描述的化合物1或PSMA配体-成像缀合物的纯度,所述常规技术包含各种色谱法或光谱技术,例如高压或高效液相色谱法(HPLC)、核磁共振光谱法、TLC、UV吸收光谱、荧光光谱等。
在另一实施例中,本文中所描述的化合物1或PSMA配体-成像缀合物以无菌容器或包装的形式提供。
在一个方面,患者对化合物1治疗的临床益处可表征为总体生存期(OS)。如本文中所使用,术语“总体生存期(OS)”意指从随机分组日期到因任何原因死亡的日期的时间。
在一个方面,可利用实体瘤反应评估标准(RECIST)标准来表征患者对用化合物1进行治疗的临床益处。说明性地,所述标准已根据最初的WHO手册(3)进行改编,其中考虑了所有目标病变的最长直径的测量值:完全反应(CR)-所有目标病变消失;部分反应(PR)-以基线总和最长直径为参考,目标病变的最长直径的总和至少减少30%;稳定疾病(SD)-以自治疗开始以来最小的最长总和为参考,既没有足够的收缩以部分反应的条件,也没有足够的增加以符合进行性疾病的条件;进行性疾病(PD)-以自治疗开始以来记录的最小总和最长直径或出现一或多个新病变为参考,目标病变的最长直径的总和至少增加20%。在另一方面,总体疾病反应率(ORR)是临床益处,且被计算为达到CR或PR的最佳反应的患者的百分比。总体疾病控制率(DCR)可以是另一种临床益处且将其计算为对CR、PR或SD的最佳反应的患者的百分比。在一些实施例中,反应可以是通过RECIST v1.1标准测量的疾病控制率(DCR)。
在另一方面,患者对用化合物1进行治疗的临床益处可表征为放射无进展生存期(rPFS)。如本文中所使用,“放射无进展生存期(rPFS)”是指如前列腺癌第3工作组(PCWG3)指南中概述的从随机分组日期到放射疾病进展日期的时间,或到因任何原因死亡的时间。参见例如Scher HI、Morris MJ、Stadler WM、Higano C、Basch E、Fizazi K等人《去势抵抗性前列腺癌的试验设计和目标:前列腺癌临床试验工作组3(Trial Design andObjectives for Castration-Resistant Prostate Cancer:Updated Recommendationsfrom theProstate Cancer Clinical Trials Work Group 3)》.《临床肿瘤学杂志(J ClinOncol)》2016;34(12):1402-18。在另一方面,患者对用化合物1进行治疗的临床益处可表征为首次出现症状性骨骼事件(SSE)的时间。将了解,症状性骨骼事件是指临床上明显的病理性骨折、手术或放射至骨骼或脊髓受压。如本文中所使用,“首次出现症状性骨骼事件的时间”是指从随机分组日期到首次出现新的症状性病理性骨折、脊髓压迫、肿瘤相关的骨科手术干预或需要放射治疗以减轻骨痛的日期,以先到者为准。
在一个说明性实例中,总体生存期是给定患者的死亡时间,将其定义为从患者接受方案治疗的第一天(C1D1)到患者死亡的日期的天数。可包含所有死亡事件,不论所述事件是在患者仍在服用研究药物时还是在患者中止研究药物后发生。如果患者尚未死亡,那么便可在上次研究访问或最后联系日期或最后一次得知患者还活着的日期检查数据,以较早者为准。
替代地,由用化合物1进行治疗而对患者产生的临床益处可表征为抑制肿瘤生长,这可以通过例如在用化合物1治疗之后对患者的癌症进行随访成像而在患者中鉴定。举例来说,可根据本文中所描述的任何成像技术,通过在投予化合物1之后测量患者中肿瘤的尺寸来表征肿瘤生长的抑制,其中肿瘤生长的抑制由稳定的肿瘤尺寸或由肿瘤尺寸的减小指示。将了解,可使用多种技术来实现对肿瘤生长抑制的鉴定,且不限于本文中所描述的成像方法(例如,CT、MRI、PET成像、SPECT成像或胸部x射线)。
在一个实施例中,提供一种确定是否指示将化合物1用于治疗患有癌症的患者的方法,所述方法包括确定癌症患者的PSMA状态的步骤,其中如果患者的PSMA状态为阳性,那么便指示将化合物1用于治疗患者。
在一个实施例中,提供一种评估是否指示将化合物1用于治疗患有本文中所描述的癌症中的一种的患者的方法。所述方法包括以下步骤:视觉上确定患者的PSMA状态,其中PSMA状态基于患者中PSMA阳性的成像肿瘤,且其中当患者的PSMA状态为阳性时,指示将化合物1用于治疗患者。
在上述实施例中,如果患者处于PSMA状态阳性的组中,那么便指示化合物1治疗的临床益处。在一个实施例中,对患者的临床益处可以是患者的总体生存期、接受使用化合物1的四个或更多个治疗周期的能力、抑制肿瘤生长、稳定疾病、患者对治疗的部分反应、患者对治疗的完全反应、疾病控制(即获得的最佳结果是完全反应、部分反应或疾病稳定)和/或总体疾病反应(即获得的最佳结果是完全反应或部分反应)。在一个说明性实例中,对于接受治疗的胸膜间皮瘤或腺癌(例如,胃食管连接处腺癌)的患者的临床益处是稳定的疾病。
在另一实施例中,本文中描述的方法包含以下实例。实例进一步说明本文中所描述的本发明的各种实施例的额外特征。然而,应理解,所述实施例是说明性的,且不应解释为限制本文中所描述的本发明的其它实施例。另外,将了解,实例的其它变型包含在本文中所描述的本发明的各种实施例中。
实例
实例1:
A.设计:
PSMA阳性扫描的患者以2:1比例随机分组,以接受化合物1加最佳支持性/最佳护理标准,或仅接受最佳支持性/最佳护理标准。最佳支持性/最佳护理标准由治疗医师/研究者确定。所述研究是开放标记的,且在整个6到10个月的治疗期间对患者进行生存期、疾病进展和不良事件的监视。长期随访期包含对生存期和治疗更新、不良事件评估以及用于血液学和化学测试的血液的收集。在随访期间,每3个月(±1个月)通过电话、电子邮件或信件与患者联系24个月,或直到生存率的总体检查率下降到在SAP鉴定的水平为止。
B.第1组:化合物1加最佳支持性/最佳护理标准(BS/BSOC)
将大约160名患者随机分组以7.4GBq(±10%)化合物1(剂量等同于200mCi)的剂量每6周(±1周)静脉内接受研究产品持续最多6个周期,加最佳支持性/最佳护理标准(BS/BSOC)。在4个周期之后,评估患者的(1)反应依据、(2)残留疾病和(3)对化合物1的耐受性。在投予
C.第2组:仅提供最佳支持性/最佳护理标准(BS/BSOC)
随机分组的患者将接受如由研究者确定的最佳支持性/最佳护理标准(BS/BSOC)
D.成果测量指标:
除接受最佳支持性/护理标准外,还接受化合物1的进行性PSMA阳性mCRPC的患者的总体生存期(OS)。
- 治疗癌症的中药组合物及制剂和应用以及治疗癌症的方法
- 包含人载脂蛋白(A)三环LK68或LK8基因作为有效成分用于治疗癌症的治疗剂,以及使用其治疗癌症的方法
