一种利用空斑染色测定鼠细小病毒滴度的方法
文献发布时间:2023-06-19 09:54:18
技术领域
本发明涉及生物技术领域,特别是涉及一种用于病毒清除研究的指示病毒-鼠细小病毒(minute virus of mice,MVM)滴度的精确测定。
背景技术
鼠细小病毒(MVM)属于细小病毒家族,是一类尺寸小、无包膜的单链DNA病毒。这种病毒对加热,干燥,低pH等物理化学处理具有较强的抵抗力。除啮齿动物细小病毒Lu III以外,每个啮齿动物细小病毒颗粒均具有一个负义基因组DNA分子,该分子既具有负链又具有正链DNA分子。MVM的天然宿主是小鼠,许多研究表明MVM对包括细胞分化,增殖和免疫抑制在内的生物学过程产生影响。
病毒安全性研究是生物制药生产过程中的关键点,各国监管机构要求生物制造商在其最终产品可以进行临床试验或商业批准之前,先对其下游制造工艺步骤的“病毒清除”功效进行验证。许多产品都是由啮齿动物衍生的细胞生产的,例如中国仓鼠卵巢细胞(CHO)和小仓鼠肾细胞(BHK)。尽管这些哺乳动物细胞已使用了数十年,但逆转录病毒样颗粒的内源表达和病毒的外源污染事件都需要继续保持警惕。这些细胞极易受MVM感染,并且有几篇关于生物反应器污染MVM的报道。因此,MVM已被用作模型病毒,以评估生物制品纯化过程中病毒去除和灭活的能力。
几种体外测定方法可用于检测MVM,这些方法包括血细胞凝集测定(HA),感染性测定,免疫荧光染色(IFA),酶联免疫吸附测定(ELISA),但均未在病毒清除研究中得到广泛应用。
目前用于细小病毒的定量方法主要包括:基于聚合酶链反应(PCR)的程序,基于逆转录酶聚合酶链反应(RT-PCR)的方法,组织细胞半数感染量测定(TCID
通过PCR进行的病毒的滴定仅限于针对病毒DNA分子的检测,而DNA分子是样本中存在的病毒特异性核酸片段拷贝数而不是感染性颗粒数目得出的。对于诸如PPV之类的细小病毒,这一个问题尤其严重,其中拷贝数与空斑形成单位(PFU)的比率可能超过10
采用RT-PCR的方法依赖于病毒mRNA的扩增,该mRNA在感染过程中可能会有不同水平的表达,或者细胞培养过程中涉及的宿主细胞因子的产生可能会影响感染水平。
当要分析大量样品时,通过TCID
通过对中英文专利的检索,并没发现明确地应用空斑检测法测定MVM病毒滴度的专利。因此急需建立一种有效的测定MVM病毒滴度的方法,使之适用于病毒的清除验证研究。
病毒清除研究是验证客户生物制品纯化工艺中清除有感染活力病毒的能力,因此病毒清除研究中需要一种能够准确测定活病毒的量的方法,这样才能准确的评价各个纯化步骤对病毒清除/灭活的效果。
本发明期望利用空斑染色准确测定有感染活力的MVM病毒,适用于病毒清除研究的需要。
空斑计数法准确定量测定MVM病毒滴度,需满足以下要求:MVM应对新的指示细胞具有高度敏感性,能够引起明显的细胞病变效应,并且能够在指示细胞上产生易于观察的病毒空斑;在一定的病毒滴度范围内,病毒的滴度应与产生的空斑数目应呈良好的线性关系;测定结果应具有稳定性,不同时间、不同细胞批次、不同的操作者均不会影响实验结果,可重复性要好,检测灵敏度要高;该方法的各种参数,包括:线性标准曲线、线性相关系数、测定范围、检测限、精密度、灵敏度等方面,都符合相关法规要求。
发明内容
现有技术中没有发现明确地应用空斑检测法测定MVM病毒滴度的方法。因此,本发明期望建立一种有效的测定MVM病毒滴度的方法,该方法中的指示细胞与MVM病毒有高度敏感性,能产生易于观察的病毒空斑,且病毒滴度与产生的空斑数目呈良好线性关系,稳定性、重现性好,灵敏度高,适用于病毒的清除验证研究。
为解决上述技术问题,本发明采用如下技术方案:
一种利用空斑染色测定鼠细小病毒(MVM)滴度的方法,该方法以324K细胞作为检测鼠细小病毒(MVM)的指示细胞,利用结晶紫染色并读取病毒空斑数目,根据空斑数目结合对应的稀释倍数计算鼠细小病毒(MVM)的滴度。
作为本发明优选的技术方案,该方法包括:
(1)将324K细胞接种于含细胞培养基的细胞培养孔板中,至细胞汇合度为50%-70%;
(2)用制备好的多个不同稀释度的MVM病毒去感染324K细胞;将接种病毒的细胞培养孔板转移入细胞培养箱中孵育,孵育后的细胞培养孔板取出并弃去病毒液,再添加细胞培养基-琼脂混合物,待覆盖在细胞表面的细胞培养基-琼脂混合物完全凝固后,将细胞培养板转移至细胞培养箱中培养7-9天;
(3)待细胞出现明显的空斑后,终止培养;对细胞进行固定,再加入染色液对细胞进行染色、洗净,晾干细胞培养孔板,并观察空斑形态,读取每孔的病毒空斑数目,计算病毒滴度。
作为本发明优选的技术方案,步骤(1)中,每个培养孔接种1.0×10
作为本发明优选的技术方案,步骤(2)中,对病毒的稀释根据实际情况作10倍或其他合适倍数(常用倍数为3.2倍(0.5log)、2.5倍(0.4log))进行系列稀释。比如,对病毒进行连续10倍稀释至10
作为本发明优选的技术方案,步骤(2)中,每个培养孔中加入相同体积的(0.5mL病毒液或其他合适体积)接种量,每个稀释度病毒液做3个复孔。
作为本发明优选的技术方案,步骤(2)中,将接种病毒的细胞板立即转移入细胞培养箱中,进行孵育;孵育期间每15至30分钟,轻轻晃动细胞板,使病毒液充分覆盖培养孔内所有细胞。
作为本发明优选的技术方案,步骤(2)中,预先将细胞培养基和融化的琼脂糖按比例混合均匀,放置在37℃水浴中待用。
作为本发明优选的技术方案,步骤(2)中,将孵育后的细胞培养孔板取出,弃去病毒液,在每孔中加入2.0mL预先准备好的细胞培养基-琼脂混合物,在室温下放置10至30分钟,直至覆盖在细胞表面的细胞培养基-琼脂混合物完全凝固。
作为本发明优选的技术方案,步骤(3)中,细胞染色前,在每孔细胞中加入适量固定试剂,使其充分覆盖细胞培养孔,固定细胞至少一小时,将细胞板底部的细胞固定。
作为本发明优选的技术方案,步骤(3)中,所述固定试剂为甲醛溶液。
作为本发明优选的技术方案,步骤(3)中,固定完成后,去除细胞表面的固体琼脂,在细胞中加入适量染色液对细胞进行染色;染色1-2分钟后,弃去染色液,用清水洗净细胞。
作为本发明优选的技术方案,步骤(3)中,所述染色液为0.5%结晶紫溶液。
作为本发明优选的技术方案,本发明所涉及到的试剂溶液配方如下:
步骤(1)中,所述细胞培养基为DMEM完全培养基;
步骤(2)中,MVM病毒的稀释液为HEPES buffered EMEM(HEPES终浓度0.25M);
步骤(2)中,所述细胞培养基-琼脂混合物的配方为:2×细胞培养基,1%低熔点琼脂糖。其中,细胞培养基为DMEM完全培养基完全培养基。
本发明中使用的324K细胞(商业化细胞系,可以从细胞供应商Thermo FisherScientific购买,且遗传背景清晰、细胞性状稳定、可连续传代)是由SV40(猿猴病毒40)转化的人新生肾脏细胞,将其作为指示MVM的指示细胞,用空斑测定法(plaque assay)准确定量测定MVM病毒的滴度,单位为PFU/mL(PFU定义为空斑形成单位)。MVM病毒感染324K细胞,324K细胞因病毒感染产生细胞病变效应(cytopathic effect,CPE)后形成病毒空斑。理论上一个有感染性的病毒颗粒侵染一个宿主细胞,病毒建立感染后以辐射状感染四周细胞,造成该区域细胞死亡,形成一个病毒空斑即形成一个PFU,根据空斑数目以及相应的稀释倍数即可计算出病毒的滴度。
本发明的有益效果包括:
1.指示细胞324K被MVM病毒感染后用固体琼脂细胞培养基进行培养,感染后的324K细胞无论是显微镜下还是肉眼观察均显示出明显的CPE(cytopathic effect),染色后呈特定的空斑形态。
2.通过控制变量,验证MVM感染324K细胞的空斑测定的稳定性与可重复性,结果表明,在不同时间、不同细胞批次和不同操作人员的情况下,用该方法测定的MVM病毒滴度没有显著差异,绘制的标准曲线具有良好的线性关系,结果稳定性好,可重复性强。
3.本方法的各种参数,包括:线性标准曲线、线性相关系数、测定范围、检测限、精密度、灵敏度等方面,符合相关法规要求,说明该方法能够应用于病毒清除研究中鼠细小病毒滴度的测定。
4.本方法详细描述了以324K细胞作为指示细胞,MVM病毒的空斑测定方法,为其他需要用于病毒清除研究的机构提供了良好的参考依据,同时也为其他细小病毒滴度测定提供可借鉴的实验方法。
附图说明
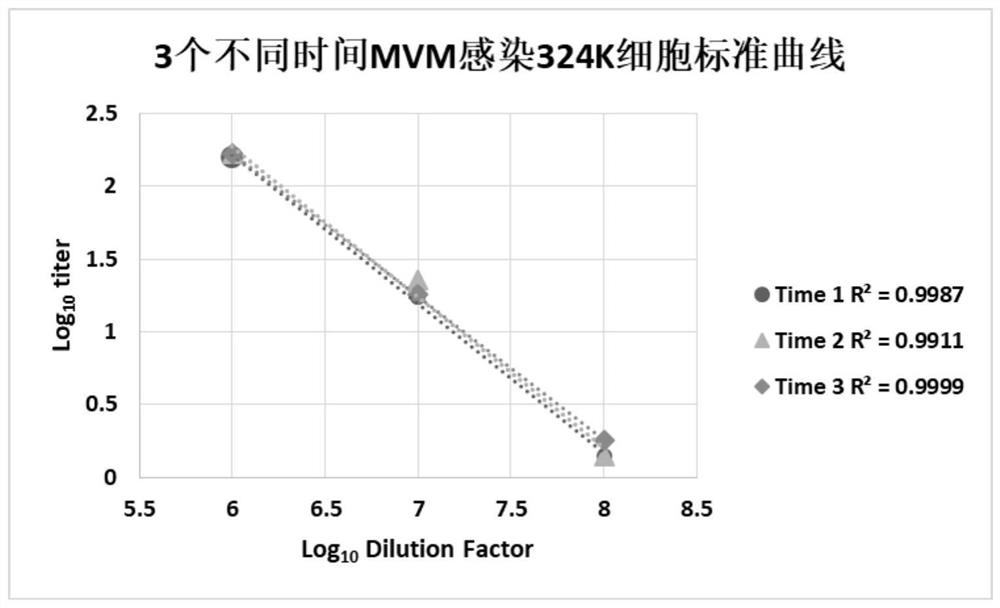
图1是分别在同一天的不同时间和隔天进行MVM的空斑测定的标准曲线的线性关系。
图2是MVM病毒感染3个批次324K细胞的各批次的线性关系。
图3是对MVM感染3个批次324K细胞的空斑测定进行汇总并绘制标准曲线。
图4是不同实验操作者Operator1和Operator2的MVM空斑测定的标准曲线。
图5是324K细胞空斑测定MVM病毒滴度共完成5个Run并绘制标准曲线。
具体实施方式
下面将对本发明的技术方案进行清楚、完整的描述,显然,所描述的实施例是本发明的一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动的前提下所获得的所有其他实施例,都属于本发明保护的范围。
实施例一:同一操作人员在不同时间进行MVM病毒感染324K细胞实验的比较
将MVM病毒解冻后,经超声和过滤处理后用病毒稀释液对病毒进行系列稀释,根据实际情况做10倍系列稀释。
将324K细胞接种于细胞培养六孔板中,每个细胞孔接种2.0×10
对病毒进行连续10倍稀释至10
待细胞出现明显的空斑后,终止培养,在每孔细胞中加入适量多聚甲醛固定试剂,使其充分覆盖细胞培养孔。多聚甲醛能够从培养基-琼脂糖凝胶的表面往下渗透,将细胞板底部的细胞固定。固定细胞至少一小时,随后轻轻去除细胞表面的固体琼脂,在细胞中加入适量0.5%结晶紫溶液对细胞进行染色。染色1-2分钟后,弃去结晶紫溶液,用清水洗净细胞。在通风橱中晾干细胞培养六孔板,并在白光透射仪下观察空斑形态:指示细胞324K被MVM病毒感染后用固体琼脂细胞培养基进行培养,感染后的324K细胞无论是显微镜下还是肉眼观察均显示出明显的CPE(cytopathic effect),结晶紫染色后呈特定的空斑形态。读取每孔的病毒空斑数目,计算病毒滴度。
同一位实验人员分别在同一天的不同时间和隔天进行MVM的空斑测定实验,每次实验做三组重复,每组做三个复孔,实验结果如图1所示。实验结果:三个时间点的MVM病毒感染324K细胞的标准曲线线性关系良好。
实施例二:MVM病毒感染3个不同批次324K细胞的比较
按照实施例一的操作流程,同一批次MVM病毒感染3个不同批次的324K细胞,每个批次细胞做三组重复,每组做三个复孔。空斑测定实验结果如图2和图3所示。由图2可知,3批次细胞之间没有显著差异,3条标准曲线的线性关系都很好,具有良好的重复性。图3中3组数据汇总后的标准曲线的线性关系好。
实施例三:不同实验操作者的比较
按照实施例一的操作流程,两位实验操作者Operator 1和Operator 2进行实验,每个操作者做三组重复,每组做三个复孔实验结果如图4所示。由图4可知,Operator 1和Operator2无显著差别,两条标准曲线重复性好。
实施例四:MVM病毒滴度的统计分析
按照实施例一的操作流程,两位实验操作人员Operator 1和Operator 2参与实验。共进行五轮实验,Operator 1完成三轮实验,Operator 2完成两轮实验,对此五轮实验结果进行统计分析:绘制标准曲线、计算线性相关系数、确定病毒检测范围同时计算出精密度、检测限等相关数据。标准曲线和线性相关系数结果见图5,其他相关数据:
Linearity:Coefficient of Determination,R
Range:范围应在可计数的空斑数范围即在1PFU到TNTC(空斑数过多无法计数)之间;
Limit of Quantitation:c=lnp/-v=1.997PFU/mL;
注:p:probability,v:volume of sample,本实验中:p≤0.05,v=1.5mL(每孔0.5mL,共三个复孔);
Limit of Detection:所检测的最小数量为一个空斑即1PFU;
Precision:不同Run的log10 Titer的平均值、标准偏差以及95%置信度进行统计分析对其精密度进行研究,见下表:
表1批内精密度测试
表2批间精密度测试
以上结果表明以324K细胞为指示细胞,用空斑测定实验测定MVM病毒滴度的方法,符合FDA,ICH和USP相关GLP法规要求,能够用于病毒清除研究中。
综上所述,上述各实施例仅为本发明的较佳实施例而已,并不用以限定本发明的保护范围,凡在本发明的精神和原则之内,所做的任何修改、等同替换、改进等,皆应包含在本发明的保护范围内。
- 一种利用空斑染色测定鼠细小病毒滴度的方法
- 一种利用空斑染色测定伪狂犬病毒滴度的方法
