在猪骨骼肌成肌细胞中过表达IL-15的方法及其应用
文献发布时间:2023-06-19 10:41:48
技术领域
本发明涉及基因工程领域,特别是涉及在猪骨骼肌成肌细胞中过表达IL-15的方法及其应用。
背景技术
随着我国畜牧业特别是现代养殖业集约化程度的提高,猪在生长、肥育和屠宰期间受到越来越多应激因素的影响,引起机体营养物质分配和自由基代谢的变化。应激会打破机体氧化与抗氧化的平衡,导致体内自由基急剧增加,使机体许多重要的生物大分子发生不可逆转的氧化损伤,导致细胞结构和功能的破坏,最终影响动物健康及肉品质(Kerth,2013)。
白细胞介素15(interleukin-15,IL-15)是1994年发现的一种多效性细胞因子,能够调控多种细胞的增殖、分化、维持以及分泌活动[2]。IL-15也是骨骼肌分泌的一类重要肌肉因子,在调节骨骼肌代谢和能量平衡方面发挥着重要作用。它能以内分泌和旁分泌的方式调节肌肉和脂肪组织的代谢,从而维持整个机体的稳态。对IL-15的研究越来越热门,但先前的研究多采用直接添加IL-15的方法来增加其在细胞中的表达,由于IL-15的半衰期很短,单次处理很难达到理想效果,因此需要多次添加,操作繁琐,且增加了研究成本。并且尚未有IL-15对猪骨骼肌成肌细胞的影响的相关报道。
发明内容
本发明的目的是提供在猪骨骼肌成肌细胞中过表达IL-15的方法及其应用,以解决上述现有技术存在的问题,在猪骨骼肌成肌细胞中过表达IL-15,降低了研究成本,简化了操作步骤。本发明证明了IL-15过表达对猪骨骼肌成肌细胞的细胞周期、凋亡率等具有调控作用,为进一步研究IL-15对畜禽肉的影响奠定了基础。
为实现上述目的,本发明提供了如下方案:
第一方面,提供了一种在猪骨骼肌成肌细胞中过表达IL-15的方法,先将IL-15转入慢病毒载体中,再将慢病毒载体转入猪骨骼肌成肌细胞中使猪骨骼肌成肌细胞过表达IL-15。
优选的,所述的慢病毒载体为GV492慢病毒表达载体。
第二方面,提供了IL-15过表达在降低猪骨骼肌成肌细胞凋亡中的应用。
第三方面,提供了IL-15过表达在增强猪骨骼肌成肌细胞抗氧化损伤能力中的应用。
第四方面,提供了IL-15过表达在促进猪骨骼肌成肌细胞的分裂增殖中的应用。
本发明公开了以下技术效果:
本发明提供在猪骨骼肌成肌细胞中过表达IL-15的方法及其应用。本发明利用慢病毒载体将猪IL-15基因转入猪骨骼肌成肌细胞中,并通过检测mRNA和蛋白表达量证明IL-15能够在猪骨骼肌成肌细胞中过表达。本发明直接在猪骨骼肌成肌细胞中过表达IL-15基因,解决了之前的研究中IL-15处理需要多次添加、操作繁琐的问题,并且为后续进一步研究IL-15对肉类的影响奠定了基础。
本发明通过实验证明了IL-15能够促进猪骨骼肌的分裂增殖,能够增强其抗氧化损伤能力及降低细胞凋亡率。提供了IL-15过表达的应用,为后续进一步的研究指明了方向。
附图说明
图1为实施例1中GV492载体图谱;
图2为实施例1中载体酶切后的电泳图;图中泳道1为10kb Marker(条带自上而下依次为:10kb、8kb、6kb、5kb、4kb、3.5kb、3kb、2.5kb、2kb、1.5kb、1kb、750bp、500bp、250bp),泳道2为载体酶切产物,泳道3为未酶切载体;
图3为实施例1中目的基因片段的电泳图;图中左侧条带为Marker(自上而下依次为5kb,3kb,2kb,1.5kb,1Kb,750bp,500bp,250bp,100bp),右侧条带为PCR产物;
图4为实施例1中转化子PCR电泳图;图中泳道1为阴性对照(ddH
图5为实施例1中阳性克隆序列比对结果图;
图6为实施例1中转染后细胞荧光观察结果图;
图7为实施例1中转染后细胞的Western Blot电泳图;图中泳道1为阳性对照,泳道2为阴性对照,泳道3为样品;
图8为实施例2中分离培养的猪骨骼肌卫星细胞图;
图9为实施例2中诱导分化的猪骨骼肌成肌细胞图;
图10为实施例2中免疫荧光测定结果图;图中由上至下依次为猪骨骼肌卫星细胞、分化后的猪骨骼肌成肌细胞、转染对照慢病毒的猪骨骼肌成肌细胞与转染过表达慢病毒的猪骨骼肌成肌细胞;
图11为实施例2中细胞周期检测结果图;
图12为实施例2中细胞凋亡检测的流式细胞术图;
图13为实施例2中猪骨骼肌成肌细胞的流式细胞术凋亡率检测图;
图14为实施例2中猪骨骼肌成肌细胞的IL-15的基因表达量比较图;
图15为实施例2中猪骨骼肌成肌细胞的IL-15的蛋白表达量比较图;
图16为实施例3中H
图17为实施例3中氧化应激条件下细胞周期的检测结果图;
图18为实施例3中氧化应急条件下细胞凋亡的流式细胞术图;
图19为实施例3中氧化应激条件下流式细胞术细胞凋亡率检测图;
图20为实施例3中氧化应激条件下Western Blot检测细胞凋亡率结果图;
图21为实施例3中阴性组的流式细胞术ROS检测结果图;
图22为实施例3中空白细胞+双氧水组的流式细胞术ROS检测结果图;
图23为实施例3中转染对照组病毒+双氧水组的流式细胞术ROS检测结果图;
图24为实施例3中转染过表达IL-15病毒+双氧水组的流式细胞术ROS检测结果图;
图25为实施例3中细胞ROS检测结果图;
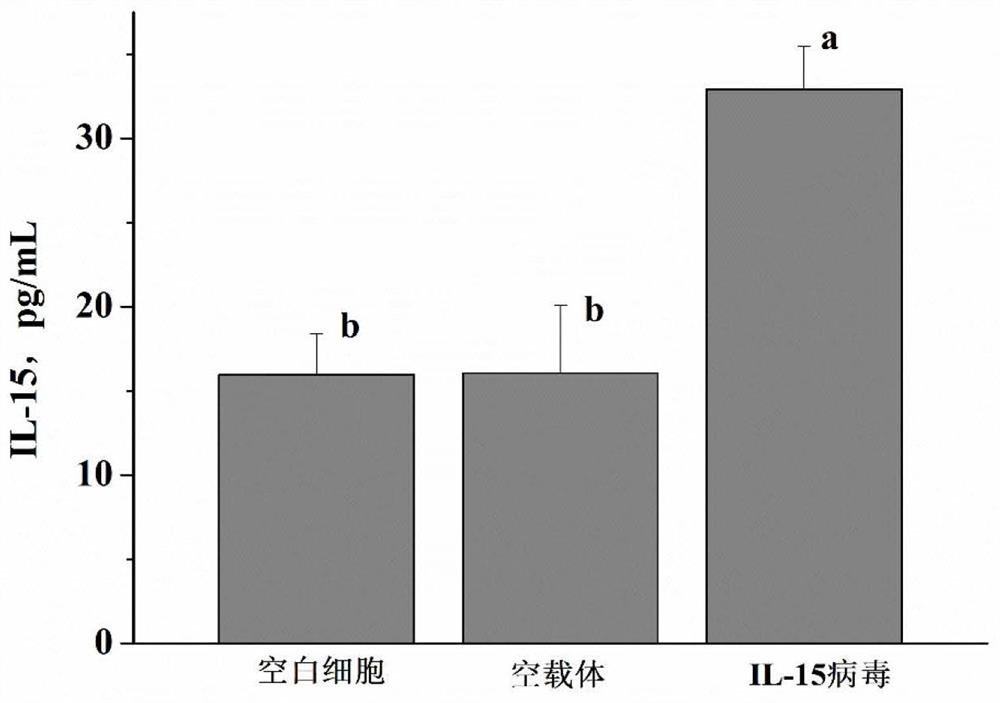
图26为实施例3中细胞IL-15分泌结果图。
具体实施方式
现详细说明本发明的多种示例性实施方式,该详细说明不应认为是对本发明的限制,而应理解为是对本发明的某些方面、特性和实施方案的更详细的描述。
除非另有说明,否则本文使用的所有技术和科学术语具有本发明所述领域的常规技术人员通常理解的相同含义。虽然本发明仅描述了优选的方法和材料,但是在本发明的实施或测试中也可以使用与本文所述相似或等同的任何方法和材料。
在不背离本发明的范围或精神的情况下,可对本发明说明书的具体实施方式做多种改进和变化,这对本领域技术人员而言是显而易见的。由本发明的说明书得到的其他实施方式对技术人员而言是显而易见的。本申请说明书和实施例仅是示例性的。
以下实施例中所使用的材料与试剂如无特殊说明,均可由商业途径获得;所采用的实验方法如未特殊说明,均为本领域常规的实验方法。
实施例1
猪IL-15基因过表达慢病毒的制备
猪IL-15基因序列由NCBI查询得到,登录号为NM_214390。
一、过表达慢病毒载体构建
1、材料与方法
1.1主要试剂
如表1所示
表1主要试剂信息
1.3主要仪器及器材
如表2所示。
表2主要仪器信息
2、载体酶切
2.1载体信息
所用载体名称为GV492,元件顺序:Ubi-MCS-3FLAG-CBh-gcGFP-IRES-puromycin,其中包含BamHI/AgeI两个克隆位点,载体图谱如图1所示。对照空载体编号为CON335。
2.2酶切结果
从细菌中提取的质粒因可能存在超螺旋,开环,线性等不同的构象而具有不同的迁移速率,在琼脂糖凝胶电泳中呈现大小不同的条带,故此时质粒的电泳条带只能作为质粒分子量大小判断的参考,不可作为准确判断依据。质粒经单酶切消化后,会呈现均一的电泳条带,此时可与Marker对比判断其分子量大小。载体经酶切后PCR结果如图2所示,可见单酶切后的载体形成了均一的条带,与Marker对比发现条带分子量与载体图谱记载相同,证明载体酶切成功。
3、目的基因片段的获取
3.1引物信息
根据目的基因序列进行全基因合成,根据载体说明书(过表达慢病毒载体包装和构建手册,https://www.genechem.com.cn/index/supports/download.html),利用PCR扩增目的基因。PCR引物信息如表3所示,引物中含交换配对碱基、酶切位点,并含有目的基因5’端部分序列用于PCR钓取目的基因。
表3 PCR引物信息(SEQ ID NO.1-SEQ ID NO.2)
3.2PCR结果
PCR电泳图如图3所示,产物约530bp。证明目的基因片段获取成功。
4、重组质粒构建
根据载体说明书(过表达慢病毒载体包装和构建手册,https://www.genechem.com.cn/index/supports/download.html),将获得的目的基因PCR产物交换入线性化表达载体,进行PCR鉴定。PCR鉴定引物信息如表4所示。
表4 PCR鉴定引物(SEQ ID NO.3-SEQ ID NO.4)
PCR鉴定结果如图4所示,阳性转化子PCR产物大小为669bp,阴性转化子PCR产物大小为185bp。
对阳性转化子进行测序及比对,比对结果(图5)显示过表达慢病毒载体构建成功。
二、IL-15的表达检测
用构建成功的慢病毒载体转染293T细胞,利用荧光显微镜观察细胞荧光、WesternBlot检测IL-15表达情况,目的基因融合蛋白大小约为20kD。
1、材料与方法
转入的目的细胞为用DMEM培养基(含10%胎牛血清)培养的293T细胞。使用的抗体信息如表5所示:
表5抗体信息
以上信息来自抗体说明书,包括抗体稀释比例(说明书推荐稀释比例)、阳性对照样品(说明书推荐阳性对照)
2、实验方法
2.1细胞蛋白抽提
预冷RIPA蛋白抽提试剂,加入蛋白酶抑制剂。在蛋白抽提开始前加入0.1M PMSF母液,PMSF终浓度1mM。细胞计数,以细胞数量1×10
2.2BCA蛋白法定量
准备BCA工作液A液:B液=50:1,稀释好各个提取BSA标准品。样品用PBS进行稀释。
样品:BCA工作液=1:8,混匀后37度孵育30min或者室温孵育60min,酶标仪570nm波长滤光片读取OD值。
2.3蛋白浓度调整
以RIPA调整蛋白浓度,加入5×还原样品缓冲液后样品终浓度为2-4mg/ml(不同样品具体确定)。煮沸变性5min。
2.4Western Blot实验
(1)根据目的蛋白的分子量,配制10%分离胶,浓缩胶浓度为5%;
(2)取待检测蛋白样品20μg上样;阳性对照为WB标准品——SURVIVIN-3FLAG-GFP(分子大小:48KD),阴性对照为293T细胞;
(3)电泳条件:浓缩胶恒压90V,约20min;分离胶恒压160V,通过预染蛋白Marker来确定电泳停止时间;
(4)湿转法,转膜条件:300mA恒流;0.45μm孔径NC膜,转膜时间2.5h;转膜完成后丽春红染色试剂对膜进行染色,观察转膜效果,同时做好泳道标记;
(5)封闭:将膜完全浸没在3%BSA-TBST中室温轻摇30min;
(6)一抗孵育:用3%BSA-TBST稀释一抗,室温孵育10min,放4℃过夜;第二天从4℃拿出膜,室温条件下孵育30min;洗膜:TBST洗膜5次,每次3min;
(7)二抗孵育:用5%脱脂奶粉-TBST稀释二抗,山羊抗小鼠IgG(H+L)HRP,1:10000,室温轻摇40min;洗膜:TBST洗膜6次,每次3min;
(8)ECL法结合x光片显色:ECL加到膜上后反应3-5min,胶片曝光10s-5min(曝光时间根据光强度调整),显影2min,定影。
2.5病毒滴度检测
荧光法进行病毒滴度检测,测得病毒滴度为2.5E+9。
3、实验结果
转染后细胞荧光观察结果图如图6所示,可以看到转染后细胞内可观察到明显的荧光,说明目的质粒转染正常、目的质粒中荧光标记基因表达正常。
Western Blot电泳结果如图7所示。可见20kD处出现了明显的特征条带,大小和目的基因融合蛋白相吻合,证明目的基因过表达成功。
实施例2
猪骨骼肌成肌细胞IL-15过表达
一、材料与设备
所需实验仪器如表6所示,材料与试剂如表7所示。
表6实验仪器信息
表7实验材料及试剂信息
二、实验步骤与结果
1、猪骨骼肌卫星细胞的分离培养及诱导分化
1.1猪骨骼肌卫星细胞的分离培养
将仔猪颈部动脉放血致死,取子宫组织,置于含有P/S的PBS中,然后使用75%酒精给仔猪全身消毒,无菌条件下分离大腿骨骼肌,置于含有双抗的PBS中,反复漂洗3-5次,移至培养皿中,用眼科剪将其剪成1mm3大小的组织块,将剪碎的组织块转移至50mL离心管,加入0.25%Trypsin 37℃水浴震荡消化30min,然后用完全培养基中和消化液,将消化好的组织混合物过100μm筛网,收集滤液,1500rpm离心10min,离心完成后,弃上清,沉淀用培养基重悬后,转入T-25培养瓶中,放入培养箱中,每隔24h换液。培养得到的细胞如图8所示,可见细胞培养成功。
1.2猪骨骼肌卫星细胞的诱导分化
取第二代的猪骨骼肌卫星细胞接种于L-多聚赖氨酸铺底的培养瓶中,待细胞融合度为50-60%左右时,加入分化培养基:DMEM(低糖)+2%山羊血清,培养到第3天时换液。总共培养5天后观察细胞的生长状况。培养得到的细胞如图9所示,可见细胞分化成功,得到猪骨骼肌成肌细胞。
1.3IL-15过表达慢病毒转染
将分化后的成肌细胞接种6孔板,每孔细胞数约为1×10
1.4免疫荧光测定
分别取猪骨骼肌卫星细胞、分化后的猪骨骼肌成肌细胞、转染对照慢病毒的猪骨骼肌成肌细胞与转染过表达慢病毒的猪骨骼肌成肌细胞进行测定。具体步骤如下:
(1)细胞爬片
取3片玻璃片于24孔板中,每孔加入培养基1mL,加入细胞0.2×10
(2)固定
细胞爬片后,吸出培养基,用PBS洗1遍,加入4%PFA于4℃固定30min。用PBS洗3×5min/次。也可最后一次不吸出PBS,放4℃过夜。
(3)破膜封闭
将玻片除去水分,置于培养皿支撑物上,
玻璃片封闭液配置:0.5%Trition X-100与PBS 1:1混合,再加10%血清,
取50uL破膜封闭液滴于防水膜上,将玻片上有细胞的一面盖上2h。
(4)一抗孵育
一抗(α-SMA)配制:抗体与PBS 1:100稀释。
破膜封闭后,取50uL一抗于防水膜上(湿盒中),将玻片(有细胞的一面)盖上置于4℃(最多可放置一周)
(5)二抗孵育
二抗(CoraLite594–conjugated Goat Anti-Rabbit IgG(H+L))配制:抗体与PBS1:500稀释。
室温避光孵育二抗2h后,用PBS洗3次,每次5min;染DAPI(DAPI:PBS=1:1000)5min,PBS洗3次,每次5min。
(6)包埋
玻片上各滴1滴Fluoromount-G,将有细胞的一面盖上,进行观察。
荧光测定结果如图10所示。
1.5细胞周期检测
使用无EDTA的胰蛋白酶消化细胞,1000r/min离心5min,收集细胞,PBS洗涤后,以75%的预冷乙醇固定过夜,1000r/min离心10min弃乙醇,用含PI 100μg/mL和RNAase 200μg/mL的染液温育30min,流式细胞仪检测凋亡细胞峰,其荧光信号经流式细胞仪Multicycle细胞周期分析软件处理。
检测结果如图11所示,转染IL-15后,G1期细胞比例显著下降,S期和G2/M期细胞比例显著升高。说明IL-15可促进成肌细胞的分裂和增殖。
1.6细胞凋亡的检测
使用Annexin V-FITC凋亡检测试剂盒(日本同仁化学研究所,批号VN665)进行细胞凋亡检测。使用无EDTA的胰蛋白酶消化细胞,1000r/min离心5min。加入1×AnnexinV结合液重悬细胞后加入5μL Annexin V-FITC、5μL PI混匀,室温避光下培养15min,随即用流式细胞仪进行检测,检测结果如图12和图13所示。细胞转染IL-15后,成肌细胞凋亡率显著下降。说明IL-15可抑制成肌细胞的凋亡。
1.7细胞基因表达检测
1.7.1材料与试剂
使用无EDTA的胰蛋白酶消化细胞,1000r/min离心5min。收集细胞,检测IL-15基因表达。所使用的仪器及试剂如表8所示。
表8所使用仪器及试剂
Real Time PCR检测目的基因所使用引物如表9所示(SEQ ID NO.5-SEQ IDNO.8)。以下引物均在北京Invitrogen公司合成。
表9检测基因表达所用引物信息
1.7.2实验方法
1.7.2.1样品RNA的提取与质量检测
采用TRNzol总RNA提取试剂进行样本RNA提取,实验操作按产品说明书进行。
利用紫外吸收测定法检测浓度和纯度。使用
RNA浓度计算方法如下:260nm处读值为1表示40ng RNA/μL。样品RNA浓度计算公式为:A
RNA纯度由A
1.7.2.3变性琼脂糖凝胶电泳
1g琼脂糖溶于72ml水中,冷却至60℃,加入10ml的10×MOPS电泳缓冲液和18ml的37%甲醛溶液(12.3M)。
10×MOPS电泳缓冲液中按终浓度计算,包括pH 7.0的MOPS 0.2M,乙酸钠0.02M,EDTA 0.01M。
灌制凝胶板,预留加样孔至少可以加入25μl溶液。胶凝后取下梳子,将凝胶板放入电泳槽内,加足量的1×MOPS电泳缓冲液至覆盖胶面几个毫米。
取1μgRNA,加1倍体积的甲醛上样染液,加EB于甲醛上样染液中至终浓度为10μg/ml。加热至70℃孵育5分钟使样品变性。上样于胶孔中,5-6V/cm电压下电泳至溴酚蓝指示剂进胶至少2-3cm。紫外透射光下观察,结果显示RNA样品纯度较高,可以用于后续实验。
1.7.2.4RealTime PCR样本检测
纯化后的RNA样品采用PrimeScript
(1)反应体系配置:将所有cDNA样品分别配置Realtime PCR反应体系。RealtimePCR反应体系为18μL体系,具体包括2×Master Mix 10μL,10μM的PCR特异引物F 0.5μL,10μM的PCR特异引物R 0.5μL,加水至总体积为18μL。轻弹管底将溶液混合,5000rpm短暂离心。
(2)加样:将18μL混合液加到96-PCR板对应的每个孔中,再加入对应的2μL cDNA。小心粘上Sealing Film封口膜,并短暂离心混合。在设置PCR程序前将准备好的PCR板放在冰上。
(3)PCR反应:按以下程序进行:95℃,30秒;40个PCR循环(95℃,5秒;60℃,40秒(收集荧光))。为了建立PCR产物的熔解曲线,扩增反应结束后,按(95℃,10秒;60℃,60秒;95℃,15秒);从60℃缓慢加热到99℃(仪器自动进行-Ramp Rate为0.05℃/秒)。
1.7.3实验结果
各样品的目的基因和内参基因分别进行Realtime PCR反应,每个样本检测3个复孔。数据采用2
结果如图14所示,转染慢病毒后,成肌细胞中IL-15的基因表达显著增加。说明IL-15过表达慢病毒构建成功。
1.8细胞蛋白表达检测
使用无EDTA的胰蛋白酶消化细胞,1,000r/min离心5min。收集细胞,检测IL-15蛋白表达。
结果如图15所示,转染慢病毒后,成肌细胞中IL-15的蛋白表达显著增加。
实施例3
IL-15对猪骨骼肌成肌细胞氧化损伤的作用
一、氧化应激模型的建立
采用MTT法检测细胞存活率。
(1)将猪骨骼肌成肌细胞按1×10
(2)除去培养液,分别加入含0.1、0.2、0.4与0.8mM H
(3)除去培养液,PBS洗涤2次;
(4)每孔加入20μL 5g/L的MTT溶液,继续培养4h;
(5)除去上清,每孔加入150μL DMSO,震荡10min;
(6)在570nm波长下酶标仪测定各孔OD值。
结果如图16所示,建立氧化应激模型时,细胞存活率通常在50%-70%范围内。细胞存活率过高,无法造成明显的氧化损伤,而存活率过低,则引起不可逆损伤,均不利于构建氧化应激模型。因此,分别以0.1mM与1.5h作为H
二、IL-15对猪骨骼肌成肌细胞氧化损伤的作用检测
原代培养猪骨骼肌卫星细胞,待细胞融合度为50-60%左右时,加入分化培养基(低糖DMEM培养基+2%山羊血清)诱导分化5天。再向分化后的成肌细胞转染空载体或GV492-IL-15重组慢病毒处理细胞,72h后以0.1mM H
1、细胞周期检测
按照实施例2的方法进行细胞周期检测,结果如图17所示,氧化应激条件下,转染IL-15后细胞G1期的比例显著下降,G2/M期细胞的比例显著升高。与空载体组相比,S期细胞比例显著下降,但与空白细胞比,差异不显著。说明IL-15可促进成肌细胞的分裂和增殖。
2、细胞凋亡检测
2.1流式细胞仪检测
使用无EDTA的胰蛋白酶消化细胞,1000r/min离心5min。加入1×AnnexinV结合液重悬细胞后加入5μL Annexin V-FITC、5μL PI混匀,室温避光下培养15min,随即用流式细胞仪进行检测。
检测结果如图18和图19所示,可见转染IL-15后细胞凋亡的比例明显下降。说明IL-15能够降低氧化应激条件下细胞的凋亡率。
2.2Western Blot检测
通过检测细胞中活化的caspase-3蛋白表达情况来反映细胞凋亡的变化。Cleavedcaspase-3抗体购自Immunoway公司,货号YM3431,稀释比例1:500。
结果如图20所示,氧化应激使成肌细胞凋亡率显著升高,而转染IL-15慢病毒可使细胞的凋亡率显著下降,证实IL-15可通过抑制细胞凋亡来缓解氧化损伤。
3、细胞ROS检测
将H
结果如图21-图25所示,氧化应激可使细胞中ROS含量显著升高。转染IL-15慢病毒处理,可使细胞中ROS含量显著降低。说明IL-15可在一定程度上抑制成肌细胞的氧化损伤。
4、细胞IL-15分泌
收集处理后的细胞培养上清,采用ELISA试剂盒(R&D Systems)检测IL-15的分泌情况。
结果如图26所示,氧化应激条件下,转染IL-15慢病毒后细胞分泌IL-15显著增多,说明IL-15可缓解由氧化应激造成的细胞损伤。
以上所述的实施例仅是对本发明的优选方式进行描述,并非对本发明的范围进行限定,在不脱离本发明设计精神的前提下,本领域普通技术人员对本发明的技术方案做出的各种变形和改进,均应落入本发明权利要求书确定的保护范围内。
序列表
<110> 中国农业科学院北京畜牧兽医研究所
<120> 在猪骨骼肌成肌细胞中过表达IL-15的方法及其应用
<160> 8
<170> SIPOSequenceListing 1.0
<210> 1
<211> 50
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 1
aggtcgctct agaggatccc gccaccatga gaattttgaa accatgtttg 50
<210> 2
<211> 39
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 2
tccttgtagt ccataccaga agggttgatg aacatttgc 39
<210> 3
<211> 23
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 3
gggtcaatat gtaattttca gtg 23
<210> 4
<211> 22
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 4
ccttatagtc cttatcatcg tc 22
<210> 5
<211> 21
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 5
gcatccagtg ctacttgtgt r 21
<210> 6
<211> 20
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 6
tgccaggttg cttctgtttt 20
<210> 7
<211> 20
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 7
tgcgggacat caaggagaag 20
<210> 8
<211> 20
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 8
agttgaaggt ggtctcgtgg 20
- 在猪骨骼肌成肌细胞中过表达IL-15的方法及其应用
- 增加Survivin表达的CAR-T细胞并联合IL-15在制备抗肿瘤药物中的应用
