一种菌-藻共生絮凝体系的制备方法
文献发布时间:2023-06-19 10:54:12
技术领域
本发明属于生物技术领域,具体涉及一种菌-藻共生絮凝体系的制备方法。
背景技术
生物絮凝菌本质上是一种胞外大分子聚合物,是由生物体在生长过程中产生的糖蛋白,多糖,蛋白质,纤维素,脂肪,糖脂和核酸等组成的。絮凝剂的絮凝活性取决于絮凝剂的特性,总的来说,生物絮凝是一个动态过程,具有无害,可生物降解的特点。
微藻广泛分布于自然界,具有环境适应能力强、生长速率快、生长周期短、可高效吸收废水中的氮、磷等营养元素等优点,已被普遍应用于生物燃料、医学原料、优质食品源及畜牧养殖业等领域,被认为是最具潜力替代传统能源的新型生物质能源。目前限制微藻生物技术发展的主要挑战之一就是微藻的富集。由于微藻个体小且能稳定悬浮于溶液中,密度低,如何从微藻培养基中高效收获微藻是目前学者们积极探索的难题。与常规富集方法如离心、过滤等相比,絮凝法被认为是低成本富集微藻的高效手段。
藻-菌共生系统可实现污水二、三级处理低成本运行,是应用前景广阔的可持续污水处理技术。然而,占地面积大、处理能力低、处理效果不稳定和藻细胞采收成本高等限制了其大规模工程推广应用。因此可自然沉降微藻-菌是解决问题的关键。在此方面,可自然沉降藻-菌共生絮凝体研究受到国内外广泛关注。
微藻细胞一般直径较小,带负电。这种特性使得藻细胞在水中往往处于较为稳定的悬浮状态,很难通过重力沉淀实现自然分离,在水处理中有效分离藻细胞都是限制微藻技术大规模工业化应用的主要瓶颈。探索在反应体系内部实施“原位”分离藻细胞的技术方法,藻-菌共生絮凝体存在很好的发展潜力。
在广泛应用的传统生物脱氮工艺中,藻类系统是一种经济且除氮效率高的解决方案。然而,需要在不影响出水质量的情况下减少藻类的实际残留,同时保持较低的运行成本。这些问题可以通过使用微藻-细菌共生体系来解决。藻类的光合作用提供氧气,供异养和氨氧化细菌使用,碳质氧化过程释放的二氧化碳可以被微藻利用。
营养物质的交换,悬浮系统中的自遮蔽效应,或细菌或藻类释放毒素等,阻碍它们的共同生长,这些因素影响藻类和细菌的生长以及它们之间的相互作用。这些相互作用受到操作条件的影响,比如pH值、光照强度、温度、营养成分等参数对微生物和微藻种群有不同的最佳范围。
絮凝法通常包括化学絮凝法、物理絮凝法、自絮凝法和生物絮凝法。其中,生物絮凝法是一种绿色环保且高效的富集方法,某些特定细菌可分泌具有絮凝活性的胞外聚合物起到絮凝微藻的作用,具有富集潜能。因此,有必要开发一种高效、低成本的下游工艺,从培养基中获取微藻细胞,并在适当的领域使用并保持其活力和生物活性。
发明内容
有鉴于此,本发明提供一种菌-藻共生絮凝体系的制备方法,本发明制备了新型海洋细菌产生物絮凝菌,绿色环保,生物絮凝菌产量显著提高,解决了生物絮凝菌生产效率低和产量低的问题,同时提供一种新的菌-藻共生絮凝体系。
本发明的技术方案为:
一种菌-藻共生絮凝体系的制备方法,其特征在于,包括生物絮凝菌的培养、栅藻的培养,将絮凝菌与栅藻在生长对数期后期共培养;所述生物絮凝菌的培养是为海科贝特氏菌(
本发明中,采用的海科贝特氏菌(
进一步的,所述生物絮凝菌的培养,包括以下步骤:
S1.从固体琼脂培养基上挑取菌落接种于种子培养基中,25-30℃、120-180r/min培养32-38h;
S2.将步骤S1中培养的种子菌液按接种量8-12%(v/v)转接至发酵培养基,25-30℃、120-180r/min培养28-36h;
S3.将步骤S2中培养液离心处理,获得生物絮凝菌母液;
S4.用蒸馏水配制培养基,121℃灭菌,20分钟;
S5.将生物絮凝菌母液在培养基中继续培养24-36h,离心处理,获得生物絮凝菌。
进一步的,所述栅藻的培养,包括以下步骤:将栅藻的藻种,在以下条件进行培养:温度为28-30℃,磁力搅拌转速为250-300r/min,CO
进一步的,所述步骤S2中,在含有发酵培养基的摇瓶中,加入摇瓶体积15-30%的种子培养液,进行培养。
进一步的,所述步骤S4中,灭菌前用2MNaOH或2MHCl将培养基初始pH调至4.0-10.0。
进一步的,所述步骤S4中,灭菌前用2MNaOH或2MHCl将培养基初始pH调至8.0。
进一步的,所述固体琼脂培养基包括以下组分:胰蛋白胨10.0g/L,酵母粉5.0g/L,NaCl30.0g/L,琼脂20.0g/L。
进一步的,所述种子培养基包括以下组分:胰蛋白胨10.0g/L,酵母粉5.0g/L,NaCl30.0g/L。
进一步的,所述发酵培养基包括以下组分:葡萄糖30.0-50.0g/L,胰蛋白胨5.0g/L,酵母粉1.0g/L,将上述组分溶于80%(v/v)人工海水和20%(v/v)去离子水中。
进一步的,所述人工海水成分包括以下组分:NaCl24.0g/L,MgCl
进一步的,所述步骤S4中,所述培养基包括固体琼脂培养基、复合氮源,所述复合氮源为酵母提取物和谷氨酸的组合。
进一步的,所述复合氮源中,酵母提取物与谷氨酸的质量比(w/w)为4:1-6:1。
絮凝法通常包括化学絮凝法、物理絮凝法、自絮凝法和生物絮凝法。其中,生物絮凝法是一种绿色环保且高效的富集方法,某些特定细菌可分泌具有絮凝活性的胞外聚合物起到絮凝微藻的作用,具有富集潜能。因此,开发一种能使得产生物絮凝菌菌(以下称絮凝剂菌)与微藻共生,而又能保持甚至提高微藻生物量,同时不影响生物絮凝菌的产生与絮凝作用的共生体系,使微藻与絮凝剂菌形成互惠互利的共生关系,生长过程中絮凝菌和微藻互利共生,促进絮凝剂的产生,提高微藻的生物量,在培养后期,共生体系中的絮凝菌所产生物絮凝菌可富集藻类。节约成本,节约处理时间,为进一步工业化实施提供高效,低成本的工艺条件。本发明中,海科贝特氏菌(Cobetiamarina)能够合成多种代谢产物,尤其是能产生对微藻有絮凝作用的胞外聚合物。高温栅藻是一种具有较高叶黄素含量和生物量产率的微藻,被认为是一种新兴的叶黄素来源。
藻类培养过程由于微藻的光合作用,pH值很容易上升至9-10,而本发明中絮凝菌种在生长过程中,培养环境中的pH值会降至3-4,二者共生环境pH值能稳定在6-8之间,有利于生长。本发明中,提供了一种藻-菌共生絮凝体,实现微藻与产絮凝活性物质的菌共生,经生物絮凝作用而自发形成的生物絮凝体,具有良好的沉降性能,可以通过静置自沉降。
本发明的有益效果在于:
本发明作为新型海洋细菌产生物絮凝菌,绿色环保,优化后的培养基通过响应面优化得到最大的生物絮凝菌产量,比原培养基显著提高,解决了生物絮凝菌生产效率低和产量低的问题,为工业化生产奠定坚实的基础。同时,本发明中,栅藻中接入生物絮凝菌后共培养,栅藻的自絮凝速度加快,出现明显聚集,提供了一种新的菌-藻共生絮凝体系。
附图说明
图1为本发明中初始碳源浓度对细胞生长和生物絮凝菌生产的影响;
图2为本发明中不同初始葡萄糖浓度下生物量积累的动态过程;
图3为本发明中不同初始葡萄糖浓度下葡萄糖消耗的动态过程;
图4为本发明中单一氮源对生物量和生物絮凝产量的影响;
图5为本发明中复合氮源对生物量和生物絮凝体产量的影响;
图6为本发明中初始pH对生物量和菌落产量的影响。
具体实施方式
为使本发明的目的、技术方案及优点更加清楚明白,以下结合具体实施方式,对本发明进行进一步的详细说明。应当理解的是,此处所描述的具体实施方式仅用以解释本发明,并不限定本发明的保护范围。
实施例1
一种菌-藻共生絮凝体系的制备方法,其特征在于,包括生物絮凝菌的培养、栅藻的培养,将絮凝菌与栅藻在生长对数期后期共培养;所述生物絮凝菌的培养是为海科贝特氏菌(
进一步的,所述生物絮凝菌的培养,包括以下步骤:
S1.从固体琼脂培养基上挑取菌落接种于种子培养基中,28℃、150r/min培养36h;
S2.将步骤S1中培养的种子菌液按接种量10%(v/v)转接至发酵培养基,28℃、150r/min培养32h;
S3.将步骤S2中培养液离心处理,获得生物絮凝菌母液;
S4.用蒸馏水配制培养基,121℃灭菌,20分钟;
S5.将生物絮凝菌母液在培养基中继续培养30h,离心处理,获得生物絮凝菌。
进一步的,所述栅藻的培养,包括以下步骤:将栅藻的藻种,在以下条件进行培养:温度为29℃,磁力搅拌转速为270r/min,CO
进一步的,所述步骤S2中,在含有发酵培养基的摇瓶中,加入摇瓶体积20%的种子培养液,进行培养。
进一步的,所述步骤S4中,灭菌前用2MNaOH或2MHCl将培养基初始pH调至8.0。
进一步的,所述固体琼脂培养基包括以下组分:胰蛋白胨10.0g/L,酵母粉5.0g/L,NaCl30.0g/L,琼脂20.0g/L。
进一步的,所述种子培养基包括以下组分:胰蛋白胨10.0g/L,酵母粉5.0g/L,NaCl30.0g/L。
进一步的,所述发酵培养基包括以下组分:葡萄糖30.0g/L,胰蛋白胨5.0g/L,酵母粉1.0g/L,将上述组分溶于80%(v/v)人工海水和20%(v/v)去离子水中。
进一步的,所述人工海水成分包括以下组分:NaCl24.0g/L,MgCl
进一步的,所述步骤S4中,所述培养基包括固体琼脂培养基、复合氮源,所述复合氮源为酵母提取物和谷氨酸的组合。
进一步的,所述复合氮源中,酵母提取物与谷氨酸的质量比(w/w)为5:1。
实施例2
一种菌-藻共生絮凝体系的制备方法,其特征在于,包括生物絮凝菌的培养、栅藻的培养,将絮凝菌与栅藻在生长对数期后期共培养;所述生物絮凝菌的培养是为海科贝特氏菌(
进一步的,所述生物絮凝菌的培养,包括以下步骤:
S1.从固体琼脂培养基上挑取菌落接种于种子培养基中,25℃、120r/min培养38h;
S2.将步骤S1中培养的种子菌液按接种量8%(v/v)转接至发酵培养基,25℃、120r/min培养236h;
S3.将步骤S2中培养液离心处理,获得生物絮凝菌母液;
S4.用蒸馏水配制培养基,121℃灭菌,20分钟;
S5.将生物絮凝菌母液在培养基中继续培养36h,离心处理,获得生物絮凝菌。
进一步的,所述栅藻的培养,包括以下步骤:将栅藻的藻种,在以下条件进行培养:温度为28℃,磁力搅拌转速为250r/min,CO
进一步的,所述步骤S2中,在含有发酵培养基的摇瓶中,加入摇瓶体积30%的种子培养液,进行培养。
进一步的,所述步骤S4中,灭菌前用2MNaOH或2MHCl将培养基初始pH调至6.0。
进一步的,所述固体琼脂培养基包括以下组分:胰蛋白胨10.0g/L,酵母粉5.0g/L,NaCl30.0g/L,琼脂20.0g/L。
进一步的,所述种子培养基包括以下组分:胰蛋白胨10.0g/L,酵母粉5.0g/L,NaCl30.0g/L。
进一步的,所述发酵培养基包括以下组分:葡萄糖40.0g/L,胰蛋白胨5.0g/L,酵母粉1.0g/L,将上述组分溶于80%(v/v)人工海水和20%(v/v)去离子水中。
进一步的,所述人工海水成分包括以下组分:NaCl24.0g/L,MgCl
进一步的,所述步骤S4中,所述培养基包括固体琼脂培养基、复合氮源,所述复合氮源为酵母提取物和谷氨酸的组合。
进一步的,所述复合氮源中,酵母提取物与谷氨酸的质量比(w/w)为4:1。
实施例3
一种菌-藻共生絮凝体系的制备方法,其特征在于,包括生物絮凝菌的培养、栅藻的培养,将絮凝菌与栅藻在生长对数期后期共培养;所述生物絮凝菌的培养是为海科贝特氏菌(
进一步的,所述生物絮凝菌的培养,包括以下步骤:
S1.从固体琼脂培养基上挑取菌落接种于种子培养基中,30℃、180r/min培养32h;
S2.将步骤S1中培养的种子菌液按接种量12%(v/v)转接至发酵培养基,30℃、180r/min培养28h;
S3.将步骤S2中培养液离心处理,获得生物絮凝菌母液;
S4.用蒸馏水配制培养基,121℃灭菌,20分钟;
S5.将生物絮凝菌母液在培养基中继续培养24-36h,离心处理,获得生物絮凝菌。
进一步的,所述栅藻的培养,包括以下步骤:将栅藻的藻种,在以下条件进行培养:温度为30℃,磁力搅拌转速为300r/min,CO
进一步的,所述步骤S2中,在含有发酵培养基的摇瓶中,加入摇瓶体积15%的种子培养液,进行培养。
进一步的,所述步骤S4中,灭菌前用2MNaOH或2MHCl将培养基初始pH调至9.0。
进一步的,所述固体琼脂培养基包括以下组分:胰蛋白胨10.0g/L,酵母粉5.0g/L,NaCl30.0g/L,琼脂20.0g/L。
进一步的,所述种子培养基包括以下组分:胰蛋白胨10.0g/L,酵母粉5.0g/L,NaCl30.0g/L。
进一步的,所述发酵培养基包括以下组分:葡萄糖50.0g/L,胰蛋白胨5.0g/L,酵母粉1.0g/L,将上述组分溶于80%(v/v)人工海水和20%(v/v)去离子水中。
进一步的,所述人工海水成分包括以下组分:NaCl24.0g/L,MgCl
进一步的,所述步骤S4中,所述培养基包括固体琼脂培养基、复合氮源,所述复合氮源为酵母提取物和谷氨酸的组合。
进一步的,所述复合氮源中,酵母提取物与谷氨酸的质量比(w/w)为6:1。
实验测试
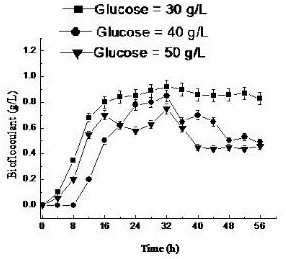
图1中给出了不同初始葡萄糖浓度下生物絮凝菌产量的时间过程。生物絮凝菌在指数期开始积累,在32h达到峰值,然后在固定期后期积累速度减缓。当葡萄糖初始浓度为40和50g/L时,生物量中生物絮凝菌含量在32h达到最大值,然后下降。当葡萄糖初始浓度为30g/L时,培养32h后生物絮凝菌产量达到最高值(0.92g/L),在固定阶段开始趋于稳定。该生物絮凝菌浓度比其他初始葡萄糖浓度培养的絮凝剂浓度高约13.4%-18.48%。
图2中为不同初始葡萄糖浓度下的生物量产量。在培养初期(12小时之前),初始葡萄糖浓度越高,细菌生长越慢。但实验组很快进入指数生长期,且在指数培养阶段各组细胞生长基本一致。初始葡萄糖浓度越高,该组进入固定阶段的速度越慢,而生物量产量也越高。初始浓度为30g/L和40g/L时,干生物量重分别在32h和48h达到峰值,生物量产量下降。当初始葡萄糖浓度为50g/L时,48h生物量最大,培养基中仍有足够的葡萄糖可供生长,因此剩余的培养时间生物量仍略有积累。在培养初期,虽然葡萄糖初始浓度较低时细菌生长较快,但当葡萄糖初始浓度为40g/L时,可以获得较高的生物量(2.85g/L)。
从图3可以看出,各组葡萄糖消耗的趋势基本相同,从初始值逐渐下降到3g/L左右。葡萄糖在培养的前24小时被迅速吸收,在培养的后24小时被缓慢吸收。初始葡萄糖浓度为30g/L和40g/L时,葡萄糖在32h内几乎耗尽,剩余葡萄糖浓度在2g/L以下。当葡萄糖初始浓度为50g/L时,32h时培养基中剩余葡萄糖比另一组多出约10g/L,且消耗缓慢,培养结束时才消耗完。
从图4可以看出,六种氮源对生物量和生物絮凝菌产量的影响。酵母提取物和谷氨酸都有利于细胞生长和生物絮凝菌的生产。前者微生物絮凝菌产量最高,为0.98g/L,后者生物量最大,为2.6g/L,也远远高于以typtone、NH4NO3、NH4Cl或尿素为氮源的组。
根据图5的结果,接下来的实验考虑酵母提取物和谷氨酸的联合氮源。为说明这一点,我们以酵母菌提取物与谷氨酸的不同重量比为4:1~6:1作为组合氮源。图5显示酵母提物/谷氨酸比值为5:1(w/w)时,菌体生物量和生物絮凝菌含量最高,分别为3.05g/L和1.06g/L。高于对照组。对照组为最小培养基培养。此外,与单氮源培养相比,生物量和生物絮凝菌产量更高。因此,我们以组合氮源培养基作为后续研究的最佳培养基。
不同初始pH条件下pH、生物量和絮凝剂产量的变化曲线如图6所示。各组在最佳培养基中培养32h,在28℃、150rpm的旋转振动筛上。由图6a可知,最终pH值基本稳定在4±0.5左右。从图6b可以看出,初始pH8时生物量(3.54g/L)和生物絮凝菌(1.15g/L)最高。对于C.marina,pH在4-10范围内可以产生生物絮凝菌,而弱碱性培养基更有利于生物絮凝菌的产生。
共培养方式实验
将将絮凝菌与栅藻在生长对数期后期共培养,在培养物于振荡器上混匀 5 s, 分别静置 5、10、15、20min,取上清液测 OD
其中,实验组1为对数期微藻在摇床中培养24h后取样;实验组2为对数期微藻在光照培养箱中培养24h后取样;实验组3为对数期微藻与对数期絮凝菌于摇床共培养24h后取样;实验组4为对数期微藻与对数期絮凝菌于光照相培养24h后取样;实验组5为空白样。
经过共培养方式验证,得出以下结论:1、藻中接入菌后置于摇床同菌生长环境共培养,收获后藻的自絮凝速度加快,明显聚沉;2、藻中接入菌后置于光照培养箱同藻类生长环境共培养,自絮凝速度比空白对照稍好,证明置于摇床中,通气量好,菌才能正常生长,分泌絮凝活性成分;3、光学显微镜下看到共生体系明显聚集;4、二者共生未影响生物量,且在摇床培养条件下,絮凝菌生物量有所提高。
对于本领域技术人员而言,显然本发明不限于上述示范性实施例的细节,而且在不背离本发明的精神或基本特征的情况下,能够以其他的具体形式实现本发明。因此,无论从哪一点来看,均应将实施例看作是示范性的,而且是非限制性的,本发明的范围由所附权利要求而不是上述说明限定,因此旨在将落在权利要求的等同要件的含义和范围内的所有变化囊括在本发明内。
此外,应当理解,虽然本说明书按照实施方式加以描述,但并非每个实施方式仅包含一个独立的技术方案,说明书的这种叙述方式仅仅是为清楚起见,本领域技术人员应当将说明书作为一个整体,各实施例中的技术方案也可以经适当组合,形成本领域技术人员可以理解的其他实施方式。需注意的是,本发明中所未详细描述的技术特征,均可以通过本领域任一现有技术实现。
- 一种菌-藻共生絮凝体系的制备方法
- 一种微藻和甲烷氧化菌共生强化沼气制取生物油脂的膜生物反应器和菌藻共生体系
