PPARγ激活剂在提高水生动物抵抗环境应激能力中的应用
文献发布时间:2023-06-19 11:42:32
技术领域
本发明涉及水产养殖领域,尤其涉及PPARγ激活剂在缓解水生动物脂毒性、提高水生动物抵抗环境应激能力中的应用。
背景技术
环境应激是指在环境中能引起动物机体呈现“紧张状态”的环境刺激,常见的环境应激有低温,高温,水质恶化等。鱼类对环境应激的反应是一种非特异性的生理反应。环境应激本身并不是一种病,但它是一种或多种疾病的诱因。在鱼类等水生动物的养殖过程中通常会遭受不同的环境应激,过强或过长的环境应激会对水生动物造成严重危害,甚至导致死亡,这会给养殖者带来严重的损失。因此提高鱼类等水生动物对环境应激的抵抗能力具有很强的实用价值。
为增强水生动物抵抗环境应激的能力,提高养殖产量,通常采用将河水进行人工处理后再加入养殖池塘,定期进行水体消毒,在饲料中添加维生素C等方式。
进一步的,过氧化物酶体增殖物激活受体γ(PPARγ)是脂肪生成的关键转录调控因子,能够直接调控脂肪细胞分化和脂类代谢相关基因的表达。
但目前尚未有研究结果将PPARγ与鱼类等水生动物对环境应激的抵抗能力进行联系,两者之间是否存在相互作用关系不得而知。
发明内容
针对上述技术问题,本发明提供了PPARγ激活剂在提高水生动物抵抗环境应激能力中的应用,其通过给予水生动物(如鱼类)PPARγ激活剂来促进脂肪合成、降低肝脏游离脂肪酸水平,以此改善缓解脂毒性,以及提高水生动物(如鱼类)在应激条件下的抵抗力。
为了实现上述目的,本发明采用了如下技术方案:
一方面,提供了一种PPARγ激活剂在制备提高水生动物抵抗环境应激能力的组合物中的用途,且所述组合物中包括PPARγ激活剂。
优选的,每kg组合物中包含10-30mg PPARγ激活剂。
优选的,所述组合物为药物组合物或水产饲料或水产饲料添加剂或水生动物保健品。
优选的,所述组合物还含有药学或饲料学或动物保健品学上可接受的载体或赋形剂。
优选的,所述载体或赋形剂为油脂性基质或水溶性基质。
优选的,所述PPARγ激活剂包括罗格列酮、环格列酮、苯扎贝特、氯贝丁酯中的一种或几种。
优选的,所述水生动物包括鱼类,更优选的,所述鱼类为观赏鱼类,如斑马鱼(俗称“花条鱼”)、孔雀花鳉(俗称:孔雀鱼)、红鲫鱼、神仙鱼等;
优选的,所述提高水生动物抵抗环境应激能力包括促进脂肪细胞的分化、降低游离脂肪酸水平、降低氧化应激、提高对冷应激的抵抗力、提高对热应激的抵抗力及提高对氨氮应激的抵抗力中的一种或几种。
一方面,提供了一种可被给予至水生动物的组合物,且所述组合物中包括PPARγ激活剂。
优选的,每kg组合物中包含10-30mg PPARγ激活剂。
还提供了一种提高水生动物抵抗环境应激能力的斑马鱼(Danio rerio)模型的构建方法,其包括如下步骤:
S1、敲除斑马鱼的过氧化物酶体增殖物激活受体γ(PPARγ)基因,以获得突变型斑马鱼;
S2、取野生型斑马鱼和突变型斑马鱼进行养殖,然后取野生型和突变型斑马鱼组织样本进行检测以及检测野生型斑马鱼、突变型斑马鱼在应激反应下的抵抗力;
S3、取野生型斑马鱼,分成2组,分别作为野生型对照组、野生型实验组,以及取突变型斑马鱼,作为突变型实验组,且野生型实验组以及突变型实验组中均投喂包含PPARγ激活剂的组合物;
以及S4、取野生型对照组、野生型实验组、突变型实验组斑马鱼组织样本进行检测以及检测各组斑马鱼在应激反应下的抵抗力。
优选的,组织样本检测指标包括:肝脏甘油三酯、肝脏游离脂肪酸等中的一种或几种,应激反应下的抵抗力检测指标包括:冷应激下的存活率、热应激下的存活率和氨氮应激下的存活率中的一种或几种。
本发明至少具备以下有益效果:
本发明通过给予水生动物(如鱼类)PPARγ激活剂来促进脂肪合成、降低肝脏游离脂肪酸水平,以此改善缓解脂毒性,以及提高水生动物(如鱼类)在应激条件下的抵抗力。
附图说明
为了更清楚地说明本发明实施例技术方案,下面将对实施例描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
图1为PPARγ激活剂(罗格列酮)安全性评估实验的结果;
图2为实施例1中分别在组合物中按照10mg/kg、20mg/kg以及30mg/kg添加罗格列酮后,斑马鱼肝脏中的甘油三酯含量、游离脂肪酸水平以及在冷应激、热应激、氨氮应激下的存活率;
图3为实施例1中基于CRISPR/Cas9技术敲除斑马鱼PPARγ基因的原理图;
图4为实施例2中野生型斑马鱼以及突变型斑马鱼肝脏中的甘油三酯含量、游离脂肪酸水平以及在冷应激、热应激、氨氮应激下的存活率;
图5为实施例2中野生型对照组斑马鱼、野生型实验组斑马鱼以及突变型实验组斑马鱼肝脏中的甘油三酯含量、游离脂肪酸水平以及在冷应激、热应激、氨氮应激下的存活率。
具体实施方式
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合附图及实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
实施例1:
本实施例提供了一种PPARγ激活剂在制备提高水生动物抵抗环境应激能力的组合物中的用途,其中,所述组合物中包括PPARγ激活剂,以及药学或组合物学或动物保健品学上可接受的载体或赋形剂,且每kg组合物中包含10-30mg PPARγ激活剂。
以及提供一种可被给予至水生动物的组合物,且每kg组合物中包含10-30mg PPARγ激活剂。
其中,所述PPARγ激活剂包括罗格列酮、环格列酮、苯扎贝特、氯贝丁酯中的一种或几种,同时,所述水生动物包括鱼类,更优选的,所述鱼类为观赏鱼类。
同时,所述组合物的形式可以是药物组合物(包括疫苗)或水产组合物或水产组合物添加剂或水生动物保健品,且所述载体或赋形剂为油脂性基质或水溶性基质。
术语“药学或组合物学或动物保健品学上可接受的载体或赋形剂”指用于治疗剂给药的载体,包括各种稀释剂,其本身并不是必要的活性成分,且施用后没有过分的毒性。合适的载体是本领域普通技术人员所熟知的。
PPARγ激活剂(罗格列酮)安全性评估实验:
按照表1所示配方制作对照组组合物。
表1对照组组合物配方
制作实验组组合物时,首先将罗格列酮溶解到二甲基亚砜(DMSO)中,且DMSO与上述配方中大豆油的重量比为1:9,因此可根据上述配方中所需大豆油的添加量计算出所需DMSO的量。将已溶解罗格列酮的DMSO与大豆油混匀,将其与上述配方中其他成分混匀、压条,通风晒干后粉碎、过筛,然后装袋,冷藏,由此获取PPARγ激活剂添加剂量为20mg/kg的实验组组合物。
安全性评估实验共设对照组、实验组两个处理组,且每个处理组设置3个平行,准备6个体积均为约30L的透明玻璃缸,向每个玻璃缸中随机放入36尾斑马鱼。
开始实验前,记录每缸斑马鱼的初始总体重,然后对照组中投喂对照组组合物,实验组中投喂实验组组合物(即图1中“20mg/kg”组),每日均按体重的4-6%投喂,每日早晚喂两次(9:00和17:00)。每周称重一次,根据体重重新计算每日投喂量,各组均养殖四周。
养殖实验期间,每隔两天吸走缸底的粪便并换掉一半的水,且用曝气除氯后的自来水进行换水,且保持水温26±5℃,pH 7.8,溶解氧高于6.5mg/L,维持14h光照和10h黑夜的光周期。实验组和对照组各取3尾斑马鱼(共6尾),分别放在6个同样大小、规格的小鱼缸内(一个小缸内1尾),然后将6个小鱼缸一并置于行为仪中,同时记录每尾斑马鱼的运动轨迹。
养殖结束后,分别从对照组、实验组的3个平行缸中各随机取3尾斑马鱼,每个处理组共取9尾斑马鱼。将斑马鱼置于20mg/L MS-222的水溶液中麻醉,采集肝脏,2-3尾斑马鱼的肝脏混一管,每个处理组4个平行,-80℃下保存。通过南京建成试剂盒对各处理组斑马鱼凋亡和炎症相关基因的表达水平进行检测,所述凋亡和炎症相关基因包括:caspase3a(半胱天冬氨酸蛋白酶-3a)、bcl2(B细胞淋巴瘤/白血病-2)、il1b(人白细胞介素1β)、nf-κb(核因子κb)。
从图1中可以看出,与对照组相比,添加20mg/kg罗格列酮的实验组组合物并未影响斑马鱼2周和4周的均重,且对4种凋亡和炎症相关基因的表达水平均未造成显著影响,同时,从斑马鱼的运动轨迹中可以看出,对照组、实验组的斑马鱼在5分钟运动总距离上并未产生明显差距,由此说明在其他组分中添加20mg/kg罗格列酮不会影响斑马鱼的生长和运动,可充分说明给予斑马鱼罗格列酮等PPARγ激活剂是安全的。
下面结合实例说明添加PPARγ激活剂(罗格列酮)对斑马鱼(Danio rerio)抵抗环境应激能力的影响。
1)制作对照组和实验组组合物
按照上述表1所示配方制作对照组组合物。
同时参照上述安全性评估实验部分的内容分别获取PPARγ激活剂添加剂量分别为10mg/kg(实验组组合物1)、20mg/kg(实验组组合物2)以及30mg/kg(实验组组合物3)的组合物。
2)开始养殖实验,养殖结束后采集斑马鱼的肝脏
养殖实验共有对照组、实验组1、实验组2、实验组3四个处理组,且每个处理组设置3个平行,准备12个体积均为约30L的透明玻璃缸,向每个玻璃缸中随机放入36尾斑马鱼。
开始养殖前,记录每缸斑马鱼的初始总体重,然后对照组中投喂对照组组合物,实验组1、实验组2、实验组3中对应投喂实验组组合物1、实验组组合物2、实验组组合物3,每日均按体重的4-6%投喂,每日早晚喂两次(9:00和17:00)。每两周称重一次,根据体重重新计算每日投喂量,各组均养殖四周。
养殖期间,每隔两天吸走缸底的粪便并换掉一半的水,且用曝气除氯后的自来水进行换水,且保持水温26±5℃,pH 7.8,溶解氧高于6.5mg/L,维持14h光照和10h黑夜的光周期。
养殖结束后,分别从对照组、实验组1、实验组2、实验组3的3个平行缸中各随机取3尾斑马鱼,每个处理组共取9尾斑马鱼。将斑马鱼置于20mg/L MS-222的水溶液中麻醉,采集肝脏,2-3尾斑马鱼的肝脏混一管,每个处理组4个平行,-80℃下保存。通过南京建成试剂盒对各处理组斑马鱼肝脏中甘油三酯的含量以及游离脂肪酸的浓度进行测定。
3)分别进行冷应激、热应激和氨氮应激
冷应激处理前,向生化培养箱中放入12个玻璃缸,每3个玻璃缸作为一个处理组,共4个处理组,并做好标记,且每个玻璃缸均调为15℃的制冷模式,再分别从上述每个处理组的每个玻璃缸中各取10尾斑马鱼,分别放入对应的、已做好标记的小缸中。
开始实验,每隔12h统计一次死鱼数,计算存活率,并降低1℃,直至任一处理组的3个平行缸中有两个或两个以上缸的斑马鱼全部死光,或实验进行到72小时的存活率已经出现显著性差异。整个实验过程停止投饵。
热应激处理前,将水浴锅调至27℃,并放入12个小隔离缸(四周打满小孔以便水流动的塑料鱼缸),每3个小隔离缸作为一个处理组,共4个处理组,并做好标记。再分别从上述每个处理组的每个玻璃缸中各取10尾斑马鱼,分别放入对应的、已做好标记的小隔离缸中。
开始实验,每隔半小时升高1℃,直至升温到38℃,之后保持38℃的水温,每隔12h统计一次死鱼数,计算存活率,直至任一处理组的3个平行缸中有两个或两个以上缸的斑马鱼全部死光,或实验进行到72小时的存活率已经出现显著性差异。整个实验过程停止投饵。
氨氮应激是以氯化铵(分析纯)为氨氮来源,本实验中确定的氮浓度为85mg/L,即向有2L除氯后的自来水的玻璃缸中添加约648.85mg的氯化铵,照此准备12个玻璃缸,每3个玻璃缸作为一个处理组,共4个处理组,且每个玻璃缸中均盛有2L除氯后的自来水,且自来水中均添加约648.85mg的氯化铵,并做好标记。
开始实验时,分别从上述每个处理组的每个玻璃缸中各取10尾斑马鱼,分别对应放入氮浓度均为85mg/L的、上述做好标记的12个玻璃缸中。
每隔12h统计一次死鱼数,计算存活率,直至任一处理组的3个平行缸中有两个或两个以上缸的斑马鱼全部死光,或实验进行到72小时的存活率已经出现显著性差异。实验期间,每24小时更换1次实验溶液,换液量为总体积的50%。整个实验过程停止投饵。
4)结果计算分析
肝脏甘油三酯的含量以及游离脂肪酸的浓度根据南京建成试剂盒说明书所给出的公式来计算,计算完成后输入GraphPad软件作图,用SPSS软件分析有无显著性差异,显著性差异设为P<0.05*,极显著性差异设为P<0.01**。
存活率数据计算完后,同样将数据输入GraphPad软件作图,用SPSS软件分析有无显著性差异。
各时间点存活率=当前时间点活鱼数/最初总鱼数。
从图2(A)中可以看出,与对照组相比,在组合物中添加10mg/kg和20mg/kg的罗格列酮可显著提高斑马鱼肝脏甘油三酯的含量,且添加20mg/kg罗格列酮的效果更明显。
从图2(B)中可以看出,与对照组相比,组合物中添加罗格列酮均有助于降低斑马鱼肝脏游离脂肪酸水平,且添加20mg/kg罗格列酮时差异显著。
从图2(C)中可以看出,与对照组相比,在组合物中添加10mg/kg和20mg/kg的罗格列酮可显著提高斑马鱼在冷应激下处理36小时和48小时的存活率,其中添加20mg/kg罗格列酮的作用更明显。
从图2(D)中可以看出,在组合物中添加20mg/kg罗格列酮可显著提高斑马鱼在热应激下60小时的存活率;另外,热应激72小时下,添加10mg/kg和20mg/kg罗格列酮均可提高斑马鱼的存活率。
从图2(E)中可以看出,添加20mg/kg罗格列酮可显著提高斑马鱼在氨氮应激下60小时和72小时的存活率。
由此可充分说明组合物中添加罗格列酮等PPAR-γ激活剂可缓解脂毒性,提高斑马鱼对冷应激、热应激及氨氮应激的抵抗力,其机理如下:
PPAR-γ是一种配体依赖性的转录因子,PPAR-γ激活剂,如罗格列酮等可与PPARγ的配体结合域以及类固醇受体共激活因子-1(SRC-1)相结合形成三元复合物,由此激活PPARγ。PPARγ激活后可诱导许多与脂质合成相关基因的表达,并促进CCAAT增强子结合蛋白α(C/EBPα)的表达,同时,PPARγ还可以诱导与甘油三酯摄取和储存相关基因的表达,从而促进脂肪细胞的分化。另外,PPARγ能增强脂蛋白脂肪酶和游离脂肪酸转运体的表达,如脂肪酸转运蛋白和脂肪酸转位酶的表达,从而促进循环脂蛋白释放的游离脂肪酸的摄取,以及激活抗氧化反应元件和抗氧化相关的基因表达,维持细胞的氧化还原稳态。
已报道,游离脂肪酸,尤其是饱和游离脂肪酸水平的升高可能在脂毒性机制中起关键作用。如果过剩的游离脂肪酸不能合成甘油三酯,会使得细胞中游离脂肪酸的水平增加,这会导致脂毒性和氧化应激,影响机体的代谢平衡。
PPARγ被罗格列酮等激活剂激活后,一方面可促进前脂肪细胞分化和游离脂肪酸的摄取,最终以甘油三酯的形式存储游离脂肪酸,另一方面,可降低氧化应激,从而缓解机体脂毒性。已知脂毒性会产生氧化应激,而环境应激导致细胞或动物的死亡与氧化应激有关,降低氧化应激可提高细胞或动物在应激下的抵抗力。
实施例2:
本实施例提供了一种提高水生动物抵抗环境应激能力的斑马鱼(Danio rerio)模型的构建方法,其包括如下步骤:
S1、敲除斑马鱼的过氧化物酶体增殖物激活受体γ(PPARγ)基因,以获得突变型斑马鱼,本实施例中,主要是基于CRISPR/Cas9技术敲除斑马鱼PPARγ基因,其具体包括如下步骤:
通过使用在线工具ZiFiT Targeter Version 4.2设计CRISPR/Cas9靶点,靶点序列为GGGCTTCGGCCTGAGCGCTC,在靶点前后各加上一段序列:TAATACGACTCACTATAGGGGCTTCGGCCTGAGCGCTCGTTTTAGAGCTAGAAATAGC,以构建CRISPR/Cas9靶点序列,再将上述CRISPR/Cas9靶点序列连接接入sgRNA(single guide RNA)质粒;
以sgRNA质粒为模板、sgRNA-R为下游引物进行PCR扩增,PCR扩增体系如下:模板1μl、10×Buffer 5μl、F1 primer(上游引物,通过常规引物设计软件获得)2μl、R1 primer(下游引物)2μl、dNTP 5μl、Taq酶0.5μl、ddH
PCR扩增程序如下:94℃5min、94℃30s、56℃30s、72℃15s(35个循环)、72℃5min、4℃1h;
通过PCR扩增获得gDNA(genomic DNA),割胶回收,进行gDNA纯化;
用Thermo T7高产率转录试剂盒进行转录,转录体系为:NTP 8μl(每种各加2ul)、5×Buffer 4μl、gDNA模板5.5μl、T7 Enzyme 2μl、RNase inhibitor 0.5μl,合计20μl,以获得gRNA;
转录程序为:a.37℃水浴放置6h;b.每管加入1.5μl DNase,混匀,37℃水浴15min;
转录结束后,每个EP管加入30μl无酶水和31μl的8M氯化锂,混匀,-20℃沉淀过夜,沉淀gRNA,用75%乙醇洗涤后晾干;
用无酶水溶解gRNA,将gRNA与Cas9蛋白混合(现用现配),进行斑马鱼胚胎注射,注射体系为:gRNA 0.2μl、Cas9蛋白0.5μl、Cas9 Buffer 0.3μl,合计1μl,gRNA终浓度为400ng/μl;
胚胎注射时,注射压调到20-40;鱼卵摆好,加针1.5μl;注射体积(小泡)为卵1/10大小;注射尽量靠近动物脊;
根据靶点在NCBI上设计引物,PPARγ(转录本号:NM_131467)的引物序列为F:CAACTGCAGATACATGCCGC,R:TGGTAGCTGTGGAAGAAGCG;通过PCR扩增后SDS跑胶或送公司测序,筛选出有突变的F0代斑马鱼;
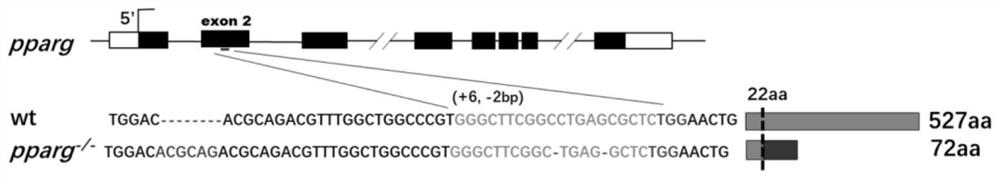
将携带突变的F0代斑马鱼与野生型斑马鱼交配产生F1代,F1代筛选出同种类型的突变,再让其雌雄交配,即可获得F2代斑马鱼,再从F2代斑马鱼中筛选出纯合子,纯合子在目标位点上添加6个碱基对并缺失2个不相邻的碱基对,另外,斑马鱼的PPARγ可编码527个氨基酸的蛋白质;然而,带有过早终止密码子的基因敲除品系的翻译产物只含有72个氨基酸残基,PPARγ基因敲除靶点如图3所示,最后,让F2代纯合子斑马鱼雌雄交配获得大量F3代斑马鱼,即获得PPARγ基因敲除后的突变型斑马鱼,也即F3代斑马鱼;
S2、取野生型斑马鱼和突变型斑马鱼,在同等条件下养殖相同时间,然后分别取野生型斑马鱼和突变型斑马鱼组织样本进行检测以及检测野生型斑马鱼、突变型斑马鱼在应激反应下的抵抗力;优选的,组织样本检测指标包括:肝脏甘油三酯、肝脏游离脂肪酸等中的一种或几种,应激反应下的抵抗力检测包括:冷应激下的存活率、热应激下的存活率和氨氮应激下的存活率中的一种或几种;所述指标检测和应激反应下的抵抗力检测方式与实施例1相同,在此不再赘述;
如图4所示,与野生型斑马鱼相比,突变型斑马鱼的肝脏甘油三酯水平显著降低,肝脏游离脂肪酸水平显著升高,从而造成肝脏脂毒性,同时,与野生型斑马鱼相比,突变型斑马鱼对冷应激、热应激以及氨氮应激的抵抗力都显著下降,由此,本发明首次发现鱼类对环境应激的抵抗力与其脂肪代谢失衡导致的脂毒性显著相关;
S3、设置三个处理组:野生型对照组、野生型实验组以及突变型实验组,且每个处理组设置N个(如3个)平行,准备3*N个相同规格的养殖容器,向野生型对照组的每个养殖容器中随机放入M尾(如30尾)斑马鱼、向野生型实验组的每个养殖容器中随机放入M尾斑马鱼以及向突变型实验组的每个养殖容器中随机放入M尾斑马鱼,N和M均为正整数,可根据实验需要设置;
记录每尾斑马鱼的初始总体重,然后野生型对照组中投喂对照组组合物(如通过表1配方制作的组合物),野生型实验组以及突变型实验组中均投喂添加有PPARγ激活剂的实验组组合物,其中,实验组组合物中,PPARγ激活剂的添加剂量为10-30mg/kg,本实施例中,所述实验组组合物为上述实验组组合物1、实验组组合物2、实验组组合物3中的一种或多种,优选的,野生型实验组、突变型实验组中投喂的实验组组合物中PPARγ激活剂的添加剂量相同,且均为20mg/kg;
各处理组每日均按体重的4-6%投喂,每日早晚喂两次(9:00和17:00),且每两周称重一次,根据体重重新计算每日投喂量,各处理组均养殖四周;
以及S4、取野生型对照组、野生型实验组、突变型实验组斑马鱼组织样本进行检测以及检测各组斑马鱼在应激反应下的抵抗力,组织样本检测指标和应激反应下抵抗力的检测指标与S2相同,在此不再赘述,检测结果如图4所示。
从图5(A)-(B)中可看出,与野生型对照组相比,野生型实验组的肝脏甘油三酯含量显著升高、肝脏游离脂肪酸水平极显著降低,而突变型实验组的肝脏甘油三酯含量极显著降低、肝脏游离脂肪酸水平显著升高,其原因在于突变型实验组的斑马鱼中缺少PPARγ基因,即使添加PPARγ激活剂也无法缓解脂毒性,而就野生型对照组、野生型实验组而言,其结果与图4中相反,即在组合物中添加PPARγ激活剂可以增加肝脏甘油三酯,同时降低肝脏游离脂肪酸水平,其恰好可以证明添加PPARγ激活剂可以有效缓解脂毒性。
进一步的,从图5(C)中可以看出,在冷应激60小时下,与野生型对照组相比,野生型实验组的存活率显著上升,而突变型实验组的存活率显著下降,另外,在冷应激24、36和48小时下,野生型实验组的存活率较野生型对照组有上升趋势,而突变型实验组的存活率较野生型对照组有下降趋势;从图5(D)中可以看出,与野生型对照组相比,野生型实验组在热应激60小时下的存活率显著上升,在热应激36和48小时下的存活率有上升趋势,而与野生型对照组相比,突变型实验组在热应激48和60小时下的存活率显著降低,在热应激12、24和36小时下的存活率有下降趋势;从图4(E)中可以看出,与野生型对照组相比,野生型实验组在氨氮应激60小时下的存活率极显著上升,在氨氮应激24、36和48小时下的存活率有上升趋势;而与野生型对照组相比,突变型实验组在氨氮应激48和60小时下的存活率显著降低,在氨氮应激24和36小时下的存活率有下降趋势。其结果趋势与甘油三酯、肝脏游离脂肪酸类似,即,由于突变型实验组的斑马鱼中缺少PPARγ基因,即使添加PPARγ激活剂也无法提高斑马鱼在应激条件下的存活率,而野生型实验组可通过添加PPARγ激活剂增加应激条件下的抵抗力。
由此,从图5结果可以看出,PPARγ基因与鱼类对环境应激的抵抗力以及与脂肪代谢失衡导致的脂毒性密切相关,通过在组合物中添加PPARγ激活剂可显著改善缓解脂毒性以及提高鱼类在应激条件下的抵抗力,提高水生动物抵抗环境应激能力的斑马鱼模型造模成功。
综上所述,本发明首次发现PPARγ基因与水生动物,如鱼类对环境应激的抵抗力以及与脂肪代谢失衡导致的脂毒性密切相关,且通过在组合物中添加PPARγ激活剂来促进脂肪合成、降低肝脏游离脂肪酸水平,以此改善缓解脂毒性,以及提高水生动物(如鱼类)在应激条件下的抵抗力。
上述实施例1-2中的技术特征可进行任意组合,且组合而成的技术方案均属于本申请的保护范围。以上显示和描述了本发明的基本原理、主要特征和本发明的优点。本行业的技术人员应该了解,本发明不受上述实施例的限制,上述实施例和说明书中描述的只是本发明的原理,在不脱离本发明精神和范围的前提下本发明还会有各种变化和改进,这些变化和改进都落入要求保护的本发明的范围内。本发明要求的保护范围由所附的权利要求书及其等同物界定。
- PPARγ激活剂在提高水生动物抵抗环境应激能力中的应用
- 提高异育银鲫在高温高密度环境下的应激能力的饲料及其应用
