一种用于检测MYO15A基因变异的试剂盒及其检测方法和应用
文献发布时间:2023-06-19 11:55:48
技术领域
本发明属于基因检测技术领域,具体涉及一种用于检测MYO15A基因c.8582T>C变异的试剂盒及其检测方法和应用。
背景技术
MYO15A基因是常见的耳聋致病基因之一,可导致常染色体隐性遗传非综合征型耳聋DFNB3(OMIM 600316)。DFNB3的发现是Friedman等于1995年在印度尼西亚发现一个常染色体隐性遗传非综合征型耳聋家族,通过连锁分析首次定位于常染色体17p11.2一段3厘摩的范围,命名为DFNB3基因座位。1998年,在3个无亲缘关系的DFNB3家系中证实MYO15A的纯合变异是导致这3个家系致病的原因,从此开始了MYO15A基因变异的研究。
MYO15A基因定位于17p11.2。全长共66个外显子,编码包含3530个氨基酸的肌球蛋白15;该蛋白结构分为头、颈、尾三个大区域,其中头部包含N末端结构域和负责ATP活性的运动结构域;颈部包含钙调蛋白轻链结合相关的IQ基序;尾部区域包含两个My TH4(肌球蛋白尾部同源物4)结构域,两个FERM结构域,一个SH3结构域,以及C端亚型Ⅰ和PDZ的结合基序。肌球蛋白15的功能是在细胞内约束细胞支架肌动蛋白纤维并为运动张力的形成提供能量,在毛细胞静纤毛的分化和延长过程中起着非常关键的作用,而该蛋白的功能异常可使毛细胞表面静纤毛之间机械传递机制的中断。由此可见,肌球蛋白15是维持正常听力所必需的,MYO15A基因变异导致的肌球蛋白15改变是引起人类DFNB3型耳聋的原因。
对于感音神经性耳聋患者MYO15A基因变异的筛查,国内外已经广泛开展,报道的致病变异位点近200个,包括错义突变、框移突变、无义突变及剪接位点突变,主要分布在编码区范围内。由于中东及南亚等国家地区在人口学存在近亲婚配及大家族更为普遍的特点,该地区MYO15A变异引起感音神经性耳聋的研究报道更为多见,并且相比于其他国家及地区,这些地区MYO15A基因变异在感音神经性耳聋中所占的比例也较高。在我国MYO15A基因变异携带人数也比较高。
国内外学者对MYO15A变异的基因型与听力表型相关性的认知是逐渐进展的过程。研究表明MYO15A变异的基因型与听力表型相关性似乎比之前预想的更为复杂。有文献报道了更多的非先天性双耳重极重度感音神经性耳聋的听力表型,表型特征更为多样化:除了低频区残余听力,还包括听力曲线为下降型的先天性中重度感音神经性聋、全频中重度感音神经性聋、进展性高频下降型重度感音神经性聋等、迟发性、进展性中重度感音神经性聋(发病年龄最迟达14岁)。明确基因型与表型的严重程度是非常重要的。
MYO15A基因的变异种类多样,每个位点变异后对蛋白的功能影响不同,明确新的变异位点致病性及导致表型的严重程度。这是遗传咨询的基础,是预防聋儿出生进行产前诊断的依据。目前尚未见关于MYO15A基因c.8582T>C(p.F2861S)变异的报道。
发明内容
本发明所要解决的技术问题在于针对上述现有技术的不足,提供一种用于检测MYO15A基因c.8582T>C变异的试剂盒及其检测方法和应用,该试剂盒可用于快速地检测MYO15A基因特定变异位点,通过检测来自患者的DNA样本中是否存在MYO15A基因c.8582T>C变异,可以判断该患者的感音神经性耳聋发生原因,进而为临床诊断提供依据。
为解决上述技术问题,本发明采用的技术方案是:一种用于检测MYO15A基因c.8582T>C变异的试剂盒,该试剂盒包括用于扩增DNA片段的PCR反应试剂,所述PCR反应试剂包括PCR引物,该PCR引物扩增的目标片段包含MYO15A基因编码区第8582位所对应的碱基。
优选地,所述试剂盒还包括用于从待测个体中提取PCR扩增所需的模板DNA的试剂。
优选地,所述试剂盒还包括用于对PCR扩增的目标片段进行测序的试剂。
优选地,所述PCR引物选自引物对P1,引物对P1包括
MYO15A-F-1和MYO15A-R-1,所述MYO15A-F-1具有序列表SEQ.ID.No.1的核苷酸序列;所述MYO15A-R-1具有序列表SEQ.ID.No.2的核苷酸序列。
优选地,所述PCR引物选自引物对P2,引物对P2包括MYO15A-F-2和MYO15A-R-2,所述MYO15A-F-2具有序列表SEQ.ID.No.3的核苷酸序列;所述MYO15A-R-2具有序列表SEQ.ID.No.4的核苷酸序列。
本发明还提供了一种用上述的检测MYO15A基因c.8582T>C变异的试剂盒检测MYO15A基因c.8582T>C变异的方法,包括以下步骤:
S1、采集待测个体的血液、体液或组织,然后提取DNA;
S2、以S1中提取得到的DNA为模板,以PCR引物进行PCR反应,得到PCR反应产物;从PCR反应产物中分离PCR反应扩增的目标片段,并对该目标片段所包含的对应于MYO15A基因编码区第8582的碱基进行分型鉴定。
优选地,所述分型鉴定采用对所述目标片段进行直接测序的方法,通过将测序结果与参考序列(MYO15A基因参考序列(NM_016239))进行比对,确定待测个体对应于MYO15A基因编码区第8582的基因型或等位基因类型。
优选地,根据比对确定的基因型或等位基因类型包括野生纯合型T/T、变异杂合型T/C或变异纯合型C/C。
本发明还提供了上述的用于检测MYO15A基因c.8582T>C变异的试剂盒的应用,所述试剂盒用于感音神经性耳聋病因学分析,使用该试剂盒并通过检测来自于待测样本(患者的MYO15A基因片段)中对应于人MYO15A基因参考序列编码区第8582位是否存在T>C变异,从而判断该患者感音神经性耳聋发生的遗传性原因。其中,MYO15A基因发生c.8582T>C变异为错义突变,导致MYO15A基因编码的第2861位的氨基酸由苯丙氨酸变成丝氨酸(p.F2861S),氨基酸疏水性发生改变,影响蛋白三级结构。
本发明与现有技术相比具有以下优点:
本发明所提出的试剂盒可用于快速地检测MYO15A基因特定变异位点,通过检测来自患者的DNA样本中是否存在MYO15A基因c.8582T>C变异,可以判断该患者的感音神经性耳聋发生原因,进而为临床诊断提供依据。
本发明所提出的试剂盒在用于感音神经性耳聋的诊断时:1)本发明将为在感音神经性耳聋患者中开展易感基因筛查提供方便确实的方法;2)通过产前诊断筛查,明确胎儿是否携带c.8582T>C纯合突变或者该位点与其他明确的隐性致病位点的复合杂合突变,降低聋儿的出生率,为社会和家庭减轻负担。
下面结合附图和实施例对本发明作进一步详细说明。
附图说明
图1是本发明的MYO15A基因编码区氨基酸的保守性分析:变异位于MYO15A基因编码区第8582的T碱基,用方框圈起来的是变异前氨基酸。
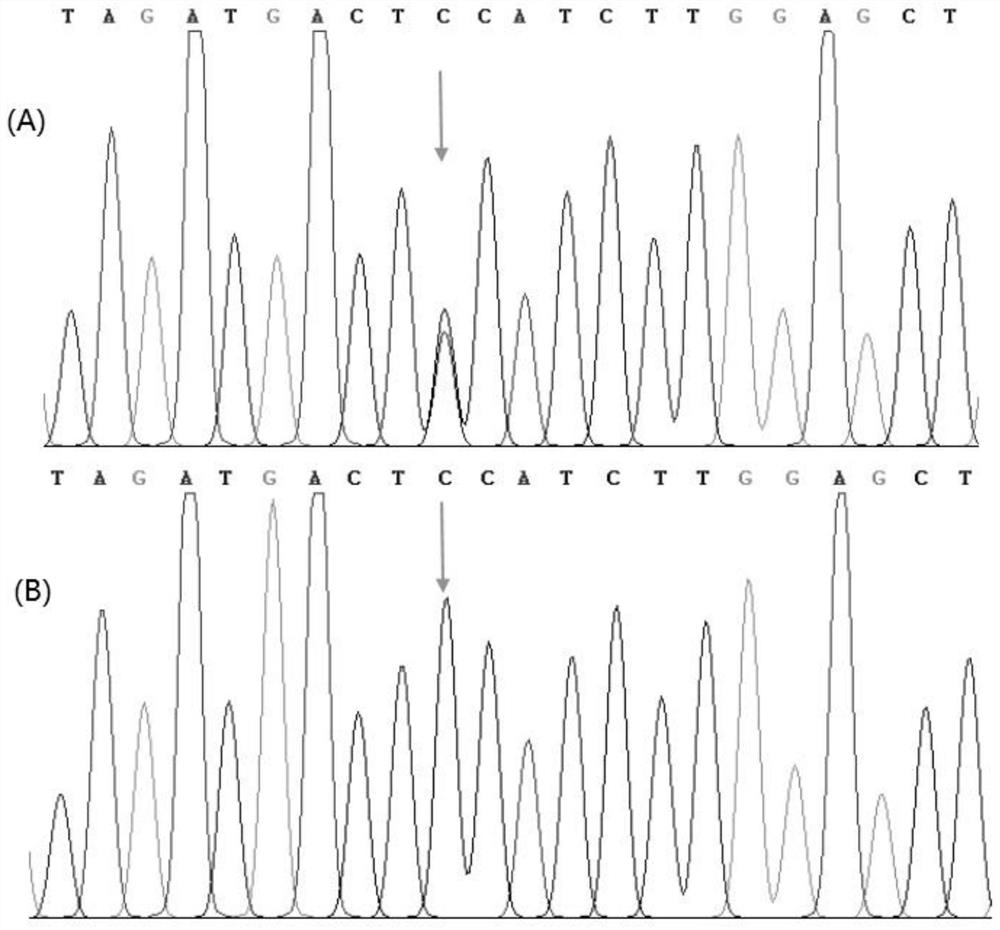
图2是本发明实施例1的待测个体MYO15A基因测序结果图(A图为变异杂合型序列,箭头所指为变异位点位置;B图为纯合型序列,箭头所指为变异位点位置)。
图3为本发明实施例1的扩增产物的电泳图谱。
具体实施方式
下面结合附图和实施例对本发明作详细说明,以下实施例用于解释本发明,而非对本发明保护范围的限制。
本发明应用候选基因筛查的方法对100例非综合征型感音神经性耳聋患者和100例听力正常且无家族史的对照进行筛查,在一个非综合征型感音神经性耳聋家系中发现MYO15A基因的c.8582T>C纯合变异。先证者与其妹妹的听力学检测结果是极重度听力损失,CT和MRI结果未显示异常,先证者的姐姐听力正常,先证者的父母亲听力正常。先证者与其妹妹的基因型是c.8582T>C纯合变异,父亲母亲均携带c.8582T>C杂合变异,MYO15A基因变异相关的感音神经性耳聋以常染色体隐性遗传的方式传递。在这一家患者中MYO15A基因变异与感音神经性耳聋表型共分离。MYO15A基因c.8582T>C为致病变异。目前MYO15A基因已经报道的与感音神经性耳聋相关的变异近200余种,尚无c.8582T>C变异的报道。
上述变异(c.8582T>C)使位于MYO15A基因编码区的第8582位碱基发生转换,导致编码的第2861位氨基酸由苯丙氨酸变成丝氨酸(野生型MYO15A基因的标准序列可以参考,例如NM_016239),疏水性发生改变。该序列各个物种之间是高度保守的(图1)。
检测上述变异(c.8582T>C)可采用多种检测点变异的方法来进行,例如PCR(聚合酶链反应)-测序法、采用标记的MYO15A基因DNA探针杂交法、用限制性片段长度多态性方法或序列特异性引物的方法等。其中,采用PCR扩增-直接测序法来检测样本,包括下述步骤:
S1、采集待测个体的血液、体液或组织,然后提取DNA;
S2、以S1中提取得到的DNA为模板,以针对MYO15A基因编码区第8582位碱基附近设计的PCR引物进行PCR反应,得到PCR扩增产物;
S3、将得到的PCR扩增产物进行测序分析,将测序所得到的序列与MYO15A基因参考序列(NM_016239)进行比较,确定待测个体MYO15A基因是否存在c.8582T>C变异;
S4、根据以上结果判断待测个体是否为MYO15A基因变异c.8582T>C导致的感音神经性耳聋基因携带者,生育前是否需要进行遗传咨询。
在上述步骤S2中使用的PCR引物可以依据已知的引物核苷酸序列设计:通常为15~30个碱基,GC含量为45~50%左右,在适当的温度下与末端特异性结合。引物可以利用现有的计算机程序设计。
上述步骤S2所得到的PCR扩增产物若使用杂交探针来检测,所用的杂交探针可以是与正常的MYO15A核苷酸序列杂交,或与变异的核苷酸序列杂交,或与它们的互补序列杂交的探针。这些探针可以用放射性同位素、发色物质或荧光物质标记,尤其是可利用等位基因特异探针。
根据检测方法的不同,用于检测MYO15A基因c.8582T>C变异的试剂盒中,除了包括PCR反应试剂,还包括检测PCR扩增产物的试剂,其具体选自测序检测试剂、限制性长度多态性检测试剂、序列特异性引物检测试剂、探针杂交检测试剂。
试剂盒容器内装有用以检测MYO15A基因c.8582T>C变异的试剂成分,与之同时提供的还有经政府药物管理机构审核的、有关药品或生物制品的制造、使用及销售信息。对于PCR反应试剂,例如,可含有扩增引物、dNTPs、用于PCR反应的DNA聚合酶及其缓冲液等。
实施例1
通过聋病门诊及资源收集网络收集各种感音神经性耳聋患者,建立资源库。在患者自愿的前提下,签署知情同意书后,留取血样,并建立门诊病历资料库,详细记录患者病情、家系中的发病情况以及联系方式。然后,应用蛋白酶降解法提取基因组DNA,定量后入库,-20℃保存,每份DNA样品均详细对应于登记的患者临床资料。然后,应用在线引物设计软件Primer5.0设计引物(扩增目标区域为MYO15A编码区区,参考序列NM_016239,扩增目标片段大小为692bp),以基因组DNA为模板,BIORAD My Cycle热循环仪上进行PCR扩增。PCR扩增产物直接测序:测序引物与PCR扩增引物相同,正反向测序,应用ABI公司3730DNA测序仪。测序得到的序列与Genbank中的序列(NM_016239)比较,确定是否存在MYO15A基因c.8582T>C变异。具体如下:
(一)待测血样提取与MYO15A基因编码区的PCR扩增
1、待测对象血样DNA的制备
1.1研究对象
对100例散发非综合征型感音神经性耳聋患者和100名无家族史的听力正常对照按照下述方法进行MYO15A基因的筛查。
散发非综合征型耳聋受试者采集自在西京医院(陕西省西安市)耳鼻咽喉头颈外科门诊做耳聋基因筛查的耳聋患者。听力正常对照是无耳聋家族史的听力正常受试者,对所有参加者详细调查其病史以及家族史,并对其进行体格检查,耳科检查包括耳镜检查、听力学评估。在签署知情同意书以后每人采集血样5~10mL,采集时间是2019年2月。
1.2基因组DNA提取
1.2.1实验前准备及重要注意事项
(1)向蛋白酶K中加入制定用量的Proteinase K Storage Buffer使其溶解,-20℃保存。配制好的Proteinase K(蛋白酶K)勿长时间室温存放,避免反复冻融,以免影响其活性。
(2)所有离心操作均在室温下完成。
(3)血样样品的储存:已加入抗凝剂的血液样品可在2~8℃储存最多10天,对于某些实验例如Southern杂交等,需要得到完整全长的基因组DNA,将血液样品在2~8℃储存不超过3天,此时基因组DNA的降解程度较轻。
1.2.2操作步骤
1)低速离心至血样分层,用移液枪去除上层血清,注意不要吸取或损坏中间层的黄膜层。
2)将全部血细胞转移至5mL离心管中,加入红细胞裂解液至总体积为4mL,上下颠倒混匀20次至沉淀充分分散。
3)6500g离心10min,弃去上清。
4)加入3mL Buffer FG1,涡漩振荡15s,使沉淀充分分散。
5)6500g离心10min,弃去上清,将离心管倒扣在干净的吸水纸上,吸干水分。
6)配制DNA提取液与蛋白酶K的混合液,混合比例为DNA提取液:蛋白酶K=100:1,混合后涡漩振荡15s充分混匀,按需配制,现配现用。
7)向样品中加入配制好的DNA提取液与蛋白酶K的混合液1mL,立即充分涡漩振荡1min,直至溶液无团块。
8)将样品置于65℃水浴锅中温育15min,其间颠倒混匀3次,至样品颜色从红色变成淡绿色,说明蛋白完全消化。
9)向样品中加入2mL异丙醇,颠倒混匀10次至可见白色絮状沉淀。
10)取干净无菌的1.5mL离心管,做好标记,加入500μL预冷的75%乙醇。
11)用干净无菌的1mL移液器tip头挑取步骤9)中的白色絮状沉淀转移至步骤10)中准备好的75%乙醇中,颠倒混匀10次,缓慢倒掉上清,注意不要倒掉白色絮状沉淀。
11)再次加入500μL预冷的75%乙醇,颠倒混匀10次,缓慢倒掉上清,吸干。
12)打开管盖,室温干燥15min,至所有液体完全挥发。
13)加入380μL DNA溶解液,置于37℃水浴/金属浴中温育2h,同时进行振荡使DNA充分溶解。
14)分光光度计定量及检测纯度。
15)-20℃保存DNA。
2、MYO15A基因编码区的PCR扩增
2.1引物序列
使用Primer5引物设计软件,参考序列基因NM_016239,序列合成后用于此检测,设计完成时间为2019年3月:
上游引物MYO15A-F-1:具有序列表SEQ.ID.No.1的核苷酸序列,
下游引物MYO15A-R-1:具有序列表SEQ.ID.No.2的核苷酸序列。
使用该引物进行PCR扩增所获得的片段大小为692bp。
2.2PCR反应体系的建立(表1)
表1.MYO15A基因的PCR反应体系
其中,PCR扩增使用天根公司PCR Mix。
反应条件:PCR反应在BIORAD My Cycle热循环仪上进行,反应过程为:94℃4min;94℃30s,61℃(每个循环逐次降0.5℃)30s,72℃40s,12个循环;94℃30s,55℃30s,72℃40s,30个循环;4℃恒温。
PCR产物电泳流程:
1)配胶(1%琼脂糖):称取0.4g琼脂糖,悬浮于40mL×TAE中(500ml锥形瓶)。
2)溶胶:微波炉中高火加热至沸,持续沸腾数分钟,注意不要沸出,其间取出混匀。
3)凉胶:待胶完全溶解,从微波炉中取出,凉至60℃左右,加入1滴EB(约10μL,10mg/mL),摇匀。
4)铺胶:平板两端用胶布封严,把250mL胶液全部倒入平板,插入梳尺。
5)上胶:将平板放入已盛有电泳液(0.5×TAE,液面距胶面1至2mm)的电泳槽中,拔下梳尺。
6)加样:用移液器按规定格式加样,最后加入
7)走胶:盖上电泳槽盖,检查正负级,开启电泳仪,调节电泳电压。
8)定量:当溴酚蓝走离加样孔1.5至2cm处,关闭电泳仪,小心取胶,放入摄相仪照相。经过电泳后,有8条带可见,
(二)MYO15A基因编码区PCR扩增产物的纯化和定量
PCR扩增产物的纯化(96孔板法):
1)PCR扩增产物电泳结束后,在长波365nm紫外透射仪下,用手术刀切下目的条带,切取的胶块质量应小于3g,将其放入对应的板孔号中。
2)4000rpm离心1min,加入500μL溶胶液,盖上封口膜,65℃水浴15min,定时。
3)检查每孔胶块是否完全溶解,若没有完全溶解再次65℃水浴3min,揭开封口膜,用连续加液器每孔加入10μL混匀的磁珠,盖上硅胶垫,漩涡震荡30s,转入水平震荡仪600~800rpm震荡5min。
4)将96孔板卡入磁力架中,磁吸30s,将磁力架和样品正反轻微颠倒3次,再次静置磁吸1min。
5)弃废液,吸水纸上轻磕,用50~1200μL 8道电动移液器向每孔移入500μL洗液,盖上硅胶垫漩涡震荡30s,将96孔板卡入磁力架中,磁吸30s,将磁力架和样品正反轻微颠倒3次,再次静置磁吸1min。
6)弃废液,吸水纸上轻磕,用50-1200μL 8道电动移液器向每孔移取500μL70%乙醇盖上硅胶垫漩涡震荡30s,将96孔板卡入磁力架中,磁吸30s,将磁力架和样品正反轻微颠倒3次,再次静置磁吸1min。
7)弃废液,吸水纸上轻磕,倒离心至600rpm水平震荡5min。
8)离心至1000rpm,将96孔板卡入磁力架中,磁吸1min。
9)2μL样品+6μL 1.4X溴酚蓝混合后点入0.8%的鉴定胶中,按照A01-H01的竖向顺序横向点入,中间空出2孔,分别加入1μL、2μL量的Marker,300V电泳11min。
10)将鉴定胶放入凝胶成像仪中采集图像,图像必须保证marker条带清晰。
11)对照纯化前后胶图,根据PCR定量标准在PCR记录表上标注每孔扩增产物纯化后所得测序模板的浓度并稀释至指定浓度,对回收后电泳无条带的样品按照4μL样品+5μL1.4X溴酚蓝再次电泳鉴定。
12)将稀释后上述模板离心2min,离心至4000rpm,标记Lims系统模板状态,确认提交前需要再次核对上述模板状态,确认无误后将上述模板4℃冰箱保存。
(三)纯化的MYO15A基因编码区PCR扩增产物的直接测序
1、PCR产物DNA模板的纯度与用量要求见表2。
DNA纯度:OD260/OD280=1.6~2.0。
DNA浓度:PCR产物10ng/μL。
表2.DNA用量
2、测序反应
1)测序反应所需试剂应为新鲜配制,需要经高压灭菌的试剂必须灭菌后方可使用。测序反应所需的器材(如96孔板、tip头等)同样应为洁净无菌的。
2)为了保证测序样本及反应试剂的新鲜,加样时应在冰上操作。
3)目前的反应体系为5μL,各种试剂加入量如表3所示。
表3.MYO15A基因PCR扩增产物的测序反应体系
其中,BDT为美国应用生物系统公司(ABI)生产的用于测序反应的荧光染料。5×GCbuffer是美国应用生物系统公司(ABI)生产的用于测序反应的缓冲液。
4)样品放于PCR仪(热循环仪)上,所作反应的过程见表4。
表4.MYO15A基因PCR扩增产物的测序反应过程
5)反应完的样品要及时从PCR仪(热循环仪)上取下,短时间内要进行纯化的样品放置于4℃冰箱中,超过一天以上才能纯化的样品放置于-20℃冰箱冷冻。
3、测序反应物的纯化和测序
1)向每孔中加入20μL 80%乙醇,4000rpm离心30min;将样品板放在折好的纸巾上,在离心机中倒甩,倒甩时速率不能超过1000rpm;
2)在每孔中加入30μL 70%乙醇,4000rpm离心10min,倒甩;
3)重复步骤2)再两次;
4)将样品板放于干净的抽屉中,避光干燥30min;
5)加入5μL甲酰胺,封膜,离心后置于-20℃冰箱中;
6)上机前95℃变性5min,放置冰上2min,离心后上ABI 3730测序仪。
测序结果如图2所示,图2中A图为变异杂合型序列,箭头所指为变异位点位置;图2中B图为纯合型序列,箭头所指为变异位点位置。
(四)检测耳聋相关基因MYO15A变异位点(c.8582T>C)试剂盒及其应用
1、试剂盒的组成
(1)扩增用引物:
上游引物MYO15A-F-1:具有序列表SEQ.ID.No.1的核苷酸序列;
下游引物MYO15A-R-1:具有序列表SEQ.ID.No.2的核苷酸序列;
(2)PCR扩增用2×PCR Mix
(4)dNTP 2.5mM
(5)Big-Dye mix(美国应用生物系统公司(ABI)生产)
2、使用方法
主要包括如下步骤:
1)PCR扩增
用软件Primer 5.0对MYO15A基因的编码区设计PCR引物(上游引物MYO15A-F-1、下游引物MYO15A-R-1),反应条件为:94℃4min;94℃30s,61℃(每个循环逐次降0.5℃)30s,72℃40s,12个循环;94℃30s,55℃30s,72℃40s,30个循环;4℃恒温。
2)PCR产物纯化
PCR产物电泳,凝胶纯化及电泳定量。
3)测序反应及验证
以PCR引物作为测序引物进行测序反应,在BIORAD My Cycle热循环仪上进行测序反应。反应结束后,延伸产物上样于ABI 3730DNA序列分析仪。将所得到的测序图谱进行分析,与正常序列(NM_016239)比较,以确定变异是否存在。
100例患者中,1例感音神经性耳聋患者的MYO15A基因检测发现为c.8582T>C纯合变异。对100名听力正常者的筛查中未发现c.8582T>C变异者。
实施例2
扩增引物(设计完成时间2019年3月)如下,其他同实例1(扩增目标区域为MYO15A基因包括c.8582位点在内,长度为714bp的片段,参考序列NM_016239):
上游引物MYO15A-F-2:具有序列表SEQ.ID.No.3的核苷酸序列,
下游引物MYO15A-R-2:具有序列表SEQ.ID.No.4的核苷酸序列。
其他试剂和反应条件同实施例1。
100例患者中,1例感音神经性耳聋患者的MYO15A基因检测发现为c.8582T>C纯合变异。对100名听力正常者的筛查中未发现c.8582T>C变异者。
以上所述,仅是本发明的较佳实施例,并非对本发明作任何限制。凡是根据发明技术实质对以上实施例所作的任何简单修改、变更以及等效变化,均仍属于本发明技术方案的保护范围内。
序列表
<110> 中国人民解放军空军军医大学
<120> 一种用于检测MYO15A基因变异的试剂盒及其检测方法和应用
<130> 2019.3.10
<160> 4
<170> SIPOSequenceListing 1.0
<210> 1
<211> 20
<212> DNA
<213> 人工合成(Artificial synthesis)
<400> 1
ttagggttct gtgggagctg 20
<210> 2
<211> 20
<212> DNA
<213> 人工合成(Artificial synthesis)
<400> 2
ttccccactc aatccctcac 20
<210> 3
<211> 20
<212> DNA
<213> 人工合成(Artificial synthesis)
<400> 3
aggaactgag ctgaagccac 20
<210> 4
<211> 20
<212> DNA
<213> 人工合成(Artificial synthesis)
<400> 4
ctgctgaagt cttcctcggg 20
- 一种用于检测MYO15A基因变异的试剂盒及其检测方法和应用
- 一种用于检测淋巴瘤基因变异的试剂盒及其应用
