含纯铁化合物
文献发布时间:2023-06-19 12:02:28
发明领域
本发明涉及一种生产含铁化合物(compound)、含铁前体或含铁水溶液的方法,以及其在含铁电极材料生产中的用途。
背景技术
铁是地壳中第四最常见的元素,通常以氧化物、硫化物或硅酸盐的形式存在。
金属铁由于其丰富的存在和相对容易地被还原成金属铁,一直以来都对人类的技术发展具有极其重要的意义,现在仍旧如此。
在现代先进技术中,铁是重要的元素,存在于例如各种电气设备、电池、燃料电池等中。铁可以作为电极如阳极或阴极的组成部分。一个具体的使用例子是在阴极中,例如锂离子电池的阴极材料,如磷酸铁锂阴极,也称为LFP阴极中。由于铁是一种相对廉价的材料,含铁的阴极材料将是发展锂离子电池的一个非常有前途的途径。由于其良好的性能,含铁锂的电池在市场上越来越多。然而,为了在这种应用中得到有效利用,铁必须以非常纯的状态存在,也就是说,杂质的量必须非常少。目前生产高纯度铁的方法,如电解沉淀(electrolytic precipitation)、各种气相提纯方法等,成本相对较高。制造方法可能包括许多复杂的步骤,这些步骤可能既耗时又高度影响旨在提供所需纯度的电池材料的生产的经济性。常规上,铁基阴极材料可由氯化铁或硫酸铁提供,这些材料可沉淀为磷酸铁。然而,在这个过程中形成的杂质需要被除去,但这样做的成本很高,而且需要许多洗涤步骤,以便最终获得足够纯的用于电池生产的材料。
因此,需要一种廉价的方法来生产高纯度的铁和含铁化合物,例如用于生产LFP-阴极的前体,从含有相对高含量的杂质的廉价铁材料开始。
本发明提供了一种方法,通过溶解和分离过程,使用容易获得的原材料,以合理的成本提供高纯度的铁基电池供应材料。
本发明从相对便宜的含有杂质的起始材料提供高纯度的含铁化合物和溶液,而用现有方法提供这些化合物和溶液是相对复杂和昂贵的。此外,本发明还提供了高纯度含铁前体(例如LFP),以及由所述前体制成的LFP阴极。阴极除了LFP之外还可以包含碳黑、粘合剂、不同的活性材料等。
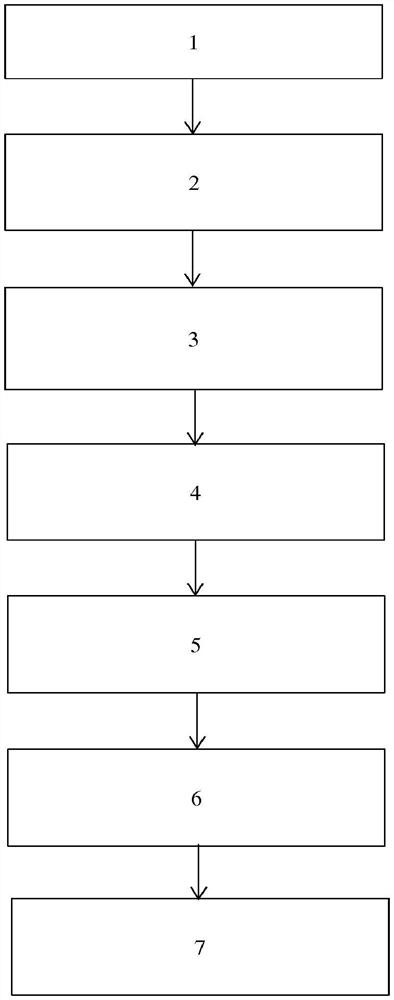
图1是根据本发明的制造方法的示意图。
将铁矿石还原成金属铁
用于制造直接还原铁的铁矿石通常要经过粉碎步骤和分离过程,例如磁选,以除去不需要的矿物。然而,粉碎和加工后的铁矿石仍然含有杂质。
本方法的进料包括直接还原铁,其通过还原气体或元素碳将铁矿石或其他固态含铁材料直接还原为铁而产生的。直接还原铁(Direct reduced iron,DRI)也被称为海绵铁(sponge iron)。铁矿石可以是块状、粒状或粉状的形式。铁矿石在高温下(例如,约800至1200℃),在例如氢气、富烃气体、一氧化碳或元素碳的存在下,在炉中加热。直接还原是指从铁矿石或其他固态含铁材料中除去氧,也就是说,是指在低于铁的熔点的高温下将铁矿石中存在的铁氧化物还原成金属铁。直接还原过程中形成的铁材料提供了一种类似海绵的、有孔的或空心的材料。铁的直接还原过程中涉及的化学反应如下。
与H
3Fe
Fe
FeO+H
与CO
3Fe
Fe
FeO+CO→Fe+CO
与反应中的固体碳
CO
需要注意的是,直接还原铁含有铁的氧化物作为杂质。此外,杂质可以例如选自氮化物、硫化物、碳化物。
本发明的一个目的是提供
一种生产含铁化合物、含铁前体或含铁水溶液的方法,包括以下步骤:
-提供直接还原铁;
-将直接还原铁溶解在有机和/或无机酸中,以提供含铁水溶液,其中直接还原铁的不溶性杂质在整个溶解过程中保持固体形式,以获得具有悬浮不溶性杂质的含铁水溶液;
-将所述不溶性杂质从含铁水溶液中分离出来,得到纯化含铁水溶液(purifiediron containing aqueous solution);和
-任选通过干燥来固化所述纯化含铁水溶液,以提供含铁化合物或含铁前体,例如以除去所述纯化含铁水溶液中存在的溶剂。
纯化含铁水溶液可以基本上不含不溶性杂质。
铁矿石
在不受任何理论约束的情况下,认为铁矿石的固态还原将把存在于氧化铁晶格中的强氧化物生成元素转移到还原铁内部或其颗粒表面的离散包裹体(discreteinclusion)中。因此,所谓的矿渣元素(gangue element)将形成(例如氧化物、硅酸盐、铝酸盐、硫化物、氮化物、碳化物等的)离散的颗粒,其在固态还原过程中使用的温度下无法还原成金属元素。
直接还原铁中的杂质可分为以下几类。
1-铁的氧化物和铁的碳化物。这些杂质通常来自于金属铁的制造过程。在本方法中,铁的氧化物通常是略微可溶性的,而铁的碳化物是不溶的。因此,在本方法中,氧化物可能被溶解,而碳化物则被发现有不溶性的杂质。
2-含有例如铁或其他金属如镍、钴、铜等的尖晶石(spinel)和/或钙钛矿(perovskite)。在本方法中,尖晶石和钙钛矿杂质是不溶性的。
3-含有比铁更强的氧化物形成剂(oxide former)的杂质。在本方法中,这些杂质是不溶性的。
4-含有比铁更具电负性的金属的杂质。在本方法中,这些杂质是可溶性的,在本溶解方法后在水相中可以发现。
直接还原铁可以以颗粒的形式提供,例如粉末,即粒度相当小的颗粒。
需要指出的是,直接还原铁优选已经被氢气、烃气体、碳或其任何组合还原。其化学反应已在此以前公开。优选不使用钙、镁或硅作为还原剂。如上所述,认为这里使用的直接还原铁的杂质不是溶解在整个铁基体中,而是作为团簇(cluster)存在于结构中。因此,当含铁材料溶解时,杂质团簇将作为固体保持在一起,并可从含铁溶液中分离出来。
存在于直接还原铁中的不溶性杂质在进行分离之前以颗粒状物质的形式存在于溶解的含铁水溶液中。需要注意的是,在任何分离之后,水溶液中也可能存在非常细小的颗粒状物质,因为就成本和设备的限制而言,在常规分离过程中,能够除去的颗粒有多小是有限制的。这种颗粒的例子是胶体颗粒。不溶性杂质可包括选自氧化物的化合物,如铁氧化物;碳化物,如铁的碳化物;氮化物;硫化物,如CuS、Bi
不溶性杂质优选由包含金属和/或半金属的化合物制成,其单独或与非金属结合,例如作为盐。本发明的含铁化合物、含铁前体或含铁水溶液中不溶性杂质的含量基于其中的金属和半金属的总含量,该金属和半金属来源于直接还原铁。
不溶性杂质可优选选自氧化物和/或碳化物。例如,这可以包括从上述制造过程中获得的铁氧化物和/或碳化物。
不溶性杂质可包括铝、砷、铋、钙、铬、铁、铅、镁、锰、钼、硒、铌、锑、硅、钽、钛、钨、钒、锌、锆、碳、氮、氧、磷、硫或其任何组合。如上所述,不溶性含铁化合物可选自含铁的碳化物;硫化物;铝酸盐,如其尖晶石;硅酸盐,不溶性氧化物,如其钙钛矿。
金属铁的溶解
在直接还原铁的溶解过程中,不溶性杂质的小的离散颗粒会从铁中释放出来。只要铁被转化为可溶性的铁离子物类,这些颗粒状的杂质就可以从含铁溶液中分离出来。
因此,用于生产直接还原铁源的铁矿石必须保持前述清单中第4组污染物的含量低,例如,过渡金属如Ni、Cu、Co的含量低,以及贵金属的含量低。这些金属比铁更具有电负性,在还原过程中不形成颗粒状物质,因此不容易通过分离除去。
含铁溶液中的可溶性铁离子物物类可以由亚铁或铁离子物物类及其络合物(complex)组成。这些络合物可能具有不同的结构,这取决于用于溶解过程的酸或所用其他添加剂。
用于溶解的有机酸可以选自化合物例如柠檬酸、甲酸、乙酸、丙酸、草酸、苯甲酸、乙醇酸、乳酸、苹果酸、酒石酸,以及它们的任何组合。优选地,柠檬酸、乙酸及其任何组合被用作用于溶解的有机酸。
用于溶解的无机酸可选自化合物例如盐酸、氯酸、高氯酸、硫酸、亚硫酸、硝酸、亚硝酸、磷酸,以及它们的任何组合。优选地,磷酸、硝酸以及它们的任何组合被用作用于溶解的无机酸。
溶解后的含铁溶液的pH值可以是最高4.5,例如最高4.2,最高4.0,或最高3.8。
直接还原铁可与有机和/或无机酸接触以进行溶解,时间约为30分钟-5小时,如1-4小时,1-3小时,或1-2小时。
溶解步骤中的温度可以是约25-100℃,如30-80℃,30-70℃,30-65℃,或40-55℃。
可以向溶解步骤提供氧,以促进金属铁氧化为可溶性的亚铁或铁离子。提供的氧可以是分子氧或臭氧。氧可以以空气、臭氧、氧气或其任何组合的形式提供给该过程,例如,通过用空气、臭氧和/或氧气冲洗。氧可以连续或间歇地提供,优选连续提供。氧有助于并改善溶解步骤。
可向所述溶解步骤添加氧化剂。这可以在向溶解提供空气、臭氧和/或氧气的基础上附加地进行。过氧化氢可以作为氧化剂添加到所述溶解步骤中。氧化剂如过氧化氢的添加可以以单次添加、间歇性添加或连续添加的方式进行。
方法优化
虽然溶解速率(dissolution rate)随着温度的升高而增加到一定程度,但不溶性的铁基物类可能形成并导致铁的表面钝化,从而导致溶解的终止。
令人惊讶的是,存在的溶解的气体被发现对溶解速率和溶解的铁物类的性质有至关重要的影响。具体来说,在溶液中引入氧,如分子氧,会大大增加溶解速度以及形成的铁物类的溶解度。在不受任何理论约束的情况下,认为氧参与了溶解反应,形成了稳定的水溶性铁氧络合物(iron-oxo complex)。
氧可以通过空气的强烈鼓泡,或者通过引入氧气和/或臭氧来引入。
另一个影响溶解过程的重要物质是过氧化氢。在溶解过程中向溶液中加入过氧化氢会使溶解速率增加。
溶解步骤可以被提供温度控制手段。这可以是为了促进稳定的溶解,因为铁的溶解是放热的,优选避免不需要的副反应。可以使用冷却装置来除去溶解过程中的多余热量。
分离
在完成直接还原铁的溶解反应后,所得到的溶液应经过分离阶段,在此阶段,未溶解的颗粒状杂质被除去。
分离可以使用倾析、沉降、过滤、离心、浮选或其任何组合进行。分离可以使用倾析器、离心机、过滤装置,如压滤机或吸滤机,或其任何组合进行。这种分离过程的例子是沉降或离心,然后是倾析,和/或过滤,任选通过抽吸促进,等等。可以在分离前加入适当的澄清剂,使颗粒状物质聚集,从而促进通过形成较粗物质的分离。
分离后提供的纯化含铁水溶液、含铁化合物或含铁前体被认为是高纯度的。这里所说的含铁水溶液的高纯度是指以其中的金属和半金属的总含量为基础,铁含量至少为90%,例如至少为93%,至少为97.5%,至少为99%,至少为99.5%,或至少为99.9%,这些金属和半金属来源于直接还原铁。铁含量主要基于其中来源于直接还原铁的溶解的金属和半金属含量。然而,如前所述,由于分离过程的限制,非常细小的颗粒状物质,如胶体颗粒,可能存在于纯化含铁水溶液中,任何这样的细小物质都可以仿佛溶解在溶液中那样被测量。含铁化合物或含铁前体也可以有至少90%的铁含量,例如至少93%、至少97.5%、至少99%、至少99.5%或至少99.9%,基于其中的源自直接还原铁的金属和半金属的总含量。这里的铁含量不包括任何来自水、酸或任何添加的碳、氧、氢的铁。这里的铁含量也不包括源于磷的任何铁,和/或源于锂的任何铁(其可以在生产电池级材料,例如锂离子阴极电池材料的过程中添加)。
纯化含铁水溶液可被视为基本上不含不溶性杂质。所提供的纯化含铁水溶液、含铁化合物或含铁前体可能含有其含量为≤1000ppm,如≤800ppm、≤600ppm、≤400ppm或≤300ppm的不溶性杂质,这些杂质来源于直接还原铁。不溶性杂质的含量可以基于其中源自直接还原铁的总金属和半金属含量。
预洗
洗涤
在溶解步骤之前,可以对直接还原铁进行洗涤步骤,其中直接还原铁的可溶性和/或可分散性的表面杂质被溶解和/或悬浮,并被除去。洗涤步骤使存在于直接还原铁颗粒上的可溶性和/或可分散性的表面杂质溶解和/或悬浮,从而可被使用的洗涤液除去。存在于直接还原铁表面的杂质被认为在很大程度上是含钙和硅的。含钙的杂质可能是水溶性的或在酸性条件下可溶解的。通过执行洗涤步骤,含铁颗粒表面的杂质可以被除去。因此,在溶解步骤之前,杂质的含量可以被降低。洗涤步骤可包括将直接还原铁置于稀酸中,如稀有机和/或无机酸。用于洗涤的稀有机酸可选自柠檬酸、甲酸、乙酸、丙酸、草酸、苯甲酸、乙醇酸、乳酸、苹果酸、酒石酸及其任何组合。用于洗涤的稀无机酸可选自盐酸、氯酸、高氯酸、硫酸、亚硫酸、硝酸、亚硝酸、磷酸以及它们的任何组合。
优选地,稀释形式的稀磷酸和/或柠檬酸被用于洗涤步骤。所提供的稀酸的浓度可以是1-25重量%,例如1-20重量%,2-15重量%,或3-10重量%。直接还原铁可与稀酸接触1-20分钟,如2-15分钟,或3-10分钟。稀酸的pH值可以是1-3,或1-2。
在洗涤步骤中,直接还原铁的溶解和/或悬浮的表面杂质可通过包括在所述洗涤步骤中的分离步骤除去。该分离步骤可选自倾析、过滤、离心及其任何组合。
洗涤步骤除了稀酸洗涤和任选的分离之外,还包括进一步用水洗涤。洗涤的直接还原铁可以在溶解步骤之前进一步用水洗涤。水洗可以使用纯水,如去离子水或蒸馏水进行。
添加剂
本纯化含铁水溶液可进一步被提供以含磷酸盐化合物(phosphate containingcompound),以及任选的含锂化合物,例如,分别是磷酸和氢氧化锂。当含磷酸盐化合物和任选的含锂化合物,如磷酸和氢氧化锂,分别与纯化含铁水溶液混合时,可提供简单的混合物。需要注意的是,没有引起或形成特定的沉淀,各组分只是在水溶液混合物中共存。此外,可任选向含铁水溶液中添加额外的碳源。
干燥和热处理
可以对包含纯化含铁水溶液、含磷酸盐化合物和任选的含锂化合物(例如分别为磷酸和氢氧化锂)以及任选的额外碳源的混合物进行固化步骤,以获得含铁化合物,或含铁前体。所述含铁化合物或含铁前体,可任选由此进一步含有磷和锂。该含铁化合物或含铁前体除了含有磷和锂之外,还可以含有额外的碳源。
凝固步骤可通过干燥(如喷雾干燥、冷冻干燥或真空干燥)水溶液混合物进行得到含铁化合物或含铁前体,更具体而言含磷酸铁化合物,优选FePO
根据本方法的热处理可在500-850℃、例如600-700℃的温度下进行以提供含铁化合物,例如,磷酸铁化合物或磷酸铁锂化合物。获得的含铁化合物处于电化学活动状态和结构。任选可以使用喷雾热解,其中热处理在喷雾干燥步骤时直接和连续进行。因此,喷雾热解是喷雾干燥和热处理的结合。
含铁化合物,例如磷酸铁化合物或磷酸铁锂化合物可以进行碳涂覆。碳涂覆在用于电池例如锂离子电池生产时是有益的。
本发明的一个目的是提供通过本方法获得的含铁化合物、含铁前体或含铁水溶液在磷酸铁锂电极材料生产中的用途,该材料可用于锂离子电池中。
本发明的一个目的是提供一种含铁水溶液、含铁组合物或含铁前体,其包含至少93重量%的铁,优选至少97.5重量%的铁,优选至少99%,优选至少99.5%,优选至少99.9%;
最多60ppm的Al,优选最多40ppm的Al;
最多160ppm的Ca,优选最多140ppm的Ca;
最多80ppm的Mg,优选最多60ppm的Mg;
最多160ppm的Mn,优选最多145ppm的Mn;
最多100ppm的Si,优选最多90ppm的Si;
最多40ppm的Ti,优选最多35ppm的Ti;以及
最多80ppm的V,优选最多60ppm的V;
基于其中来自直接还原铁的总金属和半金属的总含量。
本含铁水溶液、含铁组合物或含铁前体包含金属和半金属。它们可以包括Al、Ca、Mg、Mn、Si、Ti和V,基于其中源自直接还原铁的金属和半金属的总含量,其含量至少为0.01ppm,或至少0.1ppm。包含金属和半金属的杂质可以存在的量为约:
0.01-60ppm的Al,例如0.01-40ppm或0.1-40ppm的Al;
0.01-160ppm的Ca,例如0.01-140ppm或0.1-140ppm的Ca;
0.01-80ppm的Mg,例如0.01-60ppm或0.1-60ppm的Mg;
0.01-160ppm的Mn,例如0.01-145ppm或0.1-145ppm的Mn;
0.01-100ppm的Si,例如0.01-90ppm或0.1-90ppm的Si;
0.01-40ppm的Ti,例如0.01-35ppm或0.1-35ppm的Ti;
0.01-80ppm的V,例如0.01-60ppm或0.1-460ppm;
基于其中源自直接还原铁的总金属和半金属含量。
本发明的一个目的是提供一种含磷酸铁的组合物,其包含所述含铁组合物,或含铁前体,以及磷。
本发明的一个目的是提供一种磷酸铁锂电极材料,其包含所述的含铁组合物,或含铁前体,磷和锂。该磷酸铁锂电极材料还可进一步包含额外的碳源。
该磷酸铁锂电极材料可用于电池生产。
在图1中提供了本方法的示意图。在步骤1中,提供了还原铁粉。在步骤2中,该方法可任选包括用稀酸溶液洗涤粉末表面,以除去可溶性和/或可分散性的杂质。在步骤3中,将还原铁粉溶解在含有有机和/或无机酸的溶液中,任选同时向酸溶液提供分子氧和/或过氧化氢。在步骤4中,从含铁溶液中除去不溶性杂质,例如通过过滤。在步骤5中,该过程可能包括添加含磷酸盐化合物,以及任选的含锂化合物。此外,还可以加入碳源。在步骤6中,该方法可进一步包括通过除去溶剂,例如通过干燥,例如喷雾干燥,形成含铁前体或含铁化合物。在步骤7中,该方法可进一步包括对提供了磷酸盐和锂以及任选的含碳化合物的材料进行热处理,以提供含铁化合物。
实施例
还原铁粉的酸洗涤
进行洗涤试验以减少附着在还原铁粉(这里以可从
在一个实施例中,用8%的稀磷酸水溶液作为洗涤溶液。将50克作为粉末的还原铁加入到450克所述磷酸溶液中,并搅拌10分钟。然后通过吸滤将溶液从粉末中除去,并在持续搅拌下向粉末中加入100克蒸馏水。2分钟后,通过吸滤除去水,并再次以类似方式用水洗涤粉末样品。最后,取出粉末,并在80℃下在真空条件下进行干燥。
使用Inductively Conductive Plasma Optical Emission Spectroscopy(ICP-OES)通过进行元素分析对还原铁粉的样品进行了杂质分析,测试结果见表1。样品4公开了还原铁粉(NC100.24),其没有经过本发明的任何处理(洗涤、溶解、过滤),就像得到的还原铁粉一样。样品7公开了还原铁粉,其如上所述用稀酸和水进行了洗涤。从表1的结果可以看出,表中显示的所有测量元素的含量都下降了,特别是Ca含量下降了61%。这种用稀酸和水进行的洗涤可以除去粉末表面的可溶性和/或可分散性的、即存在于粉末颗粒表面的杂质。
还原铁的溶解和过滤
铁粉的溶解这样实现,即首先制备含有摩尔比为1:1的柠檬酸和乙酸的酸溶液,或者在560毫升去离子水中加入61.9克无水柠檬酸和21.5克冰醋酸。将30克还原铁粉(NC100.24,
然后将这样得到的含铁溶液转移到吸滤装置中,并通过滤纸(Munktell GradeOOH,开孔1-2微米)进行过滤。
向纯化含铁水溶液进一步提供61.9克正磷酸(orto-phosphoric acid)(85%)和22.5克单水合氢氧化锂。当含磷酸盐和锂的化合物与纯化含铁水溶液混合时,提供了深绿色至黑红色的透明溶液,没有启动或形成特定的沉淀。
此后将过滤后的铁溶液喷雾干燥,然后将得到的喷雾干燥的粉末在氮气环境中在750℃下热处理3小时,以热解并除去来自所用柠檬酸和乙酸的大部分碳,以促进对样品进行ICP-OES分析以测定杂质含量。以这种方式处理的样品是表1的样品9。
同样的喷雾干燥和热处理程序也用于另外两种溶液。一个样品由还原铁粉制成,其在溶解前没有用稀释的酸和水进行洗涤,并且在喷雾干燥和热处理步骤前没有对溶液进行过滤(样品5)。另一个样品由还原铁粉制成,在溶解前用稀释的磷酸溶液和水进行了洗涤,并且在喷雾干燥和热处理步骤之前,所产生的溶液没有经过过滤(样品8)。
表1中样品5和8的比较显示了在溶解前洗涤还原铁粉对杂质含量的影响。这可以与未洗涤的和洗涤的未溶解的还原铁粉(分别为样品4和7)的结果进行比较,其显示出类似的趋势。
通过过滤由经洗涤的还原铁粉的溶解得到的溶液得到了进一步的改进,在表1中显示为样品9。在这种情况下,杂质含量接近或低于ICP-OES分析仪器对三种报告杂质的检测极限。在含Ca杂质的情况下,其含量减少了840%,或者达到原含量的1/8。因此,很明显,将还原铁粉的稀酸洗涤与溶解在酸性溶液中以及随后的过滤相结合,是一种非常有效的方法,可以以低成本提供高纯度的含铁溶液,以及以低成本提供高纯度或纯的含铁化合物和高纯度含铁前体。表1中的样品6和9的比较显示了在溶解前对还原铁粉的洗涤对杂质含量的影响。与样品5和8相比,样品6和9在喷雾干燥和热处理步骤前进行了过滤。
铁矿石的溶解和过滤
作为一个比较例,将铁矿石磁铁矿(主要是Fe
在烧杯中混合10克37%的盐酸和2.7克蒸馏水的溶液,并在剧烈的搅拌下加入1.0克磁铁矿。在整个溶解过程中,该溶液保持在70℃。60分钟后,当样品被完全溶解后,对得到的含铁溶液进行过滤,以除去任何不溶性杂质。为了进行更多的比较,制备了一个类似但没有最后的过滤阶段的样品。最后,使用ICP-OES对未溶解的磁铁矿(表1的样品1)、溶解和未过滤的磁铁矿(样品2)、以及溶解和过滤的磁铁矿(样品3)的杂质含量进行了分析。从结果可以看出,溶解过程对杂质含量没有显著影响。另外,溶解后的溶液过滤也只是略微降低了杂质含量,在某些情况下杂质含量甚至没有变化。这意味着在铁矿石中,杂质处于这样的状态,即它们在溶解过程中不会形成固体颗粒,使得它们很难甚至不可能用所提出的方法除去。
水雾化铁粉的溶解和过滤
为了进行比较,对雾化铁粉的样品进行了与本发明类似的处理。对第一个市售的水雾化铁粉(样品12和13)(AHC100.29,
表1
**数值"<"为低于检测极限
样品1-3:与磁铁矿(Fe
样品4和7:与铁粉中的铁含量有关的数值。
样品5-6和8-13:与LiFePO
使用直接还原铁对本方法是重要的。当将该材料与用雾化铁粉进行的测试进行比较时,雾化铁粉中含有的杂质含量要高得多,这些杂质含有比铁更具电负性的金属,前面被公开为第4类,见表2(Co、Cu和Ni)。雾化铁粉还显示出显著更高的Mn(见表1)和Cr(见表2)杂质含量。在本方法中,这些杂质是可溶性的,在本溶解过程后可在水相中发现。因此,使用雾化铁粉并没有什么好处。
表2
**数值"<"为低于检测极限
样品5-6,8-9,和12-13:与LiFePO
- 含纯铁化合物
- 含酰亚胺基化合物、含酰亚胺基化合物溶液以及含酰亚胺基化合物的制造方法
