具有修饰的FCRN结合性质的Fc区变体
文献发布时间:2023-06-19 12:13:22
本申请是国际申请号PCT/EP2015/05425,国际申请日为2015年1月12日,进入中国国家阶段日期为2016年7月1日,中国国家阶段申请号为201580003633.0,发明名称为“具有修饰的FCRN结合性质的Fc区变体”的分案申请。
在本文中报道了就Fc-受体结合而言已经经过修饰而没有损害它们的纯化性质的IgG Fc区。
背景技术
对有成本效益的生产方法的需求已经导致优化下游纯化(包括一个或多个亲和色谱法步骤)的必要。要处理的较大体积和对原位清洁(cleaning-in-place,CIP)方案的较苛刻要求是需要解决的一些特征(Hober,S.,J.Chrom.B.848(2007)40-47)。
借助于选择性的Fc区亲和配体来纯化单克隆抗体,是最有前途的用于大规模生产治疗性单克隆抗体的方法。实际上,该规程不需要建立与抗体的抗原特异性部分(即Fab结构域)的任何相互作用,所述抗原特异性部分因而保持完整且可以保留它的性质(参见Salvalaglio,M.,等人,J.Chrom.A 1216(2009)8678-8686)。
由于它的选择性,亲和纯化步骤在早期被用在纯化链中,且由此可以减少连续单元操作的数目(参见Hober出处同上;MacLennan,J.,Biotechnol.13(1995)1180;Harakas,N.K.,Bioprocess Technol.18(1994)259)。
最适合选择性地结合IgG的配体是葡萄球菌蛋白A和蛋白G,它们能够在被称作“一致性结合位点”(“consensus binding site”,CBS)的区域中建立与大多数IgG的Fc区的高度选择性的相互作用(DeLano,W.L.,等人,Science 287(2000)1279),所述区域位于Fc区的CH2和CH3结构域之间的铰链区。
葡萄球菌蛋白A(Staphylococcal protein A,SPA)是暴露在革兰氏阳性细菌金黄色葡萄球菌(Staphylococcus aureus)的表面上的一种细胞壁相关的蛋白结构域。SPA对来自不同物种的IgG(例如人、兔和豚鼠IgG)具有高亲和力,但是对牛和小鼠IgG仅具有弱相互作用(参见下表)(参见Hober出处同上;Duhamel,R.C.,等人,J.Immunol.Methods 31(1979)211;
++:强结合/+:中等结合/-:弱或没有相互作用
IgG的CH2和CH3结构域之间的重链铰链区能够结合除了蛋白A以外的几种蛋白,诸如新生儿Fc受体(neonatal Fc receptor,FcRn)(参见DeLano和Salvalaglio出处同上)。
SPA CBS包括在抗体的表面上的疏水口袋。组成IgG CBS的残基是Ile 253、Ser254、Met 252、Met 423、Tyr 326、His 435、Asn 434、His 433、Arg 255和Glu 380(IgG重链残基的编号根据Kabat EU索引编号系统)。带电荷的氨基酸(Arg 255,Glu 380)被放置在由Ile 253和Ser 254形成的疏水凸起周围。这(可以)导致极性和亲水相互作用的建立(参见Salvalaglio出处同上)。
一般而言,可以使用两个主要结合位点描述蛋白A-IgG相互作用:第一个位于重链CH2结构域中,且特征在于Phe 132、Leu 136、Ile 150(属于蛋白A)与由Ile 253和Ser 254构成的IgG疏水凸起之间的疏水相互作用,以及特征在于Lys 154(蛋白A)和Thr 256(IgG)之间的一种静电相互作用。第二个位点位于重链CH3结构域中,且由Gln 129和Tyr 133(蛋白A)与His 433、Asn 434和His 435(IgG)之间的静电相互作用支配(参见Salvalaglio出处同上)。
Lindhofer,H.,等人(J.Immunol.155(1995)219-225)报道了在大鼠/小鼠四源杂交瘤(quadroma)中的优先的物种限制的重/轻链配对。
Jedenberg,L.,等人(J.Immunol.Meth.201(1997)25-34)报道称,两种Fc变体(Fc13和Fc31,各自含有来自各自的其它同种型的同型二肽置换)的SPA-结合分析表明Fc1和Fc31会与SPA相互作用,而Fc3和Fc13缺少可检测的SPA结合。提供的Fc区变体Fc31的SPA结合被认为源自引入的二肽置换R435H和F436Y。
现在,关于治疗性单克隆抗体的焦点是在特异性结合两种或更多种靶标(抗原)的双特异性抗体或甚至多特异性抗体的制备和应用上。
在一个表达细胞系中从四种抗体链(两种不同重链和两种不同轻链)制备多特异性的异源二聚体IgG抗体的基本挑战是所谓的链结合问题(参见Klein,C.,等人,mAb 4(2012)653-663)。要求的不同链作为多特异性抗体的左臂和右臂的应用,导致在一个细胞中表达后的抗体混合物:两种重链能够(在理论上)以四种不同的组合结合(其中的两种是相同的),且其中的每一种可以以随机方式与轻链结合,从而产生2
为了克服链结合问题和加强两种不同重链的正确结合,在二十世纪九十年代后期,来自Genentech的Carter等人发明了被称作“凸起-进入-孔洞”(“knobs-into-holes”,KiH)的方案(参见Carter,P.,J.Immunol.Meth.248(2001)7-15;Merchant,A.M.,等人,Nat.Biotechnol.16(1998)677-681;Zhu,Z.,等人,Prot.Sci.6(1997)781-788;Ridgway,J.B.,等人,Prot.Eng.9(1996)617-621;Atwell,S.,等人,J.Mol.Biol.270(1997)26-35;和US 7,183,076)。基本上,所述概念依赖于抗体的两个重链的两个CH3结构域之间的界面的修饰,在所述界面处发生大多数相互作用。将庞大残基引入一个抗体重链的CH3结构域中,并与钥匙(“凸起”)类似地起作用。在另一个重链中,形成能够容纳该庞大残基的“孔洞”,从而模仿锁。通过引入/形成人工二硫键,可以进一步稳定得到的异源二聚体Fc区。值得注意的是,所有KiH突变被埋在CH3结构域内,且是免疫系统不“可见的”。另外,具有KiH突变的抗体的性质诸如(热)稳定性、FcγR结合和效应子功能(例如,ADCC、FcRn结合)和药代动力学(PK)行为不受影响。
通过引入6个突变,可以实现具有高于97%的异源二聚化收率的正确重链结合:在“凸起”重链中的S354C、T366W,和在“孔洞”重链中的Y349C、T366S、L368A、Y407V(参见Carter出处同上;残基的编号根据Kabat EU索引编号系统)。尽管孔洞-孔洞同源二聚体可能出现,通常不会观察到凸起-凸起同源二聚体。通过选择性的纯化规程或通过下面所述的规程,可以除去孔洞-孔洞二聚体。
尽管已经解决了随机重链结合的问题,还必须确保正确的轻链结合。类似于KiHCH3结构域方案,已经做出努力来研究可能最终导致完整双特异性IgG的不对称轻链-重链相互作用。
Roche最近开发了CrossMab方案作为当将它与KiH技术组合时强化双特异性的异源二聚体IgG抗体中的正确轻链配对的可能性(参见Klein出处同上;Schaefer.W.,等人,Proc.Natl.Acad.Sci.USA 108(2011)11187-11192;Cain,C.,SciBX 4(2011)1-4)。这允许以通用方式制备双特异性抗体或甚至多特异性抗体。在该形式中,预期的双特异性抗体的一个臂保持不变。在第二个臂中,整个Fab区域或VH-VL结构域或CH1-CL结构域通过重链和轻链之间的结构域交叉而交换。结果,新形成的“交叉的”轻链不再与双特异性抗体的其它臂(正常的,即未交叉的)重链Fab区域结合。因而,通过结构域排列中的这种最小变化可以强化正确的“轻链”结合(参见Schaefer出处同上)。
Zhu等人在双体变体的两个VL/VH界面中引入了几种空间上互补的突变、以及二硫键。当将突变VL Y87A/F98M和VH V37F/L45W引入抗-p185HER2 VL/VH界面中时,以>90%收率回收异源二聚体双体,同时与亲本双体相比维持总收率和亲和力(参见Zhu出处同上)。
来自Chugai的研究人员已经如下类似地设计了双特异性双体:将突变引入VH-VL界面(主要是VH中的Q39和VL中的Q38向带电荷残基的转化)中以促进正确的轻链结合(WO2006/106905;Igawa,T.,等人,Prot.Eng.Des.Sel.23(2010)667-677)。
在WO2011097603中,报道了一种普通的轻链小鼠。
在WO2010151792中,提供了一种容易分离的双特异性抗体形式,其包含在CH3结构域中不同地修饰的(即异源二聚体的)免疫球蛋白重链可变结构域,其中所述差别修饰就CH3修饰而言是非免疫原性的或基本上非免疫原性的,并且所述修饰中的至少一个导致双特异性抗体对亲和试剂诸如蛋白A的差别亲和力,并且所述双特异性抗体可以基于它对蛋白A的亲和力从破碎的细胞、从培养基或从抗体的混合物分离。
新生儿Fc-受体(FcRn)对于体内IgG类抗体的代谢命运而言是重要的。FcRn行使功能以从溶酶体降解途径营救IgG,从而导致降低的清除率和增加的半衰期。它是一种由2个多肽组成的异源二聚体蛋白:50kDa I类主要组织相容性复合物-样蛋白(α-FcRn)和15kDaβ2-微球蛋白(β2m)。FcRn以高亲和力结合至IgG类抗体的Fc区的CH2-CH3部分。IgG类抗体和FcRn之间的相互作用是pH依赖性的,并且以1∶2化学计量学发生,即一个IgG抗体分子可以经由它的两个重链Fc区多肽与两个FcRn分子相互作用(参见例如Huber,A.H.,等人,J.Mol.Biol.230(1993)1077-1083)。
因而,IgG体外FcRn结合性质/特征指示它在血液循环中的体内药代动力学性质。
在FcRn和IgG类抗体的Fc区之间的相互作用中,重链CH2-和CH3-结构域的不同氨基酸残基正在参与。
影响FcRn结合并由此影响在血液循环中的半衰期的不同突变是已知的。已经通过定位诱变鉴别出对于小鼠Fc区-小鼠FcRn相互作用至关重要的Fc区残基(参见例如Dall’Acqua,W.F.,等人.J.Immunol 169(2002)5171-5180)。残基I253、H310、H433、N434和H435(根据Kabat EU索引编号系统编号)参与相互作用(Medesan,C.,等人,Eur.J.Immunol.26(1996)2533-2536;Firan,M.,等人,Int.Immunol.13(2001)993-1002;Kim,J.K.,等人,Eur.J.Immunol.24(1994)542-548)。发现残基I253、H310和H435对于人Fc区与鼠FcRn的相互作用是至关重要的(Kim,J.K.,等人,Eur.J.Immunol.29(1999)2819-2885)。
已经执行通过突变Fc区中的不同氨基酸残基来增加Fc区(和同样IgG)与FcRn的结合的方法:Thr 250、Met 252、Ser 254、Thr 256、Thr 307、Glu 380、Met 428、His 433和Asn434(参见Kuo,T.T.,等人,J.Clin.Immunol.30(2010)777-789;Ropeenian,D.C.,等人,Nat.Rev.Immunol.7(2007)715-725)。
Dall’Acqua等人已经描述了突变M252Y、S254T、T256E的组合,以通过蛋白-蛋白相互作用研究来改善FcRn结合(Dall′Acqua,W.F.,等人.J.Biol.Chem.281(2006)23514-23524)。人Fc区-人FcRn复合物的研究已经证实,残基I253、S254、H435和Y436对于所述相互作用而言是至关重要的(Firan,M.,等人,Int.Immunol.13(2001)993-1002;Shields,R.L.,等人,J.Biol.Chem.276(2001)6591-6604)。在Yeung,Y.A.,等人(J.Immunol.182(2009)7667-7671)中,已经报道和检查了残基248-259和301-317和376-382和424-437的多种突变体。
在WO 2014/006217中,报道了具有三重突变的二聚体蛋白。Martin,W.,等人报道了关于pH依赖性的结合机制的FcRn/异源二聚体Fc复合物在2.8埃的晶体结构(Mol.Cell.7(2001)867-877)。在US 6,277,375中,具有增加的半衰期的免疫球蛋白样结构域报道在WO2013/004842中。Shields,R.L.,等人报道了FcγRI、FcγRII、FcγRIII和FcRn在人IgG1上的结合位点的高分辨率映射图以及具有改善的对FcγR的结合的IgG1变体的设计(Biochem.Mol.Biol.276(2001)6591-6604)。Medesan,C.,等人报道了参与小鼠IgG1的胞吞转运作用和分解代谢的氨基酸残基的描述(J.Immunol.158(1997)2211-2217)。在US 2010/0272720中,报道了具有修饰的FcRn结合位点的抗体融合蛋白。在WO 2013/060867中报道了异源二聚体蛋白的生产。Qiao,S.-W.,等人报道了抗体介导的抗原呈递对FcRn的依赖性(Proc.Natl.Acad.Sci.USA 105(2008)9337-9342。
发明内容
在本文中报道了特异性结合葡萄球菌属蛋白A且不结合人FcRn的变体Fc区。这些变体Fc区含有在CH2-和CH3-结构域中的特定氨基酸突变。已经发现,这些突变当用在异源二聚体Fc区的孔洞链或凸起链中时会允许纯化异源二聚体Fc区,即从同源二聚体Fc区分离异源二聚体Fc区。
本文报道的一个方面是(二聚体)多肽,其包含
第一多肽,所述第一多肽在N-端至C-端方向包含含有一个或多个半胱氨酸残基的免疫球蛋白铰链区的至少一部分、免疫球蛋白CH2-结构域和免疫球蛋白CH3-结构域;和第二多肽,所述第二多肽在N-端至C-端方向包含含有一个或多个半胱氨酸残基的免疫球蛋白铰链区的至少一部分、免疫球蛋白CH2-结构域和免疫球蛋白CH3-结构域,
其中(根据Kabat EU索引编号系统编号)
i)所述第一多肽和所述第二多肽各自包含突变H310A、H433A和Y436A,或者
ii)所述第一多肽和所述第二多肽各自包含突变L251D、L314D和L432D,或者
iii)所述第一多肽和所述第二多肽各自包含突变L251S、L314S和L432S,
且,
其中所述第一多肽和所述第二多肽通过所述免疫球蛋白铰链区的至少一部分中的一个或多个二硫键连接。
在一个实施方案中,所述(二聚体)多肽不特异性结合人FcRn且特异性结合葡萄球菌蛋白A。
在一个实施方案中,所述(二聚体)多肽是同源二聚体多肽。
在一个实施方案中,所述(二聚体)多肽是异源二聚体多肽。
在一个实施方案中,所述第一多肽还包含突变Y349C、T366S、L368A和Y407V(“孔洞”),且所述第二多肽包含突变S354C和T366W(“凸起”)。
在一个实施方案中,所述第一多肽还包含突变S354C、T366S、L368A和Y407V(“孔洞”),且所述第二多肽包含突变Y349C和T366W(“凸起”)。
在一个实施方案中,所述第一多肽和所述第二多肽的免疫球蛋白铰链区、免疫球蛋白CH2-结构域和免疫球蛋白CH3-结构域是人IgG1亚类。在一个实施方案中,所述第一多肽和所述第二多肽各自还包含突变L234A和L235A。在一个实施方案中,所述第一多肽和所述第二多肽各自还包含突变P329G。在一个实施方案中,所述第一多肽和所述第二多肽各自还包含突变L234A、L235A和P329G。
在一个实施方案中,所述第一多肽和所述第二多肽的免疫球蛋白铰链区、免疫球蛋白CH2-结构域和免疫球蛋白CH3-结构域是人IgG4亚类。在一个实施方案中,所述第一多肽和所述第二多肽各自还包含突变S228P和L235E。在一个实施方案中,所述第一多肽和所述第二多肽各自还包含突变P329G。在一个实施方案中,所述第一多肽和所述第二多肽各自还包含突变S228P、L235E和P329G。
在一个实施方案中,所述第一多肽和所述第二多肽的免疫球蛋白铰链区、免疫球蛋白CH2-结构域和免疫球蛋白CH3-结构域是人IgG2亚类。在一个实施方案中,所述第一多肽和所述第二多肽各自还包含突变H268Q、V309L、A330S和P331S。
在一个实施方案中,所述第一多肽和所述第二多肽的免疫球蛋白铰链区、免疫球蛋白CH2-结构域和免疫球蛋白CH3-结构域是人IgG2亚类。在一个实施方案中,所述第一多肽和所述第二多肽各自还包含突变V234A、G237A、P238S、H268A、V309L、A330S和P331S。
在一个实施方案中,所述第一多肽和所述第二多肽的免疫球蛋白铰链区、免疫球蛋白CH2-结构域和免疫球蛋白CH3-结构域是人IgG4亚类。在一个实施方案中,所述第一多肽和所述第二多肽各自还包含突变S228P、L234A和L235A。在一个实施方案中,所述第一多肽和所述第二多肽各自还包含突变P329G。在一个实施方案中,所述第一多肽和所述第二多肽各自还包含突变S228P、L234A、L235A和P329G。
在一个实施方案中,所述第一多肽和所述第二多肽包含突变Y436A。
在一个实施方案中,所述(二聚体)多肽是Fc区融合多肽。
在一个实施方案中,所述(二聚体)多肽是(全长)抗体。
在一个实施方案中,所述(全长)抗体是单特异性抗体。在一个实施方案中,所述单特异性抗体是单价单特异性抗体。在一个实施方案中,所述单特异性抗体是二价单特异性抗体。
在一个实施方案中,所述(全长)抗体是双特异性抗体。在一个实施方案中,所述双特异性抗体是二价双特异性抗体。在一个实施方案中,所述双特异性抗体是四价双特异性抗体。
在一个实施方案中,所述(全长)抗体是三特异性抗体。在一个实施方案中,所述三特异性抗体是三价三特异性抗体。在一个实施方案中,所述三特异性抗体是四价三特异性抗体。
本文报道的一个方面是突变Y436A用于增加包含免疫球蛋白Fc区的(二聚体)多肽与蛋白A的结合的用途。
本文报道的一个方面是一种(二聚体)多肽,其包含
第一多肽,所述第一多肽在N-端至C-端方向包含含有一个或多个半胱氨酸残基的免疫球蛋白铰链区的至少一部分、免疫球蛋白CH2-结构域和免疫球蛋白CH3-结构域;和第二多肽,所述第二多肽在N-端至C-端方向包含含有一个或多个半胱氨酸残基的免疫球蛋白铰链区的至少一部分、免疫球蛋白CH2-结构域和免疫球蛋白CH3-结构域,
其中所述第一多肽、所述第二多肽、或所述第一多肽和所述第二多肽包含突变Y436A(根据Kabat EU索引编号系统编号),且
其中所述第一多肽和所述第二多肽通过一个或多个二硫键连接。
在一个实施方案中,所述第一多肽和所述第二多肽包含突变Y436A。
本文报道的一个方面是一种抗体,其包含
第一多肽,所述第一多肽在N-端至C-端方向包含第一重链可变结构域、亚类IgG1的免疫球蛋白CH1-结构域、亚类IgG1的免疫球蛋白铰链区、亚类IgG1的免疫球蛋白CH2-结构域和亚类IgG1的免疫球蛋白CH3-结构域,
第二多肽,所述第二多肽在N-端至C-端方向包含第二重链可变结构域、亚类IgG1的免疫球蛋白CH1-结构域、亚类IgG1的免疫球蛋白铰链区、亚类IgG1的免疫球蛋白CH2-结构域和亚类IgG1的免疫球蛋白CH3-结构域,
第三多肽,所述第三多肽在N-端至C-端方向包含第一轻链可变结构域和轻链恒定结构域,
第四多肽,所述第四多肽在N-端至C-端方向包含第二轻链可变结构域和轻链恒定结构域,
其中所述第一重链可变结构域和所述第一轻链可变结构域形成特异性结合第一抗原的第一结合位点,
其中所述第二重链可变结构域和所述第二轻链可变结构域形成特异性结合第二抗原的第二结合位点,
其中i)所述第一多肽包含突变Y349C、T366S、L368A、Y407V、L234A、L235A和P329G,且所述第二多肽包含突变S354C、T366W、L234A、L235A和P329G,或者ii)所述第一多肽包含突变S354C、T366S、L368A、Y407V、L234A、L235A和P329G,且所述第二多肽包含突变Y349C、T366W、L234A、L235A和P329G,且
其中(根据Kabat EU索引编号系统编号)
i)所述第一多肽和所述第二多肽各自还包含突变H310A、H433A和Y436A,或者
ii)所述第一多肽和所述第二多肽各自还包含突变L251D、L314D和L432D,或者
iii)所述第一多肽和所述第二多肽各自还包含突变L251S、L314S和L432S,
且
其中所述第一多肽和所述第二多肽通过所述铰链区中的一个或多个二硫键连接。
本文报道的一个方面是一种抗体,其包含
第一多肽,所述第一多肽在N-端至C-端方向包含第一重链可变结构域、免疫球蛋白轻链恒定结构域、亚类IgG1的免疫球蛋白铰链区、亚类IgG1的免疫球蛋白CH2-结构域和亚类IgG1的免疫球蛋白CH3-结构域,
第二多肽,所述第二多肽在N-端至C-端方向包含第二重链可变结构域、亚类IgG1的免疫球蛋白CH1-结构域、亚类IgG1的免疫球蛋白铰链区、亚类IgG1的免疫球蛋白CH2-结构域和亚类IgG1的免疫球蛋白CH3-结构域,
第三多肽,所述第三多肽在N-端至C-端方向包含第一轻链可变结构域和亚类IgG1的免疫球蛋白CH1-结构域,
第四多肽,所述第四多肽在N-端至C-端方向包含第二轻链可变结构域和轻链恒定结构域,
其中所述第一重链可变结构域和所述第一轻链可变结构域形成特异性结合第一抗原的第一结合位点,
其中所述第二重链可变结构域和所述第二轻链可变结构域形成特异性结合第二抗原的第二结合位点,
其中i)所述第一多肽包含突变Y349C、T366S、L368A、Y407V、L234A、L235A和P329G,且所述第二多肽包含突变S354C、T366W、L234A、L235A和P329G,或者ii)所述第一多肽包含突变S354C、T366S、L368A、Y407V、L234A、L235A和P329G,且所述第二多肽包含突变Y349C、T366W、L234A、L235A和P329G,且
其中(根据Kabat EU索引编号系统编号)
i)所述第一多肽和所述第二多肽各自还包含突变H310A、H433A和Y436A,或者
ii)所述第一多肽和所述第二多肽各自还包含突变L251D、L314D和L432D,或者
iii)所述第一多肽和所述第二多肽各自还包含突变L251S、L314S和L432S,
且
其中所述第一多肽和所述第二多肽通过所述铰链区中的一个或多个二硫键连接。
本文报道的一个方面是一种抗体,其包含
第一多肽,所述第一多肽在N-端至C-端方向包含第一重链可变结构域、亚类IgG4的免疫球蛋白CH1-结构域、亚类IgG4的免疫球蛋白铰链区、亚类IgG4的免疫球蛋白CH2-结构域和亚类IgG4的免疫球蛋白CH3-结构域,
第二多肽,所述第二多肽在N-端至C-端方向包含第二重链可变结构域、亚类IgG4的免疫球蛋白CH1-结构域、亚类IgG4的免疫球蛋白铰链区、亚类IgG4的免疫球蛋白CH2-结构域和亚类IgG4的免疫球蛋白CH3-结构域,
第三多肽,所述第三多肽在N-端至C-端方向包含第一轻链可变结构域和轻链恒定结构域,
第四多肽,所述第四多肽在N-端至C-端方向包含第二轻链可变结构域和轻链恒定结构域,
其中所述第一重链可变结构域和所述第一轻链可变结构域形成特异性结合第一抗原的第一结合位点,
其中所述第二重链可变结构域和所述第二轻链可变结构域形成特异性结合第二抗原的第二结合位点,
其中i)所述第一多肽包含突变Y349C、T366S、L368A、Y407V、S228P、L235E和P329G,且所述第二多肽包含突变S354C、T366W、S228P、L235E和P329G或ii)所述第一多肽包含突变S354C、T366S、L368A、Y407V、S228P、L235E和P329G,且所述第二多肽包含突变Y349C、T366W、S228P、L235E和P329G,且
其中(根据Kabat EU索引编号系统编号)
i)所述第一多肽和所述第二多肽各自还包含突变H310A、H433A和Y436A,或者
ii)所述第一多肽和所述第二多肽各自还包含突变L251D、L314D和L432D,或者
iii)所述第一多肽和所述第二多肽各自还包含突变L251S、L314S和L432S,
且
其中所述第一多肽和所述第二多肽通过所述铰链区中的一个或多个二硫键连接。
本文报道的一个方面是一种抗体,其包含
第一多肽,所述第一多肽在N-端至C-端方向包含第一重链可变结构域、免疫球蛋白轻链恒定结构域、亚类IgG4的免疫球蛋白铰链区、亚类IgG4的免疫球蛋白CH2-结构域和亚类IgG4的免疫球蛋白CH3-结构域,
第二多肽,所述第二多肽在N-端至C-端方向包含第二重链可变结构域、亚类IgG4的免疫球蛋白CH1-结构域、亚类IgG4的免疫球蛋白铰链区、亚类IgG4的免疫球蛋白CH2-结构域和亚类IgG4的免疫球蛋白CH3-结构域,
第三多肽,所述第三多肽在N-端至C-端方向包含第一轻链可变结构域和亚类IgG4的免疫球蛋白CH1-结构域,
第四多肽,所述第四多肽在N-端至C-端方向包含第二轻链可变结构域和轻链恒定结构域,
其中所述第一重链可变结构域和所述第一轻链可变结构域形成特异性结合第一抗原的第一结合位点,
其中所述第二重链可变结构域和所述第二轻链可变结构域形成特异性结合第二抗原的第二结合位点,
其中i)所述第一多肽包含突变Y349C、T366S、L368A、Y407V、S228P、L235E和P329G,且所述第二多肽包含突变S354C、T366W、S228P、L235E和P329G或ii)所述第一多肽包含突变S354C、T366S、L368A、Y407V、S228P、L235E和P329G,且所述第二多肽包含突变Y349C、T366W、S228P、L235E和P329G,且
其中(根据Kabat EU索引编号系统编号)
i)所述第一多肽和所述第二多肽各自还包含突变H310A、H433A和Y436A,或者
ii)所述第一多肽和所述第二多肽各自还包含突变L251D、L314D和L432D,或者
iii)所述第一多肽和所述第二多肽各自还包含突变L251S、L314S和L432S,
且
其中所述第一多肽和所述第二多肽通过所述铰链区中的一个或多个二硫键连接。
本文报道的一个方面是一种抗体,其包含
第一多肽,所述第一多肽在N-端至C-端方向包含第一重链可变结构域、亚类IgG1的免疫球蛋白CH1-结构域、亚类IgG1的免疫球蛋白铰链区、亚类IgG1的免疫球蛋白CH2-结构域、亚类IgG1的免疫球蛋白CH3-结构域、肽接头和第一scFv,
第二多肽,所述第二多肽在N-端至C-端方向包含第二重链可变结构域、亚类IgG1的免疫球蛋白CH1-结构域、亚类IgG1的免疫球蛋白铰链区、亚类IgG1的免疫球蛋白CH2-结构域、亚类IgG1的免疫球蛋白CH3-结构域、肽接头和第二scFv,
第三多肽,所述第三多肽在N-端至C-端方向包含第一轻链可变结构域和轻链恒定结构域,
第四多肽,所述第四多肽在N-端至C-端方向包含第二轻链可变结构域和轻链恒定结构域,
其中所述第一重链可变结构域和所述第一轻链可变结构域形成特异性结合第一抗原的第一结合位点,且所述第二重链可变结构域和所述第二轻链可变结构域形成特异性结合第一抗原的第二结合位点,且所述第一scFv和所述第二scFv特异性结合第二抗原,
其中i)所述第一多肽包含突变Y349C、T366S、L368A、Y407V、L234A、L235A和P329G,且所述第二多肽包含突变S354C、T366W、L234A、L235A和P329G,或者ii)所述第一多肽包含突变S354C、T366S、L368A、Y407V、L234A、L235A和P329G,且所述第二多肽包含突变Y349C、T366W、L234A、L235A和P329G,且
其中(根据Kabat EU索引编号系统编号)
i)所述第一多肽和所述第二多肽各自还包含突变H310A、H433A和Y436A,或者
ii)所述第一多肽和所述第二多肽各自还包含突变L251D、L314D和L432D,或者
iii)所述第一多肽和所述第二多肽各自还包含突变L251S、L314S和L432S,
且
其中所述第一多肽和所述第二多肽通过所述铰链区中的一个或多个二硫键连接。
本文报道的一个方面是一种抗体,其包含
第一多肽,所述第一多肽在N-端至C-端方向包含第一重链可变结构域、免疫球蛋白轻链恒定结构域、亚类IgG1的免疫球蛋白铰链区、亚类IgG1的免疫球蛋白CH2-结构域、亚类IgG1的免疫球蛋白CH3-结构域、肽接头和第一scFv,
第二多肽,所述第二多肽在N-端至C-端方向包含第二重链可变结构域、亚类IgG1的免疫球蛋白CH1-结构域、亚类IgG1的免疫球蛋白铰链区、亚类IgG1的免疫球蛋白CH2-结构域、亚类IgG1的免疫球蛋白CH3-结构域、肽接头和第二scFv,
第三多肽,所述第三多肽在N-端至C-端方向包含第一轻链可变结构域和亚类IgG1的免疫球蛋白CH1-结构域,
第四多肽,所述第四多肽在N-端至C-端方向包含第二轻链可变结构域和轻链恒定结构域,
其中所述第一重链可变结构域和所述第一轻链可变结构域形成特异性结合第一抗原的第一结合位点,且所述第二重链可变结构域和所述第二轻链可变结构域形成特异性结合第一抗原的第二结合位点,且所述第一scFv和所述第二scFv特异性结合第二抗原,
其中i)所述第一多肽包含突变Y349C、T366S、L368A、Y407V、L234A、L235A和P329G,且所述第二多肽包含突变S354C、T366W、L234A、L235A和P329G,或者ii)所述第一多肽包含突变S354C、T366S、L368A、Y407V、L234A、L235A和P329G,且所述第二多肽包含突变Y349C、T366W、L234A、L235A和P329G,且
其中(根据Kabat EU索引编号系统编号)
i)所述第一多肽和所述第二多肽各自还包含突变H310A、H433A和Y436A,或者
ii)所述第一多肽和所述第二多肽各自还包含突变L251D、L314D和L432D,或者
iii)所述第一多肽和所述第二多肽各自还包含突变L251S、L314S和L432S,
且
其中所述第一多肽和所述第二多肽通过所述铰链区中的一个或多个二硫键连接。
本文报道的一个方面是一种用于生产本文报道的(二聚体)多肽的方法,所述方法包括下述步骤:
a)培养哺乳动物细胞,所述细胞包含一个或多个编码所述(二聚体)多肽的核酸,
b)从培养基回收所述(二聚体)多肽,和
c)用蛋白A亲和色谱法纯化所述(二聚体)多肽并由此生产所述(二聚体)多肽。
本文报道的一个方面是突变H310A、H433A和Y436A的组合用于从同源二聚体多肽分离异源二聚体多肽的用途。
本文报道的一个方面是突变L251D、L314D和L432D的组合用于从同源二聚体多肽分离异源二聚体多肽的用途。
本文报道的一个方面是突变L251S、L314S和L432S的组合用于从同源二聚体多肽分离异源二聚体多肽的用途。
本文报道的一个方面是通过将本文报道的(二聚体)多肽或抗体施用给需要这种治疗的患者来治疗遭受眼血管疾病的患者的方法。
本文报道的一个方面是用于玻璃体内应用的本文报道的(二聚体)多肽或抗体。
本文报道的一个方面是用作药物的本文报道的(二聚体)多肽或抗体。
本文报道的一个方面是用于治疗血管性眼病的本文报道的(二聚体)多肽或抗体。
本文报道的一个方面是一种药物制剂,其包含本文报道的(二聚体)多肽或抗体和任选的药用载体。
就使用靶向/结合不仅存在于眼中、而且存在于其它身体中的抗原的抗体而言,穿过血眼屏障从眼进入血液中以后短的全身半衰期是有益的,以便避免全身副作用。
另外,如果抗体-抗原复合物从眼除去,即所述抗体充当受体配体从眼出来的运输媒介物并由此抑制受体信号传递,特异性结合受体的配体的抗体仅在眼病的治疗中是有效的。
本发明人已经发现,包含不结合人新生儿Fc-受体的Fc区的抗体(即本文报道的(二聚体)多肽)被运输穿过血眼屏障。这是惊人的,因为所述抗体不会结合人FcRn,尽管与FcRn的结合被认为是跨血眼屏障的运输所需要的。
本文报道的一个方面是本文报道的(二聚体)多肽或抗体用于从眼运输可溶性受体配体经过血眼屏障进入血液循环中的用途。
本文报道的一个方面是本文报道的(二聚体)多肽或抗体用于从眼除去一种或多种可溶性受体配体的用途。
本文报道的一个方面是本文报道的(二聚体)多肽或抗体用于治疗眼病、特别是眼血管疾病的用途。
本文报道的一个方面是本文报道的(二聚体)多肽或抗体用于将一种或多种可溶性受体配体从玻璃体内空间运输至血液循环的用途。
本文报道的一个方面是用于治疗眼病的本文报道的(二聚体)多肽或抗体。
本文报道的一个方面是用于从眼运输可溶性受体配体经过血眼屏障进入血液循环中的本文报道的(二聚体)多肽或抗体。
本文报道的一个方面是用于从眼除去一种或多种可溶性受体配体的本文报道的(二聚体)多肽或抗体。
本文报道的一个方面是用于治疗眼病、特别是眼血管疾病的本文报道的(二聚体)多肽或抗体。
本文报道的一个方面是用于将一种或多种可溶性受体配体从玻璃体内空间运输至血液循环的本文报道的(二聚体)多肽或抗体。
本文报道的一个方面是一种治疗具有眼血管疾病的个体的方法,所述方法包括给所述个体施用有效量的本文报道的(二聚体)多肽或抗体。
本文报道的一个方面是一种用于从眼运输可溶性受体配体经过血眼屏障进入个体的血液循环中的方法,所述方法包括给所述个体施用有效量的本文报道的(二聚体)多肽或抗体以从眼运输可溶性受体配体经过血眼屏障进入血液循环中。
本文报道的一个方面是一种从个体的眼除去一种或多种可溶性受体配体的方法,所述方法包括给所述个体施用有效量的本文报道的(二聚体)多肽或抗体以从眼除去一种或多种可溶性受体配体。
本文报道的一个方面是一种用于将一种或多种可溶性受体配体从玻璃体内空间运输至个体的血液循环的方法,所述方法包括给所述个体施用有效量的本文报道的(二聚体)多肽或抗体以将一种或多种可溶性受体配体从玻璃体内空间运输至血液循环。
本文报道的一个方面是一种用于从玻璃体内空间或眼运输可溶性受体配体经过血眼屏障进入个体的血液循环中的方法,所述方法包括给所述个体施用有效量的本文报道的(二聚体)多肽或抗体以从眼运输可溶性受体配体经过血眼屏障进入血液循环中。
在一个实施方案中,所述(二聚体)多肽是双特异性抗体。在一个实施方案中,所述双特异性抗体是二价双特异性抗体。在一个实施方案中,所述双特异性抗体是四价双特异性抗体。
在一个实施方案中,所述(二聚体)多肽是三特异性抗体。在一个实施方案中,所述三特异性抗体是三价三特异性抗体。在一个实施方案中,所述三特异性抗体是四价三特异性抗体。
在一个实施方案中,所述(二聚体)多肽是CrossMab。
在一个实施方案中,所述(二聚体)多肽是Fc区融合多肽。
在一个实施方案中,所述第一多肽还包含突变Y349C、T366S、L368A和Y407V,且所述第二多肽还包含突变S354C和T366W。
在一个实施方案中,所述第一多肽还包含突变S354C、T366S、L368A和Y407V,且所述第二多肽还包含突变Y349C和T366W。
在一个实施方案中,所述抗体或所述Fc区融合多肽属于亚类IgG1。在一个实施方案中,所述抗体或所述Fc区融合多肽还包含突变L234A和L235A。在一个实施方案中,所述抗体或所述Fc区融合多肽还包含突变P329G。
在一个实施方案中,所述抗体或所述Fc区融合多肽属于亚类IgG2。在一个实施方案中,所述抗体或所述Fc区融合多肽还包含突变V234A、G237A、P238S、H268A、V309L、A330S和P331S。
在一个实施方案中,所述抗体或所述Fc区融合多肽属于亚类IgG4。在一个实施方案中,所述抗体或所述Fc区融合多肽还包含突变S228P和L235E。在一个实施方案中,所述抗体或所述Fc区融合多肽还包含突变P329G。
附图说明
图1:具有IHH-AAA突变(突变I253A、H310A和H435A的组合(根据Kabat EU索引编号系统编号))的IgG1或IgG4亚类的抗-VEGF/ANG2抗体的概念方案和优点。
图2:小规模基于DLS的粘度测量:在200mM精氨酸/琥珀酸盐缓冲液pH 5.5中150mg/mL的推算粘度(抗-VEGF/ANG2抗体VEGF/ANG2-0016(具有IHH-AAA突变)与参考抗体VEGF/ANG2-0015(没有这样的IHH-AAA突变)的对比)。
图3:在20mM组氨酸缓冲液、140mM NaCl、pH 6.0中随温度(包括DLS聚集开始温度)的DLS聚集(本文报道的抗-VEGF/ANG2抗体VEGF/ANG2-0016(具有IHH-AAA突变)与参考抗体VEGF/ANG2-0015(没有这样的IHH-AAA突变)的对比)。
图4:在40℃100mg/mL的七天储存(主峰减少并且高分子量(HMW)增加)(显示较低聚集的本文报道的抗-VEGF/ANG2抗体VEGF/ANG2-0016(具有IHH-AAA突变)与参考抗体VEGF/ANG2-0015(没有这样的IHH-AAA突变)的对比)。
图5A和B:A:VEGF/ANG2-0015(没有IHH-AAA突变)和B:VEGF/ANG2-0016(具有IHH-AAA突变)的FcRn稳态亲和力。
图6:没有IHH-AAA突变的VEGF/ANG2-0015和具有IHH-AAA突变的VEGF/ANG2-0016(二者均是具有P329G LALA突变的IgG1亚类;作为对照,使用IgG1亚类的抗-洋地黄毒苷(digoxigenin)抗体(抗-Dig抗体)和基于IgG4的抗体)的FcγRIIIa相互作用测量。
图7A:用于确定血清和全眼裂解物中抗-VEGF/ANG2抗体的浓度的示意药代动力学(PK)ELISA测定原理。
图7B:静脉内(i.v.)施用后的血清浓度:没有IHH-AAA突变的VEGF/ANG2-0015和具有IHH-AAA突变的VEGF/ANG2-0016的对比。
图7C:玻璃体内应用后的血清浓度:没有IHH-AAA突变的VEGF/ANG2-0015和具有IHH-AAA突变的VEGF/ANG2-0016的对比。
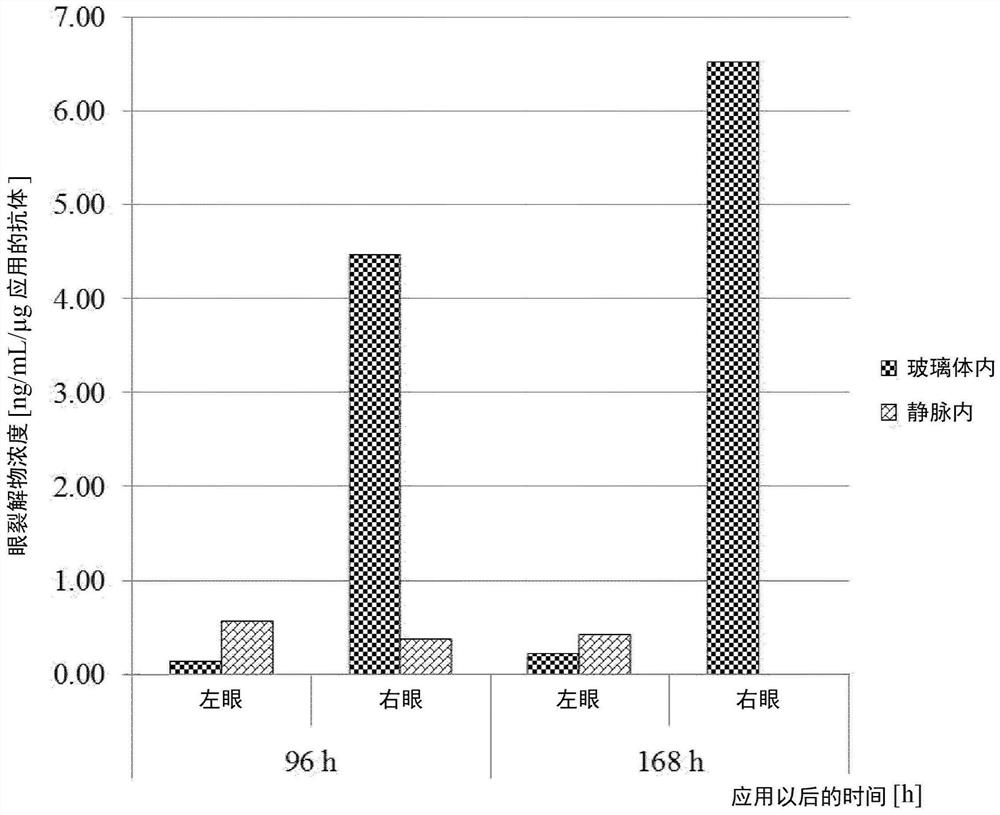
图7D:右眼和左眼中VEGF/ANG2-0016(具有IHH-AAA突变)的眼裂解物浓度(与静脉内应用相比,仅玻璃体内应用于右眼后):在玻璃体内应用后仅可在右眼检测到显著浓度;由于VEGF/ANG2-0016(具有IHH-AAA突变)的低血清半衰期,在静脉施用后在眼裂解物中检测不到浓度。
图7E:右眼和左眼中VEGF/ANG2-0015(没有IHH-AAA突变)的眼裂解物浓度(与静脉内应用相比,仅玻璃体内应用于右眼后):在右眼中(并且在一定程度上在左眼中),玻璃体内应用后可检测到VEGF/ANG2-0015浓度;这指示从右眼扩散入血清并且从那里进入左眼,这可以通过VEGF/ANG2-0015(没有IHH-AAA突变)的长半衰期解释;在静脉内应用后,由于血清稳定的VEGF/ANG2-0015(没有IHH-AAA突变)扩散入眼中,可以在双眼的眼裂解物中都检测到显著的浓度。
图8:与参考野生型(wt)抗体相比,关于其结合FcRn的能力改造的抗体在SPR分析中展示出延长的(YTE突变)或缩短的(IHH-AAA突变)体内半衰期、增强的(YTE突变)或减小的结合(IHH-AAA突变)以及在FcRn柱色谱法中增强或减少的保留时间;a)将10mg/kg单次静脉内推注施用于huFcRn转基因雄性C57BL/6J小鼠+/-276中后的PK数据:野生型IgG以及YTE和IHH-AAA Fc-修饰的IgG的AUC数据;b)BIAcore传感图;c)FcRn亲和柱洗脱;野生型抗-IGF-1R抗体(参考),抗-IGF-1R抗体的YTE-突变体,抗-IGF-1R抗体的IHH-AAA-突变体。
图9:在FcRn亲和色谱法中保留时间随引入Fc区中的突变数量的变化。
图10:FcRn-结合随引入Fc区中的突变的不对称分布的变化。
图11:在两条重链中都具有突变H310A、H433A和Y436A的组合的双特异性抗-VEGF/ANG2抗体(VEGF/ANG2-0121)来自两个连续蛋白A亲和色谱柱的洗脱色谱图。
图12:在两条重链中都具有突变H310A、H433A和Y436A的抗-IGF-1R抗体(IGF-1R-0045)来自蛋白A亲和色谱柱的洗脱色谱图。
图13:IgG Fc区修饰的抗-VEGF/ANG2抗体与在CM5芯片上固定的蛋白A的结合。
图14:不同的抗-VEGF/ANG2抗体在FcRn亲和柱上的洗脱色谱图。
图15:不同的融合多肽与葡萄球菌蛋白A(SPR)的结合。
图16:不同的抗-VEGF/ANG2抗体和抗-IGF-1R抗体突变体与固定的蛋白A(SPR)的结合。
图17:抗体IGF-1R 0033、0035和0045在静脉内应用以后的血清浓度的对比。
图18:玻璃体内和静脉内应用抗体IGF-1R 0033以后眼裂解物浓度的对比。
图19:玻璃体内和静脉内应用抗体IGF-1R 0035以后眼裂解物浓度的对比。
图20:玻璃体内和静脉内应用抗体IGF-1R 0045以后眼裂解物浓度的对比。
具体实施方式
I.定义
术语“约”表示之后接着的数值的±20%的范围。在一个实施方案中术语约表示之后接着的数值的±10%的范围。在一个实施方案中,术语约表示之后接着的数值的±5%的范围。
为了本文的目的的“受体人框架”是包含如下文定义的源自人免疫球蛋白框架或人共有框架的轻链可变结构域(VL)框架或重链可变结构域(VH)框架的氨基酸序列的框架。“源自”人免疫球蛋白框架或人共有框架的受体人框架可以包含其相同氨基酸序列,或它可以含有氨基酸序列改变。在一些实施方案中,氨基酸改变的数量为10或更少、9或更少、8或更少、7或更少、6或更少、5或更少、4或更少、3或更少或2或更少。在一些实施方案中,VL受体人框架与VL人免疫球蛋白框架序列或人共有框架序列在序列上相同。
“亲和力成熟的”抗体表示,与不具有这种改变的亲本抗体相比,在一个或多个高变区(HVR)中具有一个或多个改变的抗体,这种改变导致抗体对抗原的亲和力的改善。
术语“改变”表示亲本抗体或融合多肽(例如至少包含Fc区的FcRn结合部分的融合多肽)中的一个或多个氨基酸残基的突变(置换)、插入(添加)、或缺失,以获得修饰的抗体或融合多肽。术语“突变”表示,指定的氨基酸残基被不同的氨基酸残基置换。例如突变L234A表示,抗体Fc区(多肽)中在位置234处的氨基酸残基赖氨酸被氨基酸残基丙氨酸置换(用丙氨酸置换赖氨酸)(根据Kabat EU索引编号系统编号)。
如本文使用的,重链和轻链的所有恒定区和结构域的氨基酸位置根据Kabat,等人,Sequences of Proteins of Immunological Interest,第5版,Public HealthService,National Institutes of Health,Bethesda,MD(1991)中描述的Kabat编号系统编号,并且在本文中被称作“根据Kabat编号”。具体地,Kabat,等人,Sequences ofProteins of Immunological Interest,第5版,Public Health Service,NationalInstitutes of Health,Bethesda,MD(1991)的Kabat编号系统(参见第647-660页)用于κ和λ同种型的轻链恒定结构域CL,并且Kabat EU索引编号系统(参见第661-723页)用于恒定重链结构域(CH1、铰链、CH2和CH3)。
“天然存在的氨基酸残基”表示来自由以下氨基酸组成的集合的氨基酸残基:丙氨酸(三字母代码:Ala,单字母代码:A),精氨酸(Arg,R),天冬酰胺(Asn,N),天冬氨酸(Asp,D),半胱氨酸(Cys,C),谷氨酰胺(Gln,Q),谷氨酸(Glu,E),甘氨酸(Gly,G),组氨酸(His,H),异亮氨酸(Ile,I),亮氨酸(Leu,L),赖氨酸(Lys,K),甲硫氨酸(Met,M),苯丙氨酸(Phe,F),脯氨酸(Pro,P),丝氨酸(Ser,S),苏氨酸(Thr,T),色氨酸(Trp,W),酪氨酸(Tyr,Y),和缬氨酸(Val,V)。
术语“氨基酸突变”表示至少一个既有氨基酸残基被另一个不同的氨基酸残基(=替代氨基酸残基)置换。所述替代氨基酸残基可以是“天然存在的氨基酸残基”,并且选自:丙氨酸(三字母代码:ala,单字母代码:A),精氨酸(arg,R),天冬酰胺(asn,N),天冬氨酸(asp,D),半胱氨酸(cys,C),谷氨酰胺(gln,Q),谷氨酸(glu,E),甘氨酸(gly,G),组氨酸(his,H),异亮氨酸(ile,I),亮氨酸(leu,L),赖氨酸(lys,K),甲硫氨酸(met,M),苯丙氨酸(phe,F),脯氨酸(pro,P),丝氨酸(ser,S),苏氨酸(thr,T),色氨酸(trp,W),酪氨酸(tyr,Y),和缬氨酸(val,V)。替代氨基酸残基可以是“非天然存在的氨基酸残基”。参见例如US 6,586,207,WO 98/48032,WO 03/073238,US 2004/0214988,WO 2005/35727,WO 2005/74524,Chin,J.W.,等人,J.Am.Chem.Soc.124(2002)9026-9027;Chin,J.W.和Schultz,P.G.,ChemBioChem 11(2002)1135-1137;Chin,J.W.,等人,PICAS United States of America99(2002)11020-11024;和,Wang,L.和Schultz,P.G.,Chem.(2002)1-10(都完全通过引用并入本文)。
术语“氨基酸插入”表示至少一个氨基酸残基在氨基酸序列中在预定的位置处的(额外)掺入。在一个实施方案中,所述插入将是一个或两个氨基酸残基的插入。插入的氨基酸残基可以是任何天然存在的或非天然存在的氨基酸残基。
术语“氨基酸缺失”表示在氨基酸序列中在预定位置处的至少一个氨基酸残基的除去。
本文中使用的术语“ANG-2”表示人血管生成素-2(ANG-2)(可替换地缩写为ANGPT2或ANG2)(SEQ ID NO:31),其描述在例如Maisonpierre,P.C.,等人,Science 277(1997)55-60和Cheung,A.H.,等人,Genomics 48(1998)389-91中。发现血管生成素-1(SEQ ID NO:32)和-2作为Ties的配体,所述Ties是在血管内皮内选择性地表达的酪氨酸激酶家族(Yancopoulos,G.D.,等人,Nature 407(2000)242-248)。现在存在血管生成素家族的四个确定的成员。血管生成素-3和-4(ANG-3和ANG-4)可能代表相同基因座在小鼠和人类中的广泛散布的相应物(Kim,I.,等人,FEBS Let,443(1999)353-356;Kim,I.,等人,J.Biol.Chem.274(1999)26523-26528)。ANG-1和ANG-2最初在组织培养实验中分别被鉴定为激动剂和拮抗剂(对于ANG-1参见:Davis,S.,等人,Cell 87(1996)1161-1169;并且对于ANG-2参见:Maisonpierre,P.C.,等人,Science 277(1997)55-60)。所有已知的血管生成素主要结合Tie2(SEQ ID NO:33),并且ANG-1和-2二者都以3nM(Kd)的亲和力结合Tie2(Maisonpierre,P.C.,等人,Science 277(1997)55-60)。
本文中的术语“抗体”以最宽的含义使用,并且包括各种抗体结构,包括、但不限于单克隆抗体、多特异性抗体(例如双特异性抗体、三特异性抗体)和抗体片段,只要它们呈现期望的抗原-和/或蛋白A和/或FcRn-结合活性。
术语“不对称的Fc区”表示根据Kabat EU索引编号系统在对应位置处具有不同氨基酸残基的Fc区多肽对。
术语“就FcRn结合而言不对称的Fc区”表示由在对应位置处具有不同氨基酸残基的两条多肽链组成的Fc区,其中所述位置根据Kabat EU索引编号系统确定,其中所述不同的位置影响Fc区与人新生儿Fc-受体(FcRn)的结合。为了本文的目的,“就FcRn结合而言不对称的Fc区”中的Fc区的两条多肽链之间的差异不包括为了促进异源二聚体Fc区的形成(例如用于生产双特异性抗体)而已经引入的差异。这些差异也可以是不对称的,即所述两条链在根据Kabat EU索引编号系统的非对应氨基酸残基处具有差异。这些差异会促进异源二聚化并减少同源二聚化。这样的差异的例子是所谓的“凸起-进入-孔洞”置换(参见,例如,US 7,695,936和US 2003/0078385)。已经发现亚类IgG1的IgG抗体的Fc区的各个多肽链中的以下凸起和孔洞置换会增加异源二聚体形成:1)一条链中的Y407T和另一条链中的T366Y;2)一条链中的Y407A和另一条链中的T366W;3)一条链中的F405A和另一条链中的T394W;4)一条链中的F405W和另一条链中的T394S;5)一条链中的Y407T和另一条链中的T366Y;6)一条链中的T366Y和F405A以及另一条链中的T394W和Y407T;7)一条链中的T366W和F405W以及另一条链中的T394S和Y407A;8)一条链中的F405W和Y407A以及另一条链中的T366W和T394S;和9)一条链中的T366W以及另一条链中的T366S、L368A和Y407V,其中最后列出的是特别适合的。另外,在两条Fc区多肽链之间建立新二硫键的变化会促进异源二聚体形成(参见,例如,US 2003/0078385)。已经发现以下导致适当隔开的半胱氨酸残基(用于形成亚类IgG1的IgG抗体的Fc区的各个多肽链中新的链内二硫键)的置换会增加异源二聚体形成:一条链中的Y349C和另一条链中的S354C;一条链中的Y349C和另一条链中的E356C;一条链中的Y349C和另一条链中的E357C;一条链中的L351C和另一条链中的S354C;一条链中的T394C和另一条链中的E397C;或一条链中的D399C和另一条链中的K392C。促进氨基酸改变的异源二聚化的其它例子是所谓的“电荷对置换”(参见,例如,WO 2009/089004)。已经发现亚类IgG1的IgG抗体的Fc区的各个多肽链中的以下电荷对置换会增加异源二聚体形成:1)一条链中的K409D或K409E和另一条链中的D399K或D399R;2)一条链中的K392D或K392E和另一条链中的D399K或D399R;3)一条链中的K439D或K439E和另一条链中的E356K或E356R;4)一条链中的K370D或K370E和另一条链中的E357K或E357R;5)一条链中的K409D和K360D加上另一条链中的D399K和E356K;6)一条链中的K409D和K370D加上另一条链中的D399K和E357K;7)一条链中的K409D和K392D加上另一条链中的D399K、E356K和E357K;8)一条链中的K409D和K392D以及另一条链中的D399K;9)一条链中的K409D和K392D以及另一条链中的D399K和E356K;10)一条链中的K409D和K392D以及另一条链中的D399K和D357K;11)一条链中的K409D和K370D以及另一条链中的D399K和D357K;12)一条链中的D399K以及另一条链中的K409D和K360D;和13)一条链中的K409D和K439D以及另一条链上的D399K和E356K。
术语“结合(抗原)”表示在体外测定中抗体与其抗原的结合,在一个实施方案中,在结合测定中,将抗体结合至表面并且通过表面等离子体共振(SPR)测量抗原对所述抗体的结合。结合是指10
可以通过BIAcore测定(GE Healthcare Biosensor AB,Uppsala,Sweden)来研究结合。结合亲和力由术语k
术语“嵌合的”抗体表示这样的抗体:其中重链和/或轻链的一部分源自特定来源或物种,同时重链和/或轻链的剩余部分源自不同的来源或物种。
术语“CH2-结构域”表示大约从EU位置231延伸至EU位置340(根据Kabat的EU编号系统)的抗体重链多肽的部分。在一个实施方案中,CH2结构域具有SEQ ID NO:09的氨基酸序列:APELLGG PSVFLFPPKP KDTLMISRTP EVTCVWDVS HEDPEVKFNW YVDGVEVHNA KTKPREEQESTYRWSVLT VLHQDWLNGK EYKCKVSNKA LPAPIEKTIS KAK.
术语“CH3-结构域”表示大约从EU位置341延伸至EU位置446的抗体重链多肽的部分。在一个实施方案中,CH3结构域具有SEQ ID NO:10的氨基酸序列:
GQPREPQ VYTLPPSRDE LTKNQVSLTC LVKGFYPSDI AVEWESNGQP ENNYKTTPPVLDSDGSFFLY SKLTVDKSRW QQGNVFSCSV MHEALHNHYT QKSLSLSPG。
抗体的“类型”表示其重链具有的恒定结构域或恒定区的类型。存在五种主要的抗体类型:IgA、IgD、IgE、IgG和IgM,并且这些中的一些可以进一步分为亚类(同种型),例如,IgG
术语“可比较的长度”表示,两个多肽包含相等数目的氨基酸残基或可以在长度上相差一个或多个并且至多多至10个氨基酸残基。在一个实施方案中,所述(Fc区)多肽包含相等数目的氨基酸残基或相差1至10个氨基酸残基的数目。在一个实施方案中,所述(Fc区)多肽包含相等数目的氨基酸残基或相差1至5个氨基酸残基的数目。在一个实施方案中,所述(Fc区)多肽包含相等数目的氨基酸残基或相差1至3个氨基酸残基的数目。
“效应子功能”表示可归因于抗体的Fc区的那些生物活性,其随抗体类型改变。抗体效应子功能的例子包括:C1q结合和补体依赖性的细胞毒性(CDC);Fc受体结合;抗体依赖性的细胞介导的细胞毒性(ADCC);吞噬作用;细胞表面受体(例如B细胞受体)的下调;和B-细胞活化。
试剂(例如,药物制剂)的“有效量”表示在必要的剂量和持续必要的时间段,有效地实现期望的治疗或预防结果的量。
术语“Fc-融合多肽”表示结合结构域(例如抗原结合结构域诸如单链抗体或多肽诸如受体的配体)与呈现期望的靶标-、蛋白A-和FcRn-结合活性的抗体Fc区的融合。
术语“人源的Fc区”表示人源的免疫球蛋白重链的C-端区域,其至少含有铰链区的一部分、CH2结构域和CH3结构域。在一个实施方案中,人IgG重链Fc区从Cys226或从Pro230延伸至重链的羧基端。在一个实施方案中,所述Fc区具有SEQ ID NO:60的氨基酸序列。但是,Fc区的C-端赖氨酸(Lys447)可以存在或可以不存在。
术语“FcRn”表示人新生儿Fc-受体。FcRn行使功能以从溶酶体降解途径营救IgG,从而导致降低的清除率和增加的半衰期。FcRn是一种由两个多肽组成的异源二聚体蛋白:50kDa的I类主要组织相容性复合物-样蛋白(α-FcRn)和15kDa的β2-微球蛋白(β2m)。FcRn以高亲和力结合IgG的Fc区的CH2-CH3部分。IgG和FcRn之间的相互作用是严格pH依赖性的,并且以1∶2化学计量学发生,一个IgG通过它的两条重链结合两个FcRn分子(Huber,A.H.,等人,J.Mol.Biol.230(1993)1077-1083)。FcRn结合在核内体中在酸性pH(pH<6.5)发生,并且IgG在中性细胞表面(约7.4的pH)释放。所述相互作用的pH-敏感的性质会促进在核内体的酸性环境内通过结合受体来进行从细胞内降解摄取(pinocytose)入细胞的IgG的FcRn介导的保护。FcRn随后促进IgG再循环到细胞表面并随后在将FcRn-IgG复合物暴露于细胞外的中性pH环境后释放到血流中。
术语“Fc区的FcRn结合部分”表示大约从EU位置243延伸至EU位置261和大约从EU位置275延伸至EU位置293和大约从EU位置302延伸至EU位置319和大约从EU位置336延伸至EU位置348和大约从EU位置367延伸至EU位置393和EU位置408以及大约从EU位置424延伸至EU位置440的抗体重链多肽的部分。在一个实施方案中,根据Kabat的EU编号的以下氨基酸残基中的一个或多个被改变:F243、P244、P245P、K246、P247、K248、D249、T250、L251、M252、I253、S254、R255、T256、P257、E258、V259、T260、C261、F275、N276、W277、Y278、V279、D280、V282、E283、V284、H285、N286、A287、K288、T289、K290、P291、R292、E293、V302、V303、S304、V305、L306、T307、V308、L309、H310、Q311、D312、W313、L314、N315、G316、K317、E318、Y319、I336、S337、K338、A339、K340、G341、Q342、P343、R344、E345、P346、Q347、V348、C367、V369、F372、Y373、P374、S375、D376、1377、A378、V379、E380、W381、E382、S383、N384、G385、Q386、P387、E388、N389、Y391、T393、S408、S424、C425、S426、V427、M428、H429、E430、A431、L432、H433、N434、H435、Y436、T437、Q438、K439和S440(EU编号)。
“框架”或“FR”表示除了高变区(HVR)残基之外的可变结构域残基。可变结构域的FR通常由四个FR结构域组成:FR1、FR2、FR3和FR4。因此,HVR和FR序列通常出现在VH(或VL)中的以下序列中:FR1-H1(L1)-FR2-H2(L2)-FR3-H3(L3)-FR4。
术语“全长抗体”表示这样的抗体:其具有与包含4个多肽的天然抗体结构基本上类似的结构,或具有含有如本文中定义的Fc区的重链。全长抗体可以包含其它结构域,例如与全长抗体的一个或多个链缀合的scFv或scFab。这些缀合物也被包括在术语全长抗体中。
术语“二聚体多肽”表示包含至少两个共价地结合的多肽的复合物。所述复合物可以包含也与其它多肽共价地或非共价地结合的其它多肽。在一个实施方案中,所述二聚体多肽包含两个或四个多肽。
术语“异源二聚体”或“异源二聚体的”表示包含两个多肽(例如具有可比较的长度的多肽)的分子,其中所述两个多肽具有在对应位置具有至少一个不同氨基酸残基的氨基酸序列,其中所述对应位置根据Kabat EU索引编号系统来确定。
术语“同源二聚体”和“同源二聚体的”表示包含两个具有可比较长度的多肽的分子,其中所述两个多肽具有在对应位置相同的氨基酸序列,其中所述对应位置根据KabatEU索引编号系统来确定。
本文报道的二聚体多肽可以是同源二聚体的或异源二聚体的,根据关注的突变或性质而确定。例如,就FcRn和/或蛋白A结合(即关注的性质)而言,二聚体多肽就突变H310A、H433A和Y436A(就二聚体多肽的FcRn和/或蛋白A结合性质而言,这些突变得到关注)是同源二聚体的(即二聚体多肽的两个多肽都包含这些突变),但是同时,分别就突变Y349C、T366S、L368A和Y407V(因为这些突变针对二聚体多肽的异源二聚化并且不针对FcRn/蛋白A结合性质,这些突变不受关注)以及突变S354C和T366W(第一组仅包含在第一多肽中,而第二组仅包含在第二多肽中)而言,是异源二聚体的。此外,例如,本文报道的二聚体多肽就突变I253A、H310A、H433A、H435A和Y436A(即这些突变全部针对二聚体多肽的FcRn和/或蛋白A结合性质)而言可以是异源二聚体的,即一个多肽包含突变I253A、H310A和H435A,而其它多肽包含突变H310A、H433A和Y436A。
术语“宿主细胞”、“宿主细胞系”和“宿主细胞培养物”互换使用,且表示其中已经引入外源核酸的细胞,包括这种细胞的后代。宿主细胞包括“转化体”和“转化的细胞”,其包括原代转化的细胞和由其衍生的后代(不考虑传代数)。后代在核酸内容物方面可以与亲本细胞不完全相同,但是可以含有突变。针对最初转化的细胞筛选或选择的具有相同功能或生物活性的突变体后代被包括在本文中。
“人抗体”是这样的抗体:其氨基酸序列对应于由人或人细胞产生的抗体或源自利用人抗体组库或其它人抗体编码序列的非人来源的抗体的氨基酸序列。该人抗体的定义特别排除了包含非人抗原结合残基的人源化抗体。
“人共有框架”是代表在人免疫球蛋白VL或VH框架序列的选择中最常出现的氨基酸残基的框架。通常,从可变结构域序列的亚组选择人免疫球蛋白VL或VH序列。通常,序列的亚组是如Kabat,E.A.等人,Sequences of Proteins of Immunological Interest,第5版,Bethesda MD(1991),NIH Publication 91-3242,第1-3卷中的亚组。在一个实施方案中,对于VL,所述亚组是如在Kabat等人(出处同上)中的亚组κI。在一个实施方案中,对于VH,所述亚组是如在Kabat等人(出处同上)中的亚组III。
术语“源自”表示通过在至少一个位置处引入改变而从亲本氨基酸序列衍生出的氨基酸序列。因此,衍生的氨基酸序列在至少一个对应位置(根据抗体Fc区的Kabat EU索引编号)处不同于对应的亲本氨基酸序列。在一个实施方案中,从亲本氨基酸序列衍生出的氨基酸序列在对应位置处相差一至十五个氨基酸残基。在一个实施方案中,从亲本氨基酸序列衍生出的氨基酸序列在对应位置处相差一至十个氨基酸残基。在一个实施方案中,从亲本氨基酸序列衍生出的氨基酸序列在对应位置处相差一至六个氨基酸残基。同样,衍生的氨基酸序列与其亲本氨基酸序列具有高氨基酸序列同一性。在一个实施方案中,从亲本氨基酸序列衍生出的氨基酸序列具有80%或更高的氨基酸序列同一性。在一个实施方案中,从亲本氨基酸序列衍生出的氨基酸序列具有90%或更高的氨基酸序列同一性。在一个实施方案中,从亲本氨基酸序列衍生出的氨基酸序列具有95%或更高的氨基酸序列同一性。
术语“人Fc区多肽”表示与“天然的”或“野生型”人Fc区多肽相同的氨基酸序列。术语“变体(人)Fc区多肽”表示由于至少一个“氨基酸改变”而从“天然的”或“野生型”人Fc区多肽衍生出的氨基酸序列。“人Fc区”由两个人Fc区多肽组成。“变体(人)Fc区”由两个Fc区多肽组成,其中二者可以是变体(人)Fc区多肽,或者一个是人Fc区多肽并且另一个是变体(人)Fc区多肽。
在一个实施方案中,人Fc区多肽具有包含本文报道的突变的以下Fc区多肽的氨基酸序列:SEQ ID NO:60的人IgG1 Fc区多肽,或SEQ ID NO:61的人IgG2 Fc区多肽,或SEQ IDNO:63的人IgG4 Fc区多肽。在一个实施方案中,所述变体(人)Fc区多肽源自SEQ ID NO:60或61或63的Fc区多肽,并且与SEQ ID NO:60或61或63的Fc区多肽相比具有至少一个氨基酸突变。在一个实施方案中,所述变体(人)Fc区多肽包含/具有约一至约十个氨基酸突变,并且在一个实施方案中,包含/具有约一至约五个氨基酸突变。在一个实施方案中,所述变体(人)Fc区多肽与SEQ ID NO:60或61或63的人Fc区多肽具有至少约80%同源性。在一个实施方案中,所述变体(人)Fc区多肽与SEQ ID NO:60或61或63的人Fc区多肽具有至少约90%同源性。在一个实施方案中,所述变体(人)Fc区多肽与SEQ ID NO:60或61或63的人Fc区多肽具有至少约95%同源性。
源自SEQ ID NO:60或61或63的人Fc区多肽的变体(人)Fc区多肽由含有的氨基酸改变限定。因此,例如,术语P329G表示与SEQ ID NO:60或61或63的人Fc区多肽相比,在氨基酸位置329处具有脯氨酸至甘氨酸的突变的变体(人)Fc区多肽衍生的人Fc区多肽。
关于在本发明中讨论的所有位置,编号是根据Kabat EU索引编号系统。
人IgG1 Fc区多肽具有以下氨基酸序列:
DKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK(SEQ ID NO:60)。
具有突变L234A、L235A的人IgG1 Fc区衍生的Fc区多肽具有以下氨基酸序列:
DKTHTCPPCPAPEAAGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK(SEQ ID NO:64)。
具有Y349C、T366S、L368A和Y407V突变的人IgG1 Fc区衍生的Fc区多肽具有以下氨基酸序列:
DKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVCTLPPSRDELTKNQVSLSCAVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLVSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK(SEQ ID NO:65)。
具有S354C、T366W突变的人IgG1 Fc区衍生的Fc区多肽具有以下氨基酸序列:
DKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPCRDELTKNQVSLWCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK(SEQ ID NO:66)。
具有L234A、L235A突变和Y349C、T366S、L368A、Y407V突变的人IgG1 Fc区衍生的Fc区多肽具有以下氨基酸序列:
DKTHTCPPCPAPEAAGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVCTLPPSRDELTKNQVSLSCAVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLVSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK(SEQ JD NO:67)。
具有L234A、L235A和S354C、T366W突变的人IgG1 Fc区衍生的Fc区多肽具有以下氨基酸序列:
DKTHTCPPCPAPEAAGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPCRDELTKNQVSLWCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK(SEQ ID NO:68)。
具有P329G突变的人IgG1 Fc区衍生的Fc区多肽具有以下氨基酸序列:
DKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALGAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK(SEQ ID NO:69)。
具有L234A、L235A突变和P329G突变的人IgG1 Fc区衍生的Fc区多肽具有以下氨基酸序列:
DKTHTCPPCPAPEAAGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALGAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK(SEQ ID NO:70)。
具有P239G突变和Y349C、T366S、L368A、Y407V突变的人IgG1 Fc区衍生的Fc区多肽具有以下氨基酸序列:
DKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALGAPIEKTISKAKGQPREPQVCTLPPSRDELTKNQVSLSCAVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLVSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK(SEQ ID NO:71)。
具有P329G突变和S354C、T366W突变的人IgG1 Fc区衍生的Fc区多肽具有以下氨基酸序列:
DKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALGAPIEKTISKAKGQPREPQVYTLPPCRDELTKNQVSLWCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK(SEQ ID NO:72)。
具有L234A、L235A、P329G和Y349C、T366S、L368A、Y407V突变的人IgG1 Fc区衍生的Fc区多肽具有以下氨基酸序列:
DKTHTCPPCPAPEAAGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALGAPIEKTISKAKGQPREPQVCTLPPSRDELTKNQVSLSCAVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLVSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK(SEQ ID NO:73)。
具有L234A、L235A、P329G突变和S354C、T366W突变的人IgG1 Fc区衍生的Fc区多肽具有以下氨基酸序列:
DKTHTCPPCPAPEAAGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALGAPIEKTISKAKGQPREPQVYTLPPCRDELTKNQVSLWCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK(SEQ ID NO:74)。
人IgG4 Fc区多肽具有以下氨基酸序列:
ESKYGPPCPSCPAPEFLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSQEDPEVQFNWYVDGVEVHNAKTKPREEQFNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKGLPSSIEKTISKAKGQPREPQVYTLPPSQEEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSRLTVDKSRWQEGNVFSCSVMHEALHNHYTQKSLSLSLGK(SEQ ID NO:63)。
具有S228P和L235E突变的人IgG4 Fc区衍生的Fc区多肽具有以下氨基酸序列:
ESKYGPPCPPCPAPEFEGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSQEDPEVQFNWYVDGVEVHNAKTKPREEQFNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKGLPSSIEKTISKAKGQPREPQVYTLPPSQEEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSRLTVDKSRWQEGNVFSCSVMHEALHNHYTQKSLSLSLGK(SEQ ID NO:75)。
具有S228P、L235E突变和P329G突变的人IgG4 Fc区衍生的Fc区多肽具有以下氨基酸序列:
ESKYGPPCPPCPAPEFEGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSQEDPEVQFNWYVDGVEVHNAKTKPREEQFNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKGLGSSIEKTISKAKGQPREPQVYTLPPSQEEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSRLTVDKSRWQEGNVFSCSVMHEALHNHYTQKSLSLSLGK(SEQ ID NO:76)。
具有S354C、T366W突变的人IgG4 Fc区衍生的Fc区多肽具有以下氨基酸序列:
ESKYGPPCPSCPAPEFLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSQEDPEVQFNWYVDGVEVHNAKTKPREEQFNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKGLPSSIEKTISKAKGQPREPQVYTLPPCQEEMTKNQVSLWCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSRLTVDKSRWQEGNVFSCSVMHEALHNHYTQKSLSLSLGK(SEQ ID NO:77)。
具有Y349C、T366S、L368A、Y407V突变的人IgG4 Fc区衍生的Fc区多肽具有以下氨基酸序列:
ESKYGPPCPSCPAPEFLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSQEDPEVQFNWYVDGVEVHNAKTKPREEQFNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKGLPSSIEKTISKAKGQPREPQVCTLPPSQEEMTKNQVSLSCAVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLVSRLTVDKSRWQEGNVFSCSVMHEALHNHYTQKSLSLSLGK(SEQ ID NO:78)。
具有S228P、L235E和S354C、T366W突变的人IgG4 Fc区衍生的Fc区多肽具有以下氨基酸序列:
ESKYGPPCPPCPAPEFEGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSQEDPEVQFNWYVDGVEVHNAKTKPREEQFNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKGLPSSIEKTISKAKGQPREPQVYTLPPCQEEMTKNQVSLWCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSRLTVDKSRWQEGNVFSCSVMHEALHNHYTQKSLSLSLGK(SEQ ID NO:79)。
具有S228P、L235E和Y349C、T366S、L368A、Y407V突变的人IgG4 Fc区衍生的Fc区多肽具有以下氨基酸序列:
ESKYGPPCPPCPAPEFEGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSQEDPEVQFNWYVDGVEVHNAKTKPREEQFNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKGLPSSIEKTISKAKGQPREPQVCTLPPSQEEMTKNQVSLSCAVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLVSRLTVDKSRWQEGNVFSCSVMHEALHNHYTQKSLSLSLGK(SEQ ID NO:80)。
具有P329G突变的人IgG4 Fc区衍生的Fc区多肽具有以下氨基酸序列:
ESKYGPPCPSCPAPEFLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSQEDPEVQFNWYVDGVEVHNAKTKPREEQFNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKGLGSSIEKTISKAKGQPREPQVYTLPPSQEEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSRLTVDKSRWQEGNVFSCSVMHEALHNHYTQKSLSLSLGK(SEQ ID NO:81)。
具有P239G和Y349C、T366S、L368A、Y407V突变的人IgG4 Fc区衍生的Fc区多肽具有以下氨基酸序列:
ESKYGPPCPSCPAPEFLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSQEDPEVQFNWYVDGVEVHNAKTKPREEQFNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKGLGSSIEKTISKAKGQPREPQVCTLPPSQEEMTKNQVSLSCAVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLVSRLTVDKSRWQEGNVFSCSVMHEALHNHYTQKSLSLSLGK(SEQ ID NO:82)。
具有P329G和S354C、T366W突变的人IgG4 Fc区衍生的Fc区多肽具有以下氨基酸序列:
ESKYGPPCPSCPAPEFLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSQEDPEVQFNWYVDGVEVHNAKTKPREEQFNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKGLGSSIEKTISKAKGQPREPQVYTLPPCQEEMTKNQVSLWCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSRLTVDKSRWQEGNVFSCSVMHEALHNHYTQKSLSLSLGK(SEQ ID NO:83)。
具有S228P、L235E、P329G和Y349C、T366S、L368A、Y407V突变的人IgG4 Fc区衍生的Fc区多肽具有以下氨基酸序列:
ESKYGPPCPPCPAPEFEGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSQEDPEVQFNWYVDGVEVHNAKTKPREEQFNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKGLGSSIEKTISKAKGQPREPQVCTLPPSQEEMTKNQVSLSCAVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLVSRLTVDKSRWQEGNVFSCSVMHEALHNHYTQKSLSLSLGK(SEQ ID NO:84)。
具有S228P、L235E、P329G和S354C、T366W突变的人IgG4 Fc区衍生的Fc区多肽具有以下氨基酸序列:
ESKYGPPCPPCPAPEFEGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSQEDPEVQFNWYVDGVEVHNAKTKPREEQFNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKGLGSSIEKTISKAKGQPREPQVYTLPPCQEEMTKNQVSLWCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSRLTVDKSRWQEGNVFSCSVMHEALHNHYTQKSLSLSLGK(SEQ ID NO:85)。
下面显示了不同的人Fc区的比对(Kabat EU索引编号系统):
“人源化的”抗体表示包含来自非人HVR的氨基酸残基和来自人FR的氨基酸残基的嵌合抗体。在某些实施方案中,人源化抗体将包含基本上全部的至少一个和通常两个可变结构域,其中所有或基本上所有的HVR(例如,CDR)对应于非人抗体的HVR,并且所有或基本上所有FR对应于人抗体的FR。人源化抗体任选地可以包含源自人抗体的抗体恒定区的至少一部分。抗体(例如,非人抗体)的“人源化形式”表示已经经历人源化的抗体。
本文中使用的术语“高变区”或“HVR”表示抗体可变结构域的在序列上高变(“互补性决定区”或“CDR”)并且形成在结构上确定的环(“高变环”)和/或含有与抗原接触残基(“抗原接触点”)的每个区域。通常,抗体包含六个HVR;三个在VH中(H1、H2、H3),并且三个在VL(L1、L2、L3)中。本文中提及的HVR包括
(a)在氨基酸残基26-32(L1)、50-52(L2)、91-96(L3)、26-32(H1)、53-55(H2)和96-101(H3)处存在的高变环(Chothia,C.和Lesk,A.M.,J.Mol.Biol.196(1987)901-917);
(b)在氨基酸残基24-34(L1)、50-56(L2)、89-97(L3)、31-35b(H1)、50-65(H2)和95-102(H3)处存在的CDR(Kabat,E.A.等人,Sequences of Proteins of ImmunologicalInterest,第5版Public Health Service,National Institutes of Health,Bethesda,MD(1991),NIH Publication 91-3242.);
(c)在氨基酸残基27c-36(L1)、46-55(L2)、89-96(L3)、30-35b(H1)、47-58(H2)和93-101(H3)处存在的抗原接触点(MacCallum等人.J.Mol.Biol.262:732-745(1996));和
(d)(a)、(b)和/或(c)的组合,其包括HVR氨基酸残基46-56(L2)、47-56(L2)、48-56(L2)、49-56(L2)、26-35(H1)、26-35b(H1)、49-65(H2)、93-102(H3)和94-102(H3)。
除非另有说明,可变结构域中的HVR残基和其它残基(例如,FR残基)在本文中根据Kabat EU索引编号系统(Kabat等人,出处同上)编号。
除非另外指出,本文中使用的术语“IGF-1R”表示来自任何脊椎动物来源的任意天然的IGF-1R,所述脊椎动物来源包括哺乳动物诸如灵长类动物(例如人类)和啮齿类动物(例如,小鼠和大鼠)。该术语包括“全长的”、未加工的IGF-1R以及从细胞中的加工产生的任意形式的IGF-1R。该术语还包括IGF-1R的天然存在的变体,例如,剪接变体或等位基因变体。人IGF-1R的氨基酸序列显示在SEQ ID NO:11中。
“个体”或“受试者”是哺乳动物。哺乳动物包括、但不限于,驯养动物(例如牛、绵羊、猫、狗和马),灵长类动物(例如,人和非人灵长类动物诸如猴),兔,和啮齿类动物(例如,小鼠和大鼠)。在某些实施方案中,所述个体或受试者是人。
“分离的”抗体是已经与它的天然环境的组分分离的抗体。在一些实施方案中,将抗体纯化至大于95%或99%纯度,所述纯度通过例如电泳(例如,SDS-PAGE、等电聚焦(IEF)、毛细管电泳)或色谱(例如,尺寸排阻色谱法、离子交换或反相HPLC)确定。关于评价抗体纯度的方法的综述,参见,例如,Flatman,S.等人,J.Chrom.B 848(2007)79-87。
“分离的”核酸表示已经与它的天然环境的组分分离的核酸分子。分离的核酸包括通常含有核酸分子的细胞中包含的核酸分子,但是所述核酸分子存在于染色体外或在不同于其天然染色体位置的染色体位置。
“分离的编码抗-IGF-1R抗体的核酸”表示编码抗体重链和轻链(或其片段)的一个或多个核酸分子,包括在单个载体或分开的载体中的这样的核酸分子、以及存在于宿主细胞中的一个或多个位置的这样的核酸分子。
本文中使用的术语“单克隆抗体”表示得自基本上同源的抗体的群体的抗体,即,构成所述群体的各个抗体是相同的和/或结合相同表位,除了可能的变体抗体(例如,含有天然存在的突变或在单克隆抗体制品的生产过程中产生)以外,这样的变体通常以微量存在。与通常包括针对不同决定簇(表位)的不同抗体的多克隆抗体制品不同,单克隆抗体制品的每种单克隆抗体针对抗原上的单个决定簇。因而,修饰语“单克隆”指示所述抗体得自基本上同源的抗体群体的特征,并且不应解释为需要通过任何特定方法生产所述抗体。例如,要根据本发明使用的单克隆抗体可以通过多种技术来制备,所述技术包括、但不限于杂交瘤方法、重组DNA方法、噬菌体展示方法、和使用包含人免疫球蛋白基因座的全部或部分的转基因动物的方法,本文描述了这样的方法和其它示例性的制备单克隆抗体的方法。
“天然抗体”表示具有不同结构的天然存在的免疫球蛋白分子。例如,天然IgG抗体是约150,000道尔顿的异源四聚体糖蛋白,由二硫键合的两条相同的轻链和两条相同的重链组成。从N-端至C-端,每个重链具有可变区(VH),也称为可变重结构域或重链可变结构域,接着是三个恒定结构域(CH1、CH2和CH3)。类似地,从N-端至C-端,每个轻链具有可变区(VL),也称为可变轻结构域或轻链可变结构域,接着是恒定轻(CL)结构域。抗体的轻链可以基于其恒定结构域的氨基酸序列归入两种类型(称为kappa(κ)和lambda(λ))中的一种。
术语“包装说明书”用于表示治疗性产品的商业包装中通常包括的指令,其含有关于这样的治疗性产品的使用的适应症、用法、剂量、施用、联合治疗、禁忌和/或告诫的信息。
就参考多肽序列而言的“氨基酸序列同一性百分比(%)”被定义为,比对所述序列,如果必要的话引入间隙以实现最大序列同一性百分比,且不考虑任何保守置换作为序列同一性的一部分,候选序列中与参考多肽序列中的氨基酸残基相同的氨基酸残基的百分比。用于确定氨基酸序列同一性百分比的目的的比对可以以本领域技术中的多种方式实现,例如,使用公众可得到的计算机软件诸如BLAST、BLAST-2、ALIGN或Megalign(DNASTAR)软件。本领域技术人员可以确定用于比对序列的适当参数,包括实现在要对比的序列的全长上的最大对齐所需的任何算法。但是,为了本文的目的,使用序列对比计算机程序ALIGN-2产生%氨基酸序列同一性值。ALIGN-2序列对比计算机程序由Genentech,Inc.创造,并且源代码已经在美国版权局,Washington D.C.,20559与用户文档一起提交,其在美国版权登记号TXU510087下登记。ALIGN-2程序可以从Genentech,Inc.,South San Francisco,California公开获得,或可以从源代码编译。应该编译ALIGN-2程序以在UNIX操作系统(包括数字UNIX V4.0D)上使用。所有序列对比参数由ALIGN-2程序设定并且不改变。
在采用ALIGN-2进行氨基酸序列对比的情况下,如下计算给定氨基酸序列A相对、与、或针对给定氨基酸序列B的%氨基酸序列同一性(其可以可替换地叙述为相对、与、或针对给定氨基酸序列B具有或包含特定%氨基酸序列同一性的给定氨基酸序列A):
100×分数X/Y
其中X是通过序列比对程序ALIGN-2(在该程序的A和B的比对中)评分为相同匹配的氨基酸残基的数目,并且其中Y是B中的氨基酸残基的总数。应当理解,在氨基酸序列A的长度不等于氨基酸序列B的长度的情况下,A相对B的%氨基酸序列同一性将不等于B相对A的%氨基酸序列同一性。除非另外特别说明,本文使用的所有%氨基酸序列同一性值如在紧邻的上一段中所述使用ALIGN-2计算机程序获得。
术语“药物制剂”表示这样的制品:其呈使得包含在其中的活性成分的生物活性有效的形式,并且所述制剂不含有对所述制剂要施用的受试者有不可接受的毒性的额外组分。
“药用载体”表示药物制剂中除了活性成分之外的成分,其对受试者无毒。药用载体包括、但不限于缓冲剂、赋形剂、稳定剂或防腐剂。
本文中使用的术语“肽接头”表示具有特定氨基酸序列的肽,在一个实施方案中,其是合成来源的。在一个实施方案中,肽接头是具有至少30个氨基酸长度的氨基酸序列的肽,在一个实施方案中,具有32至50个氨基酸长度。在一个实施方案中,所述肽接头是具有32至40个氨基酸长度的氨基酸序列的肽。在一个实施方案中,所述肽接头是(G
本文中使用的术语“重组抗体”表示通过重组方式制备、表达、建立或分离的所有抗体(嵌合的、人源化的和人的)。这包括分离自宿主细胞(诸如NS0或CHO细胞)或分离自对于人免疫球蛋白基因而言转基因的动物(例如小鼠)的抗体或使用转染进宿主细胞中的重组表达载体表达的抗体。这样的重组抗体具有重新排列形式的可变区和恒定区。可以对重组抗体进行体内体细胞高突变。因此,重组抗体的VH和VL区的氨基酸序列是这样的序列:其尽管源自人种系VH和VL序列且与人种系VH和VL序列相关,但是不可能天然地存在于体内人抗体种系组库内。
本文中使用的“治疗(treatment)”(和其语法变体诸如“治疗(treat)”或“治疗(treating)”)表示试图改变治疗的个体的天然进程的临床干预,并且可以为了预防或在临床病理学进程中执行。期望的治疗效果包括、但不限于:防止疾病的发生或复发,缓解征状,减少疾病的任何直接或间接病理学后果,防止转移,降低疾病进展的速度,改善或减轻疾病状态,以及减轻或改善的预后。在一些实施方案中,本文报道的抗体或Fc区融合多肽用于延迟疾病的发展或减缓疾病的进展。
本申请中使用的术语“化合价的”表示指定数目的结合位点在(抗体)分子中的存在。这样,术语“二价”、“四价”和“六价”表示两个结合位点、四个结合位点和六个结合位点分别在(抗体)分子中的存在。在一个优选实施方案中,本文报道的双特异性抗体是“二价的”。
术语“可变区”或“可变结构域”表示抗体重链或轻链中参与所述抗体与其抗原的结合的结构域。抗体的重链和轻链的可变结构域(分别是VH和VL)通常具有类似的结构,每个结构域包含四个框架区(FR)和三个高变区(HVR)(参见,例如,Kindt,T.J.等人.KubyImmunology,第6版,W.H.Freeman and Co.,N.Y.(2007),第91页)。单个VH或VL结构域可能足以赋予抗原-结合特异性。此外,结合特定抗原的抗体可以使用来自结合所述抗原的抗体的VH或VL结构域分离,以分别筛选互补VL或VH结构域的文库(参见,例如,Portolano,S.等人,J.Immunol.150(1993)880-887;Clackson,T.等人,Nature 352(1991)624-628)。
术语“眼血管疾病”包括、但不限于眼内新生血管综合征(intraocularneovascular syndromes)如糖尿病性视网膜病变(diabetic retinopathy),糖尿病性黄斑水肿(diabetic macular edema),早产儿视网膜病变(retinopathy of prematurity),新生血管性青光眼(neovascular glaucoma),视网膜静脉闭塞(retinal vein occlusions),视网膜中央静脉闭塞(central retinal vein occlusions),黄斑变性(maculardegeneration),年龄相关的黄斑变性(age-related macular degeneration),色素性视网膜炎(retinitis pigmentosa),视网膜血管瘤样增生(retinal angiomatousproliferation),黄斑毛细血管扩张症(macular telangectasia),缺血性视网膜病变(ischemic retinopathy),虹膜新生血管形成(irisneovascularization),眼内新生血管形成(intraocular neovascularization),角膜新生血管形成(cornealneovascularization),视网膜新生血管形成(retinal neovascularization),脉络膜新生血管形成(choroidalneovascularization),和视网膜变性(retinal degeneration)(参见例如Garner,A.,Vascular diseases,见:Pathobiology of ocular disease,A dynamicapproach,Garner,A.,和Klintworth,G.K.,(编),第2版,Marcel Dekker,New York(1994),第1625-1710页)。
本文中使用的术语“载体”表示能够扩增与其连接的另一核酸的核酸分子。该术语包括作为自我复制的核酸结构的载体以及整合进它已经引入其中的宿主细胞的基因组中的载体。某些载体能够指导与其可操作地连接的核酸的表达。这样的载体在本文被称为“表达载体”。
本文中使用的术语“VEGF”表示人血管内皮生长因子(VEGF/VEGF-A),165-氨基酸人血管内皮细胞生长因子(人VEGF165:SEQ ID NO:30的前体序列的氨基酸27-191;氨基酸1-26代表信号肽),和相关的121、189和206血管内皮细胞生长因子异形体,如由Leung,D.W.,等人,Science 246(1989)1306-1309;Houck等人,Mol.Endocrin.5(1991)1806-1814;Keck,P.J.,等人,Science 246(1989)1309-1312和Connolly,D.T.,等人,J.Biol.Chem.264(1989)20017-20024描述的;以及那些生长因子的天然存在的等位基因形式和经加工的形式。VEGF参与正常的和异常的血管生成以及与肿瘤和眼内障碍相关的新生血管形成的调节(Ferrara,N.,等人,Endocrin.Rev.18(1997)4-25;Berkman,R.A.,等人,J.Clin.Invest.91(1993)153-159;Brown,L.F.,等人,Human Pathol.26(1995)86-91;Brown,L.F.,等人,Cancer Res.53(1993)4727-4735;Mattern,J.,等人,Brit.J.Cancer.73(1996)931-934;和Dvorak,H.F.,等人,Am.J.Pathol.146(1995)1029-1039)。VEGF是一种同源二聚体糖蛋白,其已经从几种来源分离并且包括几种异形体。VEGF显示出对内皮细胞的高度特异性的促有丝分裂活性。
本文中使用的术语“具有(所述)突变IHH-AAA”表示突变I253A(Ile253Ala)、H310A(His310Ala)和H435A(His435Ala)的组合,并且本文中使用的术语“具有(所述)突变HHY-AAA”表示突变H310A(His310Ala)、H433A(His433Ala)和Y436A(Tyr436Ala)的组合,并且本文中使用的术语“具有(所述)突变YTE”表示IgG1或IgG4亚类的恒定重链区中突变M252Y(Met252Tyr)、S254T(Ser254Thr)和T256E(Thr256Glu)的组合,其中所述编号是根据KabatEU索引编号系统。
本文中使用的术语“具有(所述)突变P329G LALA”表示IgG1亚类的恒定重链区中突变L234A(Leu235Ala)、L235A(Leu234Ala)和P329G(Pro329Gly)的组合,其中所述编号是根据Kabat EU索引编号系统。本文中使用的术语“具有(所述)突变SPLE”表示IgG4亚类的恒定重链区中突变S228P(Ser228Pro)和L235E(Leu235Glu)的组合,其中所述编号是根据Kabat EU索引编号系统。本文中使用的术语“具有(所述)突变SPLE和P329G”表示IgG4亚类的恒定重链区中突变S228P(Ser228Pro)、L235E(Leu23 5Glu)和P329G(Pro329Gly)的组合,其中所述编号是根据Kabat EU索引编号系统。
II.组合物和方法
在一个方面,本发明部分地基于以下发现:影响免疫球蛋白Fc区与新生儿Fc-受体(FcRn)的结合(即减少或甚至消除Fc区与FcRn的结合)的特定突变或突变组合不会同时消除Fc区与葡萄球菌蛋白A的结合。这对可以用作例如非特异性的且物质限制的亲和色谱法材料的纯化过程具有深远影响,例如需要KappaSelect,其仅结合包含κ轻链的抗体。因此,利用本文报道的突变的组合,可能同时减少或甚至消除与FcRn的结合,同时维持与葡萄球菌蛋白A的结合。
在一个方面,本发明部分地基于以下发现:通过使用每个重链的Fc区中的不同突变,可以提供异源二聚体分子例如双特异性抗体,其一方面具有减少的或甚至消除的与FcRn的结合,但是另一方面维持结合葡萄球菌蛋白A的能力。这种与葡萄球菌蛋白A的结合可以用于从同源二聚体副产物分离异源二聚体分子。例如,通过使用凸起-进入-孔洞方案组合在一个重链Fc区中的突变I253A、H310A和H435A与在另一个重链Fc区中的突变H310A、H433A和Y436A,可以得到异源二聚体Fc区,其一方面不会结合FcRn(两组突变就人FcRn而言是沉默的),但是维持与葡萄球菌蛋白A的结合(具有突变I253A、H310A和H435A的重链Fc区不会结合FcRn且不会结合葡萄球菌蛋白A,而具有突变H310A、H433A和Y436A的重链Fc区不会结合FcRn、但是仍然结合葡萄球菌蛋白A)。因而,标准蛋白A亲和色谱法可以用于除去同源二聚体的孔洞-孔洞副产物,因为这不再结合葡萄球菌蛋白A。因而,通过将凸起-进入-孔洞方案与孔洞链中的突变I253A、H310A和H435A和凸起链中的突变H310A、H433A和Y436A组合,可以促进异源二聚体的凸起-进入-孔洞产物从同源二聚体的孔洞-孔洞副产物的纯化/分离。
在一个方面,本发明部分地基于以下发现:用于玻璃体内应用的不具有FcRn-结合的抗体是有益的,因为这些抗体可以穿过血液-视网膜屏障,在眼中不具有实质上延长的或缩短的半衰期,且快速地从血液循环清除,从而在眼外不产生或产生非常有限的全身副作用。本发明的抗体可用于例如诊断或治疗眼血管疾病。
本发明至少部分地基于以下发现:通过使用Fc区的每个Fc区多肽中的不同突变,可以提供具有定制的FcRn-结合的异源二聚体分子,例如双特异性抗体,并与其一起可以提供具有定制的全身半衰期的抗体。
突变I253A、H310A、H435A、或L251D、L314D、L432D、或L251S、L314S、L432S的组合导致与蛋白A的结合的丧失,而突变I253A、H310A、H435A或H310A、H433A、Y436A或L251D、L314D、L432D的组合导致与人新生儿Fc受体的结合的丧失。
下表呈现了Fc区中参与相互作用或已经被改变以调整相互作用的氨基酸残基的示例性概览。
本文报道的修饰改变与一种或多种Fc受体(诸如人FcRn)的结合特异性。同时,一些改变与人FcRn的结合的突变不会改变与葡萄球菌蛋白A的结合。
在一个实施方案中,与缺乏该突变组合的对应二聚体多肽相比,本文报道的突变的组合确实改变或确实实际上改变二聚体多肽的血清半衰期。在一个实施方案中,与缺乏该突变组合的对应二聚体多肽相比,所述突变的组合还不会改变或不会实质上改变二聚体多肽与葡萄球菌蛋白A的结合。
新生儿Fc-受体(FcRn)对于IgG类抗体的体内代谢命运而言是重要的。FcRn行使功能以从溶酶体降解途径营救野生型IgG,从而导致减少的清除和增加的半衰期。它是一种由两个多肽组成的异源二聚体蛋白:50kDa的I类主要组织相容性复合物-样蛋白(α-FcRn)和15kDa的β2-微球蛋白(β2m)。FcRn以高亲和力结合IgG类抗体的Fc区的CH2-CH3部分。IgG类抗体和FcRn之间的相互作用是pH依赖性的并且以1:2化学计量学发生,即一个IgG抗体分子可以通过它的两个重链Fc区多肽与两个FcRn分子相互作用(参见例如Huber,A.H.,等人,J.Mol.Biol.230(1993)1077-1083)。
因而,IgG体外FcRn结合性质/特征指示它在血液循环中的体内药代动力学性质。
在FcRn和IgG类抗体的Fc区之间的相互作用中,重链CH2-和CH3-结构域的不同氨基酸残基参与。与FcRn相互作用的氨基酸残基位于大约EU位置243和EU位置261之间,大约EU位置275和EU位置293之间,大约EU位置302和EU位置319之间,大约EU位置336和EU位置348之间,大约EU位置367和EU位置393之间,在EU位置408处,和大约EU位置424和EU位置440之间。更具体地,以下根据Kabat的EU编号的氨基酸残基参与Fc区和FcRn之间的相互作用:F243、P244、P245P、K246、P247、K248、D249、T250、L251、M252、I253、S254、R255、T256、P257、E258、V259、T260、C261、F275、N276、W277、Y278、V279、D280、V282、E283、V284、H285、N286、A287、K288、T289、K290、P291、R292、E293、V302、V303、S304、V305、L306、T307、V308、L309、H310、Q311、D312、W313、L314、N315、G316、K317、E318、Y319、I336、S337、K338、A339、K340、G341、Q342、P343、R344、E345、P346、Q347、V348、C367、V369、F372、Y373、P374、S375、D376、I377、A378、V379、E380、W381、E382、S383、N384、G385、Q386、P387、E388、N389、Y391、T393、S408、S424、C425、S426、V427、M428、H429、E430、A431、L432、H433、N434、H435、Y436、T437、Q438、K439和S440。
定位诱变研究已经表明,IgG的Fc区与FcRn的关键结合位点是组氨酸310、组氨酸435和异亮氨酸253,并且在较低程度上是组氨酸433和酪氨酸436(参见例如Kim,J.K.,等人,Eur.J.Immunol.29(1999)2819-2825;Raghavan,M.,等人,Biochem.34(1995)14649-14657;Medesan,C.,等人,J Immunol.158(1997)2211-2217)。
已经通过在多个氨基酸残基处突变IgG来执行增加IgG与FcRn的结合的方法:苏氨酸250、甲硫氨酸252、丝氨酸254、苏氨酸256、苏氨酸307、谷氨酸380、甲硫氨酸428、组氨酸433和天冬酰胺434(参见Kuo,T.T.,等人,J.Clin.Immunol.30(2010)777-789)。
在一些情况下,需要在血液循环中具有减小的半衰期的抗体。例如,用于玻璃体内应用的药物应当在患者的眼中具有长半衰期并且在患者的血液循环中具有短半衰期。这样的抗体还具有增加的向疾病位点的暴露(例如在眼中)的优点。
影响FcRn结合和随之影响在血液循环中的半衰期的不同突变是已知的。已经通过定位诱变鉴定了对于小鼠Fc区--小鼠FcRn相互作用至关重要的Fc区残基(参见例如Dall’Acqua,W.F.,等人.J.Immunol 169(2002)5171-5180)。残基I253、H310、H433、N434和H435(根据Kabat的EU编号)参与所述相互作用(Medesan,C.,等人,Eur.J.Immunol.26(1996)2533-2536;Firan,M.,等人,Int.Immunol.13(2001)993-1002;Kim,J.K.,等人,Eur.J.Immunol.24(1994)542-548)。发现残基I253、H310和H435对于人Fc与鼠FcRn的相互作用是关键的(Kim,J.K.,等人,Eur.J.Immunol.29(1999)2819-2855)。Dall’Acqua等人通过蛋白-蛋白相互作用研究描述了残基M252Y、S254T、T256E会改善FcRn结合(Dall′Acqua,W.F.,等人.J.Biol.Chem.281(2006)23514-23524)。人Fc-人FcRn复合物的研究已经证实,残基I253、S254、H435和Y436对于所述相互作用是关键的(Firan,M.,等人,Int.Immunol.13(2001)993-1002;Shields,R.L.,等人,J.Biol.Chem.276(2001)6591-6604)。在Yeung,Y.A.,等人(J.Immunol.182(2009)7667-7671)中已经报道和检查了残基248-259和301-317和376-382和424-437的各种突变体。示例性突变及其对FcRn结合的影响列在下表中。
已经发现,在一个Fc区多肽一侧的一个突变足以显著弱化结合。引入Fc区中的突变越多,与FcRn的结合变得越弱。但是一侧的不对称突变不足以完全地抑制FcRn结合。在两侧上的突变是完全抑制FcRn结合所必需的。
对称改造IgG1 Fc区以影响FcRn结合的结果显示在下表中(突变的比对和在FcRn-亲和色谱柱上的保留时间)。
低于3分钟的保留时间对应于无结合,因为物质在穿流液中(空峰)。
单个突变H310A是缺失任何FcRn-结合的最沉默的对称突变。
对称的单突变I253A和H435A导致0.3-0.4min的保留时间的相对位移。这通常可以被视作不可检测的结合。
单突变Y436A导致与FcRn亲和柱可检测的相互作用强度。不受该理论约束,该突变可以对FcRn介导的体内半衰期具有影响,其可以与零相互作用诸如I253A、H310A和H435A突变的组合(IHH-AAA突变)相区分。
用对称修饰的抗-HER2抗体得到的结果提供在下表中(参见用于参考的WO 2006/031370)。
已经用使用凸起-进入-孔洞技术组装的双特异性抗体例证了在Fc区中引入不对称的影响FcRn-结合的突变的效果(参见例如US 7,695,936,US 2003/0078385;“孔洞链”突变:S354C/T366W,“凸起链”突变:Y349C/T366S/L368A/Y407V)。使用FcRn亲和色谱法方法可以容易地确定不对称地引入的突变对FcRn-结合的影响(参见图9和下表)。从FcRn亲和柱较晚洗脱(即在FcRn亲和柱上具有较长保留时间)的抗体具有较长的体内半衰期,反之亦然。
进一步用使用凸起-进入-孔洞技术组装以允许引入不对称突变的单特异性抗-IGF-1R抗体例证了在Fc区中引入不对称的影响FcRn-结合的突变的效果(参见例如US 7,695,936,US 2003/0078385;“孔洞链”突变:S354C/T366W,“凸起链”突变:Y349C/T366S/L368A/Y407V)。可以使用FcRn亲和色谱法方法容易地确定不对称地引入的突变对FcRn-结合的影响(参见下表)。从FcRn亲和柱较晚洗脱(即在FcRn亲和柱上具有较长保留时间)的抗体具有较长的体内半衰期,反之亦然。
不对称的IHH-AAA和LLL-DDD突变(LLL-DDD突变=突变L251D、L314D和L432D的组合)显示出比对应亲本或野生型抗体更弱的结合。
对称的HHY-AAA突变(=突变H310A、H433A和Y436A的组合)导致Fc区不再结合人FeRn,但是维持与蛋白A的结合(参见图11、12、13和14)。
进一步用使用凸起-进入-孔洞技术组装以允许引入不对称突变的单特异性的抗-IGF-1R抗体(IGF-1R)、双特异性抗-VEGF/ANG2抗体(VEGF/ANG2)和在两个重链的C-端具有融合的全长抗体(融合体)例证了在Fc区中引入不对称的影响FcRn-结合的突变的效果(参见例如US 7,695,936,US 2003/0078385;“孔洞链”突变:S354C/T366W,“凸起链”突变:Y349C/T366S/L368A/Y407V)。可以使用FcRn亲和色谱法方法、蛋白A亲和色谱法方法和基于SPR的方法容易地确定引入的突变对FcRn-结合和蛋白A结合的影响(参见下表)。
本文报道的一个方面是包含本文报道的变体人IgG类Fc区的抗体或Fc区融合多肽。
本文报道的Fc区(二聚体多肽)当被包含在Fc区融合多肽或全长抗体中时会给所述分子赋予上述特征。所述融合配偶体可以是具有生物活性的任何分子,其体内半衰期应当减少或增加,即其体内半衰期应当清楚地限定并且为其预期应用定制。
Fc区融合多肽可以包含例如本文报道的变体(人)IgG类Fc区和结合靶标的受体蛋白,所述靶标包括配体,例如,TNFR-Fc区融合多肽(TNFR=人肿瘤坏死因子受体)或IL-1R-Fc区融合多肽(IL-1R=人白介素-1受体)或VEGFR-Fc区融合多肽(VEGFR=人血管内皮生长因子受体)或ANG2R-Fc区融合多肽(ANG2R=人血管生成素2受体)。
Fc区融合多肽可以包含例如本文报道的变体(人)IgG类Fc区和结合靶标的抗体片段,所述靶标包括,例如,抗体Fab片段、scFv(参见例如Nat.Biotechnol.23(2005)1126-1136)或结构域抗体(dAb)(参见例如WO 2004/058821、WO 2003/002609)。
Fc区融合多肽可以包含例如本文报道的变体(人)人IgG类Fc区和受体配体(天然存在的或人工的)。
抗体(例如全长抗体或CrossMabs)可以包含本文报道的变体(人)人IgG类Fc区。
眼血管疾病是特征在于改变的或失调的新血管增生和新血管向眼组织(诸如视网膜或角膜)的结构中侵入的任意病理学状况。
在一个实施方案中,所述眼血管疾病选自:湿性年龄相关的黄斑变性(湿性AMD),干性年龄相关的黄斑变性(干性AMD),糖尿病性黄斑水肿(DME),囊样黄斑水肿(cystoidmacular edema,CME),非增生性糖尿病性视网膜病变(non-proliferative diabeticretinopathy,NPDR),增生性糖尿病性视网膜病变(proliferative diabeticretinopathy,PDR),囊样黄斑水肿,血管炎(vasculitis)(例如,视网膜中央静脉闭塞),视盘水肿(papilloedema),视网膜炎(retinitis),结膜炎(conjunctivitis),葡萄膜炎(uveitis),脉络膜炎(choroiditis),多病灶性脉络膜炎(multifocal choroiditis),眼组织胞浆菌病(ocular histoplasmosis),睑缘炎(blepharitis),干眼症(dry eye)(舍格伦病(Sjogren′s disease))和其它眼科疾病,其中所述眼病或障碍与眼新生血管形成、血管渗漏和/或视网膜水肿相关。
包含本文报道的二聚体多肽的抗体可用于预防和治疗湿性AMD、干性AMD、CME、DME、NPDR、PDR、睑缘炎、干眼症和葡萄膜炎,在一个优选实施方案中,可用于预防和治疗湿性AMD、干性AMD、睑缘炎和干眼症,还在一个优选的实施方案中,可用于预防和治疗CME、DME、NPDR和PDR,还在一个优选的实施方案中,可用于预防和治疗睑缘炎和干眼症,特别是湿性AMD和干性AMD,并且还特别是湿性AMD。
在一些实施方案中,所述眼血管疾病选自湿性年龄相关的黄斑变性(湿性AMD)、黄斑水肿、视网膜静脉闭塞、早产儿视网膜病变和糖尿病性视网膜病变。
与角膜新生血管形成相关的其它疾病包括、但不限于,流行性角结膜炎(epidemickeratoconjunctivitis),维生素A缺乏病(Vitamin A deficiency),接触镜片佩带过度(contact lens overwear),特应性角膜炎(atopic keratitis),上缘角膜炎(superiorlimbic keratitis),翼状胬肉干燥性角膜炎(pterygium keratitis sicca),舍格伦病(Sjogren’s),红斑痤疮(acne rosacea),phylectenulosis,梅毒(syphilis),分枝杆菌感染(Mycobacteria infections),脂质变性(1ipid degeneration),化学灼伤(chemicalburns),细菌性溃疡(bacterial ulcers),真菌性溃疡(fungal ulcers),单纯疱疹感染(Herpes simplex infections),带状疱疹感染(Herpes zoster infections),原虫感染(protozoan infections),卡波西肉瘤(Kaposi sarcoma),莫伦溃疡(Mooren ulcer),Terrien氏边缘变性(Terrien′s marginal degeneration),边缘性角质层分离(mariginalkeratolysis),类风湿性关节炎(rheumatoid arthritis),全身性红斑狼疮(systemiclupus),多动脉炎(polyarteritis),外伤(trauma),韦格纳结节病(Wegener’ssarcoidosis),巩膜炎(Scleritis),Steven′s Johnson病(Steven′s Johnson disease),periphigoid放射状角膜切开(periphigoid radial keratotomy)和角膜移植排斥(corneal graph rejection)。
与视网膜/脉络膜新生血管形成相关的疾病包括、但不限于,糖尿病性视网膜病变,黄斑变性,镰状细胞性贫血(sickle cell anemia),类肉瘤(sarcoid),梅毒(syphilis),弹性假黄色瘤(pseudoxanthoma elasticum),佩吉特病(Paget’s disease),静脉闭塞(vein occlusion),动脉闭塞(artery occlusion),颈动脉阻塞性疾病(carotidobstructive disease),慢性葡萄膜炎/玻璃体炎(chronic uveitis/vitritis),分枝杆菌感染(mycobacterial infections),莱姆病(Lyme′s disease),全身性红斑狼疮(systemiclupus erythematosis),早产儿视网膜病变,色素性视网膜炎(retinitis pigmentosa),视网膜水肿(retina edema)(包括黄斑水肿),伊耳斯氏病(Eale’s disease),白塞氏病(Bechet’s disease),引起视网膜炎或脉络膜炎的感染(infections causing aretinitis or choroiditis),假定的眼组织胞浆菌病(presumed ocularhistoplasmosis),贝斯特病(Best’s disease),近视(myopia),视窝(optic pits),Stargart氏病(Stargart’s disease),睫状体扁平部炎(pars planitis),慢性视网膜脱离(chronic retinal detachment),高粘滞综合征(hyperviscosity syndromes)弓形体病(toxoplasmosis),外伤和激光后并发症(post-laser complications)。
其它疾病包括、但不限于,与潮红(角的新生血管形成)相关的疾病和由纤维血管或纤维组织的异常增生引起的疾病,包括所有形式的增生性玻璃体视网膜病变。
早产儿视网膜病变(ROP)是一种影响早产儿的眼部疾病。认为其由视网膜血管的紊乱生长引起,其可能导致瘢痕形成和视网膜脱离。ROP可以是轻度的,并且可以自发地消退,但是在严重的情况下可能导致失明。因此,所有早产儿都有ROP的危险,并且非常低的出生体重是另一个危险因素。氧中毒和相关的缺氧都可能促进ROP的发展。
黄斑变性是一种主要在老年人中发现的医学病症,其中眼睛的内衬中心(被称为视网膜的黄斑区域)变薄、萎缩,并且在一些情形中,出血。这可能导致中央视觉的丧失,这使得不能看到细微的细节,不能阅读,或者不能辨识面部。根据美国眼科学会,它是当代美国超过五十岁的人们中的中央视觉丧失(失明)的主要原因。尽管一些影响年轻个体的黄斑营养不良(macular dystrophies)有时也称为黄斑变性,但是该术语通常表示年龄相关的黄斑变性(AMD或ARMD)。
年龄相关的黄斑变性从在视网膜色素上皮与其下的脉络膜之间的黄斑(提供详细的中央视觉的视网膜中央区域,称为小窝)中的特征性黄色沉积(称为玻璃疣)开始。大部分具有这些早期改变(被称作年龄相关的黄斑病变)的人们具有良好的视力。具有玻璃疣的人们可以继续发展晚期AMD。当玻璃疣变大并且变多并且与在黄斑下的色素细胞层中的紊乱相关时,危险是相当高的。大且软的玻璃疣与升高的胆固醇沉积相关,并且可能对胆固醇降低剂或Rheo Procedure做出响应。
晚期AMD(其导致深远的视觉丧失)具有两种形式:干性的和湿性的。中央地图样萎缩(即干性形式的晚期AMD)由在视网膜下的视网膜色素上皮层的萎缩导致,其通过在眼睛中央部分的光感受器(视杆和视锥)的丧失而引起视觉丧失。尽管这种病症没有可用的治疗,但是国家眼科研究所(National Eye Institute)和其它机构已经证实含有高剂量的抗氧化剂叶黄素和玉米黄素的维生素补剂会减慢干性黄斑变性的进展,并且在一些患者中改善视敏度。
色素性视网膜炎(RP)是一组遗传性眼病。在RP的征状的进展中,夜盲症通常发生在视野收缩之前数年或甚至几十年。许多患有RP的人在他们四十多岁或五十多岁之前没有变成法定意义上的失明,并且终生保留些许视力。其它人由RP发展至完全失明,在一些情形中,早在儿童期。RP的进展在每个病例中是不同的。RP是一类遗传性视网膜营养不良,一组遗传性障碍,其中光感受器(视杆和视锥)或视网膜的视网膜色素上皮(RPE)的异常导致进行性视觉丧失。受影响的个体首先经历缺陷性暗适应或夜盲(夜盲症),之后是周边视野减小(称为视野收缩),并且有时在该疾病过程的晚期丧失中央视觉。
当流体和蛋白沉积集中在眼睛的黄斑(视网膜的黄色中央区域)上面或下面使其变厚和肿胀时,发生黄斑水肿。肿胀可以使人的中央视觉扭曲,因为黄斑是在眼球后部在视网膜的中心附近。该区域容纳紧密堆叠的视锥,所述视锥提供灵敏的、清楚的中央视觉以允许人看到直接在视线上的形式、颜色和细节。囊样黄斑水肿是一类包括囊肿形成的黄斑水肿。
在一个方面,提供了一种二聚体多肽,其包含
第一多肽和第二多肽,所述第一多肽和第二多肽各自在N-端至C-端方向包含含有一个或多个半胱氨酸残基的免疫球蛋白铰链区的至少一部分、免疫球蛋白CH2-结构域和免疫球蛋白CH3-结构域,
其中
i)所述第一多肽和所述第二多肽各自包含突变H310A、H433A和Y436A,或者
ii)所述第一多肽和所述第二多肽各自包含突变L251D、L314D和L432D,或者
iii)所述第一多肽和所述第二多肽各自包含突变L251S、L314S和L432S,或者
iv)所述第一多肽包含突变I253A、H310A和H435A,且所述第二多肽包含突变H310A、H433A和Y436A,或者
v)所述第一多肽包含突变I253A、H310A和H435A,且所述第二多肽包含突变L251D、L314D和L432D,或者
vi)所述第一多肽包含突变I253A、H310A和H435A,且所述第二多肽包含突变L251S、L314S和L432S。
这些二聚体多肽由于突变具有不结合人FcRn的性质,而与葡萄球菌蛋白A的结合得到维持。
因而,通过使用常规蛋白A亲和材料,诸如MabSelectSure,可以纯化这些抗体,即与不希望的副产物分离。不要求使用非常复杂的、但是物质限制的亲和材料,例如KappaSelect,其仅可与包含κ亚类轻链的抗体一起使用。另外,如果做出轻链亚类的修饰/交换,不要求采用纯化方法(分别参见图11和12)。
本文报道的一个方面是一种用于生产本文报道的二聚体多肽的方法,所述方法包括下述步骤:
a)培养哺乳动物细胞,所述细胞包含一个或多个编码本文报道的二聚体多肽的核酸,
b)从培养基回收所述二聚体多肽,和
c)用蛋白A亲和色谱法纯化所述二聚体多肽并由此生产所述二聚体多肽。
本文报道的一个方面是突变H310A、H433A和Y436A用于从同源二聚体多肽分离异源二聚体多肽的用途。
本文报道的一个方面是突变L251D、L314D和L432D用于从同源二聚体多肽分离异源二聚体多肽的用途。
本文报道的一个方面是突变L251S、L314S和L432S用于从同源二聚体多肽分离异源二聚体多肽的用途。
本文报道的一个方面是第一Fc区多肽中的突变I253A、H310A和H435A与第二Fc区多肽中的突变H310A、H433A和Y436A的组合用于从同源二聚体Fc区分离异源二聚体Fc区的用途,所述异源二聚体Fc区包含所述第一Fc区多肽和所述第二Fc区多肽。
本文报道的一个方面是第一Fc区多肽中的突变I253A、H310A和H435A与第二Fc区多肽中的突变L251D、L314D和L432D的组合用于从同源二聚体Fc区分离异源二聚体Fc区的用途,所述异源二聚体Fc区包含所述第一Fc区多肽和所述第二Fc区多肽。
本文报道的一个方面是第一Fc区多肽中的突变I253A、H310A和H435A与第二Fc区多肽中的突变L251S、L314S和L432S的组合用于从同源二聚体Fc区分离异源二聚体Fc区的用途,所述异源二聚体Fc区包含所述第一Fc区多肽和所述第二Fc区多肽。
在前述三个方面的一个实施方案中,所述第一Fc区多肽还包含突变Y349C、T366S、L368A和Y407V,且所述第二Fc区多肽还包含突变S354C和T366W。
在前述三个方面的一个实施方案中,所述第一Fc区多肽还包含突变S354C、T366S、L368A和Y407V,且所述第二Fc区多肽还包含突变Y349C和T366W。
本文报道的一个方面是突变Y436A用于增加二聚体Fc区多肽与蛋白A的结合的用途。
已经发现,通过引入突变Y436A,可以增加Fc区与葡萄球菌蛋白A(SPA)的结合。这是有利的,例如如果引入减少与SPA的结合的额外突变,例如I253A和H310A或H310A和H435A(参见图15)。
本文报道的一个方面是一种二聚体多肽,其包含
第一多肽和第二多肽,所述第一多肽和第二多肽各自在N-端至C-端方向包含含有一个或多个半胱氨酸残基的免疫球蛋白铰链区的至少一部分、免疫球蛋白CH2-结构域和免疫球蛋白CH3-结构域,
其中所述第一多肽、所述第二多肽、或所述第一多肽和所述第二多肽包含突变Y436A(根据Kabat EU索引编号系统编号)。
在一个实施方案中,所述第一多肽和所述第二多肽包含突变Y436A。
本文报道的一个方面是一种双特异性抗体,其提供包含被不同地修饰的免疫球蛋白重链Fc区的容易分离/纯化,其中所述修饰中的至少一种导致i)所述双特异性抗体对蛋白A的差别亲和力和ii)所述双特异性抗体对人FcRn的差别亲和力,且所述双特异性抗体基于它对蛋白A的亲和力可从破碎的细胞、从培养基或从抗体的混合物分离。
在一个实施方案中,所述双特异性抗体在pH 4.0以上的pH值洗脱。
在一个实施方案中,使用蛋白A亲和色谱法和pH梯度或pH阶梯分离所述双特异性抗体,其中所述pH梯度或pH阶梯包括盐的添加。在一个具体实施方案中,所述盐以约0.5摩尔至约1摩尔的浓度存在。在一个实施方案中,所述盐选自:乙酸的锂、钠和钾盐;碳酸氢钠和碳酸氢钾;碳酸锂、碳酸钠和碳酸钾;氯化锂、氯化钠、氯化钾和氯化镁;氟化钠和氟化钾;硝酸钠、硝酸钾和硝酸钙;磷酸钠和磷酸钾;和硫酸钙和硫酸镁。在一个实施方案中,所述盐是碱金属或碱土金属的卤化物盐。在一个优选实施方案中,所述盐是氯化钠。
在一个方面,所述二聚体多肽包含如本文报道修饰过的第一多肽和关于蛋白A和FcRn结合没有修饰过的第二多肽,从而形成异源二聚体多肽,其中所述差别修饰导致所述二聚体多肽在比缺少所述差别修饰的对应二聚体多肽高0.5、0.6、0.7、0.8、0.9、1.0、1.2、1.3或1.4个pH单位处从蛋白A亲和材料洗脱。在一个实施方案中,所述差别修饰的二聚体多肽在4或更高的pH处洗脱,而未修饰的二聚体多肽在3.5或更低的pH处洗脱。在一个实施方案中,所述差别修饰的二聚体多肽在约4的pH处洗脱,而未修饰的二聚体多肽在约2.8-3.5、2.8-3.2或2.8-3的pH处洗脱。在这些实施方案中,“未修饰的”表示修饰H310A、H433A和Y436A(Kabat EU索引编号系统)在两个多肽中的缺乏。
对于色谱运行,0.5摩尔至1摩尔盐(例如NaCl)的添加可能改善同源二聚体多肽和异源二聚体多肽(特别是如果源自人IgG1亚类)的分离。盐向增加pH值的洗脱溶液中的添加可以拓宽用于洗脱的pH范围,使得例如pH阶梯梯度可以成功地分离两种物质。
因此,在一个实施方案中,一种用于分离包含异源二聚体IgG Fc区(其具有一个包含本文报道的突变的链)的双特异性抗体的方法包括在有盐存在下采用pH梯度的步骤。在一个实施方案中,所述盐以特定浓度存在,所述浓度足以使IgG Fc区同源二聚体和IgG Fc区异源二聚体从蛋白A色谱材料的洗脱之间的pH差异最大化。在一个实施方案中,所述盐以约0.5摩尔至约1摩尔的浓度存在。在一个实施方案中,所述盐是碱金属或碱土金属和卤素的盐。在一个实施方案中,所述盐是碱金属或碱土金属的盐酸盐,例如NaCl、KCl、LiCl、CaCl
通过重组方式生产本文报道的二聚体多肽。因而,本发明的一个方面是编码本文报道的二聚体多肽的核酸,且另一个方面是包含编码本文报道的二聚体多肽的核酸的细胞。用于重组生产的方法是现有技术广泛已知的,且包括在原核和真核细胞中表达蛋白,随后分离二聚体多肽并经常纯化至药用纯度。关于在宿主细胞中表达如前所述的二聚体多肽,通过标准方法将编码各种第一和第二多肽的核酸插入表达载体中。在适合的原核或真核宿主细胞如CHO细胞、NS0细胞、SP2/0细胞、HEK293细胞、COS细胞、PER.C6细胞、酵母或大肠杆菌细胞中进行表达,并从细胞(培养上清液或裂解以后的细胞)回收二聚体多肽。
用于重组生产抗体的一般方法是现有技术中公知的,且描述在,例如,Makrides,S.C.,Protein Expr.Purif.17(1999)183-202;Geisse,S.,等人,Protein Expr.Purif.8(1996)271-282;Kaufman,R.J.,Mol.Biotechnol.16(2000)151-160;Werner,R.G.,DrugRes.48(1998)870-880的综述文章中。
因此,本文报道的一个方面是一种用于生产本文报道的二聚体多肽的方法,所述方法包括下述步骤:
a)用一种或多种载体转化宿主细胞,所述载体包含编码本文报道的二聚体多肽的核酸分子,
b)在允许合成所述二聚体多肽的条件下培养所述宿主细胞,和
c)从培养物回收所述二聚体多肽并由此生产所述二聚体多肽。
在一个实施方案中,在c)下的回收步骤包括使用免疫球蛋白Fc区特异性的捕获试剂。在一个实施方案中,该Fc区特异性的捕获试剂以结合-和-洗脱模式使用。这样的Fc区特异性的捕获试剂的例子是例如基于葡萄球菌属蛋白A的亲和色谱柱,所述柱基于高刚性的琼脂糖基础基质,所述基质允许在大规模时的高流速和低反压。它们特征在于结合所述二聚体多肽(即它的Fc区)的配体。经由长亲水间隔臂连接至所述基质的配体使它可容易得到用于结合靶分子。
适当地通过常规免疫球蛋白纯化操作(例如,蛋白A-琼脂糖、羟基磷灰石色谱法,凝胶电泳,透析或亲和色谱法)从培养基中分离本文报道的二聚体多肽。B-细胞或杂交瘤细胞可以充当编码所述二聚体多肽的DNA和RNA的来源。使用常规操作,容易地分离编码所述单克隆抗体的DNA和RNA并测序。一旦被分离,可以将DNA插入表达载体中,然后将所述表达载体转染进不另外产生二聚体多肽的宿主细胞诸如HEK 293细胞、CHO细胞或骨髓瘤细胞中,以在所述宿主细胞中获得重组单克隆二聚体多肽的合成。
通过标准技术,包括碱/SDS处理、CsC1分级(CsCl banding)、柱色谱法、琼脂糖凝胶电泳和其它本领域公知的技术,进行抗体的纯化从而消除细胞成分或其它污染物,例如其它细胞核酸或蛋白(参见Ausubel,F.,等人,编Current Protocols in MolecularBiology,Greene Publishing and Wiley Interscience,New York(1987))。不同的方法是充分建立的并且广泛用于蛋白纯化,如用微生物蛋白进行的亲和色谱法(例如,蛋白A或蛋白G亲和色谱法),离子交换色谱法(例如阳离子交换(羧甲基树脂),阴离子交换(氨基乙基树脂)和混合模式交换),亲硫吸附(例如,用β-巯基乙醇和其它SH配体),疏水相互作用或芳香吸附色谱法(例如用苯基-琼脂糖、氮杂-arenophilic树脂,或间氨基苯基硼酸),金属螯合亲和色谱法(例如用Ni(II)-和Cu(II)-亲和力材料),尺寸排阻色谱和电泳方法(如凝胶电泳,毛细管电泳)(Vijayalakshmi,M.A.,Appl.Biochem.Biotech.75(1998)93-102)。
本发明的一个方面是一种药物制剂,其包含本文报道的二聚体多肽或抗体。本发明的另一个方面本文报道的二聚体多肽或抗体用于制备药物制剂的用途。本发明的另一个方面是一种用于制备药物制剂的方法,所述药物制剂包含本文报道的二聚体多肽或抗体。在另一个方面,本发明提供了一种制剂,例如药物制剂,其含有与药用载体一起配制的本文报道的二聚体多肽或抗体。
可以通过本领域已知的多种方法施用本文报道的制剂。技术人员将理解,施用的途径和/或模式将随所期望的结果而变化。为了通过某些施用途径施用本发明的化合物,可能必须用防止其失活的物质包被所述化合物,或与所述物质一起共同施用所述化合物。例如,所述化合物可以在适当的载体(例如,脂质体或稀释剂)中施用给受试者。药用稀释剂包括盐水和缓冲水溶液。药用载体包括无菌水溶液或分散体和用于即时制备无菌可注射溶液剂或分散体的无菌粉末。此类介质和物质用于药学活性物质的用途是本领域已知的。
可以使用许多可能的递送模式,包括、但不限于眼内施用或局部施用。在一个实施方案中,所述施用是眼内施用,并且包括、但不限于,结膜下注射、颅内注射(intracanieralinjection)、通过颞缘(termporai limbus)注射入前房、间质内注射、角膜内注射、视网膜下注射、房水注射、眼球筋膜下注射或持久递送装置、玻璃体内注射(例如,玻璃体前部、中部或后部注射)。在一个实施方案中,所述施用是局部的,并且包括、但不限于滴至角膜上。
在一个实施方案中,通过玻璃体内应用,例如通过玻璃体内注射,施用本文报道的二聚体多肽或本文报道的药物制剂。这可以根据本领域已知的标准操作执行(参见,例如,Ritter等人,J.Clin.Invest.116(2006)3266-3276;Russelakis-Carneiro等人,Neuropathol.Appl.Neurobiol.25(1999)196-206;和Wray等人,Arch.Neurol.33(1976)183-185)。
在一些实施方案中,本发明的治疗性试剂盒可以含有存在于如本文中所述的药物制剂中的一个或多个剂量的本文报道的二聚体多肽、用于玻璃体内注射该药物制剂的合适装置、和详述合适受试者及用于实施注射的方案的说明书。在这些实施方案中,通常将制剂通过玻璃体内注射施用给需要治疗的受试者。这可以根据本领域已知的标准操作执行。参见,例如,Ritter等人,J.Clin.Invest.116(2006)3266-3276;Russelakis-Carneiro等人,Neuropathol.Appl.Neurobiol.25(1999)196-206;和Wray等人,Arch.Neurol.33(1976)183-185。
所述制剂还可以含有佐剂诸如防腐剂、润湿剂、乳化剂和分散剂。通过上文的灭菌操作和通过包括多种抗细菌剂和抗真菌剂(例如,对羟基苯甲酸酯、三氯叔丁醇、苯酚、山梨酸等),可以确保微生物的存在的阻止。还可能需要在制剂中包括等渗剂,诸如糖、氯化钠等。此外,通过包含延迟吸收的试剂诸如单硬脂酸铝和明胶,可以实现可注射的药物形式的延长吸收。
无论选择的施用途径,通过本领域技术人员已知的常规方法将本文报道的化合物(其可以以合适的水合形式使用)和/或本文报道的药物制剂配制成药用剂型。
可以改变如本文报道的药物制剂中的活性成分的实际剂量水平,以便在对患者无毒性的情况下获得活性成分的量、组合物以及施用模式,所述量可有效实现对特定患者的所需治疗应答。选择的剂量水平将取决于多种药代动力学因素,包括采用的本发明的特定组合物的活性,施用途径,施用时间,正在采用的特定化合物的排泄速率,治疗的持续时间,与所用特定组合物联合使用的其它药物、化合物和/或材料,所治疗的患者的年龄、性别、重量、状况、一般健康和先前医疗史,和医学领域中众所周知的类似因素。
所述制剂必须是无菌的并以可通过注射器递送制剂的程度流动。除水之外,所述载体在一个优选实施方案中是等渗缓冲盐水溶液。
可以维持适当的流动性,例如,通过使用包衣诸如卵磷脂,在分散体的情况下通过维持要求的粒度,和通过使用表面活性剂。在许多情况下,优选的是,在组合物中包含等渗剂,例如,糖、多元醇诸如甘露醇或山梨醇和氯化钠。
所述制剂可以包括用于结膜下施用的包含活性剂的眼科贮库制剂。眼科贮库制剂包含基本上纯的活性剂(例如,本文报道的二聚体多肽)的微粒。包含本文报道的二聚体多肽的微粒可以嵌入生物相容的药用聚合物或脂质包囊剂中。贮库制剂可以适应于历经延长的时间段释放全部或基本上全部活性物质。如果存在的话,聚合物或脂质基质可以适应于充分地降解,以便在释放全部或基本上全部活性剂以后从施用部位转运出来。贮库制剂可以是液体制剂,其包含药用聚合物和溶解或分散的活性剂。注射后,聚合物在注射部位处形成储库,例如通过胶化或沉淀。
本发明的另一个方面是用于治疗眼血管疾病的本文报道的二聚体多肽或抗体。
本发明的一个实施方案是用于治疗眼血管疾病的本文报道的二聚体多肽或抗体。
本发明的另一个方面是用于治疗眼血管疾病的药物制剂。
本发明的另一个方面是本文报道的二聚体多肽或抗体用于制备药物的用途,所述药物用于治疗眼血管疾病。
本发明的另一个方面是通过给需要这种治疗的患者施用本文报道的二聚体多肽或抗体来治疗遭受眼血管疾病的患者的方法。
这里明确地说明,本文中使用的术语“包含”包括术语“由......组成”。因而,含有术语“包含”的全部方面和实施方案同样用术语“由......组成”公开。
在另一个方面,根据以上任一个实施方案的二聚体多肽可以单独地或以组合方式包含如下面部分1-6中所述的特征中的任一个:
1.抗体亲和力
在一个实施方案中,使用
2.嵌合的和人源化的抗体
在某些实施方案中,本文报道的二聚体多肽是嵌合抗体。某些嵌合抗体描述在例如US 4,816,567;和Morrison,S.L.,等人,Proc.Natl.Acad.Sci.USA 81(1984)6851-6855)中。在一个实施例中,嵌合抗体包含非人可变区(例如,从小鼠、大鼠、仓鼠、兔或非人灵长类动物诸如猴衍生出的可变区)和人恒定区。在另一个实施例中,嵌合抗体是“类转换的”抗体,其中类或亚类已经相对于亲本抗体发生改变。嵌合抗体包括其抗原结合片段。
在某些实施方案中,嵌合抗体是人源化抗体。典型地,将非人抗体人源化以降低对人类的免疫原性,同时保留亲本非人抗体的特异性和亲和力。通常,人源化抗体包含这样的一个或多个可变结构域:其中HVR例如CDR(或其部分)源自非人抗体并且FR(或其部分)源自人抗体序列。人源化抗体任选地也包含人恒定区的至少一部分。在一些实施方案中,将人源化抗体中的一些FR残基置换为来自非人抗体(例如,从其衍生出HVR残基的抗体)的相应残基,例如,以恢复或改善抗体特异性或亲和力。
人源化抗体和制造它们的方法综述在例如Almagro,J.C.和Fransson,J.,Front.Biosci.13(2008)1619-1633中,并且进一步描述在例如Riechmann,I.,等人,Nature332(1988)323-329;Queen,C.,等人,Proc.Natl.Acad.Sci.USA 86(1989)10029-10033;US5,821,337、US 7,527,791、US 6,982,321和US 7,087,409;Kashmiri,S.V.,等人,Methods36(2005)25-34(描述特异性决定区(SDR)移植);Padlan,E.A.,Mol.Immunol.28(1991)489-498(描述“表面重塑(resurfacing)”);Dall’Acqua,W.F.等人,方法36(2005)43-60(描述“FR改组”);Osbourn,J.等人,方法36(2005)61-68;和Klimka,A.等人,Br.J.Cancer 83(2000)252-260(描述针对FR改组的“导向选择”方案)。
可以用于人源化的人框架区包括、但不限于:使用“最佳拟合”方法选择的框架区(参见,例如,Sims,M.J.,等人,J.Immunol.151(1993)2296-2308;从轻链或重链可变区的特定亚组的人抗体的共有序列衍生出的框架区(参见,例如,Carter,P,等人,Proc.Natl.Acad.Sci.USA 89(1992)4285-4289;和Presta,L.G.,等人,J.Immunol.151(1993)2623-2632);人成熟的(体细胞突变的)框架区或人种系框架区(参见,例如,Almagro,J.C.和Fransson,J.,Front.Biosci.13(2008)1619-1633);和从筛选FR文库衍生的框架区(参见,例如,Baca,M.等人,J.Biol.Chem.272(1997)10678-10684和Rosok,M.J.等人,J.Biol.Chem.271(1996922611-22618)。
3.人抗体
在某些实施方案中,本文报道的二聚体多肽是人抗体。可以使用本领域已知的多种技术生产人抗体。人抗体通常描述在van Dijk,M.A.和van de Winkel,J.G.,Curr.Opin.Pharmacol.5(2001)368-374和Lonberg,N.,Curr.Opin.Immunol.20(2008)450-459中。
可以通过将免疫原施用给转基因动物来制备人抗体,所述转基因动物已经经过修饰以响应于抗原攻击而产生完整人抗体或具有人可变区的完整抗体。这样的动物通常含有全部或部分人免疫球蛋白基因座,其替换内源免疫球蛋白基因座或其在染色体外存在或随机整合进动物的染色体中。在这样的转基因小鼠中,内源免疫球蛋白基因座通常已经被灭活。关于从转基因动物获得人抗体的方法的综述,参见Lonberg,N.,Nat.Biotech.23(2005)1117-1125。也参见,例如,描述XENOMOUSE
还可以通过基于杂交瘤的方法制备人抗体。已经描述了用于生产人单克隆抗体的人骨髓瘤和小鼠-人异源骨髓瘤细胞系(参见,例如,Kozbor,D.,J.Immunol.133(1984)3001-3005;Brodeur,B.R.,等人,Monoclonal Antibody Production Techniques andApplications,Marcel Dekker,Inc.,New York(1987),第51-63页;和Boerner,P.,等人,J.Immunol.147(1991)86-95)。在Li,J.,等人,Proc.Natl.Acad.Sci.USA103(2006)3557-3562中也描述了借助人B-细胞杂交瘤技术产生的人抗体。额外的方法包括例如在以下文献中描述的那些方法:US 7,189,826(其描述从杂交瘤细胞系生产单克隆人IgM抗体)和Ni,J.,Xiandai Mianyixue 26(2006)265-268(其描述人-人杂交瘤)。在Vollmers,H.P.和Brandlein,S.,Histology and Histopathology 20(2005)927-937以及Vollmers,H.P.和Brandlein,S.,Methods and Findings in Experimental and Clinical Pharmacology27(2005)185-191中也描述了人杂交瘤技术(Trioma技术)。
通过分离选自人-衍生的噬菌体展示文库的Fv克隆可变结构域序列,也可以产生人抗体。这样的可变结构域序列随后可以与期望的人恒定结构域组合。下文描述了用于从抗体文库选择人抗体的技术。
4.文库衍生的抗体
在某些实施方案中,本文报道的二聚体多肽是文库衍生的抗体。通过对组合文库筛选具有期望的一种或多种活性的抗体,可以分离文库衍生的抗体。例如,本领域已知用于产生噬菌体展示文库并对这类文库筛选拥有期望的结合特征的抗体的多种方法。这类方法综述在,例如,Hoogenboom,H.R.等人,Methods in Molecular Biology 178(2001)1-37,且进一步描述在,例如,McCafferty,J.等人,Nature348(1990)552-554;Clackson,T.等人,Nature 352(1991)624-628;Marks,J.D.等人,J.Mol.Biol.222(1992)581-597;Marks,J.D.和Bradbury,A.,Methods in Molecular Biology 248(2003)161-175;Sidhu,S.S.等人,J.Mol.Biol.338(2004)299-310;Lee,C.V.等人,J.Mol.Biol.340(2004)1073-1093;Fellouse,F.A.,Proc.Natl.Acad.Sci.USA 101(2004)12467-12472;和Lee,C.V.等人,J.Immunol.Methods 284(2004)119-132。
在某些噬菌体展示法中,VH和VL基因的组库分别通过聚合酶链式反应(PCR)克隆并且在噬菌体文库中随机地重组,其随后可以针对抗原结合噬菌体进行筛选,如在Winter,G.,等人,Ann.Rev.Immunol.12(1994)433-455中所述。噬菌体通常展示抗体片段,作为单链Fv(scFv)片段或作为Fab片段。来自免疫过的来源的文库会提供针对免疫原的高亲和力抗体,无需构建杂交瘤。可替换地,可以(例如,从人)克隆原初库以在没有任何免疫接种的情况下提供针对广泛类型的非自身抗原以及自身抗原的抗体的单一来源,如Griffiths,A.D.,等人,EMBO J.12(1993)725-734所述。最后,通过从干细胞克隆未重排的V-基因区段并使用含有随机序列以编码高度可变的CDR3区并实现体外重排的PCR引物,也可以合成地产生原初文库,如Hoogenboom,H.R.和Winter,G.,J.Mol.Biol.227(1992)381-388所述。描述人抗体噬菌体文库的专利公开包括例如US 5,750,373和US 2005/0079574、US 2005/0119455、US 2005/0266000、US 2007/0117126、US 2007/0160598、US 2007/0237764、US2007/0292936和US 2009/0002360。
从人抗体文库分离的抗体或抗体片段被认为是本文中的人抗体或人抗体片段。
5.多特异性抗体
在某些实施方案中,本文报道的二聚体多肽是多特异性抗体,例如双特异性抗体。多特异性抗体是对至少两个不同部位具有结合特异性的单克隆抗体。在某些实施方案中,结合特异性中的一种是针对第一抗原,且另一种是针对不同的第二抗原。在某些实施方案中,双特异性抗体可以结合至相同抗原的两个不同表位。双特异性抗体也可以用来使细胞毒性剂定位至表达至少一种抗原的细胞。双特异性抗体可以被制备为全长抗体或抗体片段。
用于制备多特异性抗体的技术包括、但不限于重组共表达具有不同特异性的两个免疫球蛋白重链-轻链对(参见Milstein,C.和Cuello,A.C.,Nature305(1983)537-540,WO93/08829,和Traunecker,A.,等人,EMBO J.10(1991)3655-3659)和“凸起-进入-孔洞”工程改造(参见,例如,US 5,731,168)。也可以通过以下方式制备多特异性抗体:工程改造静电操纵效应用于制备抗体Fc-异源二聚体分子(WO 2009/089004);交联两个或更多个抗体或片段(参见,例如,US 4,676,980,和Brennan,M.等人,Science229(1985)81-83);使用亮氨酸拉链生产双特异性抗体(参见,例如,Kostelny,S.A.,等人,J.Immunol.148(1992)1547-1553);使用“双体抗体(diabody)”技术以制备双特异性抗体片段(参见,例如,Holliger,P.等人,Proc.Natl.Acad.Sci.USA90(1993)6444-6448);和使用单链Fv(scFv)二聚体(参见,例如Gruber,M等人,J.Immunol.152(1994)5368-5374);以及制备三特异性抗体,如在例如Tutt,A.等人,J.Immunol.147(1991)60-69)中所述。
本文中还包括具有三个或更多个功能性抗原结合位点的经工程改造的抗体,包括“章鱼抗体(Octopus antibodies)”(参见,例如US 2006/0025576)。
本文的抗体或片段还包括“双重作用Fab”或“DAF”(参见,例如,US 2008/0069820)。
本文中的抗体或片段也包括在WO 2009/080251、WO 2009/080252、WO 2009/080253、WO 2009/080254、WO 2010/112193、WO 2010/115589、WO 2010/136172、WO 2010/145792和WO 2010/145793中描述的多特异性抗体。
6.抗体变体
在某些实施方案中,本文报道的二聚体多肽是抗体。在其它实施方案中,预见到本文提供的抗体的氨基酸序列变体。例如,可能合乎需要的是,改善抗体的结合亲和力和/或其它生物学特性。通过向编码抗体的核苷酸序列中引入适当的修饰或通过肽合成,可以制备抗体的氨基酸序列变体。此类修饰包括,例如,从抗体的氨基酸序列删除残基和/或将残基插入所述氨基酸序列中和/或置换所述氨基酸序列内的残基。可以制备缺失、插入和置换的任意组合以获得最终构建体,前提条件是,所述最终构建体具有期望的特征,例如,抗原结合。
a)置换变体、插入变体和缺失变体
在某些实施方案中,提供具有一个或多个氨基酸置换的抗体变体。用于置换诱变的目标位点包括HVR和FR。在下表中在“优选置换”的标题下显示了保守置换。在下表中在“示例性置换”的标题下提供了更实质的变化,并且参考氨基酸侧链类别在下面进一步描述。可以将氨基酸置换引入目标抗体中并且针对期望的活性(例如,保留的/改善的抗原结合、降低的免疫原性、或改善的ADCC或CDC)来筛选产物。
氨基酸可以根据共同的侧链特性分组:
(1)疏水的:正亮氨酸、Met、Ala、Val、Leu、Ile;
(2)中性亲水的:Cys、Ser、Thr、Asn、Gln;
(3)酸性的:Asp、Glu;
(4)碱性的:His、Lys、Arg;
(5)影响链取向的残基:Gly、Pro;
(6)芳族的:Trp、TVr、Phe。
非保守置换需要将这些分类之一的成员交换为另一个分类的成员。
一类置换变体涉及置换亲本抗体(例如,人源化抗体或人抗体)的一个或多个高变区残基。通常,选择用于进一步研究的所得变体相对于亲本抗体在某些生物学特性上具有修饰(例如,改善)(例如,增加的亲和力、降低的免疫原性),和/或具有亲本抗体的基本上保留的某些生物学特性。一种示例性的置换变体是亲和力成熟的抗体,所述抗体可以例如使用基于噬菌体展示的亲和力成熟技术(诸如本文描述的那些)方便地产生。简而言之,将一个或多个HVR残基突变并且将变体抗体在噬菌体上展示和针对特定生物活性(例如结合亲和力)进行筛选。
可以在HVR中做出改变(例如,置换),例如,以改善抗体亲和力。这类改变可以在HVR“热点”(即,在体细胞成熟过程中以高频率经历突变的密码子所编码的残基(参见,例如,Chowdhury,P.S.,Methods Mol.Biol.207(2008)179-196)和/或接触抗原的残基中做出,并对得到的变体VH或VL试验结合亲和力。通过构建次级文库并从中重新选择而实现的亲和力成熟已经描述在,例如,Hoogenboom,H.R.等人.Methods in Molecular Biology178(2002)1-37中。在亲和力成熟的一些实施方案中,通过多种方法(例如,易出错的PCR、链改组或寡核苷酸-指导的诱变)的任一种,将多样性引入所选择用于成熟的可变基因中。随后建立次级文库。随后筛选该文库以鉴定具有期望亲和力的任何抗体变体。另一种引入多样性的方法涉及HVR-指导的方案,其中将几个HVR残基(例如,一次4-6个残基)随机化。可以特别地鉴定参与抗原结合的HVR残基,例如,使用丙氨酸扫描诱变或建模。特别地经常靶向CDR-H3和CDR-L3。
在某些实施方案中,置换、插入或缺失可以出现在一个或多个HVR内部,只要这类改变不实质上降低抗体的结合抗原的能力。例如,可以在HVR中做出不实质上降低结合亲和力的保守改变(例如,如本文中提供的保守置换)。这类改变可以例如在HVR的抗原接触残基的外部。在上文提供的变体VH和VL序列的某些实施方案中,每个HVR未改变或含有不超过一个、两个或三个氨基酸置换。
一种用于鉴定可以被靶向以便诱变的抗体残基或区域的有用方法称作“丙氨酸扫描诱变”,如Cunningham,B.C.和Wells,J.A.,Science 244(1989)1081-1085所述。在这种方法中,鉴定一个残基或靶残基组(例如,带电荷残基诸如Arg、Asp、His、Lys和Glu),并且用中性的或带负电荷的氨基酸(例如,丙氨酸或聚丙氨酸)替换以确定该抗体与抗原的相互作用是否受影响。可以在对初始置换显示出功能敏感性的氨基酸位置处引入其它置换。可替换地或额外地,可以使用抗原-抗体复合物的晶体结构来鉴定抗体和抗原之间的接触点。可以靶向或消除这类接触残基和邻近残基作为置换候选物。可以筛选变体以确定它们是否含有期望的特性。
氨基酸序列插入包括长度在从1个残基至含有一百个或更多个残基的多肽的范围内的氨基端和/或羧基端融合体,以及单个或多个氨基酸残基的序列内插入。末端插入的例子包括具有N-端甲硫氨酰基残基的抗体。抗体分子的其它插入变体包括抗体的N-或C-端与酶(例如针对ADEPT的酶)或增加所述抗体的血清半衰期的多肽的融合体。
在某些实施方案中,改变本文提供的抗体以增加或减少抗体被糖基化的程度。通过改变氨基酸序列从而建立或除去一个或多个糖基化位点,可以方便地实现对抗体添加或删除糖基化位点。
在抗体包含Fc区的情况下,可以改变与之连接的碳水化合物。哺乳动物细胞产生的天然抗体通常包含分枝的双天线寡糖,所述寡糖通常借助N-键连接至Fc区的CH2结构域的Asn297。参见,例如,Wright,A.和Morrison,S.L.,TIBTECH 15(1997)26-32。寡糖可以包括各种碳水化合物,例如,甘露糖、N-乙酰基葡糖胺(GlcNAc)、半乳糖和唾液酸,以及与双天线寡糖结构的“茎部”中的GlcNAc连接的岩藻糖。在一些实施方案中,可以修饰本发明的抗体中的寡糖以便建立具有某些改善的特性的抗体变体。
在一个实施方案中,提供具有碳水化合物结构的抗体变体,所述碳水化合物结构缺少与Fc区(直接地或间接地)连接的岩藻糖。例如,这类抗体中岩藻糖的量可以是1%至80%、1%至65%、5%至65%或20%至40%。通过以下方式确定岩藻糖的量:相对于如通过MALDI-TOF质谱法(例如,如WO 2008/077546中所述)所测量的与Asn297连接的全部糖结构(例如复杂结构、杂合结构和高甘露糖结构)的总和,计算糖链内在Asn297处的岩藻糖的平均量。Asn297表示位于Fc区中约位置297处的天冬酰胺残基(Fc区残基的EU编号);但是,由于抗体中的微小序列变异,Asn297也可以位于位置297的上游或下游±3个氨基酸附近,即,在位置294和300之间。这样的岩藻糖基化变体可以具有改善的ADCC功能。参见,例如,US2003/0157108;US 2004/0093621。与“去岩藻糖基化的”或“岩藻糖-缺陷型”抗体变体相关的出版物的例子包括:US 2003/0157108;WO 2000/61739;WO 2001/29246;US 2003/0115614;US 2002/0164328;US 2004/0093621;US 2004/0132140;US 2004/0110704;US2004/0110282;US 2004/0109865;WO 2003/085119;WO 2003/084570;WO 2005/035586;WO2005/035778;WO 2005/053742;WO 2002/031140;Okazaki,A.等人,J.Mol.Biol.336(2004)1239-1249;Yamane-Ohnuki,N.等人,Biotech.Bioeng.87(2004)614-622。能够生产去岩藻糖基化抗体的细胞系的例子包括在蛋白岩藻糖基化方面有缺陷的Lecl3 CHO细胞(Ripka,J.,等人,Arch.Biochem.Biophys.249(1986)533-545;US 2003/0157108;和WO 2004/056312,特别是在实施例11处)和敲除的细胞系,诸如α-1,6-岩藻糖基转移酶基因FUT8敲除的CHO细胞(参见,例如,Yamane-Ohnuki,N.,等人,Biotech.Bioeng.87(2004)614-622;Kanda,Y.,等人,Biotechnol.Bioeng.94(2006)680-688;和WO 2003/085107)。
还可以为抗体变体提供平分型的寡糖,例如,其中与抗体的Fc区连接的双天线寡糖由GlcNAc对分。这样的抗体变体可以具有减少的岩藻糖化和/或改善的ADCC功能。这样的抗体变体的例子例如描述在WO 2003/011878、US 6,602,684和US 2005/0123546中。还提供了具有与Fc区连接的、在寡糖中的至少一个半乳糖残基的抗体变体。这样的抗体变体可以具有改善的CDC功能。这样的抗体变体例如描述在WO 1997/30087、WO 1998/58964、和WO1999/22764中。
在某些实施方案中,可以将一个或多个其它氨基酸修饰引入本文报道的二聚体多肽中,由此产生Fc区变体。该Fc区变体可以包含人Fc区序列(例如,人IgG1、IgG2、IgG3或IgG4 Fc区),所述人Fc区序列包含在一个或多个氨基酸位置处的氨基酸修饰(例如,置换/突变)。
在某些实施方案中,本发明预见到具有一些但并非全部效应子功能的二聚体多肽,这使所述二聚体多肽成为下述应用的合乎需要的候选物:其中二聚体多肽的体内半衰期是重要的,而某些效应子功能(如CDC和ADCC)是不必要的或有害的。可以实施体外和/或体内细胞毒性测定以证实CDC和/或ADCC活性的降低/耗尽。例如,可以实施Fc受体(FcR)结合测定以确保二聚体多肽抗体缺少FcγR结合(因此可能缺少ADCC活性),但是保留FcRn结合能力。用于介导ADCC的原代细胞(NK细胞)仅表达FcγRIII,而单核细胞表达FcγRI、FcγRII和FcγRIII。Ravetch,J.V.和Kinet,J.P.,Annu.Rev.Immunol.9(1991)457-492的第464页上的表3中总结了造血细胞上的FcR表达。评估目标分子的ADCC活性的体外测定的非限制性例子描述在US 5,500,362(参见,例如Hellstrom,I.等人,Proc.Natl.Acad.Sci.USA 83(1986)7059-7063;和Hellstrom,I.等人,Proc.Natl.Acad.Sci.USA 82(1985)1499-1502);US 5,821,337(参见Bruggemann,M.等人,J.Exp.Med.166(1987)1351-1361)。可替换地,可以采用非放射性测定方法(参见,例如,用于流式细胞计量术的ACTI
具有减少的效应子功能的二聚体多肽包括具有Fc区残基238、265、269、270、297、327和329中的一个或多个的置换的那些(US 6,737,056)。这样的Fc区变体包含具有在氨基酸位置265、269、270、297和327中的两个或更多个位置处的置换的Fc区,包括将残基265和297置换成丙氨酸的所谓的“DANA”Fc区突变体(US 7,332,581)。
描述了具有改善的或减少的与FcR的结合的某些抗体变体(参见,例如,US 6,737,056;WO 2004/056312,和Shields,R.L.等人,J.Biol.Chem.276(2001)6591-6604)。
在某些实施方案中,二聚体多肽变体包含具有改善ADCC的一个或多个氨基酸置换(例如,在Fc区的位置298、333和/或334处的置换)(残基的EU编号)的Fc区。
在一些实施方案中,在Fc区内做出改变,所述改变导致变化的(即改善的或减少的)C1q结合和/或补体依赖性的细胞毒性(CDC),例如,如US 6,194,551、WO 99/51642和Idusogie,E.E.等人,J.Immunol.164(2000)4178-4184中所述。
在US2005/0014934中描述了具有增加的半衰期和改善的与新生儿Fc受体(FcRn)的结合的抗体,所述新生儿Fc受体负责将母源IgG转移至胎儿(Guyer,R.L.等人,J.Immunol.117(1976)587-593,和Kim,J.K.等人,J.Immunol.24(1994)2429-2434)。那些抗体包含其中具有一个或多个置换的Fc区,所述置换改善Fc区与FcRn的结合。这样的Fc区变体包括在一个或多个Fc区残基:238、256、265、272、286、303、305、307、311、312、317、340、356、360、362、376、378、380、382、413、424或434处具有置换(例如,Fc区残基434的置换)的那些(US7,371,826)。
关于Fc区变体的其它例子,也参见Duncan,A.R.和Winter,G.,Nature 322(1988)738-740;US 5,648,260;US 5,624,821;和WO 94/29351。
在某些实施方案中,可能合乎需要的是,建立半胱氨酸工程改造的二聚体多肽,例如,类似于“硫代MAb”,其中抗体的一个或多个残基用半胱氨酸残基置换。在特定实施方案中,置换的残基出现在二聚体多肽的可到达位点处。通过用半胱氨酸置换那些残基,由此使反应性巯基位于二聚体多肽的可到达位点处并且可以用于将二聚体多肽缀合至其它部分(诸如药物部分或接头-药物部分)以产生免疫缀合物,如本文中进一步所述。在某些实施方案中,可以用半胱氨酸置换以下残基中的任何一个或多个:轻链的V205(Kabat编号);重链的A118(EU编号);和重链Fc区的S400(EU编号)。可以如例如US 7,521,541中所述产生半胱氨酸工程改造的二聚体多肽。
在某些实施方案中,可以进一步修饰本文报道的二聚体多肽以含有本领域已知的且容易得到的额外非蛋白性部分。
适合用于衍生化二聚体多肽的部分包括、但不限于水溶性聚合物。水溶性聚合物的非限制性例子包括、但不限于聚乙二醇(PEG)、乙二醇/丙二醇的共聚物、羧甲纤维素、葡聚糖、聚乙烯醇、聚乙烯吡咯烷酮、聚-1,3-二氧杂环戊烷、聚-1,3,6-三氧杂环己烷、亚乙基/马来酸酐共聚物、聚氨基酸(同聚物或无规共聚物)和葡聚糖或聚(n-乙烯基吡咯烷酮)聚乙二醇、丙二醇同聚物、聚环氧丙烷/环氧乙烷共聚物、聚氧乙基化多元醇(例如,丙三醇)、聚乙烯醇和它们的混合物。由于它在水中的稳定性,聚乙二醇丙醛可以具有制造方面的优点。所述聚合物可以具有任何分子量,并可以是分枝或不分枝的。与二聚体多肽连接的聚合物的数目可以变动,并且如果连接超过一个聚合物,它们可以是相同或不同的分子。一般而言,用于衍生化的聚合物的数目和/或类型可以基于以下考虑事项确定:包括、但不限于待改善的二聚体多肽的特定特性或功能,二聚体多肽衍生物是否将用在确定条件下的疗法中等。
在另一个实施方案中,提供了本文报道的二聚体多肽和可以通过暴露于辐射而选择性地加热的非蛋白性部分的缀合物。在一个实施方案中,非蛋白性部分是碳纳米管(Kam,N.W.等人,Proc.Natl.Acad.Sci.USA 102(2005)11600-11605)。辐射可以具有任何波长,并包括、但不限于这样的波长:其不伤害普通细胞,但是其将非蛋白性部分加热至杀伤在二聚体多肽-非蛋白性部分附近的细胞的温度。
存在几种修饰CH3以增强异源二聚化的方案,所述方案例如在WO 96/27011、WO98/050431、EP 1870459、WO 2007/110205、WO 2007/147901、WO 2009/089004、WO 2010/129304、WO 2011/90754、WO 2011/143545、WO 2012058768、WO 2013157954、WO 2013096291中充分描述。典型地,在所有这样的方案中,第一CH3结构域和第二CH3结构域均以互补方式工程改造,使得每个CH3结构域(或包含它的重链)不再与自身同源二聚化,而是被迫与互补工程改造的其它CH3结构域异源二聚化(使得第一和第二CH3结构域异源二聚化,并且在两个第一CH3结构域之间或两个第二CH3结构域之间不形成同源二聚体)。预见到用于改善重链异源二聚化的这些不同方案作为根据本发明的多特异性抗体中与重链-轻链修饰组合的不同替代方案(在一个结合臂中VH和VL交换/替换,并且在CH1/CL界面中引入带相反电荷的带电荷氨基酸置换),这会减少轻链错误配对的Bence-Jones型副产物。
在本发明的一个优选实施方案中(在多特异性抗体包含在重链中的CH3结构域的情况下),通过“凸起-进入-孔洞”技术可以改变根据本发明的所述多特异性抗体的CH3结构域,所述技术与几个实施例一起详述在例如WO 96/027011,Ridgway,J.B.,等人,ProteinEng.9(1996)617-621;和Merchant,A.M.,等人,Nat.Biotechnol.16(1998)677-681;WO 98/050431中。在这种方法中,改变两个CH3结构域的相互作用表面以增加含有这两个CH3结构域的两条重链的异源二聚化。(两条重链的)两个CH3结构域中的每一个可以是“凸起”,而其它是“孔洞”。二硫键的引入进一步稳定异源二聚体(Merchant,A.M.,等人,NatureBiotech.16(1998)677-681;Atwell,S.,等人,J.Mol.Biol.270(1997)26-35)并增加收率。
因此,在本发明的一个实施方案中,所述多特异性抗体(包含在每条重链中的CH3结构域并且)进一步特征在于
在a)下的抗体的第一重链的第一CH3结构域和在b)下的抗体的第二重链的第二CH3结构域各自在包含抗体CH3结构域之间的初始界面的界面处会合。
其中改变所述界面以促进多特异性抗体的形成,其中所述改变特征在于:
i)改变一条重链的CH3结构域,从而在多特异性抗体内部与另一条重链的CH3结构域的初始界面会合的一条重链的CH3结构域的初始界面中,将氨基酸残基替换为具有更大侧链体积的氨基酸残基,由此在一个重链的CH3结构域的界面内部产生突出部分,所述突出部分可放置在另一个重链的CH3结构域的界面内部的腔中,
和
ii)改变另一条重链的CH3结构域,从而在多特异性抗体内部与第一CH3结构域的初始界面会合的第二CH3结构域的初始界面中,将氨基酸残基替换为具有更小侧链体积的氨基酸残基,由此在第二CH3结构域的界面内部产生腔,在所述腔内部可放置第一CH3结构域的界面内部的突出部分。
优选地,所述具有更大侧链体积的氨基酸残基选自精氨酸(R)、苯丙氨酸(F)、酪氨酸(Y)、色氨酸(W)。
优选地,所述具有更小侧链体积的氨基酸残基选自丙氨酸(A)、丝氨酸(S)、苏氨酸(T)、缬氨酸(V)。
在本发明的一个方面,如下进一步改变两个CH3结构域:引入半胱氨酸(C)作为每个CH3结构域的相应位置中的氨基酸,从而可以形成两个CH3结构域之间的二硫键。
在一个优选的实施方案中,所述多特异性抗体包含在“凸起链”的第一CH3结构域中的氨基酸T366W突变和在“孔洞链”的第二CH3结构域中的氨基酸T366S、L368A、Y407V突变。也可以使用CH3结构域之间的另一个链间二硫键(Merchant,A.M.,等人,NatureBiotech.16(1998)677-681),例如通过向“孔洞链”的CH3结构域中引入氨基酸Y349C突变和向“凸起链”的CH3结构域中引入氨基酸E356C突变或氨基酸S354C突变。
在一个优选的实施方案中,所述多特异性抗体(其包含在每条重链中的CH3结构域)包含在两个CH3结构域之一中的氨基酸S354C、T366W突变和在两个CH3结构域的另一个结构域中的氨基酸Y349C、T366S、L368A、Y407V突变(在一个CH3域中的额外氨基酸S354C突变和另一个CH3域中的额外氨基酸Y349C突变形成链间二硫键)(根据Kabat编号)。
预见到用于修饰CH3以增强异源二聚化的其它技术作为本发明的替代技术,并且它们描述在例如WO 96/27011、WO 98/050431、EP 1870459、WO 2007/110205、WO 2007/147901、WO 2009/089004、WO 2010/129304、WO 2011/90754、WO 2011/143545、WO 2012/058768、WO 2013/157954、WO 2013/096291中。
在一个实施方案中,可以可替换地使用在EP 1 870 459A1中描述的异源二聚化方案。该方案基于在两条重链之间的CH3/CH3结构域界面的特定氨基酸位置处引入带相反电荷的带电氨基酸的置换/突变。所述多特异性抗体的一个优选实施方案是在(多特异性抗体的)第一CH3结构域中的氨基酸R409D、K370E突变和在多特异性抗体的第二CH3结构域中的氨基酸D399K、E357K突变(根据Kabat编号)。
在另一个实施方案中,所述多特异性抗体包含在“凸起链”的CH3结构域中的氨基酸T366W突变和在“孔洞链”的CH3结构域中的氨基酸T366S、L368A、Y407V突变,以及额外在“凸起链”的CH3结构域中的氨基酸R409D、K370E突变和在“孔洞链”的CH3结构域中的氨基酸D399K、E357K突变。
在另一个实施方案中,所述多特异性抗体包含在两个CH3结构域之一中的氨基酸S354C、T366W突变和在两个CH3结构域的另一结构域中的氨基酸Y349C、T366S、L368A、Y407V突变,或者所述多特异性抗体包含在两个CH3结构域之一中的氨基酸Y349C、T366W突变和在两个CH3结构域的另一结构域中的氨基酸S354C、T366S、L368A、Y407V突变,以及额外在“凸起链”的CH3结构域中的氨基酸R409D、K370E突变和在“孔洞链”的CH3结构域中的氨基酸D399K、E357K突变。
在一个实施方案中,可以可替换地使用WO2013/157953中描述的异源二聚化方案。在一个实施方案中,第一CH3结构域包含氨基酸T366K突变,并且第二CH3结构域多肽包含氨基酸L351D突变。在另一个实施方案中,第一CH3结构域包含其它氨基酸L351K突变。在另一个实施方案中,第二CH3结构域包含选自Y349E、Y349D和L368E(优选地L368E)的其它氨基酸突变。
在一个实施方案中,可以可替换地使用WO2012/058768中描述的异源二聚化方案。在一个实施方案中,第一CH3结构域包含氨基酸L351Y、Y407A突变,并且第二CH3结构域包含氨基酸T366A、K409F突变。在另一个实施方案中,第二CH3结构域包含在位置T411、D399、S400、F405、N390或K392处的其它氨基酸突变,所述氨基酸突变例如选自a)T411 N、T411 R、T411Q、T411 K、T411D、T411E或T411W,b)D399R、D399W、D399Y或D399K、c S400E、S400D、S400R或S400K、F405I、F405M、F405T、F405S、F405V或F405W N390R、N390K或N390D K392V、K392M、K392R、K392L、K392F或K392E。在另一个实施方案中,第一CH3结构域包含氨基酸L351Y、Y407A突变,且第二CH3结构域包含氨基酸T366V、K409F突变。在另一个实施方案中,第一CH3结构域包含氨基酸Y407A突变,且第二CH3结构域包含氨基酸T366A、K409F突变。在另一个实施方案中,第二CH3结构域包含另一个氨基酸K392E、T411E、D399R和S400R突变。
在一个实施方案中,可以可替换地使用WO2011/143545中描述的异源二聚化方案,例如具有在选自368和409的位置处的氨基酸修饰。
在一个实施方案中,可以可替换地使用WO2011/090762中描述的异源二聚化方案,所述方案也使用上文所述的凸起-进入-孔洞技术。在一个实施方案中,第一CH3结构域包含氨基酸T366W突变,且第二CH3结构域包含氨基酸Y407A突变。在一个实施方案中,第一CH3结构域包含氨基酸T366Y突变,且第二CH3结构域包含氨基酸Y407T突变。
在一个实施方案中,所述多特异性抗体属于IgG2同种型,并且可以可替换地使用WO2010/129304中描述的异源二聚化方案。
在一个实施方案中,可以可替换地使用WO2009/089004中描述的异源二聚化方案。在一个实施方案中,第一CH3结构域包含带负电荷氨基酸(例如谷氨酸(E)或天冬氨酸(D)、优选地K392D或N392D)对K392或N392的氨基酸置换,并且第二CH3结构域包含带正电荷氨基酸(例如赖氨酸(K)或精氨酸(R)、优选地D399K、E356K、D356K或E357K和更优选地D399K和E356K)对D399、E356、D356或E357的氨基酸置换。在另一个实施方案中,第一CH3结构域还包含带负电荷氨基酸(例如谷氨酸(E)或天冬氨酸(D)、优选地K409D或R409D)对K409或R409的氨基酸置换。在另一个实施方案中,第一CH3结构域进一步或另外地包含带负电荷氨基酸(例如谷氨酸(E),或天冬氨酸(D))对K439和/或K370的氨基酸置换。
在一个实施方案中,可以可替换地使用WO2007/147901中描述的异源二聚化方案。在一个实施方案中,第一CH3结构域包含氨基酸K253E、D282K和K322D突变,且第二CH3结构域包含氨基酸D239K、E240K和K292D突变。
在一个实施方案中,可以可替换地使用WO2007/110205中描述的异源二聚化方案。
使用重组方法和组合物可以生产抗体,例如,如在US 4,816,567中所述。在一个实施方案中,提供了分离的核酸,其编码本文报道的二聚体多肽。这样的核酸可以编码包含二聚体多肽的第一多肽的氨基酸序列和/或包含二聚体多肽的第二多肽的氨基酸序列。在另一个实施方案中,提供了一种或多种包含所述核酸的载体(例如,表达载体)。在另一个实施方案中,提供了包含所述核酸的宿主细胞。在一个这样的实施方案中,宿主细胞包含以下载体(例如,已经用以下载体转化):(1)包含特定核酸的载体,所述核酸编码包含二聚体多肽的第一多肽的氨基酸序列和包含二聚体多肽的第二多肽的氨基酸序列,或(2)第一载体和第二载体,所述第一载体包含特定核酸,所述核酸编码包含二聚体多肽的第一多肽的氨基酸序列,所述第二载体包含特定核酸,所述核酸编码包含二聚体多肽的第二多肽的氨基酸序列。在一个实施方案中,所述宿主细胞是真核细胞,例如中国仓鼠卵巢(CHO)细胞或淋巴样细胞(例如,Y0、NS0、Sp20细胞)。在一个实施方案中,提供了制备本文报道的二聚体多肽的方法,其中所述方法包括:在适合表达所述二聚体多肽的条件下培养如上提供的包含编码所述二聚体多肽的核酸的宿主细胞,和任选地,从宿主细胞(或宿主细胞培养基)回收抗体。
为了重组生产本文报道的二聚体多肽,分离编码二聚体多肽的核酸,例如,如上所述,并将其插入一种或多种载体中用以在宿主细胞中进一步克隆和/或表达。可以使用常规操作容易地对这样的核酸进行分离和测序(例如,通过使用能够特异性结合编码变体Fc区多肽以及抗体的重链和轻链的基因的寡核苷酸探针)。
适用于克隆或表达编码二聚体多肽的载体的宿主细胞包括本文描述的原核或真核细胞。例如,二聚体多肽可以在细菌中制备,尤其是在不需要糖基化和Fc效应子功能时。对于抗体片段和多肽在细菌中的表达,参见,例如,US 5,648,237、US 5,789,199和US 5,840,523(也参见Charlton,K.A.,见:Methods in Molecular Biology,第248卷,Lo,B.K.C.(编),Humana Press,Totowa,NJ(2003),第245-254页,其描述了抗体片段在大肠杆菌中的表达)。在表达后,可以将二聚体多肽与可溶级分中的细菌细胞糊分离,并且可以进一步纯化。
除了原核生物以外,真核微生物诸如丝状真菌或酵母是编码二聚体多肽的载体的合适克隆或表达宿主,包括其糖基化途径已经被“人源化”的真菌和酵母菌株,从而导致具有部分地或完全地人糖基化模式的二聚体多肽的生产。参见Gerngross,T.U.,Nat.Biotech.22(2004)1409-1414;和Li,H.等人,Nat.Biotech.24(2006)210-215。
适合用于表达糖基化二聚体多肽的宿主细胞也衍生自多细胞的生物体(无脊椎动物和脊椎动物)。无脊椎动物细胞的例子包括植物和昆虫细胞。已经鉴别出众多可以与昆虫细胞结合使用的杆状病毒菌株,特别是用于转染草地贪夜蛾(Spodoptera frugiperda)细胞。
植物细胞培养物也可以用作宿主。参见,例如,US 5,959,177、US 6,040,498、US6,420,548、US 7,125,978和US 6,417,429(描述了用于在转基因植物中生产抗体的PLANTIBODIES
脊椎动物细胞也可以用作宿主。例如,适合悬浮培养的哺乳动物细胞系可能是有用的。有用的哺乳动物宿主细胞系的其它例子是用SV40转化的猴肾CV1系(COS-7);人胚肾系(HEK293或293细胞,其描述在例如Graham,F.L.,等人,J.Gen Virol.36(1977)59-74中);幼仓鼠肾细胞(BHK);小鼠塞尔托利细胞(TM4细胞,其描述在例如Mather,J.P.,Biol.Reprod.23(1980)243-252中);猴肾细胞(CV1);非洲绿猴肾细胞(VERO-76);人宫颈癌细胞(HELA);犬肾细胞(MDCK);水牛大鼠肝细胞(BRL 3A);人肺细胞(W138);人肝细胞(HepG2);小鼠乳腺肿瘤(MMT 060562);TRI细胞,其描述在例如Mather,J.P.,等人,AnnalsN.Y.Acad.Sci.383(1982)44-68中;MRC 5细胞;和FS4细胞。其它有用的哺乳动物宿主细胞系包括中国仓鼠卵巢(CHO)细胞,包括DHFR-CHO细胞(Urlaub,G.,等人,Proc.Natl.Acad.Sci.USA 77(1980)4216-4220);和骨髓瘤细胞系诸如Y0、NS0和Sp2/0。关于适合用于抗体生产的某些哺乳动物宿主细胞系的综述,参见,例如,Yazaki,P.和Wu,A.M.,Methods in Molecular Biology(分子生物学中的方法),第248卷,Lo,B.K.C.(编),Humana Press,Totowa,NJ(2004),第255-268页。
在某些实施方案中,本文报道的二聚体多肽或本文报道的药物制剂单独施用(不具有另外的治疗剂),用于治疗一种或多种本文描述的眼血管疾病。
在其它实施方案中,本文报道的二聚体多肽抗体或药物制剂与一种或多种另外的治疗剂或方法联合施用,用于治疗一种或多种本文描述的血管性眼病。
在其它实施方案中,本文报道的二聚体多肽或药物制剂与一种或多种另外的治疗剂联合配制并施用用于治疗一种或多种本文描述的血管性眼病。
在某些实施方案中,本文提供的联合治疗包括,将本文报道的二聚体多肽或药物制剂与一种或多种另外的治疗剂依次施用用于治疗一种或多种本文描述的眼血管疾病。
所述另外的治疗剂包括,但不限于,色氨酰-tRNA合成酶(TrpRS),EyeOOl(抗-VEGF聚乙二醇化的适体),角鲨胺,RETAANE(TM)(用于贮库混悬液的乙酸阿奈可他(anecortaveacetate);Alcon,Inc.),考布他汀A4前药(Combretastatin A4 Prodrug,CA4P),MACUGEN(TM),MIFEPREX(TM)(米非司酮(mifepristone)-ru486),眼球筋膜下曲安奈德(triamcinolone acetonide),玻璃体内结晶曲安奈德(intravitreal crystallinetriamcinolone acetonide),普啉司他(Prinomastat)(AG3340-合成的基质金属蛋白酶抑制剂,Pfizer),氟西奈德(fluocinolone acetonide)(包括氟轻松眼内植入物(fluocinolone intraocular implant),Bausch&Lomb/Control Delivery Systems),VEGFR抑制剂(Sugen),VEGF-Trap(Regeneron/Aventis),VEGF受体酪氨酸激酶抑制剂诸如4-(4-溴-2-氟苯胺基)-6-甲氧基-7-(1-甲基哌啶-4-基甲氧基)喹唑啉(ZD6474),4-(4-氟-2-甲基吲哚-5-基氧基)-6-甲氧基-7-(3-吡咯烷-1-基丙氧基)喹唑啉(AZD2171),伐他拉尼(vatalanib)(PTK787)和SU1 1248(舒尼替尼(sunitinib)),利诺胺(linomide),和整联蛋白v.β.3功能和血管生成抑制因子的抑制剂。
可以与本文报道的二聚体多肽或药物制剂联合使用的其它药物治疗剂包括,但不限于,使用非热激光的VISUDYNE(TM),PKC 412,Endovion(NeuroSearch A/S),神经营养因子,包括,例如,胶质细胞衍生的神经营养因子和睫状神经营养因子,diatazem,多佐胺(dorzolamide),Phototrop,9-顺式-视黄醛,眼药(包括Echo治疗),包括碘依可酯(phospholine iodide)或依可酯(echothiophate)或碳酸酐酶抑制药(carbonicanhydrase inhibitors),AE-941(AEterna Laboratories,Inc.),Sirna-027(SimaTherapeutics,Inc.),培加他尼(pegaptanib)(NeXstar Pharmaceuticals/GileadSciences),神经营养蛋白(neurotrophins)(包括,仅是举例,NT-4/5,Genentech),Cand5(Acuity Pharmaceuticals),INS-37217(Inspire Pharmaceuticals),整联蛋白拮抗剂(包括来自Jerini AG和Abbott Laboratories的那些),EG-3306(Ark Therapeutics Ltd.),BDM-E(BioDiem Ltd.),沙立度胺(thalidomide)(例如,由EntreMed,Inc.使用),心脏营养素-1(cardiotrophin-1)(Genentech),2-甲氧雌二醇(2-methoxyestradiol)(Allergan/Oculex),DL-8234(Toray Industries),NTC-200(Neurotech),四硫钼酸盐(tetrathiomolybdate)(University of Michigan),LYN-002(Lynkeus Biotech),微藻(microalgal)化合物(Aquasearch/Albany,Mera Pharmaceuticals),D-9120(CelltechGroup plc.),ATX-S10(Hamamatsu Photonics),TGF-β2(Genzyme/Celtrix),酪氨酸激酶抑制剂(Allergan,SUGEN,Pfizer),NX-278-L(NeXstar Pharmaceuticals/GileadSciences),Opt-24(OPTIS France SA),视网膜细胞神经节神经保护剂(retinal cellganglion neuroprotectants)(Cogent Neurosciences),N-硝基吡唑衍生物(Texas A&MUniversity System),KP-102(Krenitsky Pharmaceuticals),环孢素A(cyclosporin A),Timited视网膜易位,光动力学治疗,(包括,仅以举例方式,靶向受体的PDT,Bristol-MyersSquibb,Co.;与PDT一起注射的卟吩姆钠(porfimer sodium);维替泊芬(verteporfin),QLTInc.;罗培泊芬(rostaporfin)与PDT,Miravent Medical Technologies;他拉泊芬钠(talaporfin sodium)与PDT,Nippon Petroleum;莫特沙芬镥(motexafin lutetium),Pharmacyclics,Inc.),反义寡核苷酸(包括,例如,由Novagali Pharma SA和ISIS-13650,Isis Pharmaceuticals测试的产品),激光光凝术,玻璃疣激光术,黄斑裂孔手术,黄斑易位手术,可植入的微型镜管,Phi-Motion血管造影术(还称为显微-激光治疗(Micro-LaserTherapy)和Feeder Vessel治疗),质子束治疗,微刺激治疗,视网膜剥离和玻璃体手术,巩膜扣(Scleral Buckle),黄斑下手术(Submacular Surgery),经瞳孔的热治疗(Transpupillary Thermotherapy),光系统I治疗,应用RNA干扰(RNAi),体外rheopheresis(extracorporeal rheopheresis)(也称为膜分化的过滤和Rheotherapy(membranedifferential filtration and Rheotherapy)),微型芯片植入,干细胞治疗,基因替换治疗,核酶基因治疗(包括关于缺氧响应元件的基因治疗,Oxford Biomedica;Lentipak,Genetix;PDEF基因治疗,GenVec),光感受器/视网膜细胞移植(包括可移植的视网膜上皮细胞,Diacrin,Inc.;视网膜细胞植入物,Cell Genesys,Inc.),和针灸。
任何抗血管生成剂可以与本文报道的二聚体多肽或药物制剂联合使用,包括,但不限于,Carmeliet和Jain(Nature 407(2000)249-257)所列出的那些。在某些实施方案中,所述抗血管生成剂是另一种VEGF拮抗剂或VEGF受体拮抗剂,如VEGF变体、可溶性VEGF受体片段、能够阻断VEGF或VEGFR的适体、中和抗-VEGFR抗体、低分子量的VEGFR酪氨酸激酶抑制剂和它们的任意组合,并且这些包括抗-VEGF适体(例如,培加尼布(Pegaptanib)),可溶性重组诱饵受体(例如VEGF Trap)。在某些实施方案中,所述抗血管生成剂包括皮质类固醇,拮抗剂类固醇,乙酸阿奈可他,血管生成抑制因子(angiostatin),内皮他丁(endostatin),减少VEGFR或VEGF配体表达的小干扰RNA′s,使用酪氨酸激酶抑制剂的后-VEGFR阻断,MMP抑制剂,IGFBP3,SDF-1阻断剂,PEDF,γ-分泌酶,δ-样配体4,整联蛋白拮抗剂,HIF-1α阻断,蛋白激酶CK2阻断,和使用血管内皮钙粘蛋白(CD-144)和间质衍生的因子(SDF)-I抗体抑制归巢到新生血管生成位点的干细胞(即,内皮祖细胞)。还可以使用靶向VEGF受体的小分子RTK抑制剂,包括PTK787。还可以使用具有抗新生血管形成的活性的试剂(不必是抗-VEGF化合物),并且包括抗炎性药物,m-Tor抑制剂,雷帕霉素(rapamycin),依维莫司(everolismus),坦罗莫司(temsirolismus),环孢素(cyclospohne),抗-TNF试剂,抗-补体试剂,和非类固醇类的抗炎剂。还可以使用神经保护性且能够潜在地减少干性黄斑变性的进展的试剂,诸如称为‘神经类固醇’的药物种类。这些包括下述药物,如脱氢表雄酮(dehydroepiandrosterone)(DHEA)(商标名称:Prastera(R)和Fidelin(R)),硫酸脱氢表雄酮(dehydroepiandrosterone sulfate),和硫酸孕烯诺龙(pregnenolone sulfate)。任何AMD(年龄相关的黄斑变性)治疗剂可以与根据本发明的双特异性抗体或药物组合物联合使用,包括,但不限于,与PDT组合的维替泊芬,培加他尼钠(pegaptanib sodium),锌或抗氧化剂(单独的或以任意组合的)。
通过将具有期望纯度的这种二聚体多肽与一种或多种任选的药用载体(Remington′s Pharmaceutical Sciences,第16版,Osol,A.(编)(1980))混合,制备低压冻干制剂或水溶液形式的本文报道的二聚体多肽的药物制剂。药用载体通常在所用的剂量和浓度对接受者是无毒的,并且包括、但不限于:缓冲剂诸如磷酸盐、柠檬酸盐和其它有机酸;抗氧化剂,包括抗坏血酸和甲硫氨酸;防腐剂(诸如十八烷基二甲基苄基氯化铵;氯化六甲双铵;苯扎氯铵;苄索氯铵;苯酚、丁醇或苯甲醇;对羟基苯甲酸烷基酯诸如对羟基苯甲酸甲酯或对羟基苯甲酸丙酯;儿茶酚;间苯二酚;环己醇;3-戊醇;和间甲酚);低分子量(小于约10个残基)多肽;蛋白,诸如血清白蛋白、明胶或免疫球蛋白;亲水聚合物诸如聚(乙烯基吡咯烷酮);氨基酸诸如甘氨酸、谷氨酰胺、天冬酰胺、组氨酸、精氨酸或赖氨酸;单糖类、二糖类和其它碳水化合物类,包括葡萄糖、甘露糖或糊精;螯合剂诸如EDTA;糖类诸如蔗糖、甘露醇、海藻糖或山梨醇;形成盐的抗衡离子诸如钠;金属络合物(例如Zn-蛋白复合物);和/或非离子型表面活性剂,诸如聚乙二醇(PEG)。本文中的示例性的药用载体还包括间质药物分散剂诸如可溶性的中性活性透明质酸酶糖蛋白(sHASEGP),例如,人可溶性的PH-20透明质酸酶糖蛋白,诸如rhuPH20(
示例性的低压冻干的抗体制剂描述在US 6,267,958中。水性抗体制剂包括在US6,171,586和WO 2006/044908中描述的那些,后一类制剂包含组氨酸-乙酸盐缓冲剂。
本文中的制剂也可以根据正在治疗的特定适应症的需要而含有超过一种活性成分,优选地是具有不会不利地彼此影响的互补活性的那些。这样的活性成分以对于预期目的而言有效的量适当地存在。
活性成分可以包埋在例如分别通过凝聚技术或界面聚合制备的微胶囊(例如,羟甲基纤维素微胶囊或明胶微胶囊和聚(甲基丙烯酸甲酯)微胶囊)、胶态药物递送系统(例如,脂质体、白蛋白微球体、微乳液、纳米粒子和纳米胶囊)或大乳剂中。这样的技术公开在Remington′s Pharmaceutical Sciences,第16版,Osol,A.(编)(1980)。
可以制备持续释放制剂。持续释放制剂的合适例子包括含有抗体的固态疏水聚合物的半透性基质,所述基质呈成形制品(例如薄膜或微胶囊)的形式。
待用于体内施用的制剂通常是无菌的。可以容易地实现无菌性,例如通过穿过无菌滤膜过滤。
本文报道的任何二聚体多肽可以用在治疗方法中。
在一个方面,提供了用作药物的本文报道的二聚体多肽。在另一个方面,提供一种用于治疗眼血管疾病的二聚体多肽。在某些实施方案中,提供一种用在治疗方法中的二聚体多肽。在某些实施方案中,本发明提供了一种用在治疗具有眼血管疾病的个体的方法中的二聚体多肽,所述方法包括给所述个体施用有效量的本文报道的二聚体多肽。在一个这样的实施方案中,所述方法还包括给个体施用有效量的至少一种另外的治疗剂,例如,如上面在部分D中所述的。在其它实施方案中,本发明提供了一种用于在眼中抑制血管生成的二聚体多肽。在某些实施方案中,本发明提供了一种用在抑制个体中的血管生成的方法中的二聚体多肽,所述方法包括给所述个体施用有效的二聚体多肽以抑制血管生成。根据任意上述实施方案的“个体”在一个优选的实施方案中是人。
在另一个方面,本发明提供了二聚体多肽在制造或制备药物中的用途。在一个实施方案中,所述药物用于治疗眼血管疾病。在另一个实施方案中,所述药物用在治疗眼血管疾病的方法中,所述方法包括给具有眼血管疾病的个体施用有效量的药物。在一个这样的实施方案中,所述方法还包括给个体施用有效量的至少一种另外的治疗剂,例如如上所述的。在另一个实施方案中,所述药物用于抑制血管生成。在另一个实施方案中,所述药物用在抑制个体中血管生成的方法中,所述方法包括给所述个体施用有效量的药物以抑制血管生成。根据任意上述实施方案的“个体”可以是人。
在另一个方面,本发明提供了一种用于治疗血管性眼病的方法。在一个实施方案中,所述方法包括给患有这样的血管性眼病的个体施用有效量的本文报道的二聚体多肽。在一个这样的实施方案中,所述方法还包括给所述个体施用有效量的至少一种另外的治疗剂,如下文所述。根据任意上述实施方案的“个体”可以是人。
在另一个方面,本发明提供了一种用于抑制个体的眼中血管生成的方法。在一个实施方案中,所述方法包括给个体施用有效量的本文报道的二聚体多肽以抑制血管生成。在一个实施方案中,“个体”是人。
在另一个方面,本发明提供了药物制剂,其包含本文报道的二聚体多肽中的任一种,例如,用在任意上述治疗方法中。在一个实施方案中,药物制剂包含本文报道的二聚体多肽中的任一种和药用载体。在另一个实施方案中,药物制剂包含本文报道的二聚体多肽中的任一种和至少一种另外的治疗剂,例如,如下文所述的。
在治疗中,本文报道的二聚体多肽可以单独使用或与其它药剂联合使用。例如,本文报道的二聚体多肽可以与至少一种另外的治疗剂共同施用。
本文报道的二聚体多肽(和任意的另外的治疗剂)可以通过任意合适的方式施用,包括胃肠外、肺内和鼻内施用,并且,如果需要局部治疗,病灶内施用。胃肠外输注包括肌肉内、静脉内、动脉内、腹膜内或皮下施用。定量给药可以是通过任意适当的途径,例如通过注射,诸如静脉内或皮下注射,部分地取决于施用是否是短暂的或长期的。各种定量给药计划包括但不限于在不同时间点单次或多次施用,推注施用,并且在本文中预见到脉冲输注。
以与良好医学实践一致的方式,配制、定量给药和施用本文报道的二聚体多肽。在该背景下考虑的因素包括正在治疗的特定障碍、正在治疗的特定哺乳动物、个体患者的临床状况、障碍的起因、药剂的递送位点、施用方法、施用调度和医学从业人员已知的其它因素。二聚体多肽不需要、但任选地与一种或多种当前用于预防或治疗讨论的障碍的药剂一起使用。这样的其它药剂的有效量取决于存在于所述制剂中的二聚体多肽的量,障碍或治疗的类型,和上文讨论的其它因素。这些通常以相同剂量并且以本文所述的施用途径使用,或以本文所述的剂量的约1至99%、或以经验上/临床上确定为合适的任意剂量和任意途径使用。
为了预防或治疗疾病,本文报道的二聚体多肽(当单独地或与一种或多种其它另外的治疗剂联合使用时)的适当剂量将取决于要治疗的疾病的类型、二聚体多肽的类型、疾病的严重程度和进程、施用二聚体多肽是否为了预防或治疗目的、在前的治疗、患者的临床史和对二聚体多肽的应答以及主治医师的判断。适当地将二聚体多肽一次性地或经一系列治疗施用给患者。根据疾病的类型和严重程度,约1μg/kg至15mg/kg(例如0.5mg/kg至10mg/kg)的二聚体多肽可以是施用给患者的初始候选剂量,例如,不论通过一次或多次单独施用,还是通过连续输注。一个典型的每日剂量可以是从约1μg/kg至100mg/kg或更多,取决于上文提及的因素。对于根据状况经数天或更长时间的重复施用,治疗通常是持续的,直到出现期望的的疾病症状的抑制。二聚体多肽的一个示例性剂量是在约0.05mg/kg至约10mg/kg的范围内。因此,可以将一个或多个约0.5mg/kg、2.0mg/kg、4.0mg/kg或10mg/kg的剂量(或它们的任意组合)施用给患者。这样的剂量可以间歇地施用,例如每周或每三周(例如使得患者接受约二至约二十个,或例如约六个剂量的二聚体多肽)。可以施用初始的较高负荷剂量,随后可以施用一个或多个较低剂量。通过常规技术和测定可以容易地监测这种治疗的进展。
III.制成品
在发明的另一方面,提供了制成品,其含有用于治疗、预防和/或诊断上文所述的障碍的材料。制成品包含容器和贴在容器上或与容器结合的标签或包装说明书。适当的容器包括,例如,瓶子、管形瓶、注射器、静脉内溶液袋等。所述容器可以由多种材料如玻璃或塑料制成。所述容器容纳单独的组合物或与另一种可有效地治疗、预防和/或诊断病症的组合物组合的组合物,且可以具有无菌进入口(例如,容器可以是静脉内溶液袋或具有可被皮下注射针头刺穿的塞子的瓶子)。组合物内的至少一种活性剂是本文报道的二聚体多肽。所述标签或包装说明书指示,所述组合物用于治疗选择的病症。此外,制成品可以包含(a)具有包含在其中的组合物的第一容器,其中所述组合物包含本文报道的二聚体多肽;和(b)具有包含在其中的组合物的第二容器,其中所述组合物包含另一种细胞毒性治疗剂或其它的治疗剂。本发明的该实施方案中的制成品还可以包含包装说明书,所述包装说明书指示所述组合物可以用于治疗特定病症。可替换地,或另外,制品可以进一步包含第二(或第三)容器,所述容器包含药用缓冲液,诸如抑制细菌注射用水(BWFI)、磷酸盐缓冲盐水、林格氏溶液和葡萄糖溶液。制品可以进一步包含从商业和用户观点看合乎需要的其它材料,包括其它缓冲液、稀释剂、过滤器、针头和注射器。
应当理解,替代本文报道的二聚体多肽或除了本文报道的二聚体多肽之外,任意上述制成品可以包括本文报道的免疫缀合物。
IV.具体实施方案
1.一种二聚体多肽,其包含
第一多肽和第二多肽,所述第一多肽和第二多肽各自在N-端至C-端方向包含含有一个或多个半胱氨酸残基的免疫球蛋白铰链区的至少一部分、免疫球蛋白CH2-结构域和免疫球蛋白CH3-结构域,
其中
i)所述第一多肽和所述第二多肽包含突变H310A、H433A和Y436A,或者
ii)所述第一多肽和所述第二多肽包含突变L251D、L314D和L432D,或者
iii)所述第一多肽和所述第二多肽包含突变L251S、L314S和L432S,或者
iv)所述第一多肽包含突变I253A、H310A和H435A,且所述第二多肽包含突变H310A、H433A和Y436A,或者
v)所述第一多肽包含突变I253A、H310A和H435A,且所述第二多肽包含突变L251D、L314D和L432D,或者
vi)所述第一多肽包含突变I253A、H310A和H435A,且所述第二多肽包含突变L251S、L314S和L432S。
2.根据项目1所述的二聚体多肽,其特征在于,所述二聚体多肽不特异性结合人FcRn且特异性结合葡萄球菌蛋白A。
3.根据项目1-2中的任一项所述的二聚体多肽,其特征在于,所述二聚体多肽是同源二聚体多肽。
4.根据项目1-2中的任一项所述的二聚体多肽,其特征在于,所述二聚体多肽是异源二聚体多肽。
5.根据项目1-4中的任一项所述的二聚体多肽,其特征在于,i)所述第一多肽还包含突变Y349C、T366S、L368A和Y407V,且所述第二多肽包含突变S354C和T366W或ii)所述第一多肽还包含突变S354C、T366S、L368A和Y407V,且所述第二多肽包含突变Y349C和T366W。
6.根据项目1-5中的任一项所述的二聚体多肽,其特征在于,所述免疫球蛋白铰链区、所述免疫球蛋白CH2-结构域和所述免疫球蛋白CH3-结构域是人IgG1亚类。
7.根据项目1-6中的任一项所述的二聚体多肽,其特征在于,所述第一多肽和所述第二多肽还包含突变L234A和L235A。
8.根据项目1-5中的任一项所述的二聚体多肽,其特征在于,所述免疫球蛋白铰链区、所述免疫球蛋白CH2-结构域和所述免疫球蛋白CH3-结构域是人IgG2亚类,任选地具有突变V234A、G237A、P238S、H268A、V309L、A330S和P331S。
9.根据项目1-5中的任一项所述的二聚体多肽,其特征在于,所述免疫球蛋白铰链区、所述免疫球蛋白CH2-结构域和所述免疫球蛋白CH3-结构域是人IgG4亚类。
10.根据项目1-5和9中的任一项所述的二聚体多肽,其特征在于,所述第一多肽和所述第二多肽还包含突变S228P和L235E。
11.根据项目1-10中的任一项所述的二聚体多肽,其特征在于,所述第一多肽和所述第二多肽还包含突变P329G。
12.根据项目1-11中的任一项所述的二聚体多肽,其特征在于,所述二聚体多肽是Fc区融合多肽。
13.根据项目1-11中的任一项所述的二聚体多肽,其特征在于,所述二聚体多肽是(全长)抗体。
14.根据项目1-11和13中的任一项所述的二聚体多肽,其特征在于,所述(全长)抗体是单特异性抗体。
15.根据项目1-11和13-14中的任一项所述的二聚体多肽,其特征在于,所述单特异性抗体是单价单特异性抗体。
16.根据项目1-11和13-15中的任一项所述的二聚体多肽,其特征在于,所述单特异性抗体是二价单特异性抗体。
17.根据项目1-11和13中的任一项所述的二聚体多肽,其特征在于,所述(全长)抗体是双特异性抗体。
18.根据项目1-11和13和17中的任一项所述的二聚体多肽,其特征在于,所述双特异性抗体是二价双特异性抗体。
19.根据项目1-11和13和17-18中的任一项所述的二聚体多肽,其特征在于,所述双特异性抗体是四价双特异性抗体。
20.根据项目1-11和13中的任一项所述的二聚体多肽,其特征在于,所述(全长)抗体是三特异性抗体。
21.根据项目1-11和13和20中的任一项所述的二聚体多肽,其特征在于,所述三特异性抗体是三价三特异性抗体。
22.根据项目1-11和13和20-21中的任一项所述的二聚体多肽,其特征在于,所述三特异性抗体是四价三特异性抗体。
23.一种二聚体多肽,其包含
第一多肽和第二多肽,所述第一多肽和第二多肽各自在N-端至C-端方向包含含有一个或多个半胱氨酸残基的免疫球蛋白铰链区的至少一部分、免疫球蛋白CH2-结构域和免疫球蛋白CH3-结构域,
其中所述第一多肽、所述第二多肽、或所述第一多肽和所述第二多肽包含突变Y436A(根据Kabat EU索引编号系统编号)。
24.根据项目23所述的二聚体多肽,其特征在于,所述第一多肽和所述第二多肽包含突变Y436A。
25.根据项目23-24中的任一项所述的二聚体多肽,其特征在于,所述二聚体多肽不特异性结合人FcRn且特异性结合葡萄球菌蛋白A。
26.根据项目23-25中的任一项所述的二聚体多肽,其特征在于,所述二聚体多肽是同源二聚体多肽。
27.根据项目23-25中的任一项所述的二聚体多肽,其特征在于,所述二聚体多肽是异源二聚体多肽。
28.根据项目23-27中的任一项所述的二聚体多肽,其特征在于,
a)所述第一多肽还包含突变Y349C、T366S、L368A和Y407V,且所述第二多肽包含突变S354C和T366W,
或者
所述第一多肽还包含突变S354C、T366S、L368A和Y407V,且所述第二多肽包含突变Y349C和T366W,和/或
b)i)所述第一多肽和所述第二多肽包含突变H310A、H433A和Y436A,或者
ii)所述第一多肽和所述第二多肽包含突变L251D、L314D和L432D,或者
iii)所述第一多肽和所述第二多肽包含突变L251S、L314S和L432S,或者
iv)所述第一多肽包含突变I253A、H310A和H435A,且所述第二多肽包含突变H310A、H433A和Y436A,或者
v)所述第一多肽包含突变I253A、H310A和H435A,且所述第二多肽包含突变L251D、L314D和L432D,或者
vi)所述第一多肽包含突变I253A、H310A和H435A,且所述第二多肽包含突变L251S、L314S和L432S。
29.根据项目23-28中的任一项所述的二聚体多肽,其特征在于,所述免疫球蛋白铰链区、所述免疫球蛋白CH2-结构域和所述免疫球蛋白CH3-结构域是人IgG1亚类。
30.根据项目23-29中的任一项所述的二聚体多肽,其特征在于,所述第一多肽和所述第二多肽还包含突变L234A和L235A。
31.根据项目23-28中的任一项所述的二聚体多肽,其特征在于,所述免疫球蛋白铰链区、所述免疫球蛋白CH2-结构域和所述免疫球蛋白CH3-结构域是人IgG2亚类,任选地具有突变V234A、G237A、P238S、H268A、V309L、A330S和P331S。
32.根据项目23-28中的任一项所述的二聚体多肽,其特征在于,所述免疫球蛋白铰链区、所述免疫球蛋白CH2-结构域和所述免疫球蛋白CH3-结构域是人IgG4亚类。
33.根据项目23-28和32中的任一项所述的二聚体多肽,其特征在于,所述第一多肽和所述第二多肽还包含突变S228P和L235E。
34.根据项目23-33中的任一项所述的二聚体多肽,其特征在于,所述第一多肽和所述第二多肽还包含突变P329G。
35.根据项目23-34中的任一项所述的二聚体多肽,其特征在于,所述二聚体多肽是Fc区融合多肽。
36.根据项目23-34中的任一项所述的二聚体多肽,其特征在于,所述二聚体多肽是(全长)抗体。
37.根据项目23-34和36中的任一项所述的二聚体多肽,其特征在于,所述(全长)抗体是单特异性抗体。
38.根据项目23-34和36-37中的任一项所述的二聚体多肽,其特征在于,所述单特异性抗体是单价单特异性抗体。
39.根据项目23-34和36-38中的任一项所述的二聚体多肽,其特征在于,所述单特异性抗体是二价单特异性抗体。
40.根据项目23-34和36中的任一项所述的二聚体多肽,其特征在于,所述(全长)抗体是双特异性抗体。
41.根据项目23-34和36和40中的任一项所述的二聚体多肽,其特征在于,所述双特异性抗体是二价双特异性抗体。
42.根据项目23-34和36和40-41中的任一项所述的二聚体多肽,其特征在于,所述双特异性抗体是四价双特异性抗体。
43.根据项目23-34和36中的任一项所述的二聚体多肽,其特征在于,所述(全长)抗体是三特异性抗体。
44.根据项目23-34和36和43中的任一项所述的二聚体多肽,其特征在于,所述三特异性抗体是三价三特异性抗体。
45.根据项目23-34和36和43-44中的任一项所述的二聚体多肽,其特征在于,所述三特异性抗体是四价三特异性抗体。
46.一种二聚体多肽,其包含
第一多肽,所述第一多肽在N-端至C-端方向包含第一重链可变结构域、亚类IgG1的免疫球蛋白CH1-结构域、亚类IgG1的免疫球蛋白铰链区、亚类IgG1的免疫球蛋白CH2-结构域和亚类IgG1的免疫球蛋白CH3-结构域,
第二多肽,所述第二多肽在N-端至C-端方向包含第二重链可变结构域、亚类IgG1的免疫球蛋白CH1-结构域、亚类IgG1的免疫球蛋白铰链区、亚类IgG1的免疫球蛋白CH2-结构域和亚类IgG1的免疫球蛋白CH3-结构域,
第三多肽,所述第三多肽在N-端至C-端方向包含第一轻链可变结构域和轻链恒定结构域,
第四多肽,所述第四多肽在N-端至C-端方向包含第二轻链可变结构域和轻链恒定结构域,
其中所述第一重链可变结构域和所述第一轻链可变结构域形成特异性结合第一抗原的第一结合位点,
其中所述第二重链可变结构域和所述第二轻链可变结构域形成特异性结合第二抗原的第二结合位点,
其中i)所述第一多肽包含突变Y349C、T366S、L368A和Y407V,且所述第二多肽包含突变S354C和T366W,或ii)所述第一多肽还包含突变S354C、T366S、L368A和Y407V,且所述第二多肽包含突变Y349C和T366W,
其中所述第一多肽和所述第二多肽还包含突变L234A、L235A和P329G,且
其中
i)所述第一多肽和所述第二多肽包含突变H310A、H433A和Y436A,或者
ii)所述第一多肽和所述第二多肽包含突变L251D、L314D和L432D,或者
iii)所述第一多肽和所述第二多肽包含突变L251S、L314S和L432S,或者
iv)所述第一多肽包含突变I253A、H310A和H435A,且所述第二多肽包含突变H310A、H433A和Y436A,或者
v)所述第一多肽包含突变I253A、H310A和H435A,且所述第二多肽包含突变L251D、L314D和L432D,或者
vi)所述第一多肽包含突变I253A、H310A和H435A,且所述第二多肽包含突变L251S、L314S和L432S。
47.一种二聚体多肽,其包含
第一多肽,所述第一多肽在N-端至C-端方向包含第一重链可变结构域、免疫球蛋白轻链恒定结构域、亚类IgG1的免疫球蛋白铰链区、亚类IgG1的免疫球蛋白CH2-结构域和亚类IgG1的免疫球蛋白CH3-结构域,
第二多肽,所述第二多肽在N-端至C-端方向包含第二重链可变结构域、亚类IgG1的免疫球蛋白CH1-结构域、亚类IgG1的免疫球蛋白铰链区、亚类IgG1的免疫球蛋白CH2-结构域和亚类IgG1的免疫球蛋白CH3-结构域,
第三多肽,所述第三多肽在N-端至C-端方向包含第一轻链可变结构域和亚类IgG1的免疫球蛋白CH1-结构域,
第四多肽,所述第四多肽在N-端至C-端方向包含第二轻链可变结构域和轻链恒定结构域,
其中所述第一重链可变结构域和所述第一轻链可变结构域形成特异性结合第一抗原的第一结合位点,
其中所述第二重链可变结构域和所述第二轻链可变结构域形成特异性结合第二抗原的第二结合位点,
其中i)所述第一多肽包含突变Y349C、T366S、L368A和Y407V,且所述第二多肽包含突变S354C和T366W,或ii)所述第一多肽包含突变S354C、T366S、L368A和Y407V,且所述第二多肽包含突变Y349C和T366W,
其中所述第一多肽和所述第二多肽还包含突变L234A、L235A和P329G,且
其中
i)所述第一多肽和所述第二多肽包含突变H310A、H433A和Y436A,或者
ii)所述第一多肽和所述第二多肽包含突变L251D、L314D和L432D,或者
iii)所述第一多肽和所述第二多肽包含突变L251S、L314S和L432S,或者
iv)所述第一多肽包含突变I253A、H310A和H435A,且所述第二多肽包含突变H310A、H433A和Y436A,或者
v)所述第一多肽包含突变I253A、H310A和H435A,且所述第二多肽包含突变L251D、L314D和L432D,或者
vi)所述第一多肽包含突变I253A、H310A和H435A,且所述第二多肽包含突变L251S、L314S和L432S。
48.一种二聚体多肽,其包含
第一多肽,所述第一多肽在N-端至C-端方向包含第一重链可变结构域、亚类IgG4的免疫球蛋白CH1-结构域、亚类IgG4的免疫球蛋白铰链区、亚类IgG4的免疫球蛋白CH2-结构域和亚类IgG4的免疫球蛋白CH3-结构域,
第二多肽,所述第二多肽在N-端至C-端方向包含第二重链可变结构域、亚类IgG4的免疫球蛋白CH1-结构域、亚类IgG4的免疫球蛋白铰链区、亚类IgG4的免疫球蛋白CH2-结构域和亚类IgG4的免疫球蛋白CH3-结构域,
第三多肽,所述第三多肽在N-端至C-端方向包含第一轻链可变结构域和轻链恒定结构域,
第四多肽,所述第四多肽在N-端至C-端方向包含第二轻链可变结构域和轻链恒定结构域,
其中所述第一重链可变结构域和所述第一轻链可变结构域形成特异性结合第一抗原的第一结合位点,
其中所述第二重链可变结构域和所述第二轻链可变结构域形成特异性结合第二抗原的第二结合位点,
其中i)所述第一多肽包含突变Y349C、T366S、L368A和Y407V,且所述第二多肽包含突变S354C和T366W,或ii)所述第一多肽包含突变S354C、T366S、L368A和Y407V,且所述第二多肽包含突变Y349C和T366W,
其中所述第一多肽和所述第二多肽还包含突变S228P、L235E和P329G,且
其中
i)所述第一多肽和所述第二多肽包含突变H310A、H433A和Y436A,或者
ii)所述第一多肽和所述第二多肽包含突变L251D、L314D和L432D,或者
iii)所述第一多肽和所述第二多肽包含突变L251S、L314S和L432S,或者
iv)所述第一多肽包含突变I253A、H310A和H435A,且所述第二多肽包含突变H310A、H433A和Y436A,或者
v)所述第一多肽包含突变I253A、H310A和H435A,且所述第二多肽包含突变L251D、L314D和L432D,或者
vi)所述第一多肽包含突变I253A、H310A和H435A,且所述第二多肽包含突变L251S、L314S和L432S。
49.一种二聚体多肽,其包含
第一多肽,所述第一多肽在N-端至C-端方向包含第一重链可变结构域、免疫球蛋白轻链恒定结构域、亚类IgG4的免疫球蛋白铰链区、亚类IgG4的免疫球蛋白CH2-结构域和亚类IgG4的免疫球蛋白CH3-结构域,
第二多肽,所述第二多肽在N-端至C-端方向包含第二重链可变结构域、亚类IgG4的免疫球蛋白CH1-结构域、亚类IgG4的免疫球蛋白铰链区、亚类IgG4的免疫球蛋白CH2-结构域和亚类IgG4的免疫球蛋白CH3-结构域,
第三多肽,所述第三多肽在N-端至C-端方向包含第一轻链可变结构域和亚类IgG4的免疫球蛋白CH1-结构域,
第四多肽,所述第四多肽在N-端至C-端方向包含第二轻链可变结构域和轻链恒定结构域,
其中所述第一重链可变结构域和所述第一轻链可变结构域形成特异性结合第一抗原的第一结合位点,
其中所述第二重链可变结构域和所述第二轻链可变结构域形成特异性结合第二抗原的第二结合位点,
其中i)所述第一多肽包含突变Y349C、T366S、L368A和Y407V,且所述第二多肽包含突变S354C和T366W,或ii)所述第一多肽包含突变S354C、T366S、L368A和Y407V,且所述第二多肽包含突变Y349C和T366W,
其中所述第一多肽和所述第二多肽还包含突变S228P、L235E和P329G,且
其中
i)所述第一多肽和所述第二多肽包含突变H310A、H433A和Y436A,或者
ii)所述第一多肽和所述第二多肽包含突变L251D、L314D和L432D,或者
iii)所述第一多肽和所述第二多肽包含突变L251S、L314S和L432S,或者
iv)所述第一多肽包含突变I253A、H310A和H435A,且所述第二多肽包含突变H310A、H433A和Y436A,或者
v)所述第一多肽包含突变I253A、H310A和H435A,且所述第二多肽包含突变L251D、L314D和L432D,或者
vi)所述第一多肽包含突变I253A、H310A和H435A,且所述第二多肽包含突变L251S、L314S和L432S。
50.一种二聚体多肽,其包含
第一多肽,所述第一多肽在N-端至C-端方向包含第一重链可变结构域,亚类IgG1的免疫球蛋白CH1-结构域,亚类IgG1的免疫球蛋白铰链区,亚类IgG1的免疫球蛋白CH2-结构域、亚类IgG1的免疫球蛋白CH3-结构域、肽接头和第一scFv,
第二多肽,所述第二多肽在N-端至C-端方向包含第二重链可变结构域、亚类IgG1的免疫球蛋白CH1-结构域、亚类IgG1的免疫球蛋白铰链区、亚类IgG1的免疫球蛋白CH2-结构域、亚类IgG1的免疫球蛋白CH3-结构域、肽接头和第二scFv,
第三多肽,所述第三多肽在N-端至C-端方向包含第一轻链可变结构域和轻链恒定结构域,
第四多肽,所述第四多肽在N-端至C-端方向包含第二轻链可变结构域和轻链恒定结构域,
其中所述第一重链可变结构域和所述第一轻链可变结构域形成特异性结合第一抗原的第一结合位点,所述第二重链可变结构域和所述第二轻链可变结构域形成特异性结合第一抗原的第二结合位点,所述第一scFv和所述第二scFv特异性结合第二抗原,
其中i)所述第一多肽包含突变Y349C、T366S、L368A和Y407V,且所述第二多肽包含突变S354C和T366W,或ii)所述第一多肽包含突变S354C、T366S、L368A和Y407V,且所述第二多肽包含突变Y349C和T366W,
其中所述第一多肽和所述第二多肽还包含突变L234A、L235A和P329G,且
其中
i)所述第一多肽和所述第二多肽包含突变H310A、H433A和Y436A,或者
ii)所述第一多肽和所述第二多肽包含突变L251D、L314D和L432D,或者
iii)所述第一多肽和所述第二多肽包含突变L251S、L314S和L432S,或者
iv)所述第一多肽包含突变I253A、H310A和H435A,且所述第二多肽包含突变H310A、H433A和Y436A,或者
v)所述第一多肽包含突变I253A、H310A和H435A,且所述第二多肽包含突变L251D、L314D和L432D,或者
vi)所述第一多肽包含突变I253A、H310A和H435A,且所述第二多肽包含突变L251S、L314S和L432S。
51.一种二聚体多肽,其包含
第一多肽,所述第一多肽在N-端至C-端方向包含第一重链可变结构域、免疫球蛋白轻链恒定结构域、亚类IgG1的免疫球蛋白铰链区、亚类IgG1的免疫球蛋白CH2-结构域、亚类IgG1的免疫球蛋白CH3-结构域、肽接头和第一scFv,
第二多肽,所述第二多肽在N-端至C-端方向包含第二重链可变结构域、亚类IgG1的免疫球蛋白CH1-结构域、亚类IgG1的免疫球蛋白铰链区、亚类IgG1的免疫球蛋白CH2-结构域、亚类IgG1的免疫球蛋白CH3-结构域、肽接头和第二scFv,
第三多肽,所述第三多肽在N-端至C-端方向包含第一轻链可变结构域和亚类IgG1的免疫球蛋白CH1-结构域,
第四多肽,所述第四多肽在N-端至C-端方向包含第二轻链可变结构域和轻链恒定结构域,
其中所述第一重链可变结构域和所述第一轻链可变结构域形成特异性结合第一抗原的第一结合位点,所述第二重链可变结构域和所述第二轻链可变结构域形成特异性结合第一抗原的第二结合位点,且所述第一scFv和所述第二scFv特异性结合第二抗原,
其中i)所述第一多肽包含突变Y349C、T366S、L368A和Y407V,且所述第二多肽包含突变S354C和T366W,或ii)所述第一多肽包含突变S354C、T366S、L368A和Y407V,且所述第二多肽包含突变Y349C和T366W,
其中所述第一多肽和所述第二多肽还包含突变L234A、L235A和P329G,且
其中
i)所述第一多肽和所述第二多肽包含突变H310A、H433A和Y436A,或者
ii)所述第一多肽和所述第二多肽包含突变L251D、L314D和L432D,或者
iii)所述第一多肽和所述第二多肽包含突变L251S、L314S和L432S,或者
iv)所述第一多肽包含突变I253A、H310A和H435A,且所述第二多肽包含突变H310A、H433A和Y436A,或者
v)所述第一多肽包含突变I253A、H310A和H435A,且所述第二多肽包含突变L251D、L314D和L432D,或者
vi)所述第一多肽包含突变I253A、H310A和H435A,且所述第二多肽包含突变L251S、L314S和L432S。
52.一种用于生产根据项目1-51中的任一项所述的二聚体多肽的方法,所述方法包括下述步骤:
a)培养哺乳动物细胞,所述细胞包含一个或多个编码根据项目1-51中的任一项所述的二聚体多肽的核酸,
b)从培养基回收所述二聚体多肽,和
c)用蛋白A亲和色谱法纯化所述二聚体多肽。
53.突变Y436A用于增加二聚体多肽与蛋白A的结合的用途。
54.突变H310A、H433A和Y436A用于从同源二聚体多肽分离异源二聚体多肽的用途。
55.突变L251D、L314D、L432D或突变L251S、L314S、L432S用于从同源二聚体多肽分离异源二聚体多肽的用途。
56.第一多肽中的突变I253A、H310A和H435A与第二多肽中的突变H310A、H433A和Y436A的组合用于从同源二聚体多肽分离包含所述第一多肽和所述第二多肽的异源二聚体多肽的用途。
57.第一多肽中的突变I253A、H310A和H435A与第二多肽中的突变L251D、L314D、L432D或突变L251S、L314S、L432S的组合用于从同源二聚体多肽分离包含所述第一多肽和所述第二多肽的异源二聚体多肽的用途。
58.根据项目53-57中的任一项所述的用途,其特征在于,所述第一多肽还包含突变Y349C、T366S、L368A和Y407V,且所述第二多肽还包含突变S354C和T366W。
59.通过将根据项目1-51中的任一项所述的二聚体多肽施用给需要这种治疗的患者来治疗遭受眼血管疾病的患者的方法。
60.用于玻璃体内应用的根据项目1-51中的任一项所述的二聚体多肽。
61.用于治疗血管性眼病的根据项目1-51中的任一项所述的二聚体多肽。
62.一种药物制剂,其包含根据项目1-51中的任一项所述的二聚体多肽和任选的药用载体。
63.根据项目1-51中的任一项所述的二聚体多肽用于将可溶性受体配体从眼经过血眼屏障运输进血液循环中的用途。
64.根据项目1-51中的任一项所述的二聚体多肽用于从眼除去一种或多种可溶性受体配体的用途。
65.根据项目1-51中的任一项所述的二聚体多肽用于治疗眼病、特别是眼血管疾病的用途。
66.根据项目1-51中的任一项所述的二聚体多肽用于将一种或多种可溶性受体配体从玻璃体内空间运输至血液循环的用途。
67.用于治疗眼病的根据项目1-51中的任一项所述的二聚体多肽。
68.用于从眼运输可溶性受体配体经过血眼屏障进入血液循环中的根据项目1-51中的任一项所述的二聚体多肽。
69.用于从眼除去一种或多种可溶性受体配体的根据项目1-51中的任一项所述的二聚体多肽。
70.用于治疗眼病、特别是眼血管疾病的根据项目1-51中的任一项所述的二聚体多肽。
71.用于将一种或多种可溶性受体配体从玻璃体内空间运输至血液循环的根据项目1-51中的任一项所述的二聚体多肽。
72.一种治疗具有眼血管疾病的个体的方法,所述方法包括给所述个体施用有效量的根据项目1-51中的任一项所述的二聚体多肽。
73.一种用于从眼运输可溶性受体配体经过血眼屏障进入个体的血液循环中的方法,所述方法包括给所述个体施用有效量的根据项目1-51中的任一项所述的二聚体多肽以从眼运输可溶性受体配体经过血眼屏障进入血液循环中。
74.一种用于从个体的眼除去一种或多种可溶性受体配体的方法,所述方法包括给所述个体施用有效量的根据项目1-51中的任一项所述的二聚体多肽以从眼除去一种或多种可溶性受体配体。
75.一种用于将一种或多种可溶性受体配体从玻璃体内空间运输至个体的血液循环的方法,所述方法包括给所述个体施用有效量的根据项目1-51中的任一项所述的二聚体多肽以将一种或多种可溶性受体配体从玻璃体内空间运输至血液循环。
76.一种用于从玻璃体内空间或眼运输可溶性受体配体经过血眼屏障进入个体的血液循环中的方法,所述方法包括给所述个体施用有效量的根据项目1-51中的任一项所述的二聚体多肽以从眼运输可溶性受体配体经过血眼屏障进入血液循环中。
V.实施例
以下是本发明的方法和组合物的实施例。应当理解,鉴于上文提供的一般描述,可以实施多种其它的实施方案。
尽管为了清楚理解的目的已经通过具体说明和实施例对前述发明进行了比较详细的描述,但是所述描述和实施例不应解释为限制本发明的范围。本文中引用的所有专利和科学文献的公开内容明确地通过引用以它们的整体并入。
通过添加0.5μL N-聚糖酶加上(Roche)和磷酸钠缓冲液(0.1M,pH 7.1)以获得115μL的最终样品体积,使蛋白等分试样(50μg)去糖基化。将混合物在37℃温育18h。此后,为了还原和变性,添加60μL 0.5M TCEP(Pierce)在4M胍*HCl(Pierce)中的溶液和50μL 8M胍*HCl。将混合物在37℃温育30min。将样品通过尺寸排阻色谱法(Sepharose G-25,等度,含有2%甲酸的40%乙腈)脱盐。在配备nano ESI源(TriVersa NanoMate,Advion)的Q-TOF仪器(maXis,Bruker)上记录ESI质谱图(+ve)。MS参数设置如下:转移:漏斗RF,400Vpp;ISCID能量,0eV;多极RF,400Vpp;四极:离子能,4.0eV;低质量,600m/z;源:干燥气体,8L/min;干燥气体温度,160℃;碰撞室:碰撞能,10eV;碰撞RF:2000Vpp;离子冷却器:离子冷却器RF,300Vpp;转移时间:120μs;脉冲前储存,10μs;扫描范围m/z 600-2000。为了数据评价,使用内部开发的软件(Mass Analyzer)。
使用BIAcore T100仪器(BIAcore AB,Uppsala,瑞典),通过表面等离子体共振(SPR)技术分析野生型抗体和突变体对FcRn的结合特性。该系统对于分子相互作用的研究而言是充分确立的。它允许连续实时监测配体/分析物结合,并且因此在不同测定设置下确定动力学参数。SPR-技术是基于测量金包被的生物传感器芯片的表面附近的折射率。折射率的变化指示由固定化的配体与溶液中注射的分析物的相互作用造成的所述表面上的质量变化。如果分子与表面上固定化的配体结合,则质量增加,在解离的情况下,则质量减小。在当前的测定中,借助胺偶联法将FcRn受体固定在BIAcore CM5-生物传感器芯片(GEHealthcare Bioscience,Uppsala,瑞典)上达到400应答单位(RU)的水平。该测定在室温实施,用PBS、0.05%吐温20pH 6.0(GE Healthcare Bioscience)作为运行和稀释缓冲液。将200nM样品在室温以50μL/min的流速注射。结合时间是180秒,解离阶段耗时360秒。通过短暂注射HBS-P、pH 8.0,实现芯片表面的再生。通过对比注射后180秒和注射后300秒的生物应答信号高度,进行SPR-数据的评价。相应参数是RU最高水平(注射后180秒)和晚期稳定性(注射结束后300秒)。
该测定是基于表面等离子体共振光谱法。将蛋白A固定在SPR生物传感器的表面上。通过将样品注射进SPR波谱仪的流动池中,它与固定化的蛋白A形成复合物,导致传感芯片表面上的质量增加,并且因此导致更高的应答(因为1RU定义为1pg/mm
通过使用GE Healthcare的胺偶联试剂盒,将约3500应答单位(RU)的蛋白A(20μg/mL)在pH 4.0偶联到CM5芯片(GE Healthcare)上。
样品和系统缓冲液是HBS-P+(0.01M HEPES,0.15M NaCl,无菌过滤的0.005%表面活性剂P20,pH 7.4)。将流动池温度设定至25℃,并且将样品隔室温度设定至12℃。该系统用运行缓冲液引发。然后,将5nM的样品构建体溶液以30μL/min的流速注射120秒,随后是300秒解离阶段。然后,通过两次30μL/min流速的30秒长的甘氨酸-HCl pH 1.5注射,再生传感器芯片表面。一式三份地测量每个样品。
本文中使用的术语“具有突变IHH-AAA”表示在IgG1或IgG4亚类的恒定重链区中的突变I253A(Ile253Ala)、H310A(His310Ala)和H435A(His435Ala)的组合(根据Kabat EU索引编号系统编号),本文中使用的术语“具有突变HHY-AAA”表示在IgG1或IgG4亚类的恒定重链区中的突变H310A(His310Ala)、H433A(His433Ala)和Y436A(Tyr436Ala)的组合(根据Kabat EU索引编号系统编号),本文中使用的术语“具有突变P329G LALA”表示在IgG1亚类的恒定重链区中的突变L234A(Leu234Ala)、L235A(Leu235Ala)和P329G(Pro329Gly)的组合(根据Kabat EU索引编号系统编号),且本文中使用的术语“具有突变SPLE”表示在IgG4亚类的恒定重链区中的突变S228P(Ser228Pro)和L235E(Leu235Glu)的组合(根据Kabat EU索引编号系统编号)。
概述
关于人免疫球蛋白轻链和重链的核苷酸序列的一般信息给出在:Kabat,E.A.,等人,Sequences of Proteins of Immunological Interest,第5版,Public HealthService,National Institutes of Health,Bethesda,MD(1991)。将抗体链的氨基酸残基根据EU编号法进行编号和提及(Edelman,G.M.,等人,Proc.Natl.Acad.Sci.USA 63(1969)78-85;Kabat,E.A.,等人,Sequences of Proteins of Immunological Interest,第5版,Public Health Service,National Institutes of Health,Bethesda,MD(1991))。
如在Sambrook,J.等人,Molecular Cloning:A laboratory manual;Cold SpringHarbor Laboratory Press,Cold Spring Harbor,New York(1989)中所述,使用标准方法操作DNA。根据生产商的说明书使用分子生物学试剂。
根据给出的说明书在Geneart(Regensburg,德国)订购期望的基因区段。
通过在MediGenomix GmbH(Martinsried,德国)或SequiServe GmbH(Vaterstetten,德国)进行的双链测序法测定DNA序列。
GCG(遗传学计算机组(GeneticsComputerGroup),Madison,威斯康辛州)的软件包第10.2版和Infomax的Vector NT1 Advance套装8.0版用于序列生成、作图、分析、注释和图示。
为了表达所描述的抗体,使用基于cDNA组构(用或不用CMV-内含子A启动子)或基于基因组组构(用CMV启动子)的用于瞬时表达(例如在HEK293-F细胞中)的表达载体
除了抗体表达盒以外,所述载体含有:
-复制起点,其允许该载体在大肠杆菌中复制,
-β-内酰胺酶基因,其赋予在大肠杆菌中的氨苄西林抗性,和
-来自小家鼠(Mus musculus)的二氢叶酸还原酶基因,作为在真核细胞中的选择标记。
抗体基因的转录单元由以下元件组成:
-在5′末端的独特限制位点,
-来自人巨细胞病毒的立即早期增强子和启动子,
-在cDNA组构的情况下,随后是内含子A序列,
-人免疫球蛋白基因的5’-非翻译区,
-编码免疫球蛋白重链信号序列的核酸,
-编码人抗体链(野生型或具有结构域交换)的核酸,所述核酸作为cDNA或在具有免疫球蛋白外显子-内含子组构的基因组组构中,
-具有多腺苷酸化信号序列的3’非翻译区,和
-在3′末端的独特限制位点。
编码抗体链的核酸通过PCR和/或基因合成法生成并如下通过已知的重组方法和技术装配:连接相应的核酸区段,例如使用各种载体中的独特限制位点。通过DNA测序验证亚克隆的核酸序列。关于瞬时转染,通过从转化的大肠杆菌培养物(Nucleobond AX,Macherey-Nagel)制备载体,制得较大量的载体。
如Cell Biology(2000),Bonifacino,J.S.,Dasso,M.,Harford,J.B.,Lippincott-Schwartz,J.和Yamada,K.M.(编),John Wiley&Sons,Inc.中的流行方案(Current Protocols)所述,使用标准细胞培养技术。
如下文描述,通过瞬时共转染悬浮培养的HEK29-F细胞中的各种表达载体,表达双特异性抗体。
表达和纯化
使用HEK293-F系统(Invitrogen),根据生产商的说明书,通过用各个载体(例如编码重链和修饰的重链以及对应的轻链和修饰的轻链)瞬时转染,产生单特异性和双特异性抗体。简而言之,将摇瓶中或搅拌式发酵罐中在无血清FreeStyle
通过使用MabSelectSure-Sepharose
简而言之,将无菌过滤的细胞培养上清液在用PBS缓冲液(10mM Na
表:Y双特异性的
每个纯化步骤后,使用微流体Labchip技术(Caliper Life Science,USA)通过CE-SDS分析纯度和抗体完整性。根据生产商的说明书,使用HT蛋白表达试剂试剂盒(HTProtein Express Reagent Kit)制备5μL用于CE-SDS分析的蛋白溶液,并使用HT蛋白表达芯片(Protein Express Chip)在Labchip GXII系统上分析。使用Labchip GX软件分析数据。
表:通过CE-SDS确定借助不同顺序纯化步骤对典型副产物的除去
在25℃使用Superdex 200分析尺寸排阻柱(GE Healthcare,瑞典)在2xPBS(20mMNa
类似地,以如下收率制备和纯化抗-VEGF/ANG2抗体VEGF/ANG2-0012和VEGF/ANG2-0201:
还可以类似地制备和纯化抗-VEGF/ANG2双特异性抗体:具有IHH-AAA突变且具有SPLE突变的抗-VEGF/ANG2 CrossMAb IgG4(SEQ ID NO:42,SEQ ID NO:43,SEQ ID NO:44,SEQ ID NO:45),具有IHH-AAA突变的抗-VEGF/ANG2 OAscFab IgG1(SEQ ID NO:46,SEQ IDNO:47,SEQ ID NO:48),具有IHH-AAA突变且具有SPLE突变的抗-VEGF/ANG2 OAscFab IgG4(SEQ ID NO:49,SEQ ID NO:50,SEQ ID NO:51),具有HHY-AAA突变和P329G LALA突变的抗-VEGF/ANG2CrossMab IgG1(SEQ ID NO:90,SEQ ID NO:91,SEQ ID NO:40,SEQ ID NO:41),具有HHY-AAA突变和SPLE突变的抗-VEGF/ANG2 CrossMab IgG4(SEQ ID NO:92,SEQ ID NO:93,SEQ ID NO:44,SEQ ID NO:45),具有HHY-AAA突变的抗-VEGF/ANG2 OAscFab IgG1(SEQID NO:94,SEQ ID NO:95,SEQ ID NO:48),和具有HHY-AAA突变和SPLE突变的抗-VEGF/ANG2OAscFab IgG4(SEQ ID NO:96,SEQ ID NO:97,SEQ ID NO:51),以及抗-IGF-1R单特异性抗体:抗-IGF-1R野生型(SEQ ID NO:88,SEQ ID NO:89),具有IHH-AAA突变的抗-IGF-1R IgG1(SEQ ID NO:88,SEQ ID NO:90),具有YTE突变的抗-IGF-1R IgG1(SEQ ID NO:88,SEQ IDNO:91),具有KiH突变的抗-IGF-1R IgG1野生型(SEQ ID NO:88,SEQ ID NO:92,SEQ ID NO:93),具有在孔洞链中的KiH突变和IHH-AAA突变的抗-IGF-1R IgG1(SEQ ID NO:88,SEQ IDNO:94,SEQ ID NO:95),具有在孔洞链中的KiH突变和HHY-AAA突变的抗-IGF-1R IgG1(SEQID NO:88,SEQ ID NO:96,SEQ ID NO:97),具有KiH突变和YTE突变的抗-IGF-1RIgG1(SEQID NO:88,SEQ ID NO:98,SEQ ID NO:99),具有KiH突变和DDD突变的抗-IGF-1R IgG1(SEQID NO:88,SEQ ID NO:100,SEQ ID NO:101),和具有HHY-AAA突变的抗-IGF-1R IgG1(SEQID NO:88,SEQ ID NO:112)。
分析学和可发展性
粘度测量基本上如(He,F.等人,Analytical Biochemistry 399(2009)141-143)中所述进行。简而言之,将样品在200mM精氨酸琥珀酸盐(pH 5.5)中浓缩到多种蛋白浓度,然后加入聚苯乙烯胶乳珠子(300nm直径)和聚山梨酯20(0.02%v/v)。将样品通过离心穿过0.4μm滤板转移进光学384孔板并用石蜡油覆盖。在25℃通过动态光散射法确定胶乳珠子的表观直径。溶液的粘度可以计算为η=η0(rh/rh,0)(η:粘度;η0:水的粘度;rh:胶乳珠子的表观流体动力学半径;rh,0:胶乳珠子在水中的流体动力学半径)。
为了允许在相同浓度对比各种样品,用Mooney方程式(方程式1)(Mooney,M.,Colloid.Sci.,6(1951)162-170;Monkos,K.,Biochem.Biophys.Acta 304(1997)1339)拟合粘度-浓度数据,并相应地内插数据。
(S:蛋白的流体动力学相互作用参数;K:自集因子;Φ:溶解的蛋白的体积分数)
结果显示在图2中:与Fc区中无IHH-AAA突变的VEGF/ANG2-0015相比,在Fc区中具有IHH-AAA突变的VEGF/ANG2-0016在全部测量温度均显示较低的粘度。
将样品以1mg/mL的浓度在20mM组氨酸/组氨酸盐酸盐、140mM NaCl、pH 6.0中制备,通过离心穿过0.4μm滤板转移进光学384孔板并用石蜡油覆盖。将样品以0.05℃/min的速率从25℃加热至80℃的同时,通过动态光散射法重复测量流体动力学半径。将聚集开始温度定义为流体动力学半径开始增加的温度。结果显示在图3中。在图3中,显示了相对于Fc区中具有IHH-AAA突变的VEGF/ANG2-0016,无IHH-AAA突变的VEGF/ANG2-0015的聚集。VEGF/ANG2-0016显示61℃的聚集开始温度,而无IHH-AAA突变的VEGF/ANG2-0015显示60℃的开始温度。
将样品以1mg/mL的浓度在20mM组氨酸/组氨酸盐酸盐、140mM NaCl、pH 6.0中制备,通过离心穿过0.4μm滤板转移进光学384孔板并用石蜡油覆盖。将样品维持在50℃恒定温度直至145小时的同时,通过动态光散射法重复测量流体动力学半径。在这个实验中,天然的解折叠的蛋白在升高的温度下的聚集倾向将导致平均粒径随时间的增加。这种基于DLS的方法对聚集体是非常敏感的,因为这些聚集体以超比例方式促进散射光强度。甚至在50℃(接近聚集开始温度的温度,见上文)145小时以后,发现VEGF/ANG2-0015和VEGF/ANG2-0016的仅小于0.5nm的平均粒径增加。
将样品在200mM精氨酸琥珀酸盐(pH 5.5)中浓缩至100mg/mL的终浓度,无菌过滤并在40℃静止储存7天。在储存之前和之后,通过尺寸排阻色谱法确定高分子量物质和低分子量物质(分别是HMW和LMW)的含量。储存的样品和在制备后立即测量的样品之间的HMW含量和LMW含量的差异分别报告为“HMW增加”和“LMW增加”。结果显示在下表和图4中,所述结果表明,与VEGF/ANG2-0016(具有IHH-AAA突变)相比,VEGF/ANG2-0015(没有IHH-AAA突变)显示出更高的主峰下降和更高的HMW增加。令人惊讶地,与VEGF/ANG2-0015(没有IHH-AAA突变)相比,VEGF/ANG2-0016(具有IHH-AAA突变)显示出更低的聚集趋势。
表:在40℃储存7天后的主峰、HMW峰和LMW峰的变化
在25℃使用
与VEGF、ANG2、FcγR和FcRn的结合
通过使用GE Healthcare供应的胺偶联试剂盒在pH5.0在CM5芯片(GE HealthcareBR-1005-30)上偶联约12,000个共振单位(RU)的捕获系统(10μg/mL山羊抗人F(ab)’
通过确定平衡混合物中的游离相互作用配偶体的浓度,溶液亲和力会测量相互作用的亲和力。溶液亲和力测定包括将保持在恒定浓度的抗-VEGF/ANG2抗体与不同浓度的配体(=ANG2)混合。使用GE Healthcare供应的胺偶联试剂盒在pH 5.0确定固定在CM5芯片(GE Healthcare BR-1005-30)表面上的抗体的最大可能共振单位(例如17,000个共振单位(RU))。样品和系统缓冲液是HBS-P pH 7.4。将流动池设定至25℃,并且将样品区组设定至12℃并用运行缓冲液引发2次。为了产生校正曲线,将递增浓度的ANG2注射进含有固定化的抗-VEGF/ANG2抗体的BIAcore流动池中。将结合的ANG2的量确定为共振单位(RU)并相对于浓度作图。将每种配体的溶液(对于抗-VEGF/ANG2抗体,从0-200nM的11种浓度)与10nMANG2一起温育并且使其在室温达到平衡。从校正曲线确定游离ANG2浓度,所述校正曲线在测量具有已知量的ANG2的溶液的应答之前和之后制备。使用模型201,使用游离ANG2浓度作为y-轴并使用用于抑制的抗体浓度作为x-轴,用XLfit4(IDBS Software)建立一个4参数拟合。通过确定这条曲线的拐点计算亲和力。通过用0.85%H
对于FcRn测量,使用稳态亲和力相互对比双特异性抗体。将人FcRn稀释在偶联缓冲液(10μg/mL,乙酸钠,pH5.0)中并通过靶向固定化操作使用BIAcore向导固定在C1-Chip(GE Healthcare BR-1005-35)上达到200RU的最终应答。将流动池设定至25℃,并且将样品区组设定至12℃并用运行缓冲液引发2次。样品和系统缓冲液是PBS-T(包含0.05%吐温20的10mM磷酸盐缓冲盐水)pH 6.0。为了评估每种抗体的不同IgG浓度,制备62.5nM、125nM、250nM和500nM的浓度。流速设定至30μL/min,并在选择180秒结合时间的情况下将不同样品连续注射到芯片表面上。通过以30μL/min流速注射PBS-T pH 8持续60秒,使表面再生。通过减去从空白表面获得的应答,修正本体折射率差异。还减去缓冲液注射(=双参考)。为了计算稳态亲和力,使用来自BIA-评价软件的方法。简而言之,将RU值相对于分析的浓度作图,从而产生剂量-响应曲线。基于一个2参数拟合,计算上渐近线,从而允许确定半数最大RU值并因此确定亲和力。结果显示在图5和下表中。类似地,可以确定对食蟹猴、小鼠和兔FcRn的亲和力。
对于FcγRIIIa测量,使用直接结合测定。通过使用GE Healthcare供应的胺偶联试剂盒在pH 5.0在CM5芯片(GE Healthcare BR-1005-30)上偶联约3,000个共振单位(RU)的捕获系统(1μg/mL Penta-His;Qiagen)。样品和系统缓冲液是HBS-P+pH 7.4。将流动池设定至25℃-并且将样品区组设定至12℃-并用运行缓冲液引发2次。通过以5μL/min的流速注射100nM溶液60秒,捕获FcγRIIIa-His-受体。通过以30μL/min的流速注射100nM双特异性抗体或单特异性的对照抗体(对于IgG1亚类和IgG4亚类抗体,抗-洋地黄毒苷抗体)持续180秒,测量结合。通过用甘氨酸pH 2.5溶液以30μL/min的流速洗涤120秒,使表面再生。因为FcγRIIIa结合与Langmuir 1∶1模型不同,仅用这种测定确定结合/不结合。以类似的方式,可以确定FcγRIa结合和FcγRIIa结合。结果显示在图6中,其中后续是通过引入突变P329GLALA,未能检测到对FcγRIIIa的更多结合。
通过使用GE Healthcare供应的胺偶联试剂盒在pH 5.0在CM4芯片(GEHealthcare BR-1005-34)上偶联约3,500个共振单位(RU)的捕获系统(10μg/mL山羊抗-人IgG;GE Healthcare Bio-Sciences AB,瑞典)。样品和系统缓冲液是PBS-T(包含0.05%吐温20的10mM磷酸盐缓冲盐水)pH 7.4。将流动池的温度设定至25℃,并且将样品区组的温度设定至12℃。在捕获之前,将流动池用运行缓冲液引发2次。
通过以5μL/min的流速注射10nM溶液60秒,捕获双特异性抗体。通过确定依次或同时添加(30μL/min的流速)的每种配体的有效结合能力,分析每种配体与双特异性抗体的独立结合:
1.以200nM的浓度注射人VEGF持续180秒(鉴定抗原的单一结合)。
2.以100nM的浓度注射人ANG2持续180秒(鉴定抗原的单一结合)。
3.以200nM的浓度注射人VEGF持续180秒,随后额外以100nM的浓度注射人ANG2持续180秒(鉴定在VEGF存在下的ANG2的结合)。
4.以100nM的浓度注射人ANG2持续180秒,随后额外以200nM的浓度注射人VEGF(鉴定在ANG-2存在下的VEGF的结合)。
5.共同注射200nM浓度的人VEGF和100nM浓度的人ANG2持续180秒(同时鉴定VEGF的结合和ANG2的结合)。
通过用3M MgCl
如果方案3、4和5的所得最终信号等于或类似于方案1和2的各个最终信号的总和,则双特异性抗体能够相互独立地结合两种抗原。结果显示在下表中,其中证实了抗体VEGF/ANG2-0016、VEGF/ANG2-0012能够相互独立地与VEGF和ANG2结合。
首先,通过使用GE Healthcare供应的胺偶联试剂盒在pH 5.0在CM4芯片(GEHealthcare BR-1005-34)上偶联约1,600个共振单位(RU)的VEGF(20μg/mL)。样品和系统缓冲液是PBS-T(包含0.05%吐温20的10mM磷酸盐缓冲盐水)pH 7.4。将流动池设定至25℃,并且将样品区组设定至12℃并用运行缓冲液引发2次。其次,将50nM的双特异性抗体溶液以30μL/min的流速注射180秒。第三,将hANG2以30μL/min的流速注射180秒。hANG2的结合应答取决于与VEGF结合的双特异性抗体的量。并且显示出同时结合。通过用0.85%H
表:结果:对来自不同物种的VEGF异形体的动力学亲和力
表:结果:对ANG2的溶液亲和力
表:结果:对于抗-VEGF/ANG2抗体的FcRn的亲和力
表:与FcγRI-IIIa的结合结果
表:结果:VEGF和ANG2与抗-VEGF/ANG2抗体的独立结合
质谱法
本部分描述抗-VEGF/ANG2抗体的表征,重点在于正确装配。通过去糖基化的和完整的或IdeS消化的(化脓链球菌(S.pyogenes)的IgG降解酶)的抗-VEGF/ANG2抗体的电喷雾电离质谱法(ESI-MS),证实预期的一级结构。用100μg纯化的抗体进行IdeS-消化,所述抗体与2μg IdeS蛋白酶(Fabricator)在100mmol/L NaH
关于IdeS-消化的去糖基化的(下表)或完整的去糖基化的(下表)分子获得的质量对应于预测质量,所述预测质量从由两个不同轻链LC
表:去糖基化的和IdeS-消化的双特异性抗-VEGF/ANG2抗体VEGF/ANG2-0201(没有IHH-AAA突变)和VEGF/ANG2-0012(具有IHH-AAA突变)的质量
表:去糖基化的抗-VEGF/ANG2抗体VEGF/ANG2-0016(具有IHH-AAA突变)和VEGF/ANG2-0015(没有IHH-AAA突变)的质量
FcRn色谱法
将1克抗生蛋白链菌素sepharose(GE Healthcare)添加至生物素化并透析的受体,并在摇动下温育2小时。将受体衍生化的sepharose填充在1mL XK柱(GE Healthcare)中。
条件:
柱尺寸:50mm x 5mm
床高度:5cm
载量:50μg样品
平衡缓冲液:20mM MES,含有150mM NaCl,调至pH 5.5
洗脱缓冲液:20mM Tris/HCl,含有150mM NaCl,调至pH 8.8
洗脱:7.5CV平衡缓冲液,在30CV中达到100%洗脱缓冲液,10CV洗脱缓冲液
在下表中,给出了抗-VEGF/ANG2抗体在包含人FcRn的亲和柱上的保留时间。使用上述条件获得数据。
表:结果:抗-VEGF/ANG2抗体的保留时间
具有IHH-AAA突变的抗体的药代动力学(PK)性质
对于人FcRn而言转基因的FcRn小鼠的PK数据
研究包括雌性C57BL/6J小鼠(背景);小鼠FcRn缺陷的,但对于人FcRn而言半合子转基因的(huFcRn,品系276-/tg)
第1部分:
以2μL适当溶液/动物(即21μg化合物/动物(VEGF/ANG2-0015(没有IHH-AAA突变))或23.6μg化合物/动物(VEGF/ANG2-0016(具有IHH-AAA突变))以玻璃体内方式向右眼中给全部小鼠注射一次。
将小鼠分配至2个组,每组6只动物。血液样品在给药后2、24和96小时取自组1,并且在给药后7、48和168小时取自组2。
通过利用得自德国柏林World Precision Instruments,Inc.的用于纳升注射的NanoFil微量注射器系统,向小鼠右眼的玻璃体中注射。将小鼠用2.5%异氟烷麻醉,并且为了观察小鼠眼,使用具有40倍放大率的Leica MZFL 3显微镜和具有Leica KL 2500LCD闪光的环形灯。随后,使用35号针注射2μL化合物。
通过对侧眼的眼球后静脉丛,从每只动物收集血液用于确定血清中的化合物水平。
在室温1小时后,通过在4℃离心(9,300xg)3min,从血液获得至少50μL血清样品。将血清样品在离心后直接冷冻,并在-80℃冷冻贮藏直至分析。在处理后96小时,分离组1的动物的经处理的眼,并且在处理后168小时,分离组2的动物的经处理的眼。将样品在-80℃冷冻贮藏直至分析。
第2部分:
以200μL适当溶液/动物(即21μg化合物/动物(VEGF/ANG2-0015(没有IHH-AAA突变))或23.6μg化合物/动物(VEGF/ANG2-0016(具有IHH-AAA突变)),经尾静脉静脉内地给全部小鼠注射一次。
将小鼠分配至2个组,每组5只动物。血液样品在给药后1、24和96小时取自组1,并且在给药后7、48和168小时取自组2。通过眼球后静脉丛,从每只动物收集血液以确定血清中的化合物水平。
在室温1小时后,通过在4℃离心(9,300xg)3分钟从血液获得至少50μL血清样品。将血清样品在离心后直接冷冻并在-80℃冷冻贮藏直至分析。
通过物理-化学崩解来自实验室动物的全眼,获得眼裂解物。为了机械破裂,将每只眼转移进一个1.5mL圆锥底的微量瓶。在冷冻和解冻后,用1mL细胞洗涤缓冲液(Bio-Rad,Bio-Plex Cell Lysis Kit,目录号171-304011)洗涤眼一次。在以下步骤中,添加500μL新鲜制备的细胞裂解缓冲液,并且使用1.5mL组织碾磨研棒(Kimble Chase,1.5mL研棒,Art.No.749521-1500)研磨该眼。然后将混合物冷冻并解冻5次并再次研磨。为了将裂解物与剩余组织分离,将样品在4,500g离心4分钟。在离心后,将上清液收集并在-20℃贮存直至在定量ELISA中进一步分析。
用酶联免疫吸附测定(ELISA)确定小鼠血清和眼裂解物中抗-VEGF/ANG2抗体的浓度。
为了定量小鼠血清样品和眼裂解物中的抗-VEGF/ANG2抗体,进行标准固相系列夹心免疫测定,其使用生物素化的和异羟基洋地黄毒苷化的单克隆抗体作为捕获抗体和检测抗体。为了验证分析物的双特异性的完整性,生物素化的捕获抗体识别VEGF-结合位点,而异羟基洋地黄毒苷化的检测抗体将结合分析物的ANG-2结合位点。随后用与抗-洋地黄毒苷抗体偶联的辣根-过氧化物酶检测在抗生蛋白链菌素包布的微量滴定板(SA-MTP)的固相上的捕获抗体、分析物和检测抗体的结合的免疫复合物。在从SA-MTP洗去未结合的物质并添加ABTS-底物后,获得的信号与SA-MTP的固相上结合的分析物的量成正比。随后通过参考平行分析的校准物将样品的测量信号转化成浓度,进行定量。
在第一步中,将SA-MTP在MTP振荡器上在500rpm用100μL/孔的1μg/mL浓度的生物素化的捕获抗体溶液(mAb
在用捕获抗体包被SA-MTP以后,将平板用洗涤缓冲液和300μL/孔洗涤3次。随后,将100μL/孔的校准物、QC样品和样品移液到SA-MTP上并在500rpm再次温育1小时。分析物现在借助其抗VEGF结合位点通过捕获抗体结合至SA-MTP的固相。在温育并通过洗涤平板除去未结合的分析物以后,将100μL/孔的250ng/mL浓度的第一检测抗体(mAb
使用药代动力学评价程序WinNonlinTM(Pharsight)第5.2.1版,通过无房室分析计算药代动力学参数。
A)血清浓度
血清浓度的结果显示在下表和图7B至7C中。
表:VEGF/ANG2-0015(没有IHH-AAA突变):
表:VEGF/ANG2-0016(具有IHH-AAA突变):
表:VEGF/ANG2-0015(没有IHH-AAA突变)和VEGF/ANG2-0016(具有IHH-AAA突变):
表:VEGF/ANG2-0015(没有IHH-AAA突变)和VEGF/ANG2-0016(具有IHH-AAA突变):
B)在左眼和右眼的眼裂解物中的浓度
眼裂解物中浓度的结果显示在下表和图7D至7E中。
表:玻璃体内应用进右眼以后在眼裂解物中的VEGF/ANG2-0015(没有IHH-AAA突变)的浓度
表:静脉内应用以后在眼裂解物中的VEGF/ANG2-0015(没有IHH-AAA突变)的浓度
表:玻璃体内应用进右眼以后在眼裂解物中的VEGF/ANG2-0016(具有IHH-AAA突变)的浓度
表:静脉内应用以后在眼裂解物中的VEGF/ANG2-0016(具有IHH-AAA突变)的浓度
在玻璃体内应用后,与没有IHH-AAA突变的双特异性抗-VEGF/ANG2抗体VEGF/ANG2-0015相比,本文报道的双特异性抗-VEGF/ANG2抗体VEGF/ANG2-0016(具有IHH-AAA突变)显示在眼裂解物中相似的浓度(96和168小时后)。
另外,在玻璃体内应用后,与没有IHH-AAA突变的双特异性抗-VEGF/ANG2抗体VEGF/ANG2-0015相比,本文报道的双特异性抗-VEGF/ANG2抗体VEGF/ANG2-0016(具有IHH-AAA突变)额外显示在血清中更快的清除和更短的半衰期。
小鼠角膜微囊袋血管生成测定
为了试验各自具有SEQ ID NO:20和21的VEGF结合性VH和VL以及SEQ ID NO:28和29的ANG2结合性VH和VL的双特异性抗-VEGF/ANG2抗体在体内对VEGF诱导的血管生成的抗血管生成作用,执行了小鼠角膜血管生成测定。在这个测定中,将VEGF浸泡过的Nylaflo圆片以至角膜缘血管固定的距离植入无血管角膜的囊袋中。血管立即超向正在形成的VEGF梯度生长进角膜中。8-10周龄雌性Balb/c小鼠购自Charles River,Sulzfeld,德国。根据Rogers,M.S.,等人,Nat.Protoc.2(2007)2545-2550描述的方法调整方案。简而言之,在麻醉的小鼠中使用手术刀片和尖头镊子在显微镜下按照从角膜缘至角膜顶部的大约1mm制备约500μm宽度的微囊袋。植入0.6mm直径的圆片(
给圆片加载300ng VEGF或PBS作为对照并植入7天。随时间推移在第3、5和/或7天监测血管从角膜缘至圆片的生长晕。在圆片植入前1天,将抗体以10mg/kg的剂量静脉内应用(由于静脉内应用,使用血清稳定的VEGF/ANG2-0015(没有IHH-AAA突变)作为替代物,其与VEGF/ANG2-0016仅相差IHH-AAA突变,且具有相同的VEGF和ANG2结合性VH和VL以介导效力)用于在体内试验对VEGF诱导的血管生成的抗血管生成作用。对照组中的动物接受媒介物。施用体积是10mL/kg。
具有HHY-AAA突变的抗体的药代动力学(PK)性质
对于人FcRn而言转基因的FcRn小鼠的PK数据
研究包括雌性C57BL/6J小鼠(背景);小鼠FcRn缺陷的,但对于人FcRn而言半合子转基因的(huFcRn,品系276-/tg)
第1部分:
用适当的IGF-1R 0033、IGF-1R 0035、IGF-1R 0045溶液(即22.2μg化合物/动物的IGF-1R 0033,24.4μg化合物/动物的IGF-1R 0035,32.0μg化合物/动物的IGF-1R和32.0μg化合物/动物的IGF-1R 0045)以玻璃体内方式向右眼中给全部小鼠注射一次。
将13只小鼠分配至2个组,各6和7只动物。血液样品在给药后2、24和96小时取自组1,并且在给药后7、48和168小时取自组2。
通过利用得自德国柏林World Precision Instruments,Inc.的用于纳升注射的NanoFil微量注射器系统,向小鼠右眼的玻璃体中注射。将小鼠用2.5%异氟烷麻醉,并且为了观察小鼠眼,使用具有40倍放大率的Leica MZFL 3显微镜和具有Leica KL 2500 LCD闪光的环形灯。随后,使用35号针注射2μL化合物。
通过对侧眼的眼球后静脉丛,从每只动物收集血液用于确定血清中的化合物水平。
在室温1小时后,通过在4℃离心(9,300x g)3min,从血液获得至少50μL血清样品。将血清样品在离心后直接冷冻,并在-80℃冷冻贮藏直至分析。在处理后96小时,分离组1的动物的经处理的眼,并且在处理后168小时,分离组2的动物的经处理的眼。将样品在-80℃冷冻贮藏直至分析。
第2部分:
用IGF-1R 0033、IGF-1R 0035、IGF-1R 0045的适当溶液(即22.2μg化合物/动物的IGF-1R 0033、24.4μg化合物/动物的IGF-1R 0035、32.0μg化合物/动物的IGF-1R和32.0μg化合物/动物的IGF-1R 0045)经尾静脉静脉内地给全部小鼠注射一次。
将12只小鼠分配至2个组,每组6只动物。血液样品在给药后1、24和96小时取自组1,并且在给药后7、48和168小时取自组2。通过眼球后静脉丛,从每只动物收集血液以确定血清中的化合物水平。
在室温1小时后,通过在4℃离心(9,300xg)3分钟从血液获得至少50μL血清样品。将血清样品在离心后直接冷冻并在-80℃冷冻贮藏直至分析。
小心地混合100μL因子1、50μL因子2和24.73mL细胞裂解缓冲液(都得自Bio-Rad,Bio-Plex Cell Lysis Kit,目录号171-304011),并加入125μL PMSF-溶液(在2.0mL DMSO中稀释的174.4mg苯基甲基磺酰基氟化物)。
通过物理-化学崩解来自实验室动物的全眼,获得眼裂解物。为了机械破裂,将每只眼转移进一个1.5mL圆锥底的微量瓶。在解冻后,用1mL细胞洗涤缓冲液(Bio-Rad,Bio-Plex Cell Lysis Kit,目录号171-304011)洗涤眼一次。在以下步骤中,添加500μL新鲜制备的细胞裂解缓冲液,并且使用1.5mL组织碾磨研棒(VWR Int.,Art.No.431-0098)研磨该眼。然后将混合物冷冻并解冻5次并再次研磨。为了将裂解物与剩余组织分离,将样品在4500x g离心4分钟。在离心后,将上清液收集并在-20℃贮存直至在定量ELISA中进一步分析。
为了定量小鼠血清样品中的抗体,进行标准固相系列夹心免疫测定,其中使用生物素化的和异羟基洋地黄毒苷化的(digoxigenylated)单克隆抗体作为捕获抗体和检测抗体。血清占全血样品体积的约50%。
更详细地,通过人-IgG(Fab)特异性的酶联免疫吸附测定确定小鼠血清样品中的抗体浓度。在室温将抗生蛋白链菌素包被的微孔滴定板与作为捕获抗体的、在测定缓冲液中稀释的生物素化的抗-人Fab(κ)单克隆抗体M-1.7.10-IgG一起在搅拌下温育1小时。在用磷酸盐缓冲盐水-聚山梨酯20(吐温20)洗涤三次之后,加入不同稀释度的血清样品,接着在室温第二次温育1小时。三次重复的洗涤后,如下检测结合的抗体:随后与缀合至洋地黄毒苷的抗-人Fab(CH1)单克隆抗体M-1.19.31-IgG一起温育,接着与缀合至辣根过氧化物酶(HR)的抗-洋地黄毒苷抗体一起温育。使用ABTS(2,2′-连氮基-双(3-乙基苯并噻唑啉-6-磺酸);Roche Diagnostics GmbH,Mannheim,德国)作为HRP底物,以形成有色的反应产物。在405nm(ABTS;参考波长:490nm)读出得到的反应产物的吸光度。
将所有样品、阳性和阴性对照样品一式两份地分析,并且相对于提供的抗体标准品校准。
基于
在37℃将未稀释的上清液(眼裂解物)与捕获和检测分子一起温育9分钟。生物素化的抗-人-Fab(κ)单克隆抗体M-1.7.10-IgG用作捕获分子,并且钌(II)三(双吡啶基)
表:标准图表IGF-1R 0033
表:标准图表IGF-1R 0035
表:标准图表IGF-1R 0045
A)血清浓度
血清浓度的结果显示在下表和图17中。
表:IGF-1R 0033(没有HHY-AAA突变):
表:IGF-1R0035(具有在一个Fc区多肽中的HHY-AAA突变):
表:IGF-1R 0045(具有在两个Fc区多肽中的HHY-AAA突变):
表:标准化至1μg应用的抗体的抗体IGF-1R 0033、0035和0045在
B)左眼和右眼的眼裂解物中的浓度
眼裂解物中浓度的结果显示在下表和图18-20中。
表:玻璃体内应用进右眼以后在眼裂解物中的IGF-1R 0033(没有HHY-AAA突变)的浓度
表:静脉内应用以后在眼裂解物中的IGF-1R 0033(没有HHY-AAA突变)的浓度(BLO=低于定量限)
表:玻璃体内应用进右眼以后在眼裂解物中的IGF-1R 0035(具有在一个Fc区多肽中的HHY-AAA突变)的浓度
表:静脉内应用以后在眼裂解物中的IGF-1R 0035(具有在一个Fc区多肽中的HHY-AAA突变)的浓度(BLQ=低于定量限)
表:玻璃体内应用进右眼以后在眼裂解物中的IGF-1R 0045(具有在两个Fc区多肽中的HHY-AAA突变)的浓度
表:静脉内应用以后在眼裂解物中的IGF-1R 0045(具有在两个Fc区多肽中的HHY-AAA突变)的浓度(BLQ=低于定量限)
表:标准化至1μg应用的抗体,玻璃体内应用进右眼以后在眼裂解物中的IGF-1R0033、0035和0045的浓度
玻璃体内应用后,与没有HHY-AAA突变的抗-IGF-1R抗体(IGF-1R0033)相比,本文报道的抗-IGF-1R抗体0035和0045(具有一侧或两侧的HHY-AAA突变)显示在眼裂解物中类似的浓度(96和168小时后)。
此外,在玻璃体内应用后,与没有HHY-AAA突变的抗-IGF-1R抗体(IGF-1R 0033)相比,本文报道的抗-IGF-1R抗体0035和0045(具有一侧或两侧的HHY-AAA突变)额外显示在血清中更快的清除和更短的半衰期。
尽管为了清楚理解的目的已经通过具体说明和实施例对前述发明进行了比较详细的描述,但是所述描述和实施例不应解释为限制本发明的范围。本文中引用的所有专利和科学文献的公开内容明确地通过引用以它们的整体并入。
- 具有修饰的FCRN结合性质的Fc区变体
- 具有修饰的FCRN和保持的蛋白A结合性质的Fc区变体
