一种基于数字PCR检测血浆游离DNA甲基化的组合物及其应用
文献发布时间:2023-06-19 12:18:04
相关申请的交叉引用
本申请要求2021年06月01日向中国国家知识产权局提交的、专利申请号为202110608386.4的专利申请的优先权,其全部内容以引用的方式并入本文中。
技术领域
本发明属于甲基化检测技术领域,涉及一种基于数字PCR检测血浆游离DNA甲基化的组合物及其应用。
背景技术
根据国际癌症研究机构(IARC)最新发布的2020年全球最新癌症数据,胃癌较前一年就新增病例1,089,103例,已经在全球癌症新发病例数排名中被列为第五位。由于其被诊断出时通常处于晚期,因此胃癌的死亡率很高,其致死病例数占2020年全球癌症致死总病例的7.7%,位于第四位。早期发现是提高患者生存率和治愈率的关键,但目前缺乏准确的非侵入性诊断方法。Reprimo(RPRM)编码一种高度糖基化的蛋白质,主要存在于细胞质中。该基因跨许多物种表达,与胃肠道,脑血管的发育模式相关。
DNA甲基化是表观遗传学的一种调控机制。通过对基因组序列特定区域的CpG碱基组合中的胞嘧啶进行甲基化修饰,变为5-甲基胞嘧啶,引起染色质结构、DNA稳定性等发生改变,从而控制机体基因的表达,参与调节许多生物学过程,如衰老、神经系统发育、原癌基因扩增、肿瘤异质性、耐药等。研究证实血浆DNA甲基化可以作为多种肿瘤早期辅助诊断的标志物,但血浆中的DNA含量很低,且现有的甲基化检测方法难以解决血浆痕量DNA和筛选工具起始DNA含量要求较高的矛盾。
RPRM的上调可使p53依赖的G2细胞周期停滞,可作为P53依赖性肿瘤信号通路的潜在抑制剂。RPRM的表观遗传沉默主要发生在人类癌症的早期,主要是通过其启动子区域的DNA甲基化来实现的。RNF180(ring fingerprotein 180)基因在人类基因组中定位于5q12.3,是一个新型的环指基序基因。相关研究表明,RNF180与细胞分化、增殖、凋亡和肿瘤的发生密切相关,肿瘤中RNF180基因核心启动子甲基化是其表达进下调或沉默的主要机制。而RNF180基因对胃癌的发生与发展尤其关键,表现为肿瘤抑制因子的作用,RNF180的低表达或未表达还与胃癌分期和患者总生存期密切关联。RNF180甲基化状态可以作为一个独立的诊断因子和预后因子应用于临床诊疗。
但目前针对上述基因游离DNA甲基化的检测仍采用荧光定量PCR,基本原理是用亚硫酸氢盐处理后,使用特定的引物和探针来区分甲基化和非甲基化的基因序列,该方法作为高敏感性DNA甲基化的相对定量检测技术被广泛应用,但是,荧光定量法的检测结果为相对定量,难以实现血浆DNA甲基化高精准度和绝对定量的检测,导致对胃癌的临床检测并不精准。
发明内容
本发明利用数字PCR技术筛选血浆中潜在的敏感特异胃癌早期诊断甲基化标志物,建立稳定的痕量DNA甲基化位点的微滴式数字PCR检测体系,构建一种甲基化位点辅助诊断指标,为胃癌的早期诊断提供一种非侵入性、敏感特异和准确性高的新型辅助诊断指标。
第一方面,本发明提供了一种基于数字PCR检测血浆游离DNA甲基化的组合物,所述血浆游离DNA甲基化的标志物为为基因Reprimo和/或基因RNF180。所述组合物包括上游引物、下游引物、甲基化探针M-Probe、非甲基化探针U-Probe。
采用上述技术方案,本发明以Reprimo基因或RNF180基因作为单独的胃癌肿瘤检测标志物,并结合数字PCR检测技术,可以快速的对胃癌进行检测诊断,更进一步而言,将两个检测标志物联合检测,基于二元Logistic回归效果证明多参数联合分析的诊断效果要明显好于单参数检测诊断。RNF180和Reprimo联合检测可有效区分健康对照组和早期GC以及良性组和早期GC。
在某些实施例中,所述Reprimo基因的上游引物F的序列如SE ID NO.1所示、下游引物R的序列如SE ID NO.2所示、甲基化探针M-Probe的序列如SE ID NO.3所示、非甲基化探针U-Probe的序列如SE ID NO.4所示。
在某些实施例中,所述RNF180基因的上游引物FP的序列如SE ID NO.5所示、甲基化下游引物RP-M的序列如SE ID NO.6所示、非甲基化下游引物RP-UM的序列如SE ID NO.7所示、甲基化探针M-Probe的序列如SE ID NO.8所示、非甲基化探针U-Probe的序列如SE IDNO.9所示。
采用上述技术方案,本发明首次采用数字PCR对胃癌肿瘤标志物Reprimo基因或RNF180基因进行检测,该方法①检测灵敏度高,可以检测单拷贝DNA;②结果精准,无需标准曲线,可绝对定量;③操作时间耗时较短,并且价格适中,不昂贵;④检测方法高通量(96孔板),适于临床大样本,有着广阔的应用前景和产业化前景。
在某些实施例中,所述甲基化探针M-Probe、非甲基化探针U-Probe的5’端连接有荧光基团,3’端连接有猝灭基团。5’端报告荧光基团可以为FAM、JOE、TET、HEX、Cy3、TexasRed、Rox或Cy5;3’端的猝灭基团为BHQ1、BHQ2、BHQ3、TAMRA、DABCYL或MGB。
第二方面,本发明还提供了一种基于数字PCR检测基因甲基化的试剂盒,所述试剂盒包括本发明第一方面所提供的组合物。
第三方面,本发明还提供了一种基于数字PCR检测基因甲基化的方法,所述方法用于疾病非诊断和治疗目的,所述方法包括以下步骤,
(1)提取待测样品中的cfDNA;
(2)亚硫酸氢盐转化;
(3)采用上述第一方面所述的组合物或上述第二方面所述的试剂盒通过数字PCR检测所述基因的甲基化,所述基因为基因Reprimo和/或基因RNF180。
在某些实施例中,所述样品为血浆。从癌症患者的血浆或血浆中收集到的游离核酸中与肿瘤相关的基因突变和在癌变组织中发生的基因突变是一样的,因此能够实现癌症基因的微创检测,即液体活检。本方法可以解决传统胃癌检测手段中对组织样本依赖性等的问题。此外,ctDNA富集过程不需要像CTC捕获一样依赖于使用特定设备。这就为患者和医生节约了很多时间,同时也非常便捷。
第四方面,本发明还提供了上述第一方面所述的组合物或上述第二方面所述的试剂盒在制备检测胃癌的产品中应用。
在某些实施例中,所述胃癌包括恶性肿瘤导致的胃癌或良性肿瘤导致的胃癌。
在某些实施例中,所述良性肿瘤为胃多发息肉、胃平滑肌瘤、胃肠道间质瘤以及胃梭形细胞肿瘤。
本发明相对于现有技术而言,具有以下技术效果:
1)首次提出了基于微滴式数字PCR技术绝对定量检测胃癌血浆cfDNA中Reprimo基因或RNF180基因甲基化的检测方法,该方法①检测灵敏度高,可以检测单拷贝DNA;②结果精准,无需标准曲线,可绝对定量;③操作时间耗时较短,并且价格适中,不昂贵;④检测方法高通量(96孔板),适于临床大样本,有着广阔的应用前景和产业化前景。
2)本发明将胃癌标志物基因Reprimo或基因RNF180的甲基化进行联合检测,通过实验证明,多参数联合诊断分析用于区分健康对照组和GC组以及良性组和GC组的诊断价值优于单项参数检测。
3)本发明的检测样品为血浆中的cfDNA,可以解决传统胃癌检测手段中对组织样本依赖性等的问题。同时,ctDNA富集过程不需要像CTC捕获一样依赖于使用特定设备。这就为患者和医生节约了很多时间,同时也非常便捷。因此,可实现胃癌诊断的早发现、早预防,对于胃癌的治疗和预后有着重要意义。
附图说明
为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式描述中所需要使用的附图作简单地介绍。
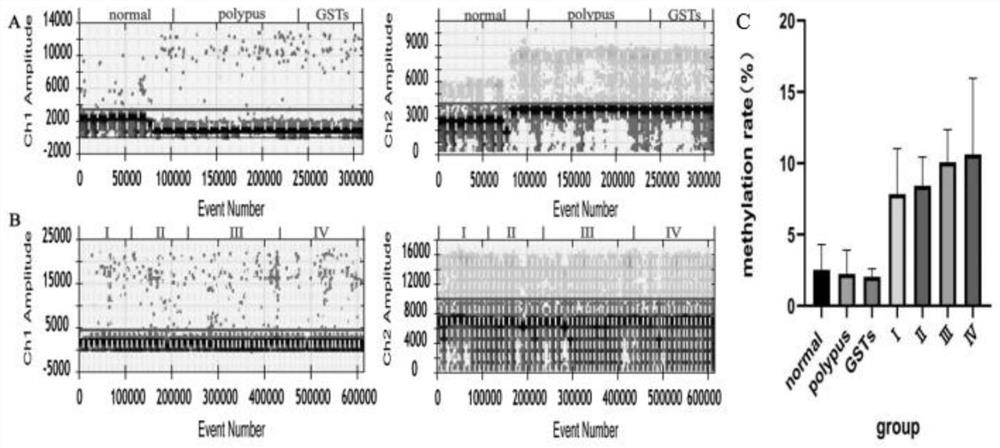
图1是实施例4中基因Reprimo的ddPCR检测结果,其中,A:健康组、息肉组、间质瘤组ddPCR结果图;B:胃癌Ⅰ期组、Ⅱ期组、Ⅲ期组、Ⅳ期组ddPCR结果图;C:Reprimo甲基化率柱形图;此外,图A、B中的左图:荧光通道1(FAM)结果图,即为甲基化结果图。X轴为微滴总数,Y轴为荧光信号强度;水平实线(紫色线)为荧光信号阈值;荧光信号强度大于阈值的微滴为阳性微滴,即蓝色微滴;荧光信号强度小于阈值的微滴为阴性微滴,即灰色微滴。图A、B中的右图:荧光通道2(VIC)结果图,即为非甲基化结果图。X轴为微滴总数,Y轴为荧光信号强度;水平实线(紫色线)为荧光信号阈值;荧光信号强度大于阈值的微滴为阳性微滴,即绿色微滴;荧光信号强度小于阈值的微滴为阴性微滴,即灰色微滴。
图2是实施例4中基因RNF180的ddPCR检测结果。其中,A:健康组、息肉组、间质瘤组ddPCR结果图;B:胃癌Ⅰ期组、Ⅱ期组、Ⅲ期组、Ⅳ期组ddPCR结果图C:RNF180甲基化率柱形图;此外,图A、B中的左图:荧光通道1(FAM)结果图,即为甲基化结果图。X轴为微滴总数,Y轴为荧光信号强度;水平实线(紫色线)为荧光信号阈值;荧光信号强度大于阈值的微滴为阳性微滴,即蓝色微滴;荧光信号强度小于阈值的微滴为阴性微滴,即灰色微滴。图A、B中的右图:荧光通道2(VIC)结果图,即为非甲基化结果图。X轴为微滴总数,Y轴为荧光信号强度;水平实线(紫色线)为荧光信号阈值;荧光信号强度大于阈值的微滴为阳性微滴,即绿色微滴;荧光信号强度小于阈值的微滴为阴性微滴,即灰色微滴。
图3是实施例5中二元logistic联合RNF180和Reprimo进行的ROC分析结果,其中,A:健康组与GC组;B:健康组与GC早期组。
图4是实施例6中二元logistic联合RNF180和Reprimo进行的ROC分析结果,其中,A:良性组与GC组;B:良性组与GC早期组。
具体实施方式
下面将对本发明技术方案的实施例进行详细的描述。以下实施例仅用于更加清楚地说明本发明的技术方案,因此只是作为示例,而不能以此来限制本发明的保护范围。需要注意的是,除非另有说明,本申请使用的技术术语或者科学术语应当为本发明所属领域技术人员所理解的通常意义。
实施例1
(1)血浆cfDNA的提取
1)在1mL血浆样本中,依次加入磁珠悬液30μL,proteinase K 55μL,Bead BindingBuffer 150μL,涡旋混匀;
2)200×g离心30s以去除盖子上的液体,将Ep管放在2mL的磁力架上,孵育1min直至溶液澄清,用移液器去除上层溶液;
3)取下Ep管,向其加入200μLBead Elution Buffer,涡旋混匀,将混合物转移至Bead Elution tube,将其放到金属浴设置程序20℃,300rpm,孵育5min;
4)将其取下放到磁力架上孵育1min,直至溶液澄清。将上清液转移到新的洗脱管中,丢弃磁珠,上清液中加入300μL ACB缓冲液,涡旋混匀,简短离心;
5)将上步的混合物加到QIAamp UCP Elution Column,6000×g,离心1min。将柱子放入干净的2mL收集管中,弃流出液;
6)加入500μL ACW2 Buffer到柱子中,6000×g,离心1min,弃流出液,将柱子放入到干净的2mL收集管中,20,000×g离心3min;
7)将柱子放入到一个干净的1.5mL离心管中,打开盖子,56℃孵育3min;
8)在柱子的膜中心处加入24μL超净水,关闭盖子,室温15-25℃,孵育1min后20,000×g离心1min;
9)将1.5mL收集管中得到的洗脱液重新加入到柱子的膜中心处,关闭盖子,室温孵育1min后20,000×g离心1min,收集DNA溶液。
(2)亚硫酸氢盐转化
1)在CT转化试剂中依次加入900μL水,300μL M-Dilution Buffer和50μLM-Dissolving Buffer,在室温下溶解并振荡10min;
2)在200μL PCR管中加入130μL的CT转化试剂和20μLDNA样本;
3)将PCR管置于热循环仪中,PCR仪盖温设置为105℃,程序为:(1)98℃10min(2)在64℃2h 10min(3)4℃最多保存20小时;
4)将Zymo-SpinTM IC Column放入到指定的收集管中,并向其加入600μL M-Binding Buffer,将步骤3的样本加入到包含M-Binding Buffer的Zymo-SpinTM IC Column中,盖上盖子,将其反复颠倒数次来混合样本;
5)10,000×g离心30s,去除流出液;
6)在柱中加入100μL M-Wash Buffer,10,000×g离心30s,去除流出液;
7)在柱中加入200μL M-Desulphonation Buffer,室温静置20min,孵育后10,000×g离心30s,去除流出液;
8)在柱中加入200μLM-WashBuffer,1000×g 30s,去除流出液,再加入200μLM-Wash Buffer,10,000×g 30s,去除流出液;
9)将柱放在新的1.5mL离心管中,直接向柱基质中加6μLM-Elution Buffer,10,000×g 30s以洗脱DNA。
实施例2
数字PCR扩增引物设计:分别以基因Reprimo亚硫酸氢盐转化后甲基化序列和非甲基化序列为靶基因进行引物的设计。引物序列见表1。
表1引物序列表
其中,M-Probe的5’端标记的荧光基团是FAM,3’端标记的淬灭基团是BHQ1;U-Probe的5’端标记的荧光基团是VIC,3’端标记的淬灭基团是BHQ1。
1)设待检样品为N,反应体系配置如表2:
表2 ddPCR反应体系
2)将反应体系充分混匀后,分装至每个反应管各17μL;
3)分别取3μL经亚硫酸氢盐转化后的DNA,加入相应的反应管中,终体积为20μL;
4)将一个新的微滴发生卡放入卡托中,将20μL样品反应液对应加入到微滴发生卡中间一排的8个孔中,不足8个样品时用20μLbuffer control补足,加样时枪头接近孔一侧底部,与侧壁呈现大约15°角,缓慢打出液体,打出一部分后缓慢提升枪头位置再打出余下液滴,不要将枪打至第一档位置以免引入气泡;;
5)在微滴发生卡最下面一排的8个孔中加入70μL微滴生成油,同样不能有空着的孔;
6)盖上胶垫,注意两边的小孔都要钩牢;
7)将以上卡托轻轻地平稳放置于微滴生成仪中,开始生成微滴,注意仪器上指示灯状态,当绿灯常亮时表示微滴发生完成;
8)微滴生成于微滴发生卡最上面一排孔内,将生成40μL微滴全部吸取并缓慢地打入96孔板相应位置孔内,枪头贴近孔壁接近孔底,注意封上盖以防油挥发,微滴发生卡和胶垫均为一次性使用品;
9)微滴全部转入到96孔板后,用预热好的PX1热封仪对其进行封膜(膜的红线朝上),运行程序为:180℃,5s;
10)封好膜之后应该在30min内进行PCR反应,或者放于4℃冰箱4小时之内进行PCR。扩增程序如表3所示:
表3 ddPCR扩增体系
注:每步都设置2.5℃/sec的升降温速度。
11)将PCR扩增完成的96板放入微滴分析仪的plate holder中,注意板斜角方位,组装好之后轻轻地平稳放入微滴读取仪中。
12)打开QuantaSoft软件,建议每次实验之前做一次Flush System,若一周以上未使用建议先做一次Prime再做Flush System。然后对96孔板中样品信息进行设置,完成后即可进行检测,结束后结果会被自动分析,人工核实后保存结果。
实施例3
数字PCR扩增引物设计:分别以基因RNF180亚硫酸氢盐转化后甲基化序列和非甲基化序列为靶基因进行引物的设计。引物序列见表4。
表4引物序列表
其中,M-Probe的5’端标记的荧光基团是FAM,3’端标记的淬灭基团是BHQ1;U-Probe的5’端标记的荧光基团是VIC,3’端标记的淬灭基团是BHQ1。
1)设待检样品为N,反应体系配置如表5:
表5 ddPCR反应体系
2)将反应体系充分混匀后,分装至每个反应管各17μL;
3)分别取3μL经亚硫酸氢盐转化后的DNA,加入相应的反应管中,终体积为20μL;
4)将一个新的微滴发生卡放入卡托中,将20μL样品反应液对应加入到微滴发生卡中间一排的8个孔中,不足8个样品时用20μLbuffer control补足,加样时枪头接近孔一侧底部,与侧壁呈现大约15°角,缓慢打出液体,打出一部分后缓慢提升枪头位置再打出余下液滴,不要将枪打至第一档位置以免引入气泡;;
5)在微滴发生卡最下面一排的8个孔中加入70μL微滴生成油,同样不能有空着的孔;
6)盖上胶垫,注意两边的小孔都要钩牢;
7)将以上卡托轻轻地平稳放置于微滴生成仪中,开始生成微滴,注意仪器上指示灯状态,当绿灯常亮时表示微滴发生完成;
8)微滴生成于微滴发生卡最上面一排孔内,将生成40μL微滴全部吸取并缓慢地打入96孔板相应位置孔内,枪头贴近孔壁接近孔底,注意封上盖以防油挥发,微滴发生卡和胶垫均为一次性使用品;
9)微滴全部转入到96孔板后,用预热好的PX1热封仪对其进行封膜(膜的红线朝上),运行程序为:180℃,5s;
10)封好膜之后应该在30min内进行PCR反应,或者放于4℃冰箱4小时之内进行PCR。扩增程序如表6所示:
表6 ddPCR扩增体系
注:每步都设置2.5℃/sec的升降温速度。
11)将PCR扩增完成的96板放入微滴分析仪的plate holder中,注意板斜角方位,组装好之后轻轻地平稳放入微滴读取仪中。
12)打开QuantaSoft软件,建议每次实验之前做一次Flush System,若一周以上未使用建议先做一次Prime再做Flush System。然后对96孔板中样品信息进行设置,完成后即可进行检测,结束后结果会被自动分析,人工核实后保存结果。
实施例4
用实施例1-3的方法对临床样本进行检测,10例健康样本,18个良性肿瘤样本,56个恶性肿瘤样本,其中Ⅰ期10例,Ⅱ期10例,Ⅲ期18例,Ⅳ期18例,检测结果如图1-2所示。同时,两个生物标志物检测结果符合正态分布P>0.05,通过SPSS软件比较均值,单因素分析比较可发现有组间显著性差异,结果如表7所示。
表7血浆生物标志物RNF180、Reprimo甲基化率比较
注:与健康组比较
以上分析表明,RNF180基因健康组与息肉组、间质瘤组及癌症组各分期之间都有显著性差异;息肉组和间质瘤组只与Ⅳ期组之间有显著性差异;在癌症分期组之间,I期、Ⅱ期患者与四期患者有显著性差异。Reprimo基因健康组与癌症组之间有显著性差异,与息肉组和间质瘤组之间没有显著性差异;息肉组和间质瘤组都与癌症组之间有显著性差异;在癌症分期之间,只有Ⅰ期和Ⅳ期组之间有显著性差异。上图的实验结果可以说明本方法检测reprimo基因甲基化灵敏,恶性组与健康组和良性组都具有显著性关系,可以辅助胃癌的早期诊断。
实施例5
基于前期血清生化、免疫参数及ROC曲线分析的实验,最终筛选出9项参数进行二元logistic回归分析。采用向前:条件法进行计算,最终只要RNF180和Reprimo两项参数进入公式中。参数RNF180和Reprimo在方程中,系数分别为11.581和4.062,常数项为-49.590。因而得出其回归方程为:
Y=logitP==-49.5903+11.5807
利用预测概率值进行进一步的ROC曲线分析,结果如图3中。其AUC为0.996,标准误为0.005,95%置信区间为0.98和1。当预测值概率为0.841时的灵敏度和特异性分别为96.4%和100%。高于单独检测时具有高诊断价值的参数Reprimo,其检测灵敏度和特异性分别为92.9%和100%。健康对照组和Ⅰ/Ⅱ的ROC曲线的AUC为0.995,预测概率值为0.841时,灵敏度和特异性分别为95%和100%。利用该方法可以看出,多参数联合检测可有效区分健康对照组和GC组,健康对照组和早期GC。
实施例6
在疾病人群当中,有些是良性疾病,如胃多发息肉、胃平滑肌瘤、胃肠道间质瘤以及胃梭形细胞肿瘤等皆为良性,而有些则是恶性肿瘤。因此,分析了99项参数在良性组和GC组之间的差异。经过前期良性组和GC组ROC曲线分析和相关性分析,最终筛选出7项参数进行二元logistic回归分析。所示向前:条件法进行计算,最终只要RNF180和Reprimo两项参数进入公式中。参数RNF180和Reprimo在方程中,系数分别为1.4646和0.8845,而常数项为-8.8361。因而得出其回归方程为:
Y=logitP==-8.8361+1.4646
利用预测概率值进行进一步的ROC曲线分析,结果如图4。其AUC为0.98,标准误为0.014,95%置信区间为0.95和1。当预测值概率为0.772时的灵敏度和特异性分别为94.6%和100%,特异度高于单独检测时具有高诊断价值的参数Reprimo。良性组和Ⅰ/Ⅱ的ROC曲线的AUC为0.969,预测概率值为0.825时,灵敏度和特异性分别为90%和100%。利用该方法可以看出,多参数联合检测可有效区分良性对照组和GC组,良性对照组和早期GC。
最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围,其均应涵盖在本发明的权利要求和说明书的范围当中。
序列表
<110> 中国人民解放军总医院
<120> 一种基于数字PCR检测血浆游离DNA甲基化的组合物及其应用
<130> 2021
<160> 9
<170> SIPOSequenceListing 1.0
<210> 1
<211> 24
<212> DNA
<213> 人工序列(artificial sequence)
<400> 1
tagtagaaag tggtaagaag aggg 24
<210> 2
<211> 20
<212> DNA
<213> 人工序列(artificial sequence)
<400> 2
ccaaaactta acccacctac 20
<210> 3
<211> 20
<212> DNA
<213> 人工序列(artificial sequence)
<400> 3
aaccttcgca ccgtcgatct 20
<210> 4
<211> 22
<212> DNA
<213> 人工序列(artificial sequence)
<400> 4
aaccttcaca ccatcaatct cc 22
<210> 5
<211> 20
<212> DNA
<213> 人工序列(artificial sequence)
<400> 5
aaggggatga taagggagaa 20
<210> 6
<211> 17
<212> DNA
<213> 人工序列(artificial sequence)
<400> 6
cgacctcgaa cgtaacg 17
<210> 7
<211> 21
<212> DNA
<213> 人工序列(artificial sequence)
<400> 7
ccacaacctc aaacataaca c 21
<210> 8
<211> 18
<212> DNA
<213> 人工序列(artificial sequence)
<400> 8
ccgccacaac caacgacc 18
<210> 9
<211> 21
<212> DNA
<213> 人工序列(artificial sequence)
<400> 9
tcacccacca caaccaacaa c 21
- 一种基于数字PCR检测血浆游离DNA甲基化的组合物及其应用
- 一种用于鉴别肺结节良恶性的血浆游离DNA甲基化基因组合及其应用
