一种几丁二糖脱乙酰酶突变体、基因、工程菌及其应用
文献发布时间:2023-06-19 12:18:04
技术领域
本发明涉及生物工程技术领域,尤其涉及一种几丁二糖脱乙酰酶突变体、基因、工程菌及其应用。
背景技术
氨基葡萄糖(GlcN)又叫葡萄糖胺,是葡萄糖的一个羟基被氨基取代后的化合物,在医疗美容、农业生产、食品保健等领域有着广泛应用。作为形成软骨组织细胞的重要营养素,GlcN在许多国家已被列入医药品行列。
GlcN通常是由甲壳素和壳聚糖酸水解而成的,从蟹壳和虾壳中提取。但是,这种方法需要在高温和浓酸条件下水解材料,造成严重的环境污染,对设备的需求量较高。因此,以微生物发酵法合成的N-乙酰氨基葡萄糖(GlcNAc)为底物生产GlcN已逐渐成为大规模生物生产GlcN的主要方法。然而,从GlcNAc到GlcN的脱乙酰化仍需要酸水解。目前,以GlcNAc为原料,反应条件温和,生物催化法生产GlcN的研究受到广泛的重视。同时也可避免在生产过程中使用酸碱,安全无毒绿色。
几丁二糖脱乙酰酶Dac来源于极端嗜热古菌Pyrococcus horikoshii,具有良好的热稳定性。几丁二糖脱乙酰酶Dac对乙酰氨基葡萄糖单体也有很高的催化活性,能够以GlcNAc为底物进行单酶催化反应,脱乙酰生成GlcN,实现GlcN的一步生产。几丁二糖脱乙酰酶Dac在生产壳寡糖和单糖方面有着不容忽视的巨大潜力。市场上现存的脱乙酰酶多是针对多聚体或寡聚体的乙酰氨基葡萄发挥作用,而针对单体形式发挥功能的脱乙酰酶鲜有报道,且存在利用几丁二糖脱乙酰酶Dac转化合成氨基葡萄糖GlcN效率不高的问题。
发明内容
为解决上述技术问题,本发明通过对几丁二糖脱乙酰酶Dac与底物GlcNAc结合的关键位点进行定点饱和突变体库的构建和筛选,并对酶活最高的突变体进行组合突变,获得了几丁二糖脱乙酰酶组合突变体。
本发明的第一个目的是提供一种几丁二糖脱乙酰酶突变体,由氨基酸序列如SEQID NO.1所示的几丁二糖脱乙酰酶突变得到;其中,突变位点为
第74位的甘氨酸G突变为天冬氨酸D;
或第74位的甘氨酸G突变为天冬氨酸D和第152位的组氨酸H突变为谷氨酸E;
或第74位的甘氨酸G突变为天冬氨酸D和第168位的苯丙氨酸F突变为丙氨酸A;
或第74位的甘氨酸G突变为天冬氨酸D和第232位的色氨酸W突变为丙氨酸A;
或第74位的甘氨酸G突变为天冬氨酸D、第152位的组氨酸H突变为谷氨酸E和第168位的苯丙氨酸F突变为丙氨酸A;
或第74位的甘氨酸G突变为天冬氨酸D、第152位的组氨酸H突变为谷氨酸E和第232位的色氨酸W突变为丙氨酸A;
或第152位的组氨酸H突变为谷氨酸E、第168位的苯丙氨酸F突变为丙氨酸A和第232位的色氨酸W突变为丙氨酸A;
或第74位的甘氨酸G突变为天冬氨酸D、第152位的组氨酸H突变为谷氨酸E、第168位的苯丙氨酸F突变为丙氨酸A和第232位的色氨酸W突变为丙氨酸A。
上述几丁二糖脱乙酰酶突变体的构建方法,包括以下步骤:
(1)几丁二糖脱乙酰酶经过丙氨酸扫描得到催化关键位点;
(2)根据步骤(1)得到的催化关键位点,构建几丁二糖脱乙酰酶的催化关键位点的所有氨基酸突变体库,筛选出酶活较高的单突变体;
(3)根据步骤(2)筛选出的酶活较高的单突变体的突变位点,构建组合突变体,筛选出酶活较高的组合突变体。
本发明通过定点饱和突变对经过丙氨酸扫描得到的4个催化关键位点(G74、H152、F168、W232)进行进一步筛选,构建几丁二糖脱乙酰酶Dac的4个催化关键位点的所有氨基酸突变体库,考察不同位点突变时几丁二糖脱乙酰酶Dac的酶活变化,并通过测序获得酶活最高的几丁二糖脱乙酰酶Dac突变体及其编码序列,再通过定点突变构建组合突变体,将携带组合突变体编码基因的质粒转入宿主细胞,并检测酶活,得到酶反应活性提高的几丁二糖脱乙酰酶组合突变体。
本发明的第二个目的是提供一种编码上述突变体的基因。
本发明的第三个目的是提供一种携带上述突变体的重组表达载体。
进一步地,重组表达载体以p43NMK为原始表达载体。
本发明的第四个目的是提供一种表达上述突变体的细胞。
进一步地,细胞为枯草芽孢杆菌。
进一步地,枯草芽孢杆菌以B.subtilis WB600为宿主,以p43NMK为载体。
本发明的第五个目的是提供一种含上述突变体的组合物。
本发明还要求保护上述突变体、基因、重组表达载体、细胞或组合物在合成氨基葡萄糖或含氨基葡萄糖产品中的应用。
进一步地,以上述突变体、组合物或细胞发酵得到的含有突变体的上清液为催化剂,以N-乙酰氨基葡萄糖为底物生产氨基葡萄糖。
进一步地,以发酵48-72h的重组枯草芽孢杆菌上清液为催化剂,以80-120g/L的N-乙酰氨基葡萄糖为底物,于35-45℃条件下转化N-乙酰氨基葡萄糖生成氨基葡萄糖。优选地,以发酵60h的重组枯草芽孢杆菌上清液为催化剂,以100g/L的N-乙酰氨基葡萄糖为底物,于40℃条件下转化N-乙酰氨基葡萄糖生成氨基葡萄糖。
进一步地,将重组枯草芽孢杆菌于35-37℃培养至OD
进一步地,按体积计2-5%的接种量接种种子培养液,优选4%。
进一步地,种子培养液经12000rpm、4℃离心2min得到上清液。
进一步地,重组枯草芽孢杆菌的发酵培养基包括蛋白胨12g/L、酵母提取物24g/L、甘油、KH
借由上述方案,本发明至少具有以下优点:
(1)本发明的几丁二糖脱乙酰酶突变体,表达量得到显著提高,催化效率也得到明显改善。
(2)本发明得到的突变体合成氨基葡萄糖GlcN,有利于解决化学合成法中污染严重,步骤繁琐等问题。
上述说明仅是本发明技术方案的概述,为了能够更清楚了解本发明的技术手段,并可依照说明书的内容予以实施,以下以本发明的较佳实施例并配合详细附图说明如后。
附图说明
为了使本发明的内容更容易被清楚的理解,下面根据本发明的具体实施例并结合附图,对本发明作进一步详细的说明。
图1为4个催化关键位点单突变的引物PCR扩增结果;
图2为G74突变为D74的单突变体在330nm下的吸光值结果;
图3为H152突变为E152的单突变体在330nm下的吸光值结果;
图4为F168突变为A168的单突变体在330nm下的吸光值结果;
图5为W232突变为A232的单突变体在330nm下的吸光值结果;
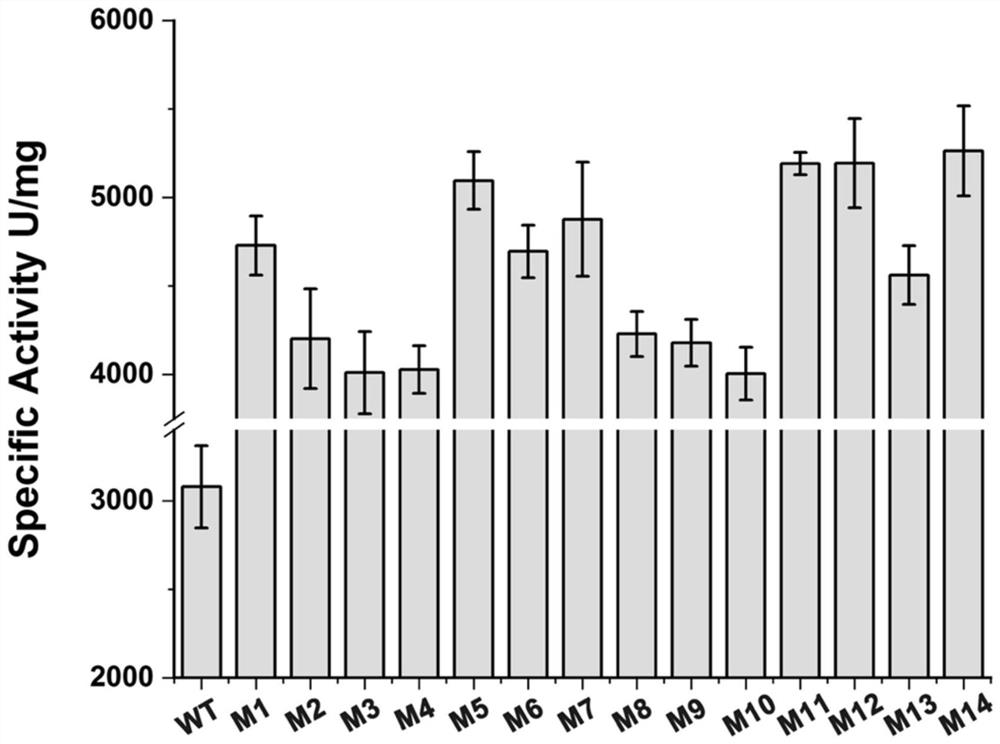
图6为14个突变体的比酶活检测结果。
具体实施方式
下面结合附图和具体实施例对本发明作进一步说明,以使本领域的技术人员可以更好地理解本发明并能予以实施,但所举实施例不作为对本发明的限定。
实施例1预测位点的定点饱和突变体库构建
根据几丁二糖脱乙酰酶Dac的碱基序列,设计简并引物(如表1)。以p43NMK-Dac(构建方法参见专利CN201910193636.5)为模板,序列如SEQ ID NO.2所示。根据Dac的编码序列设计定点突变引物,进行PCR扩增(如图1)及大肠杆菌Escherichia coli BL21转化。
表1简并引物序列
实施例2定点饱和突变体库的筛选
挑取单菌落接种于装有含Kan抗生素的液体LB培养基(600μL每孔)的灭菌96深孔板中。于37℃,900rpm培养12h,获得种子液。次日,将所得种子液200μL转接到装有培养基(600μL每孔)的新的灭菌96深孔板中,新的96深孔板的培养基成分为:含终浓度为50mg/L的Kan抗生素,终浓度为0.05mmol/L的IPTG的LB液体培养基。于37℃,900rpm的震荡摇床上诱导培养5-8h。利用96孔板离心机对培养细菌的96深孔板进行离心,3,500×g离心5min,弃上清液,每孔加入100μL 50g/L的GlcNAc溶液(溶剂为pH 8.0的PB缓冲液)对菌体进行悬浮,于40℃,900rpm震荡摇床上反应20min。然后每孔加入50μL终止剂(0.5mol/L HCl)终止反应。每孔加入350μL ddH
通过对每个位点吸光度最高的突变体进行测序分析,四个位点酶活最高的突变体分别为G74D,H152E,F168A和W232A。其中,在40℃反应条件下,1h能转化1μmol底物N-乙酰氨基葡萄糖GlcNAc为1μmol产物氨基葡萄糖GlcN所需的酶量,称为一个酶活力单位,即1U=1μmol/h。
实施例3
对定点饱和突变筛选出的4个位点进行组合突变。以p43NMK-Dac(构建方法参见专利CN201910193636.5)为模板,序列如SEQ ID NO.2所示。根据Dac的编码序列设计定点突变引物(如表2),进行PCR扩增及大肠杆菌Escherichia coli JM109转化。提取质粒后转入B.subtilis WB600。突变体及突变位点如表3所示。
表2组合突变引物序列
表3突变体及突变位点
将构建好的14个突变体菌株单克隆转化子挑入含有5mL液体LB培养基的50mL离心管中进行种子培养,每管添加了10mg/mL的卡那霉素。种子液在弹簧摇床上37℃培养12h后以4%的接种量转接至含有96mL液体TB培养基的500mL三角瓶中进行发酵培养,每瓶添加10mg/mL卡那霉素。
通过邻苯二甲醛显色法进行粗酶液酶活检测,具体方式如下:
发酵60h后,取发酵液1mL,12000rpm,4℃离心2min。上清液即为粗酶液,底物为用pH8.0的磷酸缓冲液配置的100g/L的N-乙酰氨基葡萄糖GlcNAc溶液。将待测粗酶液与底物各100μL分别装于1.5mL EP管后40℃预热5min。预热后将粗酶液和底物混合,40℃震荡反应2min,然后加入0.5mol/L HCl终止反应。12000rpm离心2min后取50μL上清加入950μL PB中。混合均匀后取5μL加入100μL OPA检测试剂中,震荡2min。利用酶标仪检测其在330nm处的吸光值。以预先加入0.5mol/L HCl失活后的酶液为反应空白对照。
GlcN的标准曲线绘制,精确称取标准品配制0.5g/L、1g/L、2g/L、3g/L、4g/L、5g/LGlcN溶液,取5μL加入100μL OPA检测试剂中,震荡1min,30℃保温2min。利用酶标仪检测其在330nm处的吸光值,绘制标准曲线。
酶活力计算公式如下所示:
式中,X为粗酶液酶活力(U/mL);A为粗酶液体积0.1(mL);B为底物溶液体积0.1(mL);M为加入终止剂后样品稀释倍数1.5;C为反应液GlcN浓度(g/L);D为空白液GlcN浓度(g/L);T为反应时间2(min);60表示60min;215.6为标准样品氨基葡萄糖盐酸盐摩尔质量(g/mol);0.1为底物溶液体积数(mL);x为酶液稀释倍数20。
对14个突变体进行纯化:取60h发酵液50mL以8000rpm离心15min,取上清液于85℃条件下进行水浴加热,再以8000rpm离心15min,将上清液置于PB1缓冲液(200mmol/L的NaH
利用5-10个柱体积的ddH
Bradford方法测定蛋白质浓度,以牛血清白蛋白测定标准曲线。14个突变体的比酶活检测结果见图6。
由图6可知,在4个单突变体中,突变体M1的比酶活最高,比野生型高53.58%,组合突变体M5、M6、M7、M11、M12、M13和M14的促进率均在48%以上,其中,组合突变体M14的比酶活最高,达到5162.17U/mg。
实施例4动力学参数的测定
在40℃反应温度下,以不同浓度的底物GlcNAc溶液(浓度范围:0.9-22.6mmol/L),进行动力学参数的K
Kcat=Vmax/E;式中,V
单突变体M1以及组合突变体M5、M6、M7、M11、M12、M13和M14的催化效率与野生型相比明显提高,其中,M14的催化效率最高,K
表4动力学参数
显然,上述实施例仅仅是为清楚地说明所作的举例,并非对实施方式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式变化或变动。这里无需也无法对所有的实施方式予以穷举。而由此所引申出的显而易见的变化或变动仍处于本发明创造的保护范围之中。
- 一种几丁二糖脱乙酰酶突变体、基因、工程菌及其应用
- 一种分泌表达几丁二糖脱乙酰酶的工程菌构建及其应用
