一株发酵用的谷糠乳杆菌及其发酵制备工艺
文献发布时间:2023-06-19 12:22:51
技术领域
本发明涉及微生物技术及其应用领域,特别为一株食品发酵用的乳酸菌菌株及其在食药同源发酵中的应用。
背景技术
发酵是指人们借助微生物在有氧或无氧条件下的生命活动来制备微生物菌体本身、或者直接代谢产物或次级代谢产物的过程。现如今,微生物发酵技术已广泛应用于食品加工行业,与传统发酵制品的生产模式相比,利用特定菌种发酵可以有效地解决传统发酵食品在工业化生产当中存在的问题,且具有发酵活力强、发酵时间短、可保持微生物菌种的活性、有效地防止杂菌污染、节省原材料、降低成本等优点,同时还可以保证发酵产品质量的稳定,能够精确控制发酵工程,降低生产风险。乳酸菌是一类可将碳水化合物代谢为乳酸的不具有芽孢结构的革兰氏阳性菌,被广泛运用于各类食品加工行业,利用乳酸菌生产加工发酵制品,在改善物料原有风味的同时,还具有强化人体胃肠道功能,促进机体对营养物质的消化吸收等作用。
“食药同源”中药是指既具有药效作用又可作为食物食用的中药材,如:人参、葛根、黄芪等,这些物料大多在中药配伍中应用较多,在食品加工产业中应用较少。发酵植物基饮料作为一种兴起的健康饮品,利用微生物对物料进行发酵,可以将物料中的大分子物质转化成小分子,在增强特征性功能物质的同时也更有易于人体的消化吸收,同时还可以优化产品的风味。目前,市场上与“食药同源”中药有关的发酵产品几乎没有。因此,将微生物发酵技术应用于“食药同源”中药材,在最大限度保留中药材中的营养物质,充分发挥中药材营养功效的同时,还可以有效地改善中药材的风味,提高中药材的保质期。基于此,利用微生物发酵技术开发研制“食药同源”中药发酵饮品,既充分利用了我国丰富的中药材资源,又增加和拓宽了我国中药材加工品的种类,促进了中药材的农业产业化。
发明内容
基于上述分析,本发明的目的是提供一种新的食品发酵用的乳酸菌菌株,以及利用该新的乳酸菌加工的 “食药同源”中药发酵制品,以克服现有技术的缺陷,最大程度地保留中药材的营养成分,优化中药材的风味,强化人体对中药材营养物质的消化吸收。
本发明提供一种类谷糠乳杆菌(Lactobacillus farraginis) 84-M-Y-7,该菌株于2021年3月23日保藏于中国微生物菌种保藏管理 委员会普通微生物中心(简称CGMCC,地址:北京市朝阳区北辰西路1 号院3号,中国科学院微生物研究所,邮编100101),分类命名为类谷 糠乳杆菌Lactobacillus farraginis,保藏编号为CGMCC No.22055。
本发明的谷糠乳杆菌(
本发明所述的利用谷糠乳杆菌(
本发明发酵饮料制备的条件是:所述谷糠乳杆菌(
本发明的一个目的是提供谷糠乳杆菌(
本发明的一个目的是提供一种发酵饮品的制备工艺,工艺步骤包括原料挑选、清洗、烫漂、榨汁、煮沸、发酵、后熟、离心、过滤、 调味、灌装、成品。工艺步骤包括原料挑选、原料处理等步骤,原料处理包括烫漂、榨汁、煮沸步骤,产品经发酵后还包括后熟步骤。工艺步骤还包括离心、过滤、调味、灌装、包装、成品的一步或多步。
本发明的另一个目的是提供一种发酵饮品的制备工艺,包括使用本发明的谷糠乳杆菌对基料进行发酵。
本发明的另一个目的是提供一种发酵饮品的制备工艺,制备工艺包括如下步骤:
(1)原料预处理;
(2)中药材原液的制备:将处理好的中药材原料添加纯净水和一定量的羧甲基纤维素钠榨汁,将榨好的中药材原料原液煮沸15-20 s后冷却备用;
(3)发酵菌种的制备:将谷糠乳杆菌84-M-Y-7在MRS液体培养基中进行3-4次传代培养,制备种子液;
(4)发酵后熟:在无菌环境下,将种子液按照4-20%的接种量接入中药材原料原液中,将其置于恒温培养箱中培养得发酵液;
(5)离心过滤:将发酵液进行离心,过滤,得发酵原液;
(6)调味灌装:将发酵原液进行调味,无菌灌装,即得发酵饮品。
优选的,原料为葛根、铁皮石斛、生姜、山药、人参、玛卡之一。
优选的,还包括后熟步骤,其为将发酵液置于4-6 ℃低温冷藏箱中进行后熟,后熟时长为24-72 h。
优选的,调味灌装中使用蜂蜜和纯净水进行调味。
优选的,原料预处理步骤包括将原料挑选、清洗、去皮、洗净,切成小块后沸水烫漂20-30s。
在上述发酵工艺中,菌株84-M-Y-7在MRS液体培养基中进行3-4次传代培养。当活菌数达到1×10
在上述发酵工艺中,可选地,谷糠乳杆菌(
在上述发酵步骤中,可选地,将预先培养的菌体按4-20%的接种量接种入原料液。发酵产品的制备工艺中还包括后熟步骤,后熟温度优选4-6 ℃,后熟时间优选36-60 h。
本发明提供的谷糠乳杆菌
产品或添加剂中谷糠乳杆菌84-M-Y-7使用MRS液体培养基培养, MRS液体培养基配方为:蛋白胨10g、牛肉粉 5g、酵母粉4g、K
通过上述技术方案,本发明公开提供了一株食品发酵用的乳酸菌菌株及其在“食药同源”中药发酵中的应用,与现有技术相比,本发明具有如下有益效果:
1.该菌株可以作为优质发酵剂:本发明作为高活菌数的菌种培养物接入到“食药同源”中药原液中,可使料液进行充分发酵且发酵时间短,发酵特性好,产品质量稳定,风味优良。
2.本发明的发酵剂使用方便:本发明的发酵剂可直接添加到物料中,不需添加其他添加剂,使用方便,使用剂量小。
3.利用该菌株制得的六种发酵饮料改善了中药材本身的味道,在优化中药材风味的同时最大限度地保留了中药材原有的营养成分,并且利用乳酸菌的作用促进了结合态活性成分的释放,有效地提高了产品的功能特性,加强了人体的消化吸收。
附图说明
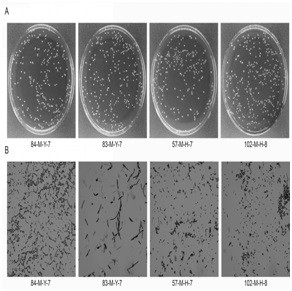
图1 4株乳酸菌菌落形态特征和革兰氏染色结果。
图2 基于16SrDNA基因序列4株菌株的系统发育树。
图3 不同菌株发酵石斛汁pH值(A)、总酸含量(B)以及OD
图4 发酵饮料与未发酵原液对ABTS自由基清除效果的比较。A-F分别为葛根、铁皮石斛、生姜、山药、人参和玛卡发酵饮料与未发酵原液的比较。
图5 发酵饮料与未发酵原液对羟自由基清除效果的比较。A-F分别为葛根、铁皮石斛、生姜、山药、人参和玛卡发酵饮料与未发酵原液的比较。
图6 发酵饮料与未发酵原液还原力的比较。A-F分别为葛根、铁皮石斛、生姜、山药、人参和玛卡发酵饮料与未发酵原液的比较。
图7 六种发酵饮料在4℃下贮藏63天pH值变化。
图8 六种发酵饮料在4℃下贮藏63天总酸含量变化。
图9 六种发酵饮料在4℃下贮藏63天活菌数变化。
图10 六种发酵饮料在4℃下贮藏63天感官评定结果。
具体实施方式
以下实施例进一步说明本发明的内容,但不应理解为对本发明的限制。在不背离本发明精神和实质的情况下,对本发明方法、步骤或条件所作的修改或替换,均属于本发明的范围。
若未特别指明,实施例中所用的技术手段为本领域技术人员所熟知的常规手段。
实施例1 乳酸菌的分离纯化
将收集的民间酵素产品在超净工作台中利用无菌生理盐水进行10倍梯度稀释,取适当稀释倍数的菌液1 mL并利用涂布棒均匀涂布于乳酸菌鉴别培养基上并置于37 ℃厌氧培养箱中恒温培养48-72 h。随后取出培养基于无菌环境下挑取直径为1-2 mm,表面光滑的单菌落,并利用划线的方法接种到新的乳酸菌鉴别培养基上,多次重复,直到分离纯化出纯菌落,此时初步鉴定菌种为乳酸菌,并对菌株进行编号。将筛选出的乳酸菌利用无菌生理盐水进行梯度稀释并利用MRS固体培养基于37 ℃恒温培养72 h观察其菌落形态特征和显微形态学特征(革兰氏染色)。
随后根据微生物菌落的大小、颜色、光泽、透明度,挑取呈乳白色,表面光滑的单一菌落,并利用划线的方法在MRS平板上划线纯化2-3次后,将菌株4 ℃冰箱保存。
实施例2 乳杆菌菌种鉴定
对纯化出的菌株的表型特征和16SrDNA 进行系统鉴定。
一、表型特征及表型观察:
分离得到的4株乳酸菌菌落形态特征如图1所示,由图1A可知,菌株的菌落形态均呈乳白色,边缘比较规则呈圆形,表面光滑,菌落直径大小在1.0-1.5 mm范围内,分别将其命名为84-M-Y-7,83-M-Y-6,57-M-H-7和102-M-H-8。将这4株乳酸菌进行革兰氏染色鉴定,并在100倍油镜下观察菌体特征。镜检结果表明,所有菌株均为革兰氏阳性菌株,其菌体形态呈杆状且排列方式多样。
二、16S rDNA序列分析
分离获得的乳酸菌接种到MRS液体培养基中活化24 h,取1 mL菌液于1.5 mL无菌离心管中,采用Plant Zol(全式金试剂盒)提取基因组,将提取的基因组DNA利用细菌通用引物27F(SEQ ID NO:1 5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R(SEQ ID NO:2 5′-CTACGGCTACCTTGTTACGA -3′)扩增细菌16SrDNA,扩增的模板采用30 μL体系进行扩增。PCR条件如下:94 ℃ 预变性5 min;94 ℃ 变性30 s,57 ℃ 退火30 s,72 ℃ 延伸1.5 min,25次循环;72 ℃ 延伸 7 min;3% 琼脂糖电泳检测,随后将扩增样品送北京睿博兴科生物技术有限公司测序。
登录 NCBI网站,将分离获得的4株乳酸菌16SrDNA测序结果与该网站数据库中相关信息进行BLAST同源性分析和比对,鉴定菌种并进行系统发育树构建,结果如图 2 所示。由图2可知,编号为84-M-Y-7的菌株为谷糠乳杆菌,编号为83-M-Y-6的菌株为哈尔滨乳杆菌,编号为57-M-H-7的菌株为副干酪乳杆菌,编号为102-M-H-8的菌株为布氏乳杆菌。
实施例3 谷糠乳杆菌(
选用新鲜的石斛,除去杂物,剔除烂叶,利用流动的清水将石斛清洗干净后,切段(约2-3 cm左右),烫漂(约10-20 s),榨汁,煮沸(约10-20 s),灌装至250 mL锥形瓶中。250mL锥形瓶采用121 ℃,灭菌15 min处理。
将活化好的4株乳酸菌于超净工作台中接种到事先灭好菌的MRS液体培养基中进行3-4次传代培养,当活菌数达到1×10
将4株乳酸菌种子液按照10%的接种量分别接种到石斛汁中进行发酵,发酵条件为:37 ℃恒温静置培养48 h,随后转置于4 ℃低温冷藏冰箱中后熟48 h。发酵后熟期间,每12 h测定一次pH值,总酸含量以及OD
基本指标测定包括:
pH值测定:利用pH计测定;
总酸含量测定:利用电位滴定法测定;
OD
数据采用Graph Pad Prism 7.0绘图软件进行处理和分析作图,用SPSS 11进行方差分析。
结果分析:不同菌株发酵石斛汁pH值、总酸含量以及OD
实验以OD
实施例4 谷糠乳杆菌(
(1)原料预处理:选择新鲜、无霉烂的葛根,以流动的清水多次重复清洗,除去表面污垢后,去皮,切成小块,利用沸水烫漂20-30s左右,备用。
(2)葛根原液的制备:将处理好的葛根按照质量份数为葛根1-6份,蜂蜜1-3份,纯净水8-18份,羧甲基纤维素钠0.03-0.09份榨汁,将榨好的葛根原液煮沸15-20s后冷却备用。
(3)发酵菌种的制备:将发酵所用的菌种谷糠乳杆菌(
(4)发酵后熟:在无菌环境下,将种子液按照6%的接种量接入葛根原液中,将其置于36 ℃的恒温培养箱中培养48 h后,将其置于4 ℃低温冷藏箱中进行后熟,后熟时长为48h。
(5)离心过滤:将葛根发酵液进行离心,离心条件为:4000r/min,10 min,取上清液过300目滤布,得发酵原液。
(6)调味灌装:将发酵原液按照质量份数葛根发酵原液3-9份,蜂蜜水(蜂蜜:水体积为1:1)1-4份,纯净水2-7份进行调味,无菌灌装于已灭菌的容器内,即得一种葛根发酵饮料。
实施例5 谷糠乳杆菌(
(1)原料预处理:选择新鲜、无霉烂的铁皮石斛,以流动的清水多次重复清洗,除去表面污垢后,切成长度为2-3 cm的小段,利用沸水烫漂20-30 s左右,备用。
(2)铁皮石斛原液的制备:将处理好的铁皮石斛按照质量份数为铁皮石斛1-3份,蜂蜜2-4份,纯净水10-20份,羧甲基纤维素钠0.02-0.05份榨汁,将榨好的铁皮石斛原液煮沸15-20s后冷却备用。
(3)发酵菌种的制备:将发酵所用的菌种谷糠乳杆菌(
(4)发酵后熟:在无菌环境下,将种子液按照10%的接种量接入铁皮石斛原液中,将其置于37 ℃的恒温培养箱中培养48 h后,将其置于4 ℃低温冷藏箱中进行后熟,后熟时长为36 h。
(5)离心过滤:将铁皮石斛发酵液进行离心,离心条件为:4000r/min,10 min,取上清液过300目滤布,得发酵原液。
(6)调味灌装:将发酵原液按照质量份数铁皮石斛发酵原液1-5份,蜂蜜水(蜂蜜:水体积为1:1)1-3份,纯净水2-8份进行调味,无菌灌装于已灭菌的容器内,即得一种铁皮石斛发酵饮料。
实施例6 谷糠乳杆菌(
(1)原料预处理:选择新鲜、无霉烂的生姜,以流动的清水多次重复清洗,除去表面污垢后,去皮,切成厚度为2-3 cm的生姜片,利用沸水烫漂20-30 s左右,备用。
(2)生姜原液的制备:将处理好的生姜按照质量份数为生姜2-6份,蜂蜜1-5份,纯净水6-18份,羧甲基纤维素钠0.02-0.08份榨汁,将榨好的生姜原液煮沸15-20 s后冷却备用。
(3)发酵菌种的制备:将发酵所用的菌种谷糠乳杆菌(
(4)发酵后熟:在无菌环境下,将种子液按照12%的接种量接入生姜原液中,将其置于36 ℃的恒温培养箱中培养36 h后,将其置于4 ℃低温冷藏箱中进行后熟,后熟时长为42h。
(5)离心过滤:将生姜发酵液进行离心,离心条件为:4000r/min,10 min,取上清液过300目滤布,得发酵原液。
(6)调味灌装:将发酵原液按照质量份数生姜发酵原液1-5份,蜂蜜水(蜂蜜:水体积为1:1)2-6份,纯净水1-8份进行调味,无菌灌装于已灭菌的容器内,即得一种生姜发酵饮料。
实施例7 谷糠乳杆菌(
(1)原料预处理:选择新鲜的山药,以流动的清水多次重复清洗,除去表面污垢后,去皮,切成厚度为2-3 cm的圆片,利用沸水烫漂20-30 s左右,备用。
(2)山药原液的制备:将处理好的山药按照质量份数为山药1-3份,蜂蜜1-6份,纯净水6-10份,羧甲基纤维素钠0.05-0.1份榨汁,将榨好的山药原液煮沸15-20 s后冷却备用。
(3)发酵菌种的制备:将发酵所用的菌种谷糠乳杆菌(
(4)发酵后熟:在无菌环境下,将种子液按照10%的接种量接入山药原液中,将其置于35 ℃的恒温培养箱中培养44 h后,将其置于4 ℃低温冷藏箱中进行后熟,后熟时长为36h。
(5)离心过滤:将发酵好的山药原液进行离心,离心条件为:4000r/min,10 min,取上清液过300目滤布,得发酵原液。
(6)调味灌装:将发酵原液按照质量份数山药发酵原液1-6份,纯净水2-6份进行调味,无菌灌装于已灭菌的容器内,即得一种山药发酵饮料。
实施例8 谷糠乳杆菌(
(1)原料预处理:选择新鲜的人参,以流动的清水多次重复清洗,除去表面污垢后,切成长度为2-3 cm的小段,利用沸水烫漂20-30s左右,备用。
(2)人参原液的制备:将处理好的人参按照质量份数为人参1-3份,蜂蜜0.5-2份,纯净水8-12份,羧甲基纤维素钠0.01-0.06份榨汁,将榨好的人参原液煮沸15-20 s后冷却备用。
(3)发酵菌种的制备:将发酵所用的菌种谷糠乳杆菌(
(4)发酵后熟:在无菌环境下,将种子液按照8%的接种量接入人参原液中,将其置于36℃的恒温培养箱中培养42 h后,将其置于4 ℃低温冷藏箱中进行后熟,后熟时长为48h。
(5)离心过滤:将发酵好的人参原液进行离心,离心条件为:4000r/min,10 min,取上清液过300目滤布,得发酵原液。
(6)调味灌装:将发酵原液按照质量份数人参发酵原液2-6份,蜂蜜水(蜂蜜:水体积为1:1)1-3份,纯净水3-7份进行调味,无菌灌装于已灭菌的容器内,即得一种人参发酵饮料。
实施例9 谷糠乳杆菌(
(1)原料预处理:选择无虫蛀、无霉烂新鲜的玛卡,以流动的清水多次重复清洗,除去表面污垢,利用沸水烫漂20-30s左右,将其切成厚度为2-3cm的玛卡片备用。
(2)玛卡原液的制备:将处理好的玛卡按照质量份数为玛卡1-5份,蜂蜜2-6份,纯净水10-18份,羧甲基纤维素钠0.04-0.1份榨汁,将榨好的玛卡原液煮沸15-20s后冷却备用。
(3)发酵菌种的制备:将发酵所用的菌种谷糠乳杆菌(
(4)发酵后熟:在无菌环境下,将种子液按照6%的接种量接入玛卡原液中,将其置于34 ℃的恒温培养箱中培养36 h后,将其置于4 ℃低温冷藏箱中进行后熟,后熟时长为42h。
(5)离心过滤:将发酵好的玛卡原液进行离心,离心条件为:4000r/min,10 min,取上清液过300目滤布,得发酵原液;
(6)调味灌装:将发酵原液按照质量份数玛卡发酵原液2-7份,蜂蜜水(蜂蜜:水体积为1:1)1-5份,纯净水4-10份进行调味,无菌灌装于已灭菌的容器内,即得一种玛卡发酵饮料。
实施例10 发酵饮料性能检测
按照上述方法制备六种发酵饮料并对其基本指标、抗氧化性以及贮藏稳定性进行测定,具体实验方法如下:
一、发酵饮料基本指标测定实验方法如下:
(1)测定指标:饮料pH值
测定方法:利用pH计直接测定
(2)测定指标:总酸含量
测定方法:按照GB12456-2018《食品中总酸的测定》中的电位滴定法测定。
(3)测定指标:活菌数
测定方法:梯度稀释平板计数法
(4)测定指标:饮料含水率
测定方法:按照GB5009.3-2010《食品中水分的测定》中的直接干燥法测定。
(6)测定指标:饮料脂肪含量
测定方法:按照GB5009.6-2016《食品中脂肪的测定》中的索氏抽提法测定。
(7)测定指标:饮料灰分含量
测定方法:按照GB5009.4-2010《食品中灰分的测定》中的直接灰化法测定。
(8)测定指标:饮料钠,钙含量
测定方法:按照GB5009.92-2016《食品中钙的测定》以及GB5009.91-2017《食品中钾、钠的测定》中火焰原子吸收光谱法测定。
(9)测定指标:饮料大肠菌群测定
测定方法:按照GB4789.3-2016《食品微生物学检验 大肠菌群计数》中的MPN法测定
(10)测定指标:饮料致病菌群测定
由于食品中最常含有的致病菌为沙门氏菌,因此,实验选择沙门氏菌作为致病菌进行检测。
测定方法:按照GB4789.3-2016《食品微生物学检验 沙门氏菌检验》测定。
二、针对六种发酵饮料抗氧化性进行测定,具体测定方法如下:
(1)清除ABTS自由基能力测定
分别吸取以纯净水稀释至体积分数为100%、50%、25%、12.5%、6.25%、3.125%、1.5625%的发酵饮料0.1 mL,加入3.5 mL ABTS稀释液,作为样品组。对照组为同样体积分数的发酵饮料0.1 mL,加入3.5 mL 10 mM pH7.4的PBS 溶液,空白组为0.1 mL的纯净水,加入3.5 mL ABTS稀释液。将上述三组样品,摇匀并置暗处反应6 min,于714nm处测吸光值。未发酵原液以同样的方法进行试验。所有试验,重复三次,取平均值,根据公式进行计算。
ABTS自由基清除率/%= [1- (Ai-Aj) /AO]×100
式中:Ai为各体积分数样品与ABTS稀释液混合液的吸光度,Aj为各体积分数样品与10 mM pH7.4的PBS混合液的吸光度,AO为纯净水与ABTS溶液混合液的吸光度。
(2)清除羟自由基能力测定
分别吸取以纯净水稀释至体积分数为100%、50%、25%、12.5%、6.25%、3.125%、1.5625%的发酵饮料1 mL,加入0.75 mmol/L的邻二氮菲溶液1 mL,0.1 mol/ L pH7.4的PBS溶液 2 mL,0.75 mmol/L的硫酸亚铁1 mL。充分混匀后,加入0.01%的过氧化氢溶液1 mL作为样品组。对照组用1 mL纯净水代替1 mL过氧化氢,空白组用1 mL纯净水代替1 mL样品,将上述三组样品,置于37 ℃水浴锅中,水浴60 min,于536 nm处测吸光值。未发酵原液以同样的方法进行试验。所有试验,重复三次,取平均值,根据公式进行计算。
羟自由基清除率/%= (AS-AP)/(AB-AP)
式中:AS为各体积分数的样品与邻二氮菲等试剂混合液的吸光度,AB为对照组的吸光度,AP为空白组的吸光度。
三、还原力的测定
分别吸取以纯净水稀释至体积分数为100%、50%、25%、12.5%、6.25%、3.125%、1.5625%的发酵饮料1 mL,加入0.2 mol/LpH 6.6的PBS溶液2.5 mL和1%铁氰化钾溶液2.5mL,50 ℃水浴反应20 min后,加入10%的TCA溶液 2.5 mL和0.1%的三氯化铁0.5 mL。暗处反应半小时后,以2000 r/min 离心5 min,取上清液于700 nm下测吸光值。未发酵原液以同样的方法进行试验。所有试验,重复三次,取平均值。
四、发酵饮料贮藏稳定性
具体测定方法如下:
将根据上述方法制作的发酵饮料置于4 ℃下放置60天,每隔7天测定饮料的pH值、总酸含量、活菌数,同时辅以感官评定来测定发酵饮料的贮藏稳定性。pH值、总酸含量、活菌数的测定方法同上述发酵饮料基本指标测定,感官评定则由多位本专业老师根据感官评定表进行品尝鉴定并打分,感官评定表如下:
实施例11 发酵饮料基本指标测定结果
按照上述测定方法,六种发酵饮料基本指标测定结果如下表所示:
实施例12发酵饮料抗氧化性测定结果
将发酵饮料与未发酵原液对ABTS自由基以及羟自由基的清除效果,二者的还原力进行比较,结果见图4、5。
ABTS自由基是2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐与过二硫酸钾反应生成的绿色自由基,该自由基在714nm处有最大吸收。在样品中加入ABTS自由基溶液后,如果714nm处的吸光度降低,则说明该物质具有自由基清除活性,通过比较样品对ABTS自由基的清除效果,可以评价其抗氧化能力。由图4可知,随着体积分数的不断增加,发酵饮料与未发酵原液对ABTS自由基的清除率也在逐步增加且不同体积分数的发酵饮料对ABTS自由基的清除率均高于未发酵原液。
图5为发酵饮料与未发酵原液对羟自由基清除效果的比较。羟自由基(—OH)是一种重要的活性氧,具有极强的得电子能力即氧化能力。实验采用邻二氮菲-Fe
还原力测定即抗氧化剂通过自身的还原作用,给出电子而清除自由基,还原力越强,抗氧化性越强。发酵饮料与未发酵原液在700 nm下测定的吸光度值如图6所示,吸光度值越大,表明样品的还原力越强。根据实验结果可知,随着样品体积分数的增加,还原力也在逐渐提高,且发酵饮料的还原力明显优于未发酵原液。综上所述,利用谷糠乳杆菌(
实施例13 发酵饮料贮藏稳定性测定结果
六种发酵饮料在4℃下贮藏63天,其pH值、总酸含量、活菌数、感官评定结果如图7-10所示。由图7-10可知,随着贮藏时间的延长,发酵饮料的pH值、总酸含量、活菌数并未发生明显变化。根据感官评定结果可知,发酵饮料冷藏保存两个月左右,仍具有较好的口感,与市场上同类型发酵产品相比,具有较长的货架期。
以上所述,仅是本发明的较佳实施例而已,并非是对本发明做其它形式的限制,任何本领域技术人员可以利用上述公开的技术内容加以变更或改型为等同变化的等效实施例。但是凡是未脱离本发明技术方案内容,依据本发明的技术实质对以上实施例所作的任何简单修改、等同变化与改型,仍属于本发明技术方案的保护范围。
序列表
<110> 中国农业科学院农产品加工研究所
<120> 一株发酵用的谷糠乳杆菌及其发酵制备工艺
<130> S010210713032Y
<160> 3
<170> SIPOSequenceListing 1.0
<210> 1
<211> 20
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 1
agagtttgat cctggctcag 20
<210> 2
<211> 20
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 2
ctacggctac cttgttacga 20
<210> 3
<211> 434
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 3
tggacgaagt ctgatggagc aacgccgcgt gagtgatgaa gggtttcggc tcgtaaaact 60
ctgttgttgg agaagaacag gtgatagagt aactgttatc atcttgacgg tatccaacca 120
gaaagccacg gctaactacg tgccagcagc cgcggtaata cgtaggtggc aagcgttgtc 180
cggatttatt gggcgtaaag cgagcgcagg cggtttttta ggtctgatgt gaaagccttc 240
ggcttaaccg gagaagggca tcggaaaccg ggagacttga gtgcagaaga ggacagtgga 300
actccatgtg tagcggtgaa atgcgtagat atatggaaga acaccagtgg cgaaggcggc 360
tgtctggtct gtaactgacg ctgaggctcg aaagcatggg tagcgaacag gattagaaac 420
cccgggtagt ccaa 434
- 一株发酵用的谷糠乳杆菌及其发酵制备工艺
- 一株发酵用的谷糠乳杆菌及其应用
