微流体装置
文献发布时间:2023-06-19 12:24:27
相关申请的交叉引用
本申请要求于2019年1月23日提交的澳大利亚专利申请第2019900210号的权益,该澳大利亚专利申请的全部内容通过引用并入本文。
技术领域
本发明涉及一种用于染色体分离的微流体装置。
背景技术
许多真核生物(包括动物和植物物种)的细胞都包含多于一组染色体,其中组数称为倍性。例如,人类是二倍体,拥有形成基因组的成对染色体组(母体拷贝和父体拷贝)。在特定染色体的每个位置或基因座处,个体可能具有相同序列的两个拷贝(诸如基因等位基因、突变、标记或表观遗传成分),或具有不同序列的两个拷贝,即,成对染色体的每个上都具有一个版本。对来自不同基因座的序列元件(诸如基因等位基因、突变、标记或表观遗传成分)是一起出现在染色体对的同一成员(顺式排列)上还是染色体对的相对成员(反式排列)上的确定被称为定相。当两个或更多个序列(等位基因、突变、标记或表观遗传)以顺式出现时,这被称为单倍型。这些单倍型序列的变化会导致功能差异,诸如在基因表达、蛋白质功能和疾病方面的差异。因此,了解个体的定相或单倍型可以带来对生物学途径的理解和控制(诸如改进的诊断方法和/或治疗方法)。不幸的是,现有的定相和单倍型确定方法存在许多缺点。
在Quake等人的综述文章中(自然方法(Nature Methods),2014年,第11卷,第1期,第19-21页)中,Quake指出,尽管基因组“分析已经从确定用于“平均的”人类基因组的参考序列发展到对个人基因组进行卓有成效的(prolific)测序”,但基因组分析的一些方面仍然很困难。特别是,Quake继续指出,现有的传统技术不太适合于单倍型确定。
另一种技术是Fan等人采用的方法(Nat.Biotechnol.,2011年1月,29(1):51-57)。Fan等人指出,当前技术(诸如mate-pair鸟枪基因组测序、各种形式的聚合酶链反应(PCR)、具有碳纳米管的原子力显微镜、fosmid/粘粒克隆和杂交探针的使用)都具有许多显著的缺点,这些缺点阻碍了广泛采用。替代地,Fan等人报告开发了一种微流体装置,所述微流体装置用于将来自单个人类中期细胞的每个染色体的同源拷贝进行分离和扩增。Fan等人的装置被划分为按其功能而不同的五个区域。第一区域包括使用光学显微镜来识别单个中期细胞。一旦已经识别了中期细胞,就会致动一系列周围的阀来捕获细胞,使得可将细胞引入到装置的第二区域中。在第二区域中,中期细胞与胃蛋白酶接触以消化细胞的细胞质并形成染色体悬浮液。然后该悬浮液被转移入第三区域中,其中通过致动装置内的一系列阀该悬浮液被分配到48个腔室中。在第四区域中,48个腔室中的每个腔室的内容物然后均通过一系列不同的通道经由用胰蛋白酶、碱处理和随后的中和在装置上进行个体扩增,以用于多链置换扩增。该装置的第五区域包括用于收集每个扩增染色体的单独出口端口。
值得注意的是,尽本发明人所知,Fan等人公开的装置尚未被采用。本发明人已试图复制Fan等人报告的方案,但没有成功。本发明人推测Fan等人的装置和方法缺乏可重复性,这已妨碍了被采用。在这方面,
由于在分离染色体以进行直接定相方面的技术上存在缺陷,因此目前推断定相或单倍型的大多数尝试(例如,为了将骨髓移植患者与潜在供体相匹配)都使用间接的推理或假设方法,诸如家族病史研究(family segregation studies,家族隔离研究)、连锁不平衡或从已测序的DNA片段中产生定相概率的算法。
在中期状态,染色体构成紧密折叠的DNA和蛋白质的离散束。这样的染色体可以彼此形成关联并且以染色体簇的形式存在。
鉴于上述情况,需要开发用于分拣和分离染色体以实现直接定相和单倍型确定的装置和/或方法。然而,现有技术的方法存在显著的缺点。因此,本发明的目的是解决和/或改善现有技术的一个或多个缺点。
说明书中对任何现有技术的引用并非承认或暗示以下情况:该现有技术在任何司法管辖区构成公知常识的一部分,或者该现有技术能由本领域技术人员合理地理解、视为与其他现有技术相关、和/或相结合。
发明内容
在本发明的第一方面中,提供了一种微流体装置,用于分离包含中期染色体的流体中的中期染色体,所述微流体装置包括:
流动通道,包括:
入口,用于接收包括中期染色体的流体;
出口,用于离散地分配单独的中期染色体;
一系列扩展区域;以及
一个或多个收缩部,位于所述一系列扩展区域中的连续扩展区域之间;
其中,收缩部能可操作地施加足够的剪切应力来将中期染色体彼此分离;
并且
扩展区域能可操作地将染色体彼此分散。
在本发明的另一方面中,提供了一种微流体装置,用于分离流体内的成簇中期染色体,所述微流体装置包括:
流动通道,包括:
入口,用于接收流体;
出口,用于分配分离的中期染色体;
一个或多个扩展区域;以及
一个或多个收缩部,具有位于收缩区域下游的至少一个扩展区域;
其中,收缩部能可操作地施加足够的剪切应力来分离成簇中期染色体;
并且
其中,扩展区域能可操作地分散分离的中期染色体。
“可操作地”是指微流体装置在流动和/或压力条件下操作,使得染色体在收缩部中经受相对高的剪切应力和/或在扩展区域中经受相对低的流速(相对于流动通道的非扩展区域中的流速)。例如,所述装置可以在恒定压力下操作,其中在收缩部和扩展部中流速的变化导致相应的剪切应力和分散;或者可以在可变压力下操作,使得当染色体流过收缩部时,施加压力脉冲以使染色体经受剪切应力,而当染色体流过扩展区域时,速度降低允许染色体分散。
在本发明的一种形式中,中期染色体为一个或多个中期染色体簇的形式,并且微流体装置用于将一个或多个中期染色体簇分离成单独的中期染色体。在这种情况下,收缩部能可操作地对一个或多个中期染色体簇施加足够的剪切应力,以从该簇中分离中期染色体或将该簇断裂成更小的簇;并且扩展区域能可操作地将分离的中期染色体和/或一个或多个中期染色体簇彼此分散。
“簇”或“成簇”是指中期染色体的分组或聚集,其中,中期染色体“粘连”或彼此密切相关联。这种聚簇可能是许多物理化学相互作用的结果,例如,当染色体可能直接地(通过蛋白质或DNA相互作用)或由于诸如细胞质基质等物质的存在而彼此形成关联时,可能会发生聚簇。因此,流体中的染色体,特别是当与其他细胞内容物相关联时,可能会粘连在一起或聚簇在一起。
在本发明的一种形式中,扩展区域能可操作地将分离的中期染色体彼此分散。
如将理解的,从装置的出口分配的中期染色体的大部分(或优选地全部)是离散分配的单独的中期染色体。
在本发明的一种形式中,含中期染色体的流体是来自包含在流体制剂中的一个或多个中期细胞的裂解物或裂解物组分。
如本文所使用的,“流体”可以包括溶解的物质。例如,流体可以包括缓冲液(诸如裂解缓冲液和/或分离缓冲液)的溶解组分。
在本发明的另一方面中,提供了一种微流体装置,用于分离包含中期染色体的流体中的中期染色体,所述微流体装置包括:
流动通道,具有大约10μm至大约30μm的宽度,所述流动通道包括:
入口;
出口;以及
一系列扩展区域和位于所述一系列扩展区域中的连续扩展区域之间的一个或多个收缩部;
其中,多个扩展区域具有大约50μm至大约150μm的通道宽度,并且多个收缩部中的每个收缩部均具有大约1μm至大约3μm的最小宽度。
每个收缩部的最小宽度的尺寸用于阻止染色体的通过,需要足够的压力使染色体经受剪切应力以驱动中期染色体通过收缩部并使中期染色体彼此分离。
扩展区域的尺寸用于经由扩散和平流中的一种或多种沿横向方向和轴向方向二者分散分离的中期染色体,这有助于在染色体离开扩展部分时增加染色体之间的间距。扩展区域可以采用任何合适的尺寸和形状。
在本发明的一种形式中,中期染色体为一个或多个染色体簇的形式,并且微流体装置用于将一个或多个中期簇分离成单独的中期染色体。
在本发明的上述方面的一个实施方案中,流动通道(可选地,除了扩展区域和/或收缩部和/或流动通道的紧邻收缩部的区域之外)具有大约5μm至大约40μm的深度。优选地,流动通道深度为大约12μm。更优选地,流动通道深度为大约14μm。甚至更优选地,流动通道深度为大约16μm。最优选地,流动通道深度为大约18μm。替代地或附加地,流动通道深度达35μm。更优选地,流动通道深度达大约30μm。最优选地,流动通道深度达大约25μm。在一个非限制性示例中,流动通道深度为20μm±2μm。
在一个实施方案中,收缩部的深度小于流动通道的深度。优选地,收缩部的深度比流动通道的深度小大约5μm至大约15μm。优选地,收缩部的深度可以为大约5μm至大约15μm。收缩部相对于流动通道的较小深度有助于增加染色体在收缩部中经受的剪切。
在上述实施方案的一种形式中,在流动通道的整体深度(bulk depth)与收缩部深度之间存在深度的阶梯变化。优选地,深度的阶梯变化为大约5μm至大约15μm,例如,当流动通道具有10μm或更大的整体深度时,收缩部深度为大约5μm。还优选地,流动通道的紧邻收缩部的区域具有与收缩部相同的深度,使得深度的阶梯变化位于流动通道内。
在上述实施方案的一种形式中,流动通道(除了扩展区域和/或收缩部和/或流动通道的紧邻收缩部的区域之外)的深度沿着流动通道的长度是恒定的。即,流动通道的深度沿着流动通道的长度基本上不变化,诸如在±2μm内。
在本发明的上述方面的一个实施方案中,流动通道(除了扩展区域和收缩部以外)具有大约10μm至大约30μm的宽度。优选地,流动通道宽度为大约12μm。更优选地,流动通道宽度为大约14μm。最优选地,流动通道宽度为大约16μm。替代地或附加地,流动通道宽度达28μm。更优选地,流动通道宽度达大约26μm。最优选地,流动通道宽度达大约24μm。在一个非限制性示例中,流动通道宽度为20μm±2μm。
如将理解的,流动通道的几何形状被选择为适合于特定应用。例如,流动通道的宽度可以大于流动通道的深度,或反之亦然。
在本发明的上述方面的一个实施方案中,流动通道的长度为大约2mm至大约15mm。优选地,流动通道长度为大约3mm。最优选地,流动通道长度为大约4mm。替代地或附加地,流动通道长度达12mm。更优选地,流动通道长度达大约10mm。最优选地,流动通道长度达大约8mm。在一个非限制性示例中,流动通道长度为约5mm。
在一个实施方案中,一个或多个收缩部或每个收缩部的最小宽度为大约1.00μm至大约3.00μm。优选地,最小宽度为大约1.25μm。更优选地,最小宽度为大约1.50μm。最优选地,最小宽度为大约1.75μm。替代地或附加地,最小宽度达大约2.75μm。更优选地,最小宽度达大约2.50μm。最优选地,最小宽度达大约2.25μm。在一非限制性示例中,最小宽度为2.00μm±0.20μm。
在一个实施方案中,收缩部的最小宽度部分的长度为大约4μm至大约16μm。优选地,长度为大约6μm。最优选地,长度为大约8μm。替代地或附加地,优选地长度达大约14μm。最优选地,达大约12μm。在一个非限制性示例中,长度为大约10μm。
在一个实施方案中,从入口到出口,每个后续收缩部都具有比在前收缩部更小的最小宽度和/或深度。在一个实施方案中,后续收缩部中的至少一些具有相同的最小宽度和/或深度。
在一个实施方案中,所述一个或多个收缩部中的一个或多个具有变宽锥形出口。优选地,变宽锥形出口扩宽至大约为流动通道的宽度的三分之二或更小的宽度。优选地,变宽锥形出口扩宽至流动通道的宽度的一半或更小的宽度。
在一个实施方案中,扩展区域具有大约50μm至大约150μm的宽度。优选地,扩展区域的宽度为大约60μm。更优选地,扩展区域的宽度为大约70μm。最优选地,扩展区域的宽度为大约80μm。替代地或附加地,扩展区域的宽度达140μm。更优选地,扩展区域的宽度达大约130μm。最优选地,扩展区域的宽度达大约120μm。在一个非限制性示例中,扩展区域的宽度为大约100μm。
在一个实施方案中,扩展区域的长度为大约0.2mm至大约0.8mm。优选地,长度为大约0.3mm。最优选地,长度为大约0.4mm。替代地或附加地,优选地长度达大约0.7mm。最优选地,达大约0.6mm。在一个非限制性示例中,长度为大约5mm。
在一个实施方案中,所述一系列扩展区域中的每个扩展区域都具有基本上相同的宽度。
在一个实施方案中,流动通道在所述一系列扩展区域中包括至少3个扩展区域。优选地,至少4个扩展区域。最优选地,至少5个扩展区域。替代地或附加地,流动通道包括达20个扩展区域。在优选形式中,流动通道包括扩展区域的数量选自:5、6、7、8、9、10、11、12、13、14、15、16、17、18或19个。
在一个实施方案中,流动通道在所述一系列扩展区域中的每个扩展区域之间包括一个或多个收缩部。
在一个实施方案中,流动通道的入口具有2μm至3μm的宽度。优选地,收缩部具有比入口窄的宽度。
在一个实施方案中,流动通道的出口的宽度为大约1μm至2μm。
在一个实施方案中,所述微流体装置还包括位于入口上游的细胞捕获和裂解结构,所述细胞捕获和裂解结构包括:
细胞捕集器,邻近于流动通道入口,被配置为接收和保留来自包含细胞的流体样本的细胞,所述细胞捕集器包括:
观察窗,允许检查细胞;
开口,连接到流动通道入口,开口的大小制成为阻止细胞从中穿过;
裂解端口,被配置为将裂解缓冲液引入细胞捕集器。
在一个实施方案中,开口和通路的大小为大约2μm至大约3μm。
在一个实施方案中,细胞捕集器是所述微流体装置中的矩形棱柱状中空结构,具有开放面以允许细胞进入细胞捕集器中。
优选地,细胞捕集器开口位于与开放面相对的面中。
优选地,细胞捕集器的深度与流动通道的深度基本上相同。更优选地,细胞捕集器具有与深度相同的宽度和长度尺寸。优选的尺寸为20μm×20μm×20μm(±5μm)。
细胞捕集器可以包括阀和/或泵,以将连接到流动通道入口的开口与流动通道入口和/或允许细胞进入细胞捕集器中的开口隔离。
在一个实施方案中,所述微流体装置还包括位于出口下游的染色体分配结构,所述染色体分配结构包括:
分配通道,限定在通道入口与通道出口之间,并且具有用于从流动通道的出口接收单独的染色体的端口;
其中,通道出口连接到分配管,所述分配管被配置为以包含单个染色体的流体液滴的形式从微流体装置分配单个染色体。在一个实施方案中,分配通道具有与流动通道的深度相同的深度。
在一个实施方案中,分配结构还包括在一系列扩展部分下游的染色体保持区域,染色体保持部分包括扩展区域,所述扩展区域用于保持其内的一个或多个染色体不向下游移动,而上游中期染色体仍行进穿过流动通道。
在一个实施方案中,微流体装置还包括检测区,所述检测区包括用于检测中期染色体存在的装置或与这样的装置相关联。在一个实施方案中,所述装置可以检测单独的中期染色体的存在。所述装置可以是例如光电检测器。适合检测的输出包括荧光。
在检测区中,可以在流动通道的出口的下游检测单独的中期染色体,在该下游处所述中期染色体被离散地分配并沉积在载玻片或孔板上用于进一步分析。
在本发明的另一方面中,提供了一种用于在包含中期染色体的流体中分离中期染色体的方法,所述方法包括:
使包含中期染色体的流体在压力下穿过本发明的一个或多个方面中如上述限定的微流体装置,从而收缩部使中期染色体经受足够的剪切应力以使中期染色体彼此分离。
在本发明的该方面的一个实施方案中,所述方法还包括从出口离散地分配染色体。
在本发明的该方面的一种形式中,中期染色体为一个或多个中期染色体簇的形式,其中,收缩部使所述一个或多个中期染色体簇经受足够的剪切应力,以将一个或多个中期染色体簇分离成单独的中期染色体;并且其中,单独的中期染色体从出口离散地分配。
在本发明的该方面的一种形式中,压力是脉冲压力。脉冲压力可以沿着流动通道在向前方向和向后方向二者上交替地施加,其中,施加的总压力平衡使得中期染色体逐渐地(incrementally)移向出口。替代地,压力可以是恒定压力。
在本发明的另一方面中,提供了一种用于分离包含染色体的流体中的中期染色体的方法,所述方法包括:
使包括中期染色体的包含染色体的流体穿过微流体装置,所述微流体装置具有流动通道,所述流动通道包括:
多个扩展区域,位于入口与出口之间;以及
一个或多个收缩部,位于扩展区域中的一个或多个之间;
使一个或多个收缩部处或者中的中期染色体经受足够的剪切应力以将中期染色体彼此分离;以及
使多个扩展区域中的分离的中期染色体彼此分散。
在本发明的该方面的一个实施方案中,所述方法还包括使分离的中期染色体从微流体装置离散地排出。
在本发明的该方面的一种形式中,中期染色体为一个或多个中期染色体簇的形式,并且其中,收缩部使所述一个或多个中期染色体簇经受足够的剪切应力,以将一个或多个染色体簇分离成单独的染色体。
在本发明的另一方面中,提供了一种用于利用微流体装置分离包含染色体的流体中的中期染色体的方法,所述方法包括:
使流体穿过微流体装置的流动通道,所述流动通道具有多个交替的收缩部和扩展部;
其中,当流体穿过收缩部时,所述方法包括施加压力脉冲以使中期染色体经受足以使中期染色体彼此分离的剪切应力;
其中,当流体穿过扩展部时,微流体装置在压力下操作以将分离的染色体彼此分散。
在本发明的该方面的一个实施方案中,所述方法还包括使分离的染色体从微流体装置离散地排出。
在本发明的该方面的一种形式中,中期染色体为一个或多个中期染色体簇的形式,并且其中,当流体穿过收缩部时,压力脉冲使所述一个或多个中期染色体簇经受足以从所述一个或多个中期染色体簇中分离出中期染色体的剪切应力。
根据本发明的上述各个方面,剪切应力为至少大约0.02N/m
根据本发明的上述各个方面,压力优选地横跨流动通道施加。横跨流动通道施加的压力为大约0毫巴至大约10,000毫巴,或介于两者之间的任何值。优选地,施加的压力为大约2毫巴至大约7,000毫巴、大约30毫巴至大约5,000毫巴、大约50毫巴至大约2,500毫巴、大约100毫巴至大约1,000毫巴、大约250毫巴至大约1,000毫巴、大约300毫巴至大约1,000毫巴、或大约400毫巴至大约700毫巴。优选地,施加的压力大于大约0毫巴、大约2毫巴、大约30毫巴、大约50毫巴、大约100毫巴、大约250毫巴、大约300毫巴、大约400毫巴、大约700毫巴、大约1,000毫巴、大约2,500毫巴、大约5,000毫巴、或大约7,000毫巴。优选地,施加的压力小于大约2毫巴、大约30毫巴、大约50毫巴、大约100毫巴、大约250毫巴、大约300毫巴、大约400毫巴、大约700毫巴、大约1,000毫巴、大约2,500毫巴、大约5,000毫巴、大约7,000毫巴、或大约10,000毫巴。
根据本发明的上述各个方面,所述方法可以包括:
在微流体装置的细胞捕集器中捕集中期细胞;以及
将裂解缓冲液引入中期细胞,并施加压力脉冲以在足够的剪切应力下将中期细胞从细胞捕集器驱动进入流动通道中,以在包含染色体的流体中裂解细胞并提供中期染色体。
根据本发明的上述各个方面,所述方法还可以包括:
从流动通道的出口接收分配的单独的染色体进入微流体装置的分配通道中;
将单独的染色体运送到分配管中;以及
以包括单个染色体的流体液滴的形式经由分配管从微流体装置分配单个染色体。
优选地,流体液滴的体积为大约100nL至大约500nL。更优选,大约100nL至大约400nL。甚至更优选地,100nL至大约300nL。
在上述一个或多个方面及其实施方案中,包含染色体的流体包括裂解缓冲液,使得所述方法是用于中期染色体的化学辅助剪切分离的方法。
如将理解的,裂解缓冲液是有助于细胞裂解的缓冲液。分离缓冲液是有助于染色体分离的缓冲液。裂解缓冲液可以包括分离缓冲液,且反之亦然。
在上述一个或多个方面及其实施方案中,引入裂解缓冲液使得细胞通过裂解缓冲液的化学作用或者化学和物理作用的组合被裂解。包含在裂解缓冲液中或在裂解缓冲液之后并入,分离缓冲液在包含染色体的流体中的中期染色体被引入流动通道的入口之前或同时被引入。
在上述本发明的一个或多个方面及其实施方案中,在将细胞引入装置的入口中之前,可以添加染色体特异性标记和/或DNA染色剂。在上述本发明的一个或多个方面及其实施方案中,在将细胞引入装置的入口中之前,可以固定和透化(permeabilised)中期细胞以促进染色体特异性标记和/或DNA染色剂的杂交(hybridisation)。
本发明的其他方面和前述段落中描述的方面的其他实施方案将从以下通过示例给出并参考附图的描述中变得显而易见。
附图说明
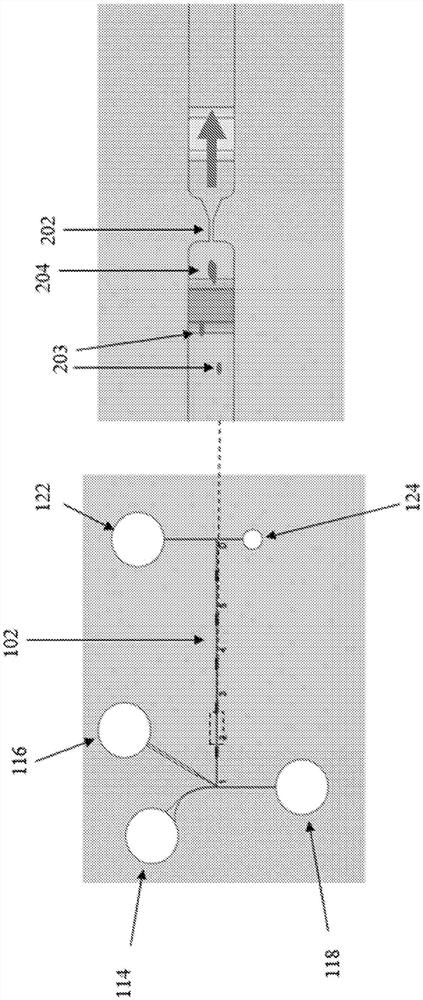
图1:根据本发明的一个实施方案的微流体装置的示意图。
图2:微流体装置的示意图,示出了收缩部。
图3:微流体装置的示意图,示出了采样端口,细胞通过该采样端口被引入微流体装置中。
图4:微流体装置的示意图,示出了上游细胞捕获和裂解结构。
图5:微流体装置的示意图,示出了细胞的化学辅助剪切裂解,并在压力脉冲下从细胞捕集器转移到流动通道中。
图6:微流体装置的示意图,示出了流动通道和扩展区域。
图7:微流体装置的示意图,示出了流动通道出口和染色体检测。
图8:微流体装置的示意图,示出了用于单个染色体分配的下游染色体隔离。
图9:示出了将包含单个染色体的液滴从微流体装置分配到孔板(well plate)上的示意图。
图10:示出了微流体装置的泵布置的示意图。
图11:示出了微流体装置的流动通道内的收缩部的细节的特写图。
参考文献
Quake等人(自然方法(Nature Methods),第11卷,第1期,2014年,第19-21页)
Fan等人(Nat.Biotechnol.,2011年1月,29(1):51-57)
具体实施方式
本发明涉及用于将中期染色体彼此分离的微流体装置和方法。
在一个优选的形式中,微流体装置被配置为捕集并裂解单个中期细胞,使排出的染色体悬浮成单个化的染色体(singulated chromosomes),检测每个单个化的染色体,然后将每个染色体从微流体装置分配到容器(诸如载玻片或孔板)上用于后处理。
广义上讲,将细胞引入微流体装置中,在微流体装置中(诸如经由光学显微镜)对细胞进行分析以确定细胞是否为中期细胞。如果细胞是中期细胞,则它会被捕集,然后将裂解缓冲液引入微流体装置中,伴随着高压脉冲以驱动细胞及其内容物从细胞捕集器通过通道限制部进入微流体装置的流动通道中,同时当细胞穿过通道限制部时,经由在细胞膜上剪切来裂解细胞。然后,通常处于一个或多个簇形式的染色体进入微流体流动通道中。在微流体流动通道中,一个或多个染色体簇穿过交替的系列收缩部和扩展部。
收缩部对所述一个或多个染色体簇流过流动通道提供了阻碍。压力脉冲驱动所述一个或多个染色体簇通过收缩部,同时还向所述一个或多个染色体簇施加显著的剪切应力以将一个或多个簇分裂。
在扩展部中,染色体经受较低的流速和变化的流动曲线,这允许染色体分散并彼此分离。扩展部还为裂解缓冲液提供了与单独的染色体混合以便稳定那些染色体以及与一个或多个染色体簇混合以在随后的收缩部中化学地辅助染色体的剪切分离的机会。
所述一个或多个染色体簇经历多个交替的收缩部和扩展部,直到所述一个或多个染色体簇已被分解成分离的和单独的染色体为止。这些单独的染色体在流动通道的出口处被检测,在出口处它们被离散地分配并被沉积在载玻片或孔板上以用于进一步分析。
以这种方式,本发明的装置和方法提供了用于分离单独的染色体以用于随后的单倍型确定的机构。
下面描述本发明的实施方案。
图1是用于从染色体悬浮液中分离和分配单个染色体的微流体装置100的示意图。在该实施方案中,微流体装置100以晶片工具作业上的聚二甲基硅氧烷(PDMS)铸件的形式形成。本领域技术人员将理解,可以使用多种不同的材料。PDMS铸件用玻璃盖玻片盖住。同样,可以使用不同的材料。然而,选择玻璃作为覆盖材料归因于其光学性质(例如,光学透明度和无自发荧光)容易允许观察微流体装置100的部件及其经由等离子体激活而与PDMS结合的能力。
微流体装置100包括具有入口104和出口106的微流体流动通道102。在该实施方案中,流动通道102具有5mm的长度。然而,可以使用不同的长度,诸如从3mm至15mm。流动通道102被划分成五个区(在图1中标记为1至5)。这些区中的每个都包括第一流动通道部分108和代表扩展部分110的第二流动通道部分。第一流动通道部分108在横向于流动方向上具有的横截面积小于扩展部分110的横截面积。在该特定情况下,流动通道102具有20μm的深度,第一通道部分108具有20μm的宽度(例如,400μm
第一流动通道部分108中的每个均包括收缩部202(参见图2和图11,展开图)。将理解的是,第一流动通道部分108中的每个均可以包括多个收缩部202。在该实施方案中,收缩部202具有大约1μm至大约2μm的宽度。此外,从入口104到出口106的每个后续第一流动通道部分108中的收缩部202的宽度小于在前第一流动通道部分108中的收缩部202的宽度。
图11示出了流动通道部分1102与1104之间的收缩部1100的实施方案。收缩部1100具有变宽锥形出口1106,其逐渐变细至约为流动通道宽度的一半的宽度。在图11中,收缩部的深度小于流动通道部分1102和1104的深度。在该特定实施方案中,收缩部具有大约5μm的深度,而流动通道部分1102和1104具有大约20μm的整体深度。流动通道的紧邻收缩部1100的区域(标记为项1108和1110)具有与收缩部相同的深度(例如,大约5μm),使得在流动通道内从收缩部1100的深度(例如,大约5μm)到流动通道的整体深度(例如,大约20μm)存在深度的阶梯变化。
现在将简要描述流动通道102的部件的操作。在操作期间,包含一个或多个染色体簇的流体在压力下经由入口104被引入流动通道102中。流体流过区1的第一流动通道部分108,在那里流体穿过收缩部202。收缩部202阻止所述一个或多个染色体簇从其穿过。单个中期染色体的近似大小为大约0.5μm至大约3μm;而染色体簇的大小可以在略大于单个中期染色体的大小到略小于中期细胞的大小(约10μm–15μm)的范围内。在任何情况下,由于提供了狭窄的流动面积,因此流体在收缩部中经受了相比于在流动通道102中增加的流速,并且这种增加的流速迫使一个或多个染色体簇通过限制部,同时取决于收缩部的尺寸、施加的压力(其进而影响速度)和流体性质,使所述一个或多个染色体簇在壁处经受显著剪切应力(诸如大约0.02N/m
在区2中,单个染色体203和/或更小的染色体簇204经受类似的过程,因为它们穿过具有收缩部202的第一流动通道部分108。然而,在这种情况下,区2中的收缩部202比区1中的收缩部202窄。这样做的原因是阻止更小的染色体簇的通过,并提供更高的流速以使更小的染色体簇经受更高的剪切应力,以进一步分裂染色体簇和/或将单个染色体从染色体簇分离。再次,在穿过该收缩部之后,染色体类似地在区2的第一流动通道部分108中出现,之后进入区2的扩展区域110中以进一步分散。
通过区3、4和5重复上述过程,其中这些区的第一流动部分110中的每个收缩部202的宽度均减小,以阻止更小的染色体簇204的通过并使所述更小的染色体簇分裂;并且这些区的每个扩展区域110都进一步彼此分散单个染色体203和/或染色体簇204。
在穿过流动通道102的每个区之后,染色体然后作为彼此轴向间隔开的单个染色体穿过流动通道的出口106。由于单个染色体轴向间隔开,因此可以将单个染色体彼此隔离以用于下游目的。
在图1中描绘的实施方案中,微流体装置100包括位于流动通道102上游的细胞捕获和裂解结构112。细胞捕获和裂解结构112包括:样本端口114,用于引入包含细胞的流体;细胞捕集器402(参见图4,展开图),用于捕集细胞以允许进行细胞的问询(interrogation);裂解端口116,用于引入裂解缓冲液,以便在认为细胞合适的情况下裂解细胞并且释放其中包含的染色体;以及废料端口118,用于排放废试剂和被认为不合适的细胞。在流动通道的出口处,所述装置包括检测区119(参见图7,展开图),所述检测区用于检测单独的中期染色体,以确保染色体被分配。在流动通道102下游,微流体装置包括分配结构120,所述分配结构包括分配端口122、提取端口124和分配通道704。细胞捕集器402具有20μm×20μm×20μm的尺寸,其足够小以容纳单个中期细胞。细胞捕集器402包括通向流动通道102的入口的开口404。开口404具有大约2μm至大约3μm的宽度,以防止细胞从细胞捕集器402进入流动通道102中。
在操作期间,细胞样本可以经由样本端口114提供给微流体装置。
图3示出了经由样本端口114添加包含细胞403的流体样本。在图3中,样本端口114在高压下操作,废料端口118在低压下操作,裂解端口116和分配端口122在基准压力(datumpressure)下操作,并且提取端口124关闭。鉴于这种布置,样本通过样本转移通道126流至废料端口118。
图4示出了细胞403在细胞捕集器402中的捕获以用于问询。在图4中,样本端口114、裂解端口116和废料端口118在基准压力下操作;分配端口122在低压下操作;并且提取端口124关闭。这种布置的效果是提供压力差,所述压力差将细胞403保持在细胞捕集器中,例如,存在抽吸效应,该抽吸效应使细胞捕集器402中的细胞相对于开口404存在偏向。然而,细胞403不能穿过开口404。在细胞403被保持在细胞捕集器402中后,可以通过玻璃盖玻片进行目视检查。目视检查的目的是确认细胞403是中期细胞,因此适合获得染色体悬浮液。
如果细胞403不是中期细胞,则诸如通过经由分配端口122施加反压并通过废料端口118排放细胞而将细胞403从细胞捕集器402冲洗掉。即,分配端口122在高压下操作;废料端口118在低压下操作,样本端口114和裂解端口116在基准压力下操作;并且提取端口124关闭。
如果细胞是中期细胞,则细胞经受裂解过程以破裂细胞膜并从细胞内释放染色体。在图5中示出该过程。在图5中,通过使裂解端口116在较高压力(例如,40毫巴-45毫巴)下操作来施加裂解缓冲液405,分配端口122在低压(例如,低于35毫巴的基准压力,诸如小于30毫巴)下操作;样本端口114和废料端口118在基准压力(例如,35毫巴)下操作;并且提取端口124关闭。这样做的效果是裂解缓冲液405从裂解端口116流过裂解通道502,在裂解通道中裂解缓冲液与待裂解的细胞接触。
然后使用压力脉冲迫使细胞通过开口并沿着收缩部,这通过剪切细胞膜并使细胞的内容物(包括一个或多个染色体簇)经由入口104进入流动通道102中而使细胞裂解。在该压力构造中,样本端口114、废料端口118和裂解端口116在脉冲压力下操作;分配端口122在低压下操作,并且提取端口124关闭。
裂解缓冲液是一种水溶液,其可以包含1型超纯水、2v/v%乙酸、5w/v%triton X-100(也称为聚乙二醇p-(1,1,3,3-四甲基丁基)-苯基醚(一种非离子表面活性剂,其具有亲水性聚环氧乙烷链(其平均具有9.5个环氧乙烷单元)和芳香烃亲脂或疏水基团))、0.1w/v%胃蛋白酶、75mM氯化钾。在该缓冲液中;乙酸固定并保持染色体形态,triton X-100溶解/裂解细胞膜成分和疏水蛋白,并在释放染色体方面起次要作用,胃蛋白酶将单独的染色体从它们的簇中释放并帮助细胞裂解并去除细胞蛋白质,且氯化钾是一种用于经由渗透压使细胞膨胀并增强胃蛋白酶溶解度的盐。替代地,缓冲液可以包括0.1%w/v胃蛋白酶、1mMEDTA、73mM乙酸钾缓冲液、2mM硫酸镁,用乙酸缓冲至pH 5。替代地,可以通过固定性甲醛来执行乙酸在这些缓冲液的任何一种中的固定作用。本领域技术人员会理解,本领域已知的其他缓冲液组合物也适合用作裂解和/或分离缓冲液。
图2示出了使用压力脉冲来驱动染色体簇通过收缩部202。这是通过经由裂解端口116施加高压脉冲(例如,300毫巴-1000毫巴)来实现的。在该操作模式下,样本端口114和废料端口118在基准压力(例如,35毫巴)下操作;分配端口122在低压(例如,<30毫巴)下操作;并且提取端口124关闭。来自裂解端口118的附加压力驱动受阻的成簇染色体204(例如,可能已被捕集在收缩部202的狭窄开口处的一个或多个染色体簇)通过收缩部202,使所述一个或多个染色体簇经受高剪切应力条件,以将所述一个或多个染色体簇204断裂成单个染色体203和/或更小的染色体簇。对各个区重复此过程。
另一种方法是经由以下端口施加高压脉冲:样本端口114(例如,250毫巴–950毫巴,或250毫巴–1,000毫巴)、废料端口118(例如,250毫巴–950毫巴,或250毫巴–1000毫巴)以及裂解端口116(例如,300毫巴-1000毫巴);分配端口122处于低压(例如,0毫巴);并且提取端口124关闭。
在描述的压力状态下,取决于收缩部的尺寸和施加的压力,通过收缩部区的剪切应力的范围为大约0.02N/m
裂解缓冲液和裂解端口116与分配端口122之间的压差的组合引起化学辅助剪切裂解过程,该过程导致细胞膜破裂且迫使细胞的内容物通过开口404并进入流动通道102中。细胞的内容物包括一个或多个染色体簇204(以及潜在的单个染色体203)。所述一个或多个染色体簇然后在通道102中经受如上文所述的剪切处理过程以分离染色体。
图6提供了在细胞已经被裂解并且染色体205被排出到流动通道102中且移动通过其中一个区的扩展区域110之后的微流体装置100的操作的图示。在图6中,样本端口114、裂解端口116和废料端口118保持裂解缓冲液施加设置;分配端口122在基准压力下操作;并且提取端口124关闭。因此,横跨流动通道102存在压差,所述压差将染色体从流动通道102的入口104朝向流动通道的出口106驱动。扩展部段示出了通过区1的扩展区域110分散且分离的单个染色体203。扩展区域110可以包括混合设备,(诸如人字形(herringbone)混合器)以辅助单个染色体的分散。
一旦染色体被分离,它们会在出口106处诸如通过荧光信号的实时记录被检测。每个检测事件都会触发分配系统启动。图7和图8示出了染色体的检测和计数,以及单个染色体经由提取端口124从微流体装置100的移出。图7示出了使用光电检测器702在出口106处检测单个染色体203。检测限制器703确保染色体在单个队列(single file)中。在检测到染色体时,启动分配系统。经由分配端口122提供中和缓冲液流(以阻止由于胃蛋白酶活性(如果存在的话)导致的染色体形态降解),以捕获检测到的染色体并将其从微流体装置100进行分配。每个染色体都以液滴的形式从微流体装置中排放。液滴被分配到容器(例如,载玻片或专门的孔板)上。更详细地,一旦检测到染色体,提取端口124上的阀就从关闭位置(图7所示)切换到打开位置,并且分配端口122的压力增加以提供中和试剂。该增加的流709(图8所示)导致单个染色体203从出口106分配并进入分配通道704中,单个染色体随后在那里沉积在孔板或载玻片上。增加的流709还导致流动通道102中的流动反转,从而有助于保持染色体分离。
举例来说,在检测期间,样本端口116和废料端口118在0毫巴下操作;裂解端口116在2毫巴-5毫巴下操作;并且分配端口122在2毫巴下操作。作为替代示例,在检测期间,样本端口116和废料端口118在10毫巴下操作;裂解端口116在20毫巴下操作;并且分配端口122在2毫巴下操作。该低压差减慢了通过流动通道102的流动以允许在出口106处检测染色体。一旦已经检测到染色体,分配端口122处的压力增加至15毫巴以将染色体从出口106分配并进入分配通道704中。
图9示出了包括单个染色体203的200nL液滴900从分配通道704的出口通过分配管705沉积到移动孔板902上。可以重复该过程直到每个染色体都已经沉积到孔板902上(诸如呈阵列形式),例如,对于取自人类细胞的染色体,将具有46个离散的液滴,每个液滴包括单个染色体。分配管的疏水涂层706确保液滴不会粘在分配管705上。图9还示出了与盒707和玻璃盖玻片708相关的分配通道704。
图10示出了具有基准压力的根据本发明的一个实施方案的泵布置。在该实施方案中,在基准压力被设置为35毫巴的情况下,样本端口114被配置为使用69毫巴压力泵;在基准压力被设置为35毫巴的情况下,裂解端口116被配置为使用1000毫巴压力泵;在基准压力被设置为35毫巴的情况下,废料端口118被配置为使用70毫巴压力泵;在基准压力被设置为35毫巴的情况下,分配端口122被配置为使用345毫巴压力泵;并且提取端口124常闭。
如上所概述的,微流体装置100的操作是通过将微流体装置的各种流体端口连接到压力/流量控制器来执行的。345毫巴压力泵连接到样本端口114和废料端口118,因为它们用于在细胞筛选和捕集期间控制细胞运动,这需要压力变化的高分辨率以产生和维持低流速。一个1000毫巴压力泵连接到裂解端口116,以提供高压脉冲以在保持在捕集器中的细胞中引起剪切。69毫巴压力泵连接到分配端口122,以允许分配通道中的压降,用于染色体转移。分配通道704在提取端口124上具有阀(位于垫圈上的座管),除了分配液滴时,所述阀在操作期间为常闭的。所有压力控制器最初将被设置为35毫巴的基准压力,每个压力线可以取决于微流体装置100内所需的流动方向而从该基准压力开始升高或降低。
替代地,在该实施方案中,在基准压力被设置为35毫巴的情况下,样本端口114被配置为使用1000毫巴压力泵;在基准压力被设置为35毫巴的情况下,裂解端口116被配置为使用1000毫巴压力泵;在基准压力被设置为35毫巴的情况下,废料端口118被配置为使用1000毫巴压力泵;在基准压力被设置为35毫巴的情况下,分配端口122被配置为使用345毫巴压力泵;并且提取端口124常闭。
如上所述,微流体装置100的操作是通过将微流体装置的各种流体端口连接到压力/流量控制器来执行的。1000毫巴压力泵连接到样本端口114和废料端口118,因为它们用于在细胞筛选和捕集期间控制细胞运动,这需要压力变化的高分辨率以产生和维持低流速。一个1000毫巴压力泵连接到裂解端口116,以提供高压脉冲以在保持在捕集器中的细胞中引起剪切。345毫巴压力泵连接到分配端口122,以允许分配通道中的压降用于染色体转移。分配通道704将在提取端口124上具有阀(位于垫圈上的座管),除了分配液滴时,所述阀在操作期间为常闭的。所有压力控制器最初被设置为35毫巴的基准压力,每个压力线可以取决于微流体装置100内所需的流动方向而从该基准压力开始升高或降低。
经由分配管705从微流体装置100分配液滴来执行分配(例如,本实施方案的分配管具有0.79mm的外径、0.15mm的内径和7mm的长度),其中每个液滴包含一个染色体。这是通过在分配端口122处产生更高的压力并打开提取端口124处的阀来实现的。然后由于压降,流体行进通过分配通道704、通过分配管并离开分配管尖端。一旦产生了正确的液滴大小(液滴大小通过改变压降而变化,但示例大小为200nL),每个液滴将被分配到载玻片或专门设计的孔板上。来自分配端口122的压力然后将恢复到基准压力。通过所形成的液滴的表面张力,液滴附着到容器。为了以阵列形式分配每个液滴并且将其分配到容器上,使用了保持容器的自动化机构。该机构沿三个轴线独立地移动到盒,诸如沿着x轴线和y轴线在容器上形成液滴阵列,并在z轴线上将每个液滴附着到容器。
将理解的是,在本说明书中公开和定义的本发明扩展到从文本或附图中提及或显而易见的两个或更多个单独特征的所有替代组合。所有这些不同的组合构成了本发明的各种替代方面。例如,将理解的是,上述各个特征的替代拓扑构成本发明的替代方面。
- 用于检测目标基因的微流体装置、用于制造微流体装置的方法及用于使用微流体装置进行检测的方法
- 用于检测目标基因的微流体装置、用于制造微流体装置的方法及用于使用微流体装置进行检测的方法
