一种非细胞神经移植物的生物测定方法
文献发布时间:2023-06-19 12:24:27
相关申请的交叉引用
本申请是2015年5月28日提交的共同未决申请14/724,365的部分继续申请,其全部内容通过引用并入本文。
背景技术
在创伤性损伤中,外周神经常常被损坏或切断。这些神经的手术修复技术包括用于较小间隙的直接神经修复,以及用于较大间隙的神经移植物的应用。虽然损伤部位近端的轴突片段可以再生新的轴突芽,但是损伤部位远端的轴突片段通常经历沃勒(Wallerian)变性的过程。沃勒变性涉及神经元(例如无功能的远端轴突及其髓鞘)的分解和清除。人们相信轴突和髓鞘质碎片具有减少神经再生的生长抑制效果。大量的证据表明神经元的清除能够改善远端神经片段的轴突外生长(outgrowing)。
神经移植物,例如具有与神经束相似的结构和组成的非细胞移植物,可以通过提供新的轴突片段可以通过其生长的支架来辅助轴突再生。神经移植物支持和引导生长的轴突片段,并且当非细胞的时候,提供没有轴突和髓鞘质碎片的通路。
背根神经节(DRG)是包含用于外周神经系统的感觉神经元的感觉神经元细胞体的解剖结构。
发明简述
本发明提供了用于生物测定的技术和系统,所述生物测定是使用支配外周神经系统的神经元的外周神经生长的体外模拟。
在一些实施方式中,该技术有助于检测神经移植物(例如,加工的、非细胞人类同种异体移植物)的生物活性或效力,以促进或支持外周神经再生。例如,通常生物测定可用于确定神经移植物的生物活性,或者用于验证或证实神经移植物的生产、储存或其他处理的一个或多个方面。
在某些实施方式中,本发明的方法包括将神经元附着于神经移植物片段以形成测试结构;在培养基中培养测试结构;分析测试结构以评估外生长的神经结构的量;并根据分析得出的度量确定神经移植物的效力。
在某些实施方式中,神经元是一组收获的神经元,例如背根神经节(DRG)或脊髓片段。在其他实施方式中,神经元可以是来源于干细胞(例如人类诱导多能干细胞(hiPSC))的神经元。在hiPSC的情况下,该测定可用于评估个体的细胞如何响应不同的因子,例如不同的药物。优选地,神经元是支配外周靶标的神经元(即外周神经神经元)。神经元可以是例如感觉神经元或运动神经元。
在一个实施方式中,分析可以通过组织学处理进行(例如,固定,切片,放置在载玻片上,染色培养的神经移植物片段),然后对载玻片进行图像分析,从而确定最远外生长神经结构的长度。
在另一个实施方式中,可以通过用扩散张量成像扫描全部或部分测试结构并产生识别外生长神经结构的示踪成像图像来执行分析。然后可以通过例如测量图像上的一个或多个外周神经结构的长度来定量外生长神经结构的数量。
在另一个实施方式中,从在神经元细胞中表达荧光团的荧光转基因动物获得DRG。通过用荧光显微镜扫描全部或部分测试结构并产生识别外生长外周神经结构的图像来执行分析。然后可以通过例如测量图像上的一个或多个神经结构的长度来定量外生长神经结构的数量。
在一些实施方式中,分析可以包括定量测量与外生长神经结构相关的蛋白质或蛋白质的mRNA的数量。例如,许旺(Schwann)细胞或神经突可被表明它们的存在的靶蛋白(如βIII-微管蛋白)识别。通过在测试结构中溶解蛋白质(或与这些蛋白质相关的mRNA),测定可以确定结构中蛋白质(或相关mRNA)的量。这个量与神经结构的数量有关。例如,可以使用ELISA或rtPCR测定来确定相关靶蛋白或mRNA的量。
在一些实施方式中,可以使用技术和材料来测试不同测试条件对神经生长的影响。有利地是,本文描述的技术和材料可以形成具有基线生物活性的一组稳定的生物测定条件。这允许在不改变其他稳定的生物测定条件的情况下,作为待测试的研究方案的一部分,添加或改变一个条件。
在另一个实施方式中,可提供具有用于测试不同测试条件对神经生长的影响的某些材料的试剂盒。
提供简述是为了以简化的形式介绍将在以下发明详述中进一步描述的一些概念。本发明简述部分不旨在标识所要求保护的主题的关键特征或基本特征,也不旨在用于限制所要求保护的主题的范围。
附图说明
图1A示出了描述根据本发明的生物测定进行的某些步骤的示例过程流程。
图1B示出了包括组织的组织学处理和染色以及之后的图像分析的一个实施方式的示例方法流程。
图1C示出了使用扩散张量成像的替代实施方式的示例过程流程。
图1D示出了使用荧光显微镜的替代实施方式的示例过程流程。
图1E示出了使用与外生长神经结构相关的靶蛋白的mRNA检测的替代实施方式的示例过程流程。
图1F示出了使用与外生长神经结构相关的靶蛋白检测的替代实施方式的示例过程流程。
图2示出了可用于包括测试结构的免疫组织化学分析的实验中的某些材料和相关方法的图。
具体实施方式
公开的技术和系统用于基于DRG的生物测定,其是使用支配外周神经系统的感觉神经元的外周神经生长的体外模拟。
“生物测定”涉及使用活体动物或植物(体内)或组织或细胞(体外)来评估测试的材料和/或方法的生物活性和/或衍生物。通常进行生物测定以测量物质或方法对活体的影响。
在本发明的一些实施方式中,该技术有助于检测神经移植物的生物活性或效力,以促进或支持外周神经再生。例如,通常生物测定可用于确定神经移植物的生物活性,或者用于验证或证实神经移植物的生产、储存或其他处理的一个或多个方面。例如,生物测定可用于在生产、加工或储存参数改变后重新确认神经移植物的生物活性。生物测定也可以用作神经移植物生产过程中的定期质量控制措施。
在一些实施方式中,技术包括:将神经元附着到神经移植物片段以形成测试结构;在培养基中培养测试结构;分析测试结构以评估外生长外周神经结构的数量;并根据衍生自分析的度量确定神经移植物的效力。
在某些实施方式中,神经元是一组收获的神经元,例如背根神经节(DRG)或脊髓片段。在其他实施方式中,神经元可以是来源于干细胞的神经元,例如人类诱导多能干细胞(hiPSC)。在hiPSC的情况下,该测定可用于评估个体的细胞如何响应不同的因子,例如不同的药物。优选地,神经元是支配外周靶标的神经元(即外周神经神经元)。神经元可以是例如感觉神经元或运动神经元。
测试结构的分析可以几种方式进行。在一个实施方式中,分析可以通过组织学处理(例如,固定,切片,放置在载玻片上,染色培养的神经移植物片段)进行,然后对载玻片进行图像分析来确定最远外生长神经结构的长度。
在另一个实施方式中,可以通过用扩散张量成像扫描全部或部分测试结构并产生识别外生长神经结构的示踪成像图像来执行分析。然后可以通过例如测量图像上的一个或多个神经结构的长度来定量外生长神经结构的数量。
在另一个实施方式中,从在神经元细胞中表达荧光团的荧光转基因动物获得DRG。通过用荧光显微镜扫描全部或部分测试结构并产生识别外生长神经结构的图像来执行分析。然后可以通过例如测量图像上的一个或多个神经结构的长度来定量外生长神经结构的数量。可以定量最远外生长外周神经结构的长度。
在一些实施方式中,分析可以包括定量测量与外生长神经结构相关的蛋白质或蛋白质mRNA的数量。例如,许旺细胞或神经突可被表明它们的存在的靶蛋白(如βIII-微管蛋白)识别。通过在测试结构中溶解蛋白质(或与这些蛋白质相关的mRNA),测定可以确定结构中蛋白质(或相关mRNA)的量。这个量与神经结构的数量有关。例如,可以使用ELISA或rtPCR测定来确定相关靶蛋白或mRNA的数量。
在一些实施方式中,神经移植物是用于手术修复外周神经不连续以支持穿过缺损再生的加工的神经同种异体移植物(人)。来自阿克松根的
经加工的人类神经同种异体移植物被脱细胞并加工,产生具有天然结构通路的手术植入物以引导轴突再生。这种神经移植物可以在一定的长度和直径范围内使用,并且作用类似于自体移植神经,而没有与二次手术部位相关的伴随疾病。神经同种异体移植物的加工和脱细胞清除大部分轴突和髓鞘碎片,使得神经可以具有无阻碍的再生通路。加工也去除了可能在受体中引起有害免疫应答的材料和分子。
在某些实施方式中,神经移植物可以是例如自体移植物(从患者身体的另一部分取得的神经),同系异体移植物(取自同卵双生的神经)或异种移植物(取自另一物种的神经)。
在某些情况下,阳性对照可以用来显示独立于神经移植物的神经元活性。阴性对照可以用来证明分析方法的适当性。在一些情况下,当使用抑制剂处理神经移植物时,钝化技术可用于显示样品中降低的外生长活性。钝化样品的降低的生长活性的水平可用于评估作为神经再生的一个因素的神经移植物的生物活性。
在一些实施方式中,可以使用技术和材料来测试不同测试条件对外周神经外生长和再生的影响。有利地是,本文描述的技术和材料可以形成具有基线生物活性的一组稳定的生物测定条件。这允许在不改变其他生物测定条件的情况下,作为待测试的研究方案的一部分,添加或改变一个条件。可以进行使用和不使用该研究方案的实验的结果的分析,以评估该研究方案对外周神经外生长的影响。
在一些情况下,神经移植物片段可以在将神经元附着到神经移植物片段的末端之前根据研究方案进行处理。研究方案可以定义作为研究或实验主题的测试条件或测试物质。例如,可以选择研究方案,因为其外生长抑制或外生长促进的潜力,或者确定研究方案对神经外生长的影响。
例如,研究方案可以包括通过将神经移植物片段浸没在包含预期会刺激神经生长的化合物(或化合物的混合物)的溶液中来给药神经移植物片段。在有或没有释放系统的情况下可能促进外生长的试剂的实施例包括神经营养因子、FK506、EPO和甾体或非甾体抗炎药。
研究方案还可以包括通过将神经移植物片段浸没在包含预期会抑制神经外生长的化合物(或化合物的混合物)的溶液中来给药神经移植物片段。例如,可以研究这些物质来确定患者可能暴露的环境因素的影响,或者在测试方案中实施控制措施。潜在的抑制剂的实施例包括降解蛋白质的试剂(如蛋白酶),修饰移植物化学结构的物质(如醛),或影响移植物或神经元细胞与移植物之间的连接分子的功能性阻断抗体(如整联蛋白)。
研究方案的其他实例包括用放射给药神经移植物片段,用干细胞或许旺细胞接种神经移植物片段,或使再生结构(例如神经移植物或整个测试结构)暴露于电场。通过比较在研究方案下得到的结果与在不在研究方案下得到的结果(例如对照条件或参考测量),可以分析研究方案的有效生物活性。
在另一个实施方式中,可提供具有用于测试不同测试条件对神经外生长的影响的某些材料的试剂盒。试剂盒可以包括可以在其上放置神经元的神经移植物片段。试剂盒的使用者可以提供神经元,或者在某些情况下,神经元可以作为试剂盒的一部分提供。该试剂盒还可以包括在其中培养神经移植物片段的标准培养基。根据一个实施方式,试剂盒还可以包括用于鉴定神经结构的一种或多种染色剂或蛋白质或mRNA测定试剂盒或组分。试剂盒可以进一步包括用于在所提供的材料的背景下并使用所描述的技术来实施测试条件或研究方案的详细说明书。
图1A示出了描述可以根据本发明的生物测定进行的某些步骤的示例过程流程。背根神经节(DRG)附着在神经移植物片段(100)的第一端。神经移植物片段可以从较大的神经移植物切下。在一些情况下,例如当神经移植物全部被测定时,神经移植物片段可被顺序移除并被识别或追踪,以便测试特定神经移植物的特定节段。
在某些情况下,神经移植物片段可能是非细胞的。例如,可通过从相同物种(这里,通常是人)的动物的尸体去除神经片段,并使用各种技术加工或处理它们以去除髓鞘质和轴突碎片来获得非细胞神经同种异体移植物。然后加工的非细胞神经同种异体移植物主要包含支持和引导新神经突及其相关辅助结构(例如许旺细胞)外生长的天然神经内膜管支架。
DRG可从最近出生的大鼠仔鼠获得(参见方法和材料)。在一些情况下,DRG可以清除神经根(以及大部分轴突)和其他结构,主要留下没有延伸的神经突的细胞体(和相关的支持细胞,例如许旺细胞)。
在一些实施方式中,可以使用一滴胶原蛋白I凝胶将神经元附着到神经移植物片段的末端,所述胶原蛋白I凝胶将神经元粘附到神经移植物的末端,从而在培养基中抵抗分离。本领域的技术人员可以想到将神经元附着到神经移植物片段末端的其它方法。
在一些情况下,神经移植物片段可被选择为近似的横截面直径。优选的尺寸接近神经元直径的两倍,或者1毫米。这个优选的尺寸允许用于放置神经突和神经突行动的空间,而不是太大,以至于在大量的横截面中观察不到神经结构的外生长。
在一些实施方式中,神经移植物片段可以用钝化技术处理,例如通过将片段浸入含有钝化化学物的溶液中以抑制片段的生物活性。例如,通过使用影响神经内膜管内层的层粘连蛋白的钝化剂,可以抑制神经移植物的生物活性。可以分析钝化样品对比未钝化样品的神经元外生长结果,以帮助测量神经移植物片段对神经再生过程的贡献。
测试结构或样本由附着有神经元的神经移植物片段形成。将测试结构在培养基中培养合理的一段时间(110),以允许神经突从神经元外生长到神经移植物片段中。
一般来说,这种培养被称为“器官型培养”,是贴壁培养的子类型。细胞体外生长有两种基本的机制,贴壁和悬浮。在贴壁培养中,细胞在人造基底(例如组织培养塑料或微载体)上生长为单层,所述基底可以用细胞外基质(例如胶原蛋白或层粘连蛋白)涂覆,以增加粘附并诱导生长和分化;在悬浮培养中,细胞在培养基中自由漂浮。大多数脊椎动物细胞最好使用贴壁培养进行培养。器官型培养允许细胞三维生长,而不是二维生长。因此,在许多情况下,器官型培养可能是体内组织中真实生长条件的更好的模拟,因为生长条件在生物化学和生理学上与体内条件更相似。
在一些情况下,培养基可以是所有样品的“标准”培养基,例如含有维生素、氨基酸、神经生长因子和抗菌/抗真菌剂的培养基。在其他情况下,培养基可包含一种或多种神经突生长促进或抑制物质或试剂。例如,神经移植物的一些片段可以放置在标准的培养基中,来自同一神经移植物的其他片段可以被放置在含有正在研究的其他物质的标准培养基中,以确定其抑制或生长诱导效应。可以比较来自标准培养样品和正在研究的试剂培养样品的结果,以分析所研究的试剂对神经再生的影响。
培养测试结构的时间段是允许神经突可测定地再生的合理时间。该时间段的范围可以从例如大约3天到大约7天。取决于培养条件和其他参数,例如当需要更多或更少的时间段来评估培养基中或应用于移植物的“正在研究的试剂”的影响,可以使用不同长度的时间段。
然后进行测试结构的分析以指示外生长神经结构的数量(120)。测试结构的分析可以以几种方式进行。例如,在某些情况下,分析可以量化一个或多个外生长神经结构进入神经移植物的长度。
在一些情况下,分析可以通过测量相关的关联蛋白的数量来定量神经结构的数量。描述分析测试结构的方面的实施方式在下面参照图1B-1F进行描述。
然后可以使用从分析得出的度量确定神经移植物的效力(190)。在某些情况下,度量(例如,距离或数量)可以与从多个样本导出的基准或参考度量进行比较。在一些情况下,该基准或参考度量可以定量神经移植物在特定条件下(例如控制条件,参考条件,钝化条件等)的效力。可以进行神经移植物在不同条件下与特定条件下的效力的比较,以确定不同条件对神经移植物的生物活性的影响或意义。
为了实验目的,可以对来自多个生物测定的多个度量进行统计分析。例如,可以进行使用大量样品的许多生物测定,以实现满足可信度阈值的结果的有效统计分析。这样的实验技术和统计分析是本领域技术人员所熟知的。
如上所述,测试结构的分析可以以几种方式进行。在一个实施方式中,分析可以通过组织学处理(例如,固定,切片,放置在载玻片上,染色培养的神经移植物片段)以及随后对载玻片进行图像分析来进行,以确定最远外生长神经结构的长度。图1B示出了包括组织的组织学处理和染色以及之后的图像分析的实施方式的示例方法流程。
在培养期之后,测试结构从培养基中移出并准备用于组织学处理(131)。准备测试结构可以包括“固定”测试结构。固定是保持组织形态并保持目标分子的抗原性的过程。固定改变组织的化学组成,并且通常需要在保持组织结构和保留表位之间进行折衷。不完全固定(Underfixation)可以使组织中的目标蛋白质降解,但过度固定(overfixation)可能导致掩蔽表位,或者当对样品进行染色时可能导致非特异性背景染色。固定的方法和时间选择是样品制备中的因素。
在一些实施方式中,将测试结构用福尔马林固定并用石蜡包埋,以允许切片。一种用于石蜡包埋组织的固定剂是中性缓冲福尔马林(NBF)。这相当于在缓冲溶液中4%的多聚甲醛以及防止甲醛转化为甲酸的防腐剂(甲醇)。石蜡包埋包括将组织样品或测试结构置于已经加热软化的石蜡块上,用熔融石蜡覆盖测试结构,并使石蜡硬化。一旦包埋,可将样品切成薄片以供显微镜观察。
制备用于切片和组织学的样品的一种替代方法是冷冻切片。为冷冻切片准备的样品在模具中快速冷冻,并且可以使用各种物质固定,包括作为醛(例如NBF)的替代物的沉淀固定剂(如丙酮)。使用NBF的固定、石蜡包埋和冷冻切片是本领域技术人员熟悉的技术。
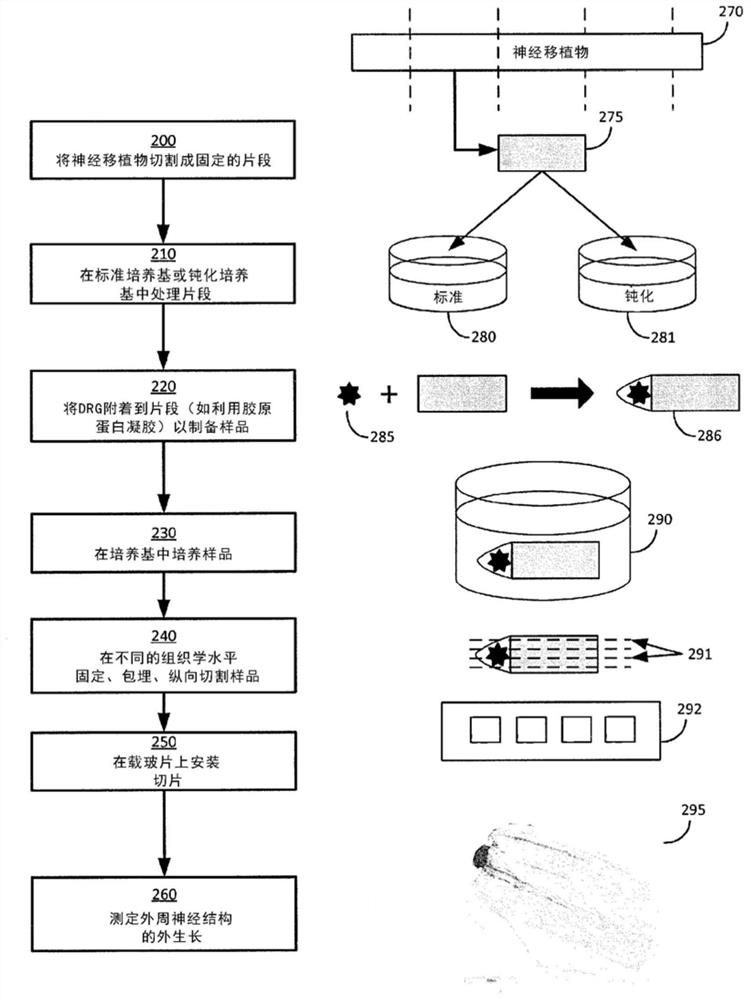
将制备的测试结构纵向切成用于染色的几个切片(132)。每个切片都有一个给定的厚度,并在给定的水平或深度代入样品中。沿着神经元-神经移植物测试结构进行纵向切片,即从放置神经元的末端沿着近垂直线以给定距离移除所述切片。图2中,元素291示出了表示纵向切片的方向的虚线。这种切片技术通过测试结构产生切片,其可以包含从神经元生长的一个或多个神经突的长度。
切片在从垂直侧到放置神经元的第一端的几个水平(距离)上进行。选择不同的水平,以便获得沿着神经移植物切片的整个横截面的神经突外生长的代表性样品。例如,在某些情况下,可以将样品中的200(1级)、400(2级)、600(3级)和800(4级)微米深度的部分去除。
切片的厚度适合于光学显微镜。在一些实施方式中,所述切片的厚度为约4μm至约8μm。可以使用超薄切片机对石蜡包埋的样品进行测试结构的切片。
去除的切片可放置在载玻片上并用一种或多种染色剂染色,以鉴定从神经元到神经移植物片段的外生长或重新生长的神经结构(133)。神经结构可以包括例如神经突和产生髓鞘质的许旺细胞。几种染色方法可用于鉴定神经结构,例如βIII-微管蛋白抗体染色,PGP9.5抗体染色和S100抗体染色。
βIII-微管蛋白抗体染色。一种类型的βIII-微管蛋白染色剂是TU-20。TU-20是针对人源βIII-微管蛋白的氨基酸441-448产生的小鼠单克隆IgG1。
PGP9.5抗体染色。蛋白质基因产物(PGP9.5)是神经元特异性蛋白质,与神经元特异性烯醇酶在结构和免疫学上不同。标准的免疫组织化学技术已经证明在中枢和外周神经系统的所有水平,在许多神经内分泌细胞以及其他身体细胞中,PGP9.5存在于神经元和神经纤维中。该抗体作为神经元的标记是有价值的。
S100抗体染色。S100蛋白质是在脊椎动物中发现的低分子量蛋白质家族,其特征在于具有螺旋-环-螺旋构象的两个钙结合位点。S100蛋白通常存在于来自神经嵴的细胞中,例如许旺细胞和黑素细胞。S100抗体染色显示正常人许旺细胞的存在。
应该指出,实验因素可能会影响染色的选择。例如,石蜡包埋虽然具有相对于冰冻切片的某些技术优势,但可能会影响染色响应。用于石蜡包埋的物质(例如醇,醛)可能会变性或影响某些蛋白质的结构,这些蛋白质在某些类型的抗体染色中引起反应响应。冷冻切片可能会不同地影响染色,导致不同的染色选择。
然后可以测量从神经移植物片段的第一端(即,放置神经元的末端)到最远外生长神经结构的末端的距离(134)。在某些情况下,一个载玻片可包含从一个特定的测试结构取得的所有纵向切片,以帮助识别最远外生长神经结构。还可以使用额外的标准技术,例如对载玻片进行成像,使得标准图像处理软件可以帮助确定距离。人类评估者可仔细检查图像,以确定外生长神经结构的最远生长的位置。
在某些情况下,对于给定的测试结构,可以测量多于一个的最远外生长神经结构。例如,对于特定的测试结构,存在于所有纵向截面上的三个最长的结构可以被识别并平均化,并且平均值可以被记录为该样本的测量距离。
可以记录多于一种类型的神经结构的距离测量。例如,在使用神经突和许旺细胞染色的情况下,可以测量和记录神经突、许旺细胞或两者的最远外生长。
图1C示出了使用扩散张量成像的替代实施方式的示例性过程流程。在如图1C所示的实施方式中,可以通过用扩散张量成像扫描全部或部分测试结构并产生识别外生长神经结构的示踪成像图像来执行分析(141)。
具有示踪成像的扩散张量成像(DTI)是一种MRI,其可以通过测量在具有纵向取向纤维的神经束中水扩散的各向异性来显现神经通路。水沿着神经束的纵轴自由地扩散,但受到垂直平面中的髓鞘的限制。扩散的方向性可以通过应用来自多个方向的扩散敏感梯度来确定,从而允许对扩散张量进行建模。然后可以从张量中计算各向异性分数图,并且可以通过对体素上的最大扩散率的方向进行建模来产生示踪成像图像。这些示踪成像图像可以用于视觉上描绘神经突的生长。
一旦获得了外生长神经突的视觉描绘,那么例如通过测量图像上的一个或多个神经结构的长度,就可以量化外生长神经结构的数量(142)。在某些情况下,可以测量最远外生长神经结构。在某些情况下,对于给定的测试结构,可以测量多于一个的最远外生长神经结构。例如,对于特定的测试结构,存在于所有纵向片段上的三个最长的结构可以被识别和平均化,并且平均值可以被记录为该样本的测量距离。还可以计算其他度量,例如神经突生长的总长度和每个神经突的平均长度。
图1D示出使用荧光显微镜的替代实施方式的示例性过程流程。在如图1D所示的实施方式中,DRG从在神经元细胞中表达荧光团的荧光转基因动物获得。
荧光团是一种荧光化学化合物,在光激发时可以重新发光。可以获得转基因动物用于在各种神经元子集中表达荧光团的实验室研究。随着神经结构从神经元外生长到神经移植物,荧光团存在于生长的细胞结构(如轴突)中。当在荧光显微镜下观察时,这些细胞结构沿其全长明亮且均匀地发出荧光。用于显示神经元结构的荧光团的实施例是黄色荧光蛋白(YFP)、绿色荧光蛋白(GFP)和青色荧光蛋白(CFP)。
通过用荧光显微镜扫描全部或部分测试结构并产生如明亮的荧光团所指示的识别外生长神经结构的图像来进行分析。荧光显微镜的类型可以包括例如共焦荧光显微镜、双光子荧光显微镜和具有统计反褶积的超分辨率荧光显微镜。
然后例如,通过测量图像上的一个或多个神经结构的长度,可以量化外生长神经结构的数量(152)。在某些情况下,可以测量最远外生长神经结构。在某些情况下,对于给定的测试结构,可以测量多于一个的最远外生长神经结构。例如,对于特定的测试结构,存在于所有纵向切片上的三个最长的结构可以被识别和平均化,并且平均值可以被记录为该样本的测量距离。还可以计算其他度量,例如神经突外生长的总长度、每个神经突的平均长度和/或图像中荧光像素的数量。
图1E显示了使用用于与外生长神经结构相关的靶蛋白的mRNA检测的替代实施方式的示例性过程流程。选择被测量的mRNA,使得其测量与神经结构的外生长相关。与外生长神经结构(如许旺细胞或神经突)关联的靶蛋白可以包括例如βIII-微管蛋白、S100和GAP-43。
在图1E中,从测试结构中提取与靶蛋白相关的mRNA(161)。提取包括溶解存在于测试结构中的分析物分子(这里是用于靶蛋白的mRNA),用于随后通过测定进行检测。根据测定的类型,可以使用各种溶剂。如果使用rtPCR测定,例如可以使用基于蛋白酶或基于酚的溶剂来溶解mRNA。
然后将来自提取过程的上清液用于mRNA测定,如标准rtPCR测定。在rtPCR测定中,mRNA被扩增、检测和定量(162)。来自rtPCR测定的mRNA的量,因为其与外生长神经结构的数量成比例,可用于确定神经移植物的效力。
图1F示出了使用与外生长神经结构相关联的靶蛋白的检测的替代实施方式的示例性过程流程。选择被测量的蛋白,使得其测量与神经结构的外生长相关。与外生长神经结构(如许旺细胞或神经突)相关的靶蛋白可以包括例如βIII-微管蛋白、S100和GAP-43。
在图1F中,从测试结构中提取靶蛋白(171)。提取包括溶解存在于测试结构(在此为靶蛋白)中的分析物分子,以便随后通过测定进行检测。根据测定的类型,可以使用各种溶剂。如果使用ELISA测定,例如可以使用基于尿素或胍的溶剂来溶解蛋白质。
然后将来自提取过程的上清液用于定量蛋白质测定,如标准ELISA测定(172)。来自ELISA测定的蛋白质的量,因为它与外生长神经结构的数量成比例,可以用来确定神经移植物的效力。
本领域技术人员可以理解使用rtPCR测定和ELISA测定测量靶蛋白或与靶蛋白有关的mRNA的技术。
实验:
在包括组织学制备、染色和切片的实施方式中,进行实验以确定生物测定方法评估神经移植物的质量和/或测试条件的效果的能力。在一些情况下,还进行了初步实验以改进某些生物测定参数的特征。例如,评估和测试阳性和阴性对照、钝化技术、培养条件、组织学制备和染色技术。这些技术的优点可以从实验获得的结果示出。这些实验的细节描述如下。示例和实验不应被解释为限制。
材料和方法
图2示出了可用于包括测试结构的免疫组织化学分析的实验中的某些材料和相关方法的简图。如图2所示,实验的方法流程一般包括(除了在阳性和阴性对照中):将神经移植物切割成固定段(200);在标准或钝化培养基中处理每个段(210);将DRG固定到一个段上以制作测试样品(220);在培养基中培养样品(230);固定、包埋和在不同组织学水平纵向切片样品(240);将所述切片安装在载玻片上并施加一个或多个染色剂(250);并测量神经结构的外生长(260)。
每个实验中使用的神经移植物270是来自阿克松根(AxoGen)的
出生后第3-7天的大鼠幼仔用作DRG的来源(例如285),因为这些DRG具有足够的尺寸以便用解剖显微镜处理。源大鼠幼仔的年龄也足够年轻,外植体能够具有从DRG 285身体的神经突的高移植率,这有利于测定。可以从多个幼仔收集DRG,但是将每只幼仔的DRG分别入池。在使用下一个池之前,使用单个池中的DRG。查尔斯河CD(Charles River CD)大鼠幼仔用于实验。查尔斯河CD大鼠是Charles River Laboratories International的不公开的Sprague-Dawley种群的商标名称。
培养
试图改变培养时间和培养基290的神经营养因子含量,作为增加生物测定信号(即迁移/外生长的距离或数量)的手段。在衍生自补充有B27、谷氨酰胺、抗生素/抗真菌剂的Neurobasal培养基的化学限定的培养基290中进行培养。“标准”培养在培养基290中使用25ng/mL神经生长因子(NGF)。
最初,测试在标准培养基290中3天培养期和7天培养期(第3天培养基变化)。在标准培养基中培养的样品在7天时显示神经突/许旺细胞良好地外生长到神经移植物片段中。3天的标准培养样品显示出比7天培养的样品较少的神经突/许旺细胞密度。
组织学和染色
培养后,制备的所有样品用于组织切片和染色。将所有样品包埋在石蜡中并纵向切片(例如291)。在初步实验中,使用4μm或8μm厚的切片进行石蜡基组织学。切片以200(1级)、400(2级)、600(3级)和800(4级)微米的水平移入样品。
将切片291固定在载玻片292上。将所有四个水平放置在同一载玻片上,并将每个样品置于不同的载玻片上。样品嵌有与预定切割平面平行的神经内膜管,产生穿过样品的纵向切片。
使用一种或多种染色剂将切片染色,以识别神经突外生长和支持许旺细胞。在初步实验中,使用PGP9.5或βIII微管蛋白来识别神经突,使用S100鉴定许旺细胞。
然后扫描载玻片292以捕获整个载玻片的图像。图像295用于测量从最接近DRG的片段的边缘到单个神经突束的最远端或许旺细胞的位置的神经突和许旺细胞外生长的长度。也可分配定性评分来描述神经突和许旺细胞外生长。
对照
使用阳性对照来证明在用于神经移植物片段的相同培养条件下的测定中使用的DRG的活力,但不使用神经移植物。
在阳性对照中使用可从几个供应商(例如来自Corning Life Sciences的Matrigel,来自Trevigen的Cultrex BME,或来自Sigma的ECM凝胶)获得的Engelbreth-Holm-Swarm(EHS)小鼠肉瘤细胞细胞外基质(ECM)的商业制剂。这些制剂在冷藏时是液体,但在环境条件(或37℃)下是凝胶。EHS细胞外基质本质上是具有高层粘连蛋白-111和胶原蛋白IV含量的可溶性基底膜;这些特性使它类似于也是基底膜层的神经内膜管的组成。这些凝胶用于体内和体外测定,以支持细胞迁移。
使用的第一个阳性对照是填充有EHS衍生的凝胶的聚四氟乙烯(PTFE或“Teflon”)管。将DRG培养在凝胶/PTFE构造的顶部。在初步实验中,第一个阳性对照构造在组织学处理过程中并不良好的保持在一起。
第二个阳性对照使用EHS衍生的凝胶和胶原蛋白I凝胶在中空管ECM衍生的医疗装置(实验中,使用
采用阴性对照来证明非特异性染色的水平(例如,染色不是由于存在神经突从DRG迁移/外生长)。每个实验中使用的阴性对照包括在标准培养条件(例如标准培养基)下培养的没有放置DRG的神经移植物片段。
钝化
钝化旨在产生具有降低的生物活性的神经移植物,以进一步证明生物测定正在测量移植物的生物活性。一般而言,钝化应导致神经突/许旺细胞向神经移植物中的延伸的减少。实验结果的分析应表明钝化和未钝化样品之间的可测量的差异,以帮助确认生物测定的有效性。
由于实验中使用的
在标准培养基280中处理未钝化的神经移植物。
实验结果
进行染色,使用βIII-微管蛋白以示出神经突外生长,并用S100以显示样品中许旺细胞的存在和位置。总体而言,βIII-微管蛋白载玻片的染色质量对于分析是可以接受的。
除了无意中放置DRG的样品外,大多数阴性对照显示出预期的染色(即,对片段中神经突延伸或许旺细胞的存在缺乏染色)。
研究了使用替代管材ECM管的其他阳性对照来代替PTFE管;ECM管用EHS凝胶填充。填充有凝胶的ECM管比PTFE管更好地保持结构,这对阳性对照组是理想的。该阳性对照结构是有效的,并且DRG的存活力通过到凝胶中的迁移/外生长是清楚可见的。
化学钝化的结果表明,预期会降低
表1中示出了单个样品神经突外生长和许旺细胞外生长。总结数据位于表2中。样品的距离通过平均样品中观察到的三个最长延伸值来获得。对每个样品的“最长三个”平均值分组进行平均,以获得组平均值和标准偏差。通过神经移植物处理类型将样品分成标准培养基组和化学钝化组。
如表2所示,7天时的标准培养条件显示从片段边缘约2204μm的神经突延伸,其约为片段总长度的73%。神经突延伸的范围是1672.3μm至2870.7μm。标准的培养条件也表明存在的许旺细胞平均距离片段边缘大约2294μm,大约占片段总长度的76%。许旺细胞从移植物边缘内生长到移植物的范围约为1253μm至2838μm。
表1单个样品数据
表2总结数据
钝化分析-使用单因素方差分析(ANOVA)分析总数据集,表明数据内存在显著差异(对于神经突和许旺细胞数据,p<0.001,参见表2)。具有假设方差相等的Bonferroni校正的T-检验表明“化学钝化”组显著不同于“标准培养基”组(神经突长度,未修正的P<0.00001;许旺细胞外生长,未修正的P<0.00001)。
此外,在载玻片图像的检查过程中,一些样品在束内具有最长的神经突,而另一些则在束外或沿着束表面有最长的神经突。不管神经突位置(即神经内膜内或神经内膜外),最长的神经突被标记,也记录神经突的位置(神经内膜内或神经内膜外)。分析每个组在束外的相比于在束内的神经突百分比。标准培养基组中有13.9%的束外最长神经突。化学钝化组具有更高的束外最长神经突百分比,占最长神经突的80.6%。这一结果支持了化学钝化通过影响层粘连蛋白有效地降低了神经内膜内表面的生物活性的分析,阻止了沿期望的生长路径的生长。
总之,用于装配和培养结构的方法是可重复的,并导致神经突和许旺细胞到神经移植物样品中的可观察到的外生长。标准培养基中的7天培养提供了高信号,测量了进入神经移植样品中的最长的神经突和许旺细胞迁移。组织学制备和染色方法导致可接受的染色,用于通过限定的评分方法进行的分析。βIII-微管蛋白和S100染色均导致类似的测量和结论。神经移植物的基于甲醛的钝化导致移植物的生物活性的可重现的和显著的衰减。在
应该理解的是,这里描述的实施例和实施方式仅用于说明的目的,并且对本领域技术人员建议了鉴于其的各种修改或改变,它们将被包括在本申请的精神和范围内。
尽管已经用结构特征和/或行为专用的语言描述了主题,但是应当理解的是,所附权利要求中限定的主题不是必须限制于上面描述的特定特征或行为。相反,上述具体特征和行为是作为实施权利要求的实施例而公开的,其他等同的特征和行为旨在落在权利要求的范围内。
- 一种非细胞神经移植物的生物测定方法
- 一种非细胞神经移植物的生物测定方法
