一种特异性识别T-2毒素的适配体亲和柱及其制备方法和应用
文献发布时间:2023-06-19 12:24:27
技术领域
本发明涉及食品安全生物技术领域,特别涉及一种特异性识别T-2毒素的适配体亲和柱及其制备方法和应用。
背景技术
T-2毒素(T-2toxin)是主要由三线镰刀菌、枝孢镰刀菌和梨孢镰刀菌筝镰刀菌属产生的有毒次级代谢产物,是类单端孢霉烯族真菌毒素中毒性最强的一种。T-2毒素是一种四环的倍半萜烯化合物,化学名4β-15-乙酰氧基-3α-羟基-8α-(3-甲基丁酰氧)-12,13-环氧单端孢霉-9-烯,分子式为C24H34O9,相对分子质量为466.2。T-2毒素广泛分布于自然界,主要污染玉米、燕麦、小麦、大麦、稻米等谷物产品。T-2毒素是非挥发性的,室温放置6~7年或在100~120℃下加热1h,其毒性依然不减。因此,T-2毒素对人畜健康的危害尤其严重,其毒性作用主要包括急性毒性作用、亚急性毒性、慢性毒性、三致作用、免疫毒性以及对血液系统和软组织的损害。
目前,实际样品中的T-2毒素检测与精准分析多需要借助大型仪器,而为了保证结果的准确,也为了保护仪器延长其使用寿命,需要进行样品前处理,且对前处理要求较高。通常情况下,样品前处理需要通过免疫亲和柱等净化步骤进行毒素的分离与提纯,去除样品中的固体杂质与其他干扰离子。免疫亲和柱(Immunoaffinity column,IAC)以抗体为作用主体,特异性结合样品中真菌毒素。因其高特异性、高灵敏度及净化效果好等优势,是目前使用最多、富集效能较强的真菌毒素样品前处理技术。目前,国内外多采用溴化氰活化的琼脂糖凝胶为载体,以随机偶联的方式将抗体分子固定在层析介质上制备亲和柱。然而由于抗体分子属于蛋白质类物质,对使用环境要求敏感。因此在实际检测过程中,若样品成分复杂则会干扰抗体的效能,从而降低免疫亲和柱的富集纯化效能。为了克服传统免疫亲和柱中存在的问题,以适配体为抗体代替物的适配体亲和柱愈益受到关注。
核酸适配体(Aptamer)是从体外合成的随机寡核苷酸文库中通过指数富集配体的系统进化(Systematic Evolution of Ligands by Exponential Enrichment,SELEX)技术筛选得到的与靶物质特异性结合的小分子DNA或RNA片段。核酸适配体能够识别与之对应的任何类型的蛋白和低分子等靶物质,并与靶物质具有高度亲和力。与抗体相比较,核酸适配体有诸多优点,比如体外合成周期短、制备成本低、无需动物实验、稳定性好、对温度不敏感和易于修饰等等。
本发明获得的T-2毒素适配体亲和柱可用于富集纯化复杂食品样品中的T-2毒素,有助于提高后续检测方法的准确度和灵敏度。克服了传统免疫亲和柱对使用环境要求敏感的缺点,具有良好的稳定性。对于被T-2毒素污染的普通食品、饲料以及珍贵药材等,可通过适配体亲和柱净化分离实现去污染的目的,使污染品恢复其使用价值。
发明内容
针对现有技术的不足,本发明提供了一种特异性识别T-2毒素的适配体亲和柱及其制备方法和应用。本发明制备的适配体亲和柱采用链霉亲和素琼脂糖凝胶作为载体,可负载大量适配体从而具有极高柱容量,具有稳定性好、成本低、保质期长和易于修饰等优点。
本发明的技术方案如下:
一种特异性识别T-2毒素的适配体,所述适配体的核苷酸序列如SEQ ID NO.1所示。
T-2毒素适配体的核苷酸序列:
5'-biotin-CAGCTCAGAAGCTTGATCCTGTATATCAAGCATCGCGTGTTTACACATGCGAGAGGTGAAGACTCGAAGTCGTGCATCTG-3'。
一种用上述适配体组装的适配体亲和柱,所述适配体亲和柱包含载体和T-2毒素适配体,所述载体为链霉亲和素琼脂糖凝胶,所述T-2毒素适配体通过化学键偶联在载体上。
一种适配体亲和柱的制备方法,所述制备方法包括如下步骤:
(1)将链霉亲和素琼脂糖凝胶用结合缓冲液洗涤活化;
(2)取步骤(1)活化的链霉亲和素琼脂糖凝胶1mL,加入适配体溶液,孵育即得偶联产物;
(3)用结合缓冲液洗涤步骤(2)制备的偶联产物,加入2%的牛血清白蛋白溶液反应封闭剩余活性基团,得到链霉亲和素琼脂糖凝胶与适配体的偶联胶体;
(4)将步骤(3)所得的偶联胶体洗涤后,用结合缓冲溶液重悬,装柱,于4℃保存备用。
进一步地,步骤(1)中,所述链霉亲和素琼脂糖凝胶的质量浓度为1mg/mL,所述链霉亲和素琼脂糖凝胶为1mL;所述结合缓冲液洗涤的方法为:每次2mL,重复洗涤3~8次。
进一步地,步骤(1)、(3)、(4)中,所述结合缓冲液为20mM NaH2PO4与150mM NaCl配成的pH 7.4的缓冲液。
进一步地,步骤(2)中,所述适配体溶液的摩尔浓度为2μM,适配体溶液体积为2mL;所述孵育方法为25℃下孵育器孵育10min。
进一步地,步骤(3)中,所述洗涤是使用结合缓冲液反复洗涤3~8次,每次2mL;所述反应的时间为12h。
进一步地,步骤(4)中所述洗涤为分别使用结合缓冲液和甘氨酸-盐酸缓冲液先后交替洗涤3~8次,以除去未偶联的适配体及多余的牛血清白蛋白;所述结合缓冲液与甘氨酸-盐酸缓冲液的体积比为1:1;所述甘氨酸-盐酸缓冲液的摩尔浓度为100mM,pH为3.0。
一种适配体亲和柱的应用,所述适配体亲和柱可用于富集和纯化待测物中的T-2毒素。
进一步地,所述待测物为粮食、坚果、饲料、乳及乳制品、水产、中药、体液、水中一种或多种。
本发明有益的技术效果在于:
(1)本发明选用了以高亲和力和特异性识别、结合靶标,具有稳定性好、成本低、保质期长和易于修饰等独特优势的适配体作为识别元件。
(2)本发明采用链霉亲和素琼脂糖凝胶作为载体,可负载大量适配体,从而具有极高柱容量,最大柱容量为200ng。
(3)本发明富集得到的靶标经洗脱可进一步定量分析。
(4)本发明实际样品检测的加标验证,对巴旦木加标回收率在78.61%~92.54%之间,对花生的加标回收率在77.49%~93.28%。
(5)本发明制备的T-2毒素适配体亲和柱在上样过程中对T-2毒素的结合率以及洗脱过程中的洗脱回收率均接近100%,对其他真菌毒素则基本不被此适配体亲和柱结合,结合率与洗脱率均接近零。
附图说明
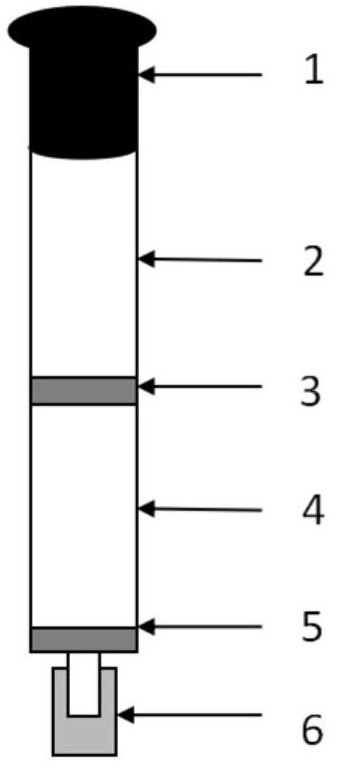
图1为本发明所制备的T-2毒素适配体亲和柱结构示意图。
图中:1、进样口堵塞;2、亲和柱柱体;3、上筛板;4、偶联胶载体;5、下筛板;6、出样口堵塞。
图2为本发明实施例1所制备的T-2毒素适配体亲和柱特异性验证。
具体实施方式
下面结合附图和实施例,对本发明进行具体描述。
本发明包括但不限于以下实施例,凡在本发明的精神和原则下进行的任何等同替换或者拒不改进,都将视为在本发明的保护范围之内。
生物素修饰适配体的合成由生工生物工程(上海)有限公司完成。
适配体溶液的配制:
(1)向生物素修饰的适配体中加入640μL的结合缓冲液,配制10μM的适配体溶液;
(2)取200μL步骤(1)制备的适配体溶液和800μL的结合缓冲液于另一离心管中,制成2μM的适配体溶液。
实施例1
一种特异性识别的T-2毒素的适配体亲和柱,所述适配体亲和柱的制备包括以下步骤:
(1)链霉亲和素琼脂糖凝胶的活化:取1mL质量浓度为1mg/mL的链霉亲和素琼脂糖凝胶,用2mL的结合缓冲液(20mM NaH
(2)链霉亲和素琼脂糖凝胶和适配体的偶联:取步骤(1)活化的链霉亲和素琼脂糖凝胶1mL,加入2mL浓度为2μM的适配体溶液,并于25℃下置于孵化器中孵育10min即得偶联产物;
(3)封闭:用2mL的结合缓冲液洗涤步骤(2)制备的偶联产物,重复洗涤3次,然后加入2mL2%的牛血清蛋白(BSA)溶液,25℃震荡反应12h,以封闭剩余活性基团,得到链霉亲和素琼脂糖凝胶与适配体的偶联胶体;
(4)洗涤:将步骤(3)所得到的偶联胶体用结合缓冲溶液和甘氨酸-盐酸缓冲液(100mM,pH 3.0)先后交替洗涤3次,每次洗涤所用的结合缓冲液和甘氨酸-盐酸缓冲液的量为2mL,以除去未偶联的适配体及剩余的BSA溶液;洗涤后的偶联胶体用2mL的结合缓冲溶液重悬后于4℃保存,并准备装柱。
(5)偶联胶体填充装柱:取容积为5mL空的固相萃取管,垫好孔径为10μm的下筛板,加入1mL结合缓冲液,使其自然流干;堵塞下方出样口,用步骤(4)洗涤的偶联胶体悬液装柱,静置5min,使偶联胶体在重力作用下自然下落,形成均匀的胶床,至胶床高度为1cm;放置孔径为10μm的上筛板,轻缓按压筛板,使其到达偶联胶体上方,防止后续上样冲坏胶床;拔掉出样口的堵塞,以1mL/min的速度将5mL结合缓冲液缓慢注入亲和柱中;堵塞下方出样口,加入3mL结合缓冲液,并堵塞上方进样口,于4℃冰箱保存备用。
实施例2
一种特异性识别的T-2毒素的适配体亲和柱,所述适配体亲和柱的制备包括以下步骤:
(1)链霉亲和素琼脂糖凝胶的活化:取1mL质量浓度为1mg/mL的链霉亲和素琼脂糖凝胶,用2mL的结合缓冲液(20mM NaH
(2)链霉亲和素琼脂糖凝胶和适配体的偶联:取步骤(1)活化的链霉亲和素琼脂糖凝胶1mL,加入2mL浓度为2μM的适配体溶液,并于25℃下置于孵化器中孵育10min即得偶联产物;
(3)封闭:用2mL的结合缓冲液洗涤步骤(2)制备的偶联产物,重复洗涤8次,然后加入2mL2%的牛血清蛋白(BSA)溶液,25℃震荡反应12h,以封闭剩余活性基团,得到链霉亲和素琼脂糖凝胶与适配体的偶联胶体;
(4)洗涤:将步骤(3)所得到的偶联胶体用结合缓冲溶液和甘氨酸-盐酸缓冲液(100mM,pH 3.0)先后交替洗涤5次,每次洗涤所用的结合缓冲液和甘氨酸-盐酸缓冲液的量为2mL,以除去未偶联的适配体及剩余的BSA溶液;洗涤后的偶联胶体用2mL的结合缓冲溶液重悬后于4℃保存,并准备装柱。
(5)偶联胶体填充装柱:取容积为5mL空的固相萃取管,垫好孔径为10μm的下筛板,加入1mL结合缓冲液,使其自然流干;堵塞下方出样口,用步骤(4)洗涤的偶联胶体悬液装柱,静置5min,使偶联胶体在重力作用下自然下落,形成均匀的胶床,至胶床高度为1cm;放置孔径为10μm的上筛板,轻缓按压筛板,使其到达偶联胶体上方,防止后续上样冲坏胶床;拔掉出样口的堵塞,以1mL/min的速度将5mL结合缓冲液缓慢注入亲和柱中;堵塞下方出样口,加入3mL结合缓冲液,并堵塞上方进样口,于4℃冰箱保存备用。
实施例3
一种特异性识别的T-2毒素的适配体亲和柱,所述适配体亲和柱的制备包括以下步骤:
(1)链霉亲和素琼脂糖凝胶的活化:取1mL质量浓度为1mg/mL的链霉亲和素琼脂糖凝胶,用2mL的结合缓冲液(20mM NaH
(2)链霉亲和素琼脂糖凝胶和适配体的偶联:取步骤(1)活化的链霉亲和素琼脂糖凝胶1mL,加入2mL浓度为2μM的适配体溶液,并于25℃下置于孵化器中孵育10min即得偶联产物;
(3)封闭:用2mL的结合缓冲液洗涤步骤(2)制备的偶联产物,重复洗涤5次,然后加入2mL 2%的牛血清蛋白(BSA)溶液,25℃震荡反应12h,以封闭剩余活性基团,得到链霉亲和素琼脂糖凝胶与适配体的偶联胶体;
(4)洗涤:将步骤(3)所得到的偶联胶体用结合缓冲溶液和甘氨酸-盐酸缓冲液(100mM,pH 3.0)先后交替洗涤5次,每次洗涤所用的结合缓冲液和甘氨酸-盐酸缓冲液的量为2mL,以除去未偶联的适配体及剩余的BSA溶液;洗涤后的偶联胶体用2mL的结合缓冲溶液重悬后于4℃保存,并准备装柱。
(5)偶联胶体填充装柱:取容积为5mL空的固相萃取管,垫好孔径为10μm的下筛板,加入1mL结合缓冲液,使其自然流干;堵塞下方出样口,用步骤(4)洗涤的偶联胶体悬液装柱,静置5min,使偶联胶体在重力作用下自然下落,形成均匀的胶床,至胶床高度为1cm;放置孔径为10μm的上筛板,轻缓按压筛板,使其到达偶联胶体上方,防止后续上样冲坏胶床;拔掉出样口的堵塞,以1mL/min的速度将5mL结合缓冲液缓慢注入亲和柱中;堵塞下方出样口,加入3mL结合缓冲液,并堵塞上方进样口,于4℃冰箱保存备用。
测试例:
利用本申请实施例1制备的T-2毒素适配体亲和柱纯化和检测坚果样品(巴旦木)中的T-2毒素。通过向正常购买的巴旦木样品中定量加入不同浓度的T-2毒素标准品,然后用本申请实施例1制备的T-2毒素适配体亲和柱进行净化后,用超高效液相色谱-荧光检测器检测,测定加标回收率,并验证亲和柱效能。
具体步骤如下:
(1)样品处理
将巴旦木样品粉碎,然后分别按照每kg巴旦木样品0.5μg、5μg、50μg的标准向巴旦木样品中分别加入T-2毒素标准品,得到不同加标量的巴旦木样品。
(2)称取5g加标后的巴旦木试样(精确到0.01g)置于50mL塑料离心管中,加入25mLPBS溶液(137mM NaCl,2.7mM KCl,10mM Na
(3)将本申请实施例1制备的T-2毒素适配体亲和柱与10mL玻璃注射器连接,准确移取50mL提取液B,以每秒1~2滴的流速全部通过亲和柱,直至空气流经亲和柱;然后将20mL PBS溶液以每秒1~2滴的流速通过亲和柱,直至空气流经亲和柱;之后准确移取5mL提取液A以每秒1~2滴的速度全部通过亲和柱,直至空气流经亲和柱;再将20mL超纯水以每秒1~2滴的流速淋洗柱子,直至空气流经亲和柱,弃去全部流出液。将1.5mL甲醇以每秒1滴的流速洗脱亲和柱,将洗脱液收集于玻璃试管中,当甲醇大部分过柱后,不要完全过柱,停止加压,静置5min,再将1.5mL甲醇以每秒1滴的流速洗脱亲和柱,将全部洗脱液收集于同一玻璃试管中。
(4)将上述收集于玻璃试管中的洗脱液用50℃下氮气吹干,加入0.5mL水-乙腈(体积比1:1),在涡旋振荡器涡旋混合2min,过0.22μm有机滤膜,收集滤液于进样瓶中以备进样。
(5)步骤(4)收集的滤液用超高效液相色谱-荧光检测器检测,检测结果如下表1所示:
表1
由表1可知,当巴旦木样品经T-2毒素适配体亲和柱后,用超高效液相色谱可以检测到。从检测结果可以看出,本申请实施例1所制备的T-2毒素适配体亲和柱对巴旦木中T-2毒素的加标回收率在78.61%~92.54%之间,RSD为1.2%~2.3%之间。
利用本申请实施例3制备的T-2毒素适配体亲和柱纯化和检测花生中的T-2毒素。通过向购买的花生样品中定量加入T-2毒素标准品,然后用本申请实施例3制备的适配体亲和柱进行净化,最后用超高效液相色谱-荧光检测器检测,测定加标回收率以验证亲和柱效能。
具体步骤如下:
(1)样品处理
粉碎花生样品,分别按照每千克样品0.5μg、5μg、50μg的标准向花生样品中加入T-2毒素标准品。
后续操作同对巴旦木的加标回收率测试中的步骤(2)、(3)、(4)、(5)。
检测结果如下表2所示。
表2
可见,花生样品经T-2毒素适配体亲和柱后,用超高效液相色谱可以检测到。从检测结果可以看出,本申请实施例3所制备的T-2毒素适配体亲和柱回收率在77.49%~93.28%之间,RSD为1.4%~2.4%之间。
本发明制备的T-2毒素适配体亲和柱的特异性测试:
为了验证本申请制备的T-2毒素适配体亲和柱只针对T-2毒素进行截留富集,而不对其他真菌毒素进行截留,以1mL/min的速度分别将0.1μg/mL的DON、ZEN、OTA、AFB
虽然,上文中已经用具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以做一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的修改或改进,均属于本发明要求保护的范围。
SEQUENCE LISTING
<110> 江南大学
<120> 一种特异性识别T-2毒素的适配体亲和柱及其制备方法和应用
<130> 1
<160> 1
<170> PatentIn version 3.3
<210> 1
<211> 80
<212> DNA
<213> 人工序列
<400> 1
cagctcagaa gcttgatcct gtatatcaag catcgcgtgt ttacacatgc gagaggtgaa 60
gactcgaagt cgtgcatctg 80
- 一种特异性识别T-2毒素的适配体亲和柱及其制备方法和应用
- 一种呕吐毒素核酸适配体亲和柱及其制备方法与应用
