一种牙髓干细胞外泌体及其制备方法和应用
文献发布时间:2023-06-19 12:24:27
技术领域
本发明涉及细胞外泌体制备技术领域,具体涉及一种牙髓干细胞外泌体及其制备方法和应用。
背景技术
牙髓间充质细胞(dental pulp stromal cells,DPSCs)从牙髓组织中分离获得,是一种常用的牙源性间充质细胞,在多种组织的修复和再生研究中被应用。DPSCs来源于神经嵴,具有自我更新和多向分化的高增殖潜力。外泌体(Exosomes,Exo)为细胞通过溶酶体微粒内陷形成的小囊泡,内含丰富的活性物质,如蛋白质、脂质、mRNA、miRNA等,可在细胞间的信息交流与物质交换方面发挥作用。近来研究发现DPSCs的外泌体(DPSC-Exo)有多种治疗作用,其在再生医学领域也有一些应用的报道。而细胞生长的微环境对外泌体的分泌有影响,通过调节细胞生长的环境可能起到优化细胞外泌体的成分,改变外泌体的治疗潜能。但是,现目前微环境对外泌体确切的调控作用尚不清楚,通过改变微环境来加强外泌体治疗效果尚不能实际实现。亟需对影响外泌体治疗功能的微环境因素进行研究,以明确具体的微环境因素和外泌体之间的调控关系,从而提升牙髓间充质细胞的应用潜能。
发明内容
本发明意在提供一种牙髓干细胞外泌体的制备方法,以解决采用现有技术方法获得的外泌体治疗的效果有限的技术问题。
为达到上述目的,本发明采用如下技术方案:
一种牙髓干细胞外泌体的制备方法,将牙髓间充质细胞悬液与低熔点琼脂糖溶液混合,获得混合物;所述混合物中的牙髓间充质细胞经过预培养和诱导培养,获得含有外泌体的上清液。
采用上述技术方案的原理以及有益效果:本方案在三维(Three-dimension,3D)条件下培养牙髓间充质细胞,通过将细胞植入到具有三维结构的载体中培养,使细胞能够在三维立体空间结构中生长、增殖、迁移及分化等,进而放大间充质细胞旁分泌效应。在本方案中,通过低熔点琼脂糖形成的三维结构可实现对牙髓间充质细胞的立体培养,并大量分泌形成外泌体,上清液中的外泌体可通过现有的试剂盒提取回收获得。
发明人研究发现,外泌体作为细胞旁分泌重要产物,其所含miRNA会随着牙髓间充质细胞三维培养环境的不同而变化。发明人对三维培养的牙髓间充质细胞的外泌体中的miRNA进行表达谱分析,并与二维培养的牙髓间充质细胞的外泌体中的miRNA进行比较,探索比较两种培养条件下外泌体miRNA差异。研究发现,三维培养会影响牙髓间充质细胞的外泌体的miRNA表达谱,三维和二维培养相比较,有60个表达量显著差异的miRNA。表达量显著上调的miRNA包括miR-302a/b/c/d家族和miR-24-3p等。miR-302a/b/c/d家族能够通过双调控细胞周期和凋亡途径来调控hESC(人胚胎干细胞)自我更新,是一类在干细胞发育、增殖、分化等方面都有显著作用的miRNA。其可靶向FGF19与EGFR发挥组织再生与修复功能。FGF19与脂质、葡萄糖等多种代谢途径相关,而人体中EGF与TGFa为EGFR最重要的两种配体,发挥着细胞增殖、血管生成、抑制凋亡等生理功能。miR-24-3p作为一个表观遗传调控因子,在血管内皮细胞的增殖、凋亡、炎性反应等方面均可发挥调节作用,是已被广泛深入研究的miRNA之一。
综上所述,三维培养牙髓间充质细胞,可以使得外泌体中的特定miRNA的表达量增加,这些特定的miRNA包括miR-302a/b/c/d家族和miR-24-3p等已知的miRNA,这些已知的miRNA具有调控干细胞的发育、增殖和分化等能力。因此,使用三维培养牙髓间充质细胞获得的外泌体具有较为显著的治疗应用潜能,可以提高牙髓间充质细胞的外泌体的治疗效能。
进一步,牙髓间充质细胞悬液与低熔点琼脂糖溶液的体积比为1:1。
采用上述技术方案,上述的混合比例有助于制造一个利于将牙髓间充质细胞立体生长的环境。低熔点琼脂糖是一种自然发生的生物相容性多糖,它便宜,无毒,具有多孔性、亲水性及良好的生物降解性,对哺乳动物细胞的粘附和降解是惰性的低熔点琼脂糖形成的凝胶对细胞没有伤害,在其中生长的牙髓细胞可保持极高的存活率。低熔点琼脂糖凝胶最终的结构趋于各向同性,平均孔隙度约为100-300mm,适合于作为三维培养细胞的支架。
进一步,所述低熔点琼脂糖溶液中低熔点琼脂糖的质量分数为1.5%。
采用上述技术方案,上述浓度的低熔点琼脂糖可获得适宜的孔隙度,为细胞生长提供三维支架。在本方案中,1.5%低熔点琼脂糖加热到约65℃熔化,其凝胶温度在26℃-30℃左右。待熔化的琼脂糖温度降至40℃左右时细胞悬液与琼脂糖迅速混匀,接种至孔板后均静置半小时,保证其充分凝胶,细胞嵌入孔隙生长,然后再加入培养基。
进一步,所述牙髓间充质细胞悬液中牙髓间充质细胞的浓度为10
采用上述技术方案,10
进一步,所述预培养的方法如下:待所述混合物结胶后,加入含有胎牛血清的α-MEM培养基,然后培养2-3天。
采用上述技术方案,通过预培养,使得细胞充分增殖并维持良好状态,以备后续的外泌体分泌。
进一步,所述诱导培养的方法如下:预培养结束后,将含有胎牛血清的α-MEM培养基替换为不含胎牛血清的α-MEM培养基,然后培养24-48h,收集上清。
采用上述技术方案,先后用带有血清和不带有血清的培养基培养细胞,一是可以刺激细胞释放外泌体,二是排除血清中本身存在的外泌体。
进一步,所述牙髓间充质细胞悬液中含有P3-P6代牙髓间充质细胞。
采用上述技术方案,P3-P6代牙髓间充质细胞具有良好的增殖活性和分泌功能,适合于作为分泌和制备外泌体的细胞。
进一步,一种由上述制备方法所制备的外泌体。
采用上述技术方案,使用三维培养的方法获得的外泌体,在miRNA表达谱上和二维培养所获得的外泌体存在显著差别,为优化牙髓间充质细胞外泌体的生物功效提供了一条有效途径。
进一步,在所述外泌体中,hsa-miR-302a-3p、hsa-miR-302b-3p、hsa-miR-302c-3p、hsa-miR-302d-3p、hsa-miR-24-3p、hsa-miR-27b-3p、hsa-miR-34a-5p和hsa-miR-100-5p的含量上调。
采用上述技术方案,miR-302a/b/c/d-3p具有靶向FGF19与EGFR的功能,发挥组织再生与修复功能的能力,为本方案获得的外泌体在再生修复相关领域的发挥作用奠定了基础。
进一步,外泌体在制备组织再生修复材料中的应用。
采用上述技术方案,外泌体作为细胞分泌囊泡中的一类功能成分,避免了直接应用细胞的弊端,具有较高的研究和临床转换价值。本方案的外泌体利用三维培养技术制作,外泌体中含有大量的与调控干细胞的发育、增殖和分化调控相关的miRNA。这些上调表达的miRNA主要富集在代谢、肿瘤、Hippo与自噬等相关通路,从而起到促进组织修复再生的治疗作用。
附图说明
图1为本发明实施例1的二维培养条件下DPSCs的倒置显微镜图像。
图2为本发明实施例1的三维培养条件下DPSCs的倒置显微镜图像。
图3为本发明实施例2的二维培养的外泌体的透射电镜图像。
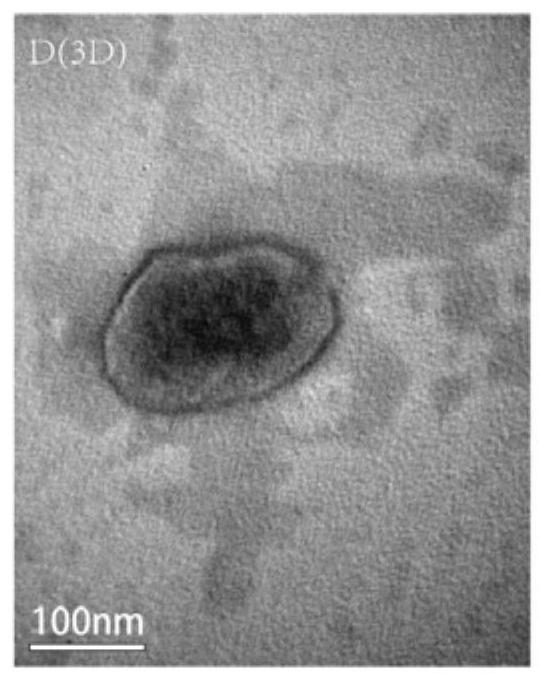
图4为本发明实施例2的三维培养的外泌体的透射电镜图像。
图5为本发明实施例2的二维和三维培养的外泌体的WB检测结果
图6为本发明实施例2的二维培养的外泌体的NTA检测结果。
图7为本发明实施例2的三维培养的外泌体的NTA检测结果。
图8为本发明实施例3的表达量韦恩图。
图9为本发明实施例3的差异基因数量统计。
图10为本发明实施例3的显著差异表达miRNA聚类热图。
图11为本发明实施例3的显著差异表达miRNA靶基因的GO注释分类。
图12为本发明实施例3的显著差异表达miRNA靶基因的GO富集情况。
图13为本发明实施例3的显著差异表达miRNA靶基因KEGG Pathway分析结果。
具体实施方式
下面结合实施例对本发明做进一步详细的说明,但本发明的实施方式不限于此。若未特别指明,下述实施例所用的技术手段为本领域技术人员所熟知的常规手段;所用的实验方法均为常规方法;所用的材料、试剂等,均可从商业途径得到。本方案用到的主要试剂和仪器如下:
α-MEM细胞培养基(Hyclone,美国);培养皿、孔板(Corning,美国);0.22μm注射式过滤器、超滤管(Millipore,美国);低熔点琼脂糖(Sigma,美国);exoEasy Maxi Kit试剂盒(Qiagen,德国);BCA试剂盒、增强化学发光试剂(Beyotime,中国);兔抗人CD63,CD9抗体(BioWorld,中国);Goat Anti-rabbit IgG/HRP抗体(ThermoFisher,美国);显影仪(Bio-Rad,美国);倒置显微镜(Nikon,日本);纳米颗粒追踪分析仪(ZetaView,德国)。
实施例1:牙髓间充质细胞(DPSCs)三维和二维培养
DPSCs的来源:收集因正畸拔除的健康前磨牙,从釉牙骨质界将牙齿截断,在超净台里取出牙髓,改良酶消化法分离培养DPSCs,经传代培养取第三代细胞进行以下实验(实际操作时,可选择P3-P6代,均能获得理想效果)。本方案使用的DPSCs取自正常成人的健康前磨牙,方案只涉及DPSCs的培养以及外泌体的获取,不涉及收集前磨牙时的牙科手术等过程。更具体的DPSCs获取方法如下:
收集口腔颌面外科门诊因正畸拔除的健康前磨牙,置于含双抗的α-MEM培养基中,冰上转移保存。其中,纳入标准和排除标准如下:
纳入标准:12-20岁之间;身体健康无全身疾病;健康无龋;牙根发育完成。
排除标准:有严重全身疾病;存在龋坏或牙髓根尖周病变;已行根管治疗;牙根严重吸收者。
获取健康前磨牙后,用高速手机磨除釉牙骨质界处牙体组织,勿漏髓,转移至超净台内,将牙齿截断,拔髓针取出牙髓置于PBS中,小剪刀剪碎组织,1000rpm,5min离心,弃PBS,加入I型胶原酶。37℃恒温消化50分钟左右,每5分钟上下颠倒数次,使其混合均匀。温浴结束后离心,弃胶原酶,加α-MEM培养基混合均匀,再次离心。保留沉淀,加入少量培养基重悬,吸取组织均匀铺于t25培养瓶底部,翻转后正面加入培养基,24h左右翻瓶,根据细胞状态每3天换液。按照上述方法可获得供后续三维培养用的DPSCs。
二维培养:取第三代生长状态良好的细胞接种到培养皿,当细胞融合率达到80%左右时,换不含血清的α-MEM培养基培养24h,收集上清,离心去除沉淀,0.22μm注射式过滤器过滤后置于-80℃保存。二维培养条件下DPSCs贴壁生长,呈长梭状的成纤维细胞样结构(图1)。
三维培养:第三代生长状态良好的DPSCs,将含有6×10
实施例2:外泌体的提取和鉴定
采用exoEasy Maxi Kit试剂盒提取外泌体。将收集的上清液4℃解冻,使用超滤管浓缩,按试剂盒说明书要求,依次加XBP,XWP,离心,弃滤液,最后加XE洗脱重悬,即为外泌体溶液。对三维培养和二维培养的上清液均进行外泌体的提取,并对获得的三维培养外泌体和二维培养外泌体进行鉴定。
透射电镜观察外泌体形态:
取新鲜提取的三维培养和二维培养条件下DPSC-Exo悬液20ul滴于铜网上,10分钟后加10μl2%的醋酸双氧铀于铜网上1min,清洗,室温干燥,样品上机,透射电镜下观察拍照。电镜结果显示二维与三维培养的外泌体均呈典型的茶托状双层膜结构(图3和图4)。
蛋白免疫印迹法检测外泌体的标记蛋白CD63,CD9:
提取外泌体蛋白,采用BCA试剂盒检测蛋白浓度,5×蛋白上样缓冲液混匀后变性10分钟。凝胶电泳,转膜,根据说明书稀释兔抗人CD63,CD9抗体,4℃孵育过夜,室温下孵二抗1h。洗膜后加入增强化学发光试剂显影。WB检测结果显示经二维和三维培养获得的外泌体均表达CD63、CD9膜蛋白标记物(图5)。
纳米颗粒追踪分析(Nanoparticle Tracking Analysis,NTA):
该检测由重庆荣达生物技术有限公司合作完成。取新鲜提取的三维培养和二维培养外泌体50μl准备检测:1)以去离子水清洗样本池;2)仪器以聚苯乙烯微球(110nm)校准;3)以1×PBS buffer(Biological Industries,Israel)清洗样本池;4)样本以1×PBSbuffer稀释后进样检测。每个样本重复检测三次。NTA检测结果显示,二维培养和三维培养获得的外泌体的粒径值在30-150nm之间(图6和图7),符合外泌体特征。
实施例3:外泌体的miRNA分析
本实验二维和三维培养的外泌体的miRNA高通量测序由武汉华大医学检验所有限公司合作完成,使用BGISEQ-500进行样本测序。采用BCA法进行外泌体蛋白浓度校正,然后进行文库构建。文库构建具体流程为:1)总RNA分离,连接5’端和3’端;2)去接头后cDNA合成;3)cDNA扩增,分离目的片段;4)文库定量及pooling环化;5)质量检测,上机测序。通过对测序所得原始数据去接头、去低质量、去污染等得到可信的备用分析的目标序列,对其进行统计分析。
应用华大基因旗下Dr.Tom平台,对miRNA表达谱进行了统计分析,对差异倍数取对数,设置当[(︱log
microRNA差异表达情况:
针对二维和三维培养获得的外泌体,共检测出253个miRNA,其中三维组检测出222个,表达量前五的miRNA分别为hsa-miR-34a-5p,hsa-let-7g-5p,hsa-let-7a-5p,hsa-miR-302b-3p及hsa-miR-100-5p。二维组检测出154个,表达量最高的为let-7家族及hsa-miR-34a-5p。二维和三维培养获得的外泌体共同表达123个,三维培养获得的外泌体特有表达99个(图8),其中显著差异表达miRNA 60个。与二维培养相比,三维培养上调27个,下调33个[︱log
表1:部分上调差异miRNA(差异倍数[log
hsa-miR-302a-3p的序列为:5’-UAAGUGCUUCCAUGUUUUGGUGA-3’,SEQ ID NO.1;
hsa-miR-302b-3p的序列为:5’-UAAGUGCUUCCAUGUUUUAGUAG-3’,SEQ ID NO.2;
hsa-miR-302c-3p的序列为:5’-UAAGUGCUUCCAUGUUUCAGUGG-3’,SEQ ID NO.3;
hsa-miR-302d-3p的序列为:5’-UAAGUGCUUCCAUGUUUGAGUGU-3’,SEQ ID NO.4;
hsa-miR-24-3p的序列为:5’-UGGCUCAGUUCAGCAGGAACAG-3’,SEQ ID NO.5;
hsa-miR-27b-3p的序列为:5’-UUCACAGUGGCUAAGUUCUGC-3’,SEQ ID NO.6;
hsa-miR-34a-5p的序列为:5’-UGGCAGUGUCUUAGCUGGUUGU-3’,SEQ ID NO.7;
hsa-miR-100-5p的序列为:5’-AACCCGUAGAUCCGAACUUGUG-3’,SEQ ID NO.8;
根据表1和图10的结果,miR-302a/b/c/d家族能够通过双调控细胞周期和凋亡途径来调控hESC自我更新,是一类在干细胞发育、增殖、分化等方面都有显著作用的miRNA(Gao Z,Zhu X,Dou Y.The miR-302/367cluster:a comprehensive update on itsevolution and functions.[J].Open Biol,2015,5:150138;Zhang ZH,Hong YF,Xiang D,et al.MicroRNA-302/367cluster governs hESC self-renewal by dually regulatingcell cycle and apoptosis pathways[J].Stem Cell Reports,2015,4(4):645-57.)。本研究发现miR-302a/b/c/d在三维培养下表达量均显著增高,其可靶向FGF19与EGFR发挥组织再生与修复功能。FGF19与脂质、葡萄糖等多种代谢途径相关,而人体中EGF与TGFa为EGFR最重要的两种配体,发挥着细胞增殖、血管生成、抑制凋亡等生理功能(Herbst RS.Reviewof epidermal growth factor receptor biology[J].Int J Radiat Oncol Biol Phys,2004,59:21-6.)。miR-302家族在肿瘤疾病中也具有重要的调控作用,有研究报道外泌体来源的miR-302b可通过TGFβRII/ERK途径抑制肺癌细胞的增殖和迁移,为人类肺癌治疗提供潜在靶点(Li JY,Yu J,Zhang HM,et al.Exosomes-Derived MiR-302b Suppresses LungCancer Cell Proliferation and Migration via TGFβRII Inhibition[J].CellPhysiol Biochem,2016,38(5):1715-26.)。综上表明,miR-302家族具有干细胞特性及肿瘤抑制因子特性,三维培养可优化DPSCs外泌体miR-302a/b/c/d表达。
另外,miR-24-3p作为一个表观遗传调控因子,在血管内皮细胞的增殖、凋亡、炎性反应等方面均可发挥调节作用(Chen W,Ou HS.Regulation of miR-24on vascularendothelial cell function and its role in the development of cardiovasculardisease[J].Sheng Li Xue Bao,2016,68(02):201-6.),是已被广泛深入研究的miRNA之一。靶基因预测显示,其可靶向多个mRNA发挥组织再生功能,如与神经再生相关的NEUROD2、NET1、NEUROD1和NREP;与血管再生、细胞迁移生长等相关的FGF11、FGFBP3、FGFR3、PDGFRA、ANGPT4、IGFBP5等。本研究中,三维培养DPSCs的外泌体表达量显著增加,表明三维培养模式可有效提高miR-24-3p的表达,为其在再生修复相关领域的深入研究中奠定基础。
靶基因预测:
根据TargetScan靶基因预测数据库,对差异倍数最大的两个miRNA进行再生修复有关的靶基因预测:has-miR-302的候选靶基因有FGF19(fibroblast growth factor 19)、EGFR(epidermal growth factor receptor)等;hsa-miR-24-3p的候选靶基因包括神经再生相关:NEUROD2(neuronal differentiation 2)NET1(neuroepithelial celltransforming 1)、NEUROD1(neuronal differentiation 1)、NREP(neuronalregeneration related protein);血管再生、细胞迁移生长等相关:FGF11(fibroblastgrowth factor 11)、FGFBP3(fibroblast growth factor binding protein 3)、FGFR3(fibroblast growth factor receptor 3)、PDGFRB(platelet-derived growth factorreceptor,beta polypeptide)、PDGFRA(platelet-derived growth factor receptor,alpha polypeptide)、ANGPT4(angiopoietin 4)、IGFBP5(insulin-like growth factorbinding protein 5)等。
Gene Ontology(GO)分析:
差异miRNA靶基因主要参与的生物学过程包括cellular process、biologicalregulation等;主要涉及的分子功能为binding;且这些差异基因大多属于cell part成分(图11),分别在regulation of transcription by RNA polymerase II;proteinbinding;membrane出现显著性GO富集(图12)。图11为二维与三维培养获得的外泌体的显著差异表达miRNA靶基因的GO注释分类,其中,X轴代表GO功能分类,Y轴代表注释到GO条目上的基因数目。图12为二维与三维培养获得的外泌体的显著差异表达miRNA靶基因的GO富集情况(Qvalue≤0.05),其中,X轴为富集比例,Y轴为GOTerm,气泡的大小表示注释到某个GOTerm上的差异基因数目,颜色越蓝代表显著性值越小。
KEGG信号通路富集分析:
前20条通路中Metabolic pathways通路的富集程度最高,且所含靶基因数目最多,为1610个;其次为Pathways in cancer通路,含靶基因632个,在Hippo signalingpathway、Autophagy等通路上也存在显著富集(图13)。图13展示了二维与三维培养获得的外泌体的显著差异表达miRNA靶基因KEGG Pathway分析(Qvalue≤0.05)结果,其中X轴是富集比例及靶基因数目,Y轴为KEGG Pathway(前20),显示在metabolic pathways上富集程度最高,靶基因数目最多。KEGG通路富集分析显示差异miRNA的靶基因富集于多个通路,具有一定研究前景。其中最显著的为Metabolic pathways,所含靶基因数目最多。其在次生代谢物的生物合成,嘌呤代谢通路上也存在富集作用,这可能与细胞在二维与三维不同生长环境有关。三维条件下,细胞成球形生长,增殖缓慢,部分miRNA表达显著增高,如上述miR-302,miR-24-3p等;同时,显著差异miRNA靶基因在癌症通路也存在富集作用,如miR-27b-3p与多种肿瘤的发生发展有关;差异miRNA在Hippo信号通路、自噬等通路上同样存在富集。Hippo信号通路在器官大小、癌症发生、组织再生等功能上均有重要作用;而自噬是一种细胞保护机制,也是近年来得研究热点之一。miR-34a-5p与miR-100-5p在2D及3D中表达量均较高,多项研究已证明它们在炎症抑制方面具有显著作用,且与自噬相关。miR-34a-5p与miR-100-5p在一些炎症疾病的治疗中可能发挥一定的作用。
以上所述的仅是本发明的实施例,方案中公知的具体技术方案和/或特性等常识在此未作过多描述。应当指出,对于本领域的技术人员来说,在不脱离本发明技术方案的前提下,还可以作出若干变形和改进,这些也应该视为本发明的保护范围,这些都不会影响本发明实施的效果和专利的实用性。本申请要求的保护范围应当以其权利要求的内容为准,说明书中的具体实施方式等记载可以用于解释权利要求的内容。
SEQUENCE LISTING
<110>重庆医科大学口腔附属医院
<120>一种牙髓干细胞外泌体及其制备方法和应用
<130>2021.5.19
<160>8
<170>PatentIn version 3.5
<210>1
<211>23
<212>RNA
<213>Homo sapiens
<400>1
uaagugcuuc cauguuuugg uga 23
<210>2
<211>23
<212>RNA
<213>Homo sapiens
<400>2
uaagugcuuc cauguuuuag uag 23
<210>3
<211>23
<212>RNA
<213>Homo sapiens
<400>3
uaagugcuuc cauguuucag ugg 23
<210>4
<211>23
<212>RNA
<213>Homo sapiens
<400>4
uaagugcuuc cauguuugag ugu 23
<210>5
<211>22
<212>RNA
<213>Homo sapiens
<400>5
uggcucaguu cagcaggaac ag 22
<210>6
<211>21
<212>RNA
<213>Homo sapiens
<400>6
uucacagugg cuaaguucug c 21
<210>7
<211>22
<212>RNA
<213>Homo sapiens
<400>7
uggcaguguc uuagcugguu gu 22
<210>8
<211>22
<212>RNA
<213>Homo sapiens
<400>8
aacccguaga uccgaacuug ug 22
SEQUENCE LISTING
<110> 重庆医科大学口腔附属医院
<120> 一种牙髓干细胞外泌体及其制备方法和应用
<130> 2021.5.19
<160> 8
<170> PatentIn version 3.5
<210> 1
<211> 23
<212> RNA
<213> Homo sapiens
<400> 1
uaagugcuuc cauguuuugg uga 23
<210> 2
<211> 23
<212> RNA
<213> Homo sapiens
<400> 2
uaagugcuuc cauguuuuag uag 23
<210> 3
<211> 23
<212> RNA
<213> Homo sapiens
<400> 3
uaagugcuuc cauguuucag ugg 23
<210> 4
<211> 23
<212> RNA
<213> Homo sapiens
<400> 4
uaagugcuuc cauguuugag ugu 23
<210> 5
<211> 22
<212> RNA
<213> Homo sapiens
<400> 5
uggcucaguu cagcaggaac ag 22
<210> 6
<211> 21
<212> RNA
<213> Homo sapiens
<400> 6
uucacagugg cuaaguucug c 21
<210> 7
<211> 22
<212> RNA
<213> Homo sapiens
<400> 7
uggcaguguc uuagcugguu gu 22
<210> 8
<211> 22
<212> RNA
<213> Homo sapiens
<400> 8
aacccguaga uccgaacuug ug 22
- 一种牙髓干细胞外泌体及其制备方法和应用
- 牙髓干细胞外泌体制剂及制备方法和应用
