一种L-苏氨酸醛缩酶突变体及其应用
文献发布时间:2023-06-19 12:27:31
本申请是“一种L-苏氨酸醛缩酶突变体、基因及制备L-syn-对甲砜基苯丝氨酸的方法”的分案申请,原申请的申请日为2020年1月17日,申请号为2020100508531。
技术领域
本发明涉及酶工程技术领域,特别是涉及一种L-苏氨酸醛缩酶突变体、基因及制备L-syn-对甲砜基苯丝氨酸的方法。
背景技术
L-syn-对甲砜基苯丝氨酸是一种重要的医药中间体,应用于多种抗生素的合成。对甲砜基苯丝氨酸有两个手性中心,具有四种异构体,分别是:L-syn-对甲砜基苯丝氨酸,L-anti-对甲砜基苯丝氨酸,D-syn-对甲砜基苯丝氨酸,D-anti-对甲砜基苯丝氨酸(图1)。
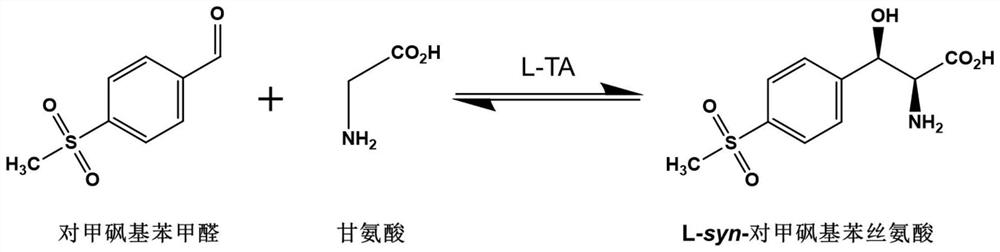
目前,L-syn-对甲砜基苯丝氨酸主要有两种生产方法。一种是化学法合成,使用硫酸铜为催化剂,利用金属离子的络合作用,对甲砜基苯甲醛和甘氨酸选择性反应生成两种顺式的产物:L-syn-对甲砜基苯丝氨酸铜和D-syn-对甲砜基苯丝氨酸铜,酸不能直接进行拆分,只能继续和乙醇进行酯化反应,生成外消旋的D,L-syn-对甲砜基苯丝氨酸乙酯,再进行手性拆分,实现D型和L型异构体的分离,从而制得光学纯的L-syn-对甲砜基苯丝氨酸乙酯。此工艺主要存在以下缺点:理论收率只有50%、无效对映体难套用、工艺比较复杂。同时需要使用等摩尔量手性拆分试剂、单次拆分收率低、拆分试剂的回用和反应中的铜盐会产生大量的废水和废盐。另一种是将化学法和生物法结合,主要过程是先利用对甲砜基苯甲醛和甘氨酸在硫酸铜的催化作用下生成消旋的对甲砜基苯丝氨酸铜盐,主要产物是L-syn-对甲砜基苯丝氨酸铜和D-syn-对甲砜基苯丝氨酸铜(图2)。除去产品中的铜离子生成L-syn-对甲砜基苯丝氨酸和D-syn-对甲砜基苯丝氨酸混合物。再使用D-苏氨酸醛缩酶分解D-syn-对甲砜基苯丝氨酸达到拆分的目的,得到光学纯的L-syn-对甲砜基苯丝氨酸。此工艺存在以下缺点:生产工艺复杂,原子利用率不高,理论收率只能达到50%、同样也会产生铜盐环境污染问题。
相比之下,使用L-苏氨酸醛缩酶突变体催化对甲砜基苯甲醛和甘氨酸直接生成L-syn-对甲砜基苯丝氨酸(图3),具有以下优点:
1、生产工艺简单,反应条件温和;
2、L-苏氨酸醛缩酶的选择性高,产品光学纯度高;
3、无需拆分,原子利用率高,理论可达100%;
4、生产过程环保,污染较小,符合绿色化学理念;
5、下游分离纯化工艺简单。
利用L-苏氨酸醛缩酶催化合成L-syn-对甲砜基苯丝氨酸的关键在于获得能够高选择性合成L-syn-对甲砜基苯丝氨酸的酶。目前报道的L-苏氨酸醛缩酶对α-碳具有较高的选择性,ee(%)>99%。而对β-碳的选择性不高,de(%)在20-50%之间,产生L-syn-对甲砜基苯丝氨酸和L-anti-对甲砜基苯丝氨酸的混合物。因此目前没有直接应用L-苏氨酸醛缩酶合成高手性纯度L-syn-对甲砜基苯丝氨酸的研究报道。
发明内容
本发明针对现有L-syn-对甲砜基苯丝氨酸合成工艺存在的缺陷,提供了一种利用L-苏氨酸醛缩酶突变体制备L-syn-对甲砜基苯丝氨酸的方法,该方法原料利用率高,且可循环利用。产物易于分离提纯且转化率、收率及手性纯度高;与化学催化工艺相比,工艺简单,污染小。
一种L-苏氨酸醛缩酶突变体,由登录号分别为WP_015261381.1、SIS82838.1、WP_016204489.1、WP_023973138.1、WP_077361571.1或WP_069998496.1的野生型L-苏氨酸醛缩酶突变所得,具体为以下突变中的一种:
(1)由登录号为WP_015261381.1的野生型L-苏氨酸醛缩酶突变所得,突变位点为以下一种:5F、5W、8H、8F、31H、31M、125K、125V、143K、143R、227R、252F、252H、305R、305K、307H、307R、308H、308K、5F/8H/31H/125V、5F/8H/31H/305R、31H/125V/227R/305R、5F/8H/31H/125V、5F/125V/227R/E305R、8H/31H/125V/227R、8H/31H/143R/305R、5F/8H/31H/125V/227R/E305K、5F/8H/Y31M/125V/227R/305R、5W/8H/31H/125V/227R/305R、5F/8F/31H/125K/227R/E305R、8H/31H/125V/143R/252F/305R、5F/8H/31H/125V/143K/305R/307R、8F/31H/125V/143R/227R/305R/307H、8F/31H/125V/143R/252F/305R/308H、8F/31M/125V/143R/252F/305R/308K;
(2)由登录号为SIS82838.1的野生型L-苏氨酸醛缩酶突变所得,突变位点为以下一种:18F、18W、21H、21F、44H、44M、138K、138V、157K、157R、241R、241F、266H、319R、319K、321H、321R、322H、322K、18F/21H/44H/138V、18F/21H/44/319R、44H/138V/241R/319R、18F/21H/44H/138V、18F/138V/241R/319R、21H/44H/138V/241R、21H/44H/157R/319R、13F/21H/44H/138V/241R/319K、13F/21H/44M/138V/241R/319R、13W/21H/44H/138V/241R/319R、13F/21F/44H/138K/241R/319R、21H/31H/138V/157R/266F/319R、13F/21H/44H/138V/143K/319R/322R、21F/44H/138V/157R/241R/319/322H、21F/44H/138V/157R/266F/319/323H、21F/44M/138V/157R/266F/319R/323K;
(3)由登录号为WP_016204489.1的野生型L-苏氨酸醛缩酶突变所得,突变位点为以下一种:5F、5W、8H、8F、31H、31M、125K、125V、143K、143R、227R、252F、252H、305R、305K、307H、307R、308H、308K、5F/8H/31H/125V、5F/8H/31H/305R、31H/125V/227R/305R、5F/8H/31H/125V、5F/125V/227R/E305R、8H/31H/125V/227R、8H/31H/143R/305R、5F/8H/31H/125V/227R/E305K、5F/8H/Y31M/125V/227R/305R、5W/8H/31H/125V/227R/305R、5F/8F/31H/125K/227R/E305R、8H/31H/125V/143R/252F/305R、5F/8H/31H/125V/143K/305R/307R、8F/31H/125V/143R/227R/305R/307H、8F/31H/125V/143R/252F/305R/308H、8F/31M/125V/143R/252F/305R/308K;
(4)由登录号为WP_023973138.1的野生型L-苏氨酸醛缩酶突变所得,突变位点为以下一种:5F、5W、8H、8F、31H、31M、125K、125V、143K、143R、227R、252F、252H、305R、305K、307H、307R、308H、308K、5F/8H/31H/125V、5F/8H/31H/305R、31H/125V/227R/305R、5F/8H/31H/125V、5F/125V/227R/E305R、8H/31H/125V/227R、8H/31H/143R/305R、5F/8H/31H/125V/227R/E305K、5F/8H/Y31M/125V/227R/305R、5W/8H/31H/125V/227R/305R、5F/8F/31H/125K/227R/E305R、8H/31H/125V/143R/252F/305R、5F/8H/31H/125V/143K/305R/307R、8F/31H/125V/143R/227R/305R/307H、8F/31H/125V/143R/252F/305R/308H、8F/31M/125V/143R/252F/305R/308K;
(5)由登录号为WP_077361571.1的野生型L-苏氨酸醛缩酶突变所得,突变位点为以下一种:5F、5W、8H、8F、31H、31M、125K、125V、143K、143R、227R、252F、252H、305R、305K、307H、307R、308H、308K、5F/8H/31H/125V、5F/8H/31H/305R、31H/125V/227R/305R、5F/8H/31H/125V、5F/125V/227R/E305R、8H/31H/125V/227R、8H/31H/143R/305R、5F/8H/31H/125V/227R/E305K、5F/8H/Y31M/125V/227R/305R、5W/8H/31H/125V/227R/305R、5F/8F/31H/125K/227R/E305R、8H/31H/125V/143R/252F/305R、5F/8H/31H/125V/143K/305R/307R、8F/31H/125V/143R/227R/305R/307H、8F/31H/125V/143R/252F/305R/308H、8F/31M/125V/143R/252F/305R/308K;
(6)由登录号为WP_069998496.1的野生型L-苏氨酸醛缩酶突变所得,突变位点为以下一种:5F、5W、8H、8F、31H、31M、125K、125V、143K、143R、227R、252F、252H、305R、305K、307H、307R、308H、308K、5F/8H/31H/125V、5F/8H/31H/305R、31H/125V/227R/305R、5F/8H/31H/125V、5F/125V/227R/E305R、8H/31H/125V/227R、8H/31H/143R/305R、5F/8H/31H/125V/227R/E305K、5F/8H/Y31M/125V/227R/305R、5W/8H/31H/125V/227R/305R、5F/8F/31H/125K/227R/E305R、8H/31H/125V/143R/252F/305R、5F/8H/31H/125V/143K/305R/307R、8F/31H/125V/143R/227R/305R/307H、8F/31H/125V/143R/252F/305R/308H、8F/31M/125V/143R/252F/305R/308K。
本发明又提供了编码所述L-苏氨酸醛缩酶突变体的基因。
本发明又提供了包含所述基因的表达载体。优选的,所述的表达载体为插入有所述基因的pET28a质粒。
本发明又提供了包含所述基因的基因工程菌。
本发明又提供了所述L-苏氨酸醛缩酶突变体、所述基因或所述基因工程菌中的一种在制备L-syn-对甲砜基苯丝氨酸中的应用。
本发明还提供了一种制备L-syn-对甲砜基苯丝氨酸的方法,以甘氨酸和对甲砜基苯甲醛为底物,以磷酸吡哆醛为辅酶,利用所述L-苏氨酸醛缩酶突变体或表达所述L-苏氨酸醛缩酶突变体的细胞作为催化剂,缩合反应生成L-syn-对甲砜基苯丝氨酸。表达所述L-苏氨酸醛缩酶突变体的细胞可以是上述包含所述基因的基因工程菌。
优选的,反应在有机溶剂-水混合溶液或水溶液中进行。更优选的,有机溶剂为DMF或DMSO,有机溶剂的添加量为总体积的≤20%。该反应能够在水相中反应,但添加了一些有机溶剂后,能够在一定程度上提高反应的转化率以及de值。
反应体系中,催化剂的使用形式为细胞破碎后的粗酶液,也可以为表达重组酶的工程菌静息细胞,还可以采用纯化后的纯酶,或者是经固定化后的酶。
与现有技术相比,本发明具有以下有益效果:
1、生产工艺简单,反应条件温和;
2、L-苏氨酸醛缩酶的选择性高,产品光学纯度高,无需拆分;
3、原子利用率高,理论可达100%;
4、生产过程环保,污染较小,符合绿色化学理念;
5、产品分离纯化简单。
附图说明
图1为对甲砜基苯丝氨酸四种构型分子结构示意图。
图2为化学合成法合成L-syn-对甲砜基苯丝氨酸的方程式。
图3为生物合成法合成L-syn-对甲砜基苯丝氨酸的方程式。
图4为不同来源苏氨酸醛缩酶序列对比及对应的突变位点图。
图5为底物对甲砜基苯甲醛标样高效液相检测图谱(非手性分析),对甲砜基苯甲醛保留时间为7.439min。
图6为产物对甲砜基苯丝氨酸标样高效液相检测图谱(非手性分析),对甲砜基苯丝氨酸保留时间为2.620min。
图7为L-anti-对甲砜基苯丝氨酸标品液相图谱(手性分析);其中,保留时间为6.333min,
图8为L-syn-对甲砜基苯丝氨酸标品液相图谱(手性分析);其中,保留时间为7.891min。
图9为实施案例4中野生型L-苏氨酸醛缩酶DdLTA反应液(反应结束后)的高效液相检测图谱(手性分析):其中,保留时间:L-anti-对甲砜基苯丝氨酸为6.286min,L-syn-对甲砜基苯丝氨酸为7.436min。
具体实施方式
本发明中的实验方法如无特别说明均为常规方法,基因克隆操作具体可参见J.萨姆布鲁克等编的《分子克隆实验指南》。
上游基因工程操作所用试剂:本发明实施例中使用的限制性内切酶、Primer STARDNA聚合酶、DNA连接酶、重组酶均购自TaKaRa;基因组提取试剂盒、质粒提取试剂盒、DNA回收纯化试剂盒购自Axygen;E.coli BL21(DE3)、质粒等购自Novagen公司;DNA marker、低分子量标准蛋白、琼脂糖电泳试剂购自北京全式金生物技术有限公司;引物合成与基因测序工作由杭州擎科梓熙生物技术有限公司完成。以上试剂使用方法参考商品说明书。
下游催化工艺所用试剂:甘氨酸、对甲砜基苯甲醛、L-syn-对甲砜基苯丝氨酸、磷酸吡哆醛均为市受分析纯。
对甲砜基苯甲醛结构式如式(1)所示;L-syn-对甲砜基苯丝氨酸的结构式如式(2)所示;具体如下:
本发明通过高效液相色谱(HPLC)分析反应液中底物、产物的浓度,监测反应进行。HPLC分析方法如下:
色谱柱型号:QS-C18、5μm、4.6×250mm。流动相:KH
实施例1:野生酶工程菌构建
在National Coalition Building Institute(NCBI)数据库中输入threoninealdolase等关键词检索并挑选编码L-苏氨酸醛缩酶的氨基酸序列WP_015261381.1(来源于Desulfitobacterium dichloroeliminans(DdLTA))、SIS82838.1(来源于Chryseobacterium chaponense(CcLTA))、WP_016204489.1(来源于Bacillus nealsonii(BnLTA))、WP_023973138.1(来源于Clostridium beijerinckii(CbLTA))、WP_077361571.1(来源于Clostridium saccharoperbutylacetonicum(CsLTA))、WP_069998496.1(来源于Cellulosilyticum sp.I15G10I2(CpLTA))。依据大肠杆菌密码子偏好性将六条氨基酸序列转化为核苷酸序列(核苷酸序列如SEQ ID No.1~6所示)。将六条核苷酸序列通过化学法全合成(安徽通用生物),并且整合在表达载体pET-28a的多克隆位点BamH I和Hind III之间。最后将构建的的质粒导入大肠杆菌BL21(DE3)中构建野生L-苏氨酸醛缩酶工程菌。
实施例2:突变酶的构建
一、工程菌的活化及质粒提取
所有工程菌(实施例1中构建获得)均使用LB培养基进行活化与培养,配方为:蛋白胨10g/L,酵母粉5g/L,NaCl 10g/L,用去离子水溶解后定容,115℃灭菌30min,待用。固体培养基为LB培养基加入2%的琼脂。
将保存的工程菌甘油管接入含有10mL LB培养基的试管中,37℃、200rpm培养12h。在获得培养菌体后,根据Axygen质粒提取试剂盒的操作说明书进行质粒提取。所得质粒可直接用于点突变也可置于-20℃长期保存。
二、基因定点突变
基因突变采用全质粒PCR的方法,获得突变基因。图4为不同来源苏氨酸醛缩酶序列对比及对应的突变位点图。
PCR扩增体系:
PCR扩增条件:
1)预变性:98℃5min;
2)变性:98℃30s;退火:60℃30s;延伸:72℃90s;共循环30次;
3)后延伸:72℃10min;
4)4℃保存。
PCR扩增结束后,扩增产物用0.9%琼脂糖凝胶电泳来检测,结果显示扩增产物为单一条带,大小分别为7000bp左右。用DNA回收纯化试剂盒对扩增产物进行纯化回收,具体步骤参照纯化试剂盒说明书。
L-苏氨酸醛缩酶DdLTA第5位赖氨酸突变为苯丙氨酸所需引物:
上游引物:ATGATCAGTTTCTTTAACGATTACAGCGA
下游引物:TCGCTGTAATCGTTAAAGAAACTGATCAT
其他突变位点引物按照该原则设计。
三、突变体工程菌的构建
将纯化后的基因片段使用DpnI消化去除模板然后用重组酶进行重组。将重组产物转化至E.coli BL21(DE3)感受态细胞中,涂平板、挑单菌落至LB液体培养,PCR法鉴定构建成功的阳性转化子,并通过测序验证突变位点的正确性。验证后无误后,加入终浓度为25%的无菌甘油后,编号,置于-80℃保藏备用。
实施例3:菌体的培养及粗酶液的制备
一、菌体的培养
LB液体培养基组成:蛋白胨10g/L,酵母粉5g/L,NaCl 10g/L,用去离子水溶解后定容,115℃灭菌30min,待用。
将含有L-苏氨酸醛缩酶基因的工程菌在经平皿划线活化后,挑单菌落接种至含50μg/mL卡那霉素的5mL LB液体培养基中,37℃震荡培养12h。按2%的接种量转接至50mL同样含50μg/ml Kan的新鲜LB液体培养基中,37℃震荡培养至OD600达到0.6左右时,加入IPTG至其终浓度为0.5mM,28℃下诱导培养10h。培养结束后,将培养液10000rpm离心10min,弃上清,收集菌体,-80℃超低温冰箱中保存,待用。
二、粗酶液的制备
将培养结束后收集到的菌体,用50mM pH 8.0的磷酸盐缓冲液洗涤菌体两次。之后将菌体重悬于pH 8.0的磷酸盐缓冲液中,400W功率超声破碎30次,每次超声持续3s,间歇7s。将此细胞破碎液12000rpm 4℃离心3min去除沉淀,得到的上清为含重组L-苏氨酸醛缩酶的粗酶液。
实施例4:L-苏氨酸醛缩酶及其突变体在水溶液中制备L-syn-对甲砜基苯丝氨酸
按实施例3的方法培养能够表达L-苏氨酸醛缩酶的工程菌及其突变体并获得粗酶液。定量称取0.1M对甲砜基苯甲醛、1M甘氨酸到1L反应器中,用100mM pH 8.0NaOH-Gly缓冲溶液定容到1L,磷酸吡哆醛的终浓度为1μM,湿菌体浓度为10g/L。通过水浴控制反应温度为30℃,磁力搅拌,反应10min后检测底物和产物的浓度及L-syn-对甲砜基苯丝氨酸de值。
反应结束数据见表1。图9为野生型L-苏氨酸醛缩酶DdLTA反应液(反应结束后)的高效液相检测图谱(手性分析):其中,保留时间:L-anti-对甲砜基苯丝氨酸为6.286min,L-syn-对甲砜基苯丝氨酸为7.436min。
表1L-苏氨酸醛缩酶及其突变体在不同体系中的转化率及de(%)值
实施例5:L-苏氨酸醛缩酶及其突变体在水-DMF溶液中制备L-syn-对甲砜基苯丝氨酸
按实施例3的方法培养能够表达L-苏氨酸醛缩酶的工程菌及其突变体并获得粗酶液。定量称取0.1M对甲砜基苯甲醛、1M甘氨酸到1L反应器中,反应体系中DMF的体积分数为20%,用100mM pH 8.0NaOH-Gly缓冲溶液定容到1L,磷酸吡哆醛的终浓度为1μM,湿菌体浓度为10g/L。通过水浴控制反应温度为30℃,磁力搅拌,反应2h后利用非手性液相色谱检测底物和产物的浓度,同时利用手性柱检测L-syn-对甲砜基苯丝氨酸de值。
反应结束数据如见表1。
实施例6:L-苏氨酸醛缩酶及其突变体在水-DMSO溶液中制备L-syn-对甲砜基苯丝氨酸
按实施例3的方法培养能够表达L-苏氨酸醛缩酶的工程菌及其突变体并获得粗酶液。定量称取0.1M对甲砜基苯甲醛、1M甘氨酸到1L反应器中,反应体系中DMSO的体积分数为20%,用100mM pH 8.0NaOH-Gly缓冲溶液定容到1L,磷酸吡哆醛的终浓度为1mM,湿菌体浓度为10g/L。通过水浴控制反应温度为30℃,磁力搅拌,反应2h后利用非手性液相色谱检测底物和产物的浓度,同时利用手性柱检测L-syn-对甲砜基苯丝氨酸de值。
反应结束数据如见表1。
序列表
<110> 浙江大学
<120> 一种L-苏氨酸醛缩酶突变体及其应用
<160> 8
<170> SIPOSequenceListing 1.0
<210> 1
<211> 1023
<212> DNA
<213> 脱硫二氯杆菌(Desulfitobacterium dichloroeliminans)
<400> 1
atgatcagtt tcaagaacga ttacagcgaa ggtgcccatc cgcgtattct ggaagcactg 60
ctgaaaagta atctgattca ggaacagggt tatggtgaag atagcttttg cctgggtgcc 120
agcgaactgc tgcgcgaacg tctgggcaat aaggatctga ccattcatta tctgaccggc 180
ggtacacagg caaatctggt ggccattagc gcctttctgc gtccgcatga agccgccatt 240
gccgcacaga ccggccatat ttttgtgcat gaaaccggcg ccattgaagc aaccggccat 300
aaagtgctga ccagcgaaag caaagatggt aaactgaccc cggcacagat tcaggaagtt 360
ctgaccgcac ataccgatga acacatggtg aaaccgaaac tggtttatat tagcaatacc 420
accgaagttg gtacagttta tagtaaaagc gaactgcagg cactgagtca gttttgccgt 480
gaaaagaatc tgtatctgtt tatggatggc gcacgcctgg gtagtgccct gtgtagcgaa 540
ggcaatgatc tggatctggc agatctgccg aaactggtgg atgcctttta tattggcggt 600
acaaaaaatg gcgcactgct gggcgaagca ctggtgctgt gtaatgaagc actgaaaccg 660
gattttcgtt atcacatgaa acagaaaggt gcactgctgg ccaaaggccg tgttattggc 720
ctgcagtttc tggaactgtt tcgtgataat ctgtattttg atctggcaat tcatgcaaat 780
accatggcat ataaactgcg tgatgaactg aaagaagcag gtgttaaatt tctggccgaa 840
agtagtagta atcaggtgtt tccgattttt agcgatgcca ttgttgaaca gctgaaagtg 900
aattatcatt ttgaaatctg gggtaaagtg ggcacccaga ccgccattcg cctggttacc 960
agttgggcca cccgtgaaga agccgtggat agctttatgg cagatctgaa aaagattctg 1020
taa 1023
<210> 2
<211> 1074
<212> DNA
<213> 章氏金黄杆菌 (Chryseobacterium chaponense)
<400> 2
atggtgttta gtccgtttct gtttattttt atcaacatga agttcagctt caagaatgat 60
tatgcagaag gttgtcatcc gcgtattctg gaagccctga gcgccaccaa tctggttcag 120
cagaatggct atggcctgga tgattattgt ctgaatgcag aacatctgat tcagaaaaag 180
attaataacc cgcgcgcaaa agtgcatttt gttagcggcg gcacccaggc caatctgatt 240
gtgattagtg catttctgcg tccgcatgaa agcgttgtga gcccggccac cggccatatt 300
tttaccaatg aaagcggcgc cattgaagca accggccata aagtgcatgc agttgaaacc 360
gaagatggca aaattcgtcc ggaagatatt cgcaaagtga ttgatgtgca tcagaataag 420
ccgcatcagg tgaaacagaa actggtttat attagcaata gcaccgaagt tggcaccatc 480
tatagcaaaa aagaactgat tgatctgtac cagttttgcc aggaaaataa tctgtttctg 540
tttgttgatg gtgcccgtct gggccatgca ctgaaagcag aaaccaatga tctgaccctg 600
gaagattttg gcaaatatac cgatgccttt tattggggtg gcaccaaaaa tggcgccctg 660
attggtgaag caattgtgat taataatgag gatctgcagg gcgaatttgg ctttcatctg 720
aaacagaaag gcgccatgct ggcaaaaggc cgcctgctgg gtattcagtt tcaggaactg 780
ctgaaagatg atctgtattt tgatctggcc aatctggcca atcagaaagc catgaaaatt 840
aagaaaagtt ttcaggaaat cggctgccat tttctgagtg aaacctttac caatcagatt 900
tttccgattc tgaataatag ccagattgaa aaactgagtg aaaattttga cttctacgtg 960
tggaaaaaga ttgatgaaga taaaagtgcc gttcgcatta ttaccagttg ggccaccagc 1020
gatgaaattg tggaaaaact gattgcagaa attagtagcc tgcgtaatag ttaa 1074
<210> 3
<211> 1011
<212> DNA
<213> 尼尔森芽孢杆菌(Bacillus nealsonii)
<400> 3
atgtacagtt tcaacaacga ttacagtgaa ggcgcacatc cgcgtattct gcaggcactg 60
gtggaaagca atctgcagca ggaaattggt tatggtcagg atagttttac caataaggcc 120
gccgaagttc tgaaaaccaa aatgaatagc gatgaagttg atgtgcatct gctggttggc 180
ggtacccaga ccaatctgat tgcaattagt gcctttctgc gcccgcatga agcagcaatt 240
gcagccagta ccggtcatat ttttgttcat gaaaccggtg caattgaagc aaccggtcat 300
aaagtgatta ccgttgatgc caaatatggt aaactgaccc cgagtctggt tcagagcgtg 360
ctggatgaac ataccgatga acatatggtg aaaccgaaac tggtttatat tagcaatagt 420
accgaaattg gcaccatcta tagtaaaagc gaactggaac agctgagtca gttttgccag 480
attaataatc tgattttcta catggacggc gcccgcctgg gtagtgccct gtgtgcaaaa 540
gataatgatc tggttctgag tgattttccg aaactgctgg atgcctttta tattggcggc 600
accaaaaatg gtgcactgat gggcgaagcc ctggttatta agaatgatag tctgaaaacc 660
gatttccgtt atcatattaa gcagaaaggt gccatgctgg caaaaggccg cctgctgggt 720
attcagtttt atgaactgtt taaagacgac ctgtttttcg aactggcaga atatgccaat 780
aagatggcag aacgtctgaa tattgccctg gccgaaaaag attatcgttt tctgaccccg 840
tcaagcacca atcaggtgtt tccgattttt agtaatgaaa aaatcaccat gctgcagaaa 900
aattatcagt ttaatatctg ggagaagatc gataaagatc atagtgccat tcgtctggtg 960
accagctggg caaccaaaga agcagaagtt gaagccttta ttaatgaaat t 1011
<210> 4
<211> 1017
<212> DNA
<213> 拜氏梭菌(Clostridium beijerinckii)
<400> 4
atgtacagct ttaagaacga ttacagtgaa ggtgcccata gccgcattct gaatgcactg 60
gttgaaacca atctggaaca gaccgatggt tatggcaccg atcagtatac cgaacgcagt 120
gttaatctgc tgaaaaagaa aattgaccgc gaagatgttg atattcatct gctggttggc 180
ggtacccagg tgaatctgac cgcaattagc gcatttctgc gcccgcatca ggcaaccatt 240
ggcgcagata ccagtcatat taattgtcat gaaaccggcg ccattgaagc aaccggtcat 300
aaagttatta ccatgaaaac caatgacggt aaactgaccc cgaatctgat tcagaatgtg 360
gttgatagtc atagtgatga acatatggtt cagccgaaac tggtttatat tagcaatagc 420
accgaactgg gcaccctgta taccaaagca gaactgattg atctgcgcga ttgttgtaaa 480
cgtaataagc tgctgctgta tctggatggt gcccgtctgg gtagcgcact ggttgccgaa 540
gaaaatgatc tgaccctggc cgatattgca aaactggttg atgcctttta tattggtggt 600
accaaaaatg gtgcactgtt tggcgaagca ctggttattt gcaatgatga actgaaagaa 660
gatttcatct atttcatcaa gcagaaaggt ggtctgctgg caaaaggtcg tctgctgggt 720
attcagtttg aagaactgtt taaagatgac ctgtattttg aactggcaaa acatgcaaat 780
aagatggcac tgatgctgaa aggtgcaatt gtggatgaag aatataaatt tctgaccgaa 840
agttttacca accagcagtt tccgattttt ccgaataatc tgattgaaaa actgagtgaa 900
aagtacagct ttaatatcga acgcgtgatt gatagtaatt ataccgccat tcgcctggtt 960
accagctggg caaccaaaga agaaattgtt ctggaattca ttgaggatct gcatctg 1017
<210> 5
<211> 1020
<212> DNA
<213> 蔗糖丁醇梭菌(Clostridium saccharoperbutylacetonicum)
<400> 5
atgtacagct ttaagaacga ttacagtgaa ggcgcccatg aacgtattct gaatgccctg 60
gttgaaagta attttgaaca gaccgatggc tatggtgaag attatcatac cgaacgcgca 120
gtgcagattc tgaaagataa aattgataac cagaacgttg acattcatct gctggttggc 180
ggcacccagg ttaatctgac cgccattagt gcatttctgc gtccgcatca ggcagcaatt 240
ggtgcagata ccagtcatat taattgccat gaaaccggcg ccattgaagc caccggccat 300
aaagttatta ccgttaaaac cgatgatggt aaactgaccc cgagtctgat tcagaaagtt 360
gtggataccc atcaggatga acacatggtt cagccgaaac tggtgtatat tagcgatagc 420
accgaactgg gcaccctgta taccaaagca gaactgaccg atctgcataa ttgctgcaaa 480
aagaataagc tgctgctgta tctggatggc gcccgcctgg gcgcagcatt aaccgcagaa 540
aagaatgatc tgaccctggc cgatattgca aaactggtgg atgcatttta tattggtggt 600
acaaaaaacg gcgccctgtt tggtgaagca ctggttattt gcaaagatga actgaaagaa 660
gatttccgtt attttatcaa gcagaaaggc ggcctgctgg ccaaaggccg tctgctgggt 720
attcagtttg aagaactgtt taaagatgac ctgtattttg aactggccaa atatgcaaat 780
aacctggcaa ttattctgaa aaatgccctg attgaaaagg gttatgaatt tctgtgcgaa 840
agttatacca atcagcagtt tccgattctg ccgaatgaag ttgttaataa gattagcgaa 900
aagtacagtt tcaacgtgga acgtgttatt gatgaaaata ataccgttat ccgtctggtg 960
accagctggg ccaccagtaa agaaaaagtt ctggaatttg ttgaggaact gaatctgtaa 1020
<210> 6
<211> 1029
<212> DNA
<213> 解纤维素菌(Cellulosilyticum sp.)
<400> 6
atgtacagtt tcaagaacga ttacagtgaa ggtgcacatc cgaaaattct ggaagcactg 60
attgccagca atctggaaca gaccgaaggc tatggcgaag atcattatag tcagaaagca 120
gcatggctgc tgaaagaaat gattggtcgt gatgatattg cagttcattt ctttgtgggc 180
ggtacacaga ccaatctgac cgcaattagc gcatttctgc gcccgcatca ggccgttatt 240
gcagccgcaa ccggccatat tgcaacccat gaaaccggcg caattgaagc caccggccat 300
aaagtgatta ccgttgaaac cagcgatggc aaactgcgta tggatcatat tcagagtgtt 360
ctggatggcc ataccgatga acacatggtt agtccgaaaa tggtttatat tagcaatagc 420
accgaagttg gtagtatcta taaaaaagca gaactggaag gtctgagtca gttttgtaaa 480
gccaataatc tgctgctgta tctggatggc gcacgcctgg gcagtgcact gaccagcaaa 540
gaaaatgata tgaccctgct ggatctgggt cgtctgaccg atgtgtttta tattggcggt 600
acaaaaaatg gtgccctgat gggtgaagca ctgatcattt gtaatgattt tctgaaagag 660
gacttccgct ttcatattaa gcagaaaggt gcactgctgg caaaaggccg tctgctgggt 720
attcagtttg aagcactgtt taaagataac ctgtattttg aactggccga acatgccaat 780
cagatggcag tgcgcctgca ggatgaaatt aagaaactgg gctttagctt tctgattagc 840
agcccgagca atcaggtgtt tccgattttt ccgaatagtg tgattgaaaa actgcaggaa 900
aaatatgcct ttcatatttg ggaaaaggtg gatgatagct atagtgccat tcgcctggtt 960
accagctggg ccaccaaaga agaagccgtg agtaattttg ttaaagatct gaataacatc 1020
gtgttctaa 1029
<210> 7
<211> 29
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 7
atgatcagtt tctttaacga ttacagcga 29
<210> 8
<211> 29
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 8
tcgctgtaat cgttaaagaa actgatcat 29
- 一种L-苏氨酸醛缩酶突变体及其应用
- L-苏氨酸醛缩酶突变体及其在合成L-syn-对甲砜基苯丝氨酸中的应用
