一种高效降解氨基甲酸乙酯的农杆菌及其应用
文献发布时间:2023-06-19 12:27:31
技术领域
本发明涉及微生物技术领域,更具体地说,涉及一种土壤中分离出具有EC 降解活性的农杆菌及其应用,命名为农杆菌DL-DNH01,分类命名为根瘤土壤 杆菌(Agrobacteriumtumefaciens)。
背景技术
氨基甲酸乙酯(Ethyl carbamate,EC)是一种具有遗传毒性和较强致癌性的代谢产物,广泛存在于酒精饮料和发酵食品(如腐乳、酱油、乳酪、食醋、泡菜等)中,对食品安全和人体健康有着严重的影响和危害。
发酵食品中的EC主要是由尿素、氨甲酰磷酸、瓜氨酸、焦碳酸二乙酯等含氨甲酰基前体物质与乙醇反应而形成。发酵食品中的EC可通过工艺优化、代谢工程、微生物降解和酶法去除。
其中,微生物降解和酶法去除是利用EC降解酶(或EC前体降解酶)或产相应酶的微生物,直接降解发酵产品中的EC或EC前体物质,比如,脲酶可以将尿素分解为氨和CO2,可有效减少EC生成,在生产过程中利用酸性脲酶控制成品酒中EC含量是最为常用方法。但是由于尿素并不是唯一的形成EC的前体物质,因此该方法难以彻底根除EC的形成。
所以,利用EC降解酶或产相应酶的微生物,直接降解发酵产品中的EC成为更有前景的方法。因为EC水解酶能够将EC降解为乙醇、氨和二氧化碳,从而能够有效的降解EC。
但是由于EC形成机制多而且比较复杂,同时抑制多种形成EC的机制比较困难,难以彻底根除EC前体物质,从而难以彻底消除EC的形成,并且EC形成后由于其结构非常稳定,难以根除,因此应用微生物降解和生物酶法去除成品中已经形成的EC,是一种较为理想的去除方法。
问题在于,目前现有的EC降解菌资源库远远不能满足食品中EC生物降解的实际需求,目前发现的EC降解菌株极少,而且利用微生物实现对EC的降解,机理比较复杂,目前尚未阐释,也进一步影响了微生物来源EC降解酶的分离和应用。
现有技术中胶红酵母(Rhodotorula mucilaginosa)应用到中国商业化的白酒中,可降解其51.6%的EC(Appl Biochem Biotechnol,2013:1-13)。来源于L. fermentum的酸性脲酶添加到日本清酒(pH 4.4,17%(v/v)乙醇)中,反应2天后可将酒中的尿素降解到1μg/L以下,从而间接抑制EC的生成,但对已生成的EC去除效果,文章并没有报道(ApplMicrobiol Biotechnol,1990,32(5): 538-543.)。
因此,本发明开展发酵食品中EC的微生物去除技术研究,筛选出EC高效降解微生物菌株是十分必要的,可为减低发酵食品中EC残留提供有效手段,为保障发酵食品安全提供技术支持。
发明内容
针对现有EC降解菌剂对EC降解效果不佳的问题,本发明目的在于提供一株农杆菌DL-DNH01,以及用该农杆菌制备的降解剂。本发明涉及的农杆菌 DL-DNH01采集自陕西宝鸡柳林镇土壤,已于2020年12月07日保藏于中国微生物菌种保藏管理委员会普通微生物中心CGMCC,保藏编号CGMCC No.21308。保藏地址:中国北京市朝阳区北辰西路1号院3号中国科学院微生物研究所。
利用所述农杆菌DL-DNH01制备降解剂的方法,包括以下步骤:
S1、将农杆菌DL-DNH01进行活化,在28-32℃、100-200rpm条件下恒温振荡培养18-36h;然后按10%-20%接种量接种,在20-35℃、100-200rpm条件下恒温振荡培养18-36h,得到种子液;
S2、将所述种子液按10%-20%接种量接种于发酵装置中,在20-35℃、通气量0.6-1.0m
S3、将所述DL-DNH01发酵产物制成微胶囊。
步骤S3中所述微胶囊的制备方法包括:
S1、取壳聚糖溶解在质量分数为1.0%的醋酸溶液中,然后加入终浓度1.0%的CaCl
S2、配制2.5%质量浓度的海藻酸钠溶液,并将所述DL-DNH01发酵产物组分按1:1比例溶于其中;
S3、再以2-10滴/秒的速度滴加至所述壳聚糖氯化钙混合溶液中,边滴加边搅拌,滴加结束后,继续搅拌0.5h,过滤后用PBS洗涤1-2次,收集微胶囊。
优选方式下,所述微胶囊湿润状态下粒径为3-5mm。
其中,步骤S2中所述DL-DNH01发酵产物包括:DL-DNH01含菌发酵液、 DL-DNH01发酵液上清、DL-DNH01菌体悬液、DL-DNH01细胞裂解液。
优选方式下,所述DL-DNH01含菌发酵液由所述DL-DNH01发酵产物经干燥,用去离子水回调至原体积的1/20制成;所述DL-DNH01发酵液上清由所述 DL-DNH01发酵产物在4000g转速下离心10min并收集发酵液上清,经干燥处理,用去离子水回调至原体积的1/20制成;所述DL-DNH01菌体悬液由所述 DL-DNH01发酵产物在4000g转速下离心10min并收集并收集菌体沉淀物,稀释至浓度20OD得到;所述DL-DNH01细胞裂解液由所述DL-DNH01菌体悬液经过细胞破壁得到。
优选方式下,所述干燥方法包括冷冻真空干燥。
一株农杆菌及其发酵产物的应用,该农杆菌DL-DNH01及其发酵产物用于降解氨基甲酸乙酯,进一步用于酒精饮料和发酵食物中氨基甲酸乙酯的降解。
本发明具有以下有益效果:
本发明筛选获得一株EC高效降解菌株农杆菌DL-DNH01,该菌株可以利用EC作为唯一碳源生长,可有效降解EC,24h对EC的降解率达到90%以上, 72h降解EC 95%以上,具有良好的EC生物降解效果。
本发明所筛选的DL-DNH01可用于发酵食品中EC的去除,对氨基甲酸乙酯的降解率达到95%,解决了发酵食品中有毒有害代谢产物超标问题和安全问题,支撑安全发酵食品的优质发展,可有效提升白酒、葡萄酒、清酒、黄酒和米酒等发酵食品的质量品质和安全性。
本发明进一步提供了一种使用菌株DL-DNH01生产制备得到的降解制剂,具有生产成本低、使用方便,去除效果明显,易于从发酵产品体系中移除等优点,适合酒类、酱油、醋类等液体发酵食品中EC的去除。
保藏说明
本发明涉及的生物材料样品的保藏信息:参据的微生物(株)为DL-DNH01, 分类命名为根瘤土壤杆菌(Agrobacterium tumefaciens),于2020年12月07 日由中国微生物菌种保藏管理委员会普通微生物中心(简称CGMCC)保藏,保 藏编号CGMCC No.21308。CGMCC地址为北京市朝阳区北辰西路1号院3号。
附图说明
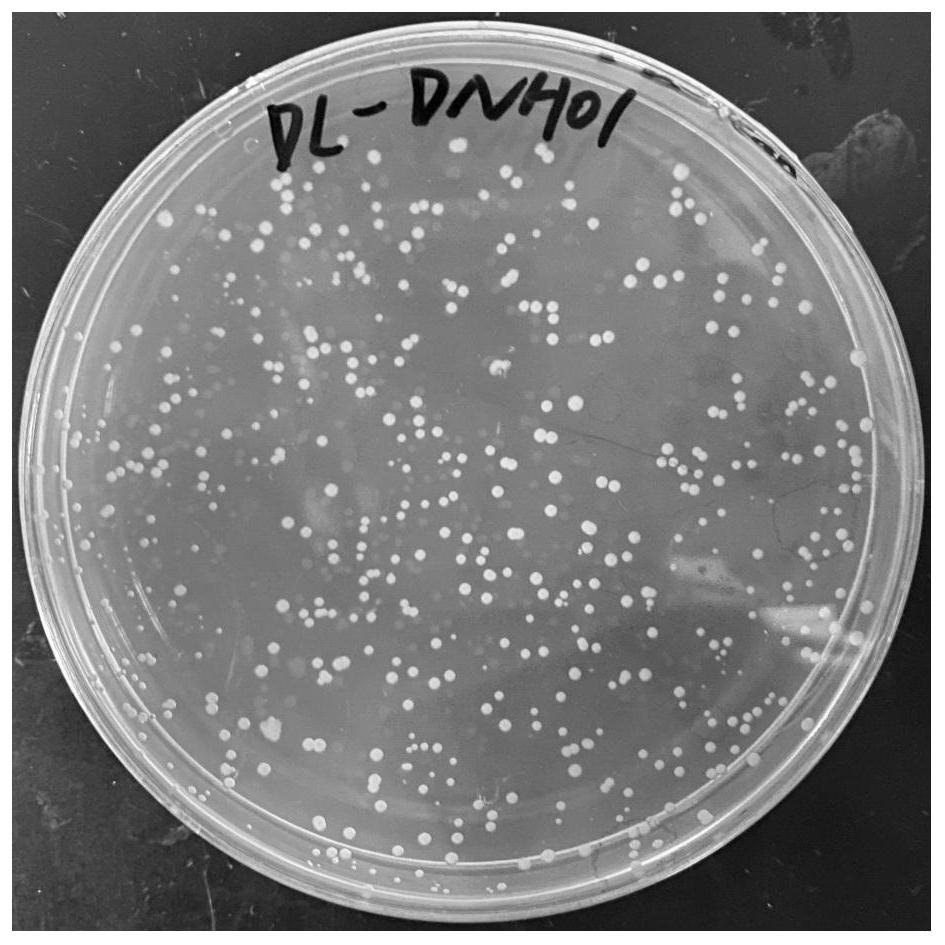
图1为本发明农杆菌DL-DNH01的菌落照片;
图2为本发明农杆菌DL-DNH01以EC为唯一碳源时的筛选图片;
图3为本发明农杆菌DL-DNH01的16S rDNA序列的系统发育树。
具体实施方式
以下结合说明书附图和具体实施例进一步说明本发明。除非特殊说明,本发明采用的试剂、方法和设备为本技术领域常规试剂、方法和设备;除非特别说明,以下实施例所用试剂和材料均为市购。
本发明中使用的各种培养基均采用常规方法配制,实施例中涉及的分子生物学操作如未注明具体试验条件和方法,均参照SambrookJ等主编,科学出版社,2002,分子克隆实验指南(第三版);或参照产品说明书。
本发明使用的培养基的配制如下:
(1)富集培养基:蛋白胨5g、牛肉膏3g、氯化钠5g,蒸馏水1000mL,调 pH至7.0,高压灭菌20min。
(2)普通固体培养基:蛋白胨5g、牛肉膏3g、氯化钠5g,琼脂15g,蒸馏水补至1000mL,调pH至7.0,高压灭菌20min,然后倒平板。
(3)LB液体培养基:胰蛋白胨10g,酵母提取物5g,NaCl 10g,蒸馏水补至1L,调pH至7.0,高压灭菌20min。
(4)LB固体培养基:胰蛋白胨10g,酵母提取物5g,NaCl 10g,15g琼脂,蒸馏水补至1L,调pH至7.0,高压灭菌20min,然后倒平板。
如图1所示,为本发明农杆菌DL-DNH01的菌落照片,农杆菌DL-DNH01 可在含有8g/L的EC的M9固体培养基上生长。
实施例
菌株DL-DNH01的分离和纯化:
(1)样品:采集自陕西宝鸡柳林镇土壤。
(2)分离筛选方法采用富集培养法,具体如下:
取土壤样品5g加入到50mL的LB培养基中,同时加入EC母液,使EC 最终质量浓度为1g/L,于30℃、200rpm震荡培养,进行EC降解菌富集。培养2d后,按1:10的比例转接到第二批EC浓度为2g/L的LB培养基中。相同条件培养2d后,再1:10的比例转接到第三批EC浓度为4g/L的LB培养基中,继续培养2d。相同条件培养2d后,再1:10的比例转接到第四批EC浓度为8g/L的LB培养基中,继续培养2d。连续富集培养四次后,利用分光光度计测定培养液OD值为2,最后取200μL富集培养液,均匀涂抹到以8g/L的EC为唯一碳源的M9固体平板上,30℃倒置培养,然后挑取不同形态特征的单菌落一一划线以8g/L的EC为唯一碳源的M9固体平板上,采用平板划线法分别进行3 次分离纯化。如图2所示,为本发明农杆菌DL-DNH01以EC为唯一碳源时的筛选图片;采用平板划线法,利用含8g/L的EC的M9固体培养基进行3次分离纯化,得到农杆菌DL-DNH01的纯培养物。
(3)采用上述方法从土壤样品中成功分离获得一株EC高效降解菌株,编号为DL-DNH01,该菌株可以利用EC作为唯一碳源生长。24h内对EC的降解率达到90%以上,具有较好的EC降解活性。
菌株DL-DNH01的鉴定:
(1)菌株DL-DNH01在LB固体平板中生长良好,30℃培养18-36h,形成圆形、突起、光滑、白色至灰白色、半透明菌落;镜检以现菌体呈短杆菌,革兰氏染色证明是G-菌;无芽胞,有鞭毛,以1~6根周生或侧生鞭毛运动,好氧,化能异养型。最适生长温度28~30℃,最适pH6.5~7.0。
(2)进一步利用TaKaRa 16S rDNA Bacterial Identification PCR Kit(TaKaRa16S rDNA细菌鉴定PCR试剂盒,TaKaRa,中国大连,货号RR176)进行菌株 DL-DNH01的16SrRNA鉴定。所有操作按照试剂盒说明进行。
菌体样品直接用试剂盒推荐的煮沸法处理获得PCR模板,具体如下:将纯化后的该菌种接种于LB固体培养基上,28℃培养24h,然后使用灭菌牙签挑取单菌落,置于装有10μL的16S-free H2O的Microtube中,于PCR仪上99℃热变性10分钟,取5μL上述液体作模板进行PCR反应。
PCR反应体系50μL:2×PCR Mix为25μL,引物Forward Primer为1μL,引物ReversePrimer 2为1μL,上述模板上清液为5μL,在加入ddH2O补齐到 50μL。
PCR程序:94℃5min;94℃1min,55℃1min,72℃1.5min,30个循环;72℃10min。
PCR结束后,PCR产物直接送上海生工测序,测序结果显示具有序列表中 SEQ IDNo.1的核苷酸序列,将其进行Blastn分析,发现该菌与根瘤土壤杆菌 (Agrobacteriumtumefaciens)的同源性最高,达到100%。
如图3所示,为本发明农杆菌DL-DNH01的16S rDNA序列的系统发育树, 从分子水平上,显示DL-DNH01菌株为一株农杆菌。
综上所述,经形态学特征和16S rRNA系统发育分析鉴定该降解菌株 DL-DNH01属于根瘤土壤杆菌(Agrobacterium tumefaciens)。并已于2020年12 月07日保藏于中国微生物菌种保藏管理委员会普通微生物中心CGMCC,保藏 编号:CGMCC No.21308。保藏地址:中国北京市朝阳区北辰西路1号院3号 中国科学院微生物研究所,邮编:100101。
菌株DL-DNH01的EC降解效果:
将纯化后的菌株DL-DNH01在LB液体培养基中培养至对数周期,以10%接种量接入含EC浓度为6g/L的LB培养基中,在30℃、180rpm恒温振荡培养,同时设不接菌的LB培养基作对照,每个处理3个重复。分别在0d、1d、 2d、3d、4d时,吸取上清液2mL,过0.2μm滤膜,然后采用分光光度法测定培养上清液中EC的残留量(参考分析实验室,2004,23(4):28-30;CN103954568 A)。该方法的原理:对二甲氨基苯甲醛(PDAB)与EC在酸性条件下发生Ehrlich反应,形成柠檬黄色衍生物——对二甲胺基苯亚甲基胺基甲酸乙酯,在416nm处有最大吸收。氨基甲酸乙酯的质量浓度与柠檬黄色衍生物的吸光度呈正相关,即氨基甲酸乙酯浓度越大吸光度越大。根据吸光度的大小和标准曲线即可计算氨基甲酸乙酯的浓度。然后计算降解率。结果显示,菌株 DL-DNH01对EC具有较好的降解效果,在培养24h时可降解90%的EC,在培养72h时EC去除率达到95%以上。
计算公式:
菌株DL-DNH01发酵产物对EC的降解:
1、DL-DNH01菌株活化
将菌株接种于LB液体培养基中进行活化,在30℃、180rpm恒温振荡培养 24h。
2、DL-DNH01菌株发酵
将活化后的菌株培养液接10%接种量接种于发酵培养基(每升发酵培养基含有蛋白胨5g、牛肉膏3g、氯化钠5g,去离子水补足1000mL,pH7.0)进行发酵,在30℃、180rpm恒温振荡培养48h,得到DL-DNH01菌株发酵液。
3、DL-DNH01发酵液EC降解实验
将步骤2中所获得的发酵液,充分混匀,取900μL的DL-DNH01含菌发酵液与100μL浓度为60mg/mL的EC溶液混匀,使得EC的最终浓度为6mg/mL;对照组为未接种的无菌的发酵培养基,900μL的发酵培养基与100μL浓度为 60mg/mL的EC溶液混匀,使得EC的最终浓度也为6mg/mL;实验组和对照组在在30℃、180rpm恒温振荡温育24h。反应结束后,用分光光度法测量清液中EC的残留量为0.59mg/mL(参考分析实验室,2004,23(4):28-30;CN 103954568A)。计算降解率。
4、DL-DNH01发酵液上清EC降解实验
取10mL步骤2中所获得的发酵液,12000rpm,离心10min,离心上清利用0.45μm的滤膜过滤除菌,得到DL-DNH01发酵液上清。取900μL的 DL-DNH01发酵液上清与100μL浓度为60mg/mL的EC溶液混匀,使得EC 的最终浓度为6mg/mL;对照组为未接种的无菌的发酵培养基,900μL的发酵培养基与100μL 60mg/mL的EC溶液混匀,使得EC的最终浓度也为6mg/mL;实验组和对照组在在30℃、180rpm恒温振荡温育24h。反应结束后,用分光光度法测量清液中EC的残留量为0.83mg/mL(分析实验室,2004,23(4):28-30;CN 103954568 A)。计算降解率。
5、DL-DNH01菌体悬液EC降解实验
取10mL步骤2中所获得的发酵液,12000rpm,离心10min,弃上清;菌体利用10mL生理盐水重悬,12000rpm,离心10min,弃上清;菌体重悬于1mL 生理盐水,得到DL-DNH01菌体悬液。取900μL的DL-DNH01菌体悬液与100 μL浓度为60mg/mL的EC溶液混匀,使得EC的最终浓度为6mg/mL;对照组为无菌生理盐水,900μL的生理盐水与100μL浓度为60mg/mL的EC溶液混匀,使得EC的最终浓度为6mg/mL;实验组和对照组在在30℃、180rpm恒温振荡温育24h。反应结束后,用分光光度法测量清液中EC的残留量为0.61 mg/mL(分析实验室,2004,23(4):28-30;CN 103954568 A)。计算降解率。
6、DL-DNH01菌体细胞裂解液EC降解实验
取50mL步骤2中所获得的发酵液,12000rpm,离心10min,弃上清;菌体利用50mL磷酸盐(50mM,pH7.0)缓冲液重悬,12000rpm,离心10min,弃上清;菌体重悬于5mL磷酸盐(50mM,pH7.0)缓冲液,使用超声细胞破碎仪将细胞悬液冰上破碎(每次超声5s,间隔5s,共10min)。破菌后,4℃, 12000rpm离心12min,收集上清,用0.45μm的滤膜过滤除菌,所得到滤液即为菌体细胞裂解液。取900μL的DL-DNH01菌体细胞裂解液与100μL浓度为 60mg/mL的EC溶液混匀,使得EC的最终浓度为6mg/mL;对照组为无菌磷酸盐(50mM,pH7.0)缓冲液,900μL的磷酸盐(50mM,pH7.0)缓冲液与 100μL浓度为60mg/mL的EC溶液混匀,使得EC的最终浓度也为6mg/mL;实验组和对照组在在30℃、180rpm恒温振荡温育24h。反应结束后,用分光光度法测量清液中EC的残留量为0.3mg/mL(分析实验室,2004,23(4):28-30;CN 103954568 A)。计算降解率。
结果显示,在24h的作用时间内,DL-DNH01含菌发酵液的EC降解率为 90%,DL-DNH01发酵液上清的EC降解率为86%,DL-DNH01菌体悬浮液的 EC降解率为89%,DL-DNH01细胞裂解液的EC降解率为95%。
DL-DNH01菌株EC降解制剂的制备:
S1、将菌株接种于LB液体培养基中进行活化,在28-32℃、180rpm恒温振荡培养24h。
S2、将活化后的菌株培养液接10%接种量接种于营养肉汤培养基(每升发酵培养基含有蛋白胨5g、牛肉膏3g、氯化钠5g,去离子水补足1000mL,pH7.0) 进行培养,在30℃、180rpm恒温振荡培养24h,获得的即为种子液。将种子液按10%(即1:10比例)接种量接种于发酵培养基(每升发酵培养基含有蛋白胨5g、牛肉膏3g、氯化钠5g,去离子水补足1000mL,pH7.0)的生产发酵罐 (装液量70%),通气量0.6-1.0m
S3发酵完成后收集得到DL-DNH01发酵产物,发酵液经冷冻真空干燥,利用去离子水回调体积至原体积的1/20,得到DL-DNH01发酵液;
S4.DL-DNH01发酵产物在4000g转速下离心10min收集DL-DNH01菌体沉淀物和发酵液上清;发酵液上清经冷冻真空干燥,利用去离子水回调体积至原体积的1/20,得到DL-DNH01发酵液上清;
S5.用稀释剂PBS缓冲液稀释菌体沉淀物得到菌株DL-DNH01菌体悬液,浓度20OD;
S6.菌株DL-DNH01菌体悬液经过细胞破壁得到DL-DNH01细胞裂解液;
S7.S3-S6所制得的DL-DNH01含菌发酵液、DL-DNH01发酵液上清、DL-DNH01菌体悬液和DL-DNH01细胞裂解液组分分别经海藻酸钠包埋,制成相应的微胶囊。步骤如下:
①取适量壳聚糖溶解在100mL质量分数为1.0%的醋酸溶液中,然后加入终浓度1.0%的CaCl
②配制2.5%质量浓度的海藻酸钠溶液并分成四份,并将S3-S6所制得的 DL-DNH01含菌发酵液、DL-DNH01发酵液上清、DL-DNH01菌体悬液和 DL-DNH01细胞裂解液组分分别按1:1比例溶于其中;
③分批取10mL上述海藻酸钠溶液,用带8号针头的10mL注射器以2-10 滴/秒的速度缓慢滴加至壳聚糖氯化钙溶液中,边滴加边搅拌,滴加结束后,继续搅拌0.5h,过滤、PBS洗涤1-2次,收集微胶囊,所述微胶囊湿润状态下粒径为3-5mm。
④以S3-S6所制得的DL-DNH01含菌发酵液、DL-DNH01菌体悬液、 DL-DNH01发酵液上清和DL-DNH01细胞裂解液组分所制备的微胶囊分别命名为EC降解剂1、EC降解剂2、EC降解剂3、EC降解剂4。
DL-DNH01菌株对发酵食品中添加EC的降解实验:
(1)制备白酒EC反应液并降解其中的EC:白酒:(45度)60mL;EC:2.6ppm;DL-DNH01菌体:10OD,在250mL锥形瓶中温育,30℃,100rpm, 5天。反应后,将白酒EC反应液进行离心,4℃,10000×g离心10分钟,去除菌体,将清液进行膜过滤(0.45μm),然后通过气相色谱-质谱法分析EC浓度。在400μL反应液中添加100μL浓度为1N的HCl和600μL氯仿后,充分混合。 4℃、12000×g离心,10分钟,将氯仿层回收到小瓶作为GC分析样品,检测 EC浓度。
(2)制备红酒EC反应液并降解其中的EC:红酒:(12度)60mL;EC: 2.6ppm;DL-DNH01菌体:10OD,在250mL锥形瓶中温育,30℃,100rpm, 5天。反应后,将红酒EC反应液进行离心,4℃,10000×g,10分钟,去除菌体,将清液进行膜过滤(0.45μm)后,通过气相色谱-质谱法分析EC浓度。在400 μL反应液中添加100μL浓度为1N的HCl和600μL氯仿后,充分混合。4℃、12000×g离心10分钟,将氯仿层回收到小瓶作为GC-MS分析样品,检测EC 浓度。
(3)制备黄酒EC反应液并降解其中的EC:黄酒:(15度)60mL;EC: 2.6ppm;DL-DNH01菌体:10OD,在250mL锥形瓶中温育,30℃,100rpm, 5天。反应后,将黄酒EC反应液进行离心,4℃,10000×g离心10分钟,去除菌体后进行膜过滤(0.45μm)后,通过气相色谱-质谱法分析EC浓度。在400μL 反应液中添加100μL浓度为1N的HCl和600μL氯仿后,充分混合。4℃离心12000×g,10分钟,将氯仿层回收到小瓶作为GC-MS分析样品,检测EC浓度。
(4)制备酸奶EC反应液并降解其中的EC:酸奶60mL;EC:2.6ppm, DL-DNH01菌体:10OD,在250mL锥形瓶中温育,30℃,100rpm,5天。反应后,将酸奶EC反应液进行离心,4℃,10000×g离心10分钟,去除菌体,将清液进行膜过滤(0.45μm)后,通过气相色谱-质谱法分析EC浓度。在400μL 反应液中添加100μL浓度为1N的HCl和600μL氯仿后,充分混合。4℃、12000 ×g离心10分钟,将氯仿层回收到小瓶作为GC-MS分析样品,检测EC浓度。
(5)制备醋EC反应液并降解其中的EC:陈醋60mL,EC:2.6ppm, DL-DNH01菌体:10OD,在250mL锥形瓶中温育,30℃,100rpm,5天。反应后,将陈醋EC反应液进行离心,4℃,10000×g离心10分钟,去除菌体,将清液进行膜过滤(0.45μm)后,通过气相色谱-质谱法分析EC浓度。在400μL 反应液中添加100μL浓度为1N的HCl和600μL氯仿后,充分混合。4℃、12000 ×g离心10分钟,将氯仿层回收到小瓶作为GC-MS分析样品,检测EC浓度。
(6)制备酱油EC反应液并降解其中的EC:酱油60mL;EC:2.6ppm; DL-DNH01菌体:10OD,在250mL锥形瓶中温育,30℃,100rpm,5天。反应后,将酱油EC反应液进行离心,4℃,10000×g离心10分钟,去除菌体后进行膜过滤(0.45μm)后,通过气相色谱-质谱法分析EC浓度。在400μL反应液中添加100μL浓度为1N的HCl和600μL氯仿后,充分混合。4℃12000×g 离心10分钟,将氯仿层回收到小瓶作为GC-MS分析样品,检测EC浓度。
(7)制备豆瓣酱EC反应液并降解其中的EC:豆瓣酱50mL;去离子水 10ml;EC:2.6ppm;DL-DNH01菌体:10OD,在250mL锥形瓶中温育,30℃, 100rpm,5天。反应后,将豆瓣酱EC反应液进行离心,4℃、10000×g离心10 分钟,去除菌体,将清液进行膜过滤(0.45μm)后,通过气相色谱-质谱法分析EC 浓度。在400μL反应液中添加100μL浓度为1N的HCl和600μL氯仿后,充分混合。4℃、12000×g离心10分钟,将氯仿层回收到小瓶作为GC-MS分析样品,检测EC浓度。
GC-MS分析条件如下:
使用气相色谱(GC7700,Agilent),在以下的条件下进行分析。
柱:DB-WAX(60m×0.25mm×0.25um)(Agilent J&W)
注射器:250℃
检测器:FID,250℃
烘箱:100℃(0min)→以10℃/min升温→在250℃保持5min
流速:2.0mL/min
注入量:5μL
表1反应5天后EC浓度
DL-DNH01菌株EC降解制剂对发酵食品中添加EC的降解实验、DL-DNH01 菌株对发酵食品中添加EC的降解实验:
(1)制备白酒EC反应液并降解其中的EC:白酒:(45度)60mL;EC: 2.6ppm;EC降解剂1:20mL,在250mL锥形瓶中温育,30℃,100rpm,5 天。反应后,将白酒EC反应液进行离心,4℃,8000×g离心10分钟,去除EC 降解制剂,将清液进行膜过滤(0.45μm)后,通过气相色谱-质谱法分析EC浓度。在400μL反应液中添加100μL浓度为1N的HCl和600μL氯仿后,充分混合。4℃、12000×g离心10分钟,将氯仿层回收到小瓶作为GC分析样品,检测EC浓度。
(2)制备红酒EC反应液并降解其中的EC:红酒(12度)60mL;EC: 2.6ppm;EC降解剂2:20mL,在250mL锥形瓶中温育,30℃,100rpm,5 天。反应后,将白酒EC反应液进行离心,4℃、8000×g离心10分钟,去除EC 降解制剂,将清液进行膜过滤(0.45μm)后,通过气相色谱-质谱法分析EC浓度。在400μL反应液中添加100μL浓度为1N HCl和600μL氯仿后,充分混合。4℃12000×g离心10分钟,将氯仿层回收到小瓶作为GC-MS分析样品,检测 EC浓度。
(3)制备黄酒EC反应液并降解其中的EC:黄酒(15度)60mL;EC: 2.6ppm;EC降解剂3:20mL,在250mL锥形瓶中温育,30℃,100rpm,5 天。反应后,将黄酒EC反应液进行离心,4℃、10000×g离心10分钟,去除 EC降解制剂,将清液进行膜过滤(0.45μm)后,通过气相色谱-质谱法分析EC浓度。在400μL反应液中添加100μL浓度为1N的HCl和600μL氯仿后,充分混合。4℃、12000×g离心,10分钟,将氯仿层回收到小瓶作为GC-MS分析样品,检测EC浓度。
(4)制备酸奶EC反应液并降解其中的EC:酸奶60mL;EC:2.6ppm; EC降解剂4:20mL,在250mL锥形瓶中温育,30℃,100rpm,5天。反应后,将酸奶EC反应液进行离心,4℃、10000×g离心10分钟,去除EC降解制剂,将清液进行膜过滤(0.45μm)后,通过气相色谱-质谱法分析EC浓度。在400 μL反应液中添加100μL浓度为1N的HCl和600μL氯仿后,充分混合。4℃、12000×g离心10分钟,将氯仿层回收到小瓶作为GC-MS分析样品,检测EC 浓度。
(5)制备醋EC反应液并降解其中的EC:陈醋60mL;EC:2.6ppm;EC 降解剂1:20mL,在250mL锥形瓶中温育,30℃,100rpm,5天。反应后,将陈醋EC反应液进行离心,4℃、10000×g离心10分钟,去除EC降解剂,将清液进行膜过滤(0.45μm)后,通过气相色谱-质谱法分析EC浓度。在400μL 反应液中添加100μL浓度为1N的HCl和600μL氯仿后,充分混合。4℃、12000×g离心10分钟,将氯仿层回收到小瓶作为GC-MS分析样品,检测EC浓度。
(6)制备酱油EC反应液并降解其中的EC:酱油60mL;EC:2.6ppm; EC降解剂1:20mL,在250mL锥形瓶中温育,30℃,100rpm,5天。反应后,将酱油EC反应液进行离心,4℃、10000×g离心10分钟,去除EC降解剂,将清液进行膜过滤(0.45μm)后,通过气相色谱-质谱法分析EC浓度。在400μL 反应液中添加100μL浓度为1N的HCl和600μL氯仿后,充分混合。4℃、 12000×g离心10分钟,将氯仿层回收到小瓶作为GC-MS分析样品,检测EC 浓度。
(7)制备豆瓣酱EC反应液并降解其中的EC:豆瓣酱50mL;去离子水 10ml;EC:2.6ppm,EC降解剂2:20mL,在250mL锥形瓶中温育,30℃, 100rpm,5天。反应后,将豆瓣酱EC反应液进行离心,4℃、10000×g离心10 分钟,去除EC降解剂,将清液进行膜过滤(0.45μm)后,通过气相色谱-质谱法分析EC浓度。在400μL反应液中添加100μL浓度为1N的HCl和600μL氯仿后,充分混合。4℃、12000×g离心10分钟,将氯仿层回收到小瓶作为GC-MS 分析样品,检测EC浓度。
表2反应5天后EC浓度
注:/,表示未实验
综上所述,DL-DNH01发酵产品及其EC降解剂对EC有很好的降解作用,发酵食品中乙醇含量、盐等成分对DL-DNH01的EC降解活性影响不大。
以上所述,仅为本发明较佳的具体实施方式,但本发明的保护范围并不局限于此,本发明主要阐述菌株以及基于所述菌株的应用思想,实施方式中简单参数的替换不能一一在实施例中赘述,其它的任何改变未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,应被视为等效的置换方式,任何熟悉本技术领域的技术人员在本发明披露的技术范围内,都应涵盖在本发明的保护范围之内。
- 一种高效降解氨基甲酸乙酯的农杆菌及其应用
- 一种降解尿素和氨基甲酸乙酯的耐乙醇双功能酶及其应用
