一种体外扩增及活化γδ-T细胞的方法
文献发布时间:2023-06-19 18:30:43
本申请是申请日为2020年5月29日提交的申请号为202010475465.8的发明专利的分案申请,原申请的发明名称为“一种体外扩增及活化γδ-T细胞的方法”,通过引用将其全部内容结合到本申请。
技术领域
本发明是关于一种体外扩增暨活化γδ-T细胞的方法。本发明另关于一种包含γδ-T细胞的医药组合物。
背景技术
免疫细胞治疗是将病人本身的免疫细胞在体外增殖和活化后,再回输至体内的一种治疗方式。目前免疫细胞治疗已逐渐被应用于癌症治疗上,成功的关键在于了解各类免疫细胞的特性和功能,并根据癌症患者的状况及基因特性来选择最合适的免疫细胞类型,例如NK细胞、T细胞等。
人体免疫系统中的T细胞大致上分为二大类:Alpha-Beta T细胞与Gamma-Delta T(γδ-T)细胞。γδ-T细胞存在于外围血液中,其数量只占外围血液中所有T细胞的1%~5%。它是藉由辨识细胞表面的异戊烯基焦磷酸(isopentenyl pyrophosphate,IPP)分子来区分正常与异常细胞。IPP是细胞代谢的一个中间产物,它在癌细胞内的产量会增加,尤其是当癌细胞的p53基因突变时。识别IPP的γδ-T细胞会增殖和活化并会增强攻击肿瘤细胞的力量,此为γδ-T细胞的特殊功能,如果其他免疫细胞没有侦测到癌细胞标志的话,γδ-T细胞还是可以发现癌细胞,并加以攻击。以一般情况来说,异常的细胞会拥有和其他正常细胞不同的分子,γδ-T细胞将这些作为癌细胞标志来识别并进行攻击。除了IPP分子之外,γδ-T细胞也能透过MIC A/b、HMB-PP、细胞间粘附分子-1,CD166等标记物来进行辨识。因此,γδ-T细胞能辨识与杀死多种癌细胞。
γδ-T细胞有一个很重要的特征,即在辨识异常细胞时不需要HLA,因此与个体的HLA型别无关。这个特征使得γδ-T细胞可使用在任何人身上而不会产生移植物抗宿主病(graft-versus-host disease,GVHD)。目前在美国、欧洲与日本已有许多细胞疗法的人体临床应用是使用γδ-T细胞来进行的,这些临床应用皆证实γδ-T细胞的使用是安全无虞的。
由于γδ-T细胞在血液中数量稀少且其增生能力因人而异,因此以γδ-T细胞进行细胞疗法的挑战在于是否能够于体外大量且快速的扩增并活化γδ-T细胞。近几年发现,使用唑来膦酸(Zoledronic acid)能使γδ-T细胞大量增殖,其技术也已经确立。唑来膦酸除了使用在培养γδ-T细胞之外,将唑来膦酸注射到癌症患者体内可以发现癌细胞更大量表现IPP,藉此可以提高γδ-T细胞对癌细胞的灵敏度。然而,唑来膦酸是一种治疗骨质疏松症的药物,用于培养细胞或注射至病患体内仍存在一定疑虑,因此仍极需要开发出一种方便、有效、安全的体外扩增暨活化γδ-T细胞的方法。
发明内容
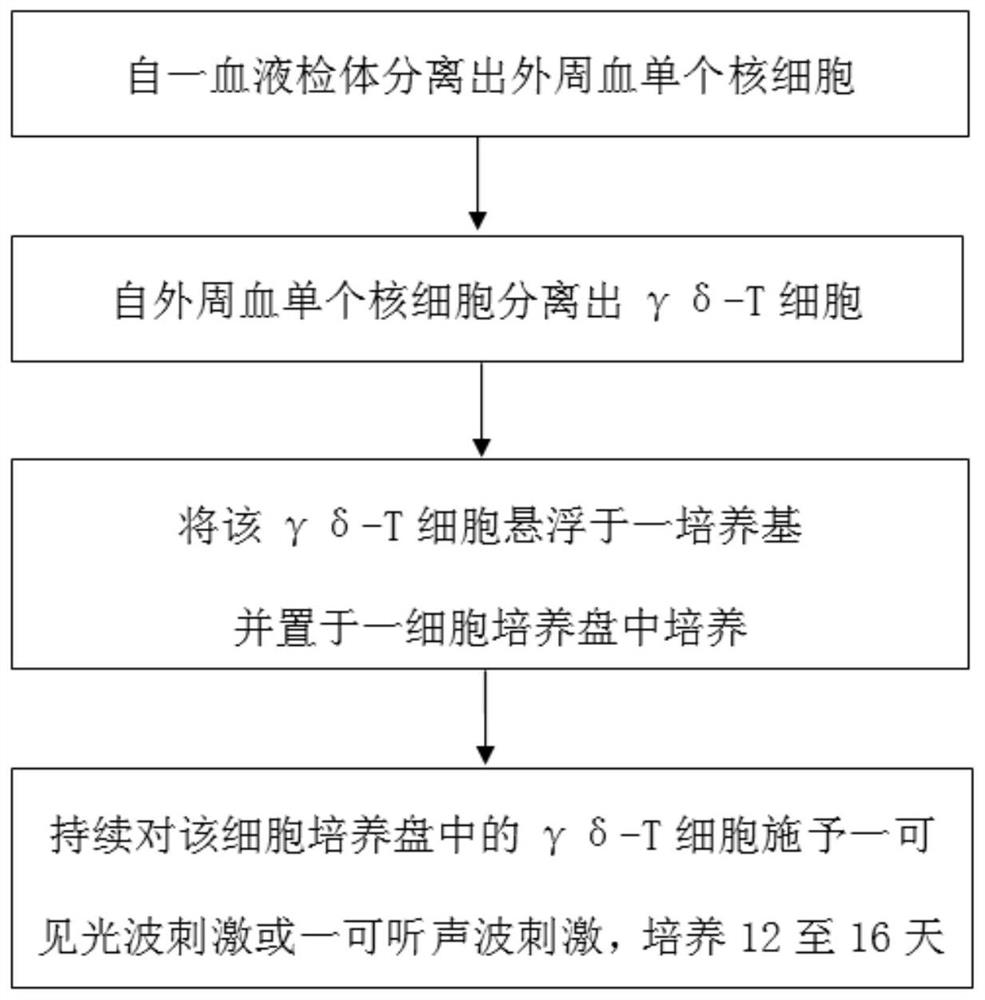
本发明于一方面,提供一种体外扩增暨活化γδ-T细胞的方法,其包含以下步骤:自一血液检体分离出外周血单个核细胞;自该外周血单个核细胞分离出γδ-T细胞;将该γδ-T细胞悬浮于一培养基并置于一细胞培养盘中培养;以及持续对该细胞培养盘中的γδ-T细胞施予一可见光波刺激或一可听声波刺激,培养12至16天。
在一具体实施例中,前述可见光波的波长是介于400nm~700nm;在一较佳实施例中,前述可见光波的波长是介于550nm~700nm。
在一具体实施例中,前述可听声波的波形为正弦波、三角波或方波;在一较佳实施例中,前述可听声波的频率为110Hz,强度为70分贝。
于本发明的一些具体实施方式中,前述培养基包含一自体树突细胞外泌体(autologous dendritic cell exosome);在一较佳实施例中,前述自体树突细胞外泌体的浓度为25μg/ml。在一较佳实施例中,前述培养基另包含唑来膦酸(zoledronic acid);在另一较佳实施例中,前述培养基另包含基础培养基以及细胞激素。
本发明于另一方面,提供一种根据前述方法所制得的细胞。
本发明于再一方面,提供一种用于抑制肿瘤细胞增殖的医药组合物,其包含前述的细胞及医药上可接受的赋形剂。
前面的概述,以及本发明以下的详细描述,在结合图式一起阅读时将可以被更好地理解。为了说明本发明,所附图式示出一些,但不是所有的,可替代的具体实施例。然而,应该理解的是,本发明并不限于所示的精确安排和手段。这些图式,其被并入并构成说明书的一部分,有助于解释本发明的原理。
附图说明
图1是本发明的γδ-T细胞体外扩增暨活化方法流程图。
图2A是本发明持续对细胞培养盘中的γδ-T细胞施予不同波长可见光波刺激后的细胞扩增倍数分析。
图2B是本发明持续对细胞培养盘中的γδ-T细胞施予不同波长可见光波刺激后,γδ-T细胞对Daudi细胞的毒杀效率分析。
图2C是本发明持续对细胞培养盘中的γδ-T细胞施予不同波长可见光波刺激后,γδ-T细胞对A549细胞的毒杀效率分析。
图2D是本发明持续对细胞培养盘中的γδ-T细胞施予不同波长可见光波刺激后,以流式细胞仪进行细胞分析的结果。
图3A是本发明持续对细胞培养盘中的γδ-T细胞施予不同波形可听声波刺激后的细胞扩增倍数分析。
图3B是本发明持续对细胞培养盘中的γδ-T细胞施予不同波形可听声波刺激后,γδ-T细胞对Daudi细胞的毒杀效率分析。
图3C是本发明持续对细胞培养盘中的γδ-T细胞施予不同波形可听声波刺激后,γδ-T细胞对A549细胞的毒杀效率分析。
图4A是本发明于培养基中加入自体树突细胞外泌体后的γδ-T细胞扩增倍数分析。
图4B是本发明于培养基中加入自体树突细胞外泌体后,γδ-T细胞对Daudi细胞的毒杀效率分析。
图4C是本发明于培养基中加入自体树突细胞外泌体后,γδ-T细胞对A549细胞的毒杀效率分析。
具体实施方式
有鉴于上述待解决的问题,本发明提出一种体外扩增暨活化γδ-T细胞的方法,该方法是将可见光波刺激、可听声波刺激以及自体树突细胞外泌体应用于γδ-T细胞体外扩增,有效率地提升γδ-T细胞扩增倍数,并产出高纯度及高癌细胞毒杀活性的γδ-T细胞。
定义
除非另有定义,所有在此使用的技术及科学术语,具有与本发明所属领域的通常知识者一般所理解的意义相同的意义。当有所冲突时,以本文件及其所定义者为准。
于此处所使用者,「约」、「大约」、或「大概」一般应指一特定数值或范围的20%以内,较佳10%以内,及更佳5%以内。在此所使用的数值为近似值,代表若未明示地陈述,「约」、「大约」、或「大概」等词可以被推断适用。
于本发明中,「γδ-T细胞」(gamma-delta T cell)是指细胞表面抗原呈现CD3
于本发明中,「细胞扩增倍数」是以下列方式判断:「经体外培养12天后的细胞数量」除以「自外周血单个核细胞分离出的起始γδ-T细胞数量」。
于本发明中,「癌细胞毒杀效率」是以γδ-T细胞为作用细胞(effector cell),并以Daudi细胞株或A549细胞株为目标细胞(target cell),在作用细胞与目标细胞的比例(E:T ratio)为0.5、1或5的情况下进行毒杀试验,将目标细胞死亡的比例做为毒杀效率。
材料与方法
本发明所述外周血检体,是依据伦理委员会通过的计划,自受试者手臂采集全血,置于无菌采血管,于室温存放待后续处理。
本发明所使用的基础培养基可选用自:CellGro SCGM(CellGenix公司)、KBM 501(Kohjin Bio公司)、AIM-V(Thermo Fisher公司)、X-VIV015(Lonza公司)、DMEM或RPM1-1640等市售的基础培养基。
本发明所述培养基中,有时含有适当的蛋白质、细胞激素、抗体、血清、化合物等成分。所述细胞激素有时为白介素-2(IL-2)、白介素-3(IL-3)、白介素-7(IL-7)、白介素-12(IL-12)、白介素-15(IL-15)、白介素-18(IL-18)或白介素-21(IL-21)。
自血液检体分离外周血单个核细胞的方法
抽取7.5-8ml的血液于采血管中,该采血管含有抗凝血剂-肝素,以及Ficoll-Hypaque试剂,外加一聚脂凝胶隔层以分离前述二液体。于室温下以1800g将采血管离心20分钟。离心完成后,收集血浆分层用于后续的细胞培养,并留下5至10mm的血浆层于接口上,操作时不扰动细胞层。接着以移液器收集接口的外周血单个核细胞(peripheral bloodmononuclear cell,PBMC)层至15ml圆锥形管中,以10ml磷酸盐缓冲生理食盐水(Phosphatebuffer saline;简称PBS)清洗PBMC并翻转圆锥形管5次,再以400g进行离心5分钟。重复前述清洗步骤两次之后,以5ml的PBS将细胞再悬浮。计算细胞数,通常1ml全血能够分离出1.3x10
体外扩增及活化γδ-T细胞的方法
于室温以400g离心15ml圆锥形管中的外周血单个核细胞悬浮液5分钟后,丢弃上清液。准备细胞培养基,培养基中加入白介素-2(IL-2)及唑来膦酸(Zometa)至最终浓度分别为1000IU/ml及5μM。其中唑来膦酸以液体形式添加,每30ml的培养基中加入50μl的唑来膦酸(浓度为4mg/5ml)。接着将细胞沉淀物重新悬浮于培养基中并调整至每毫升培养基含1x10
以流式细胞仪分析细胞表面抗原
以2x10
γδ-T细胞毒杀癌细胞能力测试方式
将扩增及活化后的γδ-T细胞做为作用细胞(effector cell),并以Daudi细胞株(淋巴癌细胞株)或A549细胞株(肺癌细胞株)做为毒杀目标细胞(target cell)。将作用细胞及目标细胞以0.5:1、1:1或5:1混合培养后,反应4小时,再以7-AAD进行细胞染色,藉此测定凋亡的细胞数量。
以可见光波刺激γδ-T细胞的方法
为了在相同的培养环境中制造一稳定的光源,于同样的培养箱中设置一标准的8瓦荧光灯管,位于培养盘上方15公分处,以确保所有培养中的细胞能够接收到相同的光刺激。培养盘的光照强度以测光仪设定为1,000流明,波长设定为400nm、550nm或700nm。对照组的培养盘亦置于相同环境中,与光源距离15公分,但以白色纸卡覆盖以完全阻绝光照。
以可听声波刺激γδ-T细胞的方法
于本发明所使用的声波频率为110Hz的正弦波、三角波以及方波,皆由NCH音频发声器软件所生成,波型与频谱以SP4Win软件进行分析,并使用Fostex 6301NB全频喇叭于培养盘上方15公分处输出声波,以RION NL-31声级计于细胞培养盘旁侦测声压级,声压级设定为70分贝。
自体树突细胞外泌体的制备与纯化
自体树突细胞外泌体(Autologous dendritic cell exosome)的制备是以新鲜的细胞培养基取代培养至第五天的树突细胞培养基,并加入颗粒单核球群落刺激生长因子(Granulocyte-macrophage colony-stimulating factor,GM-CSF)以及白介素-4并继续培养树突细胞24小时。收集经培养后的培养基并分别以300g及1000g离心10分钟,接着以孔径0.45μm的滤膜进行过滤以移除细胞及其碎片。经过滤后的培养基再以Centricon Plus-70Millipore滤膜于1000g离心45分钟进行浓缩,接着再以100,000g进行超速离心一小时后可由培养基分离得到树突细胞外泌体,再使用PBS清洗二次,通过Amicon Ultra-15滤膜以1000g离心25分钟,最后将树突细胞外泌体再悬浮于200μL PBS中。使用BCA蛋白质分析套组(Thermo Scientific)进行树突细胞外泌体的定量。
经前述方法所获得的扩增暨活化后的γδ-T细胞,可混合于适当的赋形剂中保存,所述赋形剂可为一磷酸缓冲液,最后制备成医药组合物。
实施例
实施例1、以可见光波刺激γδ-T细胞的培养结果
图2A为持续对细胞培养盘中的γδ-T细胞施予不同波长可见光波刺激后的细胞扩增倍数分析结果。由图2A发现,于培养第12天,照射700nm可见光波组的细胞扩增倍数为4,989倍;照射550nm可见光波组的细胞扩增倍数为3,433倍;照射400nm可见光波组的细胞扩增倍数为2,335倍;对照组(无可见光波刺激)的细胞扩增倍数为2,750倍。图2B为持续对细胞培养盘中的γδ-T细胞施予不同波长可见光波刺激后,γδ-T细胞对Daudi细胞的毒杀效率分析。由图2B发现,在E:T比例为5的情况下,照射700nm可见光波组的细胞毒杀效率为62.1%;照射550nm可见光波组的细胞毒杀效率为66.8%;照射400nm可见光波组的细胞毒杀效率为60.5%;对照组(无可见光波刺激)的细胞毒杀效率为63.4%。图2C为持续对细胞培养盘中的γδ-T细胞施予不同波长可见光波刺激后,γδ-T细胞对A549细胞的毒杀效率分析。由图2C发现,在E:T比例为5并添加唑来膦酸的情况下,照射700nm可见光波组的细胞毒杀效率为48.9%;照射550nm可见光波组的细胞毒杀效率为52.3%;照射400nm可见光波组的细胞毒杀效率为45.1%;对照组(无可见光波刺激)的细胞毒杀效率为42.7%。图2D为持续对细胞培养盘中的γδ-T细胞施予不同波长可见光波刺激后,以流式细胞仪进行细胞分析的结果。由图2D发现,于培养第12天,照射700nm可见光波组的γδ-T细胞,细胞纯度为92.1%;照射550nm可见光波组的γδ-T细胞,细胞纯度为91.7%;照射400nm可见光波组的γδ-T细胞,细胞纯度为90.7%;对照组的γδ-T细胞,细胞纯度为73.3%。综上,于细胞培养时持续施以特定波长的可见光波刺激,可有效提升γδ-T细胞的扩增倍率、细胞纯度及癌细胞毒杀活性。
实施例2、以可听声波刺激γδ-T细胞培养的结果
图3A为持续对细胞培养盘中的γδ-T细胞施予不同波形可听声波刺激后的细胞扩增倍数分析结果。由图3A发现,以110Hz、70分贝正弦波的可听声波持续进行刺激,于培养第12天的细胞扩增倍数为3,006倍;以110Hz、70分贝三角波的可听声波持续进行刺激,于培养第12天的细胞扩增倍数为3,226倍;以110Hz、70分贝方波的可听声波持续进行刺激,于培养第12天的细胞扩增倍数为2,864倍;对照组(无可听声波刺激)的细胞扩增倍数为3,108倍。图3B为持续对细胞培养盘中的γδ-T细胞施予不同波形可听声波刺激后,γδ-T细胞对Daudi细胞的毒杀效率分析。由图3B发现,在E:T比例为5的情况下,以110Hz、70分贝正弦波的可听声波持续进行刺激后的γδ-T细胞毒杀效率为75.6%;以110Hz、70分贝三角波的可听声波持续进行刺激后的γδ-T细胞毒杀效率为78.1%;以110Hz、70分贝方波的可听声波持续进行刺激后的γδ-T细胞毒杀效率为72.6%;对照组(无可听声波刺激)的细胞毒杀效率为61.9%。图3C为持续对细胞培养盘中的γδ-T细胞施予不同波形可听声波刺激后,γδ-T细胞对A549细胞的毒杀效率分析。由图3C发现,在E:T比例为5并添加唑来膦酸的情况下,以110Hz、70分贝正弦波的可听声波持续进行刺激后的γδ-T细胞毒杀效率为55.1%;以110Hz、70分贝三角波的可听声波持续进行刺激后的γδ-T细胞毒杀效率为58.0%;以110Hz、70分贝方波的可听声波持续进行刺激后的γδ-T细胞毒杀效率为60.4%;对照组(无可听声波刺激)的细胞毒杀效率为43.3%。综上,于细胞培养时持续施以特定波形的可听声波刺激,可有效提升γδ-T细胞的细胞纯度及癌细胞毒杀活性。
实施例3、于γδ-T细胞培养基中添加自体树突细胞外泌体的培养结果
图4A为培养基中加入自体树突细胞外泌体后的γδ-T细胞扩增倍数分析。由图4A发现,使用含有25μl/ml自体树突细胞外泌体的培养基,于培养第12天的细胞扩增倍数为6,236倍;对照组(不含自体树突细胞外泌体)的细胞扩增倍数为3,754倍。图4B为培养基中加入自体树突细胞外泌体后,γδ-T细胞对Daudi细胞的毒杀效率分析。由图4B发现,在E:T比例为5的情况下,使用含有25μl/ml自体树突细胞外泌体的培养基培养的γδ-T细胞毒杀效率为78.3%;对照组(不含自体树突细胞外泌体)的γδ-T细胞毒杀效率为64.4%。图4C为培养基中加入自体树突细胞外泌体后,γδ-T细胞对A549细胞的毒杀效率分析。由图4C发现,在E:T比例为5并添加唑来膦酸的情况下,使用含有25μl/ml自体树突细胞外泌体的培养基培养的γδ-T细胞毒杀效率为58.9%;对照组(不含自体树突细胞外泌体)的γδ-T细胞毒杀效率为43.7%。综上,于γδ-T细胞培养基中添加自体树突细胞外泌体,可有效提升γδ-T细胞的扩增倍率及癌细胞毒杀活性。
下表一统整前述各种不同培养条件下,γδ-T细胞的扩增倍数、细胞纯度、毒杀活性等数据。
表一、各种培养条件下γδ-T细胞的扩增倍数、细胞纯度、毒杀活性的汇整。
- 一种用于NK细胞体外扩增的培养基体系及NK细胞体外扩增的方法
- 一种体外高效扩增培养细胞毒性T淋巴细胞的方法
- 一种用于NK细胞体外扩增的培养基体系及NK细胞体外扩增的方法
- 一种脐带造血干细胞体外扩增培养体系和脐带造血干细胞体外扩增方法
