类器官线粒体呼吸功能的测定物、测定方法及其应用
文献发布时间:2023-06-19 18:30:43
技术领域
本发明涉及类器官线粒体呼吸功能的测定物、测定方法及其应用。
背景技术
对于类器官的线粒体呼吸功能测定具有其特殊性。其特殊性主要体现在两个方面,第一,类器官的线粒体呼吸功能测定的方法有别于普通活检组织以及2D细胞培养物或3D细胞球的线粒体呼吸功能测定;第二,类器官的线粒体呼吸功能动态测定目前只能在特定的设备上实现。
对于上述的第一点而言,常规的活检组织的线粒体呼吸功能测定时,由于活检组织中的细胞,在进行线粒体呼吸功能测定前,一般对活检组织以及2D细胞培养物或3D细胞球需要加入细胞透化剂进行处理,处理后置入检测仪器通过仪器设定的检测步骤就可以实现测定。然而,类器官是一类在实验室中培养形成的体积微小、组成单一的细胞团块,即使经过细胞透化剂的处理,也无法实现对于线粒体呼吸功能的测定。
而对于所述的第二点而言,类器官的线粒体呼吸功能动态测定目前只能在特定的检测设备上实现。如以采用seahorse分析仪测定线粒体呼吸功能为例,在测定前,2D细胞或3D细胞球需要在该分析仪指定的特定培养板上进行培养后进行后续检测。这种培养方法则无法适用于由其他培养板如气液界面培养的类器官。
Oxygraph-2k是一种高分辨率细胞呼吸测量系统。但是由于类器官的上述特殊性,目前还无法通过该设备对类器官呼吸功能进行测定。
发明内容
本申请主要目的在于解决类器官线粒体呼吸功能检测中的上述问题。
本申请的第一方面涉及类器官线粒体呼吸功能的测定物,包括于细胞消化液中孵育过的类器官。
在本申请第一方面的一些实施例中,所述的类器官是肾类器官、肺类器官、肝类器官、气道类器官、胰类器官或肠类器官。
在本申请第一方面的一些实施例中,用于所述孵育的类器官是在transwell中培养得到。
在本申请第一方面的一些实施例中,所述的细胞消化液选自Accutase、EDTA或ReLeSR
在本申请第一方面的一些实施例中,所述的测定物为含有所述孵育过的类器官与培养基的细胞悬液。
本申请的第二方面涉及类器官线粒体呼吸功能的测定方法,包括以下步骤:
在类器官中加入细胞消化液进行孵育,
将孵育过的类器官配置成适于检测的细胞悬液,
对细胞悬液进行线粒体呼吸功能的测定。
在本申请第二方面的一些实施例中,所述的类器官是肾类器官、肺类器官、肝类器官、气道类器官、胰类器官或肠类器官。
在本申请第二方面的一些实施例中,用于所述孵育的类器官在transwell中培养得到。
在本申请第二方面的一些实施例中,在transwell中培养得到的类器官,在transwell中进行冲洗处理后,在transwell的上层加入细胞消化液后,进行孵育。
在本申请第二方面的一些实施例中,通过含有培养基的移液枪将孵育的类器官吹散于transwell的小室中,转移小室中包含类器官的液体并配置形成细胞混悬液,将细胞混悬液进行计数和离心,弃去上清液后,加入培养基重悬细胞,调整成一定细胞浓度的所述细胞悬液。
在本申请第二方面的一些实施例中,所述的细胞消化液选自Accutase、EDTA或ReLeSRTM。
在本申请第二方面的一些实施例中,将细胞悬液加入到Oxygraph-2k中进行线粒体呼吸功能的测定。
在本申请第二方面的一些实施例中,所测定的呼吸功能依照测定类器官的基础呼吸速率、氧化磷酸化的耗氧率、最大呼吸速率和非线粒体呼吸速率逐步进行。
在本申请第二方面的一些实施例中,采用底物-抑制剂滴定法测定所述的类器官的基础呼吸速率、氧化磷酸化的耗氧率、最大呼吸速率和非线粒体呼吸速率。
在本申请第二方面的一些实施例中,所述的底物-抑制剂滴定法包括如下步骤:
测定线粒体基础呼吸速率,
向细胞呼吸测定仪中滴加H+-ATP合成酶抑制剂测定线粒体的氧化磷酸化的耗氧率,
向细胞呼吸测定仪中滴加解偶联剂测定线粒体最大呼吸速率,
向细胞呼吸测定仪中滴加复合物I抑制剂和复合物III抑制剂测定非线粒体呼吸速率。
本申请的第三方面还涉及了上述的测定物或上述的测定方法在测定药物毒性中的应用。
在本申请第三方面的一些实施例中,所述的呼吸功能包括线粒体基础呼吸速率和/或线粒体最大呼吸值。
在本申请第三方面的一些实施例中,所述的药物毒性包括线粒体毒性。
本申请的测定物中含有易于分散且保持了完好的表面抗原和线粒体活性的类器官,能够适用于更多的细胞呼吸检测设备,实现对于类器官线粒体呼吸功能的检测,该测定物及相关的测定方法能够被用于药物毒性的检测,具有重要的意义。
附图说明
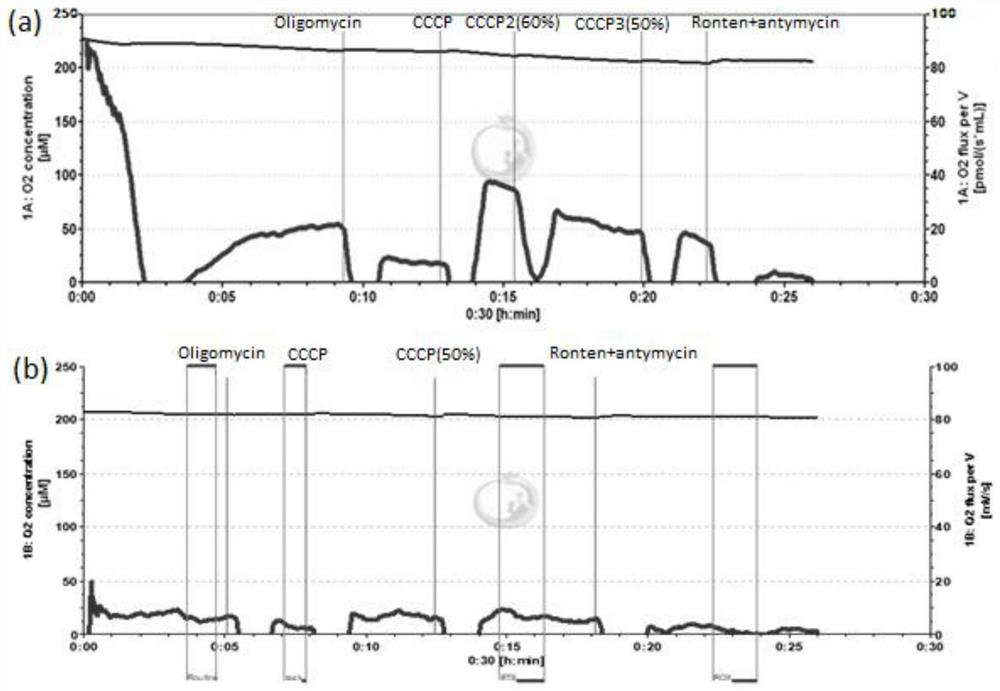
图1a和图1b分别为对照组和第一实验组的OCR图。
图2为对照组和第一实验组的线粒体基础呼吸速率(basal respiration)的对比图。
图3为对照组和第一实验组的线粒体最大呼吸值(maximal respiration)的对比图。
图4为第二实验组的OCR图。
具体实施方式
有鉴于前述的类器官在测定线粒体呼吸功能中的诸多特殊性,以及仅能用特定仪器和特定方式来进行测定所带来的诸多不便。提供类器官线粒体呼吸功能的测定物,该测定物中包括了于细胞消化液中孵育过的类器官。
上述测定物所含有的是由细胞消化液中孵育过的类器官,相比于未经该孵育处理的类器官,在孵育的过程中原本存在于细胞间的黏附作用由于细胞消化液的孵育而消除了,细胞之间形成一种易于进行分散的状态,并且同时保持了类器官完好的表面抗原和线粒体活性,这种活性完好且细胞间分散的状态为更多的细胞呼吸检测设备实现针对类器官的线粒体呼吸功能的检测创造了有利条件,使得原本受设备和特定培育方式限定的检测过程得到了解放。并且,经过本申请实施例的验证,这种测定物尤其适合在Oxygraph-2k(以下简称O2K)中的进行检测。
本申请中的类器官,是利用体外3D培养技术对干细胞或器官祖细胞进行诱导分化,形成结构和功能类似目标器官或组织的三维细胞复合体,具有和目标器官高度一致的遗传特征,实现部分器官功能。在上述测定物中,与细胞消化液进行孵化类器官种类包括但不限于肾类器官、肺类器官、气道类器官、肝类器官、胰类器官或肠类器官等等。
类器官在细胞消化液中孵育的方法也可以是现有的,如在容器中加入类器官和细胞消化液,将容器放入培养箱中进行培养,培养的时间以类器官实际形成了易于分散的形态可自行调节,培养后,还可以对类器官施以刮擦、用培养液冲散等方式帮助类器官的分散。
本申请是通过细胞消化液来解除类器官中细胞间的黏附作用,因此对于类器官本身形成的方式是不限制的。如所述孵育的类器官可以是在transwell中培养得到。除此以外,细胞消化液包括但不限于Accutase、EDTA或ReLeSR
除此以外,本申请还涉及了类器官线粒体呼吸功能的测定方法,该测定方法中主要包括以下步骤:
在类器官中加入细胞消化液进行孵育,
将经孵育的类器官配置成适于检测的细胞悬液,
对细胞悬液进行线粒体呼吸功能的测定。
类似的,在上述测定方法中,相比于未经该孵育处理的类器官,在加入细胞消化液孵育的过程中原本存在于细胞间的黏附作用被消除了,细胞之间形成一种易于进行分散的状态,并且保持了类器官完好的表面抗原和线粒体活性,这种活性完好且细胞间分散的状态为更多的细胞呼吸检测设备实现针对类器官的线粒体呼吸功能的检测创造了有利条件,使得原本受设备和特定培育方式限定的检测过程得到了解放。并且,经过本申请实施例的验证,这种测定物尤其适合在Oxygraph-2k(以下简称O2K)中的进行检测。
类器官在细胞消化液中孵育的方法也可以是现有的,如在容器中加入类器官和细胞消化液,将容器放入培养箱中进行培养,培养的时间以类器官实际形成了易于分散的形态可自行调节,培养后,还可以对类器官施以刮擦、用培养液冲散等方式帮助类器官的分散。
在本申请中所利用到的类器官,其培养方法可以采用各种现有的相关方法。这也是本申请的优势之一,相比于现有技术在特定的仪器上检测类器官的线粒体呼吸功能需要特定的培养设备,本申请类器官的培养则对于方法无特定的限制,其中较常用的培养方法包括了在transwell中进行气液界面的培养,以及在微孔球型板上进行培养,其培养方法是已知的。进一步的,本申请的测定方法可以用于测定的药物的毒性,尤其是线粒体毒性,在该情况下,测定所利用的类器官还可以是经过了在相应的化合物溶液中进行孵育一定的时间后得到的类器官。
以transwell中培养得到类器官为例,在加入细胞消化液进行孵育之前,需要在transwell中先进行冲洗处理,其冲洗处理的具体步骤可以是为:先弃去traswell上、下层中的培养基,然后在上、下层中分别加入PBS对类器官进行冲洗,冲洗后弃去多余液体。然后,在transwell的上层加入细胞消化液后,进行孵育。
所采用细胞消化液包括但不限于Accutase(主要组分为0.5mM的EDTA和3mg/L酚红)、0.5mM的EDTA或ReLeSR
在将类器官与细胞消化液进行孵育后需要将类器官进行转移至他处配置成适宜于检测的细胞悬液。以在transwell中进行培养、以及与细胞消化液进行孵育的上述类器官为例,如先通过含有培养基的移液枪将该孵育的类器官吹散于transwell的小室中,转移小室中包含类器官的液体并配置形成细胞混悬液,将细胞混悬液进行计数和离心,弃去上清液后,加入培养基重悬细胞,调整成一定细胞浓度的所述细胞悬液。细胞浓度可以根据检测设备的要求的浓度来进行调整。若在前述步骤中采用的细胞消化液为ReLeSR
随后,将配置得到的细胞悬液加入到Oxygraph-2k中进行线粒体呼吸功能的测定。所测定的呼吸功能依照测定类器官的基础呼吸速率、氧化磷酸化的耗氧率、最大呼吸速率和非线粒体呼吸速率逐步进行,测定的方法为底物-抑制剂滴定法。具体而言,所述的底物-抑制剂滴定法一般可按如下主要步骤来进行:测定线粒体基础呼吸速率;向细胞呼吸测定仪中滴加H
由此,通过采用上述测定方法,即可以使得类器官的呼吸功能检测无需再依托于特定检测设备所要求的特定类器官培养方式,类器官培养与类器官测定设备之间不再具有绑定关系,使得科研人员具有更多的选择。并且可以预见的,由于检测设备分辨率的不断提高,诸如O2K一类的高分辨率检测设备在能够被利用至类器官这一类具有特殊性的测定中时,无疑为未来的准确研究奠定了基础。而进一步的,上述检测方法又可被拓展至人体疾病对于线粒体呼吸相关的研究中,以及化合物、药物毒性检测尤其是线粒体毒性检测的相关研究中,具有重要的意义。
以下通过具体的实施例对于上述评价方法进行示例性的说明。该实施例用于检测EsA、顺铂对肾类器官线粒体呼吸功能的影响。
步骤一、准备试剂和耗材,并校准仪器。
试剂包括:75%乙醇、无水乙醇,APEL 2类器官基础培养基,PBS,Accutase细胞消化液,EsA溶液(商陆皂苷甲),DMSO(二甲基亚砜),顺铂,线粒体功能调节剂(表1):寡霉素(Oligomycin)、羰基氰化氯苯腙(CCCP)、羰基氰化物4-(三氟甲氧基)苯腙(FCCP)、鱼藤酮(Rotenone)、抗霉素A(Antimycin A)。
表1.线粒体功能调节剂
耗材包括:5mL以及10mL移液管,1000μL吸嘴,15mL离心管。
仪器包括:细胞计数仪,离心机,OROBOROS Oxygraph-2k高分辨率呼吸测定仪(以下简称:呼吸测定仪)。
步骤二、校准仪器。使用吸液器吸出呼吸测定仪仓室中的液体,纯水清洗3-5次,每次5分钟。在仓室中加入培养基2.1mL,关闭仓室塞子,尽量避免空气。打开软件,仓室温度调至37℃,并打开搅拌功能。在37℃条件下与空气平衡做校准。
步骤三、制备对照组、第一实验组、第二实验组的肾类器官。采用transwell分别诱导分化肾类器官,以分别用于对照组和第一实验组和第二实验组。肾类器官导分化第22天,将DMSO、60μM的EsA溶液、20μM的顺铂分别加入对照组、第一实验组和第二实验组transwell小室下层板孔中孵育48h。
然后,对照组、第一实验组、第二实验组均分别进行步骤四、步骤五中的操作。
步骤四,配置测定物。
(1)弃去transwell小室里的上、下层的培养基,上、下层分别加入37℃的PBS冲洗肾类器官后,弃去多余液体。
(2)从transwell的上层加入预热的Accutase细胞消化液1mL,放入培养箱孵育3分钟后取出。
(3)用1000μL移液枪吸取少量预热培养基轻轻冲向肾类器官,以使团块状的肾类器官吹散于小室中,加入1-2mL预热的APEL 2培养基稀释。
(4)用10mL移液管将整个Transwell小室上的液体以及其中的肾类器官转移至15mL的离心管中,加入预热(37℃)的PBS稀释,使细胞混悬液终体积为5mL。
(5)轻轻混匀后计数并在离心机中进行离心,离心的操作条件为:400g,2min。
(6)弃去离心管中上清后,加入预热(37℃)的APEL 2培养基重悬细胞,调整各组终浓度为0.5×10
步骤五、进行线粒体呼吸功能的各项测定。
(1)将细胞悬液转移至O2K的检测仓室中,关闭仓室后平衡5min,待数值平稳后即为该组细胞的基础呼吸速率。
(2)加入浓度为5mM的寡霉素(Oligomycin)1μL,获得细胞最大呼吸速率。
(3)加入1mM的解耦联剂(CCCP)1μL,测定肾类器官线粒体最大电子传递能力值。
(4)加入1mM的鱼藤酮(Rotenone)1μL以及5mM的抗霉素A(Antimycin A)1μL,测定剩余的非线粒体呼吸速率。
上述过程获得的数据均应用Datlab软件对数据进行采集与分析。从图1~图4可见,由于肾类器官经过了本申请方法的处理,于O2K中已经能够测定出肾类器官线粒体的呼吸功能。
测定结果分析:
图1a和图1b分别示出对照组和第一实验组即DMSO、EsA诱导肾类器官细胞OCR图(Oxygen Consumption Rate)。图2和图3分别示出了对照组与第一实验组的基础呼吸速率、最大呼吸速率的对比图。可以看出正常肾类器官暴露于EsA48小时后,其基础呼吸速率、最大呼吸速率相较于对照组均显著下降(P<0.05),表面EsA对线粒体的呼吸功能产生了影响。图4为第二实验组即顺铂诱导肾类器官细胞OCR图,可以看出在肾类器官中加入顺铂孵育48h后,肾类器官线粒体已无基础呼吸速率,给予抑制剂后几乎无响应,由此表明,顺铂对于线粒体呼吸功能产生了极大的影响。因此,可以认为EsA和顺铂均具有肾毒性,并且顺铂的肾毒性明显较大。
本发明中的实施例仅用于对本发明进行说明,并不构成对权利要求范围的限制,本领域内技术人员可以想到的其他实质上等同的替代,均在本发明保护范围内。
- 一种肌肉组织的线粒体呼吸功能原位测定方法
- 一种肿瘤类器官形成能力的测定方法
